|
PARTIE THEORIQUE
Introduction
L'électrophorèse des protéines
sériques est une analyse de routine dans la pratique quotidienne d'un
laboratoire de biochimie médicale. Les cliniciens requièrent
cette analyse principalement pour le dépistage des pathologies qui
modifient les profils électrophorétiques tels que les
gammapathies monoclonales et les syndromes néphrotiques. Aujourd'hui,
les laboratoires d'analyses médicales devraient idéalement
disposer des techniques automatisées, aptes à détecter les
dysprotéinémies, possédant une bonne résolution et
une limite de détection des plus basses possible (détection des
petits pics monoclonaux).(1)
Dans le laboratoire où j'ai effectué mon stage,
on est passé de l'électrophorèse des proteines
sériques sur gel d'acétate de la cellulose vers celle sur gel
d'agarose puis vers l'électrophorèse capillaire.
Le but de cette étude est de comparer cette nouvelle
technique d'électrophorèse capillaire à
l'électrophorèse en gel d'agarose Hydrasys®
(Sebia).
I. Les protéines sériques
1 - Définition (2)
Les protéines représentent la plus grande partie
des matières solides du plasma. En dehors du fibrinogène,
protéine fibreuse, ce sont toutes des protéines globulaires.
Seule la sérum-albumine est une holoprotéine, toutes les autres
étant des hétéroprotéines pouvant contenir des
lipides (lipoprotéines), des métaux
(métalloprotéines) et surtout des glucides, la plupart des
protéines plasmatiques sont en effet des glycoprotéines.
Leurs propriétés sont très variables :
transporteurs, anticorps, enzymes, agents de pression oncotique, marqueurs de
l'inflammation, marqueurs tumoraux, agents de la coagulation, facteurs de
croissance, etc. Mais il faudra différencier les
protéines toujours présentes dans le plasma,
éléments constitutifs de celui-ci et celles, d'origine
cellulaire, n'y apparaissant que transitoirement.
2- Les principales protéines sériques
2.1-Albumine (69 KDa) (2,3)
L'albumine sérique est une protéine d'origine
exclusivement hépatique ; c'est la protéine plasmatique la
plus importante quantitativement, représentant 50 à 60 % de
l'ensemble des protéines du plasma. C'est une molécule
relativement stable, contenant 564 aminoacides réparties sur une seule
chaine peptidique.
Ses principaux rôles physiologiques : le pouvoir
osmotique, une fonction de transporteur (calcium, acides gras, bilirubine,
médicaments, ions métalliques, vitamines, certaines hormones,
etc.), une fonction de réserve d'acides aminés.
v Intérêt de son dosage:
· dans un bilan de dénutrition.
· dans un bilan d'insuffisance hépatique
v Valeurs usuelles chez n adulte : 40 à 50
g/l.
v L'albumine augmente en cas de
déshydratation.
v L'albumine diminue en cas de :
ü malnutrition
ü insuffisance hépatique.
ü inflammations et infections chroniques.
ü entéropathie.
ü syndrome néphrotique.
ü hémorragies, brulés.
ü grossesse.
2.2- Les Alpha 1 globulines
2.2.1- Orosomucoïde (40
KDa) (3,4)
De synthèse hépatique, cette á1
globuline est très riche en sucres et en acide sialique, ce qui
lui a conféré aussi le nom de glycoprotéine acide
á1.
v Valeur Usuelle chez un adulte : 0.6 à 1.2
g/l.
v L'orosomucoïde augmente dans le sang lors
d'Inflammation aiguë en particulier lors du rhumatisme articulaire aigues
de l'enfant.
v L'orosomucoïde diminue lors d'insuffisance
hépatique et du syndrome néphrotique.
2.2.2- Alpha 1 antitrypsine : (5,6)
L'á1-antitrypsine qui constitue la fraction la plus
importante des á1 globulines est une glycoprotéine
(10% de glucide) constituée d'une chaîne polypeptidique
composée de 3 chaînes d'oligosaccharides. Elle est
synthétisée dans les hépatocytes. L'á1-antitrypsine
est l'inhibiteur de protéase le plus important dans le sang. Elle
inactive de façon spécifique les sérine-protéases
(comme par ex. la trypsine, la chymotrypsine, la collagénase,
l'élastase leucocytaire, la plasmine et la thrombine), avec lesquelles
elle forme de façon réversible un complexe enzyme-inhibiteur.
v L'á1-antitrypsine augmente en cas d'inflammation
(infections, maladies rhumatismales, par ex.), de nécroses tissulaires,
de tumeurs malignes et de traumatisme.
v L'á1-antitrypsine diminue en cas d'un déficit
héréditaire aigu en L'á1-antitrypsine, lors
d'hépatite néonatale avec cirrhose hépatique
évolutive. Ce déficit est suspecté lorsque des
emphysèmes pulmonaires sévères apparaissent chez
l'adulte.
2.3- LES Alpha 2 globulines (7 ,8)
2.3.1- Céruloplasmine (150 KDa)
C'est une á2 glycoprotéine dotée de
propriétés oxydatives qui utilise le cuivre comme cofacteur. Sa
demi-vie est de 2-5 jours.
v valeurs usuelles chez un adulte: 0.3 à 0.6
g/l.
v La céruloplasmine diminue au cours de Maladie de
Wilson : Au cours de la maladie de Wilson, le cuivre s'accumule dans les
tissus de l'organisme (le cerveau, le foie entre autres) entraînant une
atteinte cérébrale à type de
dégénérescence hépato lenticulaire.
La
céruloplasmine augmente au cours de:
Ø la grossesse et la prise de contraception orale et
d'oestrogènes.
Ø pathologie infectieuse
Ø hyperthyroïdie (excès d'hormones
thyroïdiennes dans le sang)
Ø la cirrhose du foie
Ø la leucémie aiguë
2.3.2- Haptoglobine
Cette protéine est une glycoprotéine
très riche en sucres, capable de fixer l'hémoglobine.
Son taux varie entre 0.5 et 1.5 g/l.
L'haptoglobine augmente en cas des
inflammations et diminue lors des hémolyses intravasculaires.
2.4-LES Beta 1 globulines (8)
2.4.1- Transferrine : Cette protéine
transporte le fer.
v Valeurs usuelles chez un adulte = 1.5 à 3g/l.
v La transferrine augmente lors de la carence martiale et
diminue lors des états inflammatoires et des intoxications
éthyliques.
2.5-LES Beta 2 GLOBULINES
2.5.1- Fraction C3 du
complément : Il existe des cas de diminution par surconsommation de
C3.
La Fraction C3 du complément augmente au cours des
états inflammatoires et diminue dans les syndromes infectieux et les
maladies auto-immunes.
2.6-LES Gamma globulines
2.6.1- Les
Immunoglobulines (8)
Sous forme d'anticorps, ces protéines
représentent le support de l'immunité humorale. Ces
immunoglobulines, très hétérogènes, sont
classées en cinq classes : IgG, IgA, IgM, IgD, IgE (Tableau
I)
Tableau
I: Valeurs usuelles des gammaglobulines (16)
|
IgG
|
IgA
|
IgM
|
IgD
|
IgE
|
|
concentration (g/l)
|
8 à 12
|
2 à 4
|
0.6 à 1.2
|
0.1 à 0.3
|
0.1 à 0.5
|
2.6.2- Protéine C Réactive (CRP= 120 KDa)
(3)
La CRP est une glycoprotéine formée par l'union
de 5 sous-unités identiques, cette protéine porte son nom en
raison de sa propriété de précipiter au contact du
polysaccharide C du pneumocoque.
La CRP augmente lors de la phase aigue d'inflammation, Elle
s'élève deux à quatre heures après le début
du processus inflammatoire.
II. Electrophorèse des protéines
sériques
1- Historique (9, 10)
Dès
le début du XVIIIe siècle, les travaux de Charles de COULOMB
(1736-1806), Alessandro VOLTA (1745-1827) et André-Marie AMPERE
(1775-1836) avaient permis l'émergence des premières lois de
l'électrostatistique et de l'électricité.
Un siècle plus tard, en 1859, L'Allemand Georg Hermann QUINCKE
découvre qu'il était possible de déplacer des particules
colloïdales (sous forme de colle gélatineuse) sous l'action d'un
champ électrique : ce phénomène est appelé
cataphorèse.
Par la suite, Hermann Von HELMHOTZ développe
l'électro-osmose : sous un champ électrique, il observe que des
particules chargées se déplacent vers le pôle de signe
opposé à leur charge.
En 1892, LINDER S.E et PICTON.H exploitent cette observation
pour la séparation de particules chargées.
En 1937, le Suédois Arne Wilhelm Kaurin TISELIUS
applique cette technique à la séparation des protéines du
sérum et du lait, ce qui lui vaudra le prix Nobel en 1948. Sa
méthode de fractionnement en phase liquide est alors trop
onéreuse en matériel et en personnel pour la pratique courante,
mais il la perfectionne et en 1950 il met au point
l'électrophorèse sur papier, plus simple et permettant une
utilisation plus large.
Depuis 1957, l'électrophorèse sur acétate
de cellulose autorise une meilleure individualisation des fractions et ainsi
l'établissement de tracés plus expressifs.
Les années suivantes, l'utilisation de gel de
polyacrylamide permet l'obtention d'un fractionnement plus important, mais
reste d'interprétation plus difficile et hors d'usage de la pratique
courante.
Aujourd'hui cette technique, qui ne cesse de
s'améliorer par la diversité des supports et des techniques de
réalisation, est devenue un outil indispensable dans de nombreux
laboratoires, tant au niveau de la recherche et de l'industrie que des sciences
médicales au sens large.
Parallèlement, des automates
d'électrophorèse sont apparus, permettant une meilleure
standardisation des différentes étapes de la technique et
notamment le mode de dépôt des échantillons et le
contrôle des paramètres de la migration (voltage,
température, durée de migration).
2- Principe Général (11,
12)
L'électrophorèse consiste à faire migrer
et à fractionner grâce à un champ électrique, et
dans un tampon de pH déterminé, les constituants
séparés en fonction de leur charge électrique. Ce principe
d'électrophorèse s'applique aux protéines et pour qu'ils
puissent migrer, elles doivent être ionisées. C'est ce qui se
produit lorsque le milieu est au pH alcalin supérieur au pH
isoélectrique (pHi) de différentes protéines.
3-Paramètres affectant
l'électrophorèse (5, 12)
3.1- Le courant électrique
Allant d'un bac à l'autre pour compenser la perte de
liquide par évaporation.
3.2- La charge de la molécule
Pour que la protéine se déplace dans un champ
électrique, il est indispensable qu'elle soit ionisée soit par
son groupement carboxyle soit par son groupement.
3.3- La nature du tampon
La composition du tampon est importante du fait des
interactions possibles entre certaines molécules le constituant et la
protéine.
3.4- La diffusion
Les particules incluses dans le gel ayant tendance à
diffuser des régions les plus concentrées vers les moins
concentrées, ce qui gêne la bonne séparation des zones.
3.5- La taille des particules
Car à charge égale, une molécule plus
petite migrera plus vite. Cet effet de tamisage moléculaire est surtout
important pour les gels de polyacrylamide.
3.6- Le Choix du support
Le support ayant été longtemps utilisé
est le papier, remplacé ensuite par la membrane d'acétate de
cellulose puis par le gel d'agarose qui permet une meilleure séparation
et la détection des protéines monoclonales de faible
concentration. Le gel de polyacrylamide a un très fort pouvoir
séparateur exploité dans la séparation de
lipoprotéines et des apoprotéines.
4- Les différents types
d'électrophorèse
4.1- Électrophorèse en veine liquide (13)
La migration dans ce type d'électrophorèse
s'effectue au sein d'un liquide de composition déterminée soumis
à un champ électrique de courant continu.
Cette méthode
permet la détermination des mobilités
électrophorétiques des différents constituants d'un
mélange, cependant elle est très coûteuse.
Appareillage : La mise en oeuvre est longue et
délicate. Les particules ne se séparent pas complètement
mais ils se forment des frontières mises en évidence par des
méthodes optiques telles que l'absorption ultra-violette pour les
protéines.
4.2- Électrophorèse de
zones (13,14, 15, 16)
Les principales applications utilisent un support
poreux stabilisant la
phase liquide :
on parle alors d'électrophorèse sur support ou
d'électrophorèse de zones. Le mélange à
séparer est déposé sur un support convenable, poreux et
imprégné de tampon (papier, dérivés de cellulose,
polyoside « agarose », polyacrylamide...). Le support doit
être homogène, poreux et inerte. Cependant, la condition d'inertie
n'est jamais respectée et le support joue un rôle plus ou moins
important dans la séparation.
Les différents types d'électrophorèses de
zones sont souvent nommés en fonction du type de support :
4.2.1- Électrophorèse sur
papier :
Assez peu résolutive,
cette technique d'électrophorèse est surtout destinée
à séparer des molécules de petite taille, dont les acides
aminés. Des phénomènes d'interférence liés
à la charge des acides aminés et de la cellulose du papier
interviennent de façon notable. Une goutte de solution contenant
l'échantillon à analyser est déposée sur une bande
de papier, puis séchée. La bande de papier est humidifiée
avec un tampon convenablement choisi, puis les deux extrémités
de la bande sont plongées dans deux réservoirs contenant le
tampon. Chaque réservoir est connecté à une
électrode. Un champ électrique continu est
appliqué, et les acides aminés se déplacent en
fonction de leur charge nette. En fin d'électrophorèse, la bande
de papier est séchée puis les acides
aminés sont révélés par une réaction
colorimétrique telle que celle à la ninhydrine.
4.2.2- Électrophorèse sur
acétate
de cellulose :
L'électrophorèse se fait dans des conditions proches de celles de
l'électrophorèse sur papier. Les bandes d'acétate de
cellulose sont fragiles, mais elles limitent la diffusion des molécules
à séparer. La révélation des protéines se
fait également par une réaction colorimétrique (rouge de
ponceau par exemple). Cette technique, peu résolutive, permet de
séparer grossièrement des groupes de protéines. Elle est
peu coûteuse et permet une analyse rapide des protéines
sériques.
4.2.3- Électrophorèse sur gel d'
amidon :
L'électrophorèse sur gel d'amidon est
particulièrement utile l'analyse et la séparation des isoenzymes.
Le principe de la technique repose sur une séparation
électrophorétiques des protéines sur une matrice poreuse
composée d'un gel d'amidon, de pH précis. Les enzymes
présentes sont détectées en incubant le gel dans une
solution contenant un substrat spécifique de l'enzyme donnant lieu
à un produit coloré. Les profils obtenus sont
désignés sous le nom de zymogrammes.
4.2.4- Électrophorèse sur gel
d'
agarose
: L'
électrophorèse
sur gel d'agarose est une méthode utilisée en
biochimie et en
biologie
moléculaire pour séparer les protéines, l'
ADN,
l'
ARN en
fonction de leurs
poids
moléculaires.
Les molécules de plus petites tailles se
déplacent plus rapidement et migreront plus loin que les
molécules de tailles supérieures.
4.2.5- Électrophorèse sur gel de
polyacrylamide : Les gels, formés entre
deux plaques de verre, sont obtenus par polymérisation d'un
mélange d'acrylamide (CH2 = CH-CO-NH2) et de
bisacrylamide (CH2 = CH-CO-NH-CO-CH= CH2), ce qui aboutit
à la formation d'un réseau réticulé. Les
concentrations en acrylamide et le ratio acrylamide/bisacrylamide
déterminent la taille des pores et donc les capacités
résolutives du gel. Ces techniques peuvent être utilisées
pour séparer des protéines ou bien des acides nucléiques
(de courte séquence en général) en condition native ou
dénaturante.
L'électrophorèse est réalisée
à l'aide d'un montage vertical, les échantillons étant
déposés dans des puits localisés au sommet du gel.
4.3- Électrophorèse Capillaire (17)
C'est une technique récente qui commence à se
développer et qui offre essentiellement les avantages de la
rapidité, de la très grande résolution et, partant, de la
très grande sensibilité de la détection.
L'électrophorèse utilise un capillaire de silice de
diamètre d'environ 50 ìm et de longueur 1 m (rempli de tampon ou
de gel), et des voltages élevés (15 à 30 kV). Ceci aboutit
à des vitesses de migration très rapides des composés dans
les capillaires et ceux-ci sont détectés par absorption U.V.,
fluorimétrie ou conductimétrie directement sur le capillaire,
donc dans un volume très faible. Ceci fournit donc une
sensibilité particulièrement élevée (on injecte
seulement quelques nanolitres de l'échantillon). Les domaines
d'application sont a priori nombreux : analyse de peptides, d'acides
aminés, d'oligonucléotides ... Le nombre de plateaux est de
l'ordre de 500 000 par mètre, ce qui fournit une résolution
remarquable (on peut séparer des peptides différant d'un acide
aminé, des mélanges complexes d'oligonucléotides, des
fragments tryptiques de peptides ; la méthode est utilisée pour
tester la pureté de peptides ou d'oligonucléotides de
synthèse...). La technique peut également s'appliquer à
des molécules non ionisées en présence de micelles de
détergents appropriés.
5-
Exemples d'applications d'électrophorèses
Ø
Électrophorèse des dysprotéinémies
sériques.
Ø Analyse des protéines urinaires.
Ø Analyses des protéines du liquide
céphalo-rachidien (LCR).
III- Les différents profils
protéiques
1-Définition (8)
Un profil électrophorétiques est
Représentation graphique des résultats des dosages de plusieurs
protéines. Les résultats étant exprimés en g/L ou
en % de la valeur normale en fonction de l'âge du patient.
2- Intérêt du profil
électrophorétiques des protéines sériques(8)
Ce profil permet d'orienter le diagnostic d'une infection avec
profil élargi d'orientation par dosage de 8 à 10 protéines
très différentes en ce qui concerne leurs fonctions, leurs
régulations.
Ce profil permet le suivi de l'évolution d'une maladie
avec un profil ciblé.
La répartition de ces différentes fractions
apporte des nombreux renseignements qui aident au diagnostic de
différentes pathologies :
- syndrome inflammatoire
- syndrome cirrhotique
- syndrome néphrotique
- gastro-entéropathies
- maladies héréditaires
(dysprotéinémies...)
- infections chroniques
- certains cancers, myélomes
- maladies auto-immunes
- hypo-gamma globulinémie
3- Profil protéique normal
Les concentrations des différentes fractions d'un profil
électrophorétique normal sont rassemblées dans le
Tableau I.
Tableau I : Concentrations normales des
différentes fractions des protéines sériques obtenues par
électrophorèse
|
Hydrasys ®
|
Capillarys ®
|
|
Cc en %
|
Cc en g/l
|
Cc en %
|
Cc en g/l
|
|
Albumine
|
60.0 à 71.0
|
43.0 à 51.0
|
55.8 à 66.1
|
40.2 à 47.6
|
|
Alpha 1
|
1.4 à 2.7
|
1.0 à 2.0
|
2.9 à 4.9
|
2.1 à 3.5
|
|
Alpha 2
|
7.0 à 11.0
|
5.0 à 8.0
|
7.1 à 11.8
|
5.1 à 8.5
|
|
Beta 1
|
6.0 à 9.0
|
4.0 à 6.0
|
4.7 à 7.2
|
3.4 à 5.2
|
|
Beta 2
|
2.0 à 5.0
|
1.0 à 4.0
|
3.2 à 6.5
|
2.3 à 4.7
|
|
Gamma
|
8.0 à 16.0
|
6.0 à 12.0
|
11.1 à 18.8
|
8.0 à 13.5
|

Figure 1 : Un profil normal
d'électrophorèse des protéines sériques
4-Profils protéiques pathologiques (8,
18,19)
Ø -
+

Le Cirrhose hépatique :
Au stade avancé, la cirrhose se caractérise par une fusion des
fractions béta et gamma (= bloc béta-gamma)
(aspect en «dos de chameau«) liée à l'augmentation de
la synthèse des IgA et des IgM, qui dépasse celle des IgG et qui
se positionne à l'électrophorèse dans la zone entre les
béta et gamma globulines .
Ø Syndrome
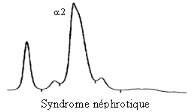
néphrotique :
Caractérisé par une augmentation de la fraction
alpha2 liée à l'augmentation de l'alpha 2 macroglobuline,
associée à une hypoprotidémie sévère due
à une protéinurie massive.
+
-
Ø Syndrome inflammatoire
aigu
-
-
+
-
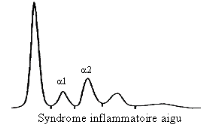
Caractérisé par l'augmentation des alpha 1 et alpha
2 liées à l'augmentation des protéines de
l'inflammation.
Ø Syndrome inflammatoire
chronique.
Caractérisé par l'augmentation des alpha1,
alpha2 et gammaglobulines liées à l'augmentation du taux
d'immunoglobulines témoignant de la chronicité de la maladie
inflammatoire.
+
-
-
-


Ø
Hypogammaglobulinémie :
-
-
+
-
Caractérisé par une diminution de la fraction
gammaglobuline liée à une diminution congénitale ou
acquise de la production des IgG.
Ø Gamma
Alb

Hypogammaglobulinémie
monoclonale :
-
-
+
-
Caractérisé par la présence d'un pic
monoclonal au niveau de la fraction de gammaglobulines témoignant de la
prolifération d'un clone de lymphocytes B au dépend des
autres.
Ø
Bisalbuminémie :

Une bisalbuminémie se caractérise par un
dédoublement ou un simple épaulement du pic de l'albumine sur le
tracé de l'électrophorèse des protéines
sériques. Elle est soit héréditaire permanente, soit
acquise. Lorsqu'elle est acquise, la bisalbuminémie est transitoire
pouvant survenir dans deux circonstances : lors d'un traitement prolongé
aux bêtalactamines en présence d'une fistule pancréatique.
Ø -
-
+
-
Déficit en alpha 1
antitrypsine :
-
-
+
-

Caractérisé par une fraction alpha1globuline
plate liée à la diminution importante de l'alpha1 antitrypsine.
PARTIE PRATIQUE
MATERIELS ET METHODES
Introduction :
L'électrophorèse de zone est utilisée
dans les laboratoires de biologie médicale depuis une soixantaine
d'années pour séparer et identifier les protéines
sériques. Initialement réalisée sur acétate de
cellulose et par des techniques manuelles, elle utilise aujourd'hui très
majoritairement les gels d'agarose et peut être automatisée.
Le but de notre travail est de comparer la méthode
semi-automatique utilisée au laboratoire :
l'électrophorèse en gel d'agarose Hydrasys ® de
Sebia et le système d'électrophorèse capillaire de Sebia
entièrement automatisable, Capillarys ®.
I- Matériels
1- Collecte des échantillons :
Les échantillons sériques analysés
proviennent des différents services du CHU Sahloul de Sousse. Durant un
mois de travail, nous avons passés 66 échantillons
simultanément en électrophorèse capillaire
(Capillarys®) et en électrophorèse sur gel
d'agarose (Hydrasys®).
ü Trente deux échantillons ayant donné de
profils électrophorétiques normaux et 33 échantillons
ayant donné de profils pathologiques sur le Capillarys, nous les avons
servit pour l'étude de corrélation des différentes
protéiques sur Capillarys® et Hydrasys®.
ü Deux échantillons sériques ont
été utilisés pour l'étude de
repétabilité.
Nos électrophorèse ont été
effectués sur des échantillons sériques issus de
prélèvements sanguins sur des tubes sans coagulant après
centrifugation à 3000 tr/min et pendant 5 min, les sérums sont
décantés puis analysés immédiatement ou
conservés à +4°C.
2- Appareillage :
2.1-Système HYDRASIS® SEBIA.

L'électrophorèse sur gel d'agarose
(Hydrasys®) est une technique semi-automatisée
permettant la migration et la séparation des protéines
sériques en tampon alcalin (pH = 9,2)
2.2-Système CAPILLARYS® SEBIA.

3- Réactifs
· Kit HYDRAGEL PROTEIN(E) K20 (sur le système
Hydrasys).
· Kit CAPILLARYS PROTEIN(E) 6 (sur le système
Capillarys).
· Sérum de contrôle normal (Réf
4785 ; N° de lot 19039/01).
v Ce contrôle nous a servi pour l'étude
d'exactitude.
II- Méthodes
1- Electrophorèse sur gel d'agarose
Principe:
L'électrophorèse des protéines du
sérum ou d'autres liquides biologiques humains est une analyse
très utile en laboratoire d'analyses cliniques pour rechercher les
modifications du profil protéique. L'agarose, d'utilisation très
facile. Il donne une séparation des constituants sériques humains
en six fractions majeures de mobilités différentes : albumine,
alpha-1 globulines, alpha-2 globulines, bêta globulines et gamma
globulines.
2-Électrophorèse
Capillaire :
Principe : Le système CAPILLARYS
utilise le principe de l'électrophorèse capillaire en solution
libre, qui représente la forme la plus courante de
l'électrophorèse capillaire. Il permet la séparation de
molécules chargées en fonction de leur mobilité
électrophorétiques propre dans un tampon de pH donné, et,
selon le pH de l'électrolyte, d'un flux électro-osmotique plus ou
moins important. Le système CAPILLARYS comprend 8 capillaires en
parallèle, permettant 8 analyses simultanées. Sur ce
système, l'injection dans les capillaires de l'échantillon
(dilué dans le tampon d'analyse) est effectuée à l'anode
par aspiration. La séparation est ensuite réalisée en
appliquant une différence de potentiel de plusieurs milliers de volts
aux bornes de chaque capillaire. La détection directe des
protéines est effectuée à 200 nm côté
cathode. Les capillaires sont ensuite lavés par une solution de lavage,
puis par le tampon d'analyse. Avec le tampon utilisé à pH
basique, l'ordre de migration des protéines sériques est le
suivant : gamma globulines, bêta-2 globulines, bêta-1 globulines,
alpha-2 globulines, alpha-1 globulines et albumine. Chaque fraction contient un
ou plusieurs constituants sériques.
3-Dosage des protides sériques totaux
Ce dosage a été effectué au niveau de
chaque échantillon sérique par la méthode de Biuret sur
l'auto analyseur CX9 de (Synchron clinical system CX9 PRO, BECKMAN COULTER) et
nous a servi pour déterminer les pourcentages des cinq fractions électrophorétiques
(Albumine, alpha1 globulines, alpha2 globulines, beta globulines et Gamma globulines).
4- Paramètres étudiés entre la
méthode sur gel d'agarose sur Hydrasys el la méthode capillaire
sur Capillarys :
4.1- Etude de la corrélation:
Cette étude a été faite par le logiciel
Microsoft Excel 2007.
* Coefficient de corrélation : Ce
coefficient a des valeurs extrêmes de zéro (aucune liaison et
à 1 (liaison maximale), donc plus on se rapproche de 1, plus la liaison
entre les deux paramètres étudiés est importante.
Deux types des profils électrophorétiques
(Normale et pathologique) ont été distingués. Pour chaque
type cinq coefficients de corrélations (R2) et cinq droites
de régression (Y = ax+b) correspond aux cinq fractions (Albumine, alpha1 globulines,
alpha2 globulines, beta globulines et Gamma globulines) effectués sur
Capillarys et Hydrasys ont été déterminés.
4.2- Etude de la précision : c'est la
qualité de l'accord, dans une zone définie de valeurs à
mesurer entre des mesures répétées, effectués sur
le même échantillon, dans les conditions
déterminées.
Elle est également appelée
fidélité. En fait on détermine habituellement
l'imprécision, qui s'exprime par le coefficient de variation (CV).
n : nombre de mesures répétées de
l'échantillon.
X1, X2, ....... Xn =
valeurs obtenues.
m : moyenne : m=? Xi/n
Dans notre cas, il s'agit de moyennes correspondantes à
chacune des cinq fractions (Albumine, alpha1 globulines, alpha2 globulines, beta
globulines et Gamma globulines)
S : écart type : est la racine carré
de la variance (notée V), la chiffre la dispersion des points autour de
la moyenne.
Donc S= v?(Xi - m)2 / (n - 1)
CV % = 100 S/m
Pour cela, nous avons estimé la précision de
chaque méthode par l'étude de la repétabilité
*La repétabilité :
nous avons fait cette étude sur deux types
d'échantillons sériques donnant un profil
électrophorétiques normal pour l'un et pathologique pour
l'autre.
L'électrophorèse de chacun des deux types
d'échantillon a été répétée dix fois
sur Hydrasys et Capillarys par le même opérateur et dans le
même sérum.
Analyse Statistique :
L'étude statistique a été réalisée par le
logiciel Excel.
Le Test de Student a été utilisé pour la
comparaison des cinq fractions (Albumine, alpha1 globulines, alpha2 globulines, beta
globulines et Gamma globulines) exprimés en pourcentages (%) sur les
deux appareils Hydrasys et Capillarys.
La limite de significativité a été
fixée à 0,05.
4.3- Etude de l'exactitude :
L'exactitude (ou justesse) d'une méthode est la qualité de
l'accord entre l'estimation d'une propriété mesurée
(valeur mesurée) et la valeur vraie, en dehors des erreurs
fortuites : on utilise pour son expression le coefficient
d'exactitude : CE= (X-X0/X0) *100.
Avec : X0= Valeur
Théorique ou attendue et X= Valeur mesurée.
Pour ceci, nous avons dosé 5 fois un avec chaque
méthode le sérum de contrôle de concentration connue et
nous avons calculé les CE.
Résultats et discussions
1-Etude de corrélation des fractions de profils
protéiques normaux sur l'Hydrasys et le Capillarys :
La comparaison de moyennes des cinq fractions de profils
électrophorétique normaux (Albumine, alpha1 globulines, alpha2
globulines, beta globulines et Gamma globulines) sur les deux appareils
Hydrasys et Capillarys, a montré des différences significatives
partout. L'albumine et les alpha1 globulines sont significativement plus
élevées sur le Capillarys (p< 0.001 ; p= 0,005
respectivement) tandis que les alpha 2 globulines, les beta-globulines et les
gammaglobulines sont significativement plus diminués
(p<0 ,001 ; p= 0.008 ; p= 0.011 respectivement)
(Tableau I).
Tableau I : Etude de corrélation
des fractions de profils protéiques normaux sur l'Hydrasys et le
Capillarys
|
Albumine
|
Alpha1
globulines
|
Alpha2
Globulines
|
Beta globulines
|
Gamma globulines
|
|
Capillarys
|
Hydrasys
|
Capillarys
|
Hydrasys
|
Capillarys
|
Hydrasys
|
Capillarys
|
Hydrasys
|
Capillarys
|
Hydrasys
|
|
Moyenne
(%)
|
57.6
|
51.7
|
4.3
|
3.8
|
10.3
|
14.3
|
11.6
|
12.3
|
16
|
17.6
|
|
Ecart-type (%)
|
2.8
|
2.8
|
0.7
|
0.5
|
1.5
|
1.9
|
1.14
|
1.2
|
2.6
|
2.6
|
|
p
|
<0.001
|
0.005
|
<0.001
|
0.008
|
0.011
|
|
Coefficient de corrélation (R2)
|
0.4
|
0.6
|
0.6
|
0.2
|
0.81
|
Aucune corrélation n'a été
constaté entre les deux appareils Hydrasys et Capillarys (Figure 1).
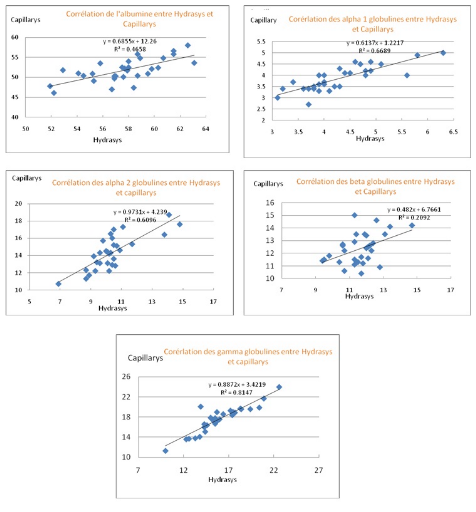
Figure 1 : Etude de corrélation des fractions de
profils protéiques normaux sur
l'Hydrasys et le Capillarys
2- Étude de
corrélation des fractions de profils protéiques pathologiques
sur l'Hydrasys et le Capillarys :
La comparaison de moyenne des cinq fractions (Albumine, alpha1
globulines, alpha2 globulines, beta globulines et Gamma globulines) des
profils électrophorétiques pathologiques (Albumine
diminué, Alpha1, Alpha2 et Gamma globulines diminués) sur les
deux appareils Hydrasys et Capillarys, a montré des différences
significatives uniquement pour l'albumine et les alpha1 globulines. Comme pour
les profils électrophorétiques normaux, l'albumine et les alpha1
globulines des profils pathologiques, étaient significativement plus
élevés sur le Capillarys (p= 0,056 ; p= 0,045
respectivement) (Tableau II).
Tableau II : Étude de
corrélation des fractions de profils protéiques pathologiques
sur l'Hydrasys et le Capillarys
|
Albumine
|
Alpha1
globulines
|
Alpha2
Globulines
|
Beta globulines
|
Gamma globulines
|
|
Capillarys
|
Hydrasys
|
Capillarys
|
Hydrasys
|
Capillarys
|
Hydrasys
|
Capillarys
|
Hydrasys
|
Capillarys
|
Hydrasys
|
|
Moyenne
(%)
|
42.7
|
39.9
|
5.77
|
5.016
|
12.6
|
15.13
|
12.79
|
12.58
|
26.13
|
27.27
|
|
Ecart-type (%)
|
7.05
|
6.19
|
2.04
|
1.37
|
6.64
|
6.95
|
3.81
|
4.67
|
9.89
|
10.25
|
|
P
|
0.056
|
0.045
|
0.072
|
0.423
|
0.329
|
|
Coeff.
de corrélation (R2)
|
0.80
|
0.74
|
0.95
|
0.69
|
0.95
|
De bonnes corrélation ont été
constaté pour les alpha2 et les gammaglobulines sur les deux appareils
Hydrasys et Capillarys (R2 = 0,95 ; R2 = 0.95
respectivement) (Figure2).

Figure 2 : Étude de
corrélation des fractions de profils protéiques pathologiques
sur l'Hydrasys et le Capillarys
3- Étude de repétabilité des fractions
de profils normaux :
Nous
avons constaté que pour les profils normaux, le Capillarys
présente une meilleure précision que l'Hydrasys avec un CV
toujours inférieur à 5% et ceci pour les cinq fractions
protéiques (Albumine, alpha1 globulines, alpha2 globulines, beta
globulines et Gamma globulines). (Tableau III)
Tableau III : Etude de
repétabilité des fractions de profils normaux
|
Albumine
|
Alpha1
globulines
|
Alpha2
Globulines
|
Beta globulines
|
Gamma globulines
|
|
Capillarys
|
Hydrasys
|
Capillarys
|
Hydrasys
|
Capillarys
|
Hydrasys
|
Capillarys
|
Hydrasys
|
Capillarys
|
Hydrasys
|
|
Moyenne
(%)
|
60.53
|
59.57
|
3.68
|
3.41
|
8.53
|
8.96
|
9.63
|
12.1
|
17.63
|
15.96
|
|
Ecart-type (%)
|
0.53
|
0.87
|
0.09
|
0.22
|
0.24
|
0.41
|
0.14
|
0.72
|
0.29
|
0.83
|
|
CV (%)
|
0.87
|
1.47
|
2.49
|
6.69
|
2.92
|
4.65
|
1.55
|
6.02
|
1.69
|
5.26
|
|
4- Étude de repétabilité des fractions
de profils pathologiques :
Pour les profils pathologiques (Albumine et gammaglobulines
diminuées ; beta globuline élevé) le Capillarys
présente toujours une meilleure précision que l'Hydrasys avec un
CV toujours inférieur à 5% et ceci pour les cinq fractions
protéiques (Albumine, alpha1 globulines, alpha2 globulines, beta
globulines et Gamma globulines). (Tableau IV)
Tableau IV : Etude de
repétabilité des fractions de profils pathologiques
|
Albumine
|
Alpha1
globulines
|
Alpha2
Globulines
|
Beta globulines
|
Gamma globulines
|
|
Capillarys
|
Hydrasys
|
Capillarys
|
Hydrasys
|
Capillarys
|
Hydrasys
|
Capillarys
|
Hydrasys
|
Capillarys
|
Hydrasys
|
|
Moyenne
(%)
|
36.11
|
35.38
|
5.09
|
4.05
|
10.06
|
12.39
|
45.75
|
43.18
|
2.99
|
5
|
|
Ecart-type (%)
|
0.23
|
1.09
|
0.11
|
0.21
|
0.15
|
0.42
|
0.24
|
1.04
|
0.11
|
0.47
|
|
CV (%)
|
0.65
|
3.08
|
2.35
|
5.23
|
1.49
|
3.39
|
0.53
|
2.41
|
3.68
|
9.56
|
La précision dans la détermination des fractions
albumine et gamma globulines sur Hydrasys est d'étant plus
médiocre que ces derniers sont diminués.
En faisant passer la fraction d'albumine de 59,7% à
35,38%, les gammaglobulines de 15,96% à 5%, les CV correspondants
passent de 1,47% à 3,08% et de 5,26% à 9,56% respectivement
L'élévation des beta globulines de 12,10 à
43,18%améliore la précision de l'Hydrasys et le CV passe de 6,02
à 2,41%.
5- Étude d'exactitude :
Le Tableau V montre que le Capillarys donne une
très bonne exactitude avec le sérum contrôle normal avec un
CE toujours inférieur à 5% avec les cinq fractions
protéiques .Par contre, l'Hydrasys s'avère non exact avec les
fractions alpha1 globulines et beta globulines (CE= 18,7% et 8,48%).
Tableau V : Etude d'exactitude
|
Albumine
|
Alpha1
globulines
|
Alpha2
globulines
|
Beta globulines
|
Gamma globulines
|
|
Capillarys
|
Hydrasys
|
Capillarys
|
Hydrasys
|
Capillarys
|
Hydrasys
|
Capillarys
|
Hydrasys
|
Capillarys
|
Hydrasys
|
|
CE(%)
|
1.56
|
0.6
|
2.22
|
18.7
|
2.12
|
4.8
|
2.03
|
8.48
|
2.78
|
4.8
|
CONCLUSION
Notre étude comparative des deux méthodes
d'électrophorèses capillaire (sur Capillarys , Sebia) et sur gel
d'agarose (Hydrasys, Sebia) a montré :
- peu de corrélation entre les deux méthodes.
-l'électrophorèse capillaire présente
toujours des fractions d'albumine et d'alpha1 globulines significativement plus
élevés que celles sur gel d'agarose.
-l'électrophorèse capillaire s'avère plus
précise et plus exacte que celle sur gel d'agarose.
Ainsi, étant ses performances analytiques et le fait
qu'elle soit plus automatisée, l'électrophorèse capillaire
sur l'appareil Capillarys, s'adapte parfaitement aux besoins et aux attentes de
notre laboratoire.
BIBLIOGRAPHIE
1- Lissoir B.,Wallemacq P.,Maisin
D.,Électrophorèse des protéines sériques :
comparaison de la technique en capillaire de zone Capillarys ®
(Sebia) et de l'électrophorèse en gel d'agarose
Hydrasys®(Sebia).
Annales
de Biologie Clinique,Septembre 2003, 61 :557-62
2-Valdiguié P., Protéines plasmatiques.
2ème éditions .Paris : Editions médicales
internationales , 2000,PP.197-228.
3-Kubab N., Imad Hakawati I., Alajati-Kubab S.Guide des
examens biologiques .4ème édition,2006,PP ,38 - 48.
4- Institut de Biologie clinique Université Libre de
Bruxelles.2009,vol. 4.
Disponible sur : `
http://www.ulb-ibc.be/repertoire%20_IBC/orosomucoides.aspx
(consulté le 24 Avril 2010)
5- Lievens M., Bienvenu J., Buitrago JMG et al. Evaluation of
four new Tina-quant assays for determination of á-1-acid
glycoprotein,á-1-antitrypsin, haptoglobin and prealbumin. Clin Lab,
1996, 42: 515-520.
6- Schneider M., Pott G., Gerlach U.,
Alpha-1-Antitrypsin-Mangel, Klin Wschr 1986: 64:197-205
7-
http://www.vulgaris-medical.com/encyclopedie/ceruleoplasmine-ceruloplasmine-5819.html
(consulté le 29 Avril 2010)
8- Bienvenu J., Roche C., Bernon H., Bienvenu F., Profil
ciblé inflammatoire, Feuillet de biologie,1995 :63-67.
9- Borel J., Caron J., Chanard J., Gougeon J., Leutenegger M.,
Maquart FX et al. Comment prescrire et interpréter un examen de
biochimie. 2e ed. Paris, Maloine S.A. Éditeur, 1985.
10- Foulon T,. Groulade P,. Groslambert M,. ;
Groslambert P,. Cadore J.- Hyperbêtaglobulinémies et
sous-classes d'igG chez le chien. Étude sur 50 cas. Bulletin de
l'académie vétérinaire de france 1996,
69 : 87-94

11-Trumel C., Schelcher F., Braun J.P., Guelfi
J.F.L'électrophorèse des protéines sériques :
principes d'interprétation chez le chien, le chat et le cheval.
Rev.Med.vét, 1996 :123-130.
12-Batamuzi E.K., Kristensen F., Jensen A.L.Serum protein
electrophoresis: Potential test for use in geriatric companion animal health
programmes. J. Vet. Med,1996 :501-508. .
13- MAGNIEZ,Frédérick,
L'électrophorèse
. Disponibe sur :
http://biotechnologie.over-blog.com/article-21737522.html
. Publié dans :
biotechnologies
le Mercredi 2 juillet 2008 (consulté le 01-05-2010)
14-Valiguié P. Biochimie clinique. Edition
médicales internationales,1993,p 391.
15-Séger J., Lcotte G.La pratique de
l'électrophorèse appliquée à la détection
des polymorphismes humains. In : Technique de laboratoire.Paris New York
Barcelone Milan Mexico Rio de Janeiro ,1981. 23-35.
16- Pasteur N. Manuel technique de
génétique par électrophorèse des protéines
Paris: Lavoisier, 1987.
17-Boyer R.F.Modern experimental
biochemistry Reading : Addison-Wesley Publishing Company,1993.114-45.
18-Garnier M. Dictionnaire des termes de
médecine,26ème édition- Maloine, Paris,2000.
19-Medaille C. Electrophorèse des protéines
sériques.Prat. Med, 1997.267-268.
| 


