:ÜÜÜÜÜ?ÈÚÔ1Ç
-~ØÇÑÜÞã-Ï~Ç
.7ÑÆÇÒÜÜÌ~Ç
.ÜÜ.ÑæåãÜÌ~Ç
REPUBLIQUE ALGERIENNE DEMOCRATIQUE ET POPULAIRE
íÜÜãáÚ~Ç
ËÍÈ1Ç æ
íÜÜ~~ÚiÇ
ã.ÜÜáÚÊ1Ç
ÉÑÇÒæ
MINISTERE DE L'ENSEIGNEMENT SUPERIEUR ET DE LA RECHERCHE
SCIENTIFIQUE
AÜÜÜÜÜá~Óã1Ç
~ÖæÈ ÏãÍã
ZÚã1Ì
UNIVERSITE MOHAMED BOUDIAF - M'SILA
MEMOIRE
présenté
A LA FACULTE DES SCIENCES ET DES SCIENCES DE
L'INGENIORAT
DEPARTEMENT DE BIOLOGIE
pour obtenir
Le Diplôme des Etudes Supérieures en
Biologie
(DES)
OPTION : BIOCHIMIE
par
Ferhat M., Kadi
I. et Lahouaou A.
THEME :
Recherche de substances bioactives de
l'espèce
Centaurea microcarpa Coss et Dur.
Encadré(e)(s) par :
Mr Benkhaled A. M.A.C.C.
Remerciements :
On remercie tout d'abord Dieu tout puissant de nous avoir
donné le courage, la force et la patience d'achever ce modeste
travail.
Nous tenons à remercier aussi :
Nos chères familles.
Notre encadreur Monsieur Benkhaled.A.
Monsieur Sghiri.K, résponsable du laboratoire de
Biologie ainsi que les ingénieurs de laboratoire, de nous avoir
acceptés au sein de leur laboratoire et de nous avoir fournis les
conditions les propices au bon déroulement de notre travail.
Monsieur Zitouni A. responsable du laboratoire de Chimie, qui
nous à accueillie dans son laboratoire. Ainsi que mlle Akrib pour ces
précieux conseils.
Tous les enseignants du département de Biologie et les
étudiants de la promotion 2008 /2009. Et tous ceux qui ont
participés de prés ou de loin à la réalisation de
ce mémoire.
Dédicaces
Je dédie ce travaille, qui est le couronnement de toutes
les années d'étude et qui ne s'est achevé sans votre amour
et encouragement:
Je remercie Dieu de tout puissant de m'avoir donné le
courage, la patience et la volante pour réaliser ce travail.
· A ma mère pour son amour et son encouragement
depuis toujours, je la dit merci ma mère, tu es la meilleure j'en suis
sure.
· A mon père qui ma su encouragé et me
soutenir sur tout les plans.
· A mes soeurs et mes frères chaq'un par son nom.
· A mes amies Maroua, Imane, Sara, Wahiba et Imene.
· Monsieur Sghiri.K, responsable du laboratoire de
Biologie ainsi que les ingénieurs de laboratoire, de nous avoir
acceptés au sein de leur laboratoire et de nous avoir fournis les
conditions les propices au bon déroulement de notre travail.
· A monsieur le chef de département de Biologie:
Sari M. et à tous les enseignants du département de Biologie
· A tous les étudiants de biologie.
Amel
oédicace
Mes remerciments vont tout d'abord à Dieu Tout puissant
pour m'avoir donné la volonté, la patience et le courage de
réaliser ce modeste travail.
Je dédie ce travail à ma chère famille en
particulier mon très cher et regretté père, ma mère
et petite soeur ; Safa.
Je remercie aussi :
· Mes amis : Amel A., Imene B., Sara C., Wahiba A. et Imene
K. pour tous les bons moments passées ensembles.
· A mon encadreur Mr Benkhaled A. pour sa présence
et ses conseils.
· Le résponsables de laboratoire de Biologie Mr
Sghiri Kamel et ses ingénieurs de laboratoire : Bilal, Benyahia et Aicha
pour nous avoir admis au sein de leur laboratoire et nous avoir octroyé
les conditions propices au bon déroulement de notre travail pratique
ainsi qu' Wahiba, Zahra et Sara pour leur présence.
· A monsieur le chef de département de Biologie:
Sari M. et à tous les enseignants du département de Biologie sans
exception pour leur efforts fournis durant ces quatre agréables
années.
· A l'ensemble des étudiants de ma promotion 2008
/2009.
Et a tous ceux qui ont participés de prés ou de
loin à l'accomplissement de se modeste travail.
Merci, merci, merci
aVarouor
Dédicaces
Je dédie ce travaille, qui est le couronnement de toutes
les années d'étude et qui ne s'est achevé sans votre amour
et encouragement:
Je remercie dieu de tout puissant de m'avoir donné le
courage, la patience et la volante pour réaliser ce travail.
· A ma mère pour son amour et son encouragement
depuis toujours, je la dit merci ma mère, tu es la meilleure j'en suis
sure.
· A mon père qui ma su encouragé et me
soutenir sur tout les plans.
· A mes soeurs et mes frères chaq'un par son nom.
· A mes amies Amel, Maroua, Imane, Sara, Wahiba, Sara et
Hala.
· A tous les étudiants de biologie.
Imene
Résumé
Centaurea microcarpa Coss et Dur., une espèce
présente dans la région de M'sila (Hourane) a été
étudié afin d'extraire des huiles essentielles par
hydrodistilation, des polyphénols et des flavonoïdes ; par
plusieurs méthodes utilisant des solvants de polarité
différente, et de mettre en évidence la présence des
composées phénoliques par une analyse chromatographique(CCM) en
utilisant plusieurs systèmes solvants.
Les résultats ont montrés que cette espèce
contient des huiles en quantité moyenne (1,231%), des
polyphénols(21%), des flavonoïdes majoritairement glycosylés
(14, 074%), et les tests de mise en évidence ont confirmés la
présence de coumarines, des tanins, d'anthocyanes et une faible
quantité de saponosides.
Abstract :
Centaurea microcarpa Coss and Dur., A species present in
the region of M'sila (Hourane) was studied to extract essential oils by
hydroditilation, polyphenols, and flavonoids unsing different solvant. And to
detect the presence of a phenolic compound by chromatography analysis (TLC).
The results showed that this species contains essential oils
(1.231%), polyphenols (21%) and flavonoids (14, 074%), and tests have
underscored confirmed the presence of coumarins ,tannins, anthocyanin and a
small amount of saponosides.
ÕÎáã:
ìÇÓìr~Ç
Ê~Øñæ~ Õ~D Úìð
ìáE ~ñÎÓÇÓÏ
ÌñÔÌÇCross et Dur. .Centarea
microcarpa íñÇ
|
|
|
ÊòÓ~ÓáÇÇ
ËìñÖ~Ç æ
ËÇÐñìðì~~1Ç
áìñò~Ç ËÇÐñÐ~
ìáE Êñìð~~~Ç
Ë1È3Ôæ~Ç
|
ÕEÎÎÓÇ
ÊòáæF ÌáæÎÔ
Ç.
|
|
|
|
íòÎ~ñÔØ~
ÌæÍ
|
áìñò~Ç
ËÇÐñÐ~ Õ1ÎÎÓÇ :
|
|
~åáæÚÎÓÇ
|
ðÎ~Ç
|
ßáÍ
|
ð~ ìIæáÇÇ
Akowah et al 5 ãÇÐÎÎÓ ~ 2005 4
ÉÐæ~ ÊáÎÎå
ÊòÈØÞ íæÑ
Ë~ÈñÒæ~Ç
|
íå
ÚÇìðÇË~ElÓ 8 .Ë~~~Ó
|
|
|
|
·
~åáåÚÎÓÇ ðÎ~Ç
ßáÍ ð~ Êòð~1~Ç
OwensæJohens 168 ÉÐæ~
Õ~ÎÎÓáÇÇ
Êòáæ~ ð~
|
áìð~~òæ~Ç
ãÐÎÎÓÇ íñÇ
.Ê~~Ó
|
Ê~ñÔØ ðT
íZÍáÇÇ
ÏæÏÔæ~Ç AkowahÁ~æ~Ç
ÊØÓÇì~ åòáE
áì1~~Ç äÍ ) 18 (%
Ê~ñÔØ ð~ ~åÇ Owens æ Johens
ÏæÏÔæ~Ç ì~ß~ )21
(%. ã1Î~Ç
áìñò~Ç ËÇÐñÐ~
ÕáÎÎ~æ~ ÊÎÈñ~Ç
ìñÛ Ð~Äñ 7å
ÇÒE
áìð~~òæ~~~
ËÇÐñìðì~~~Ç
ÕáÇ ÎÎÓÇ äÍ)85(%
æ )50(% ðÆ~æ~Ç ÆÖ11Ç
ð1 íZÍáÇÇ
ÏæÏÔæ~Ç ì~~ ËòÍ
)14(% ÌÆ~Îð Ð~Äñ ~å
ÇÒ~
. Õì~ìá~~Ç
Êò~1~Ó æ ÊòË~Ë
ÊòÆ~ñË
ËÇÐòðì~~~Ç
ÏìÌæ æ íòÎ~YO Ç
íòÎ~ñÔØ~Ç
ÌæÍ
ÊòÆ~òæòEìÎò~Ç
ËÇÓ~ÈÎNáÇÇ ÖÚ~
ÊØÓÇì~
áìñò~Ç
ËÇÐñÐ~æ
ËÇÐñìðì~~IÇ
ËÇÐñÕìðì~15~Ç
íñÓ~åìß~Ç
íòð~òÓìÎðáÇÇ
ÏìÌæ Ë~ÈËÇ ÐÚ~
. ðTEñÈ~Ç Þì~
æ ðÆÔæ~Ç íò~~~æ~Ç
ð~ ðòØ Ç
ÁÇìÖÎÓáÇÇ æ
Ê~òÞÓ Ê~òÕ ìá~
~ò1ÇÔÛìÍ1åæÔ~
ÊØÓÇì~
ÖòòæÎ~Ç
ÊòáæU
ÊòÆ~òæòß~Ç
ÊÓÇÓÐ~Ç ÐÚ/ Centaurea
microcarpa Cross et Durðáñ ~å
íå ììßÎÍ :
áìñò~Ç Ë
ÇÐñÐ~
, ËÇÐñìðì~~~Ç ,
ÊòÓ1ÓáÇÇ
ËìñÖ~Ç ,
ËÇÐñÕìðìTh Ç ,
Û~~Ð~Ç
,íòð~òÓìÎðæáÇÇ,
Ë~ññÓ~åìß~Ç
Sommaire :
Introduction
Chapitre I: Les polyphénols et mesure de l'activité
antioxydante. I.1. Polyphénols
I.2.Les flavonoides.
I.3. Activitées biologiques des polyphénols
Chapitre II: Les huiles essentiels et mesure de
l'activité antibactérienne
II.1. Les huiles essentielles
II.2. Méthodes d'extraction des huiles essentielles
II.3. Activité antimicrobienne des huiles essentielles
II.4. méthodes de mesure de l'activité
antimicrobienne de HE
Chapitre III. Plante d'étude III.1. La plante
d'étude II.2. Région d'étude
Chapitre IV. Matériel et méthodes
IV.1. Matériel végétal
IV.2. Extraction des extraits bruts polyphénoliques
IV.3. Extraction des flavonoides
IV.4. Extraction des huiles essentielles par
hydrodistillation
IV.5. Tests phytochimiques
IV.6. Séparation des extraits méthanoliques bruts
par CCM
IV.7. Spéctrophotométrie UV-visible
Chapitre V. Résultats et interpretation
V.1. Tests d'humidité et séchage
V.2. Extractions
V.3. Extraction des flavonoides
V.4. Extraction des HE
V.5. Caractérisation des extraits bruts
polyphénoliques
V.6. Chromatographie sur couche mince
V.7. Spectrophotométrie UV-visible
Liste des figures :
Figure 01 : Répartition des
polyphénols dans quelques fruits et légumes.
Figure 02 : Structure générale des
flavonoïdes (C6-C3-C6)
Figure 03 : Structure chimique du DPPH.
Figure 04 : Structure du précurseur des
huiles essentiels : l'isoprréne.
Figure 05 : Photo de Centaurea microcarpa Coss.
et Dur.
Figure 06 : Localisation de la zone
d'étude.
Figure 07: Test d'humidité de la partie
aérienne de Centaurea microcarpa Coss et Dur. Figure 08
: Protocol d'extraction des polyphénols selon la méthode
d'Akowuah et al., 2005 Figure0 9 : Filtration des extraits
(à travers un tissus)
Figure 11: Extrait méthanolique
Figure10 : Evaporation des extraits par
rotavapor.
Figure 12 : Protocol d'extraction des EBP selon
la méthode d'Owen et Johns, 1999.
Figure13: Protocol d'extraction des
flavonoïdes totaux selon la méthode de Mabray et Makhram, 1982.
Figure 14: Schéma de principe d'une
extraction par hydrodistilation.
Figure 15 : Extraction des HE par
hydrodistilation.
Figure 16 : Principe d'une séparation
CCM.
Figure 17: Pourcentage en eau de la partei
aérienne de Centaurea microcarpa Coss et Dur.
Figure18 : Rendements d'extraction en fonction
du type de solvant et du temps d'extraction
des parties aériennes de Centaurea microcarpa
Coss et Dur.
Figure 19: Rendement en flavonoïdes totaux
chez Centaurea microcarpa Coss et Dur.
Figure 20: Répartition des
différentes fractions flavonoides de Centaurea microcarpa Coss
et Dur.
Figure21: Pourcentage en HE de Centaurea
microcarpa Coss et Dur.
Liste des tableaux :
Tableau 01 : Classement des fruits et
deslégumes riches en polyphénol. Tableau 02 :
Principales méthodes d'études des composées
phénoliques. Tableau 03 : Principales activités
biologiques des composées phénoliques.
Tableau 04 : Déscription botanique de
quelques especes du genre Centaurea.
Tableau 05 : Aire de répartition de
quelques espèces du genre Centaurea.
Tableau 06: Composition chimique de quelques
espèces du genre Centaurea. Tableau
07: Propriétés thérapeutiques de quelques
espèces du genre Centaurea.
Tableau 08: Les parties de la plante
utilisées de quelques espèces du genre Centaurea.
Tableau 09: Les différents
systémes solvants utilisées pour la ccm
Tableau 10: Teneur en eau de Centaurea
microcarpa Coss et Dur.
Tableau 11: Ensemble des résultats de l
'extraction des EBP.
Tableau 12 : Rendement de l'extrait
méthanolique.
Tableau 13: Rendement en flavonoides totaux de
Centaurea microcarpa Coss et Dur.
Tableau 14: Résultats des tests
phytochimiques.
Tableau 15 : Plaques CCM après
élution et observation sou UV.
Tableau 16: Propriétés
physicochimiques des étalons utilisées en CCM.
Tableau 17: composés phénoliques
identifiés par CCM (Markham, 1982). Tableau 18:
Révélation des flavonoïdes après séparation
CCM (Markham, 1982). Tableau 19: Composés
phénoliques probables identifiés par CCM .
Tableau 20 : Résultats de l'analyse
spectral.
Introduction :
Les plantes véritable usine chimique ne cessent de nous
épater encore et encore par la richesse des constituants qu'elles
synthétisent que par les multiples utilisations qu'elles trouvent dans
notre vie quotidienne. Cela nous fait ouvrir les yeux sur la terre, sur sa
végétation et sur les possibilités médicinales car
malgré les énormes progrès réalisés par la
médecine moderne l'homme n'a eu que les plantes pour le guérir et
prévenir depuis la nuit des temps du fait que les plantes
présentent des remèdes naturels bien acceptés par
l'organisme .
La recherche sur les substances naturelles est un thème
porteur de puis quelques années et les laboratoires pharmaceutiques sont
toujours prêts à l'élaboration de nouveaux composés
actifs, à l'identification, à la caractérisation des
molécules naturelles et à la mise au point des médicaments
qui ont pour origine des substances naturelles et de s'inspirer de leurs
structures moléculaires pour imaginer de nouveaux médicaments.
Ces molécules que constitue le principe actif des plantes
médicinales appartiennent majoritairement aux métabolites
secondaires tels que les polyphénols, les huiles essentiels et les
alcaloïdes.
On s'est intéressé dans notre travail aux
molécules ayant des propriétés antioxydantes. Dans ce
cadre, on a étudié les extraits d'une espèce
végétale ; Centaurea microcarpa Coss et Dur., suivant
deux approches
- Une approche théorique visant:
· Présenter les polyphénols et les huiles
essentielles de façon générale
· Mettre en avant les activités anti oxydantes des
polyphénols et l'activité
antimicrobienne des huiles essentielles.
- Une approche expérimentale consistant à :
· Extraire des polyphénols, des flavonoïdes
et des huiles essentielles par différents
méthodes et déterminer les différents
facteurs qui influencent leur extraction ainsi que
les rendements.
(CCM) et une analyse spectrale par spectrophotométrie
UV-visible.
· Soumaitre les extraits brutes polyphénoliques a
une analyse chromatographique
Les polyphénols et
mJsXtJ IdJ Il'LF\ivité
antioxydante
I.1. Les polyphenols :
I.1.1. Définition des
polyphénols:
Avec environ 9000 structures naturelles
élucidées à ce jour, les polyphénols constituent
une famille importante de métabolites secondaires de faible poids
moléculaire du règne végétal (Akowah et al, 2004),
qui correspondent à une très large gamme de structures chimiques
et sont un bon témoin de l'extraordinaire capacité de
biosynthèse des plantes. Ce sont des corps dont la molécule
contient plusieurs fonctions phénols (Ferguson L, 2000), ces corps
jouent un rôle fondamental car sont des éléments importants
de qualités sensorielles (couleur et caractère organoleptique.)
et nutritionnelles des végétaux que consomme l'homme et leur
intervention dans la santé et maintenant reconnue dans des domaines
variés,anticoncerigene ,antioxydant, la lutte contre le vieillissement
des cellules (Sarni-Manchado et Cheynier,2006), anti oestrogenique et anti
inflammatoire, certains d'eux sont dits non nutritionnels car ils ne jouent
aucun rôle dans la plantes.
I.1.2 Localisation au niveau cellulaire et
tissulaire:
Une bonne reconnaissance de la localisation des composés
phénoliques dans les différents tissus et organes
végétaux est souvent essentielle pour orienter l'utilisation que
l'homme souhaite en faire.
A l'échelle cellulaire, la localisation des
composés est très caracteristique.Ils s'accumulent principalement
dans deux sites : d'une part la paroi cellulaire ou sont présentes les
lignines et la
vacuole RX \RQ \tRFké\ O\ SNénRl\ \RlXRe\ [lntNRF
l11\, KlMRnRl\, Ilnin\, I FRtlin\
flavonoïdes (quercétine, kamphérol) pourraient
également être présents au niveau du noyau et de la
membrane plasmique mais toujours à très faible concentration.
A l'échelle tissulaire, on observe également des
repartions très inégales des différents composés
phénoliques. Ainsi les anthocyanes et les pigments de type flavonols
sont généralement présent dans les couches cellulaires
externes des organes végétaux en particulier les épidermes
de fruits et des feuilles.(Sarni et Cheynier ,2006).
=Répartition au niveau des fruits et
légumes:
Plusieurs milliers de polyphénols ont été
identifiés chez les plantes dont plusieurs centaines dans les plantes
comestibles. Il est généralement admis que les humains
ingèrent environ 1 gramme de polyphenols par jour (Akowah et al,
2004).
Tableau 01 : Classement des fruits et
légumes les plus riches en polyphénols :
( Brad et al., 2008
)
|
Fruits et légumes
|
PP totaux ( mg GAE/100 g )
|
|
01
|
$ EtiFKIIIXtJ(JF IXEJI
|
321.3
|
|
02
|
Persil
|
280.2
|
|
03
|
Fraise
|
263.8
|
|
04
|
Choux de Bruxelles
|
257.1
|
|
05
|
Litchi
|
222.3
|
|
06
|
Raisin
|
195.5
|
|
07
|
Abricot
|
179.8
|
|
08
|
Pomme
|
179.1
|
|
09
|
Echalote
|
104.1
|
|
10
|
Datte
|
99.3
|
|
11
|
Brocoli
|
98.9
|
|
12
|
Cerise
|
94.3
|
|
13
|
Figue
|
92.5
|
|
14
|
Célerie
|
84.7
|
|
15
|
Oignon
|
76.1
|
|
16
|
Nectarine blanche
|
72.7
|
|
17
|
Fruit de passion
|
71.8
|
|
18
|
Poire
|
69.2
|
|
19
|
Mangue
|
68.1
|
|
20
|
Aubergine
|
65.6
|
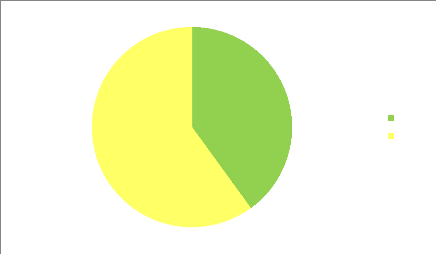
60%
0% 0%
40%
légume fruits
Figure 01 : Répartition des
polyphénols dans les fruits et légumes.
Les polyphénols sont particulièrement abondants
dans les fruits. Leur teneur Peut atteindre 263.8. mg GAE / 100 g dans certains
fruits comme les fraises, les pommes, les raisins.
Les légumes contiennent aussi des quantités
importantes de PP. le champion toute catégories est l'artichaut avec une
concentration de 321.3 mg GAE / 100 g.
Parmi les 20 premiers fruits et légumes les plus riches en
polyphénols. 60 % représentent les fruits et le reste des 40 %
est représenté par les légumes
q 11141 1 plKEdl-lafpWdl-f al-s SEOSKpnEC :
L'extraction, la séparation, la caractérisation et
le dosage des composées phénoliques se fait selon plusieurs
méthodes, les plus utilisées et employées sont
résumé dans le tableau qui suit :
Tableau 02 : Principales méthodes
d'études des composées phénoliques :
|
Techniques :
|
Principe:
|
Référence :
|
|
Extraction
|
Extraction par les
solvants (macération)
|
Le contacte entre le solvant(liquide) et la matière
végétale (solide) a pour but de libérer
les polyphénols présents dans les cellules par rupture du tissus
végétale et par diffusion.
|
Owen et johns, 1999
Hayouni et al.,2007
|
|
Extraction par
chromatographie sur
colonne
|
Elle consiste à absorber sur une résine du type
C18 pour les polyphénols et flavonoïdes des extraits
végétaux puis à éluer sélectivement les
substances polyphénoliques au moyen d'éthanol ou méthanol
aqueux .
|
|
|
Extraction supercritiques (SFE)
|
-Le CO2 supercritique, utilisé comme solvant
d'extraction, du fait de sa faible viscosité lui
confère une grande capacité de diffusion lui permettant d'avoir
accès à des composées phénoliques liés a la
paroi cellulaire et sa densité relativement élevé lui
confère un pouvoir de solvatation ce qui permet un meilleur taux
d'extraction. -Procédé non dénaturant.
-Temps d'extraction réduit.
|
Chan et Maznah ,2009
|
|
Separation et purification
|
Chromatographie sur couche mince (CCM)
|
Séparation et purification des différents
constituants en fonction de leur taille et de leur forme Les constituants du
mélange se séparent par migration différentielle : chacun
d'eux est d'autant plus entraîné par l'éluant qu'il est
plus soluble dans celui-ci et
moins adsorbé sur la phase stationnaire.
|
Tissut, 1967
|
|
Chromatographie liquide haute
performance (HPLC)
|
L'échantillon à analyser est poussé par un
liquide
(appelée phase mobile) dans une colonne remplie d'une
|
CastanedaOvando et al.,2009.
|
|
phase stationnaire de fine granulométrie (les "grains"
sont de très petite taille). Le débit d'écoulement de la
phase mobile est élevé ce qui entraîne une augmentation de
la pression dans le système. Ce débit élevé diminue
le temps nécessaire pour séparer les composants le long de la
phase stationnaire
|
|
Chromatographie
phase gaz (CPG)
|
Les différents solutés gazeux vont se
séparer par
migration différentielle le long de la phase
stationnaire.
|
Colin-Henrion et al.,2008
|
|
Caracterisation
|
Chromatographie sur couche mince (CCM
|
Les constituants du mélange se séparent par
migration différentielle : chacun d'eux est d'autant plus
entraîné par l'éluant qu'il est plus soluble dans celui-ci
et
moins adsorbé sur la phase stationnaire.
|
Lawson,2006
|
|
Spectrophotométrie UV-visible
|
méthode analytique quantitative qui consiste à
mesurer l'absorbance ou la densité optique d'une substance chimique
donnée en solution. Plus cette espèce est concentrée plus
elle absorbe la lumière dans les limites de proportionnalités
énoncées par la loi de Beer-Lambert. La densité optique
des solutions est déterminée par un spectrophotomètre
préalablement étalonné sur la longueur d'onde d'absorption
de l'espèce chimique à étudier.
|
Harbourne et al.,2009
|
|
HPLC-MS et RMN
|
|
Bassomo et al.,2004
|
|
Dosage
|
Dosage par
spectrophotométrie
|
Par méthode de Folin ( non spécifique)
|
Harbourne et al.,2009
|
|
Dosage par HPLC
|
Séparation sur colonne phase inverse C18 et
détection à l'aide d'un spectrophotomètre UV 171
|
Lawson,2006
|
².2. Les flavonoïdes
Les flavonoïdes présentent la plus grande classe
de polyphénols, ils relèvent du métabolisme secondaire et
sont très répondus dans le règne végétal. On
estime que 2% de l'ensemble du carbone photo-synthétisé par les
plantes est transformé en flavonoïdes (Alothmane et al.,2009).
Ils sont présent dans les feuilles, les fleurs, le
pollen et les fruits, leur concentration augmente avec l'exposition au soleil
et constituent de ce fait un écran protecteur contre la photo et la
thermodégradation (protègent la plante des agressions du
rayonnement UV) (Sarni-manchado et Cheynier, 2006). Ils participent aussi
à la coloration des fleurs et des fruits et existent le plus souvent a
l'état naturel sous forme d'hétérosides.
Les flavonoïdes sont des molécules
polyphénoliques avec un squelette diphenylpropane (C6-C3- C6) (Alothmane
et al., 2009), fait de 15 atomes de carbone, avec une grande diversité
structurale, en effet, on en dénombre 5000 composés
différents et présentant des propriétés de
solubilités différentes influençant leurs extraction
(Alothmane et al.,2009).
Plusieurs études ont soulignés que les
flavonoïdes de différentes sources botaniques agissent comme
antioxydants puissant encor plus que la vitamine C (Alothmane et al.,2009),
due principalement à la configuration catéchol
du noyau B. Cette activité s'exerce surtout dans les milieux
émulsionnés car ils sont peu solubles dans les phases lipidiques
et protègent efficacement les lipoprotéines ou liposomes
(Sarni-manchado et Cheynier, 2006). Les flavonoides agissent comme antioxydants
primaires et stabilisent les radicaux peroxydes, mais peuvent aussi
désactiver l'ion super-oxyde, le radical OH* ou l'oxygène
singulet, inhiber la lipoxygénase ou encor chélater les
métaux (surtout les flavonoïdes) (Sarni-manchado et Cheynier,
2006).
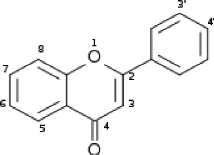
Figure 02: Squelette flavonoïdique (
C6-C3-C6)
Deux cycles aromatiques de type phényl A et B liés
par une chaine de trois carbone généralement cycliques.
Le degré d'oxydation du cycle détermine les
différentes classes de flavonoïdes
qiim Activités biologiques des
polyphénols :
Les composées phénoliques sont douées
d'activités diverses, probablement su a leurs diversités
structurales, le tableau suivant, englobe les activités biologiques des
polyphénols les plus importantes :
Tableau 03 : Principales activités
biologiques des composées phénoliques :
|
Classes de polyphénols
|
Activités
|
Références
|
|
Acide phénoliques
|
Anti carcinogènes Anti mutagènes
Anti oxydants
|
Ferguson, 2001
Sarni-Manchado et Chenyier ,2006
|
|
Stilbénes
|
Inhibent l'oxydation des LDL et l'agrégation des
plaquettes
Anti carcinogènes Anti mutagènes
|
Sarni-Manchado et Chenyier, 2006
Ferguson, 2001
|
|
Coumarines
|
Anti carcinogènes Anti mutagènes
Digestibilité des protéines
|
Ferguson,2001
Lazoui et al ,2006
|
|
Flavonoïdes
|
Anti carcinogènes Anti mutagènes
Anti oxydants
|
Ferguson, 2001
Alothane et al ,2009
|
|
Anthocyanes
|
Anti oxydants Colorants
|
Sarni-Manchado et Chenyier ,2006 Ferguson, 2001
|
|
Lignines
|
Anti carcinogènes Anti mutagènes
|
Ferguson,2001
|
|
Tanins
|
Anti oxydants Anti tumoral
Digestibilités des protéines
|
Mousavinejade et al. ,2009
Lazoui et al ,2006
|
|
Proanthocyanidines
|
Anti inflammatoires
Anti bactériens Anti fongiques
|
Ferguson,2001
|
²I.3.1 . L'activité anti oxydantes des
polyphénols :
L'activité des composés phytochimiques attire
notre attention du fait leur rôle potentiel dans le prévention des
maladies humaines. Les composés phénoliques sont
considérés comme étant le groupe majeur de
métabolites secondaires, qui contribue à l'activité
antioxydante des plantes.
a. Définition de l'oxydation :
L'oxydation est les phénomènes qui fait rouiller
les métaux, qui fait flétrir les légumes et les fruits,
rancir les graisses, il modifie le gout et la couleur des aliments.
Sur le plan chimique l'oxydation est
générée par des radicaux libres; espèces chimiques
neutres ou chargées instables qui ne cherchent qu'à
récupérer un électron dans leur environnement pour
retrouver un état stable, très rapide et se propage en cascade.
Ils ciblent tous les corps gras comme les phospholipides des membranes
cellulaires mais aussi les proteines.Dans le cas des enzymes, l'oxydation
entraine une modification ou perte de l'activité biologique de la
molécule ce qui provoque des désorganisations cellulaires par
fois irréversibles entrainant la mort cellulaire .Il on est de
même quand l'oxydation touche l'ADN (Rolland Y, 2004).
b. Mécanisme de l'oxydation :
On décrit l'oxydation en trois phases distinctes, mais
pratiquement simultanées:
- L'initiation : Formation d'hydroperoxydes, initiée par
la chaleur et l'UV ou les ions métalliques et aboutit a la formation des
espèces très réactives :ROOH et R*.
- Propagation :Destruction des hyperoxydes et apparition des
composés responsables des gouts et odeur de rance par rupture des
liaisons O-O.
-Terminaison :Apparition de nouvelles espèces
moléculaires anarchiques (formation des polymères ou au contact
avec un autre radical),les molécules crées n'ont plus de
fonctions biologiques.
Les espèces radicalaires produites par les
premières réactions sont hautement réactives et vont
à leur tour arracher un hydrogène à une autre
molécule (Rolland ,2004).
c. Les antioxydants:
Ce sont des molécules qui fixent les radicaux libres et
protègent les protéines essentielles et qui diminuent ou
empêchent l'oxydation d'autres substances chimiques (Weber B 2009).
Il existe deux types d'anti oxydants :
Les antioxydants primaires ou vrais :
Ils permettent l'interruption de la chaine auto catalytique
AFT + R* = A*+ RFT
La molécule AFT est antioxydante, si le radical A* peut
s'expliquer par sa conversion en composés non radicalaires A* + A°
=A-A ou A* + R° =AR.
Les antioxydants secondaires ou préventifs; qui
assurent l'inhibition des la production des radicaux libres. Ce sont des
substances décomposant les hyperoxdes en alcool, des thiols (glutathion,
acide aminés soufrés) ou les disulfures, des protecteurs
vis-à-vis des UV, comme les carotènes, des chélatants des
métaux promoteurs d'oxydation type fer et cuivre, comme l'acide citrique
et le lécithine)ou en fin des séquestrant d'oxygène comme
l'acide ascorbique.(Rolland ,2004).
Lorsque les mécanismes de défense sont
insuffisants et/ou lorsque un excès est gêner et/ou l'apport
d'antioxydants est réduits suite à une alimentation
déséquilibrée, le stress oxydatif peut induire des
dégâts cellulaires ,des troubles métaboliques et
générer une réaction inflammatoire.une
prédisposition génétique également être la
cause d'une capacité de décence anti oxydative diminuée
.
Le stresse oxydatif est donc le résultat d'un
équilibre entre la balance des pro-oxydants et les systèmes de
défense (antioxydants) (Weber B,2009).
²I.3.2. Les méthodes de mesure de
l'oxydation:
Toutes les méthodes de mesure du pouvoir antioxydant
d'un principe actif reposent sur le même principe également
provoquer une oxydation sur une matrice sensible, et mesurer le ralentissement
de dégradation de la matrice protégée par l'antioxydant
par rapport à un témoin sans protection.(Rolland ,2004).
²I.3.2.1 . Mesure en milieu lipidique :
a. Mesure de l'oxydation en temps
réel:
Elle se fait par la mesure de l'indice de peroxyde (le nombre
de 1 gramme d'oxygène actif du peroxyde contenus dans 1 gramme de corps
gras susceptible d'oxyder l'iodure de potassium avec libération
d'iode).l'efficacité de l'antioxydant liposoluble est mesurée par
une augmentation plus lente de l'IP par rapport à 1 témoin sans
protection. (Rolland , 2004).

Chapitre I : Les polyphénols et activité anti
oxydante.
b. Mesure de l'oxydation par tests de vieillissements
accélérés:
- Test de swift ou AOM (Active Oxygen Méthod ):
Ce test consiste à faire passer un courant d'air
purifié dans un échantillon d'huile à 97,8°C à
des intervalles régulières ,on mesure l'IP, et on
détermine le temps nécessaire à un indice de peroxyde de
100 meq d'oxygène actif/Kg de matière grasse .
Ce mode de mesure peut être réalisé par
d'autres tests :
.l'utilisation de l'appareil "Oxypress"
.l'utilisation de
l'appareil "Rancimat"
9ETE2E2E 2F1) isuai2Fil2FP laiu2FDDiN :
a. Mesure au DPPH :
Le DPPH (1,1 Diphényl 2 Pycril Hydrazil) est un radical
libre stable de couleur violette intense. La mesure de l'efficacité d'un
antioxydant (capacité à fixer des radiaux libres, donc arriter la
propagation de la réaction en chaîne). (Rolland, 2004).
,en particulier l'utilisation du paramètre CE50
(Concentration efficace de substrat pour produire 50% de réduction du
DPPH ) (Molyneux ,2004) ,se fait en mesurant la diminution de la coloration
violette, à 515nm-517nm, due à une recombinaison des radicaux
DPPH .
Lorsqu'une solution de DPPH est mélangé avec une
substance qui peut donner un hydrogéne, alors cette
réaction donne lieu à la forme réduite avec perte de la
couleur violette ( avec une couleur jaune pale résiduelle du groupements
picryl encor présent).
Représentons le radical DPPH par Z*, et le donateur de
proton par AH. La reaction primaire est :
Z* + AH ZH+ A*
Ou : ZH est la forme réduite du DPPH.
A* est le radical produit par cette première
étape.
Ce dernier subira d'avantages de réactions et
réagira avec une autre molécule de la mrme espèce,
produite par une réaction parallèle avec inhibition du
radical.
Ainsi le DPPH visa à représenter un radical
libre dont l'activité doit etre supprimé par la substance
antioxydante (polyphénol)
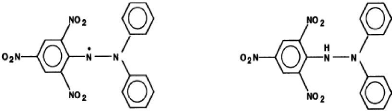
a: Diphenylpicrylhydrazyl (radical libre) b:
Diphenylpicrylhydrazine (non radicalair)
Figure 03 : Structure du DPPH (Molyneux
,2004).
b. Les paramètres influençant la mesure au
DPPH:
Cette mesure se fait grâce à un
spectrophotomètre visible, la solution est mise dans une cuve d'1 cm de
largeur avec un volume maximal de 4ml, pour une précision d'analyse, les
mélanges devraient être utilisés (comme 0,1 ml et 3,9ml et
vise vers ca) mais cela peut réduire la précision de la
mesure.
b.1. Solvantet et pH:
En ce qui concerne le solvant à utiliser, la
méthode semble fonctionner aussi bien avec du méthanol ou
l'éthanol qui interférent avec la réaction (ce sont les 2
solvants les plus communaiment utilisés), tandis que l'utilisation
d'extraits d'eau ou d' acétones semble donner des valeurs inferieures
(moindre).
Pour le pH, il a été suggéré que
le système devrait être maintenu à un pH se situant dans
une fourchette de 0,5 à 6,5 à l'aide de tampon d'acétates
mais ,cette précaution semble être abandonnée dans la
pratique actuelle. En effet, il existe une grande incertitude dans le sens du
pH dans ces valeurs principalement en milieu organique tels que le
méthanol et l'éthanol.
b.2. La concentration en DPPH:
En spectrophotométrie, la concentration en DPPH dans la
cuvette doit être
choisie de façon à donner des valeurs
d'absorbances inferieures à 01 (ce qui correspond à
l'intensité lumineuse que décroit en passant par
l'échantillon).Cela suppose une concentration entre 50 à 100
Um.
b.3. Longueur d'onde: L'absorbance est
mesurée à 515 nm, ce qui correspond au maximum d'absorbance.
b.4. Le temps de réaction:
Dans la méthode originale décrite par Blois, un
temps de température de 30minutes a été recommandé,
compte tenu du fait que le taux de la température est très
variable entre les substrats. La meilleure pratique semble être de suivre
la température jusqu'à la fin (en plateau).
-Le taux de température a été proposé
comme un autre paramètre pour caractériser les activités
antioxydantes.
Les huiles essentiels et
mesure de l'activité
antibactérienne
II. 1.Les huile essentielles :
II.1.1. Définition, localisation et
répartition :
Huile essentielle ou huile aromatique sont des produits
obtenus a partir d'une matière première végétale,
elles sont classées parmi les métabolites secondaires, leur
synthèse et accumulation se font généralement au niveau
des structures histologiques spécialisées, souvent
localisées sur la surface de la plante. Ces huiles peuvent êtres
stockées dans divers organes ; fleurs (origan), feuilles (citronnelle,
eucalyptus), écorces (cannelier), bois (bois de rose, santal), racines
(vétiver), rhizomes (acore), fruits (badiane) ou grains (carvi)
(Hernández, 2005).
Les huiles essentielles n'ont pas une présence
générale chez les végétaux. Environ 1%
des espèces élaborent des essences. Certaines
familles se caractérisent par le grand nombre d'espèces à
essences qu'elles groupent et en particulier les labiés (Thym, Menthe,
Lavande, Origan, Sauge, etc.), les Ombellifères (Anis, Fenouil,
Angélique, Cumin, Coriandre, Persil, etc.), les Myrtacées
(Myrthe, Eucalyptus), les Lauracées (Camphrier, Laurier-sauce, Cannelle)
(Benayad N, 2008).
II.1.2. Chimie des HE :
Sur le plan chimique, les huiles essentielles sont des
molécules très volatiles, de structure extrêmement
complexe, synthétisées à partir d'unités
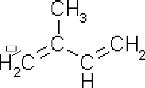
méthyle-2-buta-1,3-diène (isoprène) (figure04). Les
diverses combinaisons de ces unités, par réaction d'additions,
conduisent aux terpènes, sesquiterpènes, diterpènes, mais
aussi à leurs produits d'oxydation tels que les alcools,
aldéhydes, cétones, éther et ester terpéniques
(Hernández, 2005).
Les HE doivent leur nom à ce qu'elles sont très
réfringentes, hydrophobes et lipophiles. Elles ne sont que très
peu solubles ou pas du tout dans l'eau et on les retrouve dans
le protoplasme sous forme d'émulsion plus ou moins stable qui tende
à se collecter en gouttelettes de grosse taille. Par contre, elles sont
solubles dans les solvants des lipides (acétone, sulfure de carbone,
chloroforme, etc.) et, à l'inverse des glycérides, dans l'alcool
(Delaquis et al., 2002).
II.1.3. Propriétés des HE :
Elles ont des propriétés et des modes d'utilisation
particuliers et ont donne naissance a une branche nouvelle de la
phytothérapie : l'aromathérapie (Delaquis et al., 2002).
Les huiles essentielles possèdent de nombreuses
activités biologiques. En phytothérapie, elles sont
utilisées pour leurs propriétés antiseptiques contre les
maladies infectieuses, cependant, elles possèdent également des
propriétés cytotoxiques qui les rapprochent donc des
antiseptiques et désinfectants entant qu'agents antimicrobiens à
large spectre (Hernendez, 2005).
Chapitre II : Les Huiles essentielles et activité anti
bactérienne
Figure 04 : Structure du précurseur des
HE : l'isoprène.
(Sarni-Manchado et Cheynier, 2006)
IIM. AD plbaISHAIS'exMLFIKQAISHA (:
II.2. 1.Entraînement à la vapeur :
La plupart des huiles essentielles sont obtenues par distillation
et entraînement à la vapeur d'eau, trois variantes sont possibles
selon la texture et la fragilité de la matière première
à traiter.
II.2. 1.1. Hydro-distillation simple :
La plante est mise en contact avec l'eau dans un ballon lors
d'une extraction au laboratoire ou dans un alambic industriel. Le tout est
ensuite porté à ébullition. Les vapeurs sont
condensées dans un réfrigérant et les HE se
séparent de l'eau par différence de densité.
II.2. 1.2.Distillation à vapeur saturée :
Le matériel végétal n'est pas en contact
avec l'eau, il est placé sur une grille perforée au-dessus de la
base de l'alambic. Les composés volatils entraînés par la
vapeur d'eau vont pouvoir ~tre séparés par décantation du
distillat refroidi.
II.2.2. Hydrodiffusion :
L'hydrodiffusion consiste à faire passer un courant de
vapeur d'eau à très faible pression à travers la masse
végétale. La composition des produits obtenus est sensiblement
différente au plan qualitatif de celle des produits obtenus par les
méthodes précédentes. L'industrie des parfums a
utilisé jadis l'enfleurage pour les organes fragiles comme les fleurs,
c'est-à-dire le contact avec un corps gras qui se sature d'essence. Le
corps gras est épuisé par l'alcool absolu et ce solvant est
évaporé sous vide à 0°C.
II.2. 3.Extraction par CO2 super critique :
La technique se base sur la solubilité des constituants
dans le CO2 et de son état physique. Grâce à cette
propriété, il permet l'extraction dans le domaine supercritique
et la séparation dans le domaine gazeux. Le CO2 est
liquéfié par refroidissement et comprimé à la
pression d'extraction choisie, ensuite il est injecté dans l'extracteur
contenant le matériel végétal, après le liquide se
détend pour se convertir j à l'état gazeux pour ~tre
conduit vers un séparateur où il sera séparé en
extrait et en solvant.
II.2. 4.Extraction assistée par micro-onde
:
La technique d'extraction par micro-onde à
été développée au cours des dernières
décennies à des fins analytiques. Le procédé
d'extraction est basé sur l'absorption de l'énergie de la
micro-onde par les composantes du matériel végétal et qui
sont mesurées par une constante diélectrique, cette absorption
dépend aussi de la fréquence de l'onde et de la
température du matériel végétal.
II.3. / 4111151WWi HIFIERIKIRR auiles
essentielles :
Les HE les plus étudiées en littérature
sont reconnus par une forte activité antimicrobienne, antifongique et
antiparasitaire, en effet plusieurs auteurs ont mis l'accent sur cette
activité (Benayad, 2008, Delaquis et al., 2002, Sudjanaa et al., 2009).
Ces derniers présentent des activités remarquables contre des
souches bactériennes à Gram négatif et à Gram
positif.(Hong Yao et al.,2009).
Etant donné la grande complexité de la
composition chémotypique des HE et malgré les possibilités
de synergie certains auteurs préfèrent étudier l'effet
d'un composé isolé pour pouvoir ensuite le comparer à
l'activité globale de l'huile. Ainsi l'activité fongistatique des
composées aromatiques semble être liée à la
présence de certaines fonctions chimiques. CHAUMONT et LEGER ont
testé 12 composées aromatiques vis-à-vis de huit souches
pathogènes pour l'homme (Candida albicans, Aspergillus fumigatus,
Microsporum canis et cinq Trichophyton ssp). Ils conclurent que
les phénols (eugénol, chavicol,
4-alhyl-2,6-diméthoxyphénol) sont plus antifongiques.
Cette activité est estimée selon la durée
d'inhibition déterminée par simple observation macroscopique.
L'activité antifongique décroit selon le type de fonctions
chimiques (Hernandez, 2005) :
Phénols > Alcools >Aldéhydes >
Cétones > Ethers > Hydrocarbures.
II.4. Méthodes de mesure de
l411115iINVi HIFIERInHas HE :
Les techniques de détermination du pouvoir
antimicrobien des HE à une grande influence sur les résultats.
Les difficultés pratiques viennent de l'insolubilité des
constituants des HE dans l'eau, de leur volatilité, de la
nécessité de les tester à faible concentration et des
problèmes de standardisation des méthodes.
Les techniques existantes se répartissent en deux
catégories principales :
· Techniques de micro-atmosphère.
· Technique de contacte directe (en milieu solide ou en
milieu liquide).
II.4.1.Technique de micro-atmosphère :
Elle consiste à adapter un disque de papier filtre
imprégné d'HE au centre du cercle d'une boite de Pétrie,
sans que l'HE entre en contacte avec la gélose ensemencée par les
microorganismes. La boite est hermétiquement fermée. Il se
produit une évaporation des substances volatiles dans l'enceinte de
la boite et les cellules sensibles de l'inoculum.
Cette méthode ne quantifie pas l'activité
antimicrobienne réelle des HE, elle montre seulement l'activité
des constituants volatiles à la température d'incubation. On
considère que l'espace occupé par l'air est très petite
(le disque imprégné d'HE est prés d'environ 5mm de la
surface de l'agar) et ne permet pas de mesurer la concentration des vapeurs de
l'HE, c'est pour cette raison qu'on emploi une boite en verre
hermétiquement clos d'un volume d'air de un litre.
II.4.2. Technique par contact directe :
Les techniques par contact directe consistent à mettre en
présence l'HE et les microorganismes, puis d'observer la croissance de
ces derniers. Le contacte peut avoir lieu en milieu gélosé ou
liquide. II.4.2.1. Aromatogramme :
C'est l'un des teste les plus simples et le plus ancien, il a
été développé dans les années 1940,
l'antibiogramme par diffusion, testant l'action des antibiotiques sur les
microorganismes en mesurant leurs zones d'inhibition. Etant plus facile a
mettre en oeuvre, cette technique adoptée par les
aromathérapeutes, fut baptisé : Aromatogramme.
L'aromatogramme est basé sur la diffusion en milieu
gélosé. Ce test est réalisé à l'aide de
disques de cellulose imprégnés d'une quantité connue d'HE
déposé à la surface d'un milieu gélosé
préalablement ensemencé avec la suspension bactérienne.
Après incubation, chaque disque apparait entouré d'une zone
d'inhibition de la croissance.
II.4.2.2. Méthode du puits ou cylindre :
Proposé par Cooper et Woodman en 1946, reprise par
Shroder et Messing (1949), elle mesure une diffusion radiale de l'HE a partir
d'un puits en donnant une zone d'inhibition clair et facilement mesurable. Elle
consiste à découper un tronc circulaire vertical dans la
gélose et d'y verser une solution d'HE de concentration connu. L'HE
diffusant radialement créant une zone d'inhibition circulaire à
la surface de la gélose préalablement ensemencée avec la
suspension bactérienne.
II.4.2.3. Méthode de dilution et
micro-méthode :
Les HE à tester peuvent également être
directement mélangées en concentration connue au milieu de
ulture, qu'il soit solide ou liquide sans oublier
que les techniques de dilutions exigent une dispersion
homogène. Le milieu est ensuite inoculé à
un taux déterminé de microorganismes et après
incubation,
on note la présence ou l'absence de culture; la lecture
peut ~tre visuelle ou spectrophotométrique car le degré
d'inhibition est en rapport avec la turbidité du milieu.
Des micro-méthodes en milieu liquide ont
été mises au point, ce type de méthode sert à
déterminer les paramètres définissant l'activité
antimicrobienne en introduisant des concentrations connues dans le milieu.
Plante d'é\MIe
III.1. La Plante d'étude
Le genre botanique Centaurea (les centaurées,
à ne pas confondre avec les espèces du genre Centaurium,
de la famille des Gentianacées) regroupe de nombreuses plantes de la
famille des Astéracées (ou Composées),en effet , ce genre
comprend 500-600espèces (Mishio et al.,2006).
Notre plante d'étude est connu sous le nom de
Centaurea microcarpa Coss. et Dur. (fig.05). III.1.1.
Classification
Régne : Plantae.
Division : Magnoliophyta
Classe : Magnoliopsida
Ordre : Asterales
Famille : Asteraceae
Genre : Centaurea
Espece : Centaurea microcarpa Coss. et
Dur.

Figure 05: Centaurea microcarpa Coss.
et Dur.
III.1.2. Déscrioption botanique :
Les centaurées sont des plantes herbacées
annuelles, bisannuelles ou vivaces, à feuilles alternes. Comme pour
toutes les composées, les fleurs, ou fleurons, sont disposées en
capitule multiflores homomorphes ou dimorphes, entourées d'un involucre
ovoïde ou globuleux à bractées imbriquées sur
plusieurs rangs . Dans le cas des centaurées, les fleurs sont toutes
tubulées, multiflores homomorphes ou dimorphes, celles de la
périphérie (souvent stériles) s'ouvrant largement en cinq
lobes. Leur couleur varie le plus souvent entre le rose, le pourpre et le
violet, mais il existe aussi quelques espèces à fleurs jaunes.
Ces fleurs entourées d'un involucre ovoïde ou globuleux à
bractées imbriquées et inégales sur plusieurs rangs,
à la manière des artichaut .Ces bractées peuvent
être ciliées (cas le plus fréquent) ou épineuses.
Leur observation est essentielle pour déterminer les espèces. Le
réceptacle plan ou sub plan est garni de soies abondantes, Les fruits
sont des akènes longues ou ovoïdes, lisses, à hile
latéral, profond, barbu ou non, portant une aigrette assez courte,
simple ou double , persistante ou caduque (Quezel et Santa, 1963).
Centaurea microcarpa Coss. et Dur. Présente des
bractées de l'involucre à épines médiane
très forte et valnérante (1,5-2,5cm de long ),akénes
chauves
III.1.3. Aire de répartition :
Le genre Centaurea présente une large
distribution géographique. Ce genre ce rencontre en Europe, en Asie, en
Afrique, en Amérique du Nord (Canada et USA) et en Australie (Mishio et
al.,2006). Quelques exemples sont résumés dans le tableau qui
suit :
Tableau 04 : Aire de répartition de
quelques espèces du genre Centaurea.
Taxon :
|
|
Nom commun :
|
Origine :
|
Référence :
|
Centaurea benedicta L.
|
|
Région méditerranéenne .
|
Van wyk et wink, 2004
|
Centaurea calcitrapa L.
|
|
Afrique du Nord
|
Bellakhder, 1997
|
Centaurea chamaerhaponticum Ball.
|
|
Tafga (ar).
|
Afrique du Nord
|
Bellakhder, 1997
|
Centaurea cyanus L.
|
|
Toute l'Europe .
|
Schauenberg et Paris ,2006
|
Centaurea maroccana Ball.
|
|
Endémiqued'Afri que du Nord
|
Bellakhder, 1997
|
Centaurea montana L.
|
|
Centaurée des
montagnes(fr).
|
Régions montagneuses de l'Europe et
l'Afrique du
Nord
|
Schauenberg et Paris ,2006
|
Centaurea pugens Pomel.
|
|
Neggir (ar).
|
Saharienne
|
Bellakhder, 1997
|
Centaurea ruthencia Lam.
|
|
Europe de l'Est .
|
Mishio et
al.,2006
|
Centaurea solstitialis L.
|
|
|
Régions halophytique,Afri que du Nord
|
Mishio et
al.,2006
|
|
III.1.4. Composition chimique :
Le genre Centaurea est connu pour produire des lactones
sesquitérpeniques du groupe desgermacranolides et des guainolides, du
type de le solstitialine et de la répine ( Bellakhder, 1997).
Les flavonoïdes ont été signalés
dans de nombreuses espèces Centaurea et près de 80
taxons ont été étudiés pour leur contenu en
flavonoïdes, isolées à partir des feuilles, des parties
aériennes et parfois des racines de nombreuses espèces de
Centaurea, et identifiés comme des flavones, des flavonols,
6-deoxyflavones, et leurs O-et C-glycosides. .(Mishio et al.,2006).
Tableau 05: Composition chimique de quelques
espèces du genre Centaurea.
Taxon :
|
|
Nom commun :
|
Composition chimique :
|
Références :
|
Centaurea acaulis L.
|
|
Nagour (ar).
|
Lactones sesquiterpeniques comme
la costunolide et la zaluzanine germacranolides,
eudesmanolides et guaianolides
|
Bentamène et al., 2005
|
Centaurea calcitrapa L.
|
|
Substance amère, l'acide
calcitrapique, un glucoside ;la
cnicine.
|
Bellakhder, 1997
|
Centaurea cyanus L.
|
|
Principe amère : la cnicine ou
centaurine , les fleurs renferment un glucoside, la
cyanidine.
|
Schauenberg et Paris ,2006
|
Centaurea montana L.
|
|
Centaurée des montagnes
(fr).
|
Substance amère ,centaurine,
quelques traces d'hétérosides, de la
cichoriine, des tanins, des cyanines sensibles à la lumière et
du
potassium.
|
|
|
|
10,5 % de protéines par rapport au poids sec, et deux
lactones sesquitérpeniques.
|
Bellakhder, 1997
|
|
III.1.5.Propriétés thérapeutiques
:
Les propriétés thérapeutiques de quelques
espèces du genre Centaurea sont résumées dans le
tableau qui suit :
Tableau 06: Propriétés
thérapeutiques de quelques espèces du genre
Centaurea.
Taxon :
|
|
Nom commun :
|
Propriétés thérapeutiques
:
|
Références :
|
Centaurea calcitrapa L.
|
|
Contre les palpitations
|
Bellakhder, 1997
|
Centaurea chamaerhaponticum Ball
|
|
Tafga(ar).
|
Traitement des maladies du foie, de l'estomac et de l'intestin
.
|
|
|
Bleuet(fr).
|
Diurétique. Il est utilisé contre les
dyspepsies. Employé en collyre ou compresse pour
soigner les affections des yeux.
|
Schauenberg et Paris ,2006
|
Centaurea montana L.
|
|
Centaurée des montagnes(fr)
|
Le thé de centaurée s'emploie en cas de
dyspepsie ( difficulté de digestion ), et comme diurétique. On en
fait aussi des compresses calmantes pour les yeux .
|
|
|
Combat le refroidissement
|
Bellakhder, 1997
|
|
III.1.6. Parties utilisées :
Différents parties sont utilisées, quelques unes
sont résumées dans le tableau qui suit : Tableau 07:
Les parties de la plante utilisées de quelques espèces
du genre Centaurea.
Taxon :
|
|
Nom commun
|
Parties utilisées :
|
|
Références :
|
|
Centaurea calcitrapa L.
|
|
Sommités fleuris .
|
|
Bellakhder, 1997
|
|
Centaurea chamaerhaponticum Ball
|
|
Tafga
|
Racines ( fraiches
sèches) .
|
ou
|
|
|
Les fleurs,.
|
|
Schauenberg Paris ,2006
|
et
|
Centaurea montana L.
|
|
Centaurée des
montagnes
|
Les fleurs.
|
|
|
|
Sommités fleuris .
|
|
Bellakhder, 1997
|
|
|
III. 2. 5 pJiI4Id'ptude :
III.2.1. Localisation géographique :
Le canton d'El Haourane fait partie de la forêt domaniale
de dréat, qui comprend environ 23
canton dont la superficie totale est égale à 16879
hectare, elle est localisée à environ 15km au Nord de la commune
de Hammam dalaâ (wilaya de M'sila ), entre les coordonnées
suivantes :
Latitude 35°36'-I I ° 9' IL R[1 X (651,80-657,85) km.
Longitude 4°23'-4°27' Est Y (295,15-299.55) km.
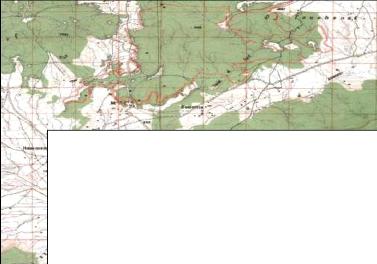
Légende:
|
|
|
: Limite du canton d'El Haourane
|
|
de la superficie totale de ar Doar Dréat, à
l'Ouest le canton de Boustéila.
Figure 06 : Localisation de la zone
d'étude.
(Extrait de la carte topographique feuille de Tarmount,
Echelle: 1/50000)
Partie pratique
Matériels et méthodes

Chapitre IV : Matériels et méthodes.
IV.1.Matériel végétal :
IV.1.1. Origine:
L'étude a été menée sur une
espèce végétal ; Centaurea microcarpa Coss. et
Dur. Une plante choisis selon sa présence dans la région. La
partie aérienne servira comme matière première pour
l'extraction des substances polyphénoliques et des HE.
IV .1.2 Echantillonnage :
Les échantillons sont collectés prés de la
cimenterie de Hammam Dalâa. (figure06). L'échantillonnage est
effectué d'une manière aléatoire et à partir de
plusieurs points du site. IV.1.3.Préparation des
échantillons:
IV.1.3.1.Test d'humidité :
Le taux d'humidité est mesuré en
déposant une masse représentative de la plante, de 2 grammes
(trois fois) dans un incubateur (Memmert) pendant 4 heurs à 104°C
(figure07).Le test est très important car il nous permet de suivre au
mieux l'étape de séchage.

mf - ms
Teneur en eau (%) = .100
mf
mf : Masse fraiche. ms : Masse sèche.
Avant séchage Après séchage
Figure 07: 7Tste d']KXP idité Tde la
partie aérienne de Centaurea microcarpa Coss et Dur.
IV.1.3.2.Séchage de l'échantillon :
Les échantillons étales sont placés dans un
incubateur (Memmert) à 45°C pendant une semaine (168 heurs), pour
subir l'opération de séchage.
IV.1.3.3.Broyage :
Les échantillons séchés sont broyés
dans un broyeur de cuisine (Seb) puis mis dans des bocaux hermétiques et
conservés à sec (température ambiante) à l'abri de
l'humidité.
Le broyage de la plante permet d'augmenter la surface de
contact solvant-échantillon, une meilleure filtration du solvant au sein
du matériel végétal ce qui à pour
conséquence une augmentation de l'extraction (solide-liquide).
IV.2. Extraction des extraits bruts
polyphénoliques :
Plusieurs procédés d'extraction peuvent être
utilisés, du fait de la diversité des métabolites
secondaires, en particulier des polyphénols.
Pour l'extraction des polyphénols on a opté
pour l'utilisation de deux méthodes, dont le principe
général est le mrme, mais différent en ce qui est des
conditions d'extraction. La première est celle utilisée par
Akowuah et al., 2005, et la deuxième est celle utilisée par OWEN
et JOHNS 1999.
Tous les extraits obtenus subissent une filtration et une
évaporation.
IV.2.1. Principe des deux méthodes d'extraction
:
Ces deux méthode d'extraction ne sont qu'une extraction
par macération ,qui est un procédé d'extraction
solide-liquide discontinu qui consiste à laisser tremper le solide dans
un solvant à température ambiante ,durant elle ou on a fait
l'ébullition ,pour en extraire les constituants solubles .
IV.2.2. 0 pINI13e11133exNIDRIQ111335 WXD111e111Da11TEM
:
Dix grammes (10g) de chaque échantillon sont
pesés puis trompé respectivement et séparément dans
100ml de Chloroforme (Prolabo), Méthanol pure (Biochem),
Acétone70%, (Chemopharma), Méthanol 50% (Biochem) et Eau.
La verrerie utilisée (Béchers, pipettes,
entonnoirs et fioles), est préalablement lavée et
séchée.
Les fioles (d'une capacité de 250ml) contenant les
solutions d'échantillons sont incubées dans un bain marie
(Memmert) à une température de 40°C pendant 4h et 8h (figure
08).
10g dans
chaque fiole
10g dans chaque fiole
Plante broyée
(parties aériennes )
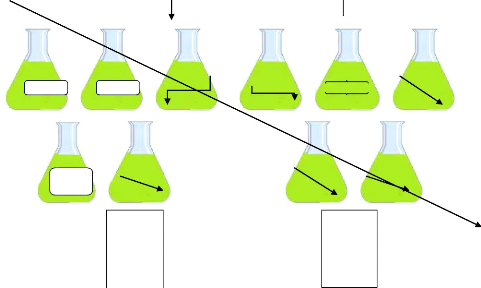
Chlorof
MeOh
50%
MeOh
MeOh
Eaue Eaue
50%
Acétone
70%
Chlorof
MeOh
Acétone
70%
Filtrations

Evaporation sous vide à 55°C
Figure 09 : 31R1RFRCEVIIIIFtIRCdeNSROSKpCROARRC
SIRZEK It Il., TE05
Après filtration sur tissu (Figure10.a), sur papier
Watman (n°=1) (Figure11.b) et sous vide (Fig12), lse filtrats sont soumis
à une évaporation à basse pression à 45°C
(rotavapor R-210 BUCHI), jusqu'à l'obtention d'extraits sec. Le poids
des extraits sec est pesé puis solubilisé par un volume connu de
solvant.
a. La filtration :
La filtration permet de clarifier les solutions
d'échantillons et d'éliminer les particules solides issues des
déchets de la plante. (Figure09)
- Une première filtration se fait à travers un
tissu de fina placé dans un bécher ; la pate ainsi
obtenue est pressé à la main pour chasser le
maximum de solvants et de solides solubles. - Une deuxième filtration
est assurée par le papier Watman porosité 1.
- Une dernière filtration, sous vide est suivie à
l'aide d'un filtre en verre fritté (porosité 4) pour
éliminer les imputées solubles.

a. Filtration à travers tissus
b. Filtration sur papier Watman.

c. Filtration sous-vide. Figure09:
Filtration des extraits.

Chapitre IV : Matériels et méthodes.
b.Evaporation :
Les filtrats obtenus subissent une évaporation sous
vide dans un rotavapor (rotavapor R-210 BUCHI) jusqu'à l'obtention
d'extraits sec de PP (figure10).Ces extraits brutes de polyphenols (EBP) sont
alors récupérés et pesés.
Poids de l'extrait sec après évaporation
Extraits brut de polyphénols (EBP) en % = X 100
Poids de l'échantillon

Figure 10: Evaporation des extraits par
rotavapor (R-210 BUCHI).

Chapitre IV : Matériels et méthodes.
IV.2.3. Méthode d'extraction d'OWEN et JOHENS
:
L'extraction a été réalisée avec
du Méthanol pur (99% Biochem). D'après le protocole suivie 200 mg
de poudre des parties aériennes de Centaurea microcarpa Coss et
Dur. Sont dissous dans un volume de 500 ml de Méthanol, le
mélange est conservé à température ambiante sous
agitation pendant une semaine de temps IIIIDCHE)lSRurldRnneill'eiIDiIlP
pINDnRlirN lIIILI E8).Après filtration par le papier Watman (n°=1),
le filtrat est soumis à une évaporation à basse pression
à 45°C (rotavapor R-210 BUCHI),
avru'àll'RniviRnld'pnleItrDplseF lLe lSRIdsldI ll'extrait sec est
pesé puis solubilisé par un volume connu de Méthanol
(figure12).

Figure 11: Extrait méthanolique
La quantification de l'extrait est calculée comme suit
:
(P1 #177; P2)

Le taux de la matière extraite (%)= x 100X X 100.
E
P1: poids du ballon vide (g)
P2:poids du ballon après évaporation (g). E: poids
de l'extrait sec (g).

Broyage

500ml de Méthanol pure Agitation (168h à
température ambiante)
éthanoli
Extrait
Filtration Evaporation à 55°C

Extrait sec



Figure : Protocol d'extraction des
composés phénoliques de la partie
aérienne de
Centaurea microcarpa Coss et Dur.
IV.3.Extraction des flavonoïdes:
· Principe:
Tous les flavonoïdes n'ont pas la même
propriété de solubilité car certains flavonoïdes sont
solubles dans l'eau et l'alcool alors que d'autres ont des
propriétés hydrosolubles extrêmement faible (Bruneton,
1999) de ce fait le principe utilisé pour l'extraction des
flavonoïdes est basé sur le degré de solubilité des
flavonoïdes dans les solvants organiques.
· Mode opératoire :
Environ 20g de matière sèche finement
broyée de Centaurea microcarpa Coss. et Dur. est
mélangée avec 200 ml de Méthanol (85%). Le mélange
est filtré sur un tissu 24 heurs plus tard. Après deux
extractions successives avec le Méthanol, 85%, trois fois et du
Méthanol, 50%, deux fois, les filtrats sont combinés,
filtrés sur du papier filtre puis soumis à une
évaporation à basse pression à 35°C
(Rotavopor, Buchi 461) la phase aqueuse ainsi obtenue est conservée
pendant 48 heurs à 4°C puis filtrée. Le filtrat est
débarrassé des cires, des lipides et de la chlorophylle par trois
lavages successifs avec du n-hexane (v/v) pour donner une phase aqueuse.
Afin de séparer les flavonoïdes en fraction
aglycone et
glycosilées.la phase aqueuse
est mélangée à volume égale avec du chloroforme
pour obtenir une phase organique contenant les flavonoïdes aglycones et
les aglycones méthoxylés .la phase aqueuse restante subit une
série d'extraction avec l'acétate d'éthyle (10fois) afin
de récupérer dans la phase organique certains flavonoïdes
aglycones ,mais sur tout les mono et les diglycosidiques .La phase aqueuse
restante contient les flavonoïdes glycosylés plus polaires comme
les di,tri et tetraglycosidiques .les extraits obtenus sont
dénommés selon le solvant qui a permis leur séparation :
extrait chloroformique et extrait d'acétate d'éthyle et extrait
aqueux. Les trois fractions récupérées sont soumises
à une concentration à basse pression à 35°C puis
pesé pour déterminer les rendements d'extraction exprimés
par rapport à100g de matière sèche (figure13).
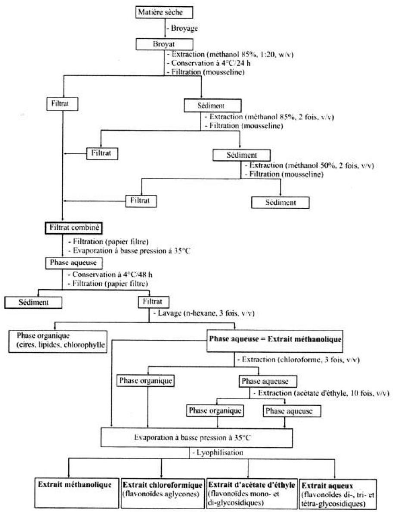
Figure : Protocole d'extraction des flavonoides :
IV.4.Extraction des huiles essentielles par
hydrodistilation :
· Principe:
La plante est mise en contact avec l'eau dans un ballon lors
d'une extraction au laboratoire ou dans un alambic industriel. Le tout est
ensuite porté à ébullition. Les vapeurs sont
condensées dans un réfrigérant et les HE se
séparent de l'eau par différence de densité. (Benayad N,
2008) (figure14).
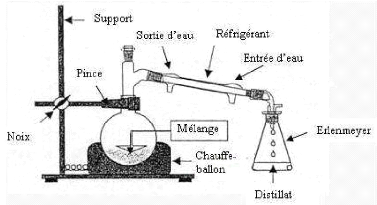
Figure 14: Schéma de principe d'une
extraction par hydrodistilation.
· Protocole expérimental
d'extraction:
La matière végétale, constituée des
parties aériennes (50g) est introduite dans un ballon en verre ,
à trois cols, de 1L, remplie au 2/3 d'eau distillée (700 ml).
Une fois placé, le dispositif d'hydrodistilation est
mis en marche. La température dans le ballon contenant l'eau et la
plante est réglé tout au long de l'extraction à 100
°C au moyen d'yn thermomètre placé dans l'autre col du
ballon.
L'ensemble est porté à ébullition et la
vapeur chargé d'eau et d'huilese condensent dans un
réfrigérant inclinée.Le distillat, s'écoule goutte
à goutte et est recueilli dans une ampoule à décanter
située à l'extrémité.
L'HE est séparée de l'eau distillée par
décantation après relargage au NaCl (Prolabo) et traitement par
l'acétate d'éthyle (Prolabo) afin d'extraire l'huile
solubilisée le surplus d'eau est éliminé par ajout du
sulfate de sodium anhydre (Na2 SO4) (Prolabo) puis filtrer sur un papier
plissé. L'ensemble HE et le solvant est conservée dans des
flacons, dans un endroit frais et obscure à l'abri de la lumière,
pour permettre l'évaporation du solvant (figure15).

Chapitre IV : Matériels et méthodes.
.
Figure 15 : Extraction des HE par
hydrodistilation.
/ I- rI-TI-P I-WI- ITF ( II-AMEDINI TRP P I- MIA : MHE
R%= X 100.
Ou : MS
Ms : Masse de la matière végétal
sèche. MHE : Masse en HE.
IV.5. Tests phytochimiques :
Le bute de ces tests est de connaître la composition
des principales classes de métabolites secondaires qui entrent dans la
composition de Centaurea microcarpa Coss. et Dur., les tests sont
effectués sur un infusé.
IV.5.1. Préparation de l'infuser:
Environ 10 grammes (10g) de poudre sont mit à infuser
dans 100ml d'eau bouillon pendant 15 min. le filtrat est ajusté à
100 ml avec l'eau distillée.
IV.5.1.1. Mise en évidence des
polyphénols:
Quelques goutes d'HCL, sont ajoutées à 5ml
d'infuser, la réaction donne une coloration rouge en présence de
polyphénols.
IV.5.1.2.Mise en évidence des tanins:
Quelques goutes d'une solution de FeCl3 à 5% sont
ajoutées à 5 ml d'infuser la réaction donne une coloration
bleue noir en présence des tanins.
IV.5.1.3. Mise en évidence des
anthocyanes:
Quelques goutes d'ammoniaque (1/2) sont ajoutées à
5 ml d'infuser la réaction donne une coloration bleu en présence
d'anthocyanes (Mamyrbékova-Békro et al., 2008).
IV.5.1.4. Mise en évidence des coumarines
:
Mettre environ 1g d'un échantillon de la plante humide
dans un tube à essai, couvrir. le tube avec du papier filtre
imbibé avec une solution de NaOH diluée, papier filtre est
examiné sous lampe UV (254nm) .une coloration de jaune fluorescent
indique la présence des coumarines (Dohou et al ,2003).
IV.5.1.5. Mise en évidence des saponosides :
Leur présence est déterminée
quantitativement par le calcul de l'indice de mousse. Ajouter 2ml d'eau
distillée jà 5ml d'infuser, bien agiter le tout pendant
2min. Après un repos de 15 min en position verticale,
on relève la hauteur de la mousse persistante en cm. (Dohou et al.,
2003).
IV.6.Séparation des extraits méthanoliques
brutes par Chromatographie sur couche mince(CCM):
V.6.1. Principe de la méthode:
La séparation et la purification des différents
composés phénoliques sont fondées sur des techniques
chromatographiques sur polyamide, Cellulose, gel de Sephadex, etc.....
Pour ce qui est de notre analyse, on se sert de la
chromatographie sur couche mince (CCM) pour identifier les substances en
fonction de leur façon de migrer dans les conditions données .La
migration est en fonction de la polarité des substances, de la
polarité de l'éluant et du pouvoir d'adsorption de la phase
stationnaire. La méthode CCM est efficace et rapide et associe la
sensibilité à la simplicité (Kolai et al, 2006)
(figure16).
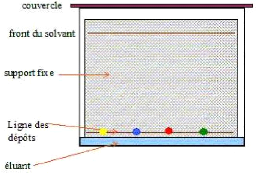
Figure 16 : Principe d'une séparation
CCM
IV.6.2. Mode opératoire :
Les deux extraits méthanoliques obtenus des deux
méthodes ont fait l'objet de la séparation par CCM
suivant les étapes décrites ci-dessous :
IV.6.2.1. Préparation de la plaque :
Les plaques de gel de silice (60 F 254, Merck), sont
découpées selon les dimensions suivantes ; 5, 5et6cm de largeur
pour 8, 10 et 12cm de hauteur.
On tracer au crayon gris, délicatement, une ligne,
appelée ligne de dépôt, à environ un
centimètre du bord inférieur de la plaque à
chromatographie. On repère la position des dépôts à
effectuer sur la ligne tracée précédemment par des lettres
qui désignent les extraits, exemples (Ex1, Ex2,...., etc.) en veillant
à les espacer régulièrement
IV.6.2.2. Préparation de la cuve :
On introduit l'éluant (système solvant) dans la
cuve à chromatographie, d'une largeur de 12 cm et de 14 cm de longueur,
de manière à ce que son niveau atteigne une hauteur d'environ un
demicentimètre. On couvre la cuve avec un couvercle
hermétique.
IV.6.2.3. Dépôt :
On dépose, à l'aide d'une micropipette sur la
ligne de dépôt une goutte de chaque extrait
à analyser ainsi que celles de référence
(quercétine et acide gallique). Les dépôts sont espacer
régulièrement afin d'éviter leur chevauchement lors de la
migration. On peut concentrer les dépôts si nécessaire en
répétant plusieurs fois les dépôts.
IV.6.2.4. Elution :
Plusieurs systèmes solvants, tirées à
partir de la bibliographie, ont été utilisées pour mieux
séparer les différents composées polyphénoliques
éventuellement présents dans l'extrait méthanolique
(Tableau 09).
L'éluant (système solvant) remonte par
capillarité le long de la plaque. Lorsqu'il arrive à environ 1 cm
du bord supérieur (front du solvant), on fait sortir la plaque de la
cuve et on la sèche.
Après ces étapes, on procède à la
révélation des chromatogrammes sous chambre UV (Camag) à
254nm et à 366nm
Tableau 09: Les différents
systèmes solvants utilisées pour la CCM.
Systémes Solvants Rapport (v/v)
Chloroform. 10
01 Methanol 2
Dichloromethane. 5
02 Methanol 1
Acétate d'éthyle. 8
03 Acide acétique. 1
Eau. 1
Acétate d'éthyle. 8
04 Acide formique. 1
Eau. 1
Acétate d'éthyle. 2
05 Ether diethylique. 8
Dichlorométhane. 9
06 Acétate d'ethyle. 1
Acétate d'éthyle. 7
07 Methanol. 1,5
Eau. 1,5
Acétate 9
08 n- butanol 1
IV.7. Spectrophotométrie UV-visible :
IV.7.1. Principe :
La spectrophotométrie est une méthode
analytique qui consiste à mesurer l'absorbance ou la densité
optique d'une substance chimique donnée en solution, par un
spectrophotomètre préalablement étalonné sur la
longueur d'onde d'absorption de l'espèce chimique à
étudier.
Lorsque le soluté absorbe la lumière visible
(longueurs d'onde comprises entre 400 et 800 nm) on parle de
spectrophotométrie visible. Si les solutions absorbent dans
l'ultraviolet (longueurs d'onde inférieures à 380 nm), on parle
alors de spectrophotométrie UV.
IV.7.2. Mode opératoire :
Dans une cuve en Quartz de 1 cm de largueur, on introduit
l'extrait brute méthanolique à analyser, environ 1ml,
après quelques minutes l'absorbance est lue au spectrophotométre
UV-visible (Shiladzu UV-2401 PC).
Avant cette procédure on étalonne d'abord
l'appareil par le témoin, qui est dans notre cas le méthanol pure
(Biochem).
Résultats et
interprétations
V. Résultats et interprétations :
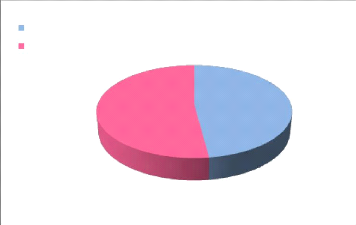
V.1. THAIG'HXP IGIAé eA sécHOTe
:
Les résultats du test d'humidité (tableau 10)
montrent que les parties aériennes de Centaurea microcarpa Coss
et Dur. possèdent un taux moyen d'humidité de 47,91334 %
confirmant sa richesse relative en eau, en effet, le poids de l'eau
représente presque la moitié de la masse de la plante (figure17).
Ce paramètre à une grande importance pour l'extraction des PP,
car sa présence (présence d'eau) est un élément
grnant du rendement de l'extraction.
Le test d'humidité (2 g de poudre de plante a 104
°C pendant 4 heurs) a été réalisé trois fois
pour calculer avec précision le taux d'humidité de la plante. Les
variations obtenues entres les trois valeurs ne sont pas vraiment
significatives.
Tableau 10: Teneur en eau de Centaurea
microcarpa Coss et Dur.
Poids de l'échantillon avant le séchage Mf (g)
|
02
|
02
|
02
|
Poids de l'échantillon après le séchage Mf
(g)
|
1,0593
|
1,0682
|
0,9977
|
Poids de l'échantillon en % après le
séchage
|
52,966
|
53,41
|
49,885
|
Poids de l'eau évaporée en g après
séchage
|
0,9407
|
0,9318
|
1,0023
|
Poids de l'eau évaporée (%d'humidité)
|
47,034
|
46,59
|
50,115
|
|
eau
matiére organique
52%
48%
Figure 17: Pourcentage en eau de la partie
aérienne de Centaurea microcarpa Coss et Dur.
V.2. Extractions :
V.2.1. Méthode d'extraction de Akowuah et al.,
2005 :
Les résultats, en extraits brutes polyphénoliques
(EBP) exprimés en pourcentage de la matière sèche, sont
résumé dans le tableau 11.
Tableau 11: Ensemble des résultats de
l'extraction des EBP :
Solvants :
|
Rendements d'extractions (% ms)
|
|
8h :
|
Chloroforme
|
3,411
|
3,696
|
Methanol pure
|
8,04
|
9,804
|
Acétone 70%
|
9,751
|
11,65
|
Methanol 50%
|
11,776
|
14,33
|
Eau
|
15,804
|
18,744
|
|
V.2.1.1.Influence du temps d'extraction :
Il apparait clair, après une simple lecture du
tableau, que les meilleurs rendements ont été obtenus pour
l'ensemble des échantillons incubés pour une durée de 8h
et ceci quelque soit la nature du solvant utilisé.
Les rendements obtenus pour les échantillons
incubés pendant 4h varient de 3,411% à 15,804%, alors que ceux
ayant subi une extraction qui a durée 8h, ils varient de 3,696 %
à 18,744% (figure18) V.2.1.2.Influence du type de solvant
:
Les PP sont une famille de composé très vaste,
regroupant de substances de solubilité très
hétérogène. En se référant à la
méthode d'Akowauh et al., 2005, on a utilisé dans notre
expérimentation cinq solvants de polarité décroissante:
l'Eau, le Méthanol 50%, l'Acétone 70%, le Méthanol pure et
le Chloroforme.
Il ressort de l'étude du tableau10 que les meilleurs
rendements sont obtenus respectivement pour les trois solvants; Eau (18,744%),
Méthanol 50% (14,33) et l'Acétone 70% (11,65%).
Les plus faibles rendements sont observés pour le
méthanol pur (9,804 %) et le chloroforme (3,696%).
Ces résultats (figure18) peuvent êtres
expliquées par la solubilité différentielle des
différents composées phénoliques ou les PP polaires sont
solubles dans les solvants polaires et les PP apolaires sont solubles dans les
solvants apolaires.
La lecture des rendements d'extraction permet de constater que
les plus grands rendements ont été obtenus avec les solvants
polaires (Eau, Méthanol 50% et l'Acétone 70%).
De ces résultats, on peu en conclure que notre plante
d'étude Centaurea microcarpa Coss et Dur. contient beaucoup
plus de PP polaires qu'apolaires, ceci peut ~tre confirmé par des
dosages dosages ultérieurs.
20
18
16
14
12
10
8
4
0
6
2
3,411
chloroforme methanol pure acétone 70% methanol 50% eau
3,696
8,04
9,804
9,751
4h 8h
11,65
11,776
14,33
15,804
18,744
Figure18 : Rendements d'extraction en fonction
du type de solvant et du temps d'extraction des
parties aériennes de Centaurea microcarpa Coss
et Dur.
V.2.2. Méthode d'extraction d'Owen et Johns
(1999) :
Le tableau12 donne le rendement EPB, exprimé en
pourcentage de la matière sèche (%ms), obtenu avec la
méthode d'Owen et Johns (1999).
Tableau 12 : Rendement de l'extrait
méthanolique.
Partie de la plante Solvant Temps d'extraction
Température Rendement (% ms)
(h)
Partie aérienne Méthanol pur 168 Ambiante 21
L'extraction solide-liquide utilisée et l'état
physique de la plante, réduite en poudre, à permis au solvant,
méthanol pure de franchir la barrière de l'interface
solide-liquide, dissoudre le principe actif a l'intérieur du solide
(matière végétale) et ressortir le soluté
(Matière organique) du solide. La plupart des auteurs
suggèrent que l'entrée du solvant se fait par un mécanisme
osmotique et la sortie du soluté par dialyse ou par diffusion.
Le solvant utilisé, le méthanol pur (99%),
donne généralement de meilleurs rendements d'extraction et de ce
fait il est très utilisées par rapport aux solvants, et le plus
efficace (CastanedaOvando et al., 2009).
On peut dire que les résultats des deux
méthodes montrent que le rendement de l'extraction de la deuxième
méthode, celle d'Owens et Johns (1999), avec le méthanol pure
(21%) est plus élevé que celui obtenus avec la première
méthode, celle d'Akowuah et al., 2005, utilisant plusieurs solvants
(cinq solvants de polarités différentes), pour une durée
d'extraction de 8h, ou le plus grand rendement n'a pas dépassé
les 18,744%.
Ceci peut être expliqué par :
· Nature du solvant d'extraction : méthanol pur.
· Temps d'extraction : 1 semaine (168 heures).
· Le rapport masse/solvant : 200 mg / 500 ml de solvant.
· Condition d'extraction : agitation continue qui permet
une meilleure infiltration du solvant.
En terme général, l'extraction des
composés phénoliques à partir de la matière
végétale dépend de leur structure chimique, du type de
solvant utilisé, de la méthode d'extraction de la
granulométrie et du temps de macération. Les extraits
phénoliques des plantes sont généralement des
mélanges des différentes classes de composés
phénoliques qui sont solubles dans le solvant utilisé. La
solubilité de ces derniers dépend du type de solvant
utilisé (polarité) et de leur degré de
polymérisation.
V.3. Extraction des flavonoïdes :
Les méthodes d'extraction des flavonoïdes
dépendent aussi bien du matériel végétal que du
type de flavonoïde à extraire. L'extraction proprement dite est
réalisée par des solvants de polarité croissante. Un
traitement préalable de la plante par un solvant apolaire (hexane ou
éther de pétrole) la débarrasse des graisses, des
stérols et des pigments (chlorophylle et caroténoïdes).un
solvant chloré, le benzène, l'acétate d'éthyle ou
l'éther diéthylique permet de récupérer les
aglycones libres peu moyennement polaires. L'acétone, le
méthanol, l'eau ou leur mélanges permet d'extraire les aglycones
polyhydroxylés et la plupart des glycosides.
Les rendements d'extraction dans toutes les fractions
flavonoidiques à partir de Centaurea microcarpa Coss et Dur.
sont exprimées en pourcentage de matière sèche
(%Ms) dans le tableau 13
Tableau 13: Rendement en flavonoïdes totaux
de Centaurea microcarpa Coss et Dur.
1 ENuU- 43I l'exNrEIN 7 IP S1prENu11143'1pIESRrENiRn
Rendement (%)
Extrait choloroformique 45° C 6,5925
Extrait d'acétate d'éthyle 45° C 7,0475
Extrait aqueux 45° C 14,536
Les résultats de l'extraction (figure19), selon la
méthode de Makbary et Makhram (1982), montrent que Centaurea
microcarpa Coss et Dur. contient différentes fractions de
flavonoïdes. Les rendements obtenus varient entre et 14,536%
dont le meilleur est celui de l'extrait aqueux avec 14,536%,
puis de l'extrait d'acétae d'éthyle avec 7,0475%, quant au plus
faible est celui obtenu par l'extrait chloroformique avec un pourcentage de
(6,5925%).
On remarque que les flavonoïdes extraits de l'espèce
Centaurea microcarpa Coss et Dur.
sont beaucoup plus polaires qu'apolaires, ce qui explique le
rendement élevées de l'extrait aqueux (14,536%) par rapport aux
deux autres extraits, choloroformique et d'acétate d'éthyle,
alors que les flavonoïdes apolaires sont mois présents, deux fois
moins abondants que les flavonoïdes polaires, du fait du faible
pourcentage obtenus avec l'extrait choloroformique.
L'ajout du chloroforme provoque la séparation des
flavonoïdes en fractions glycosylées et aglycones, on constate que
les flavonoïdes glycolysés sont plus abondants que les
flavonoïdes aglycones car l'extraits cholorformique, dont le quels ils
sont solubles, possède le plus faible rendement.
Rendement en flavonoides
16
|
14 12 10 8 6 4 2 0
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Rendemant
|
|
|
|
|
|
|
|
|
|
|
Extrait chloroformiqueExtrait d'acétate
d'éthyleExtrait aqueux
Figure 19: Rendement en flavonoïdes totaux
chez Centaurea microcarpa Coss et Dur.
D'autre part, l'ajout de l'acétate d'éthyle,
pour extraire les flavonoïdes mono et di -glycolysés, donne un
rendement de (7,047%) inférieur à celui de l'extrait aqueux
(14,536%) contient le reste des flavonoïdes, à savoir les di, tri
et tétra glycosylés. Ce dernier montre la richesse de
Centaurea microcarpa Coss et Dur. en flavonoïdes di, tri et
tétra glycosylées par rapport au flavonoïdes mono et di
glycosylés, ceci peut être expliqué par la grande
solubilité des hétérosides, augmentant ainsi la
polarité dans l'eau ce qui permet d'entrainer les flavonoïdes qui
sont entrainés dans la phase aqueuse d'où leur présence
dans l'extrait aqueux (figure20).
En outre, on observe la présence des flavonoïdes
di glycosylées dans les deux extraits aqueux et l'acétate
d'éthyle , du peu itre aux différences de masse molaires entre la
partie hétérosidique et le reste du flavonoïdes (partie
aglycone) ; si la partie hétérosidique du flavonoïde
diglycosylées domine (son poids moléculaire est plus
élevé par rapport a la partie aglycone) ce dernier sera plus
soluble dans l'eau ,en l'occurrence, retrouvé dans l'extrait aqueux ,
alors que si la partie aglycone prédomine sur
l'hétéroside, donnant ainsi une solubilité moins
marqué au flavonoïde di glycosylée, ce dernier se retrouvera
dans l'extrait d'acétate d'éthyle. On peu dire que la
solubilité des flavonoïdes dépend aussi de la la fraction
hétérosidique.
D'une manière générale, le protocole
d'extraction des flavonoïdes de Centaurea microcarpa Coss et Dur.
suivi montre que cette espèce est riche en flavonoïdes, dont ceux
glycosylées (polaires) sont plus abondants que ceux non
glycosylées (apolaires), possédant des degrés de
solubilités très hétérogènes
résultant de leurs différences de structure. En effet, les
travaux de Mishiso et son équipe (2006), sur 80 espèces
Centaurea démontre que ce genre botanique renferme des
flavonoïdes, flavones et flavonols en grande majorités, et leurs
dérivées glycosidiques.
25%
22%
53%
flavonoides di,tri et tetra glycosylées flavonoides mono
et di glycosylées flavonoides aglycones
Figure 20: Répartition des
différentes fractions flavonoides de Centaurea microcarpa Coss
et Dur.
V.4. Extraction des HE :
Le rendement en HE est défini comme étant le
rapport de la masse en HE sur la masse de la matière sèche
végétale (partie aérienne), exprimé en % (P /P).
Les résultats de l'extraction par hydrodistilation,
montrent que la plante d'étude posséde un pourcentage en HE,
estimé à 1,213%(figure21).
La teneur en HE chez la nigelle (Nigella sativa L.)
est de 0,03-0,04%, et celle de l'origan (Origannum glandulosum Desf.)
atteint les 2,62% (Bousbia, 2004). On remaque que la teneur en HE de notre
espèce se situe entre les deux pourcentages (1,213%) et prend une valeur
moyenne.
En se référent aux études
précédentes et en comparent le rendement obtenu chez
Centaurea microcarpa Coss et Dur. avec d'autre espèces, on peu
dire que cette espèce présente une teneur en HE moyenne.
1,213%
98,787%
matiére végétale séche HE
Figure21: Pourcentage en HE de Centaurea
microcarpa Coss et Dur.
V.5. Caractérisation des extraits bruts
polyphénoliques :
V.5.1. Recherche de quelques substances actives
:
Les résultats des tests phytochimiques sont
regroupés dans le tableau 14.
Les extraits de la partie aérienne de Centaurea
microcarpa Coss et Dur. contient des PP, la phase aqueuse
ayant viré au rouge après ajout du HCl.
L'anneau bleu ou bande bleu formé après ajout
d'ammoniaque à l'infus, indique la présence d'anthocyanes.
D'après la coloration noire obtenue avec FeCl3, la partie
aérienne de Centaurea microcarpa et Dur. contient des tanins
galliques et catéchiques.
La formation de mousse après agitation de l'infus et
l'eau distillé, et sa persistance après 15min de repos est due
à la présence de saponosides dans la plante mais à un
faible degré du car la hauteur de la mousse obtenus n'a pas
dépassé les 0,3cm.
Après exposition aux vapeurs de NH3 et visualisation sous
UV, les fluorescences jaunâtres observées, indique l'existence de
coumarines.
Tableau 14: Résultats des tests
phytochimiques.
|
Composée
|
PP
|
Anthocyanes
|
Tanins
|
Saponoside
|
Coumarine
|
|
Réactifs
|
HCl
|
NH4
|
Fe2Cl3
|
Eau distillé
|
NaOH
|
|
Présence
|
+
|
+
|
+
|
+
|
+
|
|
Coloration
|
Rouge
|
Bande bleu
|
Bleu nuit
|
0,3 cm
|
Jaune fluo
|
|
Photo :
|
Témoin Extrait
|
|
Témoin
|
|
Extrait
|
|
|
Témoin
Extrait
|
Témoin Extrait
|
|
|
V.6. Chromatographie sur couche mince (CCM) :
La chromatographie sur couche mince de silice qui est à
la fois une méthode de séparation et d'identification de
divers constituants d'un mélange. Pour ce qui est de notre analyse,
on se sert de la CCM pour mettre en évidence les différentes
familles de PP, en fonction de leur façon de migrer dans les conditions
données. On à utilisées huit systèmes solvants de
polarités différentes, en présence de deux substances
standards ; la quercitine et l'acide gallique.
Les plaques CCM observées, après élution par
les différents systèmes solvants, montrent des taches de nombres,
de couleurs et de distances de migrations différents (figure15).

Chapitre V : Résultats et interprétations.
Tableau : Résultats de la CCM :



En se basant sur la comparaison des RF des standards et des
taches de l'extrait méthanolique, la présence de GAE et de QER en
même temps est confirmée dans les systèmes: SII, SIV, SVI,
SVII et SVIII, dont les RF sont respectivement: 0,479, 0,875, 0,051,
0,82 et 0,76 pour GAE et sont 0,683, 0,927, 0,091, 0,87 et 0,853 pour QER.
En revanche, la présence de la quercétine seule
est observée dans les systèmes SI, SIII et SV dont les
RF sont respectivement: 0,466, 0,906 et 0,091. Ces trois systèmes n'ont
pas permis l'élution de GAE cela est du à sa faible
solubilité dans les solvants apolaires a cause de sa structure complexe
et son poids moléculaire élevé (tableau 16).
Tableau 16: Propriétés
physicochimiques des étalons utilisées en CCM.
|
Composés
|
Structure
|
Masse molaire(gmol-1 )
|
Famille
|
|
|
Quercétine
|
|
170,1195
|
flavonoïde
|
|
L'acide gallique
|
|
302,2357
|
Tanin
|
Les polyphénols sont une famille de composés
très hétérogène 9000 composés,
classés en 12 classes, dont la classe majeure est celle des
flavonoïdes. Les tableaux 17 et 18 donnent les caractéristiques des
composés phénoliques et des flavonoïdes observés sous
UV après séparation par CCM.
Tableau 17: composés phénoliques
identifiés par CCM (Markham, 1982).
Couleurs sous UV Composés probables
Rouge Anthocyanidine 3 glucoside
Rose Anthocyanidine 3,5 di glucoside
Orange Anthocyanidine 3 glucoside
Orange pale Anthocyanidine 3glucoside
Jaune Flavonols
Jaune pale Flavonols
Vert Rutine
Bleu sombre Flavonols, flavonones, aurones
Bleu vif Hydroquinones
Bleu pale Acide phénol
Bleu blanc fluo Acide phénol
Mauve Flavonols, flavonones, isoflavonones, flavones
Flavones
Violet Flavonols, flavonones, isoflavonones, flavone
Pourpre sombre chalcones.
Tableau 18: Révélation des
flavonoïdes après séparation CCM (Markham, 1982).
UV 366 nm AlCl3/UV 366 nm Type de phénols ou
flavonoïdes
|
Couleur Couleur
|
possibles.
|
|
Rouge
Jaune
Jaune pale
Bleu blanc fluo
Bleu blanc
fluo
Pourpre sombre
|
Orange Orange Jaune pale orange Bleu clair
jaune
|
Anthocyanidine 3 glucoside
Flavonols
Falvonols
Acide
phénolique
Flavonols, flavonones, flavones
Isoflavonones.
|
Flavonols, isoflavonones, flavones,
chalcones.
Après observation des plaques dans une chambre noire d'une
CCM à haute performance (HPTLC, Camag) et en s'appuyant sur les
données de la bibliographie quant à la séparation des
composés phénoliques par CCM et leur observation sous UV (tableau
17 et 18) on peut éventuellement prédire les composés ou
les familles de composés les plus probables qui peuvent entrer dans la
composition de l'extrait méthanolique de Centaurea microcarpa
Cross et Dur., l'ensemble des observations et des résultats sont
regroupés dans le tableau 19.
Tableau 19: Composés phénoliques
probables identifiés par CCM .
UV
Système 254nm spot 366nm Composés
probables
SI 07 taches sombres S1 Marron foncé Pigments
S2 Marron foncé Pigments
S3 Rouge Anthocyanidine 3,5 di glucoside
Q Sombre
|
SII 04 taches sombres S1
S2
S3 Q
AG
|
Claire
Marron claire
Rouge
Orange
Vert bleu fluorescent
|
-
Pigments
Anthocyanidines 3,5 di glucosides
|
SIII 05 taches sombres S1 Bleu fluorescent Flavonols, flavonones,
isoflavonone
Marron sombre flavones
S2 Pigments
S3 Orange foncé
S4 Orange foncé Anthocyanidine3 glucoside
S5 Orange foncé
Q Orange foncé
|
SIV 04 taches sombres S1
S2
S3
S4
S5
S6
S7
Q AG
|
Violet
Vert clair
Marron
Bleu fluorescent
Rouge
Violet
Vert clair
Rouge fluorescent
Violet fluorescent
|
Anthocyanidine3 glucoside Flavonols, flavones, aurones
Pigments
Flavonols, flavonones, isoflavonone flavones
Anthocyanidine3 glucoside Anthocyanidine3 glucoside Flavonols,
flavones, aurones
|
|
SV S1
S2
S3 Q
AG
|
Marron foncé Orange
Clair
Orange clair
Orange clair
|
Pigments
Anthocyanidine 3 glucoside
-
|
|
SVI Une seule tache sombre S1
S2
S3
S4
S5 Q
|
Orange clair Rose
Bleu
Orange
Orange clair Rose fluorescent
|
Anthocyanidine3 glucoside Anthocyanidine 3,5 di glucoside Acide
phénol
Anthocyanidine3 glucoside Anthocyanidine3 glucoside
Anthocyanidine 3,5 di glucoside
|
|
SVII 04 taches sombres S1
S2
S3
S4
S5
|
Vert jaunâtre Sombre
Vert jaunâtre Rouge
Clair
|
Flavonols, flavones, aurones Pigments
Flavonols, flavones, aurones Anthocyanidine3 glucoside -
|
Q Vert clair
AG Rose clair
|
SVIII 02 taches sombres S1
S2
S3
S4
S5
S6 Q
AG
|
Marron foncé Vert fluorescent Rose orangé Gris
foncé
Clair
Clair
Orange foncé orange
|
Pigment
Flavonols, flavones, aurones
Anthocyanidine3, 5 di glucoside
-
-
-
|
D'après les résultats de ce tableau, le
système qui a donné la meilleure séparation est celui de
l'acétate d'éthyle/acide formique/eau (8/1/1, v/v/v), par ce
qu'il a permis la séparation de 09 taches y compris les étalons,
ce qui explique la solubilité différentielle des composés
phénoliques dans le système IV.
.Observation sous UV à 254 nm:
A 254nm, le système SI a permis de séparer 07
taches sombres de taille moyenne et de forme plus ou moins circulaire, tan
disque le système SIII n'a pu séparer que 05 taches
sombres, par contre les systèmes SII, SIV, SVI et
SVII ont permis la séparation de 04 taches de grandes tailles et
de formes plus ou moins fusitives et les systèmes SII
et SVIII n'ont permis que l'apparition d'une et de deux taches
respectivement.
.Observation sous UV à 366 nm:
A 366nm, le système SI a permis le fractionnement de
l'extrait méthanolique en 03 taches, présentant les couleurs:
marron et rouge pouvant indiquer respectivement la présence des pigments
et des anthocyanidines 3,5 di glucosides.
De même le système SII n'a permis que
la séparation de 03 taches dont les couleurs sont: le marron clair, le
clair et le rouge, correspondant respectivement à des pigments et
à des anthocyanidines 3,5 di glucosides.
Après une simple comparaison entre le premier et le
deuxième système, il apparaît clair et évident que
la tache rouge, qui correspond aux anthocyanidines 3,5 di glucosides, est
commune, et vue la présence du méthanol dans ces deux
systèmes, on constate que le méthanol est le responsable de son
élution.
Le système SIII a permis le fractionnement
de l'extrait méthanolique en 05 taches de couleurs: bleu fluorescent,
marron et orange foncé, pouvant indiquer respectivement la
présence des flavonols et/ou des flavonones et/ou des isoflavonones
et/ou des flavones, des pigments et des anthocyanidine3 glucoside.
Pour ce qui est du système SIV qui a
donné 07 taches de couleurs : vert clair, marron, bleu fluorescent et
rouge, le violet indiquant respectivement des Flavonols et/ou des flavones
et/ou des aurones, des Pigments et des anthocyanidines 3 glucosides.Ce dernier
système présente 02 taches communes avec le système
précédent (bleu, marron), ce qui explique que l'acétate
d'éthyle, présent dans les 02 systèmes
SIII et SIV, est responsable de leur
séparation.
Le système SV a permis le fractionnement de l'extrait
méthanolique en 03 taches de couleurs: marron foncé, orange et
clair correspondant respectivement à des pigments et des
anthocyanidines3 glucosides.
Le tableau 14 montre que le système SVI a
permis la séparation de 06 taches dont les couleurs sont : l'orange
clair; le rose, le bleu, l'orange et le rose fluorescent, pouvant indiquer la
présence des anthocyanidines 3 glucosides pour les couleurs orange et
orange clair, les anthocyanidines pour le rose et le rose fluorescent et
l'acide phénol pour le bleu.
La tache orange est commune dans les plaques
éluées par les systèmes solvants SV et SVI, ce qui prouve
que l'acétate d'éthyle est le responsable de sa
séparation, tan disque, la tache marron est spécifique à
l'éther di éthylique et les taches: rose, rose fluorescent, bleue
sont spécifiques au dichlorométhane.
En outre, le système SVII a permis
l'apparition de 05 taches, dont les couleurs sont: le vert jaunâtre, le
sombre, le rouge et le clair pouvant indiquer respectivement la présence
des flavonols et/ou des flavones et/ou des aurones, des pigments et
anthocyanidine3 glucoside.
En fin, le système SVIII a permis la
séparation de 06 taches dont les couleurs sont: le marron foncé,
le vert fluorescent, le rose orangé et le gris foncé,
correspondant respectivement à des pigments, des flavonols et/ou des
flavones et/ou des aurones et des anthocyanidine3, 5 di glucoside.
Aprés l'analyse des résultats obtenus, la CCM
confirme la présence et la richesse de la plante en poly phénols,
en tanins et en flavonoïdes déjà mis en évidence
préalablement par des tests phytochimiques. La bonne séparation
apparaît dans les systèmes polaires prouve que les polypheols, les
tanins et les flavonoïdes existants sont de nature beaucoup plus
polaire.
V.7. Spéctrophotométrie UV-visible
:
L'analyse spectrophopotométrique UV-visible de
l'extrait brut méthanolique (figure22) indique la présence de
quatre pics, de longueurs d'ondes et d'absorbances différentes, avec
trois pics qui absorbent dans l'UV (pics 2,3 et 4) dont le plus
élevé est le pic 4 (ëmax=203nm, Abs=1,0021) ;
enfin, une faible valeur de l'absorbance est observé (0,0035) à
663nm.
L'absorption à des longueurs d'ondes différentes
(de 203nm à 663nm) (figure21) indique la présence de familles de
composées très variées, du point de vue structure
chimique, présence de fonctions ou double liaisons.
Figure 22: Spectre d'absorption de l'extrait
méthanolique obtenu par la méthode d'Owen et Johns, 19
L'analyse du spectre d'absorption de l'extrait brute
méthanolique (tableau20) à permis de constater la
différence de composition de l'extrait et le pouvoir d'absorption de ces
composées, soit dans l'UV soit dans le visible.
Tableau 20: Résultats de l'analyse
spectrale.
|
Les pics :
|
1
|
2
|
3
|
4
|
|
Longueurs d'ondes
|
663,00
|
341,00
|
268,50
|
203,00
|
|
Absorbance :
|
0,0035
|
0,1234
|
0,1997
|
1,0021
|
Une simple lecture du spectre montre que (Silverstein et al.,
1998) :
· Le pic1 (663 nm) correspond à l'absorption des
pigments chlorophylliens (a et b).
· Une absorbance à 341nm montre la présence
de tryptophane et d'acides aromatiques.
· L'absorption à une longueur d'onde de 268,5 nm est
due à la présence d'acides gras insaturées,
d'ethylebenzéne et de certaines huiles.
· Le pic 4 indique la présence de benzène qui
absorbe à 203nm.
Conclusion
Les métabolites secondaires, tel que les
polyphénols, les huiles essentiels et leurs différentes classes,
on attiré l'attention des scientifiques qui focalisent leur
études sur leurs modes d'extractions, leurs propriétés,
leur applications et leur valorisation.
La richesse de la région d'El hourane en plantes
d'intérêt phytothérapeutique nous a permis de choisir une
espèce de cette région Centaurea microcarpa Coss et dur.
comme plante d'étude afin d'en extraire des composés
bioactifs.
Quartes méthodes d'extractions ont été
suivies, deux d'entres elles pour l'extraction des poly phénols, selon
la méthode d'Akowah et al., (2004) et d'Owen et Johens (1999), une pour
l'extraction des flavonoïdes et la dernière pour l'extraction des
huiles essentielles.
Deux paramètres ont été
étudiés pour leur influence sur l'extraction par solubilisation
des poly phénols et des flavonoïdes de la plante:
· Le temps d'extraction: - 4heurs et 8 heurs pour la
méthode d'Akowah et al.,.
- 168 heurs pour celle d'Owen et Johns.
- 24 heurs pour les flavonoïdes.
· Le type de solvant: Eau, méthanol 50%,
acétone 70%, méthanol pur, chloroforme et acétate
d'éthyle.
La méthode d'Owen et Johens (1999) donne le meilleur
rendement d'extraction en polyphénols (21%), exprimé en
pourcentage de matière sèche, par rapport à celle d'Akowah
et al., (2005) ou le meilleur rendement n'a pas dépassé les
18,799% avec le solvant Eau pour une durée de 8heures.
De même l'extraction des flavonoïdes basée
sur la solubilité différentielle de ces composés, dans
plusieurs solvants de polarités différentes afin d'extraire les
différentes fractions flavonoïdiques. Le rendement le plus
élevé est observé pour la fraction aqueuse (14,536%)qui
contient des flavonoïdes di, tri et tetraflavonoides glycolsyés.
En outre l'extraction des HE montre un rendement relativement
élevé soit 1,231% (P/P).
Les tests de mise en évidence de quelques
métabolites secondaires, ont montrés l'existence de
polyphénols, de coumarines, de tanins et de saponosides.
D'autre part, la séparation et l'essai de la
caractérisation des extraits méthanoliques, par CCM, en utilisant
plusieurs systèmes solvants, à permis d'avoir une multitude de
taches ce qui prouve la richesse des extraits en substances actives
essentiellement les polyphénols, ces resultats ont été
confirmés par analyse spéctrale' dans l'UV-visible de
l'extrait.
Ce travail n'est qu'une première étape
d'étude phytochimique de Centaurea microcarpa Coss et Dur. et
ces résultats doivent être appuyés par des études
ultérieures pour:
· Le dosage, des polyphénols, des flavonoïdes
totaux et des HE et estimer leur teneur dans Centaurea microcarpa
Coss. et Dur.
· Une étude qualitative des extraits par
chromatographie liquide à haute performance(M CPG) combinée
à la spectroscopie de masse (HPLC-SM) et RMN, afin d'établir la
composition exacte de l'espèce végétale.
· En fin l'étude des activités biologiques
des extraits et des HE et plus particulièrement leurs activités
antioxydante et antibactériennedes HE.
Bibliographic:
Akowauh G.A, Zhari. I, Norgyati. I, Sadikun.A et Khamsah S.M.,
The effects of different extraction solvents of varying polarities on
polyphenols of Orthosiphon stamineus and evaluation of the free
radical-scavenging activity 2004. Food chemistry 87:
559-566.
Alothman.N, Bhat.R et Karim.A.A, Antioxydant capacity and
phénolic content of selected tropical fruits from Malysia, extracted
with different solvents. Food chemistry.
Bassoma.M.Y, Pegnyemb.D.E, Ngo Mbing.J, Atchad.D.T, Tih.R.G,
Sondengan.B.L, Bloud.a et Bado.B., 2004. Flavonoides isolés des feuilles
de Ochno afzelicet, hemisynthese des Alzelodinés A, B et C à
partir de la dihydrilophirone. African journal of scienses:
5:101-108.
Bellakhder J.1997.Pharmacopée du Maroc.
Bousbia.N., 2004. Extraction et identification de quelques huiles
essentielles (Nigelle, Coriandre, Origan, Thym, Romarin).Etude de leurs
activités antimicrobiennes. Thèse de magistère.
Castanedo- Ovando.A, De Lourdes Pacheco-Hernandez.M et
Paez-Hernandez.E., 2009. Chemicel studies of anthocyanins: Areview.Food
chemistry.113:859-871.
Chan.K.N. et Maznah.i., 2009.Supercritical carbon dioxide fluid
extraction of hibiscus Canna binus L.seed oil: A potential
solvent-free and high antioxydative edible oil. Food chemistry.
6:1291-1296.
Colin-Henriou., 2008. De la pomme transformée: Impact
du procédé sur deux composés d'intérêt
nutritionnel, caractérisation physique et sensorielle des produits
transformés. Thèse de doctorat en science agronomiques
Dohou.W, Yamni.K, Tahrouch.S, Idrissi Hassani.L.M, Bado.A et
Guira.N., 2003. Sceening phytochimiques d'une endemique ibére-macrowave,
Thymelaea lythroides. 142: 61-78.
Hayouni.E.A, Abedrabba.M, Bouix.M et Hamdi.M,. 2007. The
effects of solvants and extraction method on the phénolic contents and
biological activities in vitro of Tuinsian Quercus coccifera L. and
Juniperus phoenicea L. fruit extracts.Food
chemistry.105:1126-1134.
Horbourne.N, Marete.E, Jacquier.J.C et O'Riordan.D. Effect of
drying methods on the phénolic costituents of meadow sweet
(Filipendula ulmaria) and willon (Salix alba).Food chemistry
and technology.
Hong yao, Bin wu, Yiyucheng, Haibin Qu., 2009. High throughput
chemiluninescence platform for evaluating antioxydative activity of total
flavonoid glycosides from plant extracts. Food
chemistry.115:380-386.
Kolai.N, Berkani.A et Lotmani.B., 2006. Analyse chromatographique
(CCM) des flavonoides des feuilles des Citrus en relation avec le taux de
contamination de phyllocnistis citrella Staint (Lepidopetra,
Gracillariidae).Thèse de magistère.
Lawson.A.M., 2006. Etude phytochimique d'une Fabacée
tropicale,Lonchocarpus nicou, evaluation biologique
préliminaire. Thèse de doctorat, spécialité:
science de la vie et de la santé, science pharmaceutique phytochimie,
biologie.
Lazouni.H.A, Ben mansour.A, Chabane Sari.D et Smahi.E., 2006.
Valeur nutritives et toxicité du Foenicululumm niller. Afrique science.
02: 94-101.
Mishio.T, Houma.T et Iwashina.T., 2006.Yellow flavonoids in
Centaurea ruthencia as flower pigments. Biochimical systematics and
Ecology.34:180-184.
Owen P. et Johens T., 1999. Xanthine oxidase inhibitory activity
of northeastern North American plant remedies used for gout. Journal of
Ethnopharmacology. 64: 149-160.
Quezel. P et Santana S. ,1963.Nouvelle flore d'Algérie.
Tome II. Rolland.Y.Antioxydants naturels des végétaux.2004.
Review.11 :1-6.
Sarni-Manchado P et Cheynier.V.2006. Les polyphenols en
agroalimentaire. Edition ;science et technologie.
Sudjona.N, D'Orazcob.C, Ryaux.V., 2009.Antimicrobial activity of
commercial olea europaea (olive) leaf extract.33:461-463.
Tissut.M., 1967.Etude spectrophotometrique et chromatographique
des flavonols du Hetre (Figus syhatica
L.).Phytochemistry.6:1291-1296.
T Van wyk B.N et Wink M., 2004.Medicinal plants of the world.
Bkiza puplications.
Weber.B.,2009.Capacité antioxydante totale, antioxydants
et marqueurs du stress oxydatif. La boratoire de Junglinster, Luxembourg.



