|

UNIVERSITY OF DSCHANG
&&&&&&&&&&&&&&&&&&
UNIVERSITE DE DSCHANG
************
************
FACULTE D'AGRONOMIE ET DES SCIENCES AGRICOLES
FACULTY OF AGRONOMY AND AGRICULTURAL SCIENCES
ANTENNE D'EBOLOWA
************
EBOLOWA BRANCH
************
FILIERE PROFESSIONNELLE DES METIERS DU BOIS, DE L'EAU ET
DE L'ENVIRONNEMENT
Rapport de stage d'insertion professionnelle effectué
à EASY BUY à Douala Du 16 Mars 2020 au 16 Mai 2020.
EVALUATION DES PERFORMANCES D'UN SYSTEME DE TRAITEMENT
D'EAU PAR OSMOSE INVERSE
PAR
NGUEKAP Elie
ELEVE INGENIEUR EN PRODUCTION D'EAU POTABLE ET
ASSAINISSEMENT
CM-UDS-16ASA0028
Sous l'encadrement technique de
M. BELL ARISTIDE BELLA
Ingénieur en hydraulique et M. O.
H.
Ingénieur d'étude des projets hydrauliques à EASY
BUY
Année académique 2019-2020
FICHE DE CERTIFICATION DE L'AUTHENTICITE DU
STAGE
Je soussigné, NGUEKAP Elie,
étudiant à la Filière des Métiers du Bois, de l'Eau
et de l'Environnement, certifie que ce rapport est rédigé
à l'issu du stage de pré -insertion professionnelle
à Easy Buy, du 16 Mars au 16 Mai 2020.
Noms et prénoms de l'étudiant Signature
NGUEKAP Elie
Noms et prénoms de l'encadreur professionnel Signature
M. BELL Aristide BELLA
DEDICACE
A Mes parents M. et Mme KWETCHOUANG
ii | P a g e
iii | P a g e
REMERCIEMENTS
Le présent travail représente le couronnement de
deux mois passé à EASY BUY-Douala. Ce travail tendant à sa
fin, nous ne saurons le clore sans remercier tous ceux qui de près ou de
loin ont participé à sa rédaction. A ces personnes nous
nous devons d'exprimer notre profonde gratitude.
Mes remerciements sont donc adressés aux personnes
ci-après
· M. TCHAGANG T.
Faustin, Directeur Général de EASY BUY pour m'avoir
accepté comme stagiaire au sein de son entreprise, me permettant ainsi
de me frotter au monde professionnel.
· M. BELL Aristide B.,
pour avoir facilité mon accès à EASY BUY, pour
son encadrement et sa disponibilité à nous ses stagiaires
· Tous les enseignants de la Filière des
Métiers du Bois, de l'Eau et l'Environnement de la FASA, qui n'ont
ménagé aucun effort pour mon éducation et ma formation
dès mon entrée dans cette école ;
· Mes parents KWETCHOUANG Yves et TCHENANG
TCHOUNKEU Bernadette pour leur soutien moral, matériel et
financier. Qu'ils trouvent ici ma profonde gratitude ;
· Mon oncle Dr. TCHAWOUO Roger pour son
accueil lors de la durée de mon stage ainsi que son appui tant financier
que moral
· Papa NGANKOU Elie et Maman NGANKOU Christine
pour leur soutien inconditionnel
· Mes oncles et tantes NANKAM Igor, LONGANG
Yolande Flore, KAPTCHOUANG Andrée Marielle, NGANSOP Charles
pour lors soutien inconditionnel au cours de cette année
académique.
· Mon camarade MENTCHONG ZE Anicet pour
son aide dans la compréhension de ce sujet de travail
iv | P a g e
SOMMAIRE
DEDICACE ii
REMERCIEMENTS iii
LISTE DES ABBREVIATIONS ET DES SIGLES vi
LISTE DES TABLEAUX vii
LISTE DES FIGURES viii
RESUME ix
ABSTRACT x
INTRODUCTION 1
1. Contexte et Justification 1
2. Problématique 2
3. Présentation de la structure d'accueil 2
4. Objectif du stage 4
Chapitre I : REVUE DE LA LITTERATURE 4
1. Définitions des concepts 4
2. Composition de l'eau 5
2.1. Espèce inorganique 5
2.2. Matières organiques 6
3. Les paramètres d'évaluation de la
qualité de l'eau 7
3.1. Les paramètres organoleptiques 7
3.2. Les paramètres physico-chimiques 7
3.3. Les paramètres microbiologiques 10
4. Procédés de traitement de l'eau par osmose
inverse 10
4.1. Généralités sur les
procédés membranaires 10
5. Osmose inverse 18
5.1. Principe de l'osmose inverse 18
5.2. Pression Osmotique 19
5.3. Description générale du processus de
traitement de l'eau par osmose
inverse 20
5.4. Membranes et modules d'osmose inverse 20
6. Caractéristiques principales d'une unité
d'osmose inverse 21
6.1. Taux de conversion 21
6.2. Sélectivité 21
v | P a g e
6.3. Débit spécifique (densité du flux
volumique) 23
7. Limitation de l'osmose inverse 23
7.1. Le Colmatage 23
7.2. Polarisation de concentration 25
8. Estimation du potentiel de colmatage 25
Chapitre II : Matériel et Méthodes 27
1. Description de la zone d'étude 27
1.1. Localisation de la zone d'étude 27
1.2. Description du milieu physique et humain 28
2. Collecte des données 29
2.1. Données primaires 29
2.2. Données secondaires 33
2.3. Traitement des données 33
Chapitre III : RESULTATS ET DISCUSSION 34
1. Résultats et interprétations des analyses
physico-chimique 34
1.1. Le potentiel d'hydrogène 37
1.2. L'alcalinité 38
1.3. Le titre hydrométrique 39
1.4. La teneur en chlorure 39
1.5. La teneur en chlore 40
1.6. La teneur en silice 42
1.7. La teneur en fer 43
2. Résultats et interprétations des analyses
bactériologiques 44
3. Interprétation des mesures de performance de l'osmose
inverse 45
3.1. Le taux de conversion 45
3.2. Proportion des rejets et des passages de
sel 45
3.3. Equilibre du bilan massique 46
CONCLUSION ET PERSPECTIVES 47
REFERENCES BIBLIOGRAPHIQUES 48
vi | P a g e
LISTE DES ABBREVIATIONS ET DES SIGLES
OI : Osmose Inverse
OMS : Organisation Mondiale de la
Santé
°C : Degré Celsius
°F : degré français
GPM: gallon per minute
LPM: liter per minute
TAC : titre alcalimétrique complet
TH : titre hydrométrique
pH : potentiel d'hydrogène
%RS : pourcentage de rétention de
sels
%PS : pourcentage de passage de sels
TC : taux de conversion
SDI : Silt Density Index
MF : Microfiltration
UF : Ultrafiltration
NF : Nanofiltration
UNICEF : Fonds des Nations Unies pour
l'Enfance
UFC : Unité formatrice de colonies
vii | P a g e
LISTE DES TABLEAUX
Tableau 1: Caractéristiques
physico-chimique de l'eau de forage après injection
d'hypochlorite de Sodium 35
Tableau 2: Résultats d'analyse
physico-chimique de l'eau osmosée 36
Tableau 3: teneur en chlorures des
échantillons analysés 39
Tableau 4: variation de la teneur en chlore
à l'entrée et à la sortie de
l'osmoseur 41
Tableau 5: teneur en silice à
l'entrée et à la sortie de l'osmoseur 42
Tableau 6: Variation de la concentration en
fer 43
Tableau 7: Résultats d'analyse
microbiologique de l'eau osmosée 44
Tableau 8: Paramètres de performance
de l'osmoseur 45
viii | P a g e
LISTE DES FIGURES
Figure 1: Carte de localisation de EASY BUY 3
Figure 2 : Organigramme de EASY BUY 4
Figure 3: Schéma du mécanisme de
filtration sur membrane (Greenlee et al.
2009 Dow Water & Process Solutions) 11
Figure 4:
Classification des procédés barométriques
membranaires selon la
taille (Ouali M S. (2001)) 12
Figure 5: Description des différents
types de membrane (Baker, 2004) 17
Figure 6: Principe de l'Osmose et de l'osmose
inverse 19
Les membranes d'osmose inverse utilisées sont
constituées d'une superposition de plusieurs couches de polymères
(membranes composites) souvent de polyamide. Les autres matériaux
constituant le support
n'interviennent pas dans Figure 7: Structure
interne d'une membrane 20
Figure 8:Evolution du taux de
rejet en fonction du ratio rayon de soluté/ rayon
du pore (Patrice Bacchin, 2008) 22
Figure 9: Mécanisme simplifié du
colmatage des membranes poreuses 24
Figure 10:Phénomène de
polarisation de concentration sur une membrane 25
Figure 11: Carte de localisation de Ice service
27
Figure 12: compteur électronique de
marque HINAN 29
Figure 13: Lecture débit et pression de
l'alimentation, du perméat et du
concentrât 31
Figure 14:Evolution du pH à
l'entrée et à la sortie de l'OI 37
Figure 15: Variation de l'alcalinité de
l'eau à l'entrée et à la sortie du système
d'OI 38
Figure 16: Variation du TH à
l'entrée et à la sortie de l'osmoseur 39
Figure 17: Variation de la teneur en chlorures
à l'entrée et à la sortie de
l'osmoseur 40
Figure 18: Variation de la teneur en chlore
41
Figure 19: Variation de la teneur en silice
à l'entrée et à la sortie de l'osmoseur
42
Figure 20: variation de la teneur en fer
à l'entrée et à la sortie de l'osmoseur 43
ix | P a g e
RESUME
Lors de notre stage de pré-insertion professionnelle
réalisé à EASY BUY, nous avons travaillé sur le
système de traitement par osmose inverse dans le cadre d'une production
de glaçon et d'eau en sachet. Lors de cette étude, nous nous
sommes penchés sur l'évaluation des membranes du purificateur
d'eau par osmose inverse présente à Ice service. Ainsi donc,
évaluer les performances de celui-ci nous permet de vérifier
l'état des membranes de l'osmoseur et ainsi déduire les mesures
à prendre en cas de défectuosité de celles-ci pour ainsi
protéger les consommateurs. Aussi, nous avons procédés au
relevé des paramètres de l'eau et des paramètres de
fonctionnement de la machine tels que le débit, la pression, la
température, ... Ensuite nous avons procédés aux analyses
physico-chimique et bactériologiques de l'eau. Il en ressort que les
taux de rétention de la membrane pour la silice est dans les 98,43% et
le taux de rétention des sels est de 97,74%, ce qui est supérieur
à 95% et qui correspond aux performances attendus pour l'ensemble des
deux membranes du purificateur d'eau. On peut aussi noter que les membranes ont
retenues la majorité des autres ions contenues dans l'eau. Suite
à cela, on remarque une baisse depH due à la diminution de
concentration en sels dans l'eau. En ce qui concerne le taux de conversion qui
traduit la quantité d'eau déminéralisé, elle
constitue un taux de 71,43% qui est tout juste acceptable pour cette
unité. De par tous ces résultats, on peut dire que cette machine
fonctionne normalement et doit être sujette à des contrôles
pour vérifier l'état des membranes
Mots clés : Osmose inverse,
performance, colmatage, pression osmotique, membrane
sémi-perméable
x | P a g e
ABSTRACT
During our professional pre-insertion internship at EASY BUY,
we worked on the reverse osmosis treatment system as part of an ice cube and
sachet water production. During this study, we focused on the evaluation of the
membranes of the reverse osmosis water purifier present at Ice service.
Therefore, assessing its performance allows us to check the condition of the
reverse osmosis membranes and thus deduce the measures to be taken in the event
of a defect in order to protect consumers. Also, we proceeded to the reading of
the water parameters and the operating parameters of the machine such as the
flow, the pressure, the temperature, ... Then we proceeded to the
physico-chemical and bacteriological analyzes of the water. It appears that the
membrane retention rates for silica is in the 98.43% and the salt retention
rate is 97.74%, which is greater than 95% and which corresponds to the
performance expected for the of the two membranes of the water purifier. We can
also note that the membranes have retained the majority of the other ions
contained in water. Following this, there is a drop in depH due to the decrease
in salt concentration in the water. As for the conversion rate which translates
the quantity of demineralized water, it constitutes a rate of 71.43% which is
barely acceptable for this unit. From all these results, we can say that this
machine works normally and must be subject to checks to check the condition of
the membranes.
Keywords: Reverse osmosis, performance, clogging
Page | 1
INTRODUCTION
1. Contexte et Justification
Elément indispensable à toute la vie sur terre,
l'eau fait l'objet de débat sur sa consommation, sa gouvernance, ses
conflits d'usage, son accès et ses modes de gestion. En 2010,
l'Assemblée générale des Nations Unies a reconnu
explicitement le droit à l'eau potable et à l'assainissement
comme un droit de l'homme. Quelque 2,1 milliards de personne, soit 30% de la
population mondiale n'ont pas accès à une eau de qualité
(OMS/UNICEF, 2017). Il est très important pour la santé
publique de disposer d'une eau salubre, que ce soit pour la boisson, pour un
usage domestique, pour la production alimentaire ou le loisir.
En Afrique, plus de 300 millions de personnes manquent d'un
accès à l'eau potable et les maladies hydriques sont la
première cause de mortalité sur le continent. (Jean-Bosco
Bazié, 2014).
Au Cameroun, l'accès à l'eau potable est encore
un besoin de première nécessité. La distribution de l'eau
potable au Cameroun, est assurée par la CAMWATER qui a de la peine
à satisfaire 50% des populations situées dans les grandes villes
et métropoles du pays comme Douala où on note de plus en plus une
recrudescence des maladies hydriques (typhoïde, dysenterie amibienne et
choléra). Cette situation (faible taux de couverture des besoins en eau
potable et recrudescence des maladies hydriques) a poussé les
populations ayant des revenus modestes ainsi que les autorités en charge
de la ville à se retourner vers les eaux souterraines Malheureusement,
malgré ces efforts, on note encore une bonne tranche des populations qui
s'approvisionnent à travers les eaux des sources ou des puits dont la
qualité reste inconnue.
Ainsi donc, de nombreuses études sur le
développement de méthodes appropriées pour le traitement
des ressources contaminées ont été menées parmi
lesquelles la filtration membranaire. En effet, les procédés
membranaires se révèlent être des méthodes viables
pouvant éliminer une large gamme de polluant dans l'eau (Shih, 2005).
Ils permettent de produire de manière constante
Page | 2
une eau de haute qualité et peuvent donc être
appliqués au traitement de l'eau. Parmi ces techniques de filtration
membranaire, l'osmose inverse fera l'objet de notre étude de par son
efficacité dans le traitement de l'eau.
2. Problématique
L'osmose inverse est une technologie qui permet de
séparer, par l'application d'une pression, le solvant d'une dissolution
concentrée. Le solvant traverse une membrane semi-perméable, en
passant de la solution concentrée à la solution diluée.
Grâce à l'osmose inverse on obtient finalement deux flux, d'un
côté, le solvant pratiquement pur et, de l'autre
côté, une solution encore plus concentrée que la solution
de départ.
Il s'agit d'une technologie efficace, propre et compacte qui
permet d'obtenir de l'eau de grande qualité à partir des eaux
salubres et même d'eau de mer. Elle se révèle être
une grande alliée pour le traitement d'effluents qui doivent être
réutilisés. Les membranes utilisées sont à toujours
plus perfectionnées technologiquement, ce qui permet d'obtenir des flux
de perméat raisonnables en fonctionnant à des pressions toujours
plus basses.
Toutefois, il faut noter que ces membranes ont une
durée de vie limitée en fonction du réglage de la machine
et de la qualité de l'eau à traiter. Il peut arriver qu'elle soit
défaillante et ne dispose plus des mêmes propriétés
qu'au départ. Il serait donc judicieux de faire un diagnostic de la
membrane afin de choisir la mesure à prendre. D'où notre
thème qui porte sur L'EVALUATION DES PERFORMANCES D'UN SYSTEME
DE TRAITEMENT D'EAU PAR OSMOSE INVERSE à Ice Service dans la
localité de Ndogpassi II.
3. Présentation de la structure d'accueil
ETS EASY BUY est une jeune entreprise camerounaise
privée qui fut créé en 2018 et a obtenu un grand
succès dans les domaines de sécurité numérique
(vidéo surveillance), d'énergie renouvelable (énergie
éolienne, énergie solaire), la vente des matériaux de
construction, le génie civil et qui s'étale également dans
la réalisation des forages (études hydrogéologique et
géophysique, sondage, assainissement). Les ETS EASY BUY se situe au
niveau de la rue
Castelnau d'Akwa en face du Collège King Akwa comme le
montre la figure 1 ci-dessous :
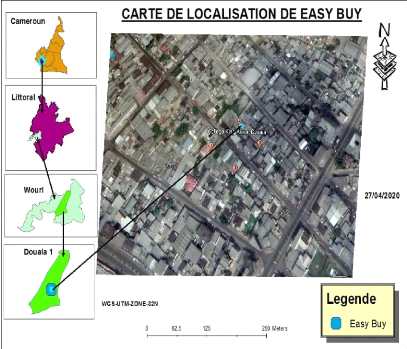
Auteur: NGUEKAP Elie
Page | 3
Figure 1: Carte de localisation de EASY BUY

Directeur Général M. TCHAGANG
Comptable
M. EMASSI Pierre Alain
Foreur
Plombier
Assistante de direction
DATCHO Helene
Magasinière/Coursière NGANKEU Joelle
Service d'étude MADAM Doriane
Stagiaire 1
Stagiaire 2
Service de réalisation
BELL Aristide
Page | 4
Figure 2 : Organigramme de EASY BUY
4. Objectif du stage
L'objectif de ce travail est d'analyser les différents
paramètres qui interviennent dans le traitement et le suivi de la
qualité de l'eau et de faire une comparaison entre l'eau brute d'un
forage et l'eau osmosée afin de déterminer la
performance de l'unité osmose inverse du service.
Chapitre I : REVUE DE LA LITTERATURE
1. Définitions des concepts
Pression Osmotique : La pression
osmotique définit le minimum de pression qui doit être
appliquée à une solution pour empêcher l'écoulement
vers l'intérieur de l'eau à travers une membrane
semi-perméable. Elle est également définie comme la mesure
de la tendance d'une solution à prendre de l'eau par osmose. Les valeurs
sont régies par le coefficient osmotique. L'osmose et les forces
osmotiques favorisent la diffusion des substances à travers la
membrane,
Page | 5
en milieu interne, le solvant passant de la solution la moins
concentrée vers la plus concentrée. L'osmose implique une
pression osmotique, et l'osmose inverse implique une pression hydrostatique.
Le colmatage : ensemble des
mécanismes qui limitent le flux de perméation à travers
une membrane, il résulte de l'accumulation de macromolécules
à la surface ou à l'intérieur des membranes. (A.
Bouchoux, 2003)
2. Composition de l'eau
La composition chimique de l'eau varie
énormément d'une région à l'autre et pour une
même région d'une saison à l'autre. Ces variations
chimiques dépendent de plusieurs paramètres comme la
solubilité des sels constituant l'écorce terrestre (CaCO3, CaSO4,
MgCO3, NaCl), ainsi que de la composition physique des roches.
2.1. Espèce inorganique
? Constituants majeurs
Ce sont des composés ioniques, anions et cations, qui
proviennent de la dissolution des roches dans l'eau qui circule à leur
contact. Il s'agit des sels minéraux tel que : Carbonate de Sodium,
Carbonate de Calcium, Nitrate de Potassium, bicarbonate de sodium, ....
? Les éléments traces
métalliques
Les « éléments traces métalliques
» (ETM) sont définis comme les éléments
métalliques présents avec une concentration d'environ une partie
par billion (103 mg.kg-1) en masse, ou moins. Les principaux
éléments traces métalliques présentent dans l'eau
sont : Titane (Ti), Zinc (Zn), Nickel (Ni), Aluminium, (Al), Chrome (Cr),
Cadmium (Cd), Cuivre (Cu), Fer (Fe), Manganèse (Mn), Plombe (Pb),
Mercure (Hg).
? Les éléments nutritifs
Page | 6
Ces éléments sont composés principalement
par le nitrate (NO3-) et l'ammoniac (NH4+), le phosphore
sous forme phosphate (PO43-) et le silicium tel que la silice
(SiO2).
2.2. Matières organiques
? Matières organiques dissoutes
La plupart du carbone organique dans l'eau est sous la forme
de matière organique dissoute et principalement de molécules
à faible poids moléculaire et d'origines diverses. La
concentration des matières organiques dissoutes et particulaires
dépend de type d'eau et sa profondeur : l'eau de mer surfacique a une
concentration plus élevée que l'eau en profondeur. On peut
trouver dix milliers de molécules différentes dans l`eau comme
les produits de dégradation de déchets végétaux,
produits de synthèse organique soluble, et matières
azotées. Le carbone organique dissous est un facteur important dans le
cycle du carbone et la chaine alimentaire. Il influence la
pénétration de la lumière, l'échange de gaz
à la surface.
? Matières organiques particulaires
C'est la matière en suspension et en émulsion,
elles peuvent être classifiées selon leur taille. Dans l'eau
surfacique, la plupart d'entre elles sont d'origine biologique. Les plus
petites particules (moins de 1 um jusqu'à quelques dizaines de um) se
composent de bactéries et d'autres détritus organiques fins, et
des particules inorganiques particulièrement des minéraux
d'argile et des composés hydratés insolubles tels que Fe(OH)3. La
gamme de taille allant de quelques dizaines à quelques centaines de um
comporte des grands détritus et des agglomérats fécaux,
produits de l'agrégation biologique (sable, boues, pétrole,
huiles, ...). L'eau contient également les gaz dessous ayant une grande
importance dans les phénomènes biologiques ainsi que chimique
(corrosion)
Page | 7
3. Les paramètres d'évaluation de la qualité
de l'eau
3.1. Les paramètres organoleptiques
Les paramètres organoleptiques sont : la couleur,
l'odeur et la saveur. La couleur de l'eau résulte essentiellement de
particules colloïdales en suspension, peu ou pas décantables.
L'importance de la couleur est surtout d'ordre organoleptique,
c'est à dire capable de produire un effet sensoriel. Elle peut
être l'indice d'une pollution par diverses substances chimiques (Potelon
et al, 1993). Alors que l'odeur et la saveur sont dues à la
présence de matières organiques en décomposition (Rodier,
2009).
L'odeur a pour origine principale la présence de
substances organiques volatiles ou de certains gaz : d'origine biologique, les
odeurs révèlent la présence de microorganismes qui peuvent
signifier une augmentation de la concentration en germes pathogènes ;
elles peuvent aussi provenir de pollutions issues des activités humaines
(Potelon et al, 1993).
L'apparition de goût provient souvent d'une croissance
de microorganismes à l'intérieur du système de
distribution ou bien d'une contamination occasionnelle par les matériaux
utilisés pour la construction ou l'entretien du réseau (Potelon
et al, 1993).
3.2. Les paramètres physico-chimiques
La qualité d'une eau souterraine est
caractérisée par un certain nombre de paramètres physiques
et chimiques ;
? Le potentiel d'hydrogène (pH)
Par définition, le pH est égal au cologarithme de
l'activité des protons. pH = - log (H3O+)
Le pH de l'eau conditionne un grand nombre d'équilibres
physico-chimiques, en particulier l'équilibre calco-carbonique et donc
l'action de l'eau sur les carbonates (attaque ou dépôt). Le pH de
l'eau est acide dans les eaux des
Page | 8
aquifères sableux ou granitiques, et alcalin dans les
calcaires Dans les eaux naturelles, le pH est corrigé selon le cas par
élimination du CO2 dissous en excès ou par correction de la
dureté carbonatée.
? La température
La température influe directement sur les réactions
chimiques, et particulièrement la dissolution des gaz et des sels dans
l'eau, cette solubilité diminue quand la température augmente.
Elle est étroitement liée au pH et à la
conductivité électrique.
? La conductivité
La conductivité électrique est l'aptitude d'un
matériau à laisser les charges électriques se
déplacer librement, autrement dit à permettre le passage du
courant électrique. Plus précisément dans le domaine de
l'eau, la conductivité électrique traduit la capacité
d'une solution aqueuse à conduire le courant électrique. Cette
notion est inversement proportionnelle à celle de la
résistivité électrique. L'unité de mesure
communément utilisée est le siemens par cm (S/cm), exprimé
souvent en micro siemens par centimètre (uS/cm). La conductivité
est directement proportionnelle à la quantité de solides (les
sels minéraux et non les matières organiques) dissous dans l'eau.
Ainsi, plus la concentration en solide dissout sera importante plus la
conductivité sera élevée.
? La dureté
La dureté d'une eau correspond à la somme des
concentrations en cations métalliques, excepté celles des
métaux alcalins et du proton. Elle est souvent due aux ions calcium et
magnésium. La présence de ces deux cations dans l'eau tend
souvent à réduire la toxicité des métaux. On
distingue :
o la dureté totale ou titre hydrotimétrique «
TH » qui est la somme des concentrations calcique et magnésienne
;
o la dureté calcique qui correspond à la teneur
globale en sels de calcium
o la dureté magnésienne qui correspond à la
teneur globale en sels de magnésium
Page | 9
? L'alcalinité
L'alcalinité d'une eau est essentiellement due à
la présence de bases et de sels d'acides faibles. Dans les eaux
naturelles, l'alcalinité résulte le plus
généralement à la présence
d'hydrogénocarbonates, carbonates et hydroxydes.
o le titre alcalimétrique T.A. d'une eau correspond
à la somme des concentrations des ions carbonates (CO32-) et
des ions hydroxydes (OH-). T.A. = [OH-] +
[CO32-]
o le titre alcalimétrique complet T.A.C rend compte de la
concentration d'une eau en ions carbonate CO32- et en ions
hydrogénocarbonate HCO32-
T.A.C. = [OH-] + [CO32-] +
[HCO3-]
Le T.A. et le T.A.C. s'expriment en milliéquivalent par
litre (meq/L) ou mol/ L. ? Les matières en
suspension
Les matières en suspension comprennent toutes les
matières minérales ou organiques qui ne se solubilisent pas dans
l'eau. Elles incluent les argiles, les sables, les matières organiques
et minérales de faible dimension, microorganismes de l'eau. La
quantité de matières en suspension varie notamment selon les
saisons et le régime d'écoulement des eaux. Ces matières
affectent la transparence de l'eau et diminuent la pénétration de
la lumière. La teneur en MES sont exprimées en mg/l.
? Les teneurs
Les eaux douces sont majoritairement constituées
d'anions et de cations : les ions bicarbonates, chlorures, nitrates, sulfates,
phosphates, calcium, magnésium, potassium et sodium (BANTON et al,
1997). Il y a aussi des oligoéléments comme le fer, le
manganèse, le zinc, le fluor... Les contaminants chimiques de l'eau
(arsenic, plomb...) peuvent à long terme engendrer des
Page | 10
maladies cancérigènes (OMS, 2006). Le suivi de
la qualité physico-chimique de l'eau destinée à la
consommation est nécessaire pour s'assurer que leurs teneurs respectent
les directives de l'OMS.
3.3. Les paramètres microbiologiques
Une eau destinée à la consommation ne doit
contenir aucune bactérie. Dans le cas contraire, des critères
permettent de fixer la quantité limite de ces organismes à
tolérer dans l'eau. Pour l'analyse microbiologique, les experts se
basent essentiellement sur des bactéries spécifiques qui
représentent des indicateurs de contamination fécale. En un
premier temps, elles se retrouvent en proportion élevées dans les
selles des animaux à sang chaud. Ceux-ci, au vu de leur contact
permanent avec les sources d'eau, se révèlent comme de
véritables vecteurs de grave contamination. La présence de ces
bactéries dans une eau suppose donc que celle-ci ne peut se consommer
sans risque de maladie. En exemple, l'Escherichia coli ou les coliformes
thermotolérants paraissent comme les plus faciles à
repérer et en même temps les plus virulents. En bref, une eau
potable doit rester exempte de ces organismes. Les experts peuvent
également rechercher des entérocoques ou des spores de
clostridium perfringens pour parfaire leurs études.
4. Procédés de traitement de l'eau par osmose
inverse 4.1. Généralités sur les procédés
membranaires
4.1.1. Principe de filtration par membrane
La membrane est définie comme une barrière
séparant deux compartiments et permettant le passage
préférentiel d'au moins une espèce parmi les autres sous
l'action d'une force de transfert chimique (concentration ...) ou physique
(pression). En général, les constituants qui sont plus petits que
les pores de la membrane sont capables de passer à travers sous l'effet
d'une pression appliquée tandis que les substances et les
molécules de taille plus importante sont retenues. La technologie de la
filtration sur membrane peut être appliquée pour la
séparation fluide / fluide ou particules / fluide en vue de
récupérer les
espèces valorisables (eau, lactose, sels
minéraux...). Les membranes ont des structures poreuses ou denses
permettant de laisser passer de manière sélective les composants
d'une solution sous l'action d'une différence de pression entre l'amont
et l'aval de la membrane. Deux fractions sont obtenues : le rétentat, en
amont de la membrane, qui contient les éléments retenus par la
membrane, et le perméat, en aval, qui contient les
éléments qui ont traversé la membrane. Les performances
d'une membrane sont définies par sa sélectivité et sa
perméabilité. Les membranes utilisées dans les
procédés de séparation membranaire sont
caractérisées par le diamètre des particules ou la masse
molaire d'une molécule qui est retenue par la membrane. Les
composés ayant une masse molaire supérieure au seuil de coupure
de la membrane sont retenus à plus de 90 % par la membrane. A l'inverse,
les composés de masse molaire inférieure au seuil de coupure de
la membrane sont retenus à moins de 90%. Le SC (seuil de coupure) est
relié principalement à la taille des pores de la membrane, mais
il est aussi beaucoup influencé par la forme de la molécule
à filtrer, par sa charge, par son degré d'hydratation, parle pH
et la force ionique de la solution à filtrer, par la
pression appliquée et le flux de perméation.
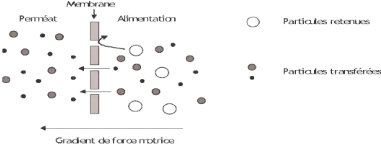
Page | 11
Figure 3: Schéma du mécanisme de
filtration sur membrane (Greenlee et al. 2009 Dow Water & Process
Solutions)
Le résultat d'une opération de filtration
membranaire est la séparation du fluide à traiter en deux parties
de concentrations différentes :
Page | 12
? Le retentât qui contient les molécules ou
particules retenues par la membrane
? Le perméat qui contient les molécules qui
traversent la membrane.
Les procédés de séparation membranaire
regroupent un grand nombre de techniques permettant de réaliser des
séparations en phase liquide ou gazeuse sous l'action de diverses forces
de transfert.
4.1.2. Les techniques membranaires à gradient de
pression
Elles reposent sur une différence de pression totale
de part et d'autre de la membrane, appelée pression transmembranaire.
Ces procédés membranaires barométriques, peuvent
être classifiés en fonction de la membrane utilisée et du
seuil de coupure en microfiltration, ultrafiltration, nanofiltration, et osmose
inverse comme présenté sur la figure 2.
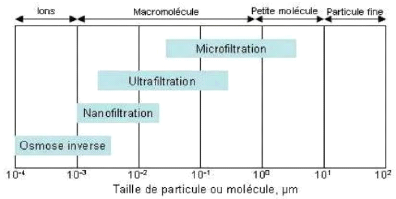
Figure 4: Classification des
procédés barométriques membranaires selon la taille (Ouali
M S. (2001))
La microfiltration, l'ultrafiltration et nanofiltration mettent
en jeu des membranes possédant une structure poreuse tandis que les
membranes d'osmose inverse sont des matériaux denses.
Page | 13
s La microfiltration
Elle est définie comme un procédé de
séparation solide / liquide. Avec une taille des pores variant de 0,1
à 5 um et une pression transmembranaire requise de 1 à 10 bars
(Cui et al., 2010), la MF est principalement utilisée pour la
séparation des solides en suspension dans l'eau. Cette séparation
se fait par tamisage à travers les macropores de la membrane (Judd,
2011). Le mécanisme est basé exclusivement sur l'effet tamis
(taille) et rend possible la rétention de particules en suspension ou de
bactéries dont la taille se situe entre 0.1 et 10 um. Les pressions
appliquées sont de quelques dixièmes de bar pour éviter un
colmatage important.
s L'ultrafiltration
L'UF est caractérisée par une taille de pores
des membranes comprise entre 1 à 100 nm et des pressions
transmembranaires comprises entre 1 et 10 bars (Cui et al., 2010). Elle est
utilisée pour la séparation des solutés de poids
moléculaire compris entre 500 et 100.000 Daltons tels que les
colloïdes (protéines), les petites molécules
(polysaccharides), etc. La séparation se fait essentiellement par «
tamisage » (effet stérique) à travers les mésopores
(Cui et al., 2010 ; Judd, 2011).
s La nanofiltration
Pour traiter des espèces de taille inférieur
à 2 nm (sucre, colorant, sels ) elle
se situe à la transition entre l'osmose inverse et
l'ultrafiltration La NF est caractérisée par un poids
moléculaire de coupure de 100 à 500 Daltons, une taille de pores
des membranes comprise entre 0,5 à 10 nm et des pressions
transmembranaires atteignant 30 bars (Cui et al., 2010). La séparation
par cette membrane se fait grâce à la combinaison rejet
électrostatique, solubilité-diffusion et « tamisage »
à travers des micropores (Judd, 2011).
s L'osmose inverse
L'OI retient les solutés tels que les sels et les
acides aminés de poids moléculaires inférieurs à
1000 Daltons (Charcosset, 2012). Sa taille de pores est
Page | 14
inférieure à 0,5 nm et la pression
transmembranaire peut atteindre les 100 bars (Cui et al., 2010). La
séparation se fait grâce à la différence de
solubilité et au taux de diffusion du solvant et du soluté dans
la membrane (Judd, 2011). L'OI est généralement utilisée
pour le dessalement et la production d'eau pure. Il utilise des membranes
denses. La pression appliquée doit être supérieure à
la pression osmotique exercée en amont de la membrane par la solution
filtrée pour observer un flux de perméat à travers la
membrane. Les pressions appliquées varient de 20 à 80 bars.
4.1.3. Nature chimique des membranes
Les membranes utilisées dans les
procédés de filtration peuvent être classés selon
leurs natures chimiques en différents types :
? Les membranes organiques sont généralement
constituées à partir de polymères, dont l'acétate
de cellulose (CA), le polyamide (PA), le polysulfone (PS), le
polyéthersulfone (PES), le polyfluorure de vinylidène (PVDF),
polypropylène (PP), etc. (Cui et al., 2010 ; Charcosset, 2012).
Les membranes polymériques sont relativement moins onéreuses,
faciles à fabriquer, disponibles dans une large gamme de tailles de
pores ; et elles ont été largement utilisées dans diverses
industries. Néanmoins, la plupart des membranes polymériques ont
des limites sur une ou plusieurs conditions de fonctionnement (le pH, la
température, la pression ou la tolérance au chlore, etc.) qui
entravent une plus large application. Par exemple, l'acétate de
cellulose est le matériau classique généralement
utilisé pour produire la peau des membranes. Cependant, il
présente de nombreux inconvénients tels qu'une température
maximale d'exploitation basse (30 - 40 °C), une faible résistance
chimique avec une étroite gamme de pH (2 - 8, de
préférence 2 - 6) et une faible tolérance au chlore (moins
de 1 mg/L de chlore libre) (Cui et al., 2010).
? Les membranes inorganiques ont été
commercialisées depuis le début de l'année 1980. Elles
sont d'un grand intérêt en technologie membranaire grâce
à leur forte résistance mécanique et chimique et à
leur stabilité thermique par rapport à la plupart des membranes
polymériques (Cui et al., 2010 ; Charcosset, 2012). Les
membranes inorganiques (telles que y-
Page | 15
alumina/á-alumina, verre borosilicaté, carbone
pyrolysé, zircone/acier inoxydable ou zircone/carbone) ont une forte
tolérance aux conditions opératoires extrêmes (Cui et
al., 2010). Des températures opératoires de plus de
500°C et des valeurs de pH extrêmes (1 et 14) peuvent être
atteintes (Charcosset, 2012), tout en ayant une grande valeur limite de
pression opératoire et une longue durée de vie (Cui et al.,
2010). De plus, les membranes inorganiques peuvent être
nettoyées avec des produits chimiques agressifs, des solvants organiques
ou par un courant d'eau chaude (Charcosset, 2012). Cependant, les membranes
inorganiques sont très fragiles mécaniquement(cassantes), ainsi
les membranes peuvent être facilement endommagées. En outre, il
existe actuellement uniquement des membranes céramiques
d'ultrafiltration et de microfiltration (Cui et al., 2010). Aussi, il faut
noter que le coût est un grand désavantage dans l'application des
membranes inorganiques. En effet, elles sont de loin plus chères que les
membranes organiques.
? Les membranes composites : Elles sont
créées à partir des deux types précédents.
Il s'agit de membranes minérales sur lesquelles on dépose des
polymères ou sur lesquelles on greffe d'autres composés tels que
des silanes. Elles possèdent donc des propriétés qui sont
un compromis entre les membranes organiques et inorganiques.
4.1.4. Structure des membranes
? Les membranes symétriques ont une structure
homogène (taille des pores uniforme) sur toute l'épaisseur de la
membrane. Parmi les membranes isotropiques on distingue :
o Membranes poreuses
La porosité d'une membrane est définie comme
étant le rapport du volume des espaces vides sur le volume total de la
matrice. La structure et la fonction d'une membrane poreuse est très
similaire à celle d'un filtre classique (diamètre de pore
supérieur au micron). Elle a une structure rigide avec un grand nombre
de pores interconnectés distribués aléatoirement et de
petite taille (0,01 à 1 micron). Les particules de taille plus grosses
que les pores sont toutes retenues, celles de
Page | 16
taille intermédiaire sont partiellement retenues et les
particules de petites tailles passent quasi totalement (Satinder Ahuja, 2003).
La séparation de soluté par les membranes poreuses se fait
principalement en fonction de la taille des molécules et de la
distribution de taille des pores ; et donc seulement les solutés qui
diffèrent significativement en taille peuvent être
séparées, comme c'est le cas en microfiltration et en
ultrafiltration. Il existe plusieurs variétés de membranes
poreuses : - membranes microporeuses : diamètre des pores
inférieur à 2 nm ; - membranes mésoporeuses :
diamètre des pores compris entre 2 et 50 nm ; - membranes macroporeuses
: diamètre des pores supérieur à 50 nm. Le
mécanisme de transfert de matière sous l'effet de la pression est
exclusivement convectif pour le solvant, celui-ci n'entraîne avec lui que
les espèces dont la taille est plus petite que celle des pores (effet
tamis).
o Membranes denses
Lorsque les interstices entre les constituants de la matrice
membranaire ont une taille voisine de celle d'un ion solvaté, la
membrane est qualifiée de dense. Cette membrane consiste en un film
dense à travers lequel le perméat est transporté par
diffusion sous l'effet d'un gradient de pression, de concentration ou de
potentiel électrique. La séparation des composés d'un
mélange est directement reliée à leur diffusivité
et leur solubilité à travers la membrane. Ainsi, une membrane
dense peut séparer des composés de taille voisine si leur
solubilité (concentration dans la membrane) diffère. Dans une
membrane dense, lorsque les pores se réduisent aux espaces libres
situés entre les chaines de polymères, leur taille est voisine de
celles des molécules organiques simples ou des ions hydratés.
L'effet tamis devient donc négligeable.
o Membranes échangeuses d'ions
Les membranes échangeuses d'ions sont des membranes
denses ou poreuses portant des charges. La membrane porte des ions fixes, qui
peuvent être positivement ou négativement chargés. Lorsque
les ions positifs sont fixés sur la membrane, on parle de membrane
échangeuse d'anion. Lorsque les ions de charge négatifs sont
fixés, on parle de membrane échangeuse de cation. La
séparation par une membrane électriquement chargée est
réalisée par la taille pore de la membrane aussi bien que par
l'exclusion de co-ions (ions de même
charge que la charge fixe de la membrane) (Satinder Ahuja,
2003). Les membranes échangeuses d'ions sont généralement
utilisées dans les techniques de dialyse ionique,
d'électrodialyse, depiézodialyse, etc.
? Les membranes asymétriques
(anistropiques) :
Ces membranes sont formées d'une couche de surface
très fine (la peau) déposée sur un support poreux plus
épais (le corps de la membrane). La peau est très mince (0,1
à 1 um d'épaisseur) et représente la couche active de
filtration et le support a une épaisseur 0,1 à 1 mm (Satinder
Ahuja, 2003). Cette structure est obtenue soit à partir de plusieurs
matériaux polymères ou soit à partir d'un processus
d'inversion de phase (Nunes & Peinemann, 2001). La plupart des membranes
d'ultrafiltration, de nanofilration et d'osmose inverse sont de structure
asymétrique, tandis que la plupart des membranes de microfiltration sont
de structure microporeuse. Un exemple bien connu de membrane asymétrique
est la membrane composite dont le développement a permis d'atteindre des
taux de transport élevés.
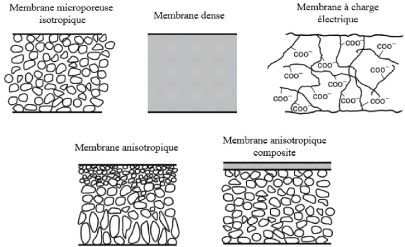
Page | 17
Figure 5: Description des différents
types de membrane (Baker, 2004)
Page | 18
4.1.5. Mécanismes de transfert de matière
Lors de la filtration par des membranes d'osmose inverse et de
nanofiltration plusieurs phénomènes de transport et de
sélectivité interviennent. Les principaux mécanismes de
transfert sont de types physiques, chimiques et électrochimiques
:
? Une séparation sur la différence de taille :
effet stérique,
? Une séparation sur la différence de
solubilité et de diffusion des espèces :
mécanisme de solubilisation - diffusion, dont toutes
les espèces moléculaires(solutés et solvant) se dissolvent
dans la membrane et diffusent à l'intérieur de celle-ci sous
l'action d'un gradient de concentration et de pression,
? Une séparation sur la différence de charges
des espèces à séparer : effet électrochimique
5. Osmose inverse
5.1. Principe de l'osmose inverse
L'osmose est le transfert de solvant à travers une
membrane sous l'effet d'un gradient de concentration. Considérons un
système de deux compartiments séparés par une membrane
semi-perméable sélective et contenant deux solutions de
concentrations différentes (figure 6). Le solvant
(généralement l'eau) s'écoule à travers la membrane
du compartiment de la solution moins concentrée vers le compartiment
contenant la solution la plus concentrée, c'est le
phénomène d'osmose. Si on applique progressivement une pression
sur le compartiment de la solution la plus concentrée, le flux d'eau qui
traverse la membrane va diminuer, puis s'annuler quand la pression
appliquée atteindra à la pression osmotique. Si on applique une
pression supérieure à la pression osmotique, l'eau va traverser
la membrane dans le sens inverse du flux osmotique, c'est le
phénomène d'osmose inverse.
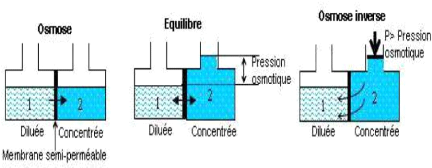
Figure 6: Principe de l'Osmose et de l'osmose
inverse
5.2. Pression Osmotique
La pression osmotique peut être calculée par la
loi de Van't Hoff qui stipule que la
pression osmotique exercée par un soluté est
égale à la pression que ce corps aurait exercé dans
l'état gazeux parfait dans le même volume (V) et à la
même température (T). Si le soluté est dissocié en n
ions, la pression osmotique sera n fois supérieure. La
pression osmotique d'une solution est proportionnelle à la concentration
en solutés.
?? = ??.??.??.??
Avec :
?? : Pression osmotique (bar)
n : Nombre d'ions dissociés dans le cas d'un
électrolyte
C : Concentration molaire (mol.l-1)
R : Constante des gaz parfaits (0,082
l.bar.mol-1K-1)
T : Température absolue (Kelvin).
Page | 19
Page | 20
5.3. Description générale du processus de
traitement de l'eau par osmose inverse
5.4. Membranes et modules d'osmose inverse
Les membranes d'osmose inverse utilisées sont
constituées d'une superposition de plusieurs couches de polymères
(membranes composites) souvent de polyamide. Les autres matériaux
constituant le support n'interviennent pas dans
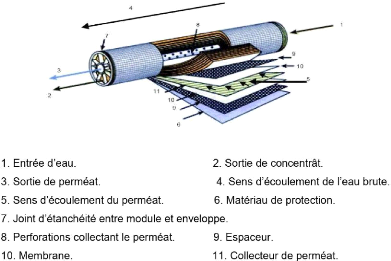
Figure 7: Structure interne d'une membrane
le procédé. La séparation des
espèces dissoutes est due principalement aux propriétés
chimiques du polymère de surface. Les membranes de séparation
sont insérés dans un dispositif appelé module afin
d'obtenir un espace d'échange plus important. Un certain nombre de
modules (6 au niveau de Cevital) disposées selon divers arrangements
forme une unité ou une vicelle. Dans chaque module spiral, les membranes
sont enroulées autour d'un tube central destiné à
collecter le perméat. La solution à filtrer circule
parallèlement au tube central dans les espaces ménagés
entre les deux faces actives des membranes par des espaceurs (écoulement
tangentiel). Les tubes de pression sont raccordés entre eux par des
connecteurs, dont le taux de conversion est fonction du nombre de modules
placés en série
Page | 21
6. Caractéristiques principales d'une unité
d'osmose inverse
La performance des procédés membranaires est
directement associée à toutes les propriétés de la
membrane. L'information sur la structure chimique de la membrane, ses
propriétés de perméabilité, sa taille de pore, la
forme et la distribution ainsi que ses propriétés de surface sont
importantes pour les fabricants et les utilisateurs de la membrane.
6.1. Taux de conversion
Le taux de conversion d'un osmoseur est défini par le
ratio entre le débit d'eau déminéralisée produite
(perméat) et le débit d'eau d'alimentation. Le débit du
perméat est notamment fonction de la pression d'eau appliquée, de
la température et de la minéralisation d'eau à traiter. Le
débit du rejet, le concentrât est à régler par une
vanne à pointeau ou capillaire, de manière à obtenir le
taux de conversion souhaitée.
Pour optimiser la durée de vie d'une membrane d'osmose
inverse, le ratio entre le perméat et le débit d'alimentation
doit être de l'ordre de 1 : 5. Ainsi 20% de l'eau d'alimentation
transformée en eau déminéralisée, le reste, soit
80% correspond au concentrât rejeté. Dans ce cas, 4 litres d'eau
sont rejetés pour en produire 1.
Afin de limiter la consommation d'eau, le taux de conversion
des osmoseurs de petites capacités est augmenté par une
augmentation du débit de rejet, même si cela réduit la
durée de vie de la membrane. C'est le cas par exemple pour les
ménages.
Dans le cas d'osmoseurs professionnels produisant des volumes
d'eau déminéralisée important, le ratio entre le
débit de production et celui de l'alimentation de la membrane est
maintenu à environ 20%. Cependant, le flux d'eau du concentrât est
réinjecté dans le flux d'alimentation.
6.2. Sélectivité
Une membrane retient des solutés selon :
? leur taille : c'est l'effet stérique qui
résulte de la structure « tamis » du matériau
Page | 22
? leur charge : une membrane peut être chargée
générant ainsi des interactions électrostatique avec des
composés chargés
? leur hydratation : dans le cas de petit soluté le
cortège d'eau d'hydratation qui l'entoure peut participer à la
rétention
Dans le cas d'une rétention stérique, il est
possible d'estimer à partir de considérations basées sur
l'écoulement du solvant et du soluté dans un pore de rayon, rs,
de définir le taux de rejet par la loi de Ferry :
????
?? = 1 - = (1 - (1 - A)2)2
????
Où A = r??est le rapport du
rayon du soluté sur le rayon du pore. L'évolution du r??
taux de rejet de l'eau en fonction de A selon cette relation
est représentée sur la figure.
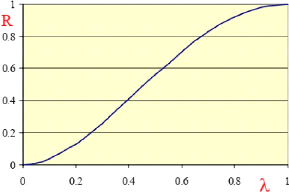
Figure 8:Evolution du taux de rejet en
fonction du ratio rayon de soluté/ rayon du pore (Patrice Bacchin,
2008)
Une membrane n'est donc pas un séparateur
séparant « parfaitement » les espèces par taille : le
transfert d'un soluté deux fois plus petit que le pore est réduit
de 40 %. Il faut, pour en rajouter encore sur « l'imperfection » des
membranes, garder à l'esprit qu'une membrane possède une
distribution de taille de pore ! Les conditions opératoires, et plus
particulièrement le flux, ont un effet important sur le taux de rejet.
En effet, le taux de rejet observé
Page | 23
expérimentalement est défini par rapport
à la concentration en solution C0 (Patrice Bacchin, 2008).
C??
R= 1- Co
Où C0 est la concentration de l'espèce à
retenir dans la solution et Cp est la concentration de la même
espèce dans le perméat.
6.3. Débit spécifique (densité du flux
volumique)
Il s'agit du flux de perméation c'est-à-dire la
productivité du procédé défini par
le débit de perméation, Qp, divisé par la surface
membranaire. Il représente aussi la vitesse du fluide perpendiculaire
à la surface de la membrane. Il s'exprime par :
??
J = s Il s'exprime en
L.h-1.m-2
7. Limitation de l'osmose inverse
7.1. Le Colmatage
L'un des principaux facteurs qui limitent l'utilisation des
membranes dans presque toutes les applications est le colmatage (Charcosset,
2012). Le colmatage est généralement défini comme un
processus résultant à une chute des performances (diminution de
flux de filtrat et/ou de la sélectivité) d'une membrane en raison
du dépôt de matières en suspension ou dissoutes sur sa
surface extérieure (Cui et al., 2010) ou à l'intérieur des
pores de la membrane (Fane et al., 2011). C'est une modification
réversible ou irréversible de la membrane provoquée par
des interactions physiques et/ou chimiques entre la membrane et les composants
présents dans les solutions d'alimentation (Charcosset, 2012). Cette
modification nécessite un nettoyage ou le remplacement de la membrane et
ne peut généralement pas être résolue simplement en
arrêtant le processus de filtration. Selon Cui et al. (2010), plusieurs
paramètres peuvent influencer le degré d'encrassement d'une
membrane : (1) la nature et concentration des solutés et des solvants,
(2) le type de membrane, (4) la distribution de la taille des pores, (5) les
caractéristiques de la surface et des matériaux membranaires
et (6) l'hydrodynamique du module. Le colmatage peut
être lié à différents modes tels que l'adsorption,
la formation de gâteau et le blocage des pores par des particules. Ces
mécanismes peuvent conduire à l'obstruction ou au blocage partiel
de la zone active de la membrane ou au dépôt d'une couche sur la
surface de la membrane (Cui et al., 2010 ; Charcosset, 2012).
Généralement, quatre mécanismes de colmatage des membranes
poreuses peuvent être observés comme l'indique la figure 2.8 (Cui
et al., 2010).
Selon la nature des éléments colmatant, le
colmatage peut être classé en tartre (précipitation des
sels solubles), en colmatage colloïdal, en colmatage organique et en
bio-colmatage (formation de biofilm) (Fane et al., 2011). L'effet net du
colmatage est soit la réduction du flux d'eau à pression
constante appliquée ou l'augmentation de la PTM pour maintenir un flux
constant d'eau. Dans les deux cas, la demande d'énergie pour traiter une
unité de volume d'eau peut être augmentée de manière
significative. Il est donc nécessaire d'effectuer un nettoyage
approprié de la membrane encrassée afin de retrouver ses
caractéristiques initiales. L'élimination des
éléments colmatant des membranes peut se faire par nettoyage
physique (ou mécanique) et/ou par l'utilisation d'une solution de
nettoyage spécifique contenant des détergents appropriés
et/ou des produits chimiques (acides et bases) (Charcosset, 2012).
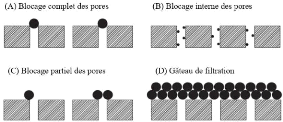
Page | 24
Figure 9: Mécanisme simplifié du
colmatage des membranes poreuses
Page | 25
7.2. Polarisation de concentration
La polarisation de concentration est liée à
l'accumulation des solutés totalement ou partiellement retenus à
la surface amont de la membrane (Van Reis & Zydney, 2007). En effet, la
concentration en soluté à proximité de la surface de la
membrane est généralement plus élevée que la
concentration au coeur de la solution en raison de la rétention des
solutés par la membrane. Le gradient de concentration au voisinage de la
surface de la membrane conduit à une rétrodiffusion des
molécules de soluté vers le coeur de la solution. Lorsque la
rétrodiffusion s'équilibre avec le transport convectif des
solutés vers la membrane, un profil de concentration de polarisation
constante est établi (figure 2.9) (Fane et al., 2011). C'est une
conséquence naturelle de la sélectivité de la membrane et
correspond à la limite de transfert de masse. Si la force motrice est
stoppée, la perméation cesse, et le phénomène de
polarisation de concentration disparaît (Cui et al., 2010).
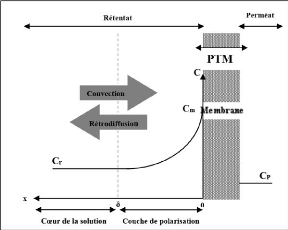
Figure 10:Phénomène de
polarisation de concentration sur une membrane
8. Estimation du potentiel de colmatage
Différentes méthodes d'évaluation du
potentiel de colmatage d'une eau ont été
développées. La plus utilisée est le Silt Density Index
(SDI).
SDI (Silt Density Index)
Le SDI est considéré comme un paramètre
représentatif du potentiel de colmatage d'une eau brute d'alimentation
dans un procédé d'osmose inverse. Un essai de SDI consiste en la
filtration d'un échantillon d'eau à travers une membrane de 0,45
um (microfiltration) de surface filtrante 1,73×10-4 m2 à
une pression transmembranaire constante de 2,07 bar. Le SDI est
déterminé par une comparaison des temps de filtration, t1 et t2,
nécessaires pour obtenir un volume de filtration fixe respectivement au
temps 0 et après un temps t.
SDIt =
t
(i - ti
t??) * i00
Page | 26
Avec :
SDI Silt Densité Index
(%min-1)
t1 temps initial pour filtrer un échantillon de
500 ml (sec) t temps après le départ de la mesure
(min)
t2 temps pour filtrer un échantillon de 500 ml
après le temps T (sec)
Le SDI15 (t = 15 minutes) est défini par l'ASTM comme
le temps nécessaire pour des essais précis et normalisés.
Néanmoins, des temps (t) plus faibles (3,5 et 10 minutes) sont
utilisés dans la pratique afin d'éviter un colmatage important et
un flux trop faible. Le SDI peut être considéré comme un
outil pour caractériser une fraction particulaire de l'eau et permettre
de comparer des eaux entre elles plus que de caractériser le colmatage
d'une membrane d'osmose inverse. En effet, on peut remarquer qu'il n'utilise
pas une membrane d'osmose inverse. De plus, la pression utilisée pendant
ce test est très inférieure à la pression utilisée
pendant l'opération d'osmose inverse. Le pouvoir de colmatage est donc
différent. Enfin, les essais de SDI sont effectués en mode
frontal et pas en tangentiel comme l'osmose inverse, le flux du perméat
est beaucoup plus élevé. Toutefois, malgré toutes les
limites posées par ce test, c'est celui qui est encore utilisé en
routine par les traiteurs d'eau. On considère généralement
que le SDI15 de l'eau d'alimentation doit être inférieur à
4 en osmose inverse. Les prétraitements sont mis au point pour amener le
SDI de l'eau en deçà de cette valeur.
Chapitre II : Matériel et Méthodes
1. Description de la zone d'étude
1.1. Localisation de la zone d'étude
Le site d'étude est localisé au sein du bassin
sédimentaire de Douala et est représenté par une
unité au sein de l'arrondissement de Douala 3ème. Le
secteur de Douala 3ème est localisé entre les coordonnées
4°00'-04°02'30»N et 09°45'00»-09°47'30»E. Le
site en question se trouve aux coordonnées 4°1'39,9432»N et
9°46'17,45904»E. Il caractérisé par un relief
quasi-plat avec des altitudes comprises entre 0 et 60 m où il est peu
vallonné avec des vallées en U ou en V et fait partie du bassin
versant du Wouri.
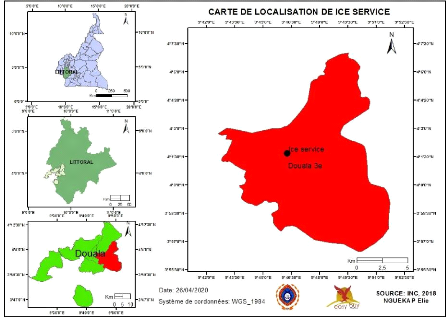
Page | 27
Figure 11: Carte de localisation de Ice
service
Page | 28
1.2. Description du milieu physique et humain
Le Climat
Il est de type équatorial humide côtier,
influencé par la mer. Cependant, la proximité
du mont Cameroun (4100 m d'altitude) influence
également ce climat qui devient très pluvieux. Il s'agit d'un
climat particulier, marqué par la quasi permanence des pluies.
On distingue deux principales saisons : une saison de pluie
longue d'environ 9 mois (de Mars à Novembre) et une saison relativement
sèche courte d'environ 3 mois (de Décembre à
Février). La température moyenne annuelle oscille autour de 27,5
°C. Le mois d'Août est le mois le plus froid avec une
température moyenne mensuelle oscillant autour de 25,5 °C tandis
que le mois de Février est le mois le plus chaud avec une
température moyenne mensuelle oscillant autour de 28,9 °C.
L'hydrographie
Le réseau hydrographique au sein de la zone
d'étude est très dense et montre des cours d'eaux d'ordre 4 qui
sont méandriformes ou rectilignes, définissant un réseau
dendritique à subparallèle. Cette présentation du
réseau hydrographique permet de définir un potentiel hydrologique
et hydrogéologique important dans la région.
Les Sols
Ils présentent une diversité marquée par
la dominance des sols ferralitiques, des sols hydromorphes, des sols peu
évolués et les sols minéraux bruts (Hieng, 2003). Parmi
les sols ferralitiques, on note la dominance des sols ferralitiques jaunes
dérivés des roches sédimentaires sableuses et
sablo-argileuses. La teneur en bases de ces sols est très faible et leur
pH est acide (en moyenne 5,5).
La Population
Fort de son potentiel humain de 1 931 977 habitants (avec 646
347 habitants à Douala 3ème et 250 626 habitants
à Douala 4ème), soit environ 77% de la
Page | 29
population générale de la région du
Littoral, la ville de Douala constitue la ville la plus peuplée de la
région du littoral (BUCREP, 2010). Cette population est cosmopolite.
2. Collecte des données
2.1. Données primaires
La collecte des données primaires a consisté
à une descente de terrain effectuée sur le site de Ice Service.
Au cours de cette descente, nous avons pris connaissance avec les
différents équipements présents sur le site. Notre
démarche de travail repose sur la prise d'échantillon d'eau pour
analyse physico-chimique et bactériologique en laboratoire, le
relevé des paramètres physiques de l'eau grâce à un
compteur électronique de marque HINAN ainsi que l'observation des
paramètres de l'osmose inverse durant son fonctionnement. Ainsi les
valeurs qui seront prises nous permettrons d'évaluer les performances
des membranes d'osmose inverses et leur état général. Il
existe une poignée de calculs qui sont utilisés pour
évaluer la performance d'un système d'osmose inverse et
également pour des considérations de conception. Un
système OI dispose d'instruments qui affichent la qualité, le
débit, la pression et parfois d'autres données telles que la
température ou les heures de fonctionnement.

Figure 12: compteur électronique de
marque HINAN
Page | 30
2.1.1. L'échantillonnage
Le prélèvement d'un échantillon d'eau est
une opération à laquelle le plus grand soin doit être
apporté. Il conditionne les résultats analytiques et
l'interprétation qui en sera donnée. Il conditionne les
résultats analytiques et l'interprétation qui en sera
donnée. L'échantillon doit être homogène,
représentatif et obtenu sans modifier les caractéristiques
physico-chimiques et microbiologique de l'eau (gaz dissous, matières en
suspension... etc.), ainsi dans des conditions d'aseptie totale.
Le prélèvement consiste à ouvrir la vanne
d'alimentation d'eau et la vanne d'eau osmosée, puis laisser couler
l'eau quelques minutes, rincer avec cette eau puis remplir des bouteilles en
polyéthylène de 500 ml étiquetées. Les
échantillons récupérés sont conservés dans
des glacières à 4°C puis ils sont immédiatement
acheminés au laboratoire pour analyse.
2.1.2. Détermination du pH
La mesure se fait à l'aide du compteur
électronique HINAN HI-9811-5, et possédant une sonde en verre. La
mesure se fait de manière très simple, il suffit de relier la
sonde sur le compteur électronique. Ensuite, on met l'appareil sous
tension puis on appuie sur le bouton pH de l'appareil. Il faut tout d'abord
étalonner l'appareil à l'aide d'une solution tampon
préalablement préparé. Une fois effectué, il suffit
de plonger la sonde dans l'eau qu'on a préalablement recueilli et
attendre quelques secondes que la valeur de pH se stabilise et la relever. La
mesure sera donc faite sur l'eau d'alimentation et sur l'eau du
perméat.
2.1.3. Mesure de la conductivité
La mesure de la conductivité se fait également
à l'aide de l'appareil HINAN HI-9811-5. Après avoir mesuré
le pH de l'eau, on change de paramètre qui est la conductivité,
on appuie sur le bouton EC/TDS pour changer ce paramètre, on plonge la
sonde dans l'eau préalablement recueilli dans un récipient puis
on patiente quelques secondes le temps que la valeur à l'écran se
stabilise puis on
relève la valeur à l'écran. Cette prise
de valeur est valable autant pour l'eau d'alimentation que l'eau du
perméat
2.1.4. La température
La température ici sera toujours mesurer par l'appareil
HINAN HI-9811-5. Pour la mesurer, on ouvrira la vanne d'eau pendant quelques
minutes le temps que la température de l'eau retrouve sa vraie valeur.
Ensuite on va recueillir l'eau dans un récipient, on appuiera sur le
bouton °C ensuite on y plongera la sonde. On attendra que la valeur
à l'écran se stabilise puis on la relèvera.
2.1.5. Pression de l'eau
La pression de l'eau d'alimentation sera mesurée ici
à l'aide d'un manomètre, celle du perméat et du concentrat
sont lues ici sur l'OI sur des manomètres qui y sont fixés.

Figure 13: Lecture débit et pression de
l'alimentation, du perméat et du concentrât
Page | 31
2.1.6. Débit de l'eau
Page | 32
Le débit de l'eau d'alimentation est obtenu suite
à la réalisation du forage après les essais de
pompage. Les débits de concentrât et de perméat sont
obtenus par lecture sur l'OI durant son fonctionnement et est
exprimé en GPM ou en LPM
2.1.7. Le taux de conversion (TC)
Le Taux de conversion d'un système OI est la
relation entre la quantité d'eau osmosée sur la quantité
d'eau d'alimentation.
débit d'eau du
perméat
TC = * 100
débit d'eau d'alimentation
2.1.8. Pourcentage de rejet de sel (%RS)
Le pourcentage de rejet de sels indique la
sélectivité des membranes d'un système d'OI. Elle est
exprimée par :
Concentration en sels dans l'eau
d'alimentation
|
%RS= 1
|
* 100
Concentration en sels dans l'eau du
perméat
|
2.1.9. Pourcentage de passage de sels (%PS)
Elle représente la proportion de sel qui traverse
la membrane d'osmoseur ou celle
contenus dans l'eau osmosée, Elle permet de
caractérisée l'état de fonctionnement de la membrane de
l'osmose inverse.
%PS = (100 - %RS)
2.1.10. Equilibre massique
Une équation de bilan de masse permet de déterminer
si les instruments de mesure de débit et de qualité lisent
correctement ou nécessitent un étalonnage.
Page | 33
Si les instruments ne lisent pas correctement, la tendance des
données de performance que l'on collecte est inutile.
On doit collecter les données suivantes auprès d'un
système OI pour effectuer un calcul du bilan massique :
1.Débit alimentation (gpm)
2. Débit Permeat (gpm)
3. Débit Concentrat (gpm)
4. Conductivité d'alimentation (ìS/cm)
5. Conductivité Permeat (ìS/cm)
6. Conductivité Concentrat (ìS/cm)
L'équation du bilan massique est
Débit d'alimentation x conductivité
d'alimentation = (débit perméat x conductivité
perméat) + (débit concentrât x conductivité
concentrât)
Débit alimentation = débit
perméat + débit concentrât
2.2. Données secondaires
Les données secondaires se définissent comme
étant des données qui ont été collectées (et
parfois analysées) par d'autres. Dans notre cas, nous avons fait une
recherche documentaire des différents rapports d'étude dans le
domaine et aux anciens rapports et mémoires qui ont déjà
été effectué sur les performances d'un systèmes
d'OI ; L'outil internet a été d'un apport particulier à
cette étape. Cette recherche bibliographique nous a permis de collecter
les données relatives à l'environnement géographique de la
zone d'étude, à la connaissance des normes sur la qualité
de l'eau potable définies par la norme camerounaise.
2.3. Traitement des données
Le traitement des données est effectué avec un
ordinateur portable, avec le logiciel MS Word pour le traitement du texte et MS
Excel pour effectuer les différents calculs et concevoir des tableaux et
des graphiques. Aussi, nous avons utilisé le logiciel ArcMap 10.8 dans
le but de localiser notre zone d'étude
Page | 34
Chapitre III : RESULTATS ET DISCUSSION
1. Résultats et interprétations des analyses
physico-chimique
Pour une analyse large des résultats trouvés,
enregistrés dans les tableaux ci-dessous, et pour savoir plus sur la
qualité de l'eau à travers les différentes étapes
de traitement, ainsi sur l'efficacité du procédé d'osmose
inverse.
Les tableaux 1 et 2, récapitulent les paramètres
ainsi que les résultats d'analyses physico-chimiques effectuées
sur l'eau de forage avant et après le traitement.
Page | 35
Tableau 1: Caractéristiques
physico-chimique de l'eau de forage après injection d'hypochlorite de
Sodium
|
Paramètres
|
pH
|
Conductivité
|
TH
Total
|
TH Ca
|
TA
|
TAC
|
SiO2
|
Cl-
|
Cl2
|
Fe
|
Mn
|
Al
|
|
Echantillons
|
|
Normes
|
6,5-9
|
<1000uS/cm
|
<1 °F
|
0°F
|
0°F
|
<1,5°F
|
4 ppm
|
<3°F
|
1,5-
3ppm
|
<3 ppm
|
1,2 ppm
|
0 ppm
|
|
N1
|
7,63
|
2219,1
|
80,95
|
54,43
|
0
|
28,25
|
2,76
|
44,26
|
0,17
|
0,22
|
0,24
|
0,05
|
|
N2
|
7,6
|
2195,3
|
84,2
|
56
|
0
|
31,27
|
6,68
|
49,13
|
0,16
|
0,54
|
0,27
|
0,04
|
|
N3
|
7,44
|
2161,3
|
81,87
|
52,67
|
0
|
30,53
|
3,2
|
49,4
|
0,16
|
0,68
|
0,23
|
0
|
|
N4
|
7,55
|
2135
|
78,53
|
52,8
|
0
|
30
|
2,18
|
48,4
|
0,15
|
1,83
|
0,2
|
0
|
|
N5
|
7,63
|
2081
|
76,73
|
50,07
|
0
|
28,07
|
6,82
|
45,87
|
0,11
|
0,36
|
0,2
|
0,04
|
|
N6
|
7,64
|
2199
|
83,07
|
55,93
|
0
|
30,33
|
7,04
|
49,47
|
0,11
|
0,42
|
0,24
|
0,05
|
|
Moyenne
|
7,581666
7
|
2165,11667
|
80,89
|
53,65
|
0
|
29,74
|
4,78
|
47,75
|
0,14
|
0,67
|
0,23
|
0,03
|
Tableau 2: Résultats d'analyse
physico-chimique de l'eau osmosée
|
Paramètres
|
pH
|
Conductivité
|
TH Total
|
TH Ca
|
TA
|
TAC
|
SiO2
|
Cl-
|
Cl2
|
Fe
|
Mn
|
Al
|
|
Echantillons
|
|
Normes
|
6,5-9
|
<1000uS/cm
|
<1 °F
|
0°F
|
0°F
|
<1,5°F
|
4 ppm
|
<3°F
|
1,5-
3ppm
|
<3 ppm
|
1,2 ppm
|
0 ppm
|
|
N1
|
6,76
|
27,02
|
0
|
54,43
|
0
|
0,43
|
0,03
|
1,39
|
0 ,07
|
0,03
|
0,09
|
0,05
|
|
N2
|
6,76
|
32,7
|
0
|
56
|
0
|
0,50
|
0,08
|
1,50
|
0 ,07
|
0,01
|
0,12
|
0,04
|
|
N3
|
6,71
|
31,93
|
0
|
52,67
|
0
|
0,47
|
0,04
|
1,53
|
0,06
|
0,01
|
0,09
|
0
|
|
N4
|
6,88
|
32,77
|
0
|
52,80
|
0
|
0,53
|
0,13
|
1,50
|
0,06
|
0,04
|
0,06
|
0
|
|
N5
|
6,89
|
28,5
|
0
|
50,07
|
0
|
0,5
|
0,09
|
1,50
|
0,03
|
0,03
|
0,10
|
0,04
|
|
N6
|
6,78
|
30,83
|
0
|
55,93
|
0
|
0,5
|
0,08
|
1,50
|
0,06
|
0,08
|
0,11
|
0,05
|
|
Moyenne
|
6,8
|
30,62
|
0
|
53,65
|
0
|
0,488
|
0,074
|
1,486
|
0,058
|
0,05
|
0,095
|
0,03
|
Page | 36
Page | 37
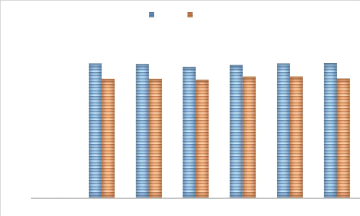
1.1. Le potentiel d'hydrogène
Les mesures du pH des différentes eaux analysées
sont montrées dans la figure suivante :
4
9
8
7
6
5
3
0
2
1
Echantillon N1 N2 N3 N4 N5 N6
0
7,63 7,6 7,64
7,44 7,55 7,63
6,76 6,76 6,88 6,89
6,71 6,78
entrée sortie
Figure 14:Evolution du pH à
l'entrée et à la sortie de l'OI
Selon les données concernant le pH, il est
constaté que l'eau de forage relativement neutre. En effet, les pH
obtenus varient entre 7 et 8. A la sortie de l'osmoseur, une réduction
de pH est enregistrée, elle est l'ordre de ?pH = 0,8. Cette variation
est due principalement à la déminéralisation de l'eau, car
les membranes d'Osmose Inverse retiennent les sels minéraux y compris
les ions hydrogénocarbonate. Une eau osmosée de pH 6,8 environ
est conforme à la norme.
Page | 38
1.2. L'alcalinité
Les résultats obtenus précédemment sur
l'alcalinité sont représentées dans la figure suivante.
35
|
30 25 20 15 10
5
0
|
|
|
Echantillon N1 N2 N3 N4 N5 N6
entrée sortie
|
Figure 15: Variation de l'alcalinité de
l'eau à l'entrée et à la sortie du système d'OI
D'après ces résultats ; on observe une
réduction importante de la valeur de TAC, entre l`entrée et la
sortie d'eau, elle est d'environ 29,47°F et ceci donne un rendement
d'élimination de 98,23%. Toutes ces valeurs sont nettement suffisantes
et indiquent le bon fonctionnement de l'osmoseur, en effet la majorité
des ions carbonates, hydrogénocarbonates sont retenus par les membranes,
ce qui traduit une faible alcalinité dans l'eau osmosée.
Page | 39
1.3. Le titre hydrométrique
Les résultats obtenus concernant le Titre
Hydrométrique des différents échantillons analysés
sont présentés dans la figure suivantes :
Figure 16: Variation du TH à
l'entrée et à la sortie de l'osmoseur
Les résultats obtenus montrent que la moyenne des TH de
l'eau à traiter est de 80,89°F, alors que celle de l'eau
osmosée est nul pour les six échantillons analysés. Cela
indique une élimination complète des ions carbonates de calcium
et de magnésium dans l'eau osmosée, donc ces ions sont retenus
totalement par la membrane d'osmoseur et par la suite entrainées dans
les rejets. Tous les résultats de TH obtenus sont conformes aux normes,
et attestent le bon état des membranes d'osmoseur qui empêchent le
passage des ions CaCO3 et MgCO3.
1.4. La teneur en chlorure
Les résultats obtenus concernant les teneurs en chlorures
des différents échantillons d'eau analysées sont
illustrés dans le tableau 3 et la figure 15.
Tableau 3: teneur en chlorures des
échantillons analysés
|
Echantillon chlorures (°F)
|
Avant
|
Après
|
Taux de
retention
|
|
N1
|
44,26
|
1,39
|
96,85%
|
|
N2
|
49,13
|
1,5
|
96,94%
|
|
N3
|
49,4
|
1,53
|
96,9%
|
Page | 40
N4
|
48,4
|
1,5
|
96,98%
|
|
N5
|
45,87
|
1,5
|
96,72%
|
|
N6
|
49,47
|
1,5
|
96,96%
|
|
Moyenne
|
47,75
|
1,486
|
96,89%
|
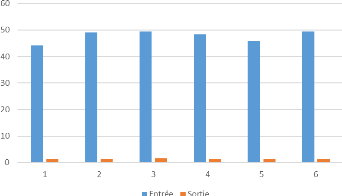
Figure 17: Variation de la teneur en
chlorures à l'entrée et à la sortie de l'osmoseur
Le tableau 3 indique les concentrations du chlorure dans l'eau
brut et le perméat. Les rétentions finales ne sont pas 100% mais
égale à 96,9 % environ pour l'échantillon 3. Globalement
les valeurs du taux de Cl- obtenues sont conformes aux normes, en
effet des rendements très élevés ont été
calculés pour les six échantillons d'eau analysés, soit
une moyenne de 96,89% des chlorures totale éliminés par les
membranes d'osmoseur. Ces résultats peuvent confirmer l'activité
optimale des membranes.
1.5. La teneur en chlore
Les résultats obtenus concernant la teneur en chlore
des différents échantillons analysés sont
présentés dans le tableau 4 et la figure 16.
Page | 41
Tableau 4: variation de la teneur en chlore
à l'entrée et à la sortie de
l'osmoseur
|
Cl2 (ppm)
|
Entrée
|
Sortie
|
|
Echantillon
|
|
N1
|
44,26
|
1,39
|
|
N2
|
49,13
|
1,5
|
|
N3
|
49,4
|
1,53
|
|
N4
|
48,4
|
1,5
|
|
N5
|
45,87
|
1,5
|
|
N6
|
49,47
|
1,5
|
|
Moyenne
|
47,75
|
1,486
|
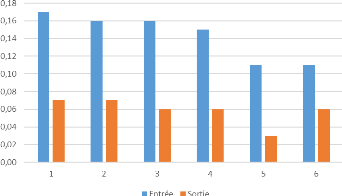
Figure 18: Variation de la teneur en chlore
A partir du tableau 4, nous observons que la concentration du
chlore est faible dans l'eau brute. Bien que des concentrations de l'ordre de
0,01 mg/l ont été enregistrées dans l'eau osmosée,
Cela s'expliquent par l'insuffisance de déchloration. Il est important
à signaler que les membranes d'OI sont très sensible au chlore,
l'accumulation de ce gaz sur la surface des membranes
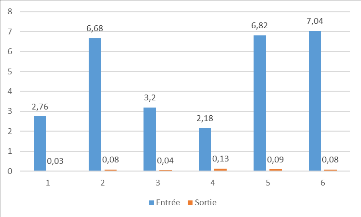
Page | 42
accélère le processus de dégradation et
réduit ainsi la durée de vie de ces membranes.
1.6. La teneur en silice
Le tableau 5 montre que les taux de rejet en silice sont
élevés (98,43%) c'est un facteur positif pour
l'amélioration de la qualité de l'eau osmosée.
Tableau 5: teneur en silice à
l'entrée et à la sortie de l'osmoseur
|
Teneur en silice (mg/L)
|
Entrée
|
Sortie
|
Taux de rejet
|
|
Echantillon
|
|
N1
|
2,76
|
0,03
|
98,91
|
|
N2
|
6,68
|
0,08
|
98,8
|
|
N3
|
3,2
|
0,04
|
98,75
|
|
N4
|
2,18
|
0,13
|
94,4
|
|
N5
|
6,82
|
0,09
|
98,68
|
|
N6
|
7,04
|
0,08
|
98,86
|
|
Moyenne
|
4,78
|
0,074
|
98,43
|
Figure 19: Variation de la teneur en silice
à l'entrée et à la sortie de l'osmoseur
Page | 43
1.7. La teneur en fer
Le tableau 6 et la figure 17 présentent la variation de la
concentration en fer au après traitement pour les six
échantillons analysés.
Tableau 6: Variation de la concentration en
fer
|
Teneur en fer (ppm)
|
Entrée
|
Sortie
|
|
Echantillon
|
|
N1
|
0,22
|
0,03
|
|
N2
|
0,54
|
0,01
|
|
N3
|
0,68
|
0,01
|
|
N4
|
1,83
|
0,04
|
|
N5
|
0,36
|
0,03
|
|
N6
|
0,42
|
0,08
|
|
Moyenne
|
0,67
|
0,05
|
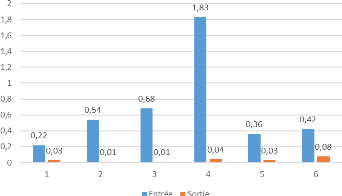
Figure 20: variation de la teneur en fer
à l'entrée et à la sortie de l'osmoseur
D'après la figure 18, on remarque que l'eau de forage
à l'entrée de l'unité d'OI contient une faible valeur de
fer (0,67 mg/l). En outre, le traitement de l'eau par OI à permet de
réduire la concentration moyenne du fer jusqu'au 0,05 mg/l pour les six
échantillons analysés, soit un taux de rejet moyen de 92,53%.
2. Résultats et interprétations des analyses
bactériologiques
Le tableau 7 montre les résultats obtenus lors des
analyses microbiologiques effectuées sur l'eau osmosée.
Tableau 7: Résultats d'analyse
microbiologique de l'eau osmosée
|
Paramètres analysés
|
Méthodes utilisés
|
Résultats en UFC
|
Critères
microbiologiques
|
|
Germes aérobies à 36°C
|
NF en ISO 6222: Juillet 1999
|
0/mL
|
<20/mL
|
|
Germes aérobies à 22°C
|
NF en ISO 6222: Juillet 2000
|
0/mL
|
<100/mL
|
|
Coliformes totaux
|
ISO 9308-1 Septembre 2014
|
0/100mL
|
0/100 mL
|
|
Escherichia Coli
|
ISO 9308-1 Septembre 2015
|
0/100mL
|
0/100 mL
|
|
Entérocoques intestinaux
|
NF en ISO 7899-2: août 2000
|
0/100mL
|
0/100 mL
|
|
Pseudomonas aeruginosa
|
NF en ISO 16266: août2008
|
0/100mL
|
0/100 mL
|
|
Anaérobies sulfito-réducteurs
|
NF en ISO 26461-2 :juillet 1993
|
0/50mL
|
0/50 mL
|
|
Salmonella spp.
|
NF en ISO 19250: juin 2013
|
absence
|
absence
|
|
Vibrio Cholerae
|
CNR cholera/IPP
|
absence
|
absence
|
Les résultats du tableau VIII indiquent que l'eau
osmosée ne renferme aucun microorganisme, en effet les membranes des
quatre osmoseurs font barrières à ces germes, en empêchant
leurs passages, ainsi l'action de l'hypochlorite de sodium qu'est
utilisé comme désinfectant à contribuée grandement
à l'élimination de ces microorganismes. Donc les résultats
des analyses microbiologiques obtenues sont conformes aux normes et à la
réglementation selon la norme camerounaise.
Page | 44
Page | 45
3. Interprétation des mesures de performance de l'osmose
inverse Le tableau 8 résume les résultats obtenus concernant les
paramètres de performances de l'osmoseur
Tableau 8: Paramètres de performance de
l'osmoseur
|
Paramètres
|
Eau d'alimentation
|
Perméat
|
Concentrât
|
|
Pression (bar)
|
1
|
1,3
|
1,3
|
|
Débit (GPM)
|
7
|
5
|
2
|
|
Conductivité (uS/cm)
|
2165,11
|
48,87
|
7200
|
|
Température (°C)
|
24,3
|
/
|
/
|
Ce tableau, permet de déduire les différents
éléments caractéristiques de l'unité osmose
inverse, ainsi que l'évaluation de la performance de l'osmose
inverse.
3.1. Le taux de conversion
Le taux de conversion est connu comme le rapport entre la
quantité ou le débit d'eau osmosée sur celle ou celui de
l'eau brute entrant dans l'installation. En effectuant ce calcul on obtient un
taux de conversion de 71,43%. Du point de vue technique, un taux de conversion
élevé va se traduire par une augmentation importante de la
salinité de la saumure et de sa pression osmotique, cela va diminuer la
pression efficace. Ces résultats sont
généralement très acceptables et montrent la
capacité des membranes d'osmoseurs à traiter une grande
quantité d'eau brute.
3.2. Proportion des rejets et des passages de
sel
Il s'agit donc ici de la capacité des membranes
d'osmoseur à déminéraliser une eau. En se servant des
valeurs contenues dans le tableau 8, on peut donc obtenir un taux de rejet de
97,74% et un taux de passage de sels dans le perméat de 2,26%. Les
résultats obtenus montrent une élimination quasi-totale de la
matière minérale contenus dans l'eau brute, ce qui est conforme
aux performances d'un osmoseur qui doit avoir un taux de rétention des
sels d'au moins 95%.
Page | 46
3.3. Equilibre du bilan massique
En utilisant les données du tableau 8, on
déterminera ainsi donc l'équilibre
massique de l'OI.
Débit d'alimentation x conductivité
d'alimentation = 15155,77
(Débit perméat x conductivité
perméat) + (débit concentrât x conductivité
concentrât) = 14644,35
Nous pouvons donc ainsi remarquer que nous obtenons deux
valeurs différents, nous effectuerons donc un quotient de ces deux
valeurs afin d'en obtenir un pourcentage qui nous permettra donc de
diagnostiquer si nous devons étalonner notre appareil.
P=95,01%
On obtient donc ainsi un deficit de 4,99%,
Nous n'avons donc pas besoin d'étalonner la machine, ce
ratio est acceptable
Page | 47
CONCLUSION ET PERSPECTIVES
En définitive, tout au long de notre stage de
pré-insertion professionnelle au sein de EASY BUY, on est en même
d'affirmer que les objectifs que nous avons définis ont
été atteint. En effet, avec les différentes manipulations
d'un osmoseur à laquelle j'ai participé m'a fait davantage
acquérir de l'expérience et ainsi me familiariser avec un nouveau
processus de traitement de l'eau.
Notre travail avait pour but principal d'apprécier dans
un cadre pratique, le fonctionnement d'une unité d'osmose inverse. De
cette observation, il est important de noter que les membranes d'osmose inverse
ont une durée de vie limitée, sa dégradation au fil du
temps empiète donc sur la qualité de l'eau à la sortie de
l'osmoseur. De ce fait, il est important d'évaluer l'état des
membranes de l'appareil avec une série de test et d'analyse et ainsi que
d'effectuer les calculs appropriés pour le déterminer.
Suite donc aux différents tests qui ont
été effectués et selon les différents
résultats obtenus, on peut noter que l'osmoseur de Ice Service produit
une eau de qualité satisfaisante. En effet le pH, la
conductivité, le TAC, le TH sont conformes aux normes prescrites par
l'OMS.
Toutefois, le purificateur d'eau par osmose inverse de Ice
service ne doit pas recevoir une eau de très mauvaise qualité au
vue d'endommager la machine. Ce purificateur a été conçu
pour traiter les eaux ayant une qualité d'eau de robinet. Il faut donc
comprendre que pour éviter le dysfonctionnement du système il
serait judicieux d'effectuer un prétraitement de l'eau avant passage sur
les membranes d'osmose inverse. La membrane se dégradant au cour du
temps, on pourrait se pencher sur la maintenance des membranes à savoir
les mesures de limitation de l'entartrage et de l'encrassement des membranes et
des mesures à appliquer pour leur décolmatage
Page | 48
REFERENCES BIBLIOGRAPHIQUES
· A. Bouchoux. (2003). Etude de la nanofiltration pour
son intégration dans le procédé de production D'acide
organique, Thèse de l'université Paule Sabatier, Laboratoire de
génie chimique. Toulouse.
· Charcosset, C. (2012). «1 - Principles on
membrane and membrane processes» in Membrane Processes in Biotechnologies
and
Pharmaceutics. Amsterdam, Elsevier, 1-41. [online]
http://www.sciencedirect.com/science/article/pii/B9780444563347000010
(Accessed September 9, 2015).
· Cui, Z. F., Jiang, Y., & Field, R. W. (2010).
Fundamentals of pressure-driven membrane separation processes. Membrane
Technology: A Practical Guide to Membrane Technology and Applications in Food
and Bioprocessing, Butterworth-Heinemann, Elsevier, UK, 12. [online]
http://www.sciencedirect.com/science/article/pii/B978185617632300001
X (Accessed May 10, 2013).
· Encyclopédie. (2006). L'eau. Edition. Encarta.
· Fane, A. G., Tang, C., & Wang, R. (2011). Membrane
technology for water: microfiltration, ultrafiltration, nanofiltration, and
reverse osmosis. Treatise on Water Science, 301-335.
· Judd, S. (2011). «Chapter 2 - Fundamentals»
in The MBR Book (Second
Edition). Oxford, Butterworth-Heinemann, 55-207. [online]
http://www.sciencedirect.com/science/article/pii/B9780080966823100022
(Accessed May 10, 2013).
· Greenlee et al., 2009 Dow Water & Process Solutions,
FILMTECTM Reverse Osmosis Membr. Tech. Man, 2009.
· Maurel A. (2006). Technique séparatives
à membranes : Considérationsthéoriques, Technique de
l'Ingénieur, traité Génie des procédés, J2
790.
· Ouali M S. (2001). Cours de procédés
unitaires biologiques et traitement des eaux. Edition. Office des publications
universitaires. Alger. 156 pages
· Rodier J. (1996). L'analyse de l'eau : eau naturelles,
eau résiduaires, eau de mer. Edition Dunod, France.1384 pages.
Page | 49
| 


