|
UNIVERSITE MARIEN NGOUABI
|
|
|
Ecole Nationale Supérieure d'Agronomie
et de
Foresterie (ENSAF)
|
Année : 2020 N° d'ordre :
MEMOIRE
Pour l'obtention du Diplôme de Master Recherche
Domaine : Foresterie
Parcours : Master Recherche
Spécialité : Gestion Durable des Forêts
Présenté et soutenu publiquement par :
NDZAI Saint Fédriche
Titulaire du Diplôme d'Ingénieur des Travaux de
Développent Rural en Techniques
Forestières
le 22/07/2013
TITRE
Comparaison entre les forêts tropicales adultes
et les forêts secondaires de l'axe
Impfondo-Dongou, Département de la Likouala,
République du Congo
SOUS LA SUPERVISION DE Félix KOUBOUANA,
Maître de Conférences, CAMES,
Université Marien
N'GOUABI
DIRECTEUR DE MEMOIRE : Chauvelin DOUH,
Maître-Assistant, CAMES, Université
Marien N'GOUABI
Jury
Président : Examinateur : Rapporteur :
DEDICACE
Au moment où j'achève ce document, j'éprouve
une pensée pieuse à celle qui a généré ma
vie
sur cette terre et que la mort l'arraché
précocement de ce monde, j'ai cité Adrienne ANAKALA. Paix
à son âme.
A mon père Albert NDZAI ;
A mes enfants Heureux Fédrich NDZAI et Samuel NDZEMONI
NDZAI ; A Niche MVOH LEBANGUI.

La réussite est au bout de l'effort !
II
REMERCIEMENTS
La réussite de ce travail est la résultante des
contributions diverses et d'une franche collaboration que nous avons eue avec
plusieurs personnes.
Ainsi, j'adresse mes vifs remerciements : Ainsi, j'adresse mes
vifs remerciements :
? aux membres du jury : qui vont évaluer ce travail et
d'apporter leurs commentaires constructifs afin de parfaire ce travail ;
? aux autorités du Département de la Likouala
pour la facilitation à l'accès aux informations ainsi qu'à
la zone de recherche ;
Je formule également mes remerciements :
? au Professeur Parisse AKOUANGO, Directeur de l'Ecole
Nationale d'Agronomie et de Foresterie (ENSAF) ;
? au Professeur Donatien N'ZALA, Chef de Département
Master, Maître de Conférences, CAMES ;
? au Docteur Pierre MBETE, et tout le personnel enseignant et
non enseignant de l'ENSAF, merci pour votre soutien.
Je dis un grand merci à mon superviseur de
mémoire : Monsieur Félix KOUBOUANA, Maître de
Conférences, CAMES, pour le temps qu'il n'a cessé de disposer
malgré ses multiples occupations et surtout ses apports
multidimensionnels. La simplicité de nos relations a sans doute
été d'un grand apport pour ce mémoire. Sans vous les
travaux du terrain et les analyses du sol ne devraient pas avoir lieux, merci
infiniment.
Un grand merci au Docteur Chauvelin DOUH
Maître-Assistant, J'ai apprécié votre manière de
diriger, cet apport d'air frais régulier et les commentaires clefs pour
la rédaction. Un grand merci.
Suspense Averti IFO, Maître de Conférences CAMES,
vous avez su trouver la juste place et être présent aux bons
moments ce qui ne devait pas toujours être facile pour apporter votre
soutien et aiguiller ce travail.
Maximilien MBOUKOU, une personne technique mais aussi mentale,
d'une endurance unique. Tu as toujours gardé le moral, le tien mais
aussi le mien même au dernier arbre à
III
mesuré dans la parcelle. Ces moments partagés,
ces discussions sur la vie ont permis de rendre agréable ces
tâches longues et fastidieuses. Merci pour la personne que tu es.
Je tiens à remercier Pr Jean-Marie MOUTSAMBOTE et
Gilbert NSOGOLA, pour les sages conseils, les encouragements et leurs
attachements lors de la réalisation de ce document.
Je pense que nos travaux auraient été
différents sans la présence des uns des autres. Ce fut un
véritable plaisir de partager ces moments en votre compagnie :
Mat-Cheridan MIKOUNGUI-GOMO, Eduarda Ornella KIMPOSSO, Helisha Audrey
Jothé MAKAYA, Stoffenne BISSANGOU, Luc KIMPOLO, NGASSAKI OKA, Amour
MATOUMOUENE, AMBOUA ISSENGUE, Romarick MOUDZALI LEGUIYA merci pour votre
enthousiasme, votre bonne humeur à toute épreuve et votre esprit
d'équipe dans tous ces moments partagés du bureau au bout du
monde.
Je tiens à remercier Guy Foly MPELA, Geoffroy
Sosthène EKANGA, Gunel Elsoman BADIABIO N'SIKA, Alima Brigitte MANTOTA
et Roch BAHAMBOULA. Vos soutiens multiformes ma grandement aider. Trouvez ici
ma profonde gratitude. Merci infiniment.
Mes remerciements vont également à l'endroit de
ceux qui nous ont aidé sur le terrain notamment : Gautier MOKOMBO et
à KOUMOU. C'est grâce à eux que cette forêt a
été explorée avec toute certitude. Merci pour vos appuis
à l'identification et d'autres activités sur le terrain.
Un grand merci à mes amis notamment : Létycia
ATSOUMPARI, Fridolin Vivien ALOUEMBE, Blaise MILANDOU, Rolvy OYEROSSILA,
Isabelle BIDIET BASSOUMBA, Gyside Ocrene Ayou MVOUKAMBA, Ges MILANDOU, Christ
Laffont DIAMBOU, Igor Daddy DOUANI, Floriane Célia TSIBA NGAMBOU, France
BATOUMA, Célie-Léoda MOUNGOUYA-MOUKASSA, Larissa MALONGA MBOUCHI,
Destin Chelvin SIASSIA VINDOU, Stevy Endurance NKELLANKELA, Master Alfir
NGUEBOYO, Clerc Russel ONDON, Priva ONDON pour l'intérêt et les
encouragements qu'ils ont porté à mon cursus scolaire.
Enfin, je ne pourrais terminer sans exprimer mon profond
attachement à mes frères et soeurs notamment : Caroline ASSIMI
NDZAI, Léa NDZAI, Christian NDZAI, Roméo NDZAI, Laure NDZAI,
Aline NDZAI, Urfette NDZAI, Cyrille NDZAI et Guydrine NDZAI. Merci pour votre
soutien et les encouragements tout au long de mes études.
iv
SIGLE ET ACRONYMES
ADEM : Agence de l'Environnement et de la
Maîtrise de l'Energie ; ANOVA : Analyse de la
Variance
CCNUCC : Convention-Cadre des Nations Unies sur
le Changement Climatique CERAPE : Centre d'Etude de la
Recherche sur les Analyses et Politiques Economiques CNIAF :
Centre Nationale d'Inventaire et d'Aménagement des Ressources
Forestière et
Faunique
COMIFAC : Commission des Forêts d'Afrique
Centrale ;
COS : Carbone Organique du Sol ;
ENSAF : Ecole Nationale Supérieure
d'Agronomie et de Foresterie ;
FAO : Organisation des Nations Unies pour
l'Agriculture et l'Alimentation ;
FRA : Evaluation des Ressources
Forestières Mondiale de la FAO ;
IPCC : Intergouvermental Panel on Climate Change
;
IRSEN : Institut National de Recherche sur les
Sciences Exactes et Naturelles
MEF : Ministère de l'Economie
Forestière ;
MO : Matière Organique ;
NERF : Niveau des Emissions de
Références pour les Forêts ;
OIBT : Organisation International des Bois
Tropicaux ;
PAM : Programme Alimentaire Mondial ;
PgC : Petagramme de Carbone ;
PNLCD : Programme Nationale de Lutte Contre la
Désertification,
UMNG : Université Marien Ngouabi ;
UNESCO : Organisation des Nations Unies pour
l'Education, la Science et la Culture ;
V
TABLE DES MATIERES
DEDICACE i
REMERCIEMENTS ii
SIGLE ET ACRONYMES iv
INTRODUCTION 1
Contexte et justification 1
Problématique 2
Objectif général et les objectifs
spécifiques 3
Hypothèses de recherches 3
CHAPITRE 1- REVUE BIBLIOGRAPHIQUE 4
1-1- Définition des concepts 4
1-1-1- La forêt 4
1-1-2- Biodiversité 4
1-1-3- Ecosystème 4
1-1-4- Forêt dense sur terre ferme 4
1-1-5- Forêt dense inondée 4
1-1-4- Forêt secondaire claire 4
1-2- Situation des forêts 4
1-2-1- Rôle des forêts 4
1-2-2- Les forêts tropicales 5
1-2-3- La forêt Congolaise 6
1-3- Variabilité de la distribution des forêts
congolaises 7
1-3-1- Régénération des forêts et
succession végétales 8
I-3-2- Dégradation des forêts 9
I-4- Fonctionnement de l'écosystème forestier
10
I-5- La Matière Organique (MO) dans le sol 10
1-6- Le carbone organique du sol (COS) et l'azote dans le sol
11
1-7- Horizons organiques du sol 12
vi
1-8- Biodiversité et fonctionnement biologique du sol
12
I-9- Perte de biodiversité du sol 13
CHAPITRE 2 : MATERIEL ET METHODES 15
2-1- Site d'étude 15
2-2- Milieu Physique 15
2-2-1-Climat 15
2-2-2- Pédologie 16
2-2-3- Végétation 17
2-2-4- Le Relief 17
2-3- Matériel végétal 17
2-4- Méthodes d'études 18
2-4-1- Sélection des parcelles 18
2-4-2- La mise en place des parcelles 18
2-4-3- Collecte des données floristiques 19
2-4-4- Prélèvement des échantillons du sol
19
2-4-5-Traitement des données 20
2-4-6-- Analyse des données floristique 21
2-4-6-1- Richesse spécifique 21
2-4-6-2-- Abondance des taxons 21
2-4-6-3- Les indices des valeurs d'importance des taxons
(Espèces et familles) 22
2-4-6-4- Les groupes écologiques 22
2-4-7- Les indices de diversité floristique 22
2-4-7-1- Indice de Shannon et Equitabilité de
Piélou 22
2-4-7-2- Le coefficient de similarité 23
2-4-8- Analyse structurale 23
2-4-8-1- Densité à l'hectare 24
2-4-8-2- Surface terrière 24
vii
2-4-8-3- Distribution par classes de diamètres des
groupements 24
2-4-8-4-- Taux de régénération (Tr) 25
2-4-9- Analyse du sol 25
2-4-9-1- Dosage du Carbone, azote et phosphore dans le sol 25
2-4-9-2- Densité apparente du sol 25
2-4-10- Elaboration de l'Analyse en Composante Principale (ACP)
26
CHAPITRE III : RESULTATS ET DISCUSSION 27
3-1- Résultats 27
3-1-1- Composition floristique 27
3-1-2- Analyse de la Fréquence relative 28
3-1-3- Dominance relative d'une espèce et d'une famille
dans les différentes forêts 29
3-1-4- Indice de Valeur d'Importance (IVI) 29
3-1-5- Analyse des groupes écologiques des
déférentes forêts étudiées 31
3-2- Indice de Shannon et d'Equitabilité par type de
forêt 32
3-3- La similitude des différents relevés 32
3-4- La densité à l'hectare et la surface
terrière des différentes forêts 33
3-5- Structure diamètrique de tous types de forêts
34
3-6- Taux de régénération (Tr) 35
3-7- Structure granulométrique moyenne des
différents types de forêts 35
3-8- Les valeurs moyennes des teneurs du Carbone (N), Azote (N)
et Phosphore (P) 36
3-10- Carbone organique moyen, Rapport Carbone/Azote et la
Matière Organique dans les
différentes forêts étudiées 36
3-11- Résultats de l'ACP 37
3-2- Discussion 39
3-2-1- Richesse floristique 39
3-2-2- Analyse des groupes écologiques des
déférentes forêts étudiées 40
3-2-3- Diversité floristique 40
VIII
3-2-4- Paramètres structuraux 42
3-2-5- Les teneurs d'azote, de phosphore et la
granulométrie du sol 44
3-2-6- Le carbone organique du sol 45
3-2-7- La matière organique (MO) et le rapport C/N
46
CONCLUSION ET PERSPECTIVES 48
REFERENCES BIBLIOGRAPHIQUES 48
ix
LISTE DES FIGURES
Figure 1 : Carte du milieu d'étude 15
Figure 2 : Courbe Ombtothermique de la Likouala de 1998-2018
(Station météorologique
d'Impfondo) 16
Figure 3 : Localisation des parcelles 18
Figure 4 : Schéma d'une parcelle Figure 5 :
Matérialisation d'une parcelle 19
Figure 6 : Prélèvement des carottes du sol
Figure 7 : La Carotte du sol 20
Figure 8 : l'Indice de valeur d'Importance par famille 30
Figure 9 : Groupes écologiques des forêts
étudiées 31
Figure 10 : Les valeurs des indices de Shannon et
d'Equitabilité 32
Figure 11 : les valeurs du coefficient de Sorensen 33
Figure 12 : Distribution diamétrique : a) FAL; b) FAC;
c) FSMa ; d) FSMu et f) FAG 34
Figure 13 : Résultats de l'ACP 37
LISTE DES TABLEAUX
Tableau I : Vue d'ensemble des principaux organismes du sol en
fonction de leur taille (FAO,
2017). 13
Tableau II : Composition floristique des différentes
forêts étudiées 27
Tableau III : Les valeurs des spectres brut et
pondéré de quelques familles les plus
importantes 28
Tableau IV : les espèces dominantes dans les
différentes forêts 29
Tableau V : Dominance relative d'une famille 29
Tableau VI : Indice de Valeur d'Importance par espèce
30
Tableau VII : Les valeurs de la Surface terrière (G) et
de la Densité à l'hectare 33
Tableau VIII : Taux de régénération dans
les différents types de forêt. 35
Tableau IX : Moyennes des teneurs en argile, limon et sable
des différents types de forêts
étudiées 35
Tableau X : Teneurs moyenne en carbone (C), azote (N) et
phosphore (P) 36
Tableau XI : Valeurs du stock moyen de carbone, du rapport
carbone/azote (C/N) et la
Matière Organique (MO) 37
1
INTRODUCTION
Contexte et justification
La gestion durable des forêts tropicales est un enjeu
plus que jamais d'actualité, dans un monde où la croissance
démographique et le développement économique se traduisent
par des besoins croissants en produits forestiers et en espace foncier (Forni
et al., 2019). En outre, les forêts accueillent entre 50 et 90 %
de toutes les espèces sur terre et font vivre 1,6 milliards de personnes
et fournissent un grand nombre de services écosystémiques, dont
la régulation du cycle de l'eau (Friends of the Earth International,
2008). Les connaissances acquise sur la superficie forestière, la
composition floristique et sa dynamique fournissent des informations qui sont
essentielles à la mise en place et au suivi des politiques
environnementales et économiques (Pascal, 2003). Ces rôles
essentiels des forêts sont pris en compte par les accords
multilatéraux sur l'environnement tels que la Convention-Cadre des
Nations Unies sur le Changement Climatique (CCNUCC), COMIFAC (2013), pour
réduire la dégradation de celles-ci, car la dégradation
forestière est l'un des facteurs majeurs de destruction des forêts
affectant ainsi le bien-être de millions de personnes.
Or, 13 millions d'hectares de forêt tropicale, dont
environ 6 millions d'hectares de forêt primaire, une zone
équivalente à deux fois la taille de la Belgique disparaissent
chaque année (FAO, 2005 ; Mangion, 2010). Il est estimé que
seulement 21 % des forêts mondiales sont encore intactes (Potapov, 2008).
Et environ 547,8 millions de tonnes de carbone séquestrées
(ONU-REED, 2. Ces forêts tropicales contiennent en général
des stocks de carbones plus importants et sont biologiquement plus
diversifiés, lorsque ces forêts sont défrichées ou
dégradées, le carbone stocké est relâché dans
l'atmosphère sous forme de dioxyde de carbone et d'autre gaz à
effet de serre (PFBC, 2005). Cependant, il sied de faire ressortir que la perte
de leur surface, de leur biodiversité et l'augmentation des
émissions des gaz à effet de serre (GES) liées à
leurs déforestations et dégradations sont dues aux actions
anthropiques en zone tropicale (Molto, 2012 ; Bocko et al., 2017 ;
FAO, 2017). La déforestation et la dégradation des forêts
contribuent approximativement de 12 à 20 % aux émissions globales
des GES dans l'atmosphère (Pearson et al., 2005). Alors que, la
caractérisation de la structure forestière des forêts
tropicales constitue un enjeu majeur pour la gestion des forêts
naturelles que les objectifs prioritaires soient l'exploitation
forestière, la conservation des biomes forestiers ou l'estimation des
stocks de carbone. A large échelle, la structure forestière varie
avec le climat et la géomorphologie.
2
Problématique
Les forêts tropicales se caractérisent par une
diversité végétale très importante et suscitent un
grand intérêt de la communauté des chercheurs pour ses
rôles multiples dans le maintien de l'équilibre global, la
préservation de l'environnement (rôle dans l'atténuation et
l'adaptation aux changements climatiques) que pour l'alimentation et la
santé des milliers de populations qui dépendent directement
d'elles. La diversité, la structure et le fonctionnement des
forêts tropicales humides sont particulièrement complexes et
insuffisamment connus. Cette méconnaissance est un obstacle pour la
gestion durable de ces forêts.
Par ailleurs, les forêts congolaises d'une superficie de
23,5 millions hectare (ha) pour 65 % du territoire national (NERF, 2016), avec
un potentiel estimé à environ 6000 espèces floristiques
(Moutsamboté, 2012), font partie intégrante du Bassin du Congo,
d'où l'enjeu de leur gestion qui intègre les stratégies
sous régionales et internationales. Ainsi, la gestion durable des
forêts du Congo et celles du Département de la Likouala requiert
une bonne connaissance de ces écosystèmes, ce qui ne peut se
faire que par des études approfondies (FAO, 2010).
De nombreuses études de connaissances de la ressource
floristique ont été faites à travers le Congo. A ce jour,
très peu d'études allant dans cette lancée ont
été menées dans la forêt de la Likouala, on peut
donc citer les travaux de : (Ifo et al., 2016 ; Bocko, 2018 ;
Moutsamboté, 2012 ; Harris et al., 2008 et 2011, Koubouana et
al., 2018 ; Ndzai, 2015), très peu sur le carbone organique
(Ifo et al., 2017; Greta et al., 2017 ; Bocko, 2018 ).
Cependant, très peu sinon aucune étude botanique et du carbone
organique sur une grande superficie n'a été entreprise dans les
forêts adultes (sur terres fermes à Celtis adolfi-friderici
Engl., inondées à Guibourtia demeusei (Harms)
Léon., et inondables à Lophira alata Banks ex
C.F.GaertN.) et secondaires (à Musanga cecropioides R. Br. et
à Macaranga monandra Mull- Arg.) de cette zone. Les travaux de
Ndzai, 2015 ; Ifo et al., 2016 ; Koubouana et al., 2018 ont
été réalisées dans ces forêts que sur des
petites superficies de 3,5 ha. Alors que, cette zone forestière connait
aujourd'hui une régression progressive de sa superficie due à la
déforestation et à la dégradation forestière
causée par les activités anthropiques notamment l'agriculture
itinérante sur brulis, les plantations de palmiers à huile, de
Cacao. C'est dans l'optique d'approfondir les connaissances sur la
diversité floristique et le stock de carbone organique de cette zone que
l'étude a été menée sous le thème «
Comparaison entre les forêts adultes et les forêts secondaires de
l'axe Impfondo-Dongou » dans le but d'apporter des informations sur
le fonctionnement des écosystèmes forestiers et de comprendre
l'impact des activités
3
anthropiques sur cette forêt afin de garantir une
gestion durable et rationnelle. Car la conservation à long terme de la
biodiversité dépend fondamentalement de la connaissance de la
structure, de la richesse spécifique et des caractéristiques
écologiques de la végétation.
Objectif général et les objectifs
spécifiques
Cette étude a pour objectif général de
contribuer à la meilleure connaissance de la
composition floristique en vue de comprendre le fonctionnement
des différents types
forestiers de l'axe Impfondo-Dongou.
De manière spécifique, elle vise à :
> déterminer les espèces caractéristiques
de ces forêts ;
> évaluer la diversité floristique de ces types
de forêts ;
> comparer les paramètres structuraux des forêts
secondaires et des forêts adultes;
> estimer les stocks de carbone organique.
Hypothèses de recherches
Dans le cadre de la présente étude, les
hypothèses suivantes ont été émises et
vérifiées :
y' les forêts adultes et secondaires de la zone
étudiée ont des espèces caractéristiques
différentes ;
y' c'est dans la forêt adulte que la diversité
floristique est maximale ;
y' c'est dans les forêts adultes que l'on trouve les
paramètres structuraux les plus importants ;
y' les stocks de carbone organique sont plus important dans les
forêts adultes que dans les forêts secondaires ;
Ce document rapporte ainsi les résultats de cette
étude et comprend trois parties bien distinctes à savoir : revue
bibliographique, matériel et méthodes du travail ;
résultats et discussions. Ainsi, dans la partie matérielle et
méthodes, nous présentons, la zone d'étude et les
méthodes adoptées, comprenant notamment le choix et
l'installation des parcelles, la collecte des données floristique et du
carbone, le traitement et l'analyse des données. Dans la partie
résultat, nous présentons et commentons les données
recueillies lors des travaux d'inventaire floristique ainsi que les
données issues de l'analyse du carbone du sol. Enfin, dans les
discussions, nous interprétons les résultats des analyses
floristiques et structurales ainsi celles du carbone organique obetenus par
rapport à la méthodologie utilisées
4
CHAPITRE 1- REVUE BIBLIOGRAPHIQUE
1-1- Définition des concepts
1-1-1- La forêt
Selon la FAO (2010), la forêt est une portion de terre
occupant une superficie de plus de 0,5 hectares avec des arbres atteignant une
hauteur supérieure à cinq (5) mètres et avec un couvert
arboré de plus de 10 %.
1-1-2- Biodiversité
La biodiversité est une contraction de diversité
biologique. Elle fait donc référence à la
variété du monde vivant. C'est synonyme de la vie sur terre
(Tilman et Nature, 2000).
1-1-3- Ecosystème
Un écosystème est un système biologique
formé par un ensemble d'espèces associées,
développant un réseau d'interdépendances dans un milieu
caractérisé par un ensemble de facteurs physiques, chimiques et
biologique (Rousse, 2010).
1-1-4- Forêt dense sur terre ferme
Peuplement fermé avec des arbres et des arbustes
atteignant diverses hauteurs. La présence
des graminées sur le sol est quasi-absente (UNESCO,
1973).
1-1-5- Forêt dense inondée
Formation forestière sur des sols gorgés d'eau
(UNESCO, 1973).
1-1-6- Forêt secondaire claire
Peuplement ouvert avec des arbres de petite et moyenne taille
dont les cimes sont plus ou
moins jointives. L'ensemble du couvert largement filtré
par la lumière. Au sol, les graminées sont peu abondantes et
peuvent être mélangées à d'autres plantes
suffrutescentes ou herbacées (Yangambi, 1956).
1-2- Situation des forêts
1-2-1- Rôle des forêts
Les forêts jouent de nombreux rôles tels que
fournir des matières premières renouvelables, assurer le maintien
de la biodiversité et la protection des ressources terrestres et
aquatiques (FAO, 2006). Elles jouent aussi un rôle important dans le
cycle des émissions de gaz à effet de serre, agissant à la
fois comme un piège et une source de dioxyde de carbone, de
méthane et d'oxyde d'azote. Le rôle des écosystèmes
forestiers dans le cycle mondial du carbone a pris
5
de l'importance depuis que le monde se préoccupe
davantage du changement climatique (Megevand et al., 2013),
d'où elles jouent un rôle dans la quantité de dioxyde de
carbone présente dans l'atmosphère. Quand les forêts
poussent, elles « puisent » le carbone de l'atmosphère et le
stockent dans le bois, les feuilles et le sol (Phillips et al., 1998 ;
Malhi & Grace, 2000 ; Pan et al., 2011). Etant donné que
les forêts peuvent absorber du carbone et le stocker pendant longtemps,
elles sont considérées comme des « puits de carbone » ;
on estime que les écosystèmes forestiers renferment plus de
carbone que l'atmosphère toute entière (FAO, 2006). Les
forêts jouent également un rôle vital dans
l'atténuation du changement climatique mondial et contribuent à
la conservation des sols et de l'eau dans nombre d'écosystèmes
fragiles (FAO, 2016). Elles fournissent toute une série de produits, non
seulement du bois rond industriels et du bois à brûler, mais
également des aliments (FAO, 2006).
1-2-2- Les forêts tropicales
La forêt tropicale humide se distingue dans trois zones
différentes dans le monde : la zone amazonienne, en Amérique ; la
zone indo-malayse, en Asie et la zone guinéenne, en Afrique. Ses
caractéristiques essentielles sont celles de formations denses humides,
sempervirentes ou semi-caducifoliées. Excepté les conditions
édaphiques, climatiques, hydrologiques ou biotiques
particulières, la forêt tropicale vit sous de nombreuses variantes
écologiques et floristiques dans ces trois zones (Sita, 1989).
Les forêts tropicales couvrent des surfaces
considérables. Elles représentent plus de deux milliards
d'hectares et sont très importantes pour la santé de la
planète. La majorité se trouve dans les pays en voie de
développement. La meilleure solution serait de les protéger ou au
moins d'assurer la meilleure gestion possible en particulier pour celles qui
sont déjà dégradées (FAO, 2002).
Les prairies permanentes et les pâturages extensifs
(terres de parcours ou range-lands) couvrent plus de 3 milliards d'hectares
dont la majorité se trouve dans les zones sèches ; l'état
de dégradation de ces sols est estimé à 14 à 31
%.
Selon l'évaluation mondiale de la dégradation du
sol (Oldeman et al., 1991), les sols dégradés
représentent une grande proportion des différents types de sol,
quel que soit le genre d'occupation.
La dégradation physique et chimique, qui sont les
principaux et premiers processus, ont très souvent pour résultat
la dégradation biologique. L'érosion par l'eau et par le vent
sont de loin, quantitativement, les processus de dégradation les plus
importants. Les principales causes sont
6
le déboisement, le surpâturage et la gestion
inappropriée du sol. La perte de matière organique n'a pas
été identifiée comme un processus de dégradation
spécifique, mais en gros, la moitié des sols chimiquement
dégradés sont appauvris.
La teneur en matière organique du sol est
généralement plus basse là où la dégradation
est plus grave. Par conséquent, la quantité de carbone
séquestré par le réaménagement des sols
dégradés sera considérable. Pour les sols tropicaux, les
sols dégradés représentent 45 à 65 %, selon le
continent. Cette situation fait espérer de très grandes
possibilités de séquestration du carbone dans les sols tropicaux
dégradés. Les bénéfices attendus comprendront les
améliorations des propriétés chimiques, la
biodisponibilité des éléments (une plus grande
fertilité), et la réaction contre la dégradation physique,
en particulier l'érosion. Par conséquent, la séquestration
du carbone aidera à restaurer la qualité des sols
dégradés (FAO, 2002). L'extension des forêts tropicales n'a
fait que fluctuer tout au long de l'histoire et beaucoup de formation que nous
connaissons actuellement n'ont pas plus de 2000 ans. Les forêts
tropicales sont donc des milieux très dynamiques et chaque formation est
nécessairement l'aboutissement d'un processus plus ou moins long, dont
on connait rarement le début et la fin (Vande, 2004).
La forêt tropicale est la forêt
caractéristique des régions tropicales et équatoriales.
Elle représente environ 10 % de la surface du globe. C'est un milieu
fragile qui est d'une importance cruciale pour le bien-être de l'ensemble
de la planète. Elle nous fournit une multitude de produits utiles (bois,
fruits, légumes, champignons, médicament/molécules, huiles
essentielles, gomme, résines cires, gibier, etc.). La
biodiversité des forêts tropicales dépasse de loin celle de
tous les autres écosystèmes terrestres de la planète. Ces
forêts abritent en effet au moins 50 % de toutes les espèces
végétales et animales du monde (FAO, 1999). Les forêts
tropicales jouent un rôle important dans la régulation du climat
à l'échelle mondiale en constituant des « puits de carbone
» : elles absorbent, via la photosynthèse, le CO2 de
l'atmosphère et le conserve sous forme de biomasse (le bois) (Houghton
et al., 2001).
Les forêts tropicales humides sont des
écosystèmes complexes composés des populations de
nombreuses espèces d'arbres qui interagissent entre elles, avec les
populations animales et le milieu physique (Jesel, 2007).
1-2-3- La forêt Congolaise
La zone guinéenne ou plus précisément le
Centre Régional d'endémisme guinéo-congolais dont la flore
est d'environ 6.000 espèces végétales (Moutsamboté,
2012), s'individualise par huit familles d'angiospermes endémiques,
vingt-huit autres familles caractéristiques et une
7
cinquantaine de genres endémiques. La
quasi-totalité de tous ces éléments floristiques, se
retrouvent dans la forêt dense humide congolaise (Sita, 1989). La
République du Congo, pays d'Afrique centrale, située de part et
d'autre de l'équateur s'étend sur une superficie de 342 000
km2 (Vennetier, 1968 ; Mengho, 2017), possédant une
population d'environ 4 millions d'habitant (CN-REDD, 2016). Ce pays abrite un
important écosystème forestier d'environ 23,5 millions
d'hectares, qui représente 69 % du territoire national (CNIAF, 2015) et
12 % du massif forestier du Bassin du Congo (CN-REDD, 2016 ; FAO, 2010). Selon
la FAO (2010) les forêts congolaises ont environ 15 millions de
forêts productives et 7 millions de forêts inondées ou
inondables. Elles sont reparties de façon inégale en deux zones.
La zone Nord occupe environ 17,4 millions d'hectares tandis que la partie Sud
ne regorge que 4,7 millions d'hectares environ (CN-REDD, 2016).
Comme tout pays d'Afrique centrale, la République du
Congo dispose d'une diversité biologique impressionnante, tant pour les
écosystèmes que pour les espèces floristiques et fauniques
(Moutsamboté, 1985 et 2012). Les sites éligibles à la
production du bois couvrent près de 15 millions d'hectares dans les
Départements de la Sangha, de la Likouala de la Cuvette et de la
Cuvettes-Ouest, où il y a abondance des bois rouges prisés
(Sapelli et Sipo notamment) (MEF, 2006). Environ 30 % de la production provient
des massifs du Chaillu et du Mayombe, au Sud, riche en essences Limba et
Okoumé (Le Roy et Demerele, 2011). Les forêts congolaises se
répartissent en trois grand ensembles à savoir: le Mayombe, le
chaillu et la forêt du Nord-Congo (Vennitier, 1968 ; MEF, 2006), mais
c'est la forêt du Nord-Congo qui, occupe la plus vaste superficie.
1-3- Variabilité de la distribution des
forêts congolaises
La forêt congolaise est qualifiée de formation
dense humide sempervirente selon Aubreville et Letouzey : la forêt se
développe sur un substrat ayant une structure géologique
caractérisée, dans la partie Nord et Nord-Ouest du pays, par une
épaisse couche de terrains sédimentaires ou quaternaires, et dans
la partie sud-ouest et Nord-Ouest, par deux zones précambriennes.
(Aubreville, 1958 ; Letouzey, 1957). De plus, cette forêt présente
des aspects divers, en fonction notamment de l'humidité du sol. Sita,
(1989). On distingue les forêts sur terre ferme et les forêts
marécageuses (Venntier, 1968 ; Moutsamboté, 1985 et 2012). Ainsi,
l'écosystème forestier en République du Congo n'est pas
uniforme sur l'ensemble du territoire national. Il est conditionné par
un certain nombre des facteurs abiotiques (température,
pluviométrie, éclairement), ou de nature climatique et de nature
édaphique ou lié au sol (nature chimique, fertilité du
sol, rapport avec l'eau, texture). Lambin et al. (2003) ont
identifié quatre grands
8
groupes de facteurs qui peuvent être
considérés comme les causes immédiates de la
déforestation et la dégradation de la forêt,
c'est-à-dire les facteurs qui agissent directement sur elles. Il s'agit
principalement : de l'extension des infrastructures ; de l'expansion de
l'agriculture ; de l'extraction du bois et autres facteurs.
1-3-1- Régénération des forêts
et succession végétales
Dans le sens des forestiers, la
«régénération naturelle» est une technique qui
fait appel à l'ensemencement spontané : elle s'oppose aux
techniques d'enrichissement ou de plantation (Alexandre, 1989). Dans le sens
des écologistes, c'est l'ensemble des processus dynamiques qui
permettent de reconstituer un couvert qui a été entamé. La
régénération naturelle est la faculté d'un
écosystème à se reconstituer spontanément
après une destruction totale ou partielle du couvert forestier. Elle
comprend l'ensemble des processus biologiques et écologiques qui
permettent aux peuplements de se renouveler (Baraloto, 2003). Elle conduit
souvent au développement d'un nouveau système forestier qui
retrouve progressivement de nombreuses propriétés de
l'écosystème forestier précédent (Cramer et
al., 2008).
Les successions primaires caractérisent
l'établissement d'une biocénose climacique sur un biotope
récemment formé. La dynamique d'occupation se fait sur une
surface nue au départ (Jaufret, 2001). Pour (Fournier et al.,
2001), les successions primaires correspondent à l'installation des
êtres vivants dans un milieu comme un sol nu qui n'a jamais
été peuplé. Les organismes qui s'installent en
1er sont qualifiés de pionniers.
Les successions secondaires correspondent au processus de
reconstitution de la végétation dans un milieu qui a
déjà été peuplé mais dont les êtres
vivants ont été éliminés totalement ou
partiellement par des modifications climatiques, géologiques
(érosion) ou par l'intervention de l'homme (défrichement). Une
succession secondaire conduit souvent à la formation d'un dis climax
différent du climax primitif (Alexandre, 1989).
Elles s'observent dans les milieux où une
végétation développée est détruite par une
agression externe (Diouf, 2011). Cette végétation reposait sur un
sol évolué, en règle générale plus fertile
qu'un sol jeune, et la dynamique conduit alors à un retour sur place
d'une formation qui existait avant la perturbation. Dans ce cas
«régénération naturelle» est synonyme de
«reconstitution». Au sens de Tansley (Alexandre, 1989), on parlera de
dynamique autogène et allogène. Quand le facteur d'agression est
l'homme, on peut parler de série anthropogène.
Le déroulement des successions est ainsi très
variable, les espèces diffèrent en fonction de la situation
géographique du site, de son sol, de son état de
dégradation. La durée même du
9
processus de reconstitution n'est pas identique dans tous les
cas. Dans chaque région, les successions sont visiblement très
marquées par le cadre éco-climatique, par d'autres facteurs du
milieu naturel (notamment édaphiques), mais aussi par des contraintes
imposées par l'homme (Fournier et al., 2001).
Clements (1936), pense que la succession secondaire est synonyme
du processus de reconstitution de la végétation après
destruction totale ou partielle d'une communauté préexistante.
I-3-2- Dégradation des forêts
La dégradation des forêts et des terres est un
grave problème, en particulier dans les pays en développement. En
2000, la superficie totale de forêts et de terres boisées
dégradées dans 77 pays tropicaux était estimée
à environ 800 millions d'hectares, dont quelques 500 millions d'hectares
de forêts primaires et secondaires (OIBT, 2002). La dégradation
des forêts est une des principales sources d'émissions de gaz
à effet de serre (GES), même si son rôle n'a pas
été estimé à l'échelle Mondiale. Dans la
forêt amazonienne brésilienne, la dégradation est
responsable de 20 % des émissions totales (Asner et al., 2005).
En Indonésie, le stock forestier a diminué de 6 % par an et la
dégradation des forets en est la cause pour les deux tiers, alors que la
déforestation ne représente qu'un tiers (Marklund & Schoene,
2006). En Afrique, le taux annuel de dégradation des forêts
avoisine les 50 % du taux annuel de déforestation (Lambin et
al., 2003). La dégradation des forêts se
réfère à la réduction de la capacité d'une
forêt de produire des biens et des services (OIBT, 2002). La
capacité comprend le maintien de la structure et des fonctions
d'écosystèmes (OIBT, 2005). Une forêt
dégradée ne fournit qu'une quantité limitée de
biens et services et ne conserve qu'une diversité biologique restreinte.
Elle a perdu la structure, la fonction, la composition des essences et/ou la
productivité normalement associées à la forêt
naturelle (OIBT, 2002). En zone forestière, la dégradation de la
végétation se manifeste par l'apparition des espèces
héliophiles telles que : Musanga cecropioides, Trema orientalis,
Harungana madagascariensis, Alchornea cordifolia, Macaranga spp., Pteridium
aquilinum, Chromolaena odorata. Dans les zones forestières
dégradées ou secondarisées, le sous-bois est souvent
dominé par les différentes espèces appartenant à la
famille des Marantaceae, de Zingiberaceae et de Commelinaceae
(Moutsamboté, 2012). Le raccourcissement de la durée des
jachères engendre la dégradation des terres qui a pour
conséquence l'apparition de nouveaux faciès forestier
constitués essentiellement des espèces héliophiles (PNLCD,
2006).
10
I.4. Fonctionnement de l'écosystème
forestier
L'écosystème représente une unité
fonctionnelle qui se perpétue de façon autonome au travers du
flux de l'énergie et du cycle de la matière entre ses
différentes composantes en constante interaction (Ramade, 1993). La
compréhension du fonctionnement de la forêt repose sur la
connaissance des mécanismes qui régissent les flux
d'énergie et de matière au sein de l'écosystème et
leur interaction avec le milieu environnant. Les flux carbonés et les
flux hydriques constituent les principaux régulateurs de ce
fonctionnement.
L'intensité des flux de dioxyde de carbone et de vapeur
d'eau entre l'atmosphère et le couvert forestier est régie par
les processus de la photosynthèse, de la respiration et de
l'évapotranspiration. Le feuillage joue un rôle
privilégié dans ces mécanismes car il se trouve à
l'interface entre l'atmosphère et la plante et c'est dans les feuilles
que se réalisent les principales réactions biochimiques vitales
pour l'arbre.
Dans le cycle du carbone, la photosynthèse et la
respiration cellulaire sont des processus clés. Par le biais de la
photosynthèse, à partir du CO2 atmosphérique
absorbé, des glucides sont fabriqués, permettant la
synthèse des principales molécules organiques carbonées
nécessaires au développement de la plante. La respiration est
aussi une partie importante du bilan carboné, car elle consomme au moins
50 % du carbone assimilé par photosynthèse (Campbell, 1993). Elle
permet à la plante d'assurer le renouvellement continu des constituants
cellulaires.
I.5. La Matière Organique (MO) dans le sol
Le sol constitue une ressource non renouvelable du patrimoine
naturel. C'est pourquoi il convient d'adopter une gestion qui garantisse le
maintien de sa fertilité. Sur le long terme, la réserve
d'éléments minéraux des sols est alimentée par deux
sources: les apports atmosphériques et l'altération des
minéraux des sols (Ebuy et al., 2016).
Les constituants organiques du sol proviennent de la
décomposition de la matière organique végétale,
animale et bactérienne. Ces substances sont en constante
évolution dans le sol et sont transformées par divers processus
géochimiques à travers le temps (Paradis, 2016). Comme elle joue
un rôle majeur sur les propriétés du sol, il est important
que la matière organique soit constamment renouvelée (Brady et
Weil, 2008). D'ailleurs, la matière organique est un important
indicateur de fertilité et de qualité des sols, c'est pourquoi ce
paramètre est souvent le premier a mesuré lors de l'étude
d'un sol et de son écosystème (Paradis, 20016). Les
matières organiques du sol constituent le réservoir de carbone
organique le plus important, devant la biomasse des végétaux. Le
premier mètre des sols mondiaux
11
stocke entre 1 500 et 2 400 milliards de tonnes de carbone
organique. Les pertes de sols et des matières organiques qu'ils
contiennent remettent en cause leur rôle de puits de carbone et
augmentent les émissions. Une réduction de 5 % des stocks
représenterait l'équivalent de deux à quatre années
d'émissions (Agence de l'Environnement et de la Maitrise de l'Energie en
sigle ADEM, 2014).
La MOS joue un rôle critique dans la stabilisation de la
structure du sol, la rétention et la libération de nutriments
pour les végétaux et le maintien de la capacité de
rétention des sols. Elle est ainsi un indicateur clé de la
productivité agricole, mais aussi de la résilience
environnementale. Le renouvellement de la MOS influence le fonctionnement des
écosystèmes et le réchauffement climatique. La
décomposition de la MOS libère des nutriments minéraux.
Ces derniers deviennent disponibles et permettent ainsi la croissance des
végétaux (Van der Wal et de Boer, 2017). Une meilleure croissance
des végétaux et une plus grande productivité contribuent
ainsi à assurer la sécurité alimentaire (FAO, 2017).
Différents réservoirs de MOS peuvent être identifiés
en fonction du temps nécessaire à sa pleine décomposition
et au temps de permanence de ses produits dans le sol (temps de renouvellement)
Gougoulias et al. (2014) :
y' Le réservoir actif : renouvellement
en quelques mois ou quelques années ;
y' Le réservoir passif :
renouvellement pouvant atteindre le millier d'années.
Plusieurs organismes du sol assurent des fonctions
essentielles liées à la fertilité et à la
productivité des écosystèmes forestiers, contribuant
à la remise en circulation des éléments nutritifs. De
plus, la faune du sol constitue un maillon important de la chaîne
alimentaire terrestre, ce qui en fait un élément indispensable
pour le maintien de plusieurs autres espèces animales en milieu
forestier (Moore et al., 2002).
1-6- Le carbone organique du sol (COS) et l'azote dans
le sol
Le grand cycle du carbone, dans lequel entre le COS, prend en
compte le cycle du carbone dans le sol, mais aussi dans la
végétation, l'océan et l'atmosphère. On estime le
contenu de COS à environ 1 500 PgC entre 0 et 1 mètre de
profondeur (FAO, 2017). Cela représente plus de carbone que ce qui est
actuellement contenu dans l'atmosphère (environ 800 PgC) et dans la
végétation terrestre (500 PgC) réunis (FAO, 2015).
Selon ADEM (2014), les sols stockent, sous forme de
matières organiques, deux à trois fois plus de carbone que
l'atmosphère. Leur utilisation engendre des flux de CO2 et a des
répercussions sur l'évolution du climat. Aujourd'hui, l'enjeu est
de limiter les pertes lorsqu'elles sont liées au retournement des terres
et d'accroître les stocks par la promotion de
12
pratiques agricoles et sylvicoles adaptées.
L'azote est stocké dans le sol sous forme de matières
organiques (débris morts ou microorganismes). Le carbone des sols acides
étant sous forme de matière organique, les stocks d'azote et de
carbone sont étroitement liés. Les phénomènes de
mise à disposition pour la plante de l'azote sont donc dépendants
des processus biologiques de décomposition des matières
organiques mortes et de la dynamique de renouvellement des microorganismes du
sol (essentiellement des bactéries et des champignons) Bakker et Augusto
(2009).
1-7- Horizons organiques du sol
Les débris végétaux frais sont
transformés plus ou moins rapidement par les organismes du sol en
fonction du degré d'activité biologique. Il en résulte
différents niveaux de décomposition décrits comme horizons
organiques: l'horizon « L » constitué essentiellement de
litière fraîche non transformée, l'horizon « Of »
où les débris végétaux sont
décomposés (fermentés), et enfin l'horizon « Oh
» dans lequel la matière organique est, dans son ensemble,
déjà décomposée en humines (OFEV, 2016).
Selon Bernhard-Reversat (1972) en Côte d'Ivoire, on
trouve sur le sol du plateau une couche de litière toujours
présente, bien que moins épaisse en saison des pluies. Au-dessous
on observe une couche fine (0,5 à 1 cm) de débris
végétaux fragmentés, puis un horizon humifère de 2
à 4 cm d'épaisseur dans lequel les racines fines sont abondantes
et forment par endroits un feutrage épais. Dans le talweg la couche de
litière, présente en saison sèche, disparaît en
saison des pluies, et laisse apparaître le sol nu avec quelques feuilles
éparses. On n'observe pas sous la litière d'horizon organique ni
d'horizon humifère.
1-8- Biodiversité et fonctionnement biologique
du sol
Les changements de la biodiversité sont évidents
quand il y a déboisement ou lorsque l'on passe de la prairie à la
culture (Houghton et al., 2001). Lors des reboisements, ils vont
dépendre du type de forêt établi. Des systèmes
d'agroforesterie bien gérés impliquent aussi une
biodiversité importante (Pan et al., 2011).
Généralement la biodiversité des
mammifères est préservée en référence
à la forêt, mais le nombre d'espèces d'oiseaux et de
végétaux diminuent respectivement de moitié et d'un tiers
(420 à 300), IPCC (2000). La plupart des systèmes de cultures
intensives ont conduit dans le passé à une diminution importante
de la biodiversité, ceci parallèlement à la
décroissance de la matière organique par la culture et
l'utilisation des pesticides (Rovira, 1994). Pour les sols cultivés en
permanence, l'augmentation de la biodiversité relative à
l'augmentation de la matière organique concerne principalement la
biodiversité du sol (Copley, 2000). Cette
13
biodiversité se répartit depuis le gène,
les micro-organismes, la faune, jusqu'aux organismes situés au-dessus du
sol. La quantité de bactéries présentes peut augmenter de
plusieurs ordres de grandeur aussitôt qu'une source de matière
organique est présente en abondance. En ce qui concerne l'effet sur la
biodiversité microbienne, on manque encore de données, car
seulement 5 à 10 % des espèces de la microflore du sol sont
connus. En utilisant les nouvelles techniques issues de la biologie
moléculaire, il est maintenant possible d'évaluer beaucoup mieux
la biodiversité spécifique ou interspécifique des
micro-organismes (Copley, 2000). Le rôle de la macrofaune dans
l'accumulation de COS a largement été souligné. Par
exemple, les mille-pattes et vers de terre dégradent et transforment les
particules de matière organique. Plus généralement, la
macrofaune du sol permet le transfert du COS vers de plus grandes profondeurs
de sol, où le COS possède un temps de présence plus
élevé (Rumpel et Kögel-Knabner, 2011). La
biodiversité du sol (bactéries, champignons, protozoaires,
insectes, vers, et autres invertébrés et mammifères)
associée au Carbone Organique du Sol forme la capacité
métabolique du sol (tableau I). Elle joue un rôle crucial dans
l'amélioration de la production alimentaire et la résilience du
sol face au changement climatique (FAO, 2017).
Tableau I : Vue d'ensemble des principaux
organismes du sol en fonction de leur taille
(FAO, 2017).
Microfaune (1 à 100 um) Mésofaune (100
um-2mm) Macrofaune (Plus de 2 mm)
Protozoaires Collemboles Vers de terre
Nématodes Mites Fourmis
Champignons Tardigrades Cloportes
Bactéries - Termites
I-9- Perte de biodiversité du sol
Les pertes de biodiversité dans le sol affectent de
multiples fonctions écosystémiques, dont la
décomposition du COS, la rétention des
nutriments et le cycle des nutriments (FAO et ITPS, 2015). De mauvaises
pratiques de gestion des terres et des changements environnementaux affectent
les communautés vivant sous la surface du sol et le déclin de
biodiversité qui en résulte limite et réduit ces avantages
(Wall et al., 2015 ; FAO, 2017).
Une gestion agricole non durable telle que pratiquée
dans de nombreux agroécosystèmes (comme la monoculture, l'usage
intensif du labour ou les apports chimiques), dégrade le
14
réseau fragile des interactions de communautés
entre les ravageurs et leurs ennemis naturels, ce qui influe
négativement sur les stocks de COS. Lorsque les pertes de COS ne peuvent
pas être complètement expliquées par les
propriétés physiques du sol, l'hypothèse qui pourrait
être formulée est que la stabilité du COS est
dépendante de l'activité et de la diversité des organismes
du sol (Gardi et Jeffery, 2009).
Etant donné les pertes actuellement observées au
sein de la diversité microbienne du sous-sol, il est important de
comprendre les relations entre la biodiversité du sol et le cycle du
carbone de manière à prévoir de quelle manière ces
pertes de biodiversité sous une altération environnementale due
aux actions humaines impactera les mécanismes du cycle du carbone global
(De Graaf et al., 2015). Les recherches actuelles indiquent que la
biodiversité du sol peut être maintenue et partiellement
restaurée si elle est gérée de manière durable.
Promouvoir la complexité écologique et la robustesse de la
biodiversité du sol au moyen de pratiques de gestion
améliorées représente une ressource sous-utilisée
qui a le potentiel ultime d'améliorer la santé humaine (Wall et
al., 2015). En ce qui concerne les techniques de gestion des sols
propres à atténuer les effets du changement climatique et de s'y
adapter dans un contexte de production alimentaire durable (FAO, 2017).
15
CHAPITRE 2 : MATERIEL ET METHODES
2-1- Site d'étude
Le milieu dans lequel cette étude a été
menée est situé dans le Département de la Likouala plus
précisément dans le district de Dongou (figure 1). Ce
Département occupe presque la partie Nord de la République du
Congo et couvre une superficie d'environ 64.044 km2 (PAM, 2009). Du
point de vue géographique, le Département de la Likouala est
limité, au Nord par la République Centrafricaine, au Sud par le
Département de la Cuvette, à l'Oust par le Département de
la Sangha et à l'Est par le fleuve Oubangui qui le sépare de la
République Démocratique du Congo.

Figure 1 : Carte du milieu d'étude
2-2- Milieu Physique
2-2-1-Climat
Le Département de la Likouala où cette étude
a été réalisée se trouve plus
précisément dans le
nuage équatorial (Moukolo, 1992) qui règne le
climat équatorial caractérisé par les
précipitations relativement modestes allant de 1600 mm à 1800 mm
par an (Vennetier, 1966). Cette zone ne connait presque pas la saison
sèche c'est-à-dire qu'il pleut presque toute l'année
16
malgré un ralentissement des pluies observé
entre décembre et février ainsi qu'en juin-juillet et un maximum
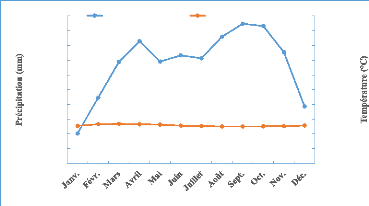
des précipitations en septembre-octobre (figure 2). La
température moyenne annuelle est voisine de 25° à 26 °C
(figure 2) avec une amplitude annuelle faible de 1 à 2 %, des
écarts diurnes sont un peu plus marqués 9 à14 %.
200,00
180,00
160,00
140,00
120,00
100,00
40,00
20,00
80,00
60,00
-
Précipitation (mm) Température
(°C)
Mois
40,00
30,00
20,00
-
90,00
80,00
70,00
60,00
50,00
100,00
10,00
Figure 2 : Courbe Ombtothermique de la
Likouala de 1998-2018 (Station météorologique d'Impfondo)
2-2-2- Pédologie
Selon Vennetier (1968), on distingue deux (2) types du sol
dans le Département de la Likouala Les sols ferralitiques : ces sols se
subdivisent en trois (3) catégorie, à savoir :
érre
y' les sols ferralitiques typiques : ils sont de couleur rouge
et sont là où les précipitations atteignent au moins 1500
mm par an, essentiellement sur les terrains précambriens. Leurs pH est
acide voisine de 4.
y' Les sols ferralitiques lessivés : ce sont des sols
sableux, perméables et pauvres. Cette pauvreté est liée
à l'infiltration des eaux qui entraine en profondeur les
éléments minéraux.
y' Les sols faiblement ferralitique ou sols remaniés :
ce sont les sols jaunes présentant de l'humus en surface et des cailloux
en profondeur.
Les sols hydromorphes : ce sont les sols qu'on rencontre le
plus souvent dans les zones où se produit une inondation, soit en
surface, soit en profondeur.
17
2-2-3- Végétation
A l'exception de quelques rares espaces non forestiers,
savanes, implantations humaines, cultures et jachères, lits des cours
d'eau, sol nu (Moutsamboté, 2012), l'ensemble du Département de
la Likouala est couvert par des forêts appartenant aux forêts
denses humides sempervirentes (Vennetier, 1966 ; Sita, 1989). La
végétation de la Likouala précisément vers Epena,
présente un aspect très classique avec une succession en hauteur
des diverses essences : l'étage dominant constitué des grands
arbres 40 à 60 m de haut tel que Limba (Teminalia superba),
Iroko (Milicia excelsa), Ayous (Triplochiton sclerosylon),
Azobé (Lophira alata), etc. Haut de 20 à 30 m, ces
arbres comportent surtout des essences de bois dur à croissance lente et
à faible diamètre. La forêt marécageuse règne
sur presque toute la Likouala (forêt inondé et forêt
inondable) (Vennetier, 1966 ; Moutsamboté, 2012). La couverture
végétale subit une petite régression significative suite
aux activités anthropiques liées à : l'agriculture
itinérante sur brulis, le feu de brousse annuel, la culture de rente
(Palmier à huile, Café, Cacao), la culture vivrière
intensive (Manioc), l'infrastructure de communication physique etc (Ndzai,
2015). Ces différents facteurs conduisent à une couverture
imparfaite du sol l'exposant ainsi aux aléas des agents climatiques
(PNLCD, 2006). La végétation de notre zone d'étude est
essentiellement constituée des forêts des forêts de terres
fermes comme : forêts adultes sur terre ferme à Celtis
adolfi-friderici, des secondaires à Macaranga spp et
à Musanga cecropioides R. Br. des forêts adultes
inondable à Lophira alata Banks ex C.F.Gaert N, forêts
adultes inondée à Guibourtia demeusei (Harms)
Léon. Et des savanes incluse à Jardinia congoensis (Koubouana et
al., 2018, Ifo et al., 2016)
2-2-4- Le Relief
Faisant partie intégrante de l'unité structurale
de la Cuvette congolaise, le Département de la Likouala a un relief
relativement moins accidenté avec des altitudes n'excédant pas
500 mètres et des dénivellations inférieures à 50 m
entre les interfleuves et les fonds de vallées ne s'élevant qu'au
Nord-Ouest en direction des plateaux Oubanguiens (CERAPE, 2011).
2-3- Matériel végétal
L'étude comparative des forêts adultes et des
forêts secondaires du Département de la Likouala, a portée
sur l'inventaire de tous les arbres vivants.
18
2-4- Méthodes d'études
2-4-1- Sélection des parcelles
Le choix des parcelles expérimentales a
été orienté suivant leur accessibilité et leur
physionomie de paysage par rapport au type de forêt. L'installation des
parcelles est portée dans les forêts secondaires d'une part et
dans les forêts adultes de terre ferme et marécageuses
(inondée et inondable) d'autre part. Ces types de forêts ont
été définis sur la base des caractéristiques de la
structure, forme de croissance et couverture de la végétation
(Birnbaum et al., 2013). En fonction de la dominance et l'abondance
des espèces ainsi que l'écologie, ces forêts ont
été qualifiées tantôt de forêt adulte
inondable à Lophira alata (FAL), forêt adulte de terre
ferme à Celtis adolfi-friderici (FAC), forêt adulte
inondée à Guibourtia demeusei (FAG) tantôt des
forêts secondaires à Macaranga monandra (FSMa) et
à Musanga cecropioides (FSMu). Deux sites ont été
choisis notamment Bondzalé et Dongou (figure 2).
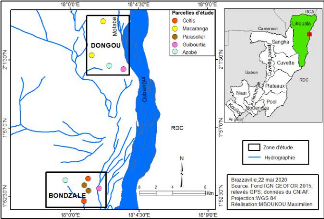
Figure 3 : Localisation des parcelles
2-4-2- La mise en place des parcelles
Pour mettre en place nos parcelles sur l'ensemble de la zone
d'étude, nous avons procédé par l'ouverture de piste de
100 m, exécutée par le macheteur en suivant les orientations de
la boussole (Nord-Sud et Est-Ouest) de manière à obtenir les
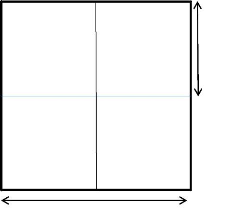
parcelles carrées au moyen d'un double décamètre (figure
5). Chaque parcelle a été matérialisée par des
piquets après une distance de 10 m. Pour un meilleur comptage des
espèces végétales, une surface de 100 m x
19
100 m a été délimitée soit une
superficie de 10.000 m2 ou 1 ha par parcelle (figure 4). Ensuite,
chaque parcelle a été subdivisée en placette de 50 m x 50
m soit 4 placettes par parcelle de 2500 m2. Nous avons
installé dans chaque type de forêt deux (2) parcelles, soit dix
(10) parcelles dans l'ensemble de la zone d'étude soit un total de 10 ha
cumulés.

100 m
2500 m2
50 m
Figure 4 : Schéma d'une parcelle
Figure 5 : Matérialisation d'une parcelle
2-4-3- Collecte des données floristiques
La collecte des données floristiques de la
présente étude a été faite en procédant
à un inventaire floristique et structural de tous les arbres ayant un
DHP (Diamètre à Hauteur de Poitrine) supérieur ou
égale à 5 cm. Tous les individus ont été
mesurés à l'aide d'un compas forestier à 1,30 m du sol.
Pour le cas des arbres à contrefort et à racines échasses,
cette mesure a été effectuée à 30 cm au-dessus de
ceux-ci.
2-4-4- Prélèvement des échantillons du
sol
Le prélèvement des échantillons du sol
s'est fait au centre des placettes de 50 m2 soit quatre (4) points
de collectes par parcelle réalisé à l'aide d'une
tarière racinaire de 15 cm de hauteur et 8 cm de diamètre. La
profondeur de 15 cm a été considérée. Au total,
nous avons prélevé (40) échantillons du sol dans ces dix
(10) parcelles. Ces échantillons ont fait l'objet des analyses au
laboratoire de l'IRSEN de Pointe-Noire. Après prélèvement,
de ces carottes du sol, chaque échantillon est mis dans des sacs
plastiques et étiqueté pour une meilleure organisation (figure 6
et 7).

20
Figure 6 : Prélèvement des
carottes du sol Figure 7 : La Carotte du sol
2-4-5-Traitement des données
Les données recueillies sur le terrain ont
été saisies à l'ordinateur et ont permis de créer
une base de données dans le tableur Microsoft Excel. La reconnaissance
des arbres sur le terrain est effectuée, par les noms pilotes, les noms
vernaculaires et les noms scientifiques pour certaines espèces.
Pour les espèces qui n'ont pas pu être
déterminées sur place, leurs échantillons ont
été récoltés séchés puis
transportés à Brazzaville et identifier par la suite à
l'Herbier National (IRSEN). Pour y parvenir, les documents suivant nous ont
servis pour l'identification de certaines espèces d'arbres :
V' Arbres des forêts denses d'Afrique Centrale :
espèces du Cameroun (Vivien et al.,
1985) ;
V' Introduction aux arbres du Nord-Congo (Harris et al.,
2011) ;
V' les arbres de la Sangha, Manuel d'identification (Harris et
Wortley, 2008) ;
V' les arbres utiles du Gabon (Quentin et al., 2015).
V' Etude écologique, phytogéographique et
phytosociologique du Congo Septentrional
(Moutsamboté, 2012).
Toutes les données d'inventaire ont été
compilées dans une base de données comprenant la liste
complète des espèces inventoriées avec leur nombre
d'individus par classe de diamètre. Les tests statistiques (ANOVA) ont
été utilisés pour connaitre des différences entres
les
21
moyennes du stock de carbone organique obtenues au seuil de
0,05 ou 5 %, l'erreur type a été utilisée sur la moyenne
pour la variabilité.
2-4-6-- Analyse des données floristique
2-4-6-1- Richesse spécifique
La richesse spécifique est le nombre total
d'espèces de la distribution observée (Ngueguim et al.,
2010).
Pour le spectre brut et pondéré, nous avons pris
en compte les formules utilisées par (Kimpouni et al. (2013)
:
- Le spectre brut de nature floristique, utilisée pour
déterminer le nombre d'espèces par famille par rapport au nombre
total d'espèce.
- Le spectre pondéral pour déterminer le nombre
d'individus par famille par rapport au nombre total d'individus.
2-4-6-2-- Abondance des taxons
ü Densité relative d'une espèce ou
d'une famille
nombre d'individus par espèce ou
par famille
Densité relative = * 100 Equation
1
nombre total d'individus des espèces ou des
familles
ü Dominance relative d'une espèce ou d'une
famille
La dominance d'une espèce ou d'une famille permet de
mettre en évidence les espèces ou des familles qui occupent plus
de place dans l'échantillon considéré à
l'intérieur d'une formation forestière étudiée
(équation 2). Ce qui implique la connaissance de la surface
terrière de chaque espèce dans l'échantillon
considéré (Kitengé, 2011).
Dominance relative = Surface terrière dune
espèce ou famille * 100 Equation 2
Surface terrière totale dune espèce
ou famille
ü Fréquence relative (Fr)
La Fréquence relative permet d'apprécier
l'hétérogénéité de la composition des
espèces d'une zone donnée (équation 3).
nombre de relevés ou
l'espèee est présente
Fr.= * 100 Equation 3
nombre total de relevés
22
2-4-6-3- Les indices des valeurs d'importance des
taxons (Espèces et familles)
Ces indices permettent d'identifier les entités
dominantes d'une communauté ou d'un compartiment, c'est-à-dire,
les espèces et les familles ayant une forte valeur écologique
(Nsangua Mposo et al., 2018). Il se calcul par la formule suivante
(équation 4) :
IVI = Densité relative +
Dominance relative + Fr Equation 4
(IVI= Indice des Valeurs d'Importance).
Ces indices ont l'avantage de combiner les aspects
floristiques et les aspects structuraux pour bien mettre en valeur l'importance
de chaque taxon dans l'écosystème forestier étudié
(Koubouana et al., 2018).
2-4-6-4- Les groupes écologiques
L'adaptation globale des végétations se
manifeste le plus directement par la forme que leur impose le facteur du milieu
le plus décisif (Evrard, 1968). C'est en partant de ces prémices
que les espèces de la florule étudiée ont
été triées selon les divers groupes suivants :
> Hydrophytes : L'appareil radicule de ces
plantes est en contact avec un substrat aquatique ou gorgé d'eau en
permanence ; la partie aérienne est souvent immergée au moins
partiellement.
> Hygrophytes : Ce sont les plantes qui
bénéficient durant toute leur période de
végétation d'une humidité atmosphérique
élevée.
2-4-7- Les indices de diversité floristique
2-4-7-1- Indice de Shannon et Equitabilité de
Piélou
L'indice de Shannon-Weaver (H') donne une mesure de la
biodiversité en tant que quantité d'information (Boudelal, 2014)
et ensuite, mesure l'incertitude quant à l'appartenance à une
espèce donnée d'un individu pris au hasard dans
l'échantillon. Il varie de 0 (une seule espèce est
présente) à log2S (toutes les espèces présentes ont
une même abondance). L'indice de Shannon s'exprime par l'équation
5.
|
s
H' = - I pilog2pi i=1
|
Équation 5
|
23
Avec pi = abondance proportionnelle ou pourcentage
d'importance de l'espèce, se calcule ainsi : pi = ni/N ; S = nombre
total d'espèces ; ni = nombre d'individus d'une espèce dans
l'échantillon ; N = nombre total d'individus de toutes les
espèces dans l'échantillon.
Selon Fournier et Sasson (1993) ; Tokombé (2011),
l'indice d'Equitabilité de Piélou est calculée par
l'équation 6.
H'
E = Équation 6
Hmax
H': indice de Shannon-Weaver ; Hmax : Log2S : diversité
spécifique maximale
Equitabilité varie entre 0 et 1. Plus cet indice tend
vers un (1), plus la dispersion des éléments de la
biodiversité est équitable, plus il tend vers zéro (0),
plus il y a une dominance d'une espèce par rapport aux autres
c'est-à-dire une dispersion non équitable (Boudelal, 2014 ;
Bassatnh, 2006).
2-4-7-2- Le coefficient de similarité
Le coefficient de similarité de Sorensen (Ngueguim et
al., 2010) permet de savoir si deux parcelles A et B comparées
sur le plan floristique appartiennent à la même communauté
végétale. Pour une valeur de Sorensen (K) supérieure
à 50 %, on peut conclure que les deux parcelles comparées
appartiennent à une même communauté végétale
(équation 8). Dans le cas contraire, les deux parcelles appartiennent
à des communautés végétales différentes.
Sorensen (K %) = (2C/A+B) x 100 Équation
8
A = nombre d'espèces de la parcelle a ;
B = nombre d'espèces de la parcelle b :
C = nombre total des espèces communes aux parcelles a et
b.
2-4-8- Analyse structurale
La structure totale d'une forêt désigne la
répartition des individus des toutes les espèces réunies
sur une superficie donnée, dans les différentes classes de
diamètres (Rollet, 1974 ; Fournier et Sasson, 1983). Elle donne des
indications relatives à l'état de
régénération et de l'équilibre ou non d'une
formation forestière.
24
2-4-8-1- Densité à l'hectare
La densité permet de déterminer le nombre de
tiges à l'hectare et s'évalue suivant la formule : (Konan et
al., 2015).
?? = ?? Équation 9
??
D= Densité à l'hectare ;
n = est le nombre total d'individus inventoriés dans le
biotope ; S = l'aire totale échantillonnée dans le milieu.
2-4-8-2- Surface terrière
La surface terrière est la surface occupée par
les troncs d'arbre pris par convention à 1,30 m du sol à la
hauteur de poitrine. Elle est égale à la somme de toutes surfaces
de toutes les espèces présentes dans l'échantillon
inventorié par hectare (Gounot, 1969). La surface terrière est
exprimée en m2 par ha (Pascal, 2003). Cet indice permet
d'estimer la surface au sol occupée par le peuplement forestier. Elle se
calcule à l'aide de l'équation 10.
|
??
G = ? ??????2
4 × d n
??=1
|
Équat??o?? ????
|
Avec : it = 3,14, G= Surface terrière du peuplement en
m2/ha, Di = Diamètre du ligneux i, d = densité du
peuplement à l'hectare, n = Effectif de la population dans la
placette.
Elle est déterminée pour évaluer la
surface occupée par les sections des fûts à 1,30 m du sol,
dans différents biotopes. La surface terrière d'un arbre est
d'autant plus élevée que l'arbre est gros. Celle d'un peuplement
est d'autant plus élevée que celui-ci est dense (Konan et
al., 2015):
? un peuplement dense et âgé pourra avoir une
surface terrière élevée 25 à 50 m2/ha ;
? un peuplement plus jeune ou plus clair aura une surface terrière
faible : 5 à 15 m2/ha.
2-4-8-3- Distribution par classes de diamètres
des groupements
Elle permet d'apprécier le degré de perturbation
ou de conservation d'un biotope. Les arbres inventoriés dans chaque
milieu sont groupés dans des classes de diamètres pour
réaliser l'histogramme des structures diamétriques. Ces classes
sont reparties comme suit : [5-9,9 cm
25
[, [10-19,9 cm[, [20-29,9 cm[, [30-39,9 cm[, [40-49,9 cm[ et
8[. La configuration de l'histogramme de la structure diamétrique du
peuplement de chaque biotope renseigne, par la forme de la courbe produite, sur
le potentiel de régénération du milieu. Ainsi, la forme de
«J» inversé indique un milieu perturbé avec un bon
potentiel de régénération, une forme de «J»
normal traduit un milieu bien conservé avec un mauvais état de
régénération (Konan et al., 2015).
2-4-8-4-- Taux de régénération
(Tr)
Il permet d'évaluer le potentiel de
régénération des espèces ligneuses dans chaque
biotope.
Lorsque Tr est supérieur à 50 %, le nombre des
juvéniles s'élève par rapport au nombre des individus
adultes qui tend vers 0 (Konan et al., 2015). Il s'exprime par
l'équation 11.
Tr = (?? ??) * ?????? É??????????????
????
n=le nombre total des individus juvéniles de
diamètre inférieur ou égal à 10 cm et N le nombre
total d'individus de l'unité de végétation.
2-4-9- Analyse du sol
2-4-9-1- Dosage du Carbone, azote et phosphore dans le
sol
Le dosage de ces éléments du sol a
été fait au laboratoire de l'IRSEN à Pointe-Noire.
Après dosage, le taux de matière organique est obtenu en
multipliant la teneur en carbone par 1,724.
Le stock de carbone organique du sol est déterminé
par l'équation 12 de Marco et al. (2010).
SC = Ci * Da * 10 * E Équation
12
Avec : SC : stock de C, en g/m2 ; Da :
densité apparente, en g/cm3 ; E : épaisseur de
l'horizon, en cm ; Ci : teneur en carbone organique de la couche en
%.
Le rapport C/N a été mesuré grâce
aux analyses des teneurs en carbone organique et de l'azote total (Ebuy et
al., 2016) des 40 échantillons.
2-4-9-2- Densité apparente du sol
La densité apparente exprime le poids de sol par
unité de volume (FAO, 2017). C'est le
facteur le plus important pour estimer les stocks de carbone
organique, et il est principalement responsable des différences entre
les estimations. Les stocks de COS dans les zones où les
26
sols sont riches en carbone organique sont les plus
affectés par la variabilité de la densité apparente (FAO,
2017). La densité apparente du sol est donc le calcul de la masse du sol
par rapport à son volume frais. La densité a été
calculée sur les échantillons du sol non perturbés
prélevés. Les sols ont ensuite été pesés et
séchés à 70°C. Les résultats sont
exprimés en g/cm3 pour les couches organiques et
minérales (Don et al., 2007). Pour calculer notre
densité apparente nous avons pesés nos échantillons,
à l'aide d'une boite à tomate d'un volume de 73 cm3.
La densité est donc égale au poids obtenu après
pesé sur le volume de la boite de tomate.
2-4-10- Elaboration de l'Analyse en Composante Principale
(ACP)
Afin d'apprécier la composition floristique des cinq
types forêts étudiées et d'autres paramètres comme :
la densité (Dens), le carbone organique du sol (CO), le rapport C/N, la
matière organique (MO), la surface terrière (G) et le taux de
régénération (TR) ont été
utilisés.
27
CHAPITRE III : RESULTATS ET DISCUSSION
3-1- Résultats
3-1-1- Composition floristique
L'inventaire floristique et structural effectué dans la
zone de Bondzalé et Dongou, nous a permis de dénombrer
5692 arbres appartenant à 156 espèces et 44
familles (Tableau, voir annexe).
Le tableau II montre que les forêts sur terre ferme sont
plus diversifiées floristiquement et sont les plus riches en nombre
d'arbres que les forêts inondées. La composition floristique est
plus importante dans la Forêt Adulte à Celtis (85 espèces
et 1349 individus) suivis de la forêt secondaire à Macaranga (83
espèces et 1332 individus), la forêt secondaire à Musanga
(84 espèces et 1187 individus). La diversité floristique est
particulièrement plus importante dans la forêt inondable à
Lophira alata (87 espèces et 1116 individus). La forêt
inondée à Guibourtia demeusii est la moins riche avec un
sous-bois clairsemé.
Tableau II : Composition floristique des
différentes forêts étudiées
|
Types de forêts
|
Individus
|
Espèces
|
Familles
|
|
Forêt Adulte inondable à Lophira alata
(FAL)
|
1116
|
87
|
31
|
|
Forêt Adulte à Celtis adolfi-friderici
(FAC)
|
1349
|
85
|
37
|
|
Forêt Secondaire à Macaranga monandra
(FSMa)
|
1332
|
83
|
36
|
|
Forêt Secondaire à Musanga cecropioides
(FSMu)
|
1187
|
84
|
37
|
|
Forêt Adulte inondée à Guibourtia
demeusei (FAG)
|
708
|
52
|
22
|
L'analyse du tableau III ci-dessous présentant le
spectre pondéré et le spectre brut ; il révèle,
quantitativement dans la FAL et la FAG, la famille des
Fabaceae-Caesalpinioideae est la plus prépondérante avec (18,91 %
et 26,13 %). Par ailleurs, il a été noté une forte
représentation Myristicaceae (19,13 %) dans la FAC. En outre, Au niveau
de la FSMa et la FSMu, les Euphorbiaceae (53,90 %) et les Urticaceae (55,18 %)
ont été les plus importantes.
Qualitativement, dans la FAL, les familles des Annonaceae,
Clusiaceae, Fabaceae-Caesalpinioideae et les Phyllanthaceae avec 6,67 % sont
les plus dominantes. Au niveau de la FAC, les Meliaceae (6,98 %) occupent la
première place, les Fabaceae-Mimosoideae, Moraceae et Rubiaceae avec
7,23 % chacune dominent dans la FSMa. Dans la FSMu ce sont les
Fabaceae-Mimosoideae et Rubiaceae avec 7,23 % qui occupent la première
place. Par
28
contre, Phyllanthaceae (13,12 %) dominent dans la FAG suivis des
Fabaceae-Mimosoideae (11,32 %) et les Euphorbiaceae (9,43 %).
Tableau III : Les valeurs des spectres brut et
pondéré de quelques familles les plus importantes
|
Familles
|
Spectre pondéré (%) FAL FAC
FSMa
|
FSMu
|
FAG
|
Spectre brut (%)
FAL FAC FSMa
|
FSMu FAG
|
|
Achariaceae
|
-
|
-
|
1,35
|
0,42
|
-
|
-
|
-
|
2,41
|
-
|
-
|
|
Annonaceae
|
3,94
|
1,85
|
-
|
-
|
1,98
|
6,67
|
4,65
|
2,41
|
3,61
|
7,55
|
|
Clusiaceae
|
14,70
|
5,26
|
-
|
2,95
|
3,11
|
6,67
|
5,81
|
-
|
3,61
|
5,66
|
|
Ebenaceae
|
4,57
|
1,04
|
-
|
-
|
15,40
|
-
|
2,33
|
-
|
-
|
3,77
|
|
Euphorbiaceae
|
5,38
|
-
|
53,90
|
4,72
|
1,55
|
5,56
|
2,33
|
6,02
|
4,82
|
9,43
|
|
Fabaceae-
18,91
Caesalpinioideae
|
2,67
|
-
|
1,60
|
26,13
|
6,67
|
4,65
|
4,82
|
3,61
|
5,66
|
|
Fabaceae-Mimosoideae
|
2,42
|
2,45
|
2,78
|
1,10
|
9,18
|
5,56
|
4,65
|
7,23
|
7,23
|
11,32
|
|
Meliaceae
|
1,79
|
4,60
|
1,35
|
2,36
|
-
|
3,33
|
6,98
|
4,82
|
6,02
|
-
|
|
Moraceae
|
-
|
-
|
4,05
|
-
|
-
|
-
|
4,65
|
7,23
|
6,02
|
-
|
|
Myristicaceae
|
5,82
|
19,13
|
7,21
|
9,35
|
-
|
4,44
|
3,49
|
3,61
|
3,61
|
-
|
|
Ochnaceae
|
11,92
|
|
-
|
-
|
-
|
3,33
|
-
|
-
|
-
|
-
|
|
Olacaceae
|
7,17
|
9,86
|
-
|
1,35
|
-
|
3,33
|
3,49
|
-
|
3,61
|
|
|
Phyllanthaceae
|
6,54
|
2,45
|
-
|
-
|
25,28
|
6,67
|
3,49
|
3,61
|
4,82
|
13,21
|
|
Rubiaceae
|
-
|
7,86
|
1,43
|
1,77
|
4,66
|
4,44
|
5,81
|
7,23
|
7,23
|
9,43
|
|
Sapotaceae
|
-
|
7,34
|
-
|
2,70
|
2,12
|
-
|
4,65
|
4,82
|
4,82
|
3,77
|
|
Urticaceae
|
-
|
-
|
10,74
|
55,18
|
-
|
-
|
-
|
-
|
2,41
|
-
|
3-1-2- Analyse de la Fréquence relative
Les 20 espèces les mieux représentées dans
tous les types de forêts c'est-à-dire qui ont une
fréquence relative de 100 % sur les 156 espèces
inventoriées sont les suivantes: Albizia ferruginea,
Albizia zygia, Angylocalyx pynaertii, Anthiaris toxicaria
var.welwitschii, Aoranthe cladantha, Barteria fistulosa,
Canarium schweinfurthii, Cleistanthus itsogohensis,
Coelocaryan preussü, Copaifera salikounda, Dacryodes
edulis, Dialium pachyphyllum Harms, Duboscia macrocarpa
Brocq., Irvingia exselsa, Klainedoxa gabonensis,
Lannea
29
welwitschii, Lophira alata, Pseudospondias
microcarpa, Sterculia tragacantha, Treculia africana.
3-1-3- Dominance relative d'une espèce et d'une
famille dans les différentes forêts
Les valeurs de la dominance relative montre que l'espèce
Lophira alata (20,14 %) occupe un
espace important dans la FAL. Dans la FAC, c'est
Strombosia grandifolia (14,23 %) qui occupe la plus grande place
Guibourtia demeusei (36,68 %) occupe une la première place dans
la FAG. Par contre, dans les forêts secondaires : Musanga
cecropioides (62,34 %) occupe une place importante dans la FSMu et
Macaranga monandra (21,04 %) dans la FSMa (tableau IV).
Tableau IV : les espèces dominantes dans
les différentes forêts
Espèces dominantes FPL (%) FPC (%) FSMa (%) FSMu
(%) FPG (%)
Lophira alata 20,14 - - - -
Guibourtia demeusei - - - - 36,68
Strombosia grandifolia - 14,23 - - -
Musanga cecropioides - - - 62,34 -
Macaranga monandra - - 21,04 - -
La famille des Ochnaceae (22,18 %) occupe une bonne place dans
la FAL, les Olacaceae dans la FAC (15,26 %), les Fabaceae-Mimosoideae (26,61 %)
dans la FSMa, les Urticaceae (62,77 %) dans la FSMu et les
Fabaceae-Caesalpinioideae (40,19 %) dans la FAG (tableau V).
Tableau V : Dominance relative d'une famille
Famille FAL (%) FAC (%) FSMa (%) FSMu (%) FAG
(%)
Ochnaceae 22,18 - - - -
Olacaceae - 15,26 - - -
Fabaceae-Mimosoideae - - 26,61 - -
Urticaceae - - - 62,77 -
Fabaceae-Caesalpinioideae - - - - 40,19
3-1-4- Indice de Valeur d'Importance (IVI)
Les résultats de cette étude montrent que sur les
44 familles inventoriées, l'IVI varie d'une
famille à une autre (figure 8).
Valeur de Indice de Valeur d'Importance (IVI)
Fabaceae-Caesalpinioideae Euphorbiaceae Fabaceae-Mimosoideae
Phyllanthaceae Sapotaceae Lecythidaceae Rubiaceae Annonaceae Fabaceae-Faboideae
Anacardiaceae Urticaceae Clusiaceae Ebenaceae Meliaceae Irvingiaceae Moraceae
Myristicaceae Olacaceae Ochnaceae Sapindaceae Malvaceae-Tilioideae Burseraceae
Pandaceae Malvaceae-Sterculioideae Putranjivaceae
70,66
121,10 115,16
120,00 106,52 102,43
95,04 91,90
140,00
81,48
100,00
80,00
60,00
40,00
20,00
-
Différentes familles
Figure 8 : l'Indice de valeur d'Importance par
famille
La famille des Fabaceae-Caesalpinioideae est la plus
représentée dans cette zone avec pour espèce principale
Guibourtia demeusei, suivie de la famille des Euphorbiaceae avec
l'espèce principale Macaranga monandra, des
Fabaceae-Mimosoideae. Les autres familles sont faiblement
représentées.
Les résultats de l'IVI des 20 espèces les mieux
représentées écologiquement sont en ordre
décroissant dans le tableau 6. Il révèle que,
Pseudospondias microcarpa (100,69), suivis de Musanga cecropioides
(98,97), Klainedoxa gabonensis (92,22), Lophira alata
(87,73), Staudtia kamerunensis Macaranga monandra (84,53) sont
des espèces les mieux représentées (tableau VI).
Tableau VI : Indice de Valeur d'Importance par
espèce
|
Espèces IVI
|
DR (%) Dor (%) Fr (%)
|
|
Pseudospondias microcarpa (A.Rich.) Engl. 100,69
|
0,30
|
0,39
|
100,00
|
|
Musanga cecropioides R. Br. 98,97
|
13,79
|
15,18
|
70,00
|
|
Klainedoxa gabonensis Pierre ex Engle. 92,22
|
0,44
|
1,78
|
90,00
|
|
Lophira alata Banks ex C. F.GaertN. 87,73
|
2,14
|
5,58
|
80,00
|
|
Staudtia kamerunensis Warb. Var. gabonensis
86,01
|
4,73
|
1,29
|
80,00
|
|
Fouilloy
|
|
|
|
30
|
Macaranga monandra Mull- Arg.
|
84,53
|
11,82
|
2,71
|
70,00
|
|
Garcinia punctata Oliv.
|
84,09
|
3,25
|
0,84
|
80,00
|
|
Cleistanthus itsogohensis Pellegr.
|
82,66
|
0,72
|
1,93
|
80,00
|
|
Duboscia macrocarpa Brocq.
|
82,23
|
1,44
|
0,79
|
80,00
|
|
Pycnantus angolensis (Welv.) Exell
|
81,68
|
1,16
|
0,52
|
80,00
|
|
Macaranga spinosa Müll-Arg.
|
81,30
|
1,04
|
0,26
|
80,00
|
|
Panda oleosa Pierre
|
80,95
|
0,51
|
0,44
|
80,00
|
|
Trichilia gilletii De Wild.
|
80,91
|
0,65
|
0,26
|
80,00
|
|
Petersianthus macrocarpus (P.Beauv.) Liben
|
75,76
|
3,04
|
2,72
|
70,00
|
|
Dialium pachyphyllum Harms
|
75,38
|
3,78
|
1,61
|
70,00
|
|
Coelocaryan preussü Warb.
|
75,01
|
3,37
|
1,64
|
70,00
|
|
Strombosia pustulata Oliv.
|
74,95
|
1,42
|
3,53
|
70,00
|
|
Uapaca guineensis Mull. Arg
|
74,35
|
0,26
|
0,70
|
20,00
|
|
Blighia welwitschii (Hiern) Radlk
|
72,95
|
1,95
|
1,00
|
70,00
|
|
Massularia acuminata (G. Don) Bullock ex Hoyle
|
72,07
|
1,88
|
0,19
|
70,00
|
3-1-5- Analyse des groupes écologiques des
déférentes forêts étudiées
Les espèces hygrophytes et Hydrophytes ont
été identifiées autours de cette étude (figure
9)
Pourcentage (%)
|
120,00
|
|
|
|
|
|
|
|
|
|
|
98,15
|
99,25
|
99,41
|
|
|
|
100,00
|
|
|
|
|
|
|
|
|
|
|
|
88,14
|
|
|
|
|
|
80,00
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
67,83
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
60,00
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
40,00
|
32,17
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20,00
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11,86
|
|
|
|
|
|
|
1,85
|
|
|
0,75
|
|
|
0,59
|
|
|
|
|
|
|
|
|
0,00
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Hydro
|
Hygro
|
Hydro
|
Hygro
|
Hydro
|
Hygro
|
Hydro
|
Hygro
|
Hydro
|
Hygro
|
|
FAL
|
FAC
|
FSMa
|
FSMu
|
|
FAG
|
|
|
|
|
|
|
Types de forêts
31
Figure 9 : Groupes écologiques des
forêts étudiées
32
Les groupes écologiques analysés (figure 8)
montrent que les espèces hygrophytes sont plus dominantes dans la FSMu
99,41 % suivi de la FSMu avec 99,25 %, la FAC 98,15 %, la FAL présente
67,83 %. La FAG présente la plus faible valeur soit 11,86 %. Par contre,
les espèces Hydrophytes sont beaucoup plus dominantes dans la FAG 88,86
%, suivis de la FAL (32,17 %). Les forêts de terre ferme
présentent les proportions les plus faibles.
3-2- Indice de Shannon et d'Equitabilité par
type de forêt
La figure 10 présente la répartition des
espèces dans les différentes forêts.
Valeurs de l'Indice de Shanon et
d'Equitabilité
|
6,00
5,00
|
|
4,99
|
Indice
|
4,82
de
|
Shannon Indice d'Equitabilité
4,19
|
|
|
|
4,00
|
|
|
|
|
3,67 3,44
|
|
|
|
3,00
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2,00
|
|
|
|
|
|
|
|
|
|
|
|
|
1,00
|
|
|
0,77
|
|
0,75
|
|
0,57
|
|
0,54
|
|
0,73
|
|
0,00
|
|
|
|
|
|
|
|
|
|
|
|
|
FAL FAC FSMa FSMu FAG
Différentes forêts
Figure 10 : Les valeurs des indices de Shannon
et d'Equitabilité
La répartition est plus ou moins équitable
c'est-à-dire aucune espèce ne prend le dessus sur les autres dans
la FAL (H' = 4,99 et E = 0,77), suivi de la FAC (H' = 4,82 et E = 0,75) et la
FAG (H' = 4,19 et E = 0,73). Par contre, cette répartition est moins
équitable c'est-à-dire avec deux ou 3 espèces dominante
dans la FSMa (H' = 3,67 et E = 0,57) et la FSMu (H' = 3,44 et E = 0,54).
3-3- La similitude des différents
relevés
L'indice de Sorensen a été calculé pour
identifier la similitude entre les différents relevés
(figure 11).
Valeurs de Sorensen en %
40,00
20,00
90,00
70,00
60,00
30,00
80,00
50,00
10,00
0,00
66,2858,4860,82
69,8272,19
46,04
80,95
24,82 22,0625,00

Types de forêts
Figure 11 : les valeurs du coefficient de
Sorensen
La figure 11 montre que les valeurs les plus
élevés du coefficient de Sorensen sont observées entre les
forêts sur terre ferme. C'est le cas de FSMa-FSMu (80,95 %), FAC-FSMa
(72,19 %), FAC-FSMa (69,82 %). La valeur du coefficient de Sorensen est
supérieur 50 % entre la forêt temporairement inondée (FAL)
et les forêts sur terre ferme. Par contre la valeur de cet indice est
inférieure à 50 % entre la forêt inondée et les
forêts sur terre ferme.
3-4- La densité à l'hectare et la surface
terrière des différentes forêts
Les valeurs de la Surface Terrière (G) par types de
forêts et par parcelles sont représentées dans le tableau
VII ci-dessous. Il en résulte que, la valeur moyenne de G la plus
élevée est obtenue dans la FAC (31,99 m2/ha), suivi de
la FAG (29,77 m2/ha), de la FAL (28,48 m2/ha). Les
faibles valeurs ont été notées dans les forêts
secondaires (28,27 m2/ha pour la FSMu et 16, 09 m2/ha pour la
FSMAC). Cependant la densité moyenne à l'hectare est obtenue dans
la FAC (675 arbres/ha), suivi de FSMa (666 arbres/ha), la FSMu (594 arbres/ha).
Par contre, la FAG présente la densité moyenne la plus faible
soit 354 arbres/ha.
Tableau VII : Les valeurs de la Surface
terrière (G) et de la Densité à l'hectare
|
Types de forêts
|
Parcelles
|
Densité/effectif
|
G (m2/ha)
|
Moy. G (m2/ha)
|
|
P1
|
663
|
26,98
|
|
|
FAC
|
|
|
|
31,99
|
|
P6
|
686
|
36,99
|
|
|
FAG
|
P3
|
335
|
33,01
|
29,77
|
33
|
P7
P5
|
373
556
|
26,54
32,04
|
|
|
FSMu
|
|
|
|
28,27
|
|
P2
|
631
|
24,49
|
|
|
P8
|
449
|
24,34
|
|
|
FAL
|
|
|
|
28,48
|
|
P4
|
667
|
32,63
|
|
|
P9
|
675
|
18,21
|
|
|
FSMa
|
|
|
|
16,09
|
|
P10
|
657
|
13,97
|
|
3-5- Structure diamètrique de tous types de
forêts
La structure diamétrique des différentes
forêts étudiées est de façon générale
en forme
exponentielle décroissante (forme de L).
C'est-à-dire il y a plus d'individus de petit diamètre que les
gros (figure 12).

a
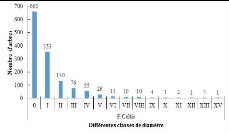
b
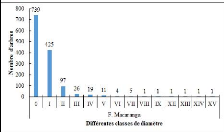
d
c
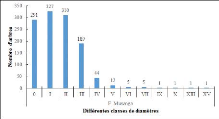
f
34
Figure 12 : Distribution diamétrique : a)
FAL; b) FAC; c) FSMa ; d) FSMu et f) FAG
La FSMa, la FAC et la FAL présentent une bonne allure
de la structure diamétrique. Par contre, la FSMu et la FAG
présentent un déficit des jeunes individus exprimant une
instabilité relative de ces forêts.
3-6- Taux de régénération (Tr)
La régénération, c'est-à-dire les
jeunes tiges de moins de 10 cm de diamètre (classe 0) est plus
forte dans la FSMa avec un taux de 55,48 %, suivi de la FAL
(51,25 %). La régénération est faible dans la FSMu soit
24,52 % et la FAG 25,99 % dont les tiges de moins de 10 cm de diamètre
sont plus faible que celles de plus de 10 cm de diamètre (Classe I),
27,55 % pour la FSMu et 35,45 % pour la FAG (tableau VIII).
Tableau VIII : Taux de
régénération dans les différents types de
forêt.
FAL FAC FSMa FSMu FAG
Classes de diamètre
Types de Forêts
Classe 0
|
51,25
|
%
|
48,93
|
%
|
55,48
|
%
|
24,52
|
%
|
25,99
|
%
|
|
Classe I
|
27,15
|
%
|
26,17
|
%
|
31,91
|
%
|
27,55
|
%
|
35,45
|
%
|
3-7- Structure granulométrique moyenne des
différents types de forêts
Les teneurs moyennes en argile, sable, et limon des
différentes forêts étudiées sont
présentées
dans le tableau IX.
Ces résultats révèlent que les teneurs en
argile sont très faibles dans les FPC, FPG, FPL, FSMu et FSMa. Ces
valeurs d'argile sont un peu plus élevées dans la FPC
(0,91#177;0,39 %), moins faible dans la FPL (0,67#177;0,52 %), très
faible dans la FPG (0,37#177;0,40 %). La valeur des limons est
élevée dans la FSMu (4,14#177;3,82 %), moins faible dans la FPL
(3,61#177;2,64 %) et FPC (3,52#177;073 %) et plus faible dans la FSMa
(2,39#177;0,55 %). Ces résultats montrent que nos forêts
étudiées sont très riches en sable.
Tableau IX : Moyennes des teneurs en argile,
limon et sable des différents types de forêts
étudiées
|
Types de forêts
|
Argile (%)
|
Limon (%)
|
Sable (%)
|
|
FPC
|
0,91#177;0,39
|
3,52#177;073
|
7,88#177;0,86
|
|
FPG
|
0,37#177;0,40
|
2,37#177;1,23
|
6,36#177;1,93
|
|
FPL
|
0,67#177;0,52
|
3,61#177;2,64
|
7,84#177;4,37
|
35
36
|
FSMa
|
0,42#177;0,26
|
2,39#177;0,55
|
8,80#177;0,86
|
|
FSMu
|
0,61#177;0,28
|
4,14#177;3,82
|
8,08#177;2,41
|
0,05 0,40 0,40
3-8- Les valeurs moyennes des teneurs du Carbone (N),
Azote (N) et Phosphore (P)
Les résultats des teneurs moyennes en carbone, en azote
et phosphore organique varient du type de forêt à un autre. Le
tableau X montre que la teneur moyenne en carbone est plus élevée
dans la FAG (14,88#177;15,46 %), moins élevée dans la FAL
(8,40#177;3,95 %) et faible dans la FSMu (1,60#177;0,61 %). La
différence de ces teneurs en carbone est très significative entre
ces deux types de forêts (p=0.004). La teneur la plus
élevée en azote est obtenue dans la FAG (0,62#177;0,54 %), la
moins élevée dans la FAL (0,36#177;0,15 %) et enfin la plus
faible est obtenue dans la FSMu (0,13#177;0,05 %). Ainsi, la différence
est significative (p=0.004) entre ces trois types de forêts du point de
vue teneur d'azote. En ce qui est de la teneur en phosphore, c'est dans la FAL
(0,06#177;0,04 %) que la teneur en phosphore est élevée ; moins
élevée dans la FAG (0,04#177;0,01 %), et faible dans les FSMa et
FSMu (0,02#177;0,005 %) et dans la FAC (02#177;0,007 %). En ce qui concerne la
teneur en phosphore dans ces cinq types de forêts, la différence
est très significative (p=0.0004)
Tableau X : Teneurs moyenne en carbone (C),
azote (N) et phosphore (P)
|
Types de forêts
|
C (%)
|
N (%)
|
P (%)
|
|
FPL
|
8,40#177;3,95
|
0,36#177;0,15
|
0,06#177;0,04
|
|
FPC
|
2,57#177;1,51
|
0,19#177;0,11
|
0,02#177;0,007
|
|
FPG
|
14,88#177;15,46
|
0,62#177;0,54
|
0,04#177;0,01
|
|
FSMa
|
4,06#177;1,23
|
0,23#177;0,06
|
0,02#177;0,005
|
|
FSMu
|
1,60#177;0,61
|
0,13#177;0,05
|
0,02#177;0,005
|
3-10- Carbone organique moyen, Rapport Carbone/Azote et
la Matière Organique dans les différentes forêts
étudiées
Il apparait dans le tableau XI que, le stock de carbone organique
moyen le plus important est
obtenu dans la FAG (14,00#177;14,63 tC/ha). Suivis de la FAL
(8,17#177;3,22 tC/ha), FSMa (4,92#177;1,42 tC/ha) et la FAC (3,49#177;1,83
tC/ha). Par contre, la FSMu présente un stock faible soit (2,22#177;0,89
tC/ha). Le test statistique montre une différence significative entre
ces stocks de carbone (p=0,01). Le rapport carbone azote (C/N) des cinq types
de forêts révèle une valeur moyenne plus importante dans la
FAL soit (22,91#177;6,71), la FAG présente
37
(20,44#177;5,82), la FSMa (17,57#177;2,27), la FPC
(14,17#177;2,14) et la dernière valeur dans la FSMu (12,64#177;1,11). La
différence est très hautement significative (p=0.000). Les
résultats moyens de la matière organique (MO) sont plus
élevées dans la FAG (25,66#177;6,65 %), moins faibles dans FAL
(14,47#177;6,81 %), la FSMa (7,01#177;2,13 %), la FAC (4,42#177;2,60 %) et la
plus faible dans la FSMu (2,75#177;1,05 %). L'analyse des tests statistiques
révèle une différence significative (p=0.004).
Tableau XI : Valeurs du stock moyen de carbone,
du rapport carbone/azote (C/N) et la Matière Organique (MO)
|
Type de forêts
|
Stock moyen de carbone en
tC/ha
|
C/N
|
Moyenne MO (%)
|
|
FAL
|
8,17#177;3,22
|
22,91#177;6,71
|
14,47#177;6,81
|
|
FAC
|
3,49#177;1,83
|
14,17#177;2,14
|
4,42#177;2,60
|
|
FAG
|
14,00#177;4,63
|
20,44#177;5,82
|
25,66#177;6,65
|
|
FSMa
|
4,92#177;1,42
|
17,57#177;2,27
|
7,01#177;2,13
|
|
FSMu
|
2,22#177;0,89
|
12,64#177;1,11
|
2,75#177;1,05
|
3-11- Résultats de l'ACP
En regroupant les caractéristiques floristiques,
structurales et écologiques des différentes
forêts étudiées, nous avons effectué
une ACP qui a donné les résultats suivants (figure 13) :
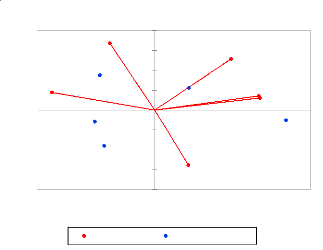
F2 (27,22 %)
-1
-2
-3
-4
4
3
2
0
1De
-3 -2 -1 0 1 2 3 4
F1 (60,49 %)
ns
FSMa
FAC
FSMu
Variables actives Observations actives
TR
Biplot (axes F1 et F2 : 87,71 %)
G
FAL
C/N
MO
CO
FAGU
Figure 13 : Résultats de l'ACP
38
Cette figure montre que le plan principal (F1 et F2) explique
à lui seul 87,74 % de l'information sur la caractérisation des
forêts de la zone étudiée. L'axe F1, qui explique 60,49 %
de l'information, discrimine les types forestiers étudiés en deux
groupes :
y' le premier groupe est constitué de la forêt
adulte à Lophira (FAL) et la forêt à Guibourtia (FAG) qui
sont situées dans la partie positive de l'axe F1. Ce sont des
forêts inondée (FAG) et inondable (FAL)
caractérisées par les paramètres pédologiques
élevés notamment une concentration de la matière organique
(MO), du carbone organique (CO) et d'un Rapport C/N élevé.
y' Le second groupe est constitué de la forêt
adulte à Celtis (FAC), la forêt secondaire à Macaranga
(FSMu) et de la forêt secondaire à Musanga (FSMu) qui sont des
forêts sur terre ferme caractérisées par leur
densité élevé en arbres et des forts taux de
régénération.
39
3-2- Discussion
3-2-1- Richesse floristique
Réaliser sur une superficie de 10 hectares, cette
étude nous a permis d'obtenir au total 5692 individus, 156
espèces repartis en 44 familles. Ces résultats obtenus dans ces
forêts adultes et secondaires montrent une richesse floristique
importante tant sur le plan floristique que structurale. Le bilan de
l'inventaire floristique de la Patte d'Oie de Brazzaville réalisé
par Kimpouni et al. (2013), révèle 47 familles pour 120
espèces. Ndzaï (2015) sur l'axe Impfondo-Dongou a
réalisé l'inventaire floristique des arbres de dbh
supérieur ou égal à 5 cm, il a trouvé, 37 familles
et 114 espèces sur une superficie de 3,75 ha. Ces résultats sont
plus faibles que les notres tout simplement, parce que nous avons
travaillés sur 10 hectares. Bocko en 2018 dans la même zone, a
dénombré un bilan faible 2630 individus de dbh supérieur
ou égal à 10 cm représentant 105 espèces et 33
familles. Cette différence est due peut-être par la
méthodologie adoptée du dbh des individus.
Les résultats des spectres écologiques montrent
que quantitativement dans la FAL et dans la FAG, c'est la famille des
Fabaceae-Caesalpinioideae qui est la mieux représentée (18,91 %
et 26,13 % respecivement). La forte dominance de cette famille est
confirmée par l'abondance de l'espèce Dialium pachyphyllum
(15,50 %) et de Guibourtia demeusei (20, 76 %). Dans la FAC c'est
la famille des Myristicaceae (19,13 %) qui est la mieux
représentée avec abondance de l'espèce Staudtia
kamerunensis (9,93 %). Dans la FSMa c'est la famille des Euphorbiaceae
(53,90 %) avec une large abondance de l'espèce Macaranga monandra
(48,42 %), dans la FSMu ce sont les Urticaceae (10,74 %) dont Musanga
cecropioides (54,76 %) est très abondante. Ces groupements
forestiers qui ont fait l'objet de notre étude avec les espèces
caractéristiques (abondance-dominance) ont été
décrits par Moutsamboté (2012, 1985), Vennetier (1966) ; Sita
(1989) ; Evrard (1968) ; Ifo et al. (2015), Koubouana et al.
(2018).
Moutsamboté (2012) stipule que, les forêts de la
Likouala sont caractérisées par les espèces de terre ferme
(Celtis adolphi-friderici), les espèces de forêt
inondée (Guibourtia demeusei), les espèces de
forêt adulte inondable (Lophira alata) d'où leur
appellation.
Sur le plan qualitatif (spectre brut), dans la FAL ce sont les
familles des Annonaceae, Clusiaceae, Fabaceae-Caesalpinioideae et les
Phyllanthaceae avec 6,67 % ; Dans la FAC, c'est la famille des Meliaceae (6,98
%) ; dans la FSMa c'est la famille des Fabaceae-Mimosoideae, Moraceae et
Rubiaceae avec 7,23 % chacune ; dans la FSMu ce sont les Fabaceae-Mimosoideae
et Rubiaceae avec 7,23 % chacune ; dans la FAG ce sont des
40
Phyllanthaceae (13,12 %). Cela signifie que, ces
différentes forêts sont beaucoup dominées par ces familles
qui sont caractéristiques de ces zones.
L'analyse des résultats de la dominance relative d'une
espèce et d'une famille dans ces différentes forêts montre
que, l'espèce Lophira alata (20,14 %) occupe un espace
important dans la FAL. La dominance de la famille des Ochnaceae (22,18 %) dans
cette forêt confirme cette occupation. Dans la FAC, Strombosia
grandifolia (14,23 %) avec comme famille dominante Olacaceae (15,26 %).
Guibourtia demeusei (36,68 %) occupe la première place dans la
FAG, avec comme famille dominante Fabaceae-Caesalpinioideae (40,19 %). Par
contre, dans les forêts secondaires : Musanga cecropioides
(62,34 %) occupe une place importante dans la FSMu avec comme famille
dominante des Urticaceae (62,77 %) et Macaranga monandra (21,04 %)
dans la FSMa avec comme famille dominante des Euphorbiaceae (26,61 %) bien que
les Macaranga monandra n'appartiennent pas à cette famille, ce
qui montre que certainement l'espèce Macaranga monandra
présente des diamètres très faibles. La dominance de
ces espèces et familles dans cette étude caractérise bien
ces types de forêts.
3-2-2- Analyse des groupes écologiques des
déférentes forêts étudiées
Moutsamboté (2012 ; 1985) et Evrard (1968), soulignent
l'importance des groupements écologiques dans la répartition de
la flore. Il existe bien, des espèces caractéristiques des zones
inondables, inondées, de terre ferme et des zones secondaires (Sita,
1989). Nos résultats sur les différents types de forêts
montrent la prédominance des espèces hygrophytes dans la FSMu
(99,41 %), FSMa (99,25 %), FAC (98,15 %) et dans la FAL (67,83 %). Par contre,
les espèces Hydrophytes sont beaucoup plus dominantes dans la FAG (88,86
%). Ces résultats montrent bien que, la zone étudiée
présente trois écosystèmes bien différents (terre
ferme, inondable et inondée) dont les FSMu, FSMa et FAC se trouvent dans
la zone de terre ferme (hygrophytes), la FAG dans la zone inondée
(Hydrophytes). Tandis que, la FAL présente à la fois les
hygrophytes et les Hydrophytes traduisant ainsi la zone saisonnièrement
inondée. La présente étude contribue aussi bien à
la connaissance de la flore du Congo en général et celle de la
zone de Dongou en particulier, car elle présente plusieurs groupements
forestiers.
3-2-3- Diversité floristique
Les valeurs de l'indice de Shannon pour notre étude
varient de 3,44 à 4,99 en fonction des types de forêts et de
l'Equitabilité de 0,54 à 0,77. Dans les cinq (05) types de
forêts étudiées,
41
la diversité floristique est bien présente dans
certaines forêts adultes que dans les forêts secondaires. Cette
valeur de H' est plus élevée dans la FAL soit 4,99, suivi de la
FAC (4,82) et la FAG (4,19), c'est-à-dire aucune espèce ne prend
le déçu sur les autres dans ces types de forêts. Nos
résultats montrent une grande diversité floristique sans
abondance d'une espèce ou d'un groupe d'espèces sur les autres.
Par contre, ces valeurs de H' sont un peu plus faibles dans les forêts
secondaires soit 3,44 dans la FSMu et 3,67 dans la FSMa. Ce qui montre qu'il y
a dominance de deux ou de trois espèces dans ces types de forêts
comme le confirme l'analyse de la dominance et l'abondance de cette
étude.
Nos résultats correspondent avec ceux obtenus par
Koubouana et al. (2016) dans l'étude « Structure and Flora
Tree Biodiversity in Congo Basin: Case of a Secondary Tropical Forest in
Southwest of Congo-Brazzaville » dont l'indice de H' varie de 3, 08 et
4,16. Koubouana et al. (2016) avec H' qui varie de 5,21 et 5,95.
Omatoko et al. (2015) « Etude floristique et structurale des
peuplements sur sols argileux à Pericopsis elata et sableux
à Julbernardia seretii dans la forêt de plaine d'UMA en
République Démocratique du Congo » H' varie de 3,89 et 4,03.
Ifo et al. (2016) dans les forêts du Nord-Congo avec H' variant
de 0,75 et 4,46. Ces résultats obtenus sur l'axe Impfondo-Dongou rejoint
la théorie de Vennetier (1966) ; Moutsamboté (2012) et Sita
(1989) ; qui stipulent que les forêts primaires du Nord-Congo sont des
forêts denses avec une diversité d'espèces
c'est-à-dire il y a une variabilité d'arbres et les forêts
secondaires sont beaucoup plus dominées par une espèce. Ces
mêmes résultats des forêts secondaires rejoignent
également ceux obtenus par PNLCD (2006) qui stipule que les forêts
secondaires sont dues aux actions anthropiques ou aux chablis qui occasionnent
les dégâts majeurs et se manifestent par l'apparition des
espèces héliophiles. C'est pour cela que, dans les forêts
secondaires nous avons une valeur de l'indice de Shannon qui tourne autour de 3
car ces deux types de forêts présentent une abondance-dominance de
Musanga cecropiodes et de Macaranga monandra. Confirmé
par l'analyse de l'abondance des espèces de cette même
étude, les espèces Musanga cecropiodes et de
Macaranga monandra sont largement abondantes dans les forêts
secondaires.
La similarité des relevés est affirmée
quand la valeur de l'indice de Sorensen est supérieure à 50 %.
Dans le cas contraire, les relevés appartiennent à des
communautés végétales différentes (Ngueguim et
al., 2010). Les valeurs du coefficient de Sorensen et les
résultats de l'ACP ont montré une affinité floristique
entre les forêts secondaires (FSMa-FSMu soit 80, 95 %). Ces deux
forêts appartiennent à une même communauté
végétale et partagent les mêmes espèces. Nous tenons
aussi à signaler que ces deux types de forêts se trouvent dans la
zone de
42
terre ferme. La similarité est aussi forte dans les
FAC-FSMu (72,19 %), FAC-FSMu (69,82 %). Cette forte similarité entre la
FAC ainsi que celle des FSMu et FSMa s'expliquent par le fait que, bien que
secondarisée par les activités humaines ces deux types de
forêts se trouvent dans les zones de terre fermes dont les espèces
de la FAC se régénèrent avec une diversité
très importante dans le sous-bois. Cependant, les valeurs de la
similarité sont plus faibles dans la FSMa-FAG (22,06 %), FSMu-FAG (25,00
%) et FAC-FAG (24,82 %). Les faibles valeurs observées entre ces types
de forêts (FSMa-FAG, FSMu-FAG et FAC-FAG) sont due tout simplement par
l'écologie car, elle joue un rôle primordial dans la
répartition des espèces forestières (Harris et
al., 2011). Cette différence floristique est également
confirmée par les résultats de l'ACP de cette même
étude dont la FAG ne partage pas les mêmes affinités
floristiques que les autres types de forêts. L'analyse de l'ACP montre
que les forêts secondaires et la FAC partagent les mêmes
affinités floristiques.
3-2-4- Paramètres structuraux
La densité moyenne calculée dans les
forêts étudiées varie entre 354 à 675 arbres/ha.
Cette densité est plus forte dans la FAC, FSMu et la FSMa et faible,
dans la FAG (354 arbres/ha). La faible densité obtenue dans la FAG peut
s'expliquer par la présence d'eau en permanence où la
majorité d'espèces ne supporte pas l'étouffement et
meurent par asphyxie. Les forêts inondées de cette zone sont
beaucoup plus dominées par des Arecaceae (Lascosperma laive) et
d'autres espèces comme Azymorpha senegalensis, et les
Raphia spp dans le sous-bois que des arbres et la présence des
espaces d'eau très importantes qui empêchent le
développement et la croissance rapide des arbres. Cette étude
montre qu'en général, les forêts de terre ferme sont plus
denses que celles des forêts inondées. Nos résultats obetus
sur les forêts de terre ferme (Celtis, Musanga et Macaranga) ainsi que
ceux de la forêt inondable à Lophira coïncident avec la
théorie de Pascal (2003), qui stipule que dans les forêts denses
tropicales, les densités varient de 450 à 750 individus. Au Gabon
sur la gestion forestière et la biodiversité (Doucet, 2003)
trouve une densité de 411 individus/ha. Les résultats de l'ACP
présentés dans cette étude démontrent clairement
que la FAC, la FSMu et la FSMa constituent un seul écosystème
dont le climax et la FAC. La FSMu et FSMa sont donc les étapes de la
reconstitution forestière.
Les résultats de notre étude montrent en outre
que, les valeurs de la surface terrière moyenne varient de 16,09
à 31,99 m2/ha. Les valeurs les plus élevées des
surfaces terrières sont obtenues dans les forêts adultes que dans
les forêts secondaires. Elle est de 31,99 m2/ha pour la FAC,
29,77m2/ha pour la FAG et de 28,48m2/ha pour FAL. Ce
pendant, la plus faible
43
valeur est obtenue dans la FSMa soit 16,09 m2/ha.
Cette différence de valeurs pourrait s'expliquer par le fait que, les
forêts adultes présentent un nombre important d'arbres à
gros diamètre. Nous pouvons dire que, plus la valeur de la surface
terrière est maximale, plus les arbres sont de gros diamètre et
plus les arbres sont de petits diamètre plus leurs surfaces
terrières sont faibles. La surface terrière d'un arbre est
d'autant plus élevée que l'arbre est gros. Celle d'un peuplement
est d'autant plus élevée que celui-ci est dense (Konan, 2015).
Pascal (2003), pour les forêts tropicales denses humides, a obtenu les
valeurs de la surface terrière qui varient de 25 m2/ha et 50
m2/ha, ce qui rejoint les résultats des forêts
primaires de la zone étudiées.
La distribution par classes de diamètres est
utilisée pour comprendre la dynamique des arbres et peut être
utilisée pour évaluer l'impact de la pression anthropique sur la
population des arbres (Abdourhamane et al., 2013). La
répartition des arbres en classes de diamètres nous a permis
d'apprécier l'état de la forêt. La structure en
diamètre des forêts de notre zone d'étude est en forme de
« L » c'est-à-dire en forme exponentielle décroissante.
L'histogramme de classe de diamètre de ces forêts traduit une
diminution du nombre de tiges lorsqu'on passe des classes de petits
diamètres aux classes de diamètres supérieurs. Comme
stipule Pascal (2003) que, d'une façon générale, au sein
des forêts denses tropicales humides, les classes de diamètres
pour l'ensemble du peuplement se distribuent selon une fonction voisine d'une
exponentielle décroissante : il y a beaucoup de petits diamètres
et peu de gros.
La structure diamétrique donne des indications
relatives à l'état de régénération et de
l'équilibre ou non d'une formation forestière. Cette étude
montre les différences des classes de diamètre par rapport aux
types de forêts. On n'observe que, dans la FAL, FAC et FSMa, la structure
diamétrique est en forme de « J » renversée traduisant
ainsi une bonne régénération de celles-ci. Par contre,
cette structure diamétrique est en forme de « U »
renversé dans la FSMu et un peu léger dans la FAG; ce qui ne
traduit pas une bonne régénération dans ces zones et la
préservation s'avère être importante. L'évaluation
du taux de régénération des espèces ligneuses dans
les 5 types de forêts du Département de la Likouala a
montré que le peuplement ligneux de cette forêt se reconstitue
fortement. Le taux de régénération est
élevé, 55,48 % dans la FSMa. Ces résultats indiquent que
les différentes actions anthropiques dans la FSMa n'ont pas
influencés négativement la régénération
naturelle des espèces ligneuses. Dans la FAL, le taux de
régénération est élevé également
(51,25 %). Ce taux de régénération est confirmé par
la structure diamétrique de cette même étude. Par ailleur,
dans la FAG et dans la FSMu, ce taux de régénération est
très faible (25,99 % et 24,52 % respectivement), traduisant ainsi une
très faible régénération.
44
3-2-5- Les teneurs d'azote, de phosphore et la
granulométrie du sol
Les moyennes des teneurs en azote sont plus fortes dans les
forêts adultes que dans les forêts secondaires. Elles sont de
0,62#177;0,54 % dans la forêt inondée à Guibourtia et de
0,36#177;0,15 % dans la forêt inondable à Lophira et faibles dans
la forêt secondaire à Musanga. Cette augmentation du taux d'azote
dans ces types de forêts est due certainement par la présence des
espèces forestières appartenant à la famille des
Légumineuses ou Fabaceae. L'analyse floristique de cette même
étude révèle que, l'espèce Guibourtia demeusei
(Fabaceae-Caesalpinioideae) est la plus dominante et abondante dans la
forêt à Guibourtia. Dans la forêt inondable, on observe
l'abondance de l'espèce Dialium pachyphyllum
(Fabaceae-Caesalpinioideae). En revanche, dans les sols forestiers
naturels, la teneur en azote est plus élevée. La composition
chimique de l'azote organique du sol dépend fortement des sources
d'origine, du type de sol et des pratiques agricoles. Simon (2014) stipule que,
certains arbres ne se limitent pas qu'aux symbioses mycorhiziennes. Leurs
racines forment des renflements, appelés nodosités, qui peuvent
mesurer quelques millimètres à plusieurs centimètres. Ces
nodosités sont peuplées de bactéries qui fixent l'azote
atmosphérique en une forme organique assimilable par l'arbre.
Le taux de phosphore le plus élevé est obtenu
dans la FAL (0,06#177;0,04 %) et la FAG (0,04#177;0,01 %) et moins faible dans
les forêts secondaires. Cette différence est due certainement par
les activités anthropiques de ces forêts. Harrison (1987) montre
que le phosphore varie selon les sols et leur type d'utilisation. La mise en
culture des sols et l'apport de fertilisants augmentent les pertes en phosphore
quand les conditions hydrologiques sont favorables (Haygarth et Jarvis, 1999).
La proportion du phosphore dans le sol varie au cours de la
pédogenèse. Elle est très faible lorsque la roche
mère commence à s'altérer, puis au fur et à mesure
que le sol se développe elle prend de plus en plus de l'importance pour
atteindre un maximum et diminuer enfin dans les sols très fortement
altérés (Syers et Curtin, 1989). Sur des échelles de temps
plus courtes, le phosphore diminue lorsqu'un sol est mis en culture sans apport
d'engrais phosphaté, mais il augmente lorsque le sol reçoit des
quantités importantes de matières organiques sur de longue
périodes et quand le sol cultivé retourne sous forme de prairie
ou de jachère (Condron et al., 1990 ; Dalal, 1977). Williams et
Anderson (1968) montrent que la concentration en phosphore augmente lorsque la
matière organique s'accumule dans les sols et diminue lorsque les sols
sont mis en culture. Une bonne teneur en phosphore favorise la division
racinaire (Simon, 2014). Cependant, une carence en phosphore favorise une
diminution de la photosynthèse (Rausch et Bucher, 2002).
45
Les teneurs en carbone sont plus élevées dans
les forêts adultes que dans les forêts secondaires. Pour Batjes
(1996), une grande variation des teneurs en carbone organique relativement aux
types de sol. La teneur du sol en carbone dépend des principaux facteurs
à long terme de la formation du sol, mais elle peut être fortement
modifiée, dégradée ou améliorée par les
changements d'utilisation du sol et la gestion du sol (FAO, 2002).
L'analyse des résultats de cette étude montre
que les teneurs moyennes en argile sont plus élevées dans la FAC
(0,91#177;0,39 %) et de la FAL (0,67#177;0,52 %) et moins élevées
dans la FAG (0,37#177;0,40 %). Les teneurs moyennes en limon les plus
élev ées sont obtenues dans la FSMu (4,14#177;3,82 %) et moins
élevées dans la FAG et dans la FSMa. Par contre, les teneurs en
sable sont plus élevées dans la FSMa (8,80#177;0,86 %) et
à FSMu (8,08#177;2,41 %). Les études de Volkoff et al.
(1999) ; Banville (2009) ont permis de constater que les stocks de carbone les
plus bas correspondent toujours aux classes texturales les plus sableuses. Ce
qui correspond bien avec nos résultats du carbone du sol dont les stocks
les plus bas sont obtenus dans les forêts secondaires. L'analyse de ces
teneurs en azote, en phosphore et en carbone montre bien la différence
entre les forêts adultes et les forêts secondaires.
3-2-6- Le carbone organique du sol
Les moyennes des quantités de carbone du sol (tC/ha)
diffèrent significativement (p=0,01) entre les types de forêts
étudiées. Les quantités du carbone du sol augmentent dans
la FAG (14,00#177;4,63 tC/ha) et dans la FAL (8,17#177;3,22 tC/ha) et diminuent
par contre, dans la FSMu (2,22#177;0,89 tC/ha) et dans la FAC (3,49#177;1,83
tC/ha). Les différences de composition floristique et la présence
d'eau notée dans la présente étude peuvent expliquer les
dissemblances de stocks de carbone observées entre les cinq types
forestiers étudiés. Dans cette optique, la lecture de l'ACP
traduit bien les différences des stocks de carbone entre les
forêts adultes (inondables et inondées) et les forêts
secondaires dont le stock le plus élevé se trouve dans les
forêts inondables et inondées. De même, plusieurs
études réalisées en zone tropicale montrent que le stock
de carbone est plus important dans les tourbières et dans les sols noirs
(FAO, 2017), ce qui confirme une augmentation du stock de carbone dans la FAG
et la FAL qui possèdent un sol noir et une présence de la tourbe.
Les faibles quantités de carbone observé dans les forêts
secondaires sont dues par le degré de perturbation d'humaine. La
densité apparente exprime le poids de sol par unité de volume.
C'est le facteur le plus important pour estimer les stocks de carbone organique
du sol, et il est principalement responsable des différences entre les
estimations du carbone. Gardi et Jeffery (2009) démontrent que la
stabilité du carbone du sol est dépendante de l'activité
et de la diversité des
46
organismes du sol. Toutefois, l'on note que cette
quantité de carbone est relative à plusieurs facteurs. Le stock
de carbone est en moyenne 1,6 fois plus élevé dans les sols
à végétation permanente et en forêt que dans les
sols cultivés ou secondarisés (IFEN, 2017 ; Batjes, 2014 ; FAO,
2017).
3-2-7- La matière organique (MO) et le rapport
C/N
Le type de végétation influence également
les stocks de carbone dans les sols par la production de litière et la
vitesse à laquelle se décomposent les composés organiques
des différentes espèces (Gower et al., 1997 ; Quideau et
al., 2001). Les résultats de la MO et de l'ACP de cette
étude montrent bien la variabilité de MO dans les
différents types de forêts étudiées. La
quantité de la MO est plus importante dans la FAG (25,66#177;6,65 %) et
dans la FAL (14,47#177;6,81 %). La quantité de la MO la plus faible est
obtenue dans les forêts secondaires. Ces quantités importante de
la MO dans les forêts adultes inondées et inondable montrent la
stabilité et la durabilité de ces écosystèmes dont
les activités humaines sont quasiment impossible. Il aussi imprecieux de
noter que le type de végétation (forêts vielles et
intactes) favorise l'accumulation de la MO au sol. ADEM (2014) ;
IFEN, (2017) indiquent
que les forêts jeunes ou secondaires accumulent moins la MO
car la litière qui arrive au sol est
faible.
Ces résultats de la MO ont permis de mettre en
évidence la richesse en MO de chaque type de forêt
étudiée du district de Dongou. Un sol riche en matière
organique favorisera la présence des animaux et végétaux,
nombreux et variés, et donc la biodiversité. La MO augmente
généralement la qualité du sol et améliore la
capacité de régulation de l'eau et de l'atmosphère du sol,
en influençant sa structure, sa capacité de rétention en
eau, ses réserves en éléments nutritifs, sa
biodiversité ainsi que la profondeur d'enracinement et les nutriments
des végétaux qui y croissent (Huber et Schaub, 2011 ; Chenu et
al., 2014 ; FAO, 2017 ; Robert, 1996).
Le rapport C/N indique la vitesse de minéralisation des
amendements humiques apportés au sol, le degré d'évolution
de la matière organique, l'activité biologique et le potentiel de
fourniture d'azote par le sol. Il oriente aussi la décomposition de la
matière organique soit vers la minéralisation ou vers
l'humification. Plus ce rapport est bas (?12), plus la vitesse de
décomposition de la matière organique fraiche est rapide. Plus il
est élevé (>12), plus l'activité biologique est
réduite et la minéralisation rencontre des difficultés
(Boulaine, 1982 ; LCA, 2008). Les résultats obtenus pour cette
étude montrent que le C/N est supérieur à 12 dans tous les
types de forêts étudiées. Ce qui montre que les sols de
cette zone sont des sols
47
d'activités biologiques réduites et la
décomposition de la MO est lente. Par contre, la minéralisation
et l'humification s'équilibrent dans ces types de forêt car le C/N
tourne autour de 20 (LCA, 2008). Bocko, 2018 dans cette même zone
d'étude (forêts de terre ferme, forêts inondées et
inondables) indique le C/N supérieur à 12. En outre, le calcul de
C/N a permis de conclure que les sols du Département de la Likouala en
général et ceux de la zone de Dongou en particulier
présentent une décomposition lente de la matière
organique, la minéralisation est non favorisée et il n'y a pas
une forte production d'azote minéral utilisable par les plantes.
48
CONCLUSION ET PERSPECTIVES
L'étude réalisée sur la comparaison des
forêts tropicales adultes et les forêts secondaires de l'axe
Impfondo-Dongou a permis de distinguer ces différents cinq types de
forêt : forêt adulte sur terre ferme à Celtis
adolfi-friderici, forêt adulte inondable à Lophira
alata, forêt adulte inondée à Guibourtia
demeusei, forêt secondaire à Musanga cecropioides et
la forêt secondaire à Macaranga monandra.
Quantitativement, dans la FAL et dans la FAG, la famille des
Fabaceae-Caesalpinioideae avec (18,91 % et 26,13 % respectivement) est la plus
abondante, les Myristicaceae (19,13 %) dans la FAC. En outre, Au niveau de la
FSMa et la FSMu, ce sont les Euphorbiaceae (53,90 %) et les Urticaceae (55,18
%). L'analyse de la dominance des espèces caractérise ces cinq
types de forêt dont : Lophira alata, Guiboutia demeusei, Macaranga
monandra, Musanga cecropioides et Dialium pachyphylllum sont les
espèces les plus dominantes et plus abondantes. La répartition
est plus ou moins équitable c'est-à-dire aucune espèce ne
prend le dessus sur les autres dans les forêts adultes avec l'indice de
Shannon et l'Equitabilité qui tourne autour de 4 et de 0,8 Par contre,
cette répartition est moins équitable c'est-à-dire avec
deux ou 3 espèces dominantes dans les forêts secondaire. Les
résultats de l'ACP ont montré une variabilité de la
composition floristique tant sur le plan du substrat que sur le plan des
activités anthropiques. L'indice de Sorensen confirme bien les
résultats l'ACP qui montre que les cinq types de forêts
étudiés n'appartiennent pas totalement à une même
communauté végétale mais il existe une similarité
entre les forêts secondaires et la FAC avec les valeurs dépassant
50 %.
Les paramètres structuraux (Surface terrière et
densité) calculés varient bien entre les forêts adultes et
les forêts secondaires dont les valeurs les plus élevées se
trouvent dans les forêts adultes. C'est dans les forêts adultes que
le stock de carbone moyen, la matière organique et le rapport
carbone/azote est plus élevé avec une différence
très significative. Ces résultats démontrent aussi que
l'impact des activités anthropiques contribue à la
réduction du stock de carbone organique du sol, la matière
organique ainsi que le rapport carbone/azote. En définitive, nous
pouvons dire que les forêts adultes de terre ferme, inondées et
inondables de l'axe Impfondo-Dongou sont très différentes des
forêts secondaires sur le plus floristique, structurale et du stock de
carbone et de la matière organique.
En perspective, nous souhaitons étendre cette
étude dans toutes les forêts de la Likouala en considérant
la profondeur de 1 mètre pour le carbone organique et de conscientiser
les populations de ces localités d'utiliser les zones inondées et
inondables pour d'autres activités agricoles afin de limiter les
pressions sur les forêts de terre ferme.
49
REFERENCES BIBLIOGRAPHIQUES
Abdourhamane H., Morou B., Rabiou H., Mahamane A., 2013.
Caractéristiques floristiques, diversité et structure de la
végétation ligneuse dans le Centre-Sud du Niger : cas du complexe
des forêts classées de Dan kada Dodo-Dan Gado, 21p.
ADEM, 2014. Carbone organique des sols. L'énergie de
l'agro-écologie, une solution pour le climat. Collectivités
territoriales et monde agricole, 15p.
Alexandre D.Y., 1989. Dynamique de la
régénération naturelle en forêt dense de Côte
d'Ivoire. Edition de l'ORSTOM. Collection Etudes et Thèse, 102
p.
Anderson, N. H., Cline, P., Aumen, N. G., Sedell, J. R.,
Lienkaemper, G. W., Cromack Jr., K., Cummins, K.W.,1986. Ecology of coarse
woody debris in temperate ecosystems. Adv. Ecol. Res. 15: 133-302.
Asner G. P., Hughes R. F., Varga T. A., Knapp D. E. and
Kennedy-Bowdoin T., 2009. Environmental and Biotic Controls over Aboveground
Biomass Throughout a Tropical Rain Forest. Ecosystems 12, 261 -278
Aubreville A. ,1958.Accord à Yangambi sur la
nomenclature des types africains de végétation. Bois et forets
des tropiques .51 : 23- 27.
Bakker M. &Augusto L., 2009. Les sols forestiers landais :
caractéristiques et effets des pratiques de gestion. UMR TCEM
(INRA-ENITA de Bordeaux), France, pp 3-5.
Banville J., 2009. Caractérisation des stocks de
carbone de 5 types de formations végétales dans un secteur du
bassin versant de la rivière Eastman, baie James. Mémoire de
maîtrise, université du Québec , Montréal, 161
p.
Baraloto C., 2003. Régénération naturelle
: de la graine à la jeune tige. Dynamique des milieux forestiers,
Rev. For. Fr. LV- numéro spécial ,179-187.
Bassatneh Al Cheik M., 2006. Facteurs du milieu, gestion
sylvicole et organisation de la biodiversité : les systèmes
forestiers de la montagne de Lure (Alpes de Haute-Province, France).
Thèse pour obtention du grade de docteur, Discipline : Biologie des
populations et écologie, Faculté des sciences et techniques,
Université Paul Cezanne AIX-Marselle III, 240p.
Batjes, N. H. 1996. Total carbon and nitrogen in the soils of
the world. European Journal of Soil Science 47: 151-163.
50
Birnbaum Ph., Hequet V., Vandrot H., Ibanez T. & Blanchard
E., 2013. Cartographie et caractérisation des faciès forestiers
sur sols volcano-sédimentaires en province nord de
Nouvelle-Calédonie. Rapport final Juin 2013. Botanique et d'Ecologie
Végétale Appliquées. 49p.
Bocko Y. E., 2018. Variation spatiale des stocks de carbone
des forêts marécageuses de la Likouala (Nord-Congo). Thèse
pour l'obtention du grade de Docteur en Biologie et Physiologie
Végétales. Université Marien Ngouabi, Brazzaville, Congo,
131p.
Bocko Y. E., Ifo S. A., Loumeto J. J., 2017. Quantification
des Stocks de carbone de trois pools clés de carbone en Afrique Centrale
: cas de la forêt marécageuse de la Likouala (Nord Congo).
European Scientific Journal February 2017 edition vol.13, No.5 ISSN: 1857 -
7881 (Print) e - ISSN 1857- 743
Boudelal Mahmoud A. B., 2014. Relations structure des
peuplements forestiers, biodiversité au niveau du Parc National de
Tlemcen. Mémoire de Master. Université Abou BekrBelbkaid,
Algérie, 120p.
Boulaine J., 1982. L'agrologie. Collection Que sais-je ?
Presse Universitaire de France, Paris, 127p.
Brady N. C, Weil R. R., 2008. The nature and properties of
soils, 14thed; personed, Columbus, OH, USA.
Campbell, N. A., 1993. Biology. De Boeck Université, 3th
ed. ISBN De Boeck 2-80412084 8
CERAPE., 2011. Monographie du Départementale de la
Likouala. Etude du secteur agricole, République du Congo, 95p.
Chenu C., Klumpp k., Bispo A., Angers D., Colnenne C. et Metay
A., 2014. Stocker du carbone dans les sols agricoles : évaluation de
leviers d'action pour la France. Innovations Agronomiques, vol. 37, pp
: 23-37.
Clements F. E., 1936. Nature and structure of the climax. J. EcoL
24 : 252-284
CNIAF, 2015. Carte de changement du couvert forestier en
république du Congo pour la période 2000 - 2012,32p.
CN-REDD, 2016. Niveau des émissions de
référence pour les forêts (NERF) de la République du
Congo. 65p.
CN-REDD, 2016. Niveau des émissions de
référence pour les forêts (NERF) de la République du
Congo. Soumission au secrétariat de la CCNUCC. Coordination
Nationale REDD, Rapport, 65 p.
COMIFAC, 2013. Les forêts du bassin du Congo: Evolution du
couvert forestier du niveau national ou régional et moteur de changement
Pp.21-47
Condron L., M.; Frossard, E.; Tiessen H.; Newman R. H. &
Stewart J. W. B., 1990. Chemical nature of organic phosphorus in cultivated and
uncultivated soils under different environmental conditions. Journal of Soil
Science 41, 41-50.
Copley, J., 2000. Ecology goes underground. Nature 406:
402-454.
Cramer V. A., Hobbs R. J. and Standish R. J., 2008. What's new
about old fields? Land abandonment and ecosystem assembly Trends Ecol. Evol. 23
104-12
Dalal, R. C., 1977. Soil organic phosphorus. Advances in agronomy
29, 83-113.
De Graaf, M. A., Adkins, J., Kardol, P. & Throop, H. L.,
2015. A meta-analysis of soil biodiversity impacts on the carbon cycle.
SOIL, 1: 257-271.
Diouf J. C., 2011. Dynamique du peuplement ligneux au Ferlo
(Nord - Sénégal), Conséquences et perspectives pour une
Gestion Durable. Thèse pour l'obtention du Doctorat. Écologie,
Université Cheikh Anta Diop De Dakar, Faculté des Sciences et
Techniques Département de Biologie Végétale. 263P.
Don, A, L. Robertson et C. Walter., 2007. «Spatial and
vertical variation of soil carbon attwo grassl
Doucet J. L., 2003. Alliance de la gestion forestière
et de la biodiversité dans les forêts du centre Gabon.
Thèse de doctorat. Faculté universitaire des sciences
agronomiques de Gembloux 323p.
Ebuy J., Mate J. P., Mukandama J. P., Ponette Q., 2016. Chute
des litières et fertilité des sols sous plantations
forestières dans le bassin du Congo : cas de la station
I.N.E.R.A/Yangambi en R.D.C. Journal of Animal &Plant Sciences, 2016.
Vol.31, Issue 1: 4843-4860
Evrard C., 1968 - Recherches écologiques sur le
peuplement forestier des sols hydromorphes de la cuvette centrale congolaise.
Publ. INEAC., ser. Sc. 110, 295
51
FAO, 1999. Techniques de gestion des écosystèmes
forestiers tropicaux : Etat de l'art. 146p.
52
FAO, 2016. Fao : Situation des forêts du monde 2016.
Forêts et agriculture : défis et possibilités concernant
l'utilisation des terres. FAO, Rome, Italie, 137.
FAO. 2002. Actes: Deuxième réunion d'experts sur
l'harmonisation des définitions forestières à l'usage des
différentes parties prenantes. Rome, 11 -13 septembre 2002,
OMM//GIEC/CIFOR/FAO/IUFRO /PNUE, Rome.
FAO. 2006. Evaluation des ressources forestières
mondiales 2005. Etude FAO: forêts, 147 p. Rome.
FAO., 2010. Evaluation des ressources forestières
mondiale. Rapport national Congo. Pp.6-19 FAO., 2012. Changement d'utilisation
des terres forestières mondiales 1990-2005. Rome, Italie, p 1.
FAO., 2017. Carbone Organique du Sol: une richesse invisible.
Rome, Italie, 90p.
Forni E., Rossi V., Gillet J.-F., Bénédet F.,
Cornu G., Freycon V., Zombo I., Mazengue M., Alberny E., Mayinga M., Istace V.,
Gourlet-Fleury S., 2019. Dispositifs permanents de nouvelle
génération pour le suivi de la dynamique forestière en
Afrique centrale : bilan en République du Congo. Bois et
Forêts des Tropiques, 341 : 55-70. Doi :
https://doi.org/10.19182/
bft2019.341.a31760
Foumier A, Floret C. & Gnahoua G-M.,
2001.Végétation des jachères et succession post-culturale
en Afrique tropicale. La jachère en Afrique tropicale - Ch. Floret, R.
Pontanier John Libbey Eurotext, Paris, 123-168 p.
Fournier et Sasson, 1983. Écosystème, structure,
fonctionnement évolution. Collection d'écologie, nasson, Paris,
2ème édition, 312-314p.
Fournier F., Sasson A., 1983. Ecosystèmes forestiers
tropicaux d'Afrique. ORSTOM UNESCO.
Friends of the Earth., 2008. « Forests in a Changing
Climate: Will forests' role in regulating the global climate be hindered by
climate change? », Amsterdam.
Gardi, C. & Jeffery, S., 2009. Soil Biodiversity.
Luxembourg: Centre de recherche commun; Institut pour l'environnement et la
durabilité.
Gougoulias, C., Clark, J. M. & Shaw, L. J., 2014. The role
of soil microbes in the global carbon cycle: tracking the below-ground
microbial processing of plant-derived carbon for manipulating carbon dynamics
in agricultural systems. Journal of the Science of Food
andAgriculture, 94: 2362-2371.
53
Gounot N., 1969. Méthode d'étude quantitative de
la végétation. Ed. Nasson et Cie, Paris, 314, 315 et 316 p.
Gower S. T, Vogel J. G, Norman J. M, Kucharik C. J, Steele S. J,
Stow T. K., 1997. Carbon distribution and aboveground net primary production in
aspe n, jack pine, and black spruce stands in Saskatchewan and Manitoba,
Canada. J GeophysRes 102:29-41.
Greta C. D, Lewis S. L., Lawson I. T., Edward T. A. Mitchard,
Page S. E, Bocko Y. E & Ifo S. A., 2017. Age, extent and carbon storage of
the central Congo Basin peatland complex. doi:10.1038/nature21048
Harris D., Moutsamboté J. M., Kami E., Florence J.,
Bridgewater S. G. M., Wortley A. H., 2011. Introduction aux arbres du
Nord-Congo, 208p.
Harris J. D. and Wortley A. H., 2008. Les arbres de la Sangha
: Manuel d'identification illustré.
Harrison, A. F. 1987. Soil organic phosphorus. A review of world
literature. CAB International, Wallingford UK
Haygarth, P. M. & Jarvis, S. C., 1999. Transfer of phosphorus
from agricultural soils. Advances in agronomy 66, 195-249.
Houghton, R. A., Lawrence, K. T., Hackler, J. L., & Brown, S.
2001. The spatial distribution of forest biomass in the Brazilian Amazon : a
comparison of estimates. Global Change Biology, 7(7), 731-746. 491FL Times
Cited : 124 Cited References Count : 78.
Huber G., et Schaub C., 2011. La fertilité des sols :
l'importance de la matière organique. Service Environnement-Innovation,
46p.
Ifen, 2007. Le stock de carbone dans les sols agricoles
diminue. Les données de l'environnement, n°121, 4p.
Ifo S. A., Mbemba M., Koubouana F., 2017. Stock de carbone
dans les gros débris ligneux végétaux : cas des
forêts tropicales pluvieuses de la Likouala, République du Congo.
European Scientific Journal April 2017 edition Vol.13, No.12 ISSN:
1857 - 7881 (Print) e - ISSN 1857- 7431
Ifo S. A., Moutsambote J. M., Koubouana F., Yoka J., Ndzai S.,
Bouetou-Kadilamio L.N., Mampouya H., Jourdain C., Bocko Y., Mantota A. B.,
Mbemba M., Mouanga-Sokath D.,
54
Odende R., Mondzali R., Yeto E., Mampouya W., Ouissika B. C.
and Loumeto J.J. 2016. Tree Species Diversity, Richness, and Similarity in
Intact and Degraded Forest in the Tropical Rainforest of the Congo Basin: Case
of the Forest of Likouala in the Republic of Congo. Hindawi Publishing
Corporation. 12p. International, Paris. 579 p.
Ifo, A. S., Koubouana, F., Jourdain, C., & Nganga, D.,
2015. Stock and Flow of Carbon in Plant Woody Debris in Two Different Types of
Natural Forests in Bateke Plateau, Central Africa. Open Journal of
Forestry, 5, 38-47.
http://dx.doi.org/10.4236/ojf.2015.51005
IPCC. 2000. Land use, land-use change, and forestry special
report. Cambridge University Press, 377 pp.
Jauffret S., 2001. Validation et comparaison de divers
indicateurs des changements à long terme dans les
écosystèmes méditerranéens arides, application au
suivi de la désertification dans le sud tunisien, Thèse
d'écologie, Université d'Aix Marseille, 328 p.
Jesel S., 2007. Regeneration Ecology and Population. Dynamics
of Dicoryniaguianenis (Ceasalpiniaceae) in a French Guiana Rain forest. Life
science. INAPG (Agroparis Tech) 21p. Kimpouni V., Mbou P., Gakosso G. et Motom
M., 2013. Biodiversité floristique du sous-bois et
régénération naturelles de la forêt de la Patte
d'Oie de Brazzaville. Ecole Normal Supérieure. Université Marien
NGOUABI, Brazzaville, Congo. Int. J. Biol. Chem. Sci. 7(3), 1255-1270.
June 2013.
Kitengé M., 2011. Contribution à l'étude
structurale et floristique comparées des forêts mono dominante et
mixte dans la R.F. de Yoko (Bloc sud, Ubundu). T.F.E. Fac.de Sci, Unikis,
1922p.
Konan D., Bakayoko A., Tra Bi F. H., Bitignon B. G. A. &
Piba S. C., 2015. Dynamisme de la structure diamétrique du peuplement
ligneux des différents biotopes de la forêt classée de
Yapo-Abbé, Sud de la Côte d'Ivoire. Journal of Applied Biosciences
94:8869 - 8879 ISSN 1997-5902
Koubouana F., Ifo S. A., Ndzai S. F., Stoffenne B. et
Mondzali-Lénguya R., 2018 : Étude comparative d'une forêt
Adulte et d'une forêt dégradée au Nord de la
République du Congo par référence à la structure
des forêts tropicales humides. Revue Scientifiue et Technique
Forêt et Environnement du Bassin du Congo Volume 11. PP. 11-25, Octobre
(2018) Print ISSN : 2409-1693 / Online ISSN : 2412-3005
55
Lambin E. F., Geist H. J. et Lepers E., 2003. Dynamics of
land-use and Land-cover change in Tropical Regions. Annual Review of
Environemental Ressource 20: 205-241
LCA, 2008 -
http://www.languedocrousillon.chambagri.fr
Leroy M. Derroire G, Vendé J. Aubet P. M, Espinosa L.
et Lemenager T., 2011. La gestion durable des forêts tropicales : De
l'analyse critique du consept à l'évaluation environnementale des
dispositifs de gestion, France, Agence Française de Developpement.
25p
Letouzey, R.1986. Manuel de botanique forestière.
Centre Technique Forestier Tropical, 3 vol., Nogent-sur-Marne, France.
Malhi Yadvinder, & Grace J., 2000. Tropical forests and
atmospheric carbon dioxide. Trends in Ecology & ; Evolution, 15(8),
332-337.
Mangion, 2010. Le futur mécanisme REDD face aux moteurs
de la déforestation et de la dégradation des forêts au
Brésil, en Indonésie et en RDC. Master en Sciences et Gestion de
l'Environnement. Université Libre de Bruxelles, Belgique, 144p
Marco P., Henry M., Blavet D. et Bernoux M., 2010. Variation
des stocks de carbone organique du sol après plantation
forestière : essai de méta-analyse incluant quelques situations
d'Amérique latine. Bois et forêts des tropiques, n°3
05 (3) ; 21 - 32.
Marklud L. G. et Schoene D., 2006. Global Assessment of
Growing stock, biomass and carbon stock. Forest ressources assessment Programme
Working Paper 106/E, Rome.
MEFE, 2006. Programme d'action national de lutte contre la
déforestation. 57p.
Megevand C., Mosnier A., Hourtica J., Sanders K., Doestinchem
K., Streck C.; 2013. Dynamique de deforestation dans le bassin du Congo:
Réconcilier la croissance économique et la protection de la
forêt ; World Bank ; Washington DC ; 180p.
Mengho B., 2017. Géographie du Congo. L'Harmattan,
2017.
www.editions-harmattan.fr ISBN : 978-2-343-12355-4 EAN :
9782343123554
Meunier Q., Moumbogou C. et Doucet J. L., 2015. Les arbres
utiles du Gabon. Les presses Agronomiques du Gembloux. ISBN :
978-87016-134-0.
Molto Q., 2012. Estimation de biomasse en forêt
tropicale humide : Propagation des incertitudes dans la modélisation de
la distribution spatiale de la biomasse en Guyane
56
française. Thèse : Physiologie et biologie des
organismes, populations, interactions ; Université des Antilles et de la
Guyane, 184p.
Moore J-D., Ouimet R., Camiré C. et Houle D., 2002.
Impact des coupes forestières sur la faune du sol. Le cas d'une
érablière des basses-Laurentides, Canada. Volume
126, numéro 2 - Été 2002. Pages 55-58
Moukolo N., 1992. Etat des connaissances actuelles sur
l'hydrogéologie du Congo Brazzaville. 12 p.
Moutsamboté J. M., 1985. Dynamique de la reconstituions
de forêt Yombé (Dimonoka, R.P. Congo. Thèse pour obtenir le
grade de Doctorat de Spécialité. Université de Bordeaux
III, Paris Pp 48-109.
Moutsamboté J. M., 2012. Etude écologique,
phytogéographique et phytosociologique du Centre et du Nord-Congo,
Brazzaville, (Plateaux, Cuvette, Likouala et Sangha). Thèse d'Etat,
Université Marien Ngouabi, Brazzaville, 632p.
Ndzai S. F., 2015. Etude comparée de la structure
forestière entre les forêts intactes et dégradées de
l'axe Impfondo-Dongou, Département de la Likouala. Mémoire en vue
d'obtention du diplôme de Master professionnel en sciences et Techniques
forestières Université Marien Ngouabi, Brazzaville,
République du Congo, 76p.
NERF, 2016. Soumission au Secrétariat CCNUCC.65P ;
Ngueguim J. R., Zapfack L., Youmbi E., Riera B., Onana J.,
Foahom B. et Makombu J. G., 2010. Diversité floristique sous
canopée en plantation forestière de Mangombe-Edea (Cameroun).
Biotechnol. Agron. Soc. Environ. 2010 14 (1), 167-176. 10p
Nsangua Mposo B., Nshimba Nseya H., Boyemba F., Katusi R.,
Mbayo F., Mbuyu L., 2018. Etude de la variabilité structurale et
floristique des forets sur terre ferme en chefferie de Bahema-Boga (Province de
l'Ituri, RDC). EuropeanScientific Journal October 2018 edition Vol.14,
No.30 ISSN: 1857 - 7881 (Print) e - ISSN 1857- 7431
OFEV, 2016. La protection des sols en forêt contre les
atteintes physiques. La gestion forestière entre les
impératifs de rentabilité et la préservation des
propriétés physiques du so, pp 31-36.
OIBT., 2002. Directive OIBT pour la restauration:
l'aménagement et la réhabilitation des forêts tropicales
dégradées et secondaires. Série OIBT: politique
forestière n° 13. OIBT. Yokohama.
57
OIBT., 2005. Critère et indicateur révisé de
l'OIBT pour l'aménagement durable des forêts tropicales,
modèle du rapport sur C et I inclus. Série OIBT. Politique
forestière n°15. Oldeman, L. R., Hakkeling, R.T.A., Sombroek, W.G.,
1991. World map of the status of humaninduced soil degradation: an explanatory
note. United Nations Environment Programme, Nairobi.
PAM., 2009. Evaluation rapide de la sécurité
alimentaire des refugiés au Département de la Likouala. Likouala,
République du Congo, 12p.
Pan, Y., Birdsey, R.A., Fang, J., Houghton, R., Kauppi, P.E.,
Kurz, W.A. , Phillips, O. L., Shvidenko, A., Lewis, S.L., Canadell, J. G.,
Ciais, P., Jackson, R. B., Pacala, S. W., McGuire, A. D., Piao, S., Rautiainen,
A., Sitch, S. and Hayes, D., 2011. A large and Persistent Carbon Sink in the
World's Forests. Science vol 333, n°6045: 988-993.
Pascal, 2003. Notion sur les structures et dynamique des
forêts tropicales humide 13p.
Pearson T., Harris N., Shoch D., Brown S., 2005. A sourcebook
of methods and procedures for monitoring and reporting anthropogenic greenhouse
gas emissions and removals associated with deforestation, gains and losses of
carbon stocks in forests remaining forests, and forestation. Global
Observation of Forest and Land Cover Dynamics, 25p.
PFBC. 2005. Les forêts du Bassin du Congo. Evaluation
prelininaire, 1-6p
Philippe, Jackson, Robert B., Pacala, Stephen, McGuire, A.
David, Piao, Shilong, Rautiainen, Aapo, Sitch, Stephen, & Hayes, Daniel.
2011. A Large and Persistent Carbon Sink in the World's Forests. Science.
PNLCD., 2006. Problématique de la dégradation des
terres au Congo-Brazzaville, 57p
Quideau, S. A., Chadwick O. A., Benesi A., Graham R. C. et
Anderson M. A., 2001. « A direct link between forest vegetation type and
soi! organic matter composition ». Geoderma, vol. 104, no. 1-2 p.
41-60.
Ramade, F., 1984. Ecologie fondamentale. Ediscience
International, Paris, MacGraw-Hill, 302p.
Rausch C. & Bucher M., 2002. Molecular mechanisms of
phosphate transport in plants. Planta 216, 23-37.
58
Robert M., 1996. Le sol : interface dans l'environnement,
ressource pour le développement. Dunod/Masson, Paris. 240 pp.
Rollet B., 1974. L'architecture des forêts denses
humides sempervirentes des plaines, Paris, 299p
Rousse C., 2010. Où se trouve la biodiversité sur
une exploitation ? Quelques definitions 4p. Rovira, A. D., 1994. The effect of
farming practices on the soil biota. in Soil Biota Management in Sustainable
Farming Systems, Vol.1. in: Pankhurst, C.E., Doube, B.M. Gupta, V.VSR, Grace
P.R.(eds.). C SIRO, Australia.
Rumpel C. & Kögel-Knabner I., 2011. Deep soil organic
matter a key but poorly unders tood component of terre strial C cycle. Plant
and Soil, 338(1-2) : 143-158.
Simon B., 2014. Les racines des plantes. Anatomie et
fonctionnement. Mémoire N3, 58p Sita P., 1989. La forêt tropicale
au Congo. Brazzaville, Congo, 8p.
Syers J. K. & Curtin D., 1989. Inorganic reactions
controlling phosphorus cycling. In: Phosphorus cycles in terrestrial and
aquatic ecosystems. Regional workshop 1: Europe. H. Tiessen. (ed). SCOPE-UNEP,
p. 17-29.
Tilman D., Nature, 2000. The most striking feature of Earth is
the existence of life, and the most striking feature of life is its diversity.
La biodiversité, cours 3, pp 1-2.
UNESCO., 1979. Ecosystèmes forestiers tropicaux. Un
rapport sur l'état des connaissances préparé par l'UNESCO,
le PNUE et la FAO, 740 p.
Van der Wal, A. & De Boer, W. 2017. Dinner in the dark:
Illuminating drivers of soil organic matter decomposition. SoilBiology and
Biochemistry, 105: 45-48.
Vande Weghe J. P., 2004. Forêts d'Afrique Centrale: la
nature et l'homme 367p.
Vennetier P., 1966. Géographie du Congo Brazzaville: la
couverture végétale et les sols du Congo. Pp. 47-53.
Vivien J. et Faure J. J., 1985. Arbres des forêts denses
d'Afrique Centrale, espèces du Cameroun : Agence de Coopération
Culturelle et Technique, 565p.
Volkoff B., Faure P., Dubroeucq D. et Viennot M., 1999.
Estimation des stocks de carbone des sols du Bénin. IRD (ex ORSTOM),
Etude et Gestion des Sols, volume 6, numéro 2, pp : 115-130.
59
Wall, D. H., Nielson, U. N. & Six, J. 2015.
Soilbiodiversity and humanhealth. Nature, 528: 69-76.
Wilks C. et Issembe Y., 2000. Guide pratique d'identification
: les arbres de la Guinée Equatoriale. Région continentale.
CUREF, Bata, Guinée Equatoriale, 546p.
Williams C. H. & Anderson G., 1968. Inositol phosphates in
some Australian soils. Australian Journal of Soil Research 6, 121-130.
A
Annexe : Compostion floristique des differents
types de forêts étudiés
|
Forêt adulte adulte à Lophira alata
(FAL)
|
|
FAMILLES
|
NOMS SCIENTIFIQUES
|
ESPECES
|
INDIVIDUS
|
|
Anacardiaceae
|
Lannea welwitschii Hiern Engl.var.welwitschii
|
3
|
8
|
|
Pseudospondias microcarpa (A.Rich.) Engl.
|
|
Trichoscypha acuminata Engl.
|
|
Annonaceae
|
Cleistopholis patens (Benth.) Engl. & Diels
|
6
|
44
|
|
Greenwayodendron suaveolens Engl. & Diels
|
|
Isolona hexaloba (Pierre) Engl. & Diels
|
|
Monodora angolensis Welw.
|
|
Xylopia aethiopica (Dunal) A. Rich.
|
|
Xylopia hypolampra Mildbr.
|
|
Burseraceae
|
Canarium schweinfurthii Engl.
|
2
|
3
|
|
Dacryodes edulis (G. Don) H.J. Lam.
|
|
Chrysobalanaceae
|
Parinari congensis F. Didr.
|
2
|
4
|
|
Parinari excelsa Sabine
|
|
Clusiaceae
|
Allamblackia floribunda Oliv.
|
6
|
164
|
|
Garcinia epunctata Stapf
|
|
Garcinia ovalifolia Oliv.
|
|
Garcinia punctata Oliv.
|
|
Garcinia smeathmannii (Planch. & Triana) Oliv.
|
|
Mammea africana Sabine
|
|
Ebenaceae
|
Diospyros gilletii De Wild.
|
2
|
51
|
|
Diospyros ituriensis (Gùrke) R. Let et F.
white
|
|
Euphorbiaceae
|
Dichostemma glaucescens Pierre
|
5
|
60
|
|
Macaranga barteri Müll.Arg.
|
|
Macaranga monandra Mull- Arg.
|
|
Macaranga schwinfurthii Pax
|
|
Macaranga spinosa Müll-Arg.
|
|
Fabaceae-
Caesalpinioideae
|
Copaifera salikounda Heckel
|
6
|
211
|
|
Detarium macrocarpum Harms
|
|
Dialium pachyphyllum Harms
|
|
Erythrophleum suaveolens Brenan
|
|
Guibourtia demeusei (Harms) Léon.
|
|
Pachyelasma tessmannii (Harms) Harms
|
|
Fabaceae-Faboideae
|
Angylocalyx pynaertii De Wild
|
3
|
30
|
|
Milletia sanagana Harmes
|
|
Pterocarpus soyauxii Taub.
|
|
Fabaceae-Mimosoideae
|
Albizia ferruginea (Guill. & Perr.) Benth.
|
5
|
27
|
|
Albizia rhomboidea
|
|
Albizia zygia (DC.) J.F. Macbr
|
|
Newtonia devredii G.C.C. Gilbert
|
B
|
Piptadeniastrum africanum (Hook. f.) Brenan
|
|
|
|
Irvingiaceae
|
Irvingia exselsa Mildber.
|
3
|
17
|
|
Irvingia grandifolia (Engl.) Engl.
|
|
Klainedoxa gabonensis Pierre ex Engle.
|
|
Lamiaceae-Viticoideae
|
Vitex grandifolia
|
2
|
2
|
|
Vitex pachyphyllum Bak
|
|
Lecythidaceae
|
Petersianthus macrocarpus (P.Beauv.) Liben
|
2
|
12
|
|
Scytopetatum pierreanum (De Wild.) Tiegh.
|
|
Malvaceae- Bombacoideae
|
Ceiba pentandra (L.) Gaertn.
|
1
|
1
|
|
Malvaceae- Sterculioideae
|
Sterculia tragacantha Lindl.
|
1
|
1
|
|
Malvaceae-Tilioideae
|
Duboscia macrocarpa Brocq.
|
1
|
6
|
|
Meliaceae
|
Glyphea brevis (Spreng.) Monach.
|
4
|
20
|
|
Trichilia gilletii De Wild.
|
|
Trichilia monadelpha (Thonn.) J. J. DE Wild
|
|
Trichilia tessmannii Harms
|
|
Moraceae
|
Anthiaris toxicaria var. welwitschii Lesch
|
2
|
9
|
|
Treculia africana Decne
|
|
Myristicaceae
|
Coelocaryan preussü Warb.
|
4
|
65
|
|
Coelocaryon botryoides Vermoesen
|
|
Pycnantus angolensis (Welv.) Exell
|
|
Staudtia kamerunensis Warb. Var. gabonensis Fouilloy
|
|
Ochnaceae
|
Lophira alata Banks ex C.F.GaertN.
|
2
|
133
|
|
Rhabdophyllum arnoldianum (DeWild. & Th. Dur.)
Van Tiegh.
|
|
Olacaceae
|
Strombosia grandifolia hoof. F.
|
3
|
80
|
|
Strombosia pustulata Oliv.
|
|
Strombosiopsis tetrandra Engl.
|
|
Pandaceae
|
Panda oleosa Pierre
|
1
|
4
|
|
Passifloraceae
|
Barteria fistulosa Mast.
|
1
|
7
|
|
Phyllanthaceae
|
Cleistanthus itsogohensis Pellegr.
|
6
|
73
|
|
Cleistanthus mildbraedrü Jabl
|
|
Hymenocardia ripicola J. Léonard
|
|
Hymenocardia ulmoides Oliv.
|
|
Maesobotrya dusenii (Pax.) Hutch.
|
|
Uapaca guineensis Mull. Arg
|
|
Rubiaceae
|
Aoranthe cladantha (K. Schum.) Somers
|
4
|
7
|
|
Hallea stipulosa (DC.) J.-F.Leroy
|
|
Massularia acuminata (G. Don) Bullock ex Hoyle
|
|
Psydrax arnoldiana (De Wild).
|
|
Sapindaceae
|
Blighia welwitschii (Hiern) Radlk
|
3
|
18
|
|
Eriocoelum microspermum Radlk
|
|
Pancovia laurentii (De Wild.) Gilg ex De Wild.
|
|
Sapotaceae
|
Manilkara pellegriniana Tisser. & Sillans
|
3
|
5
|
|
Synsepalum brevipes (Baker) T.D. Penn.
|
C
|
Tridesmostemon omphalocarpioides Engl.
|
|
|
|
Scytopetalaceae
|
Brazzeia congensis Baill.
|
1
|
9
|
|
Thomandersiaceae
|
Thomandersia hensii De Wild.
|
1
|
43
|
|
Urticaceae
|
Musanga cecropioides R. Br.
|
1
|
1
|
|
Violaceae
|
Rinorea oblongifolia (C.H.Wright) Marquand ex Chipp
|
1
|
1
|
|
TOTAL
|
87
|
1116
|
|
Forêt adultes à Celtis adolfi-friderici
Engl. (FAC)
|
|
FAMILLES
|
NOMS SCIENTIFIQUE
|
ESPECES
|
INDIVIDUS
|
|
Anacardiaceae
|
Lannea welwitschii Hiern Engl.var.welwitschii
|
3
|
5
|
|
Pseudospondias microcarpa (A.Rich.) Engl.
|
|
Trichoscypha acuminata Engl.
|
|
Annonaceae
|
Anonidium mannii (Oliv.) Engl. & Diels
|
1
|
25
|
|
Apocynaceae
|
Greenwayodendron suaveolens Engl. & Diels
|
4
|
2
|
|
Isolona hexaloba (Pierre) Engl. & Diels
|
|
Xylopia hypolampra Mildbr.
|
|
Funtumia africana (Benth.) Stapf
|
|
Bignoniaceae
|
Markhamia tomentosa (Benth.) K.
|
1
|
1
|
|
Burseraceae
|
Canarium schweinfurthii Engl.
|
2
|
2
|
|
Dacryodes edulis (G. Don) H.J. Lam.
|
|
Cannabaceae
|
Celtis adolfi-friderici Engl.
|
1
|
19
|
|
Chrysobalanaceae
|
Parinari excelsa Sabine
|
1
|
1
|
|
Clusiaceae
|
Allamblackia floribunda Oliv.
|
5
|
71
|
|
Garcinia epunctata Stapf
|
|
Garcinia kola Heckel
|
|
Garcinia ovalifolia Oliv.
|
|
Garcinia punctata Oliv.
|
|
Combretaceae
|
Pteleopsis hylodendron Mildbr.
|
2
|
4
|
|
Terminalia superba Engl. Et Diels.
|
|
Ebenaceae
|
Diospyros crassiflora Hiern
|
2
|
14
|
|
Diospyros ituriensis (Gùrke) R. Let et F.
white
|
|
Euphorbiaceae
|
Macaranga barteri Müll.Arg.
|
2
|
4
|
|
Macaranga spinosa Müll-Arg.
|
|
Fabaceae-
Caesalpinioideae
|
Amphimas ferrugineus Pierre ex Pellegr.
|
4
|
36
|
|
Copaifera salikounda Heckel
|
|
Dialium pachyphyllum Harms
|
|
Pachyelasma tessmannii (Harms) Harms
|
|
Fabaceae-Faboideae
|
Angylocalyx pynaertii De Wild
|
2
|
13
|
|
Pterocarpus soyauxii Taub.
|
|
Fabaceae-Mimosoideae
|
Albizia ferruginea (Guill. & Perr.) Benth.
|
4
|
33
|
|
Albizia zygia (DC.) J.F. Macbr
|
|
Penthacletra macrophylla Benth
|
|
Piptadeniastrum africanum (Hook. f.) Brenan
|
D
Gentianaceae
|
Anthocleista schweinfurthii Gilg
|
1
|
1
|
|
Irvingiaceae
|
Irvingia exselsa Mildber.
|
3
|
9
|
|
Irvingia grandifolia (Engl.) Engl.
|
|
Klainedoxa gabonensis Pierre ex Engle.
|
|
Lamiaceae-Viticoideae
|
Vitex grandifolia
|
2
|
2
|
|
Vitex pachyphyllum Bak
|
|
Lecythidaceae
|
Petersianthus macrocarpus (P.Beauv.) Liben
|
1
|
97
|
|
Malvaceae- Sterculioideae
|
Cola nitida (Vent.) Schott & Endl
|
2
|
8
|
|
Sterculia tragacantha Lindl.
|
|
Malvaceae-Tilioideae
|
Duboscia macrocarpa Brocq.
|
1
|
58
|
|
Meliaceae
|
Entandrophragma cylindricum (Sprague) Sprague
|
6
|
62
|
|
Lovoa trichilioides Harms
|
|
|
Trichilia gilgiana Harms
|
|
|
Trichilia gilletii De Wild.
|
|
|
Trichilia monadelpha (Thonn.) J. J. DE Wild
|
|
|
Trichilia tessmannii Harms
|
|
|
Moraceae
|
Anthiaris toxicaria var. welwitschii Lesch
|
4
|
8
|
|
Ficus exasperata Vahl
|
|
Milicia excelsa (Welw.) C.C. Berg
|
|
Treculia africana Decne
|
|
Myristicaceae
|
Coelocaryan preussü Warb.
|
3
|
258
|
|
Pycnantus angolensis (Welv.) Exell
|
|
Staudtia kamerunensis Warb. Var. gabonensis Fouilloy
|
|
Ochnaceae
|
Lophira alata Banks ex C.F.GaertN.
|
1
|
11
|
|
Olacaceae
|
Strombosia grandifolia hoof. F.
|
3
|
133
|
|
Strombosia pustulata Oliv.
|
|
Strombosiopsis tetrandra Engl.
|
|
Pandaceae
|
Microdesmis haumanianus Léonard
|
1
|
20
|
|
Passifloraceae
|
Microdesmis puberula Hook.f.ex Planchon
|
3
|
1
|
|
Panda oleosa Pierre
|
|
Barteria fistulosa Mast.
|
|
Phyllanthaceae
|
Cleistanthus itsogohensis Pellegr.
|
3
|
33
|
|
Hymenocardia ulmoides Oliv.
|
|
Uapaca guineensis Mull. Arg
|
|
Putranjivaceae
|
Drypetes pellegrinii Léandri
|
1
|
6
|
|
Rhizophoraceae
|
Anopyxis klaineana (Pierre) Engl.
|
1
|
1
|
|
Rubiaceae
|
Aoranthe cladantha (K. Schum.) Somers
|
5
|
106
|
|
Cuviera angolensis Welw. ex Hiern
|
|
Massularia acuminata (G. Don) Bullock ex Hoyle
|
|
Pausinystalia johimbe (K.Schum.) Pierre ex Dupouy &
Beille
|
|
Rothmannia whitfieldii (Lindl.) Dandy
|
|
Ruscaceae
|
Dracaena reflexa Lamk.var.nitens Welw.ex Bak.
|
1
|
2
|
|
Sapindaceae
|
Blighia welwitschii (Hiern) Radlk
|
2
|
97
|
|
Pancovia laurentii (De Wild.) Gilg ex De Wild.
|
|
Sapotaceae
|
Chrysophyllum beguei Aubrev.
|
4
|
99
|
E
|
Chrysophyllum perpulchrum Mildber. Ex Hutch. &
Dalziel
|
|
|
|
Synsepalum subcordatum (De Wild.)
|
|
Tridesmostemon omphalocarpioides Engl.
|
|
Thomandersiaceae
|
Thomandersia hensii De Wild.
|
1
|
100
|
|
Urticaceae
|
Musanga cecropioides R. Br.
|
1
|
5
|
|
Violaceae
|
Rinorea oblongifolia (C.H.Wright) Marquand ex Chipp
TOTAL
|
1
85
|
2
1349
|
|
Forêt secondaire à Macaranga monandra
Mull- Arg. (FSMa)
|
|
FAMILLES
|
NOMS SCIENTIFIQUES
|
ESPECES
|
INDIVIDUS
|
|
Achariaceae
|
Lindakeria dentata (Oliv.) Gilg
|
2
|
18
|
|
Oncoba welwitschii Oliv.
|
|
Anacardiaceae
|
Lannea welwitschii Hiern Engl.var.welwitschii
|
2
|
7
|
|
Pseudospondias microcarpa (A.Rich.) Engl.
|
|
Annonaceae
|
Cleistopholis patens (Benth.) Engl. & Diels
|
2
|
5
|
|
Isolona hexaloba (Pierre) Engl. & Diels
|
|
|
Apocynaceae
|
Alstonia boonei De Wild.
|
3
|
8
|
|
Funtumia africana (Benth.) Stapf
|
|
Tabernaemontana crassa Benth.
|
|
Burseraceae
|
Canarium schweinfurthii Engl.
|
2
|
7
|
|
Dacryodes edulis (G. Don) H.J. Lam.
|
|
Cannabaceae
|
Celtis adolfi-friderici Engl.
|
2
|
7
|
|
Trema orientalis (L.) Blume
|
|
Clusiaceae
|
Garcinia punctata Oliv.
|
1
|
2
|
|
Combretaceae
|
Pteleopsis hylodendron Mildbr.
|
2
|
13
|
|
Terminalia superba Engl. Et Diels.
|
|
Ebenaceae
|
Diospyros crassiflora Hiern
|
1
|
1
|
|
Euphorbiaceae
|
Macaranga barteri Müll.Arg.
|
4
|
718
|
|
Macaranga monandra Mull- Arg.
|
|
Macaranga spinosa Müll-Arg.
|
|
Ricinodendron heudelotii (Baill.) Pierre ex Heckel
|
|
Fabaceae-
Caesalpinioideae
|
Amphimas ferrugineus Pierre ex Pellegr.
|
4
|
5
|
|
Copaifera salikounda Heckel
|
|
Dialium pachyphyllum Harms
|
|
Pachyelasma tessmannii (Harms) Harms
|
|
Fabaceae-Faboideae
|
Angylocalyx pynaertii De Wild
|
3
|
20
|
|
Milletia sanagana Harmes
|
|
Pterocarpus soyauxii Taub.
|
|
Fabaceae-Mimosoideae
|
Albizia ferruginea (Guill. & Perr.) Benth.
|
6
|
37
|
|
Albizia laurentii De Wild
|
|
Albizia zygia (DC.) J.F. Macbr
|
|
Parkia filicoidea Welw. ex Oliv.
|
|
Penthacletra macrophylla Benth
|
|
Piptadeniastrum africanum (Hook. f.) Brenan
|
F
Gentianaceae
|
Anthocleista vogelii Planch.
|
1
|
3
|
|
Irvingiaceae
|
Irvingia exselsa Mildber.
|
3
|
10
|
|
Irvingia grandifolia (Engl.) Engl.
|
|
Klainedoxa gabonensis Pierre ex Engle.
|
|
Lamiaceae-Viticoideae
|
Vitex doniana Sweet
|
1
|
17
|
|
Lecythidaceae
|
Petersianthus macrocarpus (P.Beauv.) Liben
|
1
|
26
|
|
Malvaceae-Bombacoideae
|
Ceiba pentandra (L.) Gaertn.
|
1
|
|
|
Malvaceae-Sterculioideae
|
Sterculia tragacantha Lindl.
|
2
|
13
|
|
Theobroma cacao L.
|
|
Malvaceae-Tilioideae
|
Duboscia macrocarpa Brocq.
|
1
|
9
|
|
Meliaceae
|
Entandrophragma cylindricum (Sprague) Sprague
|
4
|
18
|
|
Trichilia gilletii De Wild.
|
|
Trichilia monadelpha (Thonn.) J. J. DE Wild
|
|
Trichilia tessmannii Harms
|
|
Moraceae
|
Anthiaris toxicaria var. welwitschii Lesch
|
6
|
54
|
|
Ficus exasperata Vahl
|
|
Ficus vogeliana (Miq.) Miq
|
|
Milicia excelsa (Welw.) C.C. Berg
|
|
Treculia africana Decne
|
|
Trelipisium madagascariensis DC
|
|
Myristicaceae
|
Coelocaryan preussü Warb.
|
3
|
96
|
|
Pycnantus angolensis (Welv.) Exell
|
|
Staudtia kamerounensis Warb. Var. gabonensis Fouilloy
|
|
Ochnaceae
|
Lophira alata Banks ex C.F.GaertN.
|
1
|
3
|
|
Olacaceae
|
Strombosia grandifolia hoof. F.
|
2
|
8
|
|
Strombosia pustulata Oliv.
|
|
Pandaceae
|
Panda oleosa Pierre
|
1
|
5
|
|
Passifloraceae
|
Barteria fistulosa Mast.
|
1
|
7
|
|
Phyllanthaceae
|
Cleistanthus itsogohensis Pellegr.
|
3
|
8
|
|
Hymenocardia ulmoides Oliv.
|
|
Uapaca guineensis Mull. Arg
|
|
Putranjivaceae
|
Drypetes pellegrinii Léandri
|
1
|
2
|
|
Rhamnaceae
|
Maesopsis eminii Engl.
|
1
|
5
|
|
Rubiaceae
|
Aoranthe cladantha (K. Schum.) Somers
|
6
|
19
|
|
Colletoecema dewevrei (De Wild.) Petit
|
|
Cuviera angolensis Welw. ex Hiern
|
|
Massularia acuminata (G. Don) Bullock ex Hoyle
|
|
Psydrax arnoldiana (De Wild).
|
|
Rothmannia whitfieldii (Lindl.) Dandy
|
|
Rutaceae
|
Zanthoxylum heitzii (Aubrév. & Pellegr.) P.
G. Waterman
|
1
|
2
|
|
Sapindaceae
|
Blighia welwitschii (Hiern) Radlk
|
2
|
6
|
|
Pancovia laurentii (De Wild.) Gilg ex De Wild.
|
|
Sapotaceae
|
Chrysophyllum beguei Aubrev.
|
4
|
6
|
|
Omphalocarpum elatum Miers
|
|
Synsepalum dulcificum (Schumach & Thonn.) Daniell
|
G
|
Tridesmostemon omphalocarpioides Engl.
|
|
|
|
Thomandersiaceae
|
Thomandersia hensii De Wild.
|
1
|
22
|
|
Urticaceae
|
Musanga cecropioides R. Br.
|
2
|
143
|
|
Myrianthus arboreus P. Beauv.
|
|
TOTAL
|
83
|
1332
|
|
Forêt secondaire à Musanga cecropioides
R. Br. (FSMu)
|
|
FAMILLES
|
NOMS SCIENTIFIQUES
|
ESPECES
|
INDIVIDUS
|
|
Anacardiaceae
|
Lannea welwitschii Hiern Engl.var.welwitschii
|
3
|
5
|
|
Pseudospondias microcarpa (A.Rich.) Engl.
|
|
Trichoscypha acuminata Engl.
|
|
Annonaceae
|
Anonidium mannii (Oliv.) Engl. & Diels
|
3
|
10
|
|
Greenwayodendron suaveolens Engl. & Diels
|
|
Isolona hexaloba (Pierre) Engl. & Diels
|
|
Apocynaceae
|
Funtumia africana (Benth.) Stapf
|
1
|
1
|
|
Burseraceae
|
Canarium schweinfurthii Engl.
|
2
|
4
|
|
Dacryodes edulis (G. Don) H.J. Lam.
|
|
Cannabaceae
|
Celtis adolfi-friderici Engl.
|
2
|
8
|
|
Celtis zenkeri Engl.
|
|
Clusiaceae
|
Allamblackia floribunda Oliv.
|
3
|
35
|
|
Garcinia kola Heckel
|
|
Garcinia punctata Oliv.
|
|
Combretaceae
|
Pteleopsis hylodendron Mildbr.
|
1
|
2
|
|
Ebenaceae
|
Diospyros crassiflora Hiern
|
1
|
6
|
|
Euphorbiaceae
|
Macaranga barteri Müll.Arg.
|
4
|
56
|
|
Macaranga monandra Mull- Arg.
|
|
Macaranga spinosa Müll-Arg.
|
|
Ricinodendron heudelotii (Baill.) Pierre ex Heckel
|
|
Fabaceae-
Caesalpinioideae
|
Dialium pachyphyllum Harms
|
3
|
19
|
|
Erythrophleum suaveolens Brenan
|
|
Pachyelasma tessmannii (Harms) Harms
|
|
Fabaceae-Faboideae
|
Angylocalyx pynaertii De Wild
|
3
|
7
|
|
Milletia sanagana Harmes
|
|
Pterocarpus soyauxii Taub.
|
|
Fabaceae-Mimosoideae
|
Albizia ferruginea (Guill. & Perr.) Benth.
|
6
|
13
|
|
Albizia laurentii De Wild
|
|
Albizia zygia (DC.) J.F. Macbr
|
|
Penthacletra macrophylla Benth
|
|
Piptadeniastrum africanum (Hook. f.) Brenan
|
|
Tetrapleura tetraptera (Schumach. & Thonn.) Taub.
|
|
Gentianaceae
|
Anthocleista vogelii Planch.
|
1
|
1
|
|
Irvingiaceae
|
Irvingia exselsa Mildber.
|
3
|
18
|
|
Irvingia grandifolia (Engl.) Engl.
|
|
Klainedoxa gabonensis Pierre ex Engle.
|
H
Lamiaceae-Viticoideae
|
Vitex doniana Sweet
|
1
|
3
|
|
Lecythidaceae
|
Petersianthus macrocarpus (P.Beauv.) Liben
|
1
|
41
|
|
Malvaceae- Bombacoideae
|
Ceiba pentandra (L.) Gaertn.
|
1
|
1
|
|
Malvaceae-Sterculioideae
|
Sterculia tragacantha Lindl.
|
1
|
15
|
|
Malvaceae-Tilioideae
|
Duboscia macrocarpa Brocq.
|
1
|
9
|
|
Meliaceae
|
Carapa procera var procera DC.
|
5
|
28
|
|
Entandrophragma cylindricum (Sprague) Sprague
|
|
Trichilia gilletii De Wild.
|
|
Trichilia monadelpha (Thonn.) J. J. DE Wild
|
|
Trichilia tessmannii Harms
|
|
Moraceae
|
Anthiaris toxicaria var. welwitschii Lesch
|
5
|
11
|
|
Ficus exasperata Vahl
|
|
Milicia excelsa (Welw.) C.C. Berg
|
|
Treculia africana Decne
|
|
Trelipisium madagascariensis DC
|
|
Myristicaceae
|
Coelocaryan preussü Warb.
|
3
|
111
|
|
Pycnantus angolensis (Welv.) Exell
|
|
|
Staudtia kamerunensis Warb. Var. gabonensis Fouilloy
|
|
|
Myrtaceae
|
Psydium goyava
|
1
|
1
|
|
Ochnaceae
|
Lophira alata Banks ex C.F.GaertN.
|
1
|
1
|
|
Olacaceae
|
Ongokea gore (Hua) Pierre
|
3
|
16
|
|
Strombosia grandifolia hoof. F.
|
|
Strombosia pustulata Oliv.
|
|
Pandaceae
|
Microdesmis puberula Hook.f.ex Planchon
|
2
|
7
|
|
Panda oleosa Pierre
|
|
Passifloraceae
|
Barteria fistulosa Mast.
|
1
|
4
|
|
Phyllanthaceae
|
Cleistanthus itsogohensis Pellegr.
|
4
|
9
|
|
Cleistanthus mildbraedrü Jabl
|
|
Hymenocardia ulmoides Oliv.
|
|
Uapaca guineensis Mull. Arg
|
|
Putranjivaceae
|
Drypetes pellegrinii Léandri
|
1
|
4
|
|
Rhamnaceae
|
Maesopsis eminii Engl.
|
1
|
4
|
|
Rubiaceae
|
Aoranthe cladantha (K. Schum.) Somers
|
6
|
21
|
|
Colletoecema dewevrei (De Wild.) Petit
|
|
Cuviera angolensis Welw. ex Hiern
|
|
Massularia acuminata (G. Don) Bullock ex Hoyle
|
|
Pausinystalia johimbe (K.Schum.) Pierre ex Dupouy
&Beille
|
|
Rothmannia whitfieldii (Lindl.) Dandy
|
|
Rutaceae
|
Zanthoxylum heitzii (Aubrév. & Pellegr.) P.
G.Waterman
|
1
|
5
|
|
Sapindaceae
|
Blighia welwitschii (Hiern) Radlk
|
1
|
6
|
|
Sapotaceae
|
Chrysophyllum beguei Aubrev.
|
4
|
32
|
|
Chrysophyllum perpulchrum Mildber. Ex Hutch. &
Dalziel
|
|
Synsepalum dulcificum (Schumach & Thonn.) Daniell
|
|
Tridesmostemon omphalocarpioides Engl.
|

Thomandersiaceae
|
Thomandersia hensii De Wild.
|
1
|
10
|
|
Urticaceae
|
Musanga cecropioides R. Br.
|
2
|
655
|
|
Myrianthus arboreus P. Beauv.
|
|
Violaceae
|
Rinorea oblongifolia (C.H.Wright) Marquand ex Chipp
|
1
|
8
|
|
TOTAL
|
84
|
1187
|
|
Forêt adulte à Guibourtia demeusei
(Harms) Léon. (FAG)
|
|
FAMILLES
|
NOMS SCIENTIFIQUES
|
ESPECES
|
INDIVIDUS
|
|
Anacardiaceae
|
Lannea welwitschii Hiern Engl.var.welwitschii
|
2
|
5
|
|
Pseudospondias microcarpa (A.Rich.) Engl.
|
|
Annonaceae
|
Cleistopholis patens (Benth.) Engl. & Diels
|
4
|
14
|
|
Xylopia aethiopica (Dunal) A. Rich.
|
|
Xylopia hypolampra Mildbr.
|
|
Xylopia staudtii Engl. & Diels
|
|
Chrysobalanaceae
|
Parinari congensis F. Didr.
|
1
|
2
|
|
Clusiaceae
|
Garcinia ovalifolia Oliv.
|
3
|
22
|
|
Garcinia punctata Oliv.
|
|
Garcinia smeathmannii (Planch. & Triana) Oliv.
|
|
Ebenaceae
|
Diospyros gilletii De Wild.
|
2
|
109
|
|
Diospyros ituriensis (Gùrke) R. Let et F.
white
|
|
|
Euphorbiaceae
|
Croton haumananus J. Léonard
|
5
|
11
|
|
Dichostemma glaucescens Pierre
|
|
Macaranga monandra Mull- Arg.
|
|
Macaranga schwinfurthii Pax
|
|
Margaritaria discoidea (Baill.) Webster
|
|
Fabaceae-
Caesalpinioideae
|
Daniellia pynaertii De Willd.
|
3
|
185
|
|
Dialium pachyphyllum Harms
|
|
Guibourtia demeusei (Harms) Léon.
|
|
Fabaceae-Faboideae
|
Baphia dewevrei De Wild.
|
1
|
11
|
|
Fabaceae-Mimosoideae
|
Albizia laurentii De Wild
|
6
|
65
|
|
Albizia rhomboidea
|
|
Albizia zygia (DC.) J.F. Macbr
|
|
Paramacrolubium coeruleum (Taub.) J. Léonard
|
|
Parkia bicolor A. Chev.
|
|
Parkia filicoidea Welw. ex Oliv.
|
|
Irvingiaceae
|
Irvingia exselsa Mildber.
|
2
|
5
|
|
Klainedoxa gabonensis Pierre ex Engle.
|
|
Lecythidaceae
|
Brazzeia congensis Baill.
|
2
|
32
|
|
Scytopetatum pierreanum (De Wild.) Tiegh.
|
|
Malvaceae-Sterculioideae
|
Sterculia tragacantha Lindl.
|
1
|
2
|
|
Malvaceae-Tilioideae
|
Duboscia macrocarpa Brocq.
|
1
|
1
|
|
Meliaceae
|
Trichilia gilgiana Harms
|
1
|
1
|
|
Moraceae
|
Treculia africana Decne
|
1
|
2
|
|
Myrtacées
|
Syzygium rowlandii
|
1
|
1
|
J
Ochnaceae
|
Lophira alata Banks ex C.F.GaertN.
|
1
|
7
|
|
Olacaceae
|
Strombosia pustulata Oliv.
|
1
|
1
|
|
Phyllanthaceae
|
Cleistanthus itsogohensis Pellegr.
|
7
|
179
|
|
Cleistanthus mildbraedrü Jabl
|
|
Cleistanthus ripicola Léonard
|
|
Hymenocardia ripicola J. Léonard
|
|
Maesobotrya dusenii (Pax.) Hutch.
|
|
Margaritaria discoidea (Baill.) Webster
|
|
Uapaca heudelotii Baill.
|
|
Putranjivaceae
|
Drypetes paxii Hutch.
|
1
|
5
|
|
Rubiaceae
|
Corynanthe pachyceras K.Schum.
|
5
|
33
|
|
Morelia senegalensis A. Rich.
|
|
Pausinystalia johimbe (K.Schum.) Pierre ex Dupouy &
Beille
|
|
Psydrax subcordata DC
|
|
Sarcocephalus diderrichii (De Wild. & T. Durand)
Merr.
|
|
Sapotaceae
|
ManilKara fouilloyana Aubr. Et Pellegr
|
2
|
15
|
|
Synsepalum brevipes (Baker) T.D. Penn.
|
|
TOTAL
|
52
|
708
|
|
|



