|
|
UNIVERSITÉ
Joseph KI-ZERBO
|
|
|
École Doctorale
Sciences et Technologies
|
|
Laboratoire d'Entomologie
Fondamentale et Appliquée (LEFA)
|
|
N° d'ordre :
|
Thèse Présentée
Par Mahamoudou
BALBONE
Pour obtenir le grade de
Docteur de
l'Université Joseph KI-ZERBO
Option : Sciences Biologiques
Appliquées
Spécialité : Entomologie
Alternative à la résistance aux
pyréthrinoïdes au Burkina Faso : Évaluation
des
activités insecticides et répulsives-irritantes d'huiles
essentielles de plantes locales
seules et en combinaison sur les populations
de Anopheles gambiae et de Aedes
aegypti (Diptera:
Culicidae).
Soutenue le 17 décembre 2022, devant le jury
composé de :
Président : Laya
SAWADOGO, Professeur titulaire, Université Joseph KI-ZERBO
Membres :
- Ibrahima DIA, Directeur de recherche, Institut
Pasteur-Dakar (Rapporteur)
- Cédric PENNETIER, Chercheur, HDR,
MIVEGEC-IRD-Montpellier (Rapporteur)
- Moussa NAMOUNTOUGOU, Maître de
Conférences, Université Nazi-Boni (Examinateur)
- Olivier GNANKINE, Professeur titulaire,
Université Joseph KI-ZERBO (Directeur de thèse)
Année Académique 2021 - 2022
DEDICACE
Je rends gloire à Allah Le Miséricordieux qui m'a
permis de produire cette thèse.
Je dédie ce mémoire tout d'abord à ma
famille :
- A mes feus parents (grand-père, père et
mère) qui m'ont inspiré tout au long de cette
aventure ;
- A ma grand-mère KERE Awa (Adja) pour toutes ses
bénédictions ;
- Ma 2e mère YEMBONE Fatoumata qui s'est sentie
abandonnée durant la période de mes
recherches ;
- A mon épouse Azara et mes enfants Fadela et Firdaws qui
ont su supporter mes
différentes absences et mes humeurs durant mes travaux de
recherche ;
- A mon Directeur de thèse Professeur GNANKINE et sa
famille pour leurs soutiens
multiformes.
Thèse de Doctorat unique j
REMERCIEMENTS
Ce travail est le fruit de quatre années
d'études universitaires et d'une collaboration fructueuse entre deux
institutions auxquelles je ne saurais exprimer assez ma profonde gratitude. Je
cite : l'Université Joseph KI-ZERBO
(UJKZ) à travers le Laboratoire d'Entomologie
Fondamentale et Appliquée (LEFA) et l'Unité de Formation et de
Recherche en Sciences de la Vie et de la Terre (UFR/SVT) à Ouagadougou,
Burkina Faso ; l'Institut de Recherche en Sciences de la
Santé/Direction Régionale de l'Ouest
(IRSS/DRO) à travers le Laboratoire
d'Entomologie et Parasitologie Médicales (LEPM) à Bobo-Dioulasso,
Burkina Faso.
Cette thèse a pu être réalisée
grâce à l'appui financier de The World Academy of Science (TWAS)
à travers le financement TWAS 18-163 RG/BIO/AF/AC_G - FR3240303649
octroyé au Professeur Olivier GNANKINE, coordonnateur
du Projet, qui m'a permis de terminer ma thèse dans de bonnes
conditions.
C'est de tout coeur que je tiens à remercier tous ceux
qui, de près ou de loin, ont contribué à la
réalisation de ce travail. La liste est longue mais, dans les lignes qui
suivent, je tiens particulièrement à nommer certains dont le
soutien a été inconditionnel. Nos sincères remerciements
vont :
Au Professeur Olivier GNANKINE,
Enseignant-chercheur à l'Université Joseph KI-Zerbo, mon
directeur de thèse, qui a dirigé de bout en bout ce travail avec
toute la dextérité et la clairvoyance requises. J'ai
été honoré de faire partie de son équipe, de
travailler à ses côtés et de profiter de son immense
savoir. Sa disponibilité, sa sollicitude, sa magnanimité, sa
rigueur scientifique, ses immenses qualités humaines ainsi que ses
soutiens multiples et multiformes ont permis de mener cette thèse
à bon port et dans de meilleures conditions. C'est à lui que je
dois la plus importante part de mes connaissances dans le domaine de la
recherche scientifique de façon générale et de
l'entomologie en particulier. Professeur, sachez que vous avez
été pour moi plus qu'un Directeur de thèse. Merci pour
toute la confiance portée à mon égard et aussi pour vos
permanents soutiens et conseils. Donc, du fond du coeur, MERCI à vous
mon Mentor !
Au Professeur Roch K. DABIRE, Directeur de
Recherche, Directeur de l'Institut de Recherche en Sciences de la Santé/
Direction Régionale de l'Ouest (IRSS/DRO), de m'avoir accepté
dans votre institut, aussi pour les encouragements et la confiance
placée en moi.
Au Professeur Antoine SANON,
Enseignant-chercheur à l'Université Joseph KI-ZERBO
Thèse de Doctorat unique ii
et Responsable du Laboratoire d'Entomologie Fondamentale et
Appliquée (LEFA), pour m'avoir accepté dans son laboratoire, pour
ses conseils et la formation de qualité que nous avons reçue de
lui.
Au Professeur Laya SAWADOGO,
Enseignant-chercheur à l'Université Joseph KI-ZERBO,
Président du jury de cette thèse. Cher Maître, les mots ne
sauraient exprimer toute notre reconnaissance et notre profonde gratitude !
Docteur Moussa NAMOUNTOUGOU,
Enseignant-chercheur à l'Université Nazi-Boni et Chercheur
associé en Entomologie Médicale à l'IRSS DRO, qui a
accepté avec enthousiasme d'examiner ce travail de thèse. Plus
qu'un privilège, c'est un honneur pour moi de faire ces premiers pas
dans la recherche à vos côtés. Cher maître, sachez
que vous êtes un modèle pour moi à plus d'un titre. Je vous
suis infiniment reconnaissant pour les moyens matériels, scientifiques
mis à ma disposition pour ce travail. Veuillez trouver ici l'expression
de ma profonde gratitude.
Au Docteur Ibrahima DIA, Directeur de
recherche à l'Institut Pasteur de Dakar, Sénégal,
éminents spécialistes de l'entomologie médicale, qui a
bien voulu lire cette thèse et apporter des suggestions très
pertinentes, malgré leurs multiples occupations. Toute ma gratitude et
ma reconnaissance pour avoir consacré beaucoup de votre temps pour
l'amélioration de ce travail !
Au Docteur Cédric PENNETIER,
Chercheur, HDR, MIVEGEC-IRD-Montpellier, pour avoir accepté avec
promptitude d'être rapporteur de cette thèse. Cher Maître
les mots ne sauraient exprimer toute notre reconnaissance et notre profonde
gratitude !
Au Docteur Samson GUENNE, Maître de
Conférences à l'Université Joseph KI-ZERBO, pour avoir
accepté avec promptitude d'être rapporteur de cette thèse.
Veuillez trouver ici l'expression de ma profonde gratitude.
Au Docteur Dieudonné Diloma SOMA, pour
son encadrement et sa disponibilité. Travailler pendant toutes ces
années auprès de vous a été un plaisir aux plans
professionnel et humain. Vous m'avez accordé votre confiance et votre
aide, je vous en suis immensément reconnaissant. Vos conseils et vos
qualités d'ainé en Entomologie ont énormément
compté dans le succès de ces travaux de thèse, soyez-en
remercié.
Au Professeur Imaël Henri Nestor
BASSOLE, Enseignant-chercheur à l'Université Joseph
Ki-Zerbo, à qui nous adressons nos sincères remerciements et
toute notre reconnaissance pour sa collaboration dans l'aboutissement de cette
thèse. Nous souhaitons pouvoir bénéficier
Thèse de Doctorat unique iii
Thèse de Doctorat unique iv
toujours de cette collaboration.
Au Docteur Roger C.H. NEBIE, Chercheur en
chimie organique, Directeur de recherche au CNRST et premier responsable de
l'Institut de Recherche en Sciences Appliquées et Technologies à
qui j'adresse mes sincères remerciements et toute ma reconnaissance pour
sa collaboration dans l'aboutissement de cette thèse.
Au Docteur Ahmed COULIBALI,
Enseignant-chercheur à l'Université Norbert ZONGO de Koudougou,
merci pour vos conseils, encouragements et contributions à la
réalisation de ce document.
Au Docteur Etienne BILGO, Chercheur en
Entomologie Médicale à l'Institut de Recherche en Sciences de la
Santé/ Direction Régionale de l'Ouest (IRSS/DRO) à qui
j'adresse mes sincères remerciements et toute ma reconnaissance pour sa
collaboration dans l'aboutissement de cette thèse.
Au Docteur Koama BAYILI, à qui
j'adresse mes sincères remerciements et toute ma reconnaissance pour sa
collaboration dans l'aboutissement de cette thèse.
Au Docteur Samuel Fogné DRABO,
Enseignant-chercheur au Centre Universitaire de Ziniaré, pour sa
collaboration, son soutien et ses conseils.
Au Docteur Rahim Romba, Enseignant-chercheur
à l'Université Joseph KI-ZERBO pour sa collaboration, ses
conseils et ses encouragements.
Au Docteur François D. Sales Hien,
Chercheur en Entomologie Médicale à l'Institut de Recherche en
Sciences de la Santé/ Direction Régionale de l'Ouest (IRSS/DRO)
à qui j'adresse mes sincères remerciements et toute ma
reconnaissance pour sa collaboration dans l'aboutissement de cette
thèse. Merci « capitaine » pour avoir facilité mon
intégration dans l'équipe de football de l'IRSS/Centre MURAZ.
Au Docteur Aristide S. HIEN, Chercheur en
Entomologie Médicale à l'Institut de Recherche en Sciences de la
Santé/ Direction Régionale de l'Ouest (IRSS/DRO) pour ses
conseils et ses encouragements.
Aux Docteurs Charles NIGNAN, Dimitri W. WANGRAWA
et Serge B. PODA, pour leurs conseils et leurs
encouragements.
Au grand frère Casimir GNANKINE pour
ses apports pendant les corrections de nos articles scientifiques.
A tous les Enseignants de l'UFR/SVT et particulièrement
à ceux du département de
Biologie et Physiologie Animale pour les encouragements et les
conseils durant toutes ces années de formation. Nous pensons aux :
Professeur Mahamoudou DICKO, Professeur Balé
BAYALA, Professeur Athanase BADOLO, Docteur
Malika KANGOYE, Professeur Joseph BOUSSIM,
Docteur Ernest R. TRAORE, Docteur Zakaria
ILBOUDO, Docteur Samson GUENNE, Docteur
Moussa COMPAORE, Docteurs Fousseni TRAORE et
Lacina TRAORE.
Au personnel de l'Institut de Recherche en Sciences
Appliquées et Technologies (IRSAT), particulièrement à
Monsieur SAWADOGO Ignace.
A tous les travailleurs de l'Institut de Recherche en Sciences
de la Santé/ Direction Régionale Ouest (IRSS/DRO). Je cite
particulièrement, Baudoin DABIRE, Ali
SANOU, Maurice COMBASSERE, Leonard
BAZIE, Simplice SANOU, Hamidou TRAORE
(mon kalanfa), Hervé SOMDA, Siaka
TOURO. Une mention spéciale à George Benson
MEDA, technicien à l'IRSS/DRO, pour ses conseils et ses
soutiens multiformes. Merci mon frère de Koper.
Aux étudiants stagiaires à l'IRSS/DRO,
particulièrement, Mahamadi KHIÈTEGA,
Didier A. KABORE, KONATE Hamadou,
Samina MAIGA, Kelly Lionelle NGAFFO,
Daniel SANOU, Delphine O. KARAMA,
Abdramane CAMARA, TOE Oumar, BELEM Ismael.
Merci à tous mes amis de l'IRSS/Centre Muraz pour tous
les bons moments passés ensemble: Docteur Bazoma BAYILI, Roger
SANOU, Siaka TOURO, Thomas BAZIÉ, Docteur
Séverin N'DO, Bernard SOMÉ, Kambou Sansan Simplice,
Dabiré Bodouin, Emmanuel Sougué, Rodrigue DAH, NEA Catherien,
Abel S. MILLOGO, Issaka SARÉ, docteur Lassane KOALA. Je vous
suis très reconnaissant de l'amitié que vous me portez.
A tous mes amis de l'UFR SVT et particulièrement ceux
du LEFA: OUEDRAGO Y. Theodore, Docteur Edouard DRABO, COMPAORE Idrissa,
YAMEOGO Felix, SANON Aboubacar, SAGNON Bakary, Prisca S. PARE, Mariam
YOUBA.
A mes collegues Inspecteurs de l'Enseignement Secondaire,
particulièrement à Emmanuel ZONGO, Boukary CONSEIBO,
Hermane P. BONOU, Benjamin BALBONE, Abdoulaye BALBONE, Innocent BAMOUNI, Jean
P. S. TONI, Magloire B. SOME, Harouna DEMBELE, Lacina TRAORE, Kalifa G. TRAORE,
Raoul SANON.
A mes oncles, Issa BALBONNE, Salifou BALBONE,
Mahamoudou BALBONE
Thèse de Doctorat unique v
BALBONE Ibrahim, Dahiman
BALBONE, Yacouba BALBONET (Champion), ma
grand-mère Adja Awa KERE, à mes mamans
Fatoumata (Toubabou), Fatimata (Korlos),
Abibou (Nagouta), Zenabou (Worotigui), Feue
Awa (Yabaworo), Aguiratou (Yababinré)
et à mes grand frères Abdoulaye, Aboukare, Dramane,
Oumarou, Inoussa, Drissa (Vichy), Issa (Kofi koffi),
à la famille SEONI pour leurs soutiens, leurs conseils
et leurs bénédictions.
A mes amis (es), Souleymane KERE,
Emmanuel SORGHO, Bakary BAMBARA,
Ousmane SORGHO, Boubakar GUINKO,
Mamadou WARMA, Drissa ZARE, Docteur
Boukari SORGHO, Rodolphe BANCE,
Issiaka KERE, Jérémy NANA,
Abdoulaye TANOU, Docteur ILBOUDO Hermann,
Madina ZEBA, Mariam KERE, Docteur
Hamidou MAIGA, Docteur Grissoum TARNAGDA,
Docteur Oumarou SAMBARE, Nassirou NOMBRE, Karim
YENKENE, Docteur Mamadou BOUNTOGO et Issouf
BALBONE. Merci pour vos soutiens multiformes.
Thèse de Doctorat unique vi
SOMMAIRE
DEDICACE i
REMERCIEMENTS ii
SOMMAIRE vii
LISTE DES FIGURES xi
LISTE DES TABLEAUX xiii
SIGLES ET ABREVIATIONS xv
Publications et Communications Scientifiques
xvi
Résumé xix
Abstract xx
PARTIE 1 : REVUE BIBLIOGRAPHIQUE - 7 -
1- 1. Vecteurs du paludisme et de la dengue - 8
-
1- 1.1. Classification - 8 -
1- 1.2. Cycle de développement des moustiques -
9 -
1- 1.2.1. Phase pré-imaginale - 9 -
1- 1.2.2. La phase imaginale - 11 -
1- 1.3. Répartition géographique
mondiale des moustiques Aedes aegypti et
Anopheles
gambiae . - 14 -
1- 1.4. Écologie et comportement des moustiques
- 16 -
1- 1.5. Les conséquences du repas sanguine des
femelles de Aedes et de Anopheles - 18 -
1- 2. Méthodes de luttes antivectorielle
actuelles - 18 -
1- 2.1. La diminution du contact homme-vecteur - 18
-
1- 2.2. La diminution de la densité vectorielle
- 20 -
1- 2.2.1. La Lutte biologique - 20 -
1- 2.2.2. Lutte physique - 21 -
1- 2.2.3. La lutte chimique - 22 -
1- 2.3.1. La lutte chimique - 24 -
1- 2.3.2. Lutte génétique - 25 -
1- 3. Mécanismes de résistance des
moustiques aux insecticides - 26 -
1- 3.1. Résistances liées à la
modification physiologique - 27 -
Thèse de Doctorat unique vii
|
1- 3.1.1. Mécanismes de résistance
métabolique
|
- 27
|
|
1- 3.1.2. La résistance cuticulaire
|
- 29
|
|
1- 3.2. La résistance liée à la
modification de la cible
|
- 29
|
|
1- 3.2.1. Les mutations kdr/le canal sodium
|
- 29
|
|
1- 3.2.2. La mutation Ace-1/l'acétylcholinestérase
(AChE)
|
- 29
|
|
1- 3.3. Résistance comportementale
|
- 30
|
|
1- 4. Stratégies de gestion de la
résistance aux insecticides
|
- 30
|
|
1- 4.1. Peintures insecticides
|
- 31
|
|
1- 4.2. L'ivermectine comme outil de lutte
antivectorielle
|
- 32
|
|
1- 4.3. Les stratégies des pièges à
appât sucré et des « tubes d'avant-toit »
|
- 32
|
|
1- 4.4. Huiles essentielles comme bio-insecticides
alternatifs
|
- 33
|
|
1.5. Importance des HE
|
- 35
|
|
PARTIE 2 : METHODOLOGIE GENERALE
|
- 37
|
|
2- 1. Cadre d'étude
|
- 38
|
|
2- 2. Matériel
|
- 40
|
|
2- 2.1. Matériel végétal
|
- 40
|
|
2- 2.2. Matériel animal : les souches de
moustiques
|
- 43
|
|
2- 2.3. Matériel physique
|
- 43
|
|
2- 2.3.1. Matériels d'extraction des huiles
végétales
|
- 43
|
|
2- 2.3.3. Matériels pour les tests
bio-essais.
|
- 44
|
|
2- 3. Méthodes
|
- 45
|
|
2- 3.1. Collecte larvaire et élevage des
moustiques
|
- 45
|
|
2- 3.2. Techniques d'extraction
|
- 46
|
|
2- 3.3. Caractérisation des huiles essentielles
|
- 47
|
|
2- 3.3.1. L'analyse par chromatographie en phase gazeuse
(CPG)
|
- 47
|
|
2- 3.3.2. L'analyse par chromatographie en phase gazeuse
couplée avec la
|
- 47
|
|
spectrométrie de masse (CPG/SM)
|
- 47
|
|
2- 3.3.3. Identification des composants des huiles
|
- 48
|
- - - - - - - - - - - - - - - - - - -
2- 2.3.2. Matériels pour l'élevage des
larves et adultes de An. gambiae et de Ae. aegypti - 44 - - -
- - - - - - - 2- 3.4. Méthode de dilution des huiles
essentielles et des combinaisons d'huiles essentielles
- 48 -
Thèse de Doctorat unique viii
|
2- 3.5. Imprégnation des papiers
|
- 49 -
|
|
2- 4. Analyse des données
|
- 50 -
|
|
PARTIE 3 : RESULTATS ET DISCUSSIONS
|
- 51 -
|
Chapitre 1 : Activités larvicides de cinq huiles
essentielles extraites de cinq plantes locales vis-à-vis des populations
de Aedes aegypti et de Anopheles gambiae collectés
à l'Ouest du
|
Burkina Faso.
|
- 53 -
|
|
3- 1-1. Introduction
|
- 53 -
|
|
3-1-2. Méthodologie : tests larvaires
|
- 54 -
|
|
3- 1-3. Résultats
|
- 55 -
|
|
3- 1-3.1. Caractérisation chimique des huiles essentielles
|
- 55 -
|
|
3- 1-3.2. Activités larvicides des huiles essentielles
sur Anopheles gambiae
|
- 57 -
|
|
3- 1-3.3. Activités larvicides des huiles essentielles sur
Aedes aegypti
|
- 60 -
|
|
3- 1-4. Discussion
|
- 63 -
|
|
3- 1-5. Conclusion partielle
|
- 66 -
|
Chapitre 2 : Évaluation des
propriétés adulticides des huiles essentielles de cinq plantes
locales et des combinaisons de deux d'entre elles sur des populations de
Aedes aegypti et de
|
Anopheles gambiae (Diptera : culicidae) de
l'Ouest du Burkina Faso.
|
- 67 -
|
|
3- 2-1. Introduction
|
- 67 -
|
|
3- 2-2. Méthodologie : test de sensibilité
en tubes OMS
|
- 68 -
|
|
3- 2-3. Résultats
|
- 69 -
|
|
3- 2-3.1. Caractérisation chimique des huiles essentielles
|
- 69 -
|
|
3- 2-3.2. Tests adulticides sur les populations de Anopheles
gambiae
|
- 70 -
|
|
3- 2-3.2.1. L'activité des huiles essentielles
|
- 70 -
|
|
3.2.3.2.2. L'activité des combinaisons des huiles
essentielles
|
- 73 -
|
|
3- 2-3.3. Tests adulticides sur les populations de Aedes
aegypti
|
- 78 -
|
|
3- 2-3.3.1. L'activité des huiles essentielles
|
- 78 -
|
|
3- 2-3.3.2. L'activité des combinaisons des huiles
essentielles
|
- 82 -
|
|
3- 2-4. Discussion
|
- 86 -
|
|
3- 2-5. Conclusion partielle
|
- 90 -
|
Chapitre 3 : Activité excito-répulsive de
cinq huiles essentielles extraites de plantes locales
contre les vecteurs de la dengue et du paludisme au
Burkina Faso - 91 -
Thèse de Doctorat unique ix
Thèse de Doctorat unique x
3- 3-1. Introduction partielle - 91 -
3- 3-2. Méthodologie : test
répulsif-irritant par contact - 92 -
3.3.3. Résultats - 95 -
3.3.3.1. Réponses comportementales avec les populations
de Anopheles gambiae - 95 -
3- 3-3.2. Réponses comportementales avec les
populations de Aedes aegypti - 99 -
3- 3-4. Discussion - 101 -
3- 3-5. Conclusion partielle - 103 -
1. Discussion générale - 106
-
1.1. Les huiles essentielles comme des larvicides -
106 -
1.2. Les cinq (5) HE et les combinaisons de deux (2)
d'entre elles comme adulticides - 107 -
1.3. Les huiles essentielles comme répulsifs
anti moustiques - 109 -
2. Conclusion générale et perspectives
- 110 -
REFERENCES BIBLIOGRAPHIQUES - 112 -
ANNEXES - 145 -
LISTE DES FIGURES
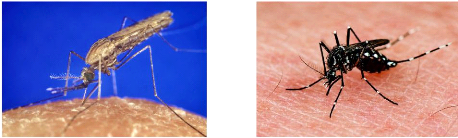
Figure 1: Images de Anopheles gambiae (A) et
Aedes aegypti (B) - 9 -
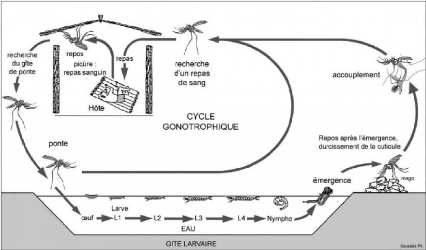
Figure 2: Cycle biologique de l'anophèle (Carnevale et
al., 2009) - 13 -
Figure 3: Cycle de développement des moustiques (
http://www.institutpasteur.nc/les-moustiques-
|
et-la-dengue/)
|
- 13 -
|
|
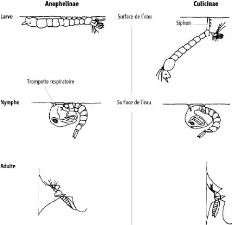
Figure 4: Comparaison des Anophelinae et Culicinae (OMS 2013)
|
- 14 -
|
|
Figure 5: Répartition géographique mondiale de
Aedes aegypti (Kraemer et al., 2015). ...
|
- 15 -
|
Figure 6: Distributions potentielles de Anopheles gambiae
dans les conditions climatiques
actuelles (Li et al., 2021). - 16 -
Figure 7 :
Méthodes biologiques de contrôle des moustiques (Benelli, Jeffries
& Walker, 2016)
.- 21 -
Figure 8: Mécanismes de résistance
des vecteurs aux insecticides (in Carnevale et Robert, 2009)
|
- 27 -
Figure 9: Appareils d'extraction des huiles essentielles (A =
Appareil de Clevenger ; B =
|
|
Alambic ; C = Dispositif par le Soxhlet)
|
- 35 -
|
|
Figure 10: Présentation des sites d'études
|
- 40 -
|
|
Figure 11: Les plantes dont les huiles essentielles ont
été extraites
|
- 42 -
|
|
Figure 12: Clevenger pour extraction d'huiles essentielles
(Cliché Balboné, 2019)
|
- 44 -
|
|
Figure 13: Collecte larvaire et élevage de moustiques
|
- 46 -
|
|
Figure 14: Chromatographe en phase gazeuse couplé avec
spectromètre de masse
|
- 48 -
|
Figure 15: Les huiles essentielles et l'imprégnation des
papiers whatman (Cliché Balboné, 2020)
- 49 -
Figure 16: Quelques étapes du test larvaire - 55 -
Figure 17: Mortalités des larves de la souche sensible de
An. gambiae « Kisumu » en fonction des
concentrations des HE. (Les barres d'erreurs
représentent l'IC à 95%) ............... - 59 -
Figure
18: Mortalités des larves de la souche de terrain de An.
gambiae « VK » en fonction des
concentrations des HE. (Les barres d'erreurs
représentent l'IC à 95%) - 59 -
Figure 19:
Mortalités en fonction des concentrations des HE des larves de la souche
de Ae.
aegypti de Bobo-Dioulasso. (Les barres d'erreurs
représentent l'IC à 95%) .- 62
-
Thèse de Doctorat unique xi
Figure 20: Mortalités en fonction des concentrations des
HE des larves de la souche de Ae.
aegypti de Bobo-Dioulasso. (Les barres d'erreurs
représentent l'IC à 95%). ... - 63 -
Figure 21: Quelques étapes du déroulement des tests
bioessais - 69 -
Figure 22: Taux de Mortalité des adultes de An.
gambiae Kisumu et VK en fonction des
concentration des HE. (Les barres d'erreurs
représentent l'IC à 95%). - 71 -
Figure 23: Taux
de Mortalité des adultes de An. gambiae de Kisumu et VK en
fonction des concentration des combinaisons des HE de C. nardus et
O. americanum. (Les barres
d'erreurs représentent l'intervalle de confiance
à 95%). - 74 -
Figure 24: Mortalité des adultes de Ae. aegypti
en fonction des concentrations des HE. - 80 -
Figure 25: Mortalité des adultes de Ae. aegypti
en fonction des concentration des combinaisons des HE de C. nardus
et O. americanum. (Les barres d'erreurs représentent
l'IC à 95%).- 82
-
Figure 26: Dispositif de Grieco et al. (2005) adapté
à Anopheles gambiae (Deletre et al. 2013)
- 93 -
Figure 27: Présentation des tubes OMS (OMS 2022b) - 94
-
Figure 28: Déroulement des tests répulsifs
irritants de contact - 94 -
Figure 29: Taux d'échappés des femelles de la
souche sensible de Anopheles gambiae «Kisumu» aux 5 HE, au
DEET et à la perméthrine et, le dendrogramme représentant
les réactions comportementales obtenues par le regroupement
hiérarchique de ces insecticides selon leurs
effets irritants de contact. - 98 -
Figure 30: Taux
d'échappés des femelles de la souche de terrain de Anopheles
gambiae «VK» aux 5 HE, au DEET et à la perméthrine
et, le dendrogramme représentant les réactions comportementales
obtenues par le regroupement hiérarchique de ces insecticides selon
leurs
effets irritants de contact. - 98 -
Figure 31: Taux
d'échappés des femelles de la souche sensible de Aedes
aegypti «Bora Bora» aux 5 HE, au DEET et à la
perméthrine et, le dendrogramme représentant les réactions
comportementales obtenues par le regroupement hiérarchique de ces
insecticides selon leurs
effets irritants de contact. - 100 -
Figure 32: Taux
d'échappés des femelles de la souche de terrain de Aedes
aegypti «Bobo-Dioulasso» aux 5 HE, au DEET et à la
perméthrine et, le dendrogramme représentant les
Thèse de Doctorat unique xii
Thèse de Doctorat unique xiii
réactions comportementales obtenues par le regroupement
hiérarchique de ces insecticides
selon leurs effets irritants de contact. - 100 -
LISTE DES
TABLEAUX
Tableau I: Présentation des espèces
végétales - 41 -
Tableau II : Composition chimique des huiles
essentielles des 5 plantes Cymbopogon citratus, Cymbopogon nardus,
Eucalyptus camaldulensis, Lippia multiflora et Ocimum americanum
- 56 -
Tableau III : Les concentrations létales
à 50 et 90 % (CL50 et CL90) et leurs intervalles de confiance des huiles
essentielles de plantes contre les larves de la souche sensible de
An.
gambiae, Kisumu - 57 -
Tableau IV : Les
concentrations létales à 50 et 90 % (CL50 et CL90) et leurs
intervalles de confiance des huiles essentielles des plantes contre les larves
de la souche résistante de An.
gambiae de VK - 57 -
Tableau V : Les concentrations
létales à 50 et 90 % (CL50 et CL90) et leurs intervalles de
confiance des huiles essentielles de plantes contre les larves de la souche
sensible de Ae.
aegypti, Bora Bora - 60 -
Tableau VI : Les
concentrations létales à 50 et 90 % (CL50 et CL90) et leurs
intervalles de confiance des huiles essentielles de plantes contre les larves
de la souche de An. gambiae de
Bobo-Dioulasso - 60 -
Tableau VII : Concentrations
létales 50 et 99 (CL50, CL99) et concentrations diagnostiques pour
les huiles - 72 -
Tableau VIII: KDT50, KDT95 obtenus avec les
huiles essentielles des 5 plantes sur les deux
souches de Anopheles gambiae (Kisumu et de VK) - 73
-
Tableau IX: KDT50, KDT95 avec les combinaisons d'huiles essentielles de
C. nardus et de O.
americanum sur les souches de Anopheles gambiae
(Kisumu et VK) - 76 -
Tableau X: Effets des interactions des HE de Cymbopogon
nardus (C.n) et - 77 -
Tableau XI: Effets des interactions des HE de Cymbopogon
nardus (C.n) et Ocimum americanum (O.a) dans les combinations sur
les adultes de la souche de An. gambiae de VK (n = 150)....
- 77 -
Tableau XII : les temps nécessaires pour assommer 50 et
95% (KDT50 et KDT95) avec les intervalles de confiance à 95% (IC95%)
obtenus sur les deux souches de Ae. Aegypti testées
(Bora bora et de Bobo-Dioulasso) avec les HE. - 79 -
Tableau
VII : Concentrations létales 50 et 99 (CL50, CL99) et concentrations
diagnostiques pour
les huiles - 81 -
Tableau XIV : KDT50, KDT95 produits par les combinaisons d'huiles
essentielles de C. nardus et de O. americanum sur les souches
de Aedes aegypti (Bora bora et de Bobo-Dioulasso)- 84 -
Tableau XV : Effets des interactions des huiles essentielles de
Cymbopogon nardus (C.n) et Ocimum americanum (O.a) dans les
combinations sur les adultes de la souche sensible de
Aedes aegypti Bora Bora (n = 150). - 85 -
Tableau
XVI : Effets des interactions des huiles essentielles de Cymbopogon nardus
(C.n) et Ocimum americanum (O.a) dans les combinations sur les
adultes de la souche de Bobo-
Dioulasso de Aedes aegypti (n = 150). - 85 -
Tableau XVII: Taux de KD obtenus parmi les moustiques qui ne se
sont pas échappés - 97 -
Thèse de Doctorat unique xiv
SIGLES ET ABREVIATIONS
% : Pourcentage
°C : Degré Celsus
Ae.: Aedes
An.: Anopheles
CDC: Centers for Disease Control and
Prevention
CNEV : Centre National d'Expertise sur les
Vecteurs
CL : Concentration létale
CI : Concentration Inhibitrice
COVID-19 : Maladie à coronavirus
2019
CPG : Chromatographie en phase gazeuse
CPG/SM : Chromatographie en phase gazeuse
couplée avec la spectrométrie de masse
DEET : N, N-diethyl-m-toluamide ou N,
N-diéthyl-3-méthylbenzamide
FIC : concentration fractionnelle
inhibitrice
HE : Huiles Essentielle (s)
IC 95 : Intervalle de confiance 95%
INSD : Institut National de la Statistique et
de la Démographie
IR3535 : Insect repellent 3535 ou
éthylbutylacétylaminopropionate
IRSAT : Institut de Recherche en Science
Appliquées et Technologiques
IRSS : Institut de Recherche en Sciences de
la Santé
KBR3023 : icaridine ou picaridine
KD : Knock-down
KDT : Temps de Knock down
LAV : lutte antivectorielle
MILDA : Moustiquaire Imprégnée
à Longue Durée d'Action
OMS : Organisation Mondiale de la
Santé
PID : Pulvérisation Intra
domiciliaire
PPM : Partie Par Million
Thèse de Doctorat unique xv
VK: Vallée du Kou
WHO: World Health Organization;
LAV: lutte anti-vectorielle
Publications et Communications Scientifiques Publications
scientifiques
A. Publications issues de la thèse
Articles publiés
1-Balboné M., Soma, D. D., Namountougou,
M., Drabo, S. F., Konaté, H., Toé O., Bayili, K., Meda, G. B.,
Dabiré, R. K. and Gnankine, O. (2022a). Essential oils from five local
plants: an alternative larvicide for Anopheles gambiae s.l. (Diptera:
Culicidae) and Aedes aegypti (Diptera: Culicidae) Control in Western
Burkina Faso. Front. Trop. Dis. 3:853405.
https://doi.org/:10.3389/fitd.2022.853405.
2-Balboné M., Soma, D. D., Drabo, S.
F., Namountougou, M., Konaté, H., Meda, G. B.,
Sawadogo I., Romba R., Bilgo E., Nebié R. C. H.,
Bassolé I. H. N., Dabire R. K. and Gnankine O. (2022b). Alternatives to
Chemical Resistance: Combinations of Cymbopogon nardus and Ocimum
americanum essential oils improve the bioefficiency control against the
adults populations of Aedes aegypti L . ( Diptera : Culicidae ).
Journal of Medical Entomology 59(6), 2102-2109.
https://doi.org/10.1093/jme/tjac148.
3-Balboné M., Sawadogo I., Soma D. D.,
Drabo S. F., Namountougou M., Bayili K., Romba R., Meda G. B., Nebié H.
C. R., Dabire R. K., Bassolé I. H. N., Gnankine O. (2022c). Essential
oils of plants and their combinations as an alternative adulticides against
Anopheles gambiae (Diptera: Culicidae) Populations. Scientific
Reports 12, 19077.
https://doi.org/10.1038/s41598-022-23554-6.
Articles en préparation
Balboné M., Gnankine O., Namountougou M.,
Soma D. D., Drabo S. F., Romba R., Bassolé I.H. N. and Dabire R. K.
(2022). Excito-repellent activity of five essential oils extracted from local
plants against dengue and malaria vectors in Burkina Faso. (Soumis à
Biologia).
Thèse de Doctorat unique xvi
Thèse de Doctorat unique xvii
B. Publications issus d'autres travaux de recherche
Articles publiés
1-Namountougou M., Soma D. D., Kientega M.,
Balboné M., Kaboré D. P. A., Drabo S., Coulibaly
A. Y., Fournet F., Baldet T., Diabaté A., Dabiré R. K., Gnankine
O. 2019. Insecticide resistance mechanisms in Anopheles gambiae
complex populations from Burkina Faso, West Africa. Acta Tropica,
197:105054, 9 p.
https://doi.org/10.1016/j.actatropica.2019.105054.
2-Namountougou M., Soma D. D., Balboné
M., Kaboré D. A., Kientega M., Hien A., ... & Dabiré
R. K. (2020). Monitoring insecticide susceptibility in Aedes Aegypti
populations from the two biggest cities, Ouagadougou and Bobo-Dioulasso, in
Burkina Faso: implication of metabolic resistance. Tropical Medicine and
Infectious Disease, 5(2), 84.
https://doi.org/10.3390/tropicalmed5020084.
3-Drabo F. S., Coulibaly A. Y., Romba R., Balboné
Mahamoudou, & Gnankiné O. (2019). Biochemical resistance to
insecticide in Bemisia tabaci field population from Burkina Faso, West
Africa. Phytoparasitica, 47(5), 671-681. doi.
10.1007/s12600-019-00765-8.
4-Namountougou M., Soma D. D., Sangare I., Djouaka R., Hien A.
S., Kientega M., Kaboré
D. P. A., Sawadogo S. P., Millogo A. A.,
Balboné M., Baldet T., Ouédraogo J., Martin T.,
Simard F., Ouédraogo G. A., Diabaté A., Gnankine O. and
Dabiré R. K. (2022). Use of different cotton pest control strategies
(conventional, organic and transgenic) had no impact on insecticide resistance
in Anopheles gambiae sl populations in Burkina Faso, West Africa.
International Journal of Pest Management,
1-12.
doi.org/10.1080/09670874.2022.2051642.
Communications scientifiques
Communications des travaux de la thèse
Mahamoudou Balboné, Dieudonné
Diloma Soma, Samuel F. Drabo, Hamadou Konaté, Oumarou Toe, Koama Bayili,
Georges B. Meda, Moussa Namountougou, Roch K. Dabire, Olivier Gnankine.
Activité larvicide des huiles essentielles de cinq plantes
aromatiques locales contre Anopheles gambiae (Diptera
: Culicidae), dans l'Ouest du Burkina Faso. IXe Journées
Burkinabè de Parasitologie, du 02 au 04 juin au Centre Muraz,
Bobo-Dioulasso, Burkina Faso (Communication affichée).
Mahamoudou Balboné, Dieudonné
Diloma Soma, Samuel F. Drabo, Hamadou Konaté,
Oumarou Toe, Koama Bayili, Georges B. Meda, Moussa
Namountougou, Roch K. Dabire, Olivier Gnankine. Activité larvicide des
huiles essentielles de cinq plantes aromatiques locales contre Aedes
aegypti (Diptera : Culicidae), dans l'Ouest du Burkina Faso. Doctoriales
2022 de l'Université Joseph KI-ZERBO, du 02 au 04 juin à
l'Université Joseph KI-ZERBO, Ouagadougou, Burkina Faso (Communication
orale).
Mahamoudou Balboné, Dieudonné
D. Soma, Ignace Sawadogo, Samuel F. Drabo, Moussa Namountougou, Koama Bayili,
Rahim Roamba, Honorat C. R. Nebié4, Imaël H. N.
Bassolé, Roch K. Dabire, Olivier Gnankine. Huiles essentielles de
plantes et leurs combinaisons comme adulticides alternatifs contre
Anopheles gambiae (Diptera : Culicidae). Journées Scientifiques de
l'IRSS, 2e édition du 20 au 22 octobre à
Bobo-Dioulasso, Burkina Faso (Communication orale).
Mahamoudou Balboné, Dieudonné
Diloma Soma, Samuel F. Drabo, Hamadou Konaté,
Oumarou Toe, Koama Bayili, Georges B. Meda, Moussa
Namountougou, Roch K. Dabire, Olivier Gnankine. Activité larvicide des
huiles essentielles de cinq plantes aromatiques locales contre Aedes
aegypti (Diptera : Culicidae), dans l'Ouest du Burkina Faso. Colloque
Internationale Sciences et Technologies de l'Université Nobert Zongo, 2e
édition, du 21 au 23 novembre 2022 à l'Université Nobert
Zongo, Koudougou, Burkina Faso (Communication orale).
Thèse de Doctorat unique
xviii
Résumé
Le paludisme et la dengue sont les deux principales maladies
vectorielles transmises respectivement par les genres Anopheles et
Aedes. La lutte antivectorielle (LAV) est basée essentiellement
sur l'utilisation d'insecticides de synthèse à partir de produits
chimiques. La prolifération des molécules insecticides et le
développement de la résistance de ces vecteurs aux insecticides
de synthèse suscitent un intérêt de rechercher des outils
innovants comme ceux basés sur les produits naturels extraits de plantes
à propriété insecticide, comme les huiles essentielles
(HE) qui peuvent constituer une alternative aux insecticides chimiques.
L'objectif de cette thèse est d'étudier les activités
larvicides, adulticides et répulsives-irritantes des HE de
Cymbopogon citratus, Cymbopogon nardus, Eucalyptus camaldulensis, Lippia
multiflora et Ocimum americanum seules et en combinaison sur les
populations de Ae. aegypti de Bobo-Dioulasso et An. gambiae
de la Vallée du Kou (VK) dans l'Ouest du Burkina Faso selon les
protocoles de l'OMS (2017). Les composés chimiques des HE extraites de
ces 5 plantes ont été identifiés par GC-MS. L'HE de L.
multiflora dont les composés majeurs sont le
ß-caryophyllène, le p-cymène, l'acétate de thymol et
le 1,8 cinéol est la plus toxique sur les larves de Ae. aegypti
et de An. gambiae avec une activité proche du
pyriproxyfène, contrôle positif sur les larves. La population de
An. gambiae a été plus sensible aux HE testées
que celle de Ae. aegypti. Concernant les tests adulticides, l'HE de
L. multiflora et les combinaisons constituées de C. nardus
: 80% et O. americanum : 20% (C8) et C. nardus : 90% et
O. americanum : 10% (C9) sur An. gambiae et C. nardus
: 20% et O. americanum : 80% (), C8 et C9 sur Ae.
aegypti, ont été les plus toxiques. Aussi, les combinaisons
C9 et C8 ont donné des effets synergiques respectivement sur An.
gambiae de VK et Ae. aegypti de Bobo-Dioulasso. En plus, les
combinaisons C9 et ont donné des effets additionnels sur Ae.
aegypti de Bobo-Dioulasso.
Les HE de C. citratus, C. nardus et E.
camaldulensis ont produit des effets répulsifs irritants de contact
très proches de ceux du DEET sur An. gambiae et Ae.
aegypti.
L'HE de L. multiflora et les combinaisons C8 et C9 de
C. nardus et de O. americanum pourraient être
utilisées comme bio insecticides alternatifs aux insecticides chimiques
dans la LAV. Les données de cette thèse sont précieuses et
contribueront sans doute à l'amélioration du dispositif de lutte
antivectorielle contre ces espèces de moustiques au Burkina Faso.
Thèse de Doctorat unique xix
Mots clés : Aedes aegypti,
Anopheles gambiae, Huile essentielle, combinaison, Lutte antivectorielle
Abstract
Malaria and dengue fever are the two main vector diseases
transmitted by Anopheles gambiae and Aedes aegypti
respectively. Vector Control is based mainly on the use of chemicals.
Concern for environmental safety and the development of chemical resistance in
these vectors has led to an interest in investigating innovative tools,
including plant-based insecticides as alternatives to chemical insecticides.
The thesis aimed at evaluating larvicides, adulticides and
repellent-irritant of 5 essential oils namely Cymbopogon citratus,
Cymbopogon nardus, Eucalyptus camaldulensis, Lippia
multiflora and Ocimum americanum alone or in combinations on
populations of Bobo-Dioulasso Ae. aegypti and «Vallée du
Kou» An. gambiae collected in western Burkina Faso
according to WHO protocols. As results, the EO of L. multiflora whose
major compounds were ß-caryophyllene, p-cymene, thymol acetate and
1,8-cineole were more toxic against larvae of Ae. aegypti and An.
gambiae and their activity was close to Pyriproxyfen (The positive
control). In terms of adulticides tests, L. multiflora EO and
combinations of C8 (C. nardus: 80% and O. americanum: 20%)
and C9 (C. nardus: 90% and O. americanum: 10%) on An.
gambiae and (C. nardus: 20% and O. americanum: 80%), C8
and C9 on Ae. aegypti were the most toxic. The combinations C9 and C8
gave synergistic effects on An. gambiae from the «Vallée
du Kou» and Ae. aegypti from Bobo-Dioulasso respectively. The
combinations C9 and gave additional effects on Ae. aegypti from
Bobo-Dioulasso. The EOs of C. citratus, C. nardus and E.
camaldulensis produced contact irritant repellent effects very similar to
those of DEET on An. gambiae. On Ae. aegypti, the EOs of
C. citratus, O. americanum and E. camaldulensis
were very close to DEET.L. multiflora and combinations of C8 and
C9 of C. nardus and O. americanum could be used as
alternative insecticides to chemical insecticides in vector control. The data
of this thesis are valuable and will undoubtedly contribute to the improvement
of the vector control strategies against these mosquitos' species in Burkina
Faso.
Key words: Aedes aegypti, Anopheles
gambiae, essential oil, combination, vector control
Thèse de Doctorat unique xx
- 1 -
INTRODUCTION GENERALE
Thèse de Doctorat unique - 2
-
Introduction générale
Les maladies à transmission vectorielle sont des
maladies infectieuses causées par des parasites, des virus ou des
bactéries qui sont transmis par des vecteurs (OMS, 2020). Ces maladies
à transmission vectorielle sont la dengue, la fièvre jaune,
l'encéphalite japonaise, la leishmaniose, la maladie de Chagas,
l'onchocercose, le paludisme, la schistosomiase et la trypanosomiase humaine
africaine. Elles sont responsables de plus de 17% des maladies infectieuses et
provoquent plus d'un million de décès par an dans le monde (OMS,
2021a).
Parmi les maladies à transmission vectorielle, le
paludisme et la dengue sont les plus répandues. Au cours de la
dernière décennie, l'incidence mondiale et la mortalité
dues au paludisme ont considérablement diminué. En revanche,
l'incidence mondiale de la dengue est en pleine croissance (OMS, 2020). Ces
deux grandes maladies à transmission vectorielle ont approximativement
les mêmes symptômes à telle enseigne que certains ont
nommé la dengue « palu-dengue ».
Le paludisme est une maladie potentiellement mortelle
causée par des parasites transmis aux hommes par des piqûres de
moustiques femelles, du genre Anopheles, infectés. Parmi les
nombreuses espèces de Anopheles, seulement une vingtaine
assurent la transmission du paludisme dans le monde (Pagès,
Orlandi-Pradines et Corbel, 2007). En 2019, le nombre de cas de paludisme dans
le monde a été estimé à 229 millions et le nombre
estimé de décès imputables à cette maladie à
transmission vectorielle s'élevait à 409.000 (OMS, 2020). Et de
surcroit, ce sont les enfants âgés de moins de cinq ans et les
femmes enceintes qui constituent le groupe le plus vulnérable
touché par cette maladie. En effet, 67 % des décès dus au
paludisme dans le monde concernent les enfants âgés de moins de
cinq ans (OMS, 2021a). Selon le Bulletin épidémiologique, le
Burkina Faso a enregistré en 2021, plus de 12 millions de cas dans les
établissements sanitaires avec 605.504 cas de paludisme grave et 4.355
décès (Ministère de la Santé du Burkina Faso,
2022).
Quant à la dengue, elle est une infection virale
transmise à l'être humain par la piqûre de moustiques
femelles, du genre Aedes, infectés. Les principaux vecteurs de
cette maladie sont les moustiques de l'espèce Aedes aegypti et
dans une moindre mesure Aedes albopictus (OMS, 2022a). Selon Bhatt et
al. (2013), on compterait dans le monde 390 millions de cas de dengue
par an, dont 96 millions présentent des manifestations cliniques (quelle
que soit la gravité de la maladie). Une autre étude sur la
prévalence de la dengue avait estimé que 3,9 milliards de
Thèse de Doctorat unique - 3
-
personnes dans 128 pays étaient exposées
à l'infection par les virus de la dengue (Brady et al., 2012).
Le nombre de cas de dengue notifiés dans le monde a atteint son maximum
en 2019 et toutes les Régions de l'OMS ont été
touchées (OMS, 2021a).
Au Burkina Faso, une augmentation de l'incidence hebdomadaire
de cas de dengue a été constatée à partir de la
31ème semaine de l'année 2017 (Ministère de la
Santé du Burkina Faso, 2017).
La lutte contre les maladies à transmission vectorielle
humaine repose principalement sur l'utilisation des Moustiquaires
Imprégnées d'insecticide à Longue Durée d'Action
(MILDA) et dans une moindre mesure sur la Pulvérisation Intra
Domiciliaire (PID) d'insecticides à effet rémanent pour
réduire le contact homme-vecteur et/ou diminuer la population vectrice
(OMS, 2021b). Par ailleurs, les insecticides anciennement utilisés en
santé publique pour l'imprégnation des moustiquaires sont de la
famille des pyréthrinoïdes (Zaim, Aitio et Nakashima, 2000). En
effet, ils présentent des propriétés physico-chimiques
nécessaires pour protéger à la fois l'utilisateur de la
moustiquaire et avoir un impact au niveau communautaire (Henry et al.,
2005 ; Fegan et al., 2007). Les pyréthrinoïdes à
faible dose sont inoffensifs pour l'homme, agissent très rapidement sur
les moustiques (effet Knock down) et présentent un effet
excito-répulsif (Zaim, Aitio et Nakashima, 2000). Cet effet
excito-répulsif empêche le moustique de rester suffisamment
longtemps au même endroit sur la moustiquaire pour pouvoir piquer en cas
de contact entre le dormeur et la moustiquaire pendant son sommeil.
Malheureusement, l'émergence de la résistance aux
pyréthrinoïdes chez les vecteurs du paludisme constitue une menace
à l'encontre des stratégies de lutte utilisées par les
Programmes Nationaux de Lutte contre le Paludisme (Ranson et Lissenden, 2016).
En effet, des études antérieures avaient rapporté la
résistance des vecteurs du paludisme aux insecticides chimiques (Chandre
et al., 1999; Diabate et al., 2002; Namountougou et
al., 2019). Aussi, plusieurs études ont signalé une
résistance aux insecticides chez les vecteurs de la dengue dans le monde
entier, notamment en Inde (Bharati & Saha, 2018), au Brésil (de
Araújo et al., 2019), en Malaisie (Ishak et al.,
2017), au Laos (Marcombe et al., 2019), au Myanmar (Kawada et
al., 2014), en Afrique (Kamgang et al., 2011; Kawada et
al., 2016), et particulièrement au Burkina Faso (Badolo et
al., 2019; Sombié et al., 2019; Namountougou et
al., 2020, Toé et al., 2022).
Face à l'émergence de la résistance aux
insecticides chimiques qui a réduit l'efficacité des outils
actuels de lutte antivectorielle, les recherches sont dirigées de plus
en plus sur d'autres
Thèse de Doctorat unique - 4
-
formes de luttes qui peuvent être des alternatives
efficaces contre les moustiques vecteurs de maladie (Vani, Cheng et Chuah,
2009; Ileke et al., 2015). En effet, plusieurs stratégies
alternatives et/ou complémentaires sont envisagées afin de
contourner les mécanismes de résistance. Parmi ces moyens
complémentaires, nous avons les insecticides biologiques notamment les
extraits naturels de plantes.
Les extraits naturels de plantes offrent l'avantage de
provoquer très peu de résistance contrairement aux insecticides
synthétiques, car leur efficacité provient d'une synergie
d'action entre les différents composés organiques qu'ils
contiennent (Pavela, 2014 ; Deletre et al., 2015). Les huiles
essentielles (HE) étant biodégradables et peu toxiques pour les
mammifères, elles font partie des produits d'origine naturelle les plus
employés dans la lutte antivectorielle (LAV) (Deletre et al.,
2013). En effet, elles possèdent des propriétés
insecticides et répulsives (Deletre et al., 2016; Pohlit et
al., 2011).
Au Burkina Faso où les vecteurs du paludisme ont une
activité surtout nocturne, les hommes reçoivent un nombre
important de piqûres, environ 15% des piqûres des moustiques du
genre Anopheles intervenant entre 18 et 20 heures (Badolo et
al., 2004). Le moustique de l'espèce Ae. aegypti se
nourrit le jour ; il pique principalement tôt le matin, ainsi que le soir
avant le coucher du soleil (Trpis et al., 1973). Cette situation
nécessite l'usage de moyens complémentaires comme les
répulsifs pour prévenir les piqûres de moustiques avant de
se retrouver sous la moustiquaire.
En effet, des évaluations quantitatives récentes
indiquent que la lutte contre les larves peut entraîner des
réductions plus importantes que prévues de la transmission des
agents pathogènes dans certaines circonstances (Smith et al.,
2013; Ouédraogo et al., 2018). Par conséquent, cibler
les moustiques vecteurs au stade larvaire demeure une des meilleures
alternatives, car les larves sont relativement confinées dans des sites
de reproduction souvent accessibles ; elles sont donc plus vulnérables
par rapport aux moustiques adultes (Tomé et al., 2014).
Toutefois, au Burkina Faso, les études menées
sur l'activité insecticide des extraits végétaux
vis-à-vis des moustiques est en plein essor avec des travaux
déjà menés par Bassolé et al. (2003),
Gnankiné et Bassolé (2017), Yameogo et al. (2021) et
récemment Wangrawa et al.(2022a; 2022b). Mais ces études
n'ont pas concerné les populations de moustiques de la partie
occidentale du pays. Aussi, ces études ne se sont pas
intéressées aux effets combinés et répulsifs des HE
sur les populations de moustiques.
Thèse de Doctorat unique - 5
-
Les travaux de notre thèse s'inscrivent dans un
contexte de recherche de nouvelles stratégies de lutte antivectorielle
et ont été initiés dans le but d'acquérir de
meilleures connaissances sur les effets insecticides et répulsifs
irritants de contact des huiles essentielles (HE) et des combinaisons d'HE sur
des vecteurs du paludisme et de la dengue.
Nos travaux ont pour objectif principal d'examiner
l'efficacité entomologique des HE de cinq (5) plantes locales,
Cymbopogon citratus, Cymbopogon nardus, Eucalyptus camaldulensis, Lyppia
multiflora, Ocimum americanum, et des combinaisons des HE de deux plantes,
Cymbopogon nardus et Ocimum americanum en vue d'une meilleure
gestion de la résistance de An. gambiae s.l., responsable de la
transmission du parasite du paludisme et de Ae. aegypti, vecteur du
virus de la dengue au Burkina Faso.
De façon spécifique, nous avons d'abord
évalué l'efficacité larvicide et adulticide des HE de ces
plantes sur des populations de moustiques de An. gambiae
collectées au niveau de la Vallée du Kou (VK) et de Ae.
aegypti collectées à Bobo-Dioulasso.
Ensuite, nous avons examiné le renforcement de
l'efficacité insecticide de différentes combinaisons des HE de
deux (2) des plantes sur les adultes des mêmes populations de moustiques
de An. gambiae et de Ae. aegypti.
Enfin, nous avons évalué l'effet répulsif
irritant de contact des HE de ces cinq (5) plantes locales sur les adultes des
mêmes populations de moustiques de An. gambiae et de Ae.
aegypti. Les hypothèses de recherche suivantes ont
été émises :
· Les HE des plantes de C. citratus, C. nardus, E.
camaldulensis, L. multiflora et de O. americanum ont des
propriétés larvicides ;
· Ces HE sont des adulticides efficaces contre les
moustiques vecteurs de la dengue et du paludisme ;
· Ces HE sont des répulsifs de contact contre les
vecteurs de la dengue et du paludisme ;
· Les combinaisons de deux HE améliorent
l'efficacité de ces HE.
Le présent document est structuré en trois
parties et est basé sur les différentes publications relatives
aux travaux de recherche liés à notre thèse.
o La première partie intitulée « Revue
bibliographique » présente les connaissances sur la
classification et la bio-écologie des vecteurs de la dengue et du
paludisme. Nous y évoquons également les mécanismes de
résistance des vecteurs de ces deux maladies à transmission
vectorielles aux insecticides chimiques et les stratégies
de LAV utilisées ou en développement. Enfin, nous évoquons
les informations sur les répulsifs et les HE.
o La deuxième partie nommée «
Méthodologie générale »
présente le matériel et les méthodes utilisées aux
laboratoires et sur le terrain depuis la collecte larvaire jusqu'aux
différents tests réalisés.
o La troisième partie intitulée «
Résultats et Discussion » subdivisée en
trois chapitres présente les résultats des différents
travaux effectués dans le cadre de cette thèse. Chaque chapitre
est structuré en introduction, méthodologie spécifique
utilisée, résultats, discussion et conclusion partielle. Ces
trois (3) chapitres sont articulés autour des articles publiés ou
en cours de préparation.
Nous terminons par une Discussion
générale, une Conclusion générale et des
Perspectives à nos travaux.
Thèse de Doctorat unique - 6
-
PARTIE 1 : REVUE BIBLIOGRAPHIQUE
Thèse de Doctorat unique - 7
-
Thèse de Doctorat unique - 8
-
1- 1. Vecteurs du paludisme et de la dengue
1- 1.1. Classification
Les moustiques constituent l'une des plus importantes
familles de vecteurs d'agents pathogènes appartenant à la classe
des insectes. (Duvallet, Fontenille et Robert, 2017). Parmi ces vecteurs nous
avons les Anopheles, vecteurs de Plasmodiums sp, parasites
responsables du paludisme et les Aedes, vecteurs de Flavivirus
(DENV), virus de la dengue. Ces vecteurs sont des arthropodes appartenant
au :
o Règne : Animalia
o Sous-règne : Metazoa
o Phylum : Arthropoda (= pattes et appendices
articulés)
o Classe : Insecta (= corps segmenté en trois
parties)
o Ordre : Diptera (= une paire d'ailes)
o Sous-ordre : Nematocera (= avec antennes rondes et
longues)
o Famille : Culicidae (= moustique)
- Sous-famille : Anophelinae (Anophèles) -
Sous-famille : Culicinae (Aedes)
- Genre : Anopheles, Aedes.
Le genre Anopheles, vecteur du paludisme, comporte
plus de 400 espèces mais seulement une trentaine assure, avec une
efficacité importante, la transmission des Plasmodium humains
dans le monde (Sinka et al., 2010; Sinka et al., 2012; OMS,
2020). En Afrique subsaharienne, les vecteurs du paludisme appartiennent
majoritairement au complexe Anopheles gambiae s.l. (Figure 1A) (9
espèces dont trois vecteurs principaux : An. coluzzii, An.
gambiae et An. arabiensis), groupe An. funestus (neuf
espèces dont deux vectrices : An. funestus s.s. et An.
rivulorum) et An. nili (quatre espèces dont trois vecteurs
principaux : An. nili s.s., An. carnevalei et An.
ovengensis) ( Carnevale et Robert, 2009; Sinka et al., 2012; Soma
et al., 2020). Certaines espèces de Anopheles jouent
également un rôle en santé animale en assurant la
transmission de Plasmodium de mammifères, notamment de rongeurs, et de
filaires animales (Carnevale et Robert, 2009). D'autres sont impliquées
dans la transmission de virus animaux tels que ceux de la myxomatose et de la
fièvre de la Vallée du Rift (ANSES, 2020).
Le genre Aedes, vecteur des arboviroses, regroupe
actuellement 263 espèces en 21 sous-genres (Harbach, 2007). Le
sous-genre Stegomyia héberge de nombreuses espèces vectrices
d'arboviroses humaines dont Aedes aegypti (Figure 1B) vecteur de la
dengue et dans une moindre mesure, Aedes albopictus (OMS, 2020b).
Aedes aegypti est aussi vecteur de l'infection à Zika, du
chikungunya et de la fièvre jaune (OMS, 2022).
A B
|
A : Anopheles gambiae. Foto: James
Gathany, Scientific Photographer, Center for Disease
Control, U.S. Department of Health & Human Services .
www.cdc.gov
www.vectorbase.org
Figure 1: Images de moustiques A
et B
|
B : Aedes aegypti. Tis.re/[Projet] TIS 2B -
Technique de l'Insecte Stérile (c) IRD - Nil Rahola
|
1- 1.2. Cycle de développement des
moustiques
Les moustiques sont des insectes à métamorphose
complète ou holométaboles. Leur cycle de développement
(Figures 2 et 3), comme chez tous les insectes diptères, est un cycle
biphasique qui se déroule en quatre stades (l'oeuf, la larve, la nymphe
et l'adulte). Le temps de développement de chaque stade dépend de
la température de l'eau et d'autres facteurs.
1- 1.2.1. Phase pré-imaginale
La phase pré-imaginale qui se déroule en milieu
aquatique regroupe le stade oeuf, le stade larvaire et le stade nymphal.
o Les oeufs
Les femelles des moustiques (Anophèles et Aedes) ne
s'accouplent qu'une seule fois au cours de leur vie et peuvent continue
à pondre pendant toute leur vie. La plupart des femelles
Thèse de Doctorat unique - 9
-
Thèse de Doctorat unique - 10
-
pondent 1 à 3 fois, mais certaines peuvent pondre
jusqu'à 5 à 7 fois (OMS, 2014). Pour la maturation des oeufs, les
femelles prennent un repas de sang. Les oeufs des moustiques mesurent environ 1
millimètre de long. Blanchâtres au moment de la ponte, ils
s'assombrissent dans les heures qui suivent.
Les oeufs des moustiques comprennent 3 membranes : la membrane
interne qui entoure le vitellus et l'embryon ; la membrane intermédiaire
ou endochorion et la troisième membrane ou exochorion.
En fonction des espèces de moustiques, nous avons une
variété bien déterminée de gîtes aquatiques
pour la ponte :
· Chez les Anopheles, les oeufs sont pondus
isolément à la surface de l'eau 100 à 150 oeufs et sont
munis de flotteurs latéraux qui les rendent insubmersibles. Les
anophèles pondent dans les petites quantités d'eau, dans des
empreintes de pas, des flaques d'eau de pluie ou collections plus grandes comme
des rivières, canaux, marécages, lacs, rizières, etc.
· Chez les Aedes, les oeufs sont pondus isolement sur
des supports humides à proximité immédiate de la surface
de l'eau, ou à même le sol sec. Ces oeufs doivent attendre
d'être submergés pour éclore. L'éclosion se produit
au bout de 36 à 48 heures après la ponte, dès que
l'embryon est entièrement développé. Ce délai est
allongé lorsque la température diminue (Carnevale et Robert,
2009). Les Aedes pondent préférentiellement dans les pneus
usagés, les fûts récupérateurs d'eau, les pots de
fleurs, les bouteilles ou les tasses jetés, etc.
o Les larves
Les larves de moustiques ressemblent à des vers et
sont dépourvues de pattes et d'ailes. Le corps de la larve comporte 3
parties : la tête, le thorax et l'abdomen avec une croissance discontinue
en quatre stades dits L1, L2, L3 et L4 morphologiquement comparables
séparés par trois (3) mues. Le premier stade correspond à
la larve nouvellement éclos ou sorti de l'oeuf. Après un jour ou
deux, elle mue, abandonnant son enveloppe et devient ainsi le second stade,
suivi par le troisième stade et le quatrième stade, à des
intervalles d'environ deux jours chacun.
Les larves des moustiques sont le plus souvent
détritivores mais certaines sont prédatrices ou même
cannibales. Elles se nourrissent généralement par filtration,
soit à la surface, soit au fond de l'eau et se déplacent par
saccades.
Thèse de Doctorat unique - 11
-
Chez les Anophelinae, les larves respirent
directement l'air extérieur par des stigmates dorsaux, ce qui leur
impose une position de repos parallèle à la surface de l'eau
donnant l'impression qu'elles flottent (Figure 4) tandis que celles des
Culicinae respirent par un siphon situé à
l'extrémité de l'abdomen et sont donc obliques par rapport
à la surface de l'eau au repos (Figure 4).
Le développement larvaire a une durée variable
dépendant de la température, de l'humidité et des
nutriments retrouvés dans le milieu de vie (Carnevale et Robert,
2009).
o Les nymphes
La nymphe ou pupe est le stade pendant lequel une
transformation majeure se produit : le passage de la vie aquatique à la
vie aérienne de l'adulte.
Les nymphes ont la forme d'une virgule et restent
généralement à la surface de l'eau (Figure 1) mais
plongent lorsqu'elles sont dérangées, en déployant et
reployant l'abdomen terminé par deux palettes natatoires. Elles ne
peuvent pas se nourrir mais respirent à l'aide de deux trompettes
situées sur le céphalothorax et non au bout de l'abdomen comme
chez la larve. La durée de vie de la nymphe est courte, 1 à 2
jours généralement chez Anopheles. Chez Aedes, ce stade peut
aller jusqu'à 3 jours. A la fin de ce stade, la nymphe subit des
changements morphologiques aboutissant à la formation de l'adulte. En
effet, au moment de l'émergence de l'adulte, en général la
nuit, l'enveloppe de la nymphe se fend longitudinalement, le moustique adulte
se gonfle d'air et s'extrait de l'exuvie à la surface de l'eau puis s'y
repose temporairement jusqu'à ce qu'il soit capable de s'envoler (OMS,
2014).
1- 1.2.2. La phase imaginale
La phase imaginale qui est aérienne concerne le stade
adulte ailé ou imago. Le moustique adulte se gonfle d'air et s'extrait
de l'exuvie (mue) à la surface de l'eau. Les moustiques adultes volent
après avoir émergé puis s'accouplent. Les premiers jours
de la vie imaginale sont caractérisés par le durcissement de la
cuticule, la prise de repas sucré et la maturation des organes de
reproduction sexuels. Une période de 24 heures est nécessaire
à la femelle pour que ses pièces buccales soient assez rigides
pour pouvoir percer l'épiderme des hôtes vertébrés
et prendre un repas de sang. Tous les adultes des moustiques s'alimentent de
nectars ou du jus sucrés des fleurs
afin de couvrir leurs besoins énergétiques. Les
mâles deviennent fertiles après 3 jours de vie imaginale et
contrairement aux femelles, ils peuvent s'accoupler plus d'une fois.
Plusieurs caractéristiques permettent de distinguer
les moustiques adultes du genre Anopheles à ceux du genre
Aedes.
· Les moustiques du genre Anopheles n'ont pas
d'écailles sur leur abdomen.
Les palpes sont aussi longs que la trompe chez la femelle ou
renflés à leur extrémité chez le mâle. Les
Anophèles se développent dans des eaux calmes, douces, rarement
dans des gîtes de petites dimensions. Les femelles piquent
généralement à partir du crépuscule. Au repos,
l'adulte des Anophelinae a son abdomen maintenu à un certain
angle par rapport à la surface sur laquelle il se pose et forme une
ligne droite avec la trompe. Au repos, les Anophèles adoptent
généralement une position oblique par rapport au support, les
différenciant facilement des autres Culicinae qui se
positionnent parallèlement au support (Figure 4).
· Les moustiques du genre Aedes ont des
écailles sur l'abdomen et des soies insérées en
arrière des spiracles antérieurs. Les femelles ont des palpes
plus courts que la trompe et des crèques apparents à
l'extrémité de l'abdomen. Les plus dangereux, Aedes aegypti
et Aedes albopictus, se développent dans des gîtes
créés par l'homme (récipients de stockage d'eau
abandonnés autour des maisons et les pneus au rebut) (OMS, 2014).
Le cycle gonotrophique se caractérise
premièrement par la recherche de l'hôte pour le repas sanguin,
suivi de l'ingestion et la digestion du sang accompagnées de la
maturation des follicules ovariens. Pendant cette phase, le moustique est moins
actif. La femelle gravide achève ce cycle par la recherche d'un site
d'oviposition.
Thèse de Doctorat unique - 12
-
Thèse de Doctorat unique - 13
-
Figure 2: Cycle biologique de l'anophèle
(Carnevale et al., 2009)
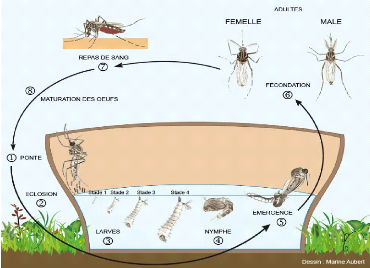
Figure 3: Cycle de développement des
moustiques (
http://www.institutpasteur.nc/les-moustiques-et-la-dengue/)
Thèse de Doctorat unique - 14
-
Figure 4: Comparaison des Anophelinae et
Culicinae (OMS 2013)
1- 1.3. Répartition géographique mondiale
des moustiques Aedes aegypti et Anopheles gambiae
Historiquement, les moustiques se sont toujours
déplacés au gré des migrations humaines, de leurs habitats
d'origine en Afrique et en Asie au reste du monde. Au cours des prochaines
années, le changement climatique leur permettra de se déplacer
encore davantage, y compris dans des zones qu'ils n'avaient pas encore
colonisées.
o Cas de Aedes aegypti
Le commerce des pneus usagés, qui constituent l'un des
principaux gîtes larvaires artificiels, a joué un rôle
important. Ajoutons que Ae. aegypti est essentiellement urbain. Son
caractère anthropophile (qui aime les lieux habités par l'homme)
explique qu'une fois installer dans une zone, il est pratiquement impossible de
s'en débarrasser.
La carte montrant la distribution mondiale prédite pour
Ae. aegypti est présentée dans la Figure 5. Ae.
aegypti est principalement présente dans les régions
tropicales et subtropicales, avec des concentrations dans le nord du
Brésil et dans le sud-est de l'Asie, y compris toute l'Inde, mais
Thèse de Doctorat unique - 15
-
avec relativement peu de zones propices en Europe (uniquement
en Espagne et en Grèce) et en Amérique du Nord
tempérée (Kraemer et al., 2015).
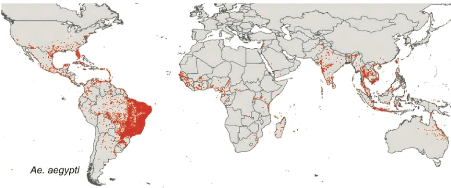
Figure 5: Répartition géographique
mondiale de Aedes aegypti (Kraemer et al., 2015).
o Cas de Anopheles gambiae
La Figure 6 représente la carte montrant la
distribution mondiale pour An. gambiae. Dans les conditions
climatiques actuelles, les zones potentiellement favorables à An.
gambiae sont principalement situées près de
l'équateur, comprenant le centre et le nord de l'Amérique du Sud,
une fraction des zones proches de l'équateur en Amérique du Nord,
le centre et le sud de l'Afrique, certaines régions tropicales du sud de
l'Asie et de petites zones en Océanie (Li et al., 2021). Les
zones hautement et moyennement appropriées étaient principalement
distribuées en Afrique centrale et australe (y compris la Gambie, le
Ghana, le Nigeria, l'Afrique centrale, le Soudan, Madagascar, le Mozambique);
en Asie du Sud et du Sud-Est (y compris la côte sud-ouest de l'Inde, la
Thaïlande, le Cambodge et le Vietnam); dans les parties les plus
occidentales, les plus orientales et les plus septentrionales de
l'Amérique du Sud (Est du Brésil, Équateur, Venezuela) ;
et sur la côte Nord de l'Australie (Li et al., 2021). Les zones
faiblement adaptées étaient principalement distribuées le
long de la côte sud-ouest de l'Amérique du Nord (y compris le
Mexique et le Nicaragua), le centre de l'Amérique du Sud (y compris le
Brésil), le Sud de
Thèse de Doctorat unique - 16
-
l'Afrique (y compris l'Angola, la Zambie, le Zimbabwe et
l'Afrique du Sud), le Centre de l'Inde et le Laos en Asie, et la côte
Ouest et Nord de l'Australie (Li et al., 2021).
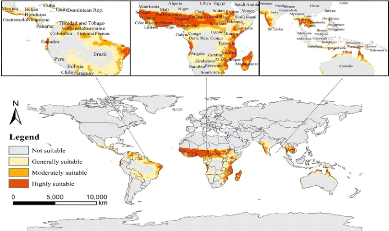
Figure 6: Distributions potentielles de
Anopheles gambiae dans les conditions climatiques actuelles (Li et
al., 2021).
1- 1.4. Écologie et comportement des
moustiques
La biologie des adultes des moustiques est
caractérisée par deux principales phases qui sont l'alimentation
et la reproduction. Le cycle de reproduction étant conditionné
par le repas sanguin chez les femelles, entraine leur dispersion à la
recherche successive de l'hôte vertébré, du site de repos
et du gîte de ponte. L'ensemble de ces comportements définit ce
qu'on appelle le « cycle gonotrophique » qui ne concerne que la
femelle, hématophage (se nourrissant de sang) car le mâle se
nourrit exclusivement de jus sucré et n'est pas hématophage. En
effet, le repas sanguin sert pour la maturation des oeufs chez les femelles
pares.
L'accouplement (2 à 3 jours après
l'émergence, avant ou après le premier repas de sang) est souvent
précédé d'un essaimage de mâles observables
au-dessus de plusieurs marqueurs
Thèse de Doctorat unique - 17
-
physiques (Sawadogo et al., 2013). L'accouplement
peut se dérouler entièrement pendant le vol ou débuter
pendant le vol et s'achever lorsque le couple est au sol. Il aboutit au
stockage du sperme dans la spermathèque de la femelle. Les femelles sont
attirées dans les essaims par des stimuli optique, olfactif
(phéromone) et auditif tandis que les mâles sont attirés
par la fréquence de vibration des ailes de la femelle (Carnevale et
Robert 2009).
Une légère différence de comportement
trophique s'observe chez les deux types de moustiques. L'espèce Ae.
aegypti, étroitement liée à l'homme à cause de
la nature anthropisée de ses gîtes, présente une
anthropophilie relativement exclusive. Quant au vecteur du paludisme, An.
gambiae, il est très fortement anthropophile et endophages, mais
l'abondance locale du bétail ou la mise en place de méthodes de
lutte contribue à moduler ce comportement (Boussès et
Granouillac, 2011). Les deux espèces de moustiques peuvent piquer aussi
bien à l'extérieur qu'à l'intérieur des
habitations. Ae. aegypti pique principalement pendant la
journée et An. gambiae pique généralement la
nuit, du crépuscule à l'aube. Après son repas sanguin, les
femelles de Ae. aegypti comme celle de An. gambiae peuvent se
reposer aussi bien à l'intérieur (endophilie) qu'à
l'extérieur (exophilie) des habitations. En milieu urbain, l'endophilie
semble plus prononcée.
Les gîtes de ponte de An. gambiae sont
très variés et constitués généralement de
petites collections d'eau temporaires dépendant des pluies, peu
profondes et ensoleillées dans lesquelles la végétation
est absente : empreintes de pas, de sabots ou de roue, trous d'emprunt de
terre, marécages partiellement drainés, flaques
résiduelles à la décrue des cours d'eau, etc. An.
gambiae disparait pendant la saison sèche, dans les zones de savane
et réapparait en grand nombre dès les premières pluies
(Boussès et Granouillac, 2011; Lehmann et al., 2014).
Les gîtes de ponte de Ae aegypti sont des
réservoirs artificiels crées par l'Homme : vases, soucoupes des
fleurs, récipients de stockage des eaux de pluies, bidons,
gouttières, gobelets en plastique usagés, bouchons de bouteilles.
Ces gîtes sont apprécies des Aedes, car ils contiennent
généralement de l'eau stagnante et claire (peu polluée)
(Carnevale et Robert, 2009). C'est pourquoi ils se déplacent peu, et
restent souvent à proximitéì des habitations,
dans lesquelles ils rentrent pour piquer ou se reposer (Carnevale et Robert,
2009). La capacité à piquer à la fois à
l'intérieur et à l'extérieur des habitations, et aussi la
nature essentiellement diurne de l'activité de piqûre de Ae.
aegypti constituent d'ailleurs une véritable
difficultéì à surmonter pour la mise en place
de stratégies efficaces de lutte contre le vecteur de la dengue.
Thèse de Doctorat unique - 18
-
1- 1.5. Les conséquences du repas sanguine des
femelles de Aedes et de Anopheles
Le moustique femelle lors de son repas de sang, pique une
personne, il lui injecte sa salive et aspire son sang.
Si cette personne auparavant était infecté par
le virus de la dengue ou le plasmodium agent causal du paludisme, le moustique
femelle aspire le sang contenant des virus de la dengue (DENV) ou des
plasmodiums, selon qu'il soit de l'espèce Ae. aegypti ou
An. gambiae. L'agent causal va se multiplier dans l'organisme du
moustique puis s'accumuler dans ses glandes salivaires. Lors d'un repas de
sang, ce moustique infectieux pique une personne (saine) et lui injecte sa
salive contenant l'agent causal de la dengue ou du paludisme.
La continuité de ce cycle entretient l'expansion des
maladies dont les vecteurs sont des moustiques.
1- 2. Méthodes de luttes antivectorielle
actuelles
La lutte antivectorielle est une composante importante de la
prévention des maladies à transmission vectorielle.
Les stratégies de lutte anti vectorielle (LAV) ont
trois (3) objectifs : la diminution du contact homme - vecteur, la lutte contre
les moustiques adultes et la lutte contre les larves (OMS, 2014). Les deux
derniers objectifs visent la diminution de la densité des vecteurs et la
durée de vie des vecteurs adultes.
1- 2.1. La diminution du contact
homme-vecteur
L'objectif majeur de ces outils de lutte est d'empêcher
les vecteurs d'entrer en contact direct avec l'Homme (Duvallet, Fontenille et
Robert, 2017). Cette barrière direct Homme-vecteur peut se faire par
l'installation des barrières physiques. En effet, elles permettent la
protection de l'individu contre les piqûres de moustiques. Parmi ces
outils, nous avons : les vêtements, les tentes, les bâches, les
moustiquaires, les rideaux, les grillages pour la protection des ouvertures des
maisons et les répulsifs. La plupart de ces outils sont des
barrières physiques direct Homme-vecteur. L'efficacité des
barrières physiques a été renforcée par leur
imprégnation aux insecticides pyréthrinoïdes qui procurent
en plus un effet répulsif et létal (Darriet, 1998).
La moustiquaire imprégnée à longue
durée d'action (MILDA) et la moustiquaire imprégnée
d'insecticide (MII) agissent i) en protégeant la personne qui dort en
dessous (niveau
Thèse de Doctorat unique - 19
-
individuel : protection personnelle) et ii) en étendant
leur effet à l'ensemble d'une zone (niveau communautaire : effet de
masse). La protection personnelle opère en évitant le contact
entre le moustique et la personne qui se trouve sous la moustiquaire. Le
succès des moustiquaires imprégnées d'insecticides (MII)
fut observé dans les années 1980 avec l'utilisation
d'insecticides de la famille des pyréthrinoïdes.
L'efficacité résiduelle de la deltaméthrine et de la
perméthrine a été évaluée par des bio essais
en utilisant la souche Aedes aegypti à Bobo-Dioulasso ( Hervy
et Sales, 1980). Dans la MII, l'insecticide à effet rémanent
constitue une barrière chimique qui renforce la barrière
physique.
Un répulsif est une substance chimique naturelle
très volatile capable de repousser tout animal nuisible pour l'homme.
Les essences de certaines plantes sont utilisées pour chasser les
moustiques (Paluch, Bartholomay et Coats, 2010 ; Rehman, Ali et Khan, 2014 ;
Deletre et al., 2013 ; Semmler et al, 2014). Des
répulsifs chimiques ont été développées pour
renforcer le pouvoir de répulsion des substances naturelles (Semmler et
al., 2014). Ces répulsifs chimiques sont des molécules
dérivées des principes actifs de plantes, telle que la
pyréthrine, ou des molécules provenant des composés
chimiques simples, tel que le DEET (N1, N-diéthyl-m-toluamide), IR35-35
(N-acétyl-N-butyl-ß-alaninate d'éthyle), KBR3023
(Carboxylate de Sec-butyl 2-(2-hydroxyéthyl)
pipéridine-1/Icaridine).
o La pyréthrine, de la famille chimique des
pyréthrinoïdes, est efficace contre les piqûres de vecteurs
de maladies (Banks et al., 2014 ; Schreck et McGovern, 1989). Certes,
les pyréthrinoïdes sont des insecticides, ils peuvent être
répulsifs-irritants à de faibles concentrations. (ANSES,
2013).
o Le N,N-diéthyl-3-méthyl-benzamide (DEET) est
un répulsif efficace à large spectre, utilisé comme actif
principal ou unique dans de nombreuses formulations commerciales disponibles
pour protéger les humains contre les piqûres d'arthropodes
(Rutledge et al., 1989 ; Fradin et Day, 2002; Katz, Miller et Hebert,
2008).
o L'icaridine, appelée aussi picaridine ou KBR3023,
est une substance chimique peu nocive conçue en 1996 par les
laboratoires allemands Bayer (Paluch et al., 2010) pour pallier les
effets secondaires du DEET (Lundwall et al., 2005). Il est aussi
efficace que le DEET contre les moustiques Ae. aegypti, Ae.
albopictus et An. gambiae (Costantini et al, 2004 ; Licciardi et
al., 2006). Il est l'un des répulsifs les plus utilisés
dans le monde
Thèse de Doctorat unique - 20
-
et est recommandéì par l'OMS en LAV,
notamment dans les zones où le paludisme est endémique
(Costantini, Badolo et Ilboudo-Sanogo, 2004).
o Insect Repellent 3535 (IR3535) ou éthyl butyl
acétyl aminopropionate est plus efficace que le DEET sur certains
vecteurs de maladies tels que les tiques (Boulanger et Lipsker, 2015) et les
moustiques An. gambiae et An. funestus (Licciardi et
al.. 2006). Cependant, il est moins efficace sur Ae. aegypti
que le DEET (Fradin et Day 2002).
1- 2.2. La diminution de la densité
vectorielle
Afin de réduire la densité du vecteur, la lutte
antivectorielle doit perturber le cycle de développement des moustiques
ceci soit en agissant directement sur les oeufs et les larves soit en visant
les adultes ou indirectement en se concentrant sur leur milieu naturel et le
rendant défavorable. Ils se présentent sous les trois formes de
lutte : physique, chimique et biologique
1- 2.2.1. La Lutte biologique
La lutte biologique est définie comme l'utilisation de
prédateurs, parasites ou pathogènes dans le biotope des larves ou
des adultes de moustiques. Le lâcher de mâles stériles
relève également de ce type de lutte lorsque le génome de
ces moustiques n'est pas modifié (figure 7).
Les poissons larvivores comme le Gambusia et les insectes
aquatiques entomophages (se nourrissent d'insectes) ou de certains
microorganismes (bactérie, prédateurs, virus...) sont des
prédateurs de larves de moustiques. En effet, Gambusia affinis,
un poisson culiciphage, est très vorace (Bendali, Djebbar et Soltani,
2001) et a permis d'obtenir de bons résultats dans la lutte contre les
larves de moustique du genre Culex (Lacey, 1990). Aussi, des
espèces de poissons, telles que Poecilia reticulata et
Aplocheilus blochi sont utilisées contre les larves
d'anophèle (Duvallet, Fontenille et Robert, 2017). Également, des
larves de Toxorhynchite, un Culicidae, sont des prédatrices de larves de
Aedes (Rodhain et Perez, 1985). Cette prédation s'observe
également chez les batraciens qui utilisent les larves de Culicidae
comme source de protéines.
Des organismes entomopathogènes tels que certains
virus, bactéries, champignons et helminthes peuvent être
utilisés dans la lutte contre les moustiques. En effet, les
bactéries Bacillus sphaericus sont utilisées contre les
larves de Culex et Bacillus thurengiensis israeliensis H14 contre les
larves d'anophèles (Darriet, 1998; Osborn et al., 2007 ;Boyce
et al., 2013). Aussi, Eliminate Dengue utilise des bactéries
naturelles appelées Wolbachia, endosymbiontes
Thèse de Doctorat unique - 21
-
bactériens, pour réduire la capacité des
moustiques à transmettre aux hommes des virus nocifs tels que ceux de la
dengue, chikungunya et Zika. L'utilisation de la bactérie Wolbachia
pourrait aider à réduire non seulement la population de
Ae. aegypti, sa capacité à transmettre les virus ainsi
que la capacité de prise de sang des femelles âgées (Aliota
et al., 2016).
Les champignons entomopathogènes, des
pathogènes fongiques, peuvent être utilisés comme
mosquitocides ou malariacides à travers leurs spores qui infectent les
moustiques (Bilgo et al., 2017 ; Lowett et al., 2019) . Ces
études ont montré que les actions des spores du champignon du
genre Metarhizium entraînaient une réduction du
comportement d'alimentation sanguine, rendant ainsi les Anopheles
incapables de transmettre le paludisme dans les 5 jours suivant l'infection.
Figure 7 : Méthodes biologiques de
contrôle des moustiques (Benelli, Jeffries et Walker, 2016)
1- 2.2.2. Lutte physique
La lutte physique, ou mécanique, permet
l'éradication pérenne d'un gîte larvaire, en
aménageant l'environnement (assèchement des marais, drainage...)
(Duvallet, Fontenille et
Thèse de Doctorat unique - 22
-
Robert, 2017). Ces actions permettent en outre, de
réduire la productivité des gîtes en adultes ou
d'éliminer complètement ces gîtes. Cette méthode de
lutte présente un réel intérêt, lorsqu'il s'agit de
moustiques dont le mode de vie est domiciliaire ou péri-domiciliaire. Il
s'agit d'éliminer tous les récipients naturels ou anthropiques
pouvant contenir de l'eau stagnante, soit en éliminant ces gîtes
potentiels ou en les vidant de leur eau, soit en les couvrant afin
d'empêcher les femelles d'y pondre (Duvallet, Fontenille et Robert,
2017).
L'OMS et ses groupes d'experts ont élaboré des
guides pratiques (guidelines) pour faciliter la prise en considération
du volet « santé publique » inéluctablement lié
à toute modification de l'environnement. Ces modifications sont
envisagées en fonction de l'échelle spatiale : concernant de
grandes surfaces, pour les travaux de type barrages, routes, zones
d'agriculture irriguée, déforestation ; ou bien, au contraire,
portant sur des micro-chantiers comme les trous d'emprunt de terre pour faire
des briques pour construire les maisons, par exemple. Tout cela relève
de l'hygiène générale du milieu ainsi que
d'éducation sanitaire (Duvallet, Fontenille et Robert, 2017).
1- 2.2.3. La lutte chimique
La lutte chimique repose sur l'utilisation de produits
chimiques (insecticides de synthèse) à effet toxique ou
répulsif sur les insectes cibles. Ces insecticides chimiques
utilisés à la fois contre des adultes et des larves de moustiques
ont connu une forte utilisation dans la deuxième moitié du
siècle dernier, suite à la seconde guerre mondiale. Tous ces
insecticides sont utilisés dans plusieurs méthodes de lutte
antivectorielles : dans les matériaux imprégnés
d'insecticides (moustiquaires et rideaux imprégnés d'insecticides
à longue durée d'action, etc.), les pulvérisations extra
et intra domiciliaires, dans les serpentins, les crèmes
répulsives, les aérosols et le plus souvent dans les gîtes
larvaires.
Les principaux insecticides de synthèse
utilisés en LAV appartiennent à quatre familles chimiques selon
leur mode d'action lié à la neurotoxicité de certaines
molécules, à l'impact sur la respiration cellulaire, à la
formation de la cuticule ou à la perturbation de la mue. Ces familles
sont : les organochlorés (OC), les organophosphorés (OP), les
carbamates (CX) et les pyréthrinoïdes (PY). Ainsi :
o Les organochlorés (OC) sont des
insecticides de contact, neurotoxiques provenant de l'industrie du chlore. Ils
sont considérés comme la plus ancienne famille d'insecticides.
Thèse de Doctorat unique - 23
-
Cependant, leur emploi est en très nette
régression. Outre leur rémanence excessive, leur usage a
été freiné suite à l'apparition des
phénomènes de résistance apparus chez certains moustiques
(Carnevale et Robert, 2009). Cette famille regroupe le DDT et ses analogues, le
lindane (hexachloro-cyclohexane ou HCH) et les cyclodiènes (dieldrine,
endosulfan, chlordecone etc). Le DDT agit à la fois sur le
système nerveux central et périphérique de l'insecte par
contact et ingestion (Carnevale et Robert, 2009) en modifiant les
caractéristiques pharmacologiques et électrophysiologiques des
protéines des canaux sodium voltage-dépendant (CNaVdp)
entraînant ainsi une perturbation des courants calcium/magnésium
(Ca2+/Mg2+) et sodium/potassium
(Na+/K+) le long de l'axone. A cet effet, il exerce sur
les insectes un effet KD comme les pyréthrinoïdes.
o Les organophosphorés (OP) sont des
dérivés de l'acide phosphorique. Ce sont des
insecticides neurotoxiques agissant au niveau du
système nerveux central sur l'acétylcholinestérase (AChE),
enzyme responsable de la dégradation de l'acétylcholine en acide
acétique et en choline ( Rübsamen et al., 1976). La forme
oxydée de ces molécules se fixe sur cette enzyme entraînant
une accumulation d'acétylcholine dans la jonction synaptique. Lorsque sa
concentration devient trop forte, les récepteurs de
l'acétylcholine se bloquent en position ouverte, empêchant la
transmission de l'influx nerveux. Ce qui conduit à la paralysie, puis
à la mort de l'insecte (Carnevale et Robert, 2009). A la
différence des organochlorés, ils présentent une
toxicité aigüe élevée, mais une faible
rémanence. Ils pénètrent facilement dans l'organisme des
insectes à cause de leur liposolubilité élevée.
Parmi ces molécules, nous pouvons citer : le dichlorvos, le malathion,
le fénitrothion, le parathion, le chlorpyriphos-méthyl, le
diazinon, le pirimiphos-méthyl, le téméphos, le fenthion,
etc.
o Les carbamates (CX) dérivés
de l'acide carbamique, sont des insecticides de contact agissant sur le
système nerveux central en inhibant l'acétylcholinestérase
(comme les organophosphorés). Cependant, contrairement aux
organophosphorés, les carbamates agissent directement sans oxydation
préalable. Ils ont généralement une faible
rémanence. Ils sont moins utilisés en santé publique
à cause de leur coût de production et leur toxicité souvent
plus élevée vis-à-vis des mammifères. Les
carbamates sont entre autres, le carbaryl, le propoxur, le bendiocarbe, le
carbofuran, etc.
Thèse de Doctorat unique - 24
-
o Les pyréthrinoïdes sont des
dérivés synthétiques des pyréthrines, insecticides
naturels extraits des fleurs d'une espèce de chrysantème,
Chrysanthemum cinerariaefolium (Namountougou et al., 2013).
Dotés d'une toxicité considérable, mais moins aiguës
que le DDT, les pyréthrinoïdes tuent presque instantanément
les insectes par effet de choc neurotoxique, ce qui permet de les utiliser
à des doses très réduites. Comme les organochlorés,
les pyréthrinoïdes tuent l'insecte en bloquant le fonctionnement
des canaux sodium indispensables à la transmission de l'influx nerveux
(Chapman, 1969). Réputés peu toxiques pour les mammifères,
on leur attribue le coefficient de sécurité le plus
élevé parmi les insecticides chimiques. Très
biodégradables, donc peu persistants, ils sont cependant très
toxiques pour certains organismes aquatiques (poissons) ainsi que pour les
insectes auxiliaires de l'agriculture dont les abeilles qui assurent la
pollinisation. Les pyréthrinoïdes sont des candidats de choix en
santé publique pour l'imprégnation des MILDA à cause de
leur photo-stabilité, leur toxicité sélective et leur
innocuité pour les vertébrés à sang chaud (Zaim,
Aitio et Nakashima, 2000). Les pyréthrinoïdes sont en autres, la
bifenthrine, la bioresméthrine, la deltaméthrine, l'etofenprox,
la cyperméthrine, la cyfluthrine, la lambda-cyhalothrine, la
perméthrine, etc.
Certains insecticides chimiques sont des Régulateurs de
Croissance d'Insectes (RCI). Ils sont caractérisés par un mode
d'action perturbant la mue ( Casida et Quistad, 1998).
1- 2.3. La réduction de la durée de vie des
vecteurs adultes
La réduction de la longévité des vecteurs
adultes peut être obtenue surtout par les luttes génétique
et chimique.
1- 2.3.1. La lutte chimique
La généralisation des aspersions intra
domiciliaires d'insecticides à effet rémanent et les
pulvérisations spatiales à l'intérieur mais surtout
à l'extérieur des maisons peuvent influencer la durée de
vie des vecteurs adultes.
Cet objectif de LAV peut être atteint surtout avec
l'utilisation des Régulateurs de Croissance d'Insectes (RCI). Ces RCI
peuvent être :
· les juvénoïdes (méthoprène
et pyriproxyfène) qui sont des analogues de l'hormone juvénile
inhibant la nymphose, donc provoquant la mort des moustiques avant ou
pendant
Thèse de Doctorat unique - 25
-
la nymphose. Le pyriproxyfène est utilisé dans
l'imprégnation des MILDA et dans les peintures insecticides (Mosqueira
et al., 2010; Bayili et al., 2015).
· les benzoylurées (diflubenzuron) qui inhibent
la sclérification du tégument de la larve après une mue
larvaire ou nymphale. Elles peuvent aussi provoquer la mort des moustiques
à tous les stades du développement pré-imaginal.
Les RCI sont recommandés par l'OMS pour des
traitements larvaires (WHOPES, 2016). Cependant, leur application sur le
terrain pose d'énormes problèmes opérationnels du fait de
leur durée de vie très courte (2-7 jours) et de la
mortalité des moustiques qui est lente rendant difficile la
vérification de leur efficacité ( Bouyer, Gentile et Chandre,
2017; Robert, Ayala et Simard, 2017).
1- 2.3.2. Lutte génétique
La lutte génétique ou encore lutte autocide
affecte les insectes au sein de leur patrimoine génétique. Son
but est d'éliminer une espèce ou de modifier le génome de
l'espèce en introduisant un gène étranger pour la rendre
réfractaire au pathogène (Alphey, 2014). Il s'agit principalement
de :
· La technique de l'insecte stérile qui consiste
à rendre stérile des insectes mâles puis les relâcher
en grand nombre dans une zone d'intervention afin qu'ils puissent entrer en
compétition avec la population locale (Nolan et al., 2011;
Boyer et al., 2012). Après l'accouplement avec un mâle
stérile, les femelles sauvages pondent des oeufs non viables entrainant
ainsi une diminution du nombre d'individus à chaque
génération et à long terme, la disparition de
l'espèce vectrice ciblée. Compte tenu du fait que les mâles
ne piquent pas, cette technique ne risque pas d'accroître l'expansion des
épidémies.
Elle a permis de contrôler la population de
Glossina palpalis gambiensis dans le sud-ouest du Burkina Faso
(Cuisance et al., 1978). Malheureusement, elle reste inefficace contre
les Culicidae, car les mâles stériles sont moins
compétitifs que les mâles sauvages (Maïga et al.,
2014).
· L'incompatibilité cytoplasmique consistant
à utiliser des mâles hybrides nés de la multiplications de
souches dont les origines sont géographiquement éloignées.
Le lâcher de ces mâles hybrides dans des populations
indigènes aboutit à des croisements qui donnent des oeufs
stériles.
·
Thèse de Doctorat unique - 26
-
Moustiques réfractaires au Plasmodium par
l'intégration de gènes responsables de la résistance
à l'infection chez des mâles afin qu'ils soient transmis aux
femelles lors de la copulation. L'expression de ces gènes dans le
génome des femelles leur confère la capacité de
réfractivité au Plasmodium (Rodhain et Perez, 1985).
· Les technologies « Gene Drive »
basées sur des systèmes d'hérédité
biaisés qui
accélèrent la transmission d'un
caractère génétique ciblé d'un parent à sa
descendance à travers la reproduction sexuée (Flannery et
al., 2016 ; Sinkins et Gould, 2006). Cette technologie permet d'augmenter
la probabilité de transmission d'un gène désiré,
sans tenir compte de la valeur sélective. Elle peut être
utilisée dans la LAV, contre les ravageurs agricoles et les
espèces envahissantes (Flannery et al., 2016).
· L'intégration de la bactérie symbionte
intracellulaire Wolbachia dans le vecteur et sa transmission de
génération en génération via les oocytes
infectés de la femelle dans le but de raccourcir sa durée de vie
et empêcher ainsi les parasites d'avoir un développement complet
(Hoffmann et al., 2011).
De nos jours, certaines méthodes de lutte
génétique ont été expérimentées avec
succès sur le terrain en Malaisie, en Polynésie française,
au Brésil et en Australie (Alphey, 2014).
1- 3. Mécanismes de résistance des
moustiques aux insecticides
La résistance est une adaptation
génétique aux modifications de l'environnement. Elle a
été définie par l'OMS comme étant la
capacité d'une population à tolérer des doses de
substances toxiques qui seraient létales pour la majorité des
individus d'une population normale de la même espèce (OMS,
2012).
Trois termes sont employés pour décrire les
patrons de résistance des insectes aux insecticides: résistance
croisée, résistance multiple et résistance multiplicative
(Nikou, Ranson et Hemingway, 2003). Quand un gène/une mutation est
responsable de la résistance à plusieurs familles d'insecticides,
on parle de résistance croisée. Un tel phénomène
s'observe généralement entre des molécules ayant le
même site d'action. Par exemple, les organophosphorés et les
carbamates ont des cibles et des modes d'actions relativement similaires et la
résistance à une famille entraîne souvent une
résistance à l'autre. La résistance multiple est la
résistance conférée par plusieurs mécanismes de
résistances chez un insecte. Enfin, la résistance multiplicative
désigne le fait que le niveau de résistance conféré
par plusieurs mécanismes de résistances aux
Thèse de Doctorat unique - 27
-
insecticides chez un insecte sera plus élevé que
la somme des niveaux de résistance conférée par ces
mêmes mécanismes isolés (Hardstone, Leichter et Scott,
2009). Autrement dit, les mécanismes de résistances peuvent agir
en synergie.
Différents mécanismes de résistance ont
été sélectionnés par l'utilisation massive
d'insecticide aussi bien pour la LAV que pour les traitements agricoles
(Chandre et al., 1999; Dabiré et al., 2012a; Gnankine
et al., 2013).
Les insectes peuvent utiliser deux types de mécanismes
pour résister aux insecticides. Ces mécanismes peuvent être
dus à un changement de comportement, ou une modification physiologique
(métabolique et cuticulaire) ou une modification de la cible (Figure
8).

Figure 8: Mécanismes de
résistance des vecteurs aux insecticides (in Carnevale et Robert,
2009)
1- 3.1. Résistances liées à la
modification physiologique 1- 3.1.1. Mécanismes de résistance
métabolique
Elle se traduit par une augmentation du métabolisme
des insecticides grâce à des enzymes dites de
détoxification présente dans l'ensemble du règne animal et
végétal. L'augmentation du
Thèse de Doctorat unique - 28
-
métabolisme des insecticides peut être due soit
à une augmentation de la production d'une ou de plusieurs enzymes de
détoxication existantes, soit à un meilleur métabolisme de
l'insecticide suite à une mutation d'une ou de plusieurs enzymes. Ces
enzymes dégradent les insecticides en molécules non toxiques ou
moins toxiques. La surproduction d'enzymes peut être due à une
modification d'un gène régulateur contrôlant le
degré d'expression de l'enzyme (Mouchès et al., 1987) ou
à une augmentation du nombre de copies du gène qui code pour ces
enzymes (Hemingway et al., 2004). Ce phénomène se
traduit par une diminution de la quantité d'insecticide atteignant la
cible et donc à une augmentation de la tolérance de l'insecte.
La détoxification fait intervenir trois groupes
d'enzymes à savoir les estérases, les oxydases et les
Glutathion-S transférases (GST) (Enayati, Ranson et Hemingway, 2005) qui
permettent à l'insecte soit :
· de dégrader l'insecticide en métabolite
moins toxique;
· d'augmenter la solubilité des molécules
d'insecticide dans l'eau pour accroitre leur excrétion ;
· d'augmenter la résistance liée à
l'activité catalytique et ou d'augmenter la quantité d'enzymes
intervenant dans la dégradation des insecticides (Enayati, Ranson et
Hemingway, 2005).
Les enzymes intervenant dans les mécanismes de
résistance métabolique peuvent être classées en
trois familles : les estérases, les Glutathion-S transférases
(GST) et les oxydases.
o Les estérases attaquent les
liaisons carboxyester et phosphotriester des organophosphorés, des
carbamates et des pyréthrinoïdes rendant l'insecte résistant
à ces insecticides.
o Les Glutathion-S transférases (GST)
est la famille d'enzymes qui catalyse la liaison du glutathion avec des
composés dotés d'un centre électrophile réactif. Il
en résulte la formation de produits hydrosolubles moins réactifs
moins toxiques et faciles à éliminer.
o Les oxydases sont impliquées dans
la résistance à plusieurs groupes d'insecticides. Il s'agit de
phénomènes métaboliques relativement mal connus pour ce
qui concerne leur implication dans la résistance aux insecticides.
Thèse de Doctorat unique - 29
-
1- 3.1.2. La résistance cuticulaire
Elle désigne toute modification chimique de la
cuticule de l'insecte entraînant une réduction de la
pénétration de l'insecticide dans son organisme aboutissant
à une meilleure protection des individus (Plapp, 1984).
1- 3.2. La résistance liée à la
modification de la cible
C'est un mécanisme très efficace
conférant une résistance croisée à tous les
insecticides agissant sur la même cible. La résistance liée
à la modification d'une cible s'explique par la substitution d'un ou de
plusieurs acide (s) aminé (s) dans la séquence de la
protéine cible suite à une mutation non synonyme
(Ffrench-Constant, Daborn et Le Goff, 2004). Cela aboutit à
l'altération de la molécule d'origine (d'où la diminution
de l'affinité de la cible pour les insecticides concernés)
permettant aux insectes de supporter une longue exposition aux insecticides
sans être tués.
1- 3.2.1. Les mutations kdr/le canal sodium
Plusieurs mutations ont été recensées
à ce jour dont les plus importantes sont celles du canal sodium voltage
dépendante (CNaVdp) où l'on note une substitution de la leucine
au niveau du codon 1014 dans le domaine II du 6ème segment
(IIS6), par la serine (L1014S) ou la phénylalanine (L1014F)
(Martinez-Torres et al., 1998 ; Ranson et al., 2000).
En Afrique de l'Ouest, la mutation L1014F est
fréquemment retrouvée dans les populations de An. gambiae
s.l. (Martinez-Torres et al., 1998), alors que la
mutation L1014S est plus fréquente chez les populations d'Afrique de
l'Est (Ranson et al., 2000). Cependant, chez la souche
résistante (knock down resistant « kdr »),
une mutation ponctuelle entraine une diminution de l'affinité de
l'insecticide aux CNaVdp, conférant ainsi la résistance aux
pyréthrinoïdes et au DDT.
Actuellement la mutation L1014F est quasiment
fixée dans la majorité des zones endémiques au Burkina
Faso (Namountougou et al., 2019).
1- 3.2.2. La mutation
Ace-1/l'acétylcholinestérase (AChE)
Cette mutation du gène codant
l'acétylcholinestérase résulterait d'un remplacement de la
glycine par la serine au niveau du segment 119 (mutation G119S) de l'enzyme,
entraînant ainsi
Thèse de Doctorat unique - 30
-
une diminution de l'affinité de l'AChE vis-à-vis
de l'insecticide (organophosphoré et carbamate) (Weill et al.,
2003, 2004). Cette résistance a été mise en
évidence à des fréquences plus élevées chez
An. gambiae et An. coluzzii dans le Sud-ouest du
Burkina Faso (Dabiré et al., 2009).
1- 3.3. Résistance comportementale
Il s'agit d'un changement de comportement de la part des
insectes permettant d'éviter tout effet létal ou contact avec des
endroits et surfaces traités avec des insecticides (Bogh et
al., 1998; Ranson et al., 2011). Ce changement de
comportement en réponse à l'exposition aux insecticides peut
conduire à une meilleure survie des insectes. Ces mécanismes,
moins étudiés, interviennent souvent en synergie avec les
mécanismes précédents. Cependant, ce type de
mécanisme de résistance reste relativement difficile à
étudier et peu d'études sont disponibles.
1- 4. Stratégies de gestion de la
résistance aux insecticides
Le développement de la résistance dans les
populations d'insectes est un phénomène évolutif
basé sur les mécanismes adaptatifs de la sélection
naturelle. Ce n'est pas l'utilisation d'insecticides qui crée la
résistance, mais la résistance apparait par mutation
spontanée ou par migration au niveau des descendants. Si la pression
insecticide est maintenue sur plusieurs générations, alors la
fréquence des individus porteurs d'allèles de résistance
augmente progressivement à chaque génération (CNEV, 2014).
Ce processus de sélection est sous la dépendance de facteurs tels
que la biologie de l'insecte, les facteurs liés aux gènes de
résistance (CNEV, 2014). Par exemple, les insectes qui ont un temps de
développement court, de nombreuses générations par an et
une forte prolificité (stratégie R, exemple des moustiques)
deviennent plus rapidement résistants que les insectes au
développement long, avec un nombre limité de
générations et de descendants (stratégie K, exemple des
glossines).
Le plan mondial de gestion de la résistance aux
insecticides des vecteurs du paludisme (GPIRM) comprend cinq activités
décrites en cinq « piliers » visant à contrôler
la résistance aux insecticides afin de garantir l'efficacité
continue des outils de LAV (OMS, 2012). Ce plan repose sur les cinq piliers
suivants :
o Planifier et appliquer des stratégies de gestion de
la résistance aux insecticides dans les pays endémiques;
o Veiller au suivi entomologique en temps utile, à la
surveillance de la résistance et à une
Thèse de Doctorat unique - 31
-
gestion efficace des données;
o Élaborer des outils novateurs de lutte antivectorielle
;
o Combler les lacunes de connaissances au niveau des
mécanismes de résistance aux insecticides et de l'impact des
stratégies actuelles de gestion de la résistance.
o Veiller à mettre en place des mécanismes
(plaidoyer, ressources humaines et financières) créant des
conditions favorables.
De nos jours, plusieurs outils sont proposés afin de
maintenir l'efficacité de la LAV malgré la menace de
résistances (OMS, 2012).
1- 4.1. Peintures insecticides
Ce sont de nouvelles formulations de peintures dans lesquelles
différents insecticides microencapsulés sont incorporés
dans des résines, puis sont libérés progressivement
à la surface des supports peints. Les insectes volants ou rampants se
contaminent par un simple contact avec la surface du revêtement. Puis, de
la partie contaminée de l'insecte, la matière active de
l'insecticide va remonter jusqu'à son système nerveux. Il s'en
suit alors un effet Knock down et l'insecte tombe sur le sol sans tacher le
support peint.
Les peintures insecticides s'adaptent à toutes sortes
de supports minéraux, poreux ou absorbant.
En fonction des conditions ambiantes, les peintures
insecticides peuvent rester actives sur les supports peints, pendant plusieurs
années. Malgré cela, elles ne sont pas nocives ou toxiques pour
les humains ou les animaux domestiques et n'émettent pas de vapeurs
odorantes.
Inesfly ®5A IGR est un exemple de peinture de vinyle avec
une base aqueuse contenant deux organophosphorés, le chlorpyriphos
(1,5%) et le diazinon (1,5%) et un régulateur de croissance d'insectes
(RCI), le pyriproxyfène (0,063%) incorporés dans du carbonate de
calcium (CaCO3) et des microcapsules de résine. Des études
antérieures ont démontré que le chlorpyrifos induit une
excito-toxicité due au glutamate, que le diazinon provoque la mort
neuronale apoptotique et que pyriproxyfène agit sur la fertilité
des femelles de moustiques, sur les larves et les nymphes des insectes
(Aldridge, 1950; Dhadialla, Carlson et Le, 1998; Mbare, Lindsay et Fillinger,
2014 ; Bayili et al., 2015).
Thèse de Doctorat unique - 32
-
1- 4.2. L'ivermectine comme outil de lutte
antivectorielle
L'ivermectine (IVM) est un dérivé des
avermectines, isolé à partir de la fermentation de bouillons de
Streptomyces avermitilis. Il est utilisé en santé animale contre
les nématodes (vers ronds) et les arthropodes (insectes et tiques)
(Campbell et al., 1983; Benz, Roncalli et Gross, 1989). En
santé humaine, il est très utilisé pour le traitement des
maladies tropicales négligées telles que l'onchocercose, la
filariose lymphatique et les strongyloidoses (Suputtamongkol et al.,
2011).
Au début de la pandémie, l'intérêt
de l'ivermectine pour traiter le COVID-19 a été
évalué avec quelques études qui ont semblé
être prometteuses (Caly et al., 2020; Kory et al.,
2021) mais qui n'ont pas connu le consensus scientifique.
Autrefois, utilisée pour lutter contre les maladies
parasitaires négligées, l'ivermectine suscite un
intérêt grandissant pour les chercheurs qui l'envisagent comme un
outil alternatif de lutte contre les vecteurs du paludisme (Chippaux,
Boussinesq et Prod'hon, 1995; Chaccour et al., 2013; Pooda et
al., 2015). Plusieurs études ont montré les
propriétés insecticides de l'ivermectine sur différentes
espèces d'anophèles (Jones et al., 1992; Rohrer et
al., 1994; Foley, Bryan et Lawrence, 2000; Chaccour, Lines et Whitty,
2010; Pooda et al., 2015; Sampaio et al., 2016). Aussi,
d'autres études ont montré une diminution de la survie et de la
fécondité chez des populations d'anophèles gorgées
sur des sujets humains ou animaux ayant pris des doses thérapeutiques
d'ivermectine (Sylla et al., 2010 ; Kobylinski et al., 2011,
2014; Chaccour et al., 2013; Slater et al. 2020). En effet,
les distributions de masse d'ivermectine peuvent constituer un outil
très efficace dans la LAV, si ces distributions sont
répétées fréquemment avec une couverture large
(Slater et al., 2014, 2020).
1- 4.3. Les stratégies des pièges à
appât sucré et des « tubes d'avant-toit »
La stratégie des pièges à appât
sucré sur l'approche « attirer et tuer » (ou « attractive
toxic sugar bait » (ATSB) en anglais). Elle consiste en l'utilisation des
pièges contenant à la fois du jus sucré qui attire les
moustiques et des substances toxiques comme les insecticides pour les tuer
(Müller et al., 2010 ; Marshall et al., 2013 ; Traore et
al., 2020) . Les études effectuées ont montré des
résultats encourageants. En effet, une étude menée au Mali
à grande échelle a montré que cette stratégie
entrainait une réduction considérable de la densité
d'agressivité des moustiques (Traore et al., 2020).
Thèse de Doctorat unique - 33
-
La stratégie « tubes d'avant-toit » ou
(« Eavetubes » en anglais) consiste à fermer les ouvertures
des avant-toits des habitations à l'aide de revêtement
électrostatique afin d'empêcher les moustiques d'entrer dans les
maisons (Knols et al., 2016 ; Sternberg et al., 2016;
Snetselaar et al., 2017 ; Barreaux et al., 2019).
1- 4.4. Huiles essentielles comme bio-insecticides
alternatifs
Les extraits de plantes sont aussi utilisés comme
outils dans la lutte anti vectorielle. En effet, ces extraits de plantes aqueux
ou sous forme d'huiles essentielles (HE) contiennent des substances toxiques
pouvant agir efficacement sur les moustiques.
Ce sont des sources de molécules naturelles
présentant un grand potentiel d'application contre les insectes et
d'autres parasites des plantes et du monde animal (Guarrera, 1999).
Les HE sont classées usuellement selon la nature
chimique des composés actifs majeurs. On retient neuf principales
classes (Georges, 1979) :
· huiles essentielles riches en carbures terpéniques
et sesquiterpéniques (HE de citron) ;
· huiles essentielles riches en alcools (HE de coriandre)
;
· huiles essentielles mélanges d' esters et
d'alcools (HE de lavande, HE de menthe...) ;
· huiles essentielles riches en aldéhydes HE de
citronnelle ;
· huiles essentielles riches en cétones (HE de
camphrier ) ;
· huiles essentielles riches en phénols (HE de
girofle) ;
· huiles essentielles riches en éthers (HE d'
Eucalyptus) ;
· huiles essentielles riches en peroxydes (HE de
Eucalyptus globulus (Eucalyptol)) ;
· huiles essentielles sulfurées (HE d'ail).
La plupart des HE sont constituées dans leur grande
majorité d'un mélange assez complexe de monoterpènes, de
sesquiterpènes, d'alcools, d'esters, d'aldéhydes, d'oxydes,
etc.
Les HE sont des mélanges naturels complexes de
métabolites secondaires volatils, isolées par hydrodistillation
ou par expression mécanique (Kalemba et Kunicka, 2003). Elles sont
obtenues par hydrodistillation, expression à froid à partir de
feuilles, de graines, de bourgeons, de fleurs de brindilles, d'écorces,
de bois, de racines, de tiges ou de fruits (Burt, 2004), mais également
à partir de gommes qui s'écoulent du tronc des arbres.
Les plantes ayant des propriétés insecticides
sont réparties dans une cinquantaine de familles incluant les Lamiaceae,
les Asteraceae, les Rutaceae, les Lauraceae, les Magnoliaceae et
Thèse de Doctorat unique - 34
-
les Verbenaceae (Bruneton, 1993). On dénombre plus de
1200 plantes répertoriées comme possédant des effets
répulsifs (Curtis et al., 1987). Différentes parties des
plantes sont utilisées pour les extractions des différents
composés : les feuilles, les fleurs, les écorces et les tiges.
Les HE contiennent surtout des terpénoïdes
oxygénés et hydrocarbonés. Ces composés peuvent
être extraits et utilisés comme insecticides ou répulsifs
contre les insectes. Les HE peuvent tuer les insectes à tous les stades
de développement (Dell`Agli et al., 2012). Plusieurs
études ont démontré les effets ovicides, larvicides et
adulticides des HE vis-à- vis des moustiques (Bassolé et
al., 2003; Sengottayan, 2007; Tchoumbougnang et al., 2009;
Dua, Pandey et Dash 2010.; Wangrawa et al., 2015; Yameogo et
al., 2021; Balboné et al., 2022a, 2022b).
Les larves de Aedes aegypti et de Culex pipiens
sont tuées à de faibles doses par les HE de Citrus
bergamia, Cuminum myrrha, Pimenta racemosa, Psidium
rotundatum et Melaleuca leucadendron qui entrainent 100% de
mortalité à 25 ppm (Lee, 2006). Les HE exercent
également une activité Knock down et adulticide sur
différentes espèces de moustiques (Dua, Pandey, and Dash 2010).
Les HE sont toxiques vis-à-vis des larves et des adultes de An.
gambiae, Ae. aegypti, Cx. quinquefasciatus, An. culicifacies, An. fluvialitis
et An. stephensi (Dua, Pandey, and Dash 2010.; Oparaocha, Iwu et
Ahanaku, 2010; Kweka et al., 2011).
Les méthodes d'extraction des HE peuvent être
entre autres, la méthode par hydrodistillation avec le Clevenger, la
méthode par hydrodistillation avec le Soxhlet et la méthode
d'extraction par hydro-diffusion avec l'alambic.
o Principe de la méthode par hydrodistillation
avec le Clevenger
L'eau et les échantillons de la plante à
extraire sont dans un ballon qui est place dans un dispositif de chauffage. La
vapeur monte dans le tube à dégagement jusqu'à un
condensateur, et le condensat retombe dans une petite burette. L'huile flotte
sur l'eau, qui est pour sa part progressivement renvoyée dans le ballon
chauffé par un conduit en diagonale. Ce processus peut durer deux heures
et le volume d'huile recueilli peut être mesuré directement dans
la burette.
o Principe de la méthode par hydrodistillation
avec le Soxhlet
L'échantillon broyé (broyat) de la plante
à extraire est entassé dans une cartouche qui est
déposée dans le Soxhlet avec 1L de solvant pour chaque
extraction. Soixante-quinze (75) centilitres de solvant sont versés
directement sur le broyat et les 25cl restants versés dans le ballon
dans lequel sont déposés au préalable quelques grains de
pierres ponces. Le tout est porté à
Thèse de Doctorat unique - 35
-
ébullition dans le thermostat. L'ensemble est donc
prêt pour l'extraction à l'aide de l'éther de
pétrole 60-80 à ébullition qui dissout graduellement
l'huile végétale. Le solvant contenant l'huile
végétale retourne dans le ballon par déversements
successifs causés par un effet de siphon dans le coude latéral.
La matière grasse s'accumule dans le ballon jusqu'à ce que
l'extraction soit complète. Une fois l'extraction terminée,
l'éther de pétrole est évaporé,
généralement sur un évaporateur rotatif.
o Principe de la méthode d'extraction par
hydro-diffusion avec l'alambic
Ce dispositif est composé d'une cuve dans laquelle on
place les plantes à distiller. Les plantes sont dissociées de
l'eau dans la même cuve. La cuve est chauffée et recouverte par un
chapiteau qui est prolongé par un col de cygne, celui-ci est
raccordé à un serpentin de refroidissement. Pour cela, celui-ci
est plongé dans une cuve d'eau froide. Le serpentin débouche sur
l'essencier, muni de deux robinets. Celui du bas permet de recueillir
l'hydrolat ou eau florale et celui du haut l'huile essentielle.
A B C
Figure 9: Appareils d'extraction des huiles
essentielles (A = Appareil de Clevenger ; B =
Alambic ; C = Dispositif par le Soxhlet)
1.5. Importance des HE
Les extraits de plantes jouent un rôle dans
l'écologie de la plante, notamment dans les interactions plantes-plantes
et les interactions plantes insectes. C'est ainsi que la plupart des HE,
produits du métabolisme secondaire, ont des propriétés
allopathiques ou pesticides.
Les HE sont utilisées dans différentes
formulations, comme les médicaments traditionnels pour des soins de
santé primaire et dans la parfumerie (Heath, 1981; OMS, 2002).
Cette ruée vers la médecine par les plantes peut
s'expliquer par le fait que les plantes sont accessibles et abondantes, surtout
dans les pays en voie de développement (OMS, 2002; Muthu et
al., 2006) . De plus, les effets secondaires causés par les plantes
sont minimes voire absents, au contraire des médicaments
semi-synthétiques ou synthétiques (Iwu, Duncan et Okunji, 1999).
Plusieurs études ont montré les propriétés
antibactériennes et antifongiques des HE (Bassolé et
al., 2005; Burt, 2004 ; Samba et al., 2020 ; Sawadogo et
al., 2022).
Les HE présentent également un
intérêt scientifique en plus de celui économique et
agro-alimentaire, résidant dans le fait qu'elles procurent souvent de
nouvelles molécules, qui servent de modèles pour la
synthèse industrielle d'analogues structuraux.
Thèse de Doctorat unique - 36
-
PARTIE 2 : METHODOLOGIE GENERALE
Thèse de Doctorat unique - 37
-
Thèse de Doctorat unique - 38
-
Cette partie présente la description des sites de
collectes larvaires, des sites de récolte des différentes
plantes, ainsi que le matériel biologique (animal et
végétal) et le matériel expérimental. Il
décrit aussi les différentes méthodes d'extraction des HE
et les tests statistiques qui ont été réalisés sur
les données obtenues lors de cette étude. Les travaux de cette
thèse se sont déroulés sur trois années
consécutives (2019, 2020 et 2021).
2- 1. Cadre d'étude
Cette étude a été menée au Burkina
Faso, pays situé au coeur de l'Afrique de l'Ouest. Le Burkina Faso
s'étend sur une superficie de 274 200 km2 (INSD 2020). Son
réseau hydrographique assez important est constitué de trois
bassins principaux : les bassins de la Volta, de la Comoé et du Niger.
Le bassin de la Volta s'étend au Centre et à l'Ouest du pays sur
une superficie de 178 000 km2 (INSD 2020). Il est constitué
par trois sous-bassins majeurs : le Mouhoun, le Nakambé et le Nazinon.
Le bassin de la Comoé draine l'extrémité Sud-Ouest du pays
sur un bassin versant de 18 000 km2 comprenant de nombreux affluents
(INSD 2020). Le bassin du Niger draine le Nord-Est et l'Est du pays avec un
bassin versant de 72 000 km2. Les cours d'eau du Burkina Faso,
à l'exception du Mouhoun et de ceux du Sud-Ouest (bassin de la
Comoé), sont temporaires et ne coulent que de juillet à octobre
(INSD 2020).
Le Burkina Faso a un climat tropical sec où s'alternent
deux saisons : une longue saison sèche (d'octobre à avril) et une
courte saison pluvieuse (de mai à septembre). Le climat tropical sec est
subdivisé en trois zones climatiques qui sont :
· la zone sahélienne au Nord avec moins de 600 mm
de pluviométrie par an et des amplitudes thermiques
élevées (15 à 45°C) ;
· la zone soudano-sahélienne au centre avec une
pluviométrie qui varie entre 600 et 900 mm par an et des
températures moyennes variant entre 28 et 30°C ;
· la zone soudano-guinéenne à l'Ouest
où les précipitations varient de 900 à 1200 mm par an avec
des températures moyennes inférieures à 28°C.
Pays en voie de développement, le Burkina Faso est un
pays où l'agriculture représente 32% du produit intérieur
brut (PIB) et occupe 80% de la population active (INSD 2020). Les pratiques
agricoles regroupent principalement les cultures de rente (coton, arachide,
sésame, canne à sucre, anacarde, etc.), les cultures
céréalières (sorgho, mil, maïs et riz) et les
cultures maraîchères de contre-saison (INSD, 2020). En plus de
l'agriculture, d'autres activités sont
Thèse de Doctorat unique - 39
-
pratiquées par les populations notamment la
pisciculture, l'élevage et la sylviculture (INSD, 2020).
La province du Houet, située dans la zone
soudano-guinéenne, est un carrefour et l'une des grandes zones
industrielles du pays. Bobo-Dioulasso est le chef-lieu de la province et Bama
(Vallée du Kou), l'un de ses départements où l'agriculture
est l'activité principale de la population cause à des
aménagements hydro-agricoles.
Les travaux de cette thèse ont été
réalisés dans la région des Hauts-Bassins du Burkina Faso
(Figure 10).
Les prospections larvaires pour An. gambiae ont
été effectuées dans la Vallée du Kou (Bama) et dans
divers quartiers de Bobo Dioulasso pour Ae. aegypti.
La Vallée du Kou (VK) (11°24'N et 4°24'O) est
située à une trentaine de kilomètres au Nord de
Bobo-Dioulasso (Figure 10). La température moyenne annuelle y est de
27,7°C et les précipitations sont en moyenne de 900,8 mm par an
(INSD, 2020). C'est une zone rizicole aménagée depuis 1972,
composée de sept (7) quartiers rizicoles avec une population
estimée à environ 85.798 habitants sur une superficie de 1.500 ha
(INSD, 2020).
En raison du système d'irrigation et de la
disponibilité en eau, les casiers rizicoles dans la Vallée du Kou
créent en permanence des gîtes très productifs aux
culicidés. D'autres gîtes temporaires favorables aux
Anophèles, composés de dépressions et de retenues d'eau,
s'y ajoutent pendant la saison des pluies. Plusieurs études
menées dans la commune de Bama ont confirmé la résistance
des vecteurs du paludisme aux pyréthrinoïdes et au DDT avec des
fréquences de la mutation kdr-L1014F quasiment fixées
(Dabiré et al., 2008; M. Namountougou et al.,
2019).
Bobo-Dioulasso (11°11'N et 4°17'O), situé
à environ 360 kilomètres de Ouagadougou, est la capitale
économique du Burkina Faso et la deuxième grande ville en
population après Ouagadougou. C'est la capitale de la région des
Hauts-Bassins et le chef-lieu de la province du Houet. A cause de l'essor
démographique, les gîtes de Ae. aegypti se sont
développés dans la ville de Bobo-Dioulasso aussi bien dans les
domiciles que dans les services. D'après une enquête menée
en 2015 par Fournet F. et al., les Indices de Breteau (nombre de
maisons avec gîtes positifs pour 100 maisons) sont plus
élevés à Bobo-Dioulasso avec des gîtes positifs plus
fréquents dans l'ensemble des quartiers visités. Des
études ont montré la résistance des vecteurs de la dengue
aux insecticides chimiques dans cette localité (Ouattara et
al., 2019; Namountougou et al., 2020).
Thèse de Doctorat unique - 40
-
Le choix de ces sites se justifie en grande partie par la
situation de résistance des moustiques aux insecticides chimiques.
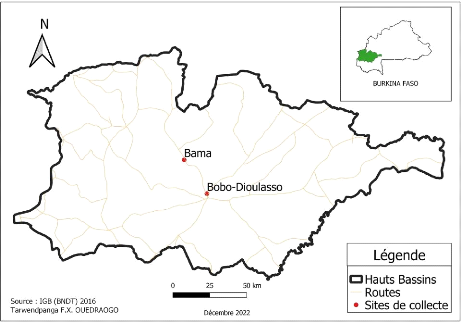
Figure 10: Présentation des sites
d'études
2- 2. Matériel
2- 2.1. Matériel végétal
Le matériel végétal est constitué
des feuilles de plantes de Eucaluptus camaldulensis, de Cymbopogon
nardus, de Cymbopogon citratus, de Lippia multiflora et
de Ocimum americanum (Figure 11). Les cinq plantes ont
été choisies tout d'abord en raison des informations provenant de
personnes interrogées dans les régions étudiées
ainsi qu'à partir de la littérature.
Thèse de Doctorat unique - 41
-
Les spécimens ont été identifiés
et conservés à l'Herbier de l'Université Joseph KI-ZERBO.
Lesdites feuilles ont été récoltées dans le mois de
juillet 2019 dans le jardin de l'Institut de Recherche en Sciences
Appliqués et Technologies (IRSAT) (Tableau I).
Tableau I: Les espèces
végétales dont les feuilles ont été
collectées dans le jardin de l'IRSAT pour l'extraction des huiles
essentielles
|
Espèces végétales
|
Familles botaniques
|
|
Eucalyptus camaldulensis
|
Myrtaceae
|
|
Cymbopogon nardus
|
Poaceae
|
|
Cymbopogon citratus
|
Poaceae
|
|
Lippia multiflora
|
Verbenaceae
|
|
Ocimum americanum
|
Lamiaceae
|

Cymbopogon nardus

Cymbopogon citratus

Eucalyptus camaldulensis

Lippia multiflora Ocimum americanum
Thèse de Doctorat unique - 42
-
Figure 11: Les plantes dont les huiles
essentielles ont été extraites (Cliché
Balboné, 2019)
Thèse de Doctorat unique - 43
-
2- 2.2. Matériel animal : les souches de
moustiques
Quatre souches de moustiques ont été testées
:
o les souches sensibles : Kisumu qui est la
souche de référence de An. gambiae originaire du Kenya
et Bora Bora qui est la souche de référence de Ae. aegypti.
Ces deux souches ont été élevées à
partir des oeufs à l'insectarium de l'Institut de Recherches en Sciences
de la Santé / Direction Régionale de l'Ouest (IRSS/DRO) en
collaboration avec le Centre MURAZ de Bobo-Dioulasso ;
o les souches de terrain de An. gambiae
et de Ae. aegypti, populations naturelles résistantes aux
pyréthrinoïdes collectées respectivement à la
Vallée du Kou et à Bobo-Dioulasso.
2- 2.3. Matériel physique
2- 2.3.1. Matériels d'extraction des huiles
végétales
Les huiles essentielles ont été extraites
à partir des feuilles par hydrodistillation avec un appareil de type
Clevenger (Schott DURAN, Allemagne) (Figure 12) au laboratoire des substances
naturelles de l'IRSAT. Une balance a été utilisée pour le
pesage des différentes feuilles avant l'extraction. En effet, deux cents
(200) grammes de matériel végétal frais
découpé en petits morceaux ont été mis dans le
ballon contenant 1200 ml d'eau (Akrout, 2004). Puis, le mélange contenu
dans le ballon a été porté en ébullition pendant
trois heures (3h).
Après une montée de la vapeur dans le tube
jusqu'au réfrigérant, le condensat a été recueilli
dans la burette. L'opération a été
répétée trois fois. Les huiles essentielles ont
été ensuite collectées par décantation et
séchées sur du sulfate de sodium Anhydre. Des bouteilles ont
servi à la conservation des différentes HE. Le rendement en huile
essentielle (R%) est défini comme étant le rapport de la masse de
l'huile essentielle obtenue sur la masse de la matière
végétale fraiche (Kpatinvoh et al., 2017). Le rendement
est exprimé en pourcentage (%) est calculé par la formule
suivante :
R% = (Mh / Ms) x 100 où Mh est la masse d'huile
essentielle obtenue et Ms, la masse de matière végétale
utilisée.
réfrigérant
tube
tube de retour
ballon
burette à robinet en verre
|
|
|
Thèse de Doctorat unique - 44
-
Figure 12: Clevenger pour extraction d'huiles
essentielles (Cliché Balboné, 2019)
2- 2.3.2. Matériels pour l'élevage des
larves et adultes de An. gambiae et de Ae.
aegypti
Il s'agit :
o des farines de croquettes de chat (TetraMinBaby®) et du
jus sucré : ils ont servi respectivement à nourrir les larves et
les adultes des moustiques d'études ;
o des gobelets en plastiques transparents pour contenir les
nymphes dans les cages ;
o du ruban adhésif pour l'étiquetage des bacs ;
o des bacs voilés de moustiquaire contenant l'eau pour
l'élevage des larves d'études ;
o des cages couvertes de moustiquaire pour l'élevage des
adultes.
2- 2.3.3. Matériels pour les tests
bio-essais.
Il s'agit :
o de l'alcool 70% pour le nettoyage de la paillasse et des tubes
OMS
o des tubes OMS ;
o de l'acétone pour la dilution des HE ;
o du papier whatman ;
o des pipettes et micropipettes pour la dilution des HE ;
o du papier aluminium pour la conservation des papiers
imprégnés.
2- 3. Méthodes
2- 3.1. Collecte larvaire et élevage des
moustiques
Les larves ont été collectées entre
août et octobre des années 2019 et 2020 dans les rizières
et les retenues d'eaux entre les maisons dans la vallée du Kou pour
An. gambiae (Figure 13A) et dans des pneus et des récipients
abandonnés dans différents milieux urbains de Bobo-Dioulasso pour
Ae. aegypti (Figure 13B), à l'aide d'une louche par la
méthode standard de « dipping ». Les larves collectées
ont été traitées et mises dans des bidons de 1,5L pour
être transportées à l'insectarium de l'IRSS/Centre
Muraz.
A l'insectarium, en fonction des sites de collectes, les
larves ont été mises dans des bacs d'élevage contenant 1
litre d'eau de source pour environ 200 larves (Figure 13C) et nourries avec du
TetraMinBaby® dans les conditions standards de l'insectarium
(température 27 #177; 2 °C ; humidité relative : 70#177;5% ;
12h : 12h en alternance jour/nuit). Après le stade nymphal, les
moustiques adultes, maintenus dans des cages, ont été nourris en
plaçant sur chaque cage un tampon de coton hydrophile imbibé de
glucose 5% (Figure 13C). En fonction des besoins, certaines larves de stades 3
et 4 ont été triées pour les tests larvaires. Les autres
seront conservées jusqu'à l'émergence en adultes à
l'insectarium pour les tests adulticides.
Les femelles adultes de An. gambiae s.l. ont
été séparées des autres culicidés
grâce à la clef de détermination morphologique de Gillies
et Coetzee (1987).
Les larves des souches sensibles de Ae. aegypti et
de An. gambiae (respectivement Bora Bora et Kisumu) ont
été obtenues à l'insectarium de l'IRSS/DRO à partir
des pontes des adultes de ces souches sensibles qui sont des souches de
références OMS.
Thèse de Doctorat unique - 45
-

A
B
C
Thèse de Doctorat unique - 46
-
Figure 13: Collecte larvaire et élevage
de moustiques
A : Collecte de larves de Aedes aegypti
; B : Collecte de larves de Anopheles gambiae ;
C : Élevage des moustiques à l'insectarium
(Cliché Balboné, 2019)
2- 3.2. Techniques d'extraction
Les huiles essentielles utilisées dans cette
étude ont été extraites à l'IRSAT par
hydrodistillation avec un dispositif de type clevenger (Clevenger 1928) (Figure
13). Cette méthode a consisté en une distillation classique dans
laquelle le matériel végétal et l'eau sont introduits dans
la partie appelée « bac pour eau + matière ». Ce
mélange a été ensuite chauffé à l'aide du
gaz butane jusqu'à ébullition environ quarante-cinq (45) minutes
après le début du chauffage. La vapeur qui en est sortie a suivi
le tube à dégagement jusqu'à un condensateur où le
condensat est retombé dans une petite burette. Dans cette burette,
l'huile flottant sur l'eau, le volume d'huile recueilli peut être
mesuré directement. Ce processus peut durer deux heures. Les huiles
essentielles avec quelques gouttelettes d'eau ont été ensuite
mises dans des petites bouteilles qui ont été placées dans
un congélateur dans lequel l'eau se congèle et libère
l'HE. Puis, les HE ont été vidées dans des bocaux vides et
propres.
Thèse de Doctorat unique - 47
-
2- 3.3. Caractérisation des huiles
essentielles
La caractérisation des huiles essentielles a
été réalisée à l'IRSAT selon le protocole
décrit de la façon suivante : Les huiles essentielles ont
été analysées par chromatographie en phase gazeuse (CPG)
et chromatographie en phase gazeuse couplée avec la spectrométrie
de masse (CPG/SM).
2- 3.3.1. L'analyse par chromatographie en phase gazeuse
(CPG)
L'analyse en CPG a été effectuée
à l'aide d'un chromatographe de type Agilent 6890 série N
équipé d'un détecteur à ionisation de flamme (FID)
et d'une colonne du type DB-5 (longueur : 10 m X 0,1 mm Diamètre ;
l'épaisseur de film était de 0,17 ìm, Agilent Palo Alto,
CA). Le gaz vecteur était l'hélium (vitesse moyenne 42 cm/sec) et
la température de programmation du four était comprise entre 60
et 165 °C avec un gradient de 8°C/mn ; de 165°C à
280°C avec un gradient de 20°C/mn. L'appareil a été
piloté par un système informatique de type « HP ChemStation
», gérant le fonctionnement de l'appareil et a permis de suivre
l'évolution des analyses chromatographiques.
2- 3.3.2. L'analyse par chromatographie en phase gazeuse
couplée avec la spectrométrie de masse (CPG/SM)
Cette analyse a été réalisée sur
un chromatographe en phase gazeuse (Figure 14) de type Hewlett-Packard
(série HP 6890 GC) couplé avec un spectromètre de masse,
série HP 5972 MSD (Hewlett Packard, Palo Alto, CA). La fragmentation a
été effectuée par impact électronique sous un champ
de 70 eV. La colonne utilisée était une colonne capillaire HP-
5MS Zebron (30 m X 0,25 mm), l'épaisseur du film était de 0,25
ìm. La température du four a été maintenue à
45 ° C pendant 2 min et augmentée de 45 ° C à 165
° C à 4 ° C / min, et à partir de 165 ° C à
280 ° C à 15 ° C / min. Le gaz vecteur a été
l'hélium dont le débit est fixé à 1,5 ml/min. Le
mode d'injection a été split (rapport de fuite : 1/50).

Thèse de Doctorat unique - 48
-
Figure 14: Chromatographe en phase gazeuse
couplé avec spectromètre de masse
(
http://crapcexpertise.dz/wp-content/uploads/2018/10/5973inert-640x425.jpg)
2- 3.3.3. Identification des composants des
huiles
L'identification des composants de l'huile essentielle a
été réalisée par comparaison de leurs indices de
rétention avec ceux des homologues série de n-alcanes (C8-C32)
déterminés dans les mêmes conditions du mode
opératoire, et par comparaison de leurs spectres de masse avec ceux des
données de la littérature (Adams 2007). Les pourcentages relatifs
des composants ont été calculés sans utiliser les facteurs
de correction.
2- 3.4. Méthode de dilution des huiles
essentielles et des combinaisons d'huiles essentielles
Les différentes dilutions ont été faites
sur la base de la conservation de quantité de matière dans le
solvant : Ci. Vi = Cf. Vf. Ce qui a permis de
déterminer le volume de l'HE pure (Vi) dans la solution diluée.
Des dilutions successives ont été faites dans l'acétone
pour les tests larvaires et les tests des adultes en tubes OMS. Trois
concentrations ont été préparées à l'aide de
dilutions en série (v/v).
o Vi = Volume d'HE pure ou de la combinaison
à prélever en millilitre ;
o Ci = Concentration de l'HE pure
ou de la combinaison en pourcentage ; on a supposé par convention que
quand l'HE est pure, sa concentration est égale à 100 % ;
o Cf = Concentration de l'HE
diluée ou de la combinaison diluée exprimée en
pourcentage,
o Vf = Volume final de la solution
diluée en millilitre ; nous avons supposé qu'il fût
égal à 100 ml pour toutes les dilutions.
Les différentes combinaisons ont été
faites de la façon suivante : X ml de l'HE (A) + Y ml de l'HE B avec X +
Y correspondant à 100 %.
Pour obtenir 2 ml de la solution finale à la
concentration de 1 % qui a servi à l'imprégnation d'un papier
Whattman n°1, 20 ul d'HE pure ou de la combinaison d'HE pure ont
été dilués dans 1980 ul d'acétone.
2- 3.5. Imprégnation des papiers
L'imprégnation des papiers Whattman n°1 a
été faite selon le protocole adopté par N'Guessan et
al., (2007) et Corbel et al., (2017). Quatre papiers (4)
découpés en rectangle de dimensions 12cm x 15cm ont
été imprégnés chacun de 2ml de la solution obtenue
par la dilution de l'HE dans de l'acétone. Les HE ont été
diluées en 3 concentrations et chaque concentration a été
imprégnée en 4 répliques. Les trois concentrations 0,1,
0,5 et 1 % ont été retenues après des tests
préliminaires sur les souches de référence de Ae.
aegypti (Bora Bora) et de An. gambiae (Kisumu) et à partir
de la littérature.
Les papiers ont été déposés
individuellement sur une planche à clous, puis imprégné
avec 2 ml de l'HE diluée à l'aide d'une pipette (Figure 15B). Les
papiers imprégnés ont été séchés au
laboratoire pendant 10 minutes (Figure 15C) avant d'être conservés
dans du papier aluminium et gardés au réfrigérateur
(4°C) jusqu'à l'utilisation pour le test.

B
C

A
Thèse de Doctorat unique - 49
-
Figure 15: Les huiles essentielles et
l'imprégnation des papiers whatman (Cliché
Balboné, 2020)
A : Les 5 huiles essentielles ; B :
Imprégnation d'un papier whatman ; C :
séchage des papiers imprégnés.
Thèse de Doctorat unique - 50
-
2- 4. Analyse des données
Les analyses ont été réalisées
à l'aide du logiciel statistique XLSTAT version 2015.1.01. Les valeurs
de CL50, CL90 pour les larves mortes et les temps de paralysie des moustiques
adultes ou temps de knock-down (KDT50 et KDT95), les concentrations
létales à la moitié et à 99% (CL50 et CL99) ainsi
que leurs intervalles de confiance à 95% (IC95%) ont été
calculés par analyse probit en utilisant le même logiciel
statistique afin de comparer la sensibilité des larves de moustiques
testées aux HE des 5 cinq plantes et du pyriproxyfène et, de
comparer la toxicité des mêmes HE et des combinaisons d'HE contre
les moustiques adultes testés. Les valeurs CL50 et CL90 pour les larves
et, les valeurs KDT50, KDT95, CL50, CL99 et les mortalités pour les
adultes ont été considérées comme significativement
différentes entre les HE si p < 0,05. Dans tous les tests, aucune
mortalité de contrôle n'a été détectée
après l'exposition de 24 heures ; par conséquent, aucune
correction n'a été requise selon la formule d'Abbot (Abbott,
1925).
Les interactions entre les combinaisons
réalisées ont été déterminées
à l'aide des indices de concentration fractionnelle inhibitrice ou
indices FIC. Ces indices ont été calculés de la
manière suivante : Indice FIC = FICA+ FICB et FICA = MICAB / MICA et
FICB = MICAB / MICB où FICA et FICB sont les
concentrations inhibitrices ou létales minimales qui tuent les
moustiques adultes pour les huiles essentielles A et B respectivement. Ainsi,
nous avons i) FICA : Concentration fractionnaire létale de A ; ii) FICB
: Concentration fractionnaire létale de B ; iii) MICAB : Concentration
létale de A dans la combinaison ; iv) MICA : Concentration létale
de A ; v) MICAB : Concentration minimale inhibitrice de B dans la
combinaison.
Les résultats ont été
interprétés comme suit : i) Synergie : FIC < 0,5 ; ii)
addition : 0,5 = FIC = 1 ; iii) indifférence : 1 = FIC = 4 ; ou iv)
antagonisme : FIC > 4 (Schelz, Molnar, et Hohmann 2006 ; Bassolé et
Juliani 2012).
Le rapport de résistance (RR) entre les souches VK et
Kisumu a été calculé en divisant la CL50 de la souche VK
par la CL50 de la souche Kisumu. Selon l'OMS (2017), RR < 5 indique une
faible résistance, RR 5-10 dénote une résistance
modérée, et RR > 10 indique une résistance
significative.
PARTIE 3 : RESULTATS ET DISCUSSIONS
Thèse de Doctorat unique - 51
-
Dans cette partie, nous présenterons les
différents résultats obtenus à la suite de nos travaux de
recherches puis nous les discuterons. Dans chaque chapitre, nous ferons une
introduction où nous indiquerons le contexte scientifique qui a
motivé chaque étape de nos recherches. Nous décrierons la
méthodologie spécifique utilisée pour l'atteinte des
objectifs à chaque niveau de nos travaux.
Thèse de Doctorat unique - 52
-
Thèse de Doctorat unique - 53
-
Chapitre 1 : Activités larvicides de cinq huiles
essentielles extraites de cinq plantes locales vis-à-vis des populations
de Aedes aegypti et de Anopheles gambiae collectés
à l'Ouest du Burkina Faso.
Les résultats présentés dans ce chapitre
ont fait l'objet d'un article publié dans le journal
Frontiers in Tropical Diseases (article 1).
3- 1-1. Introduction
Les stratégies actuelles de lutte antivectorielle sont
basées principalement sur l'utilisation des insecticides chimiques.
Cependant, l'émergence de la résistance aux insecticides
chimiques chez les principales espèces de vecteurs de maladies, la
pollution de l'environnement et les effets toxiques de ces insecticides
chimiques pour l'homme et d'autres organismes non ciblés, en raison de
leur large spectre d'activité, compromettent le succès de la LAV
(Minjas et Sarda, 1986 ; OMS, 1992 ; Hemingway, 2004). Ce constat a
suscité un intérêt accru dans la recherche de produits
naturels dérivés de plantes comme alternatifs (Gnankiné et
al., 2013 ; Redwane et al., 2002). Parmi les nombreux
produits naturels, les huiles essentielles (HE) et leurs constituants chimiques
ont fait l'objet d'une attention considérable dans la recherche de
nouveaux pesticides. En effet, des études menées au Burkina Faso
ont montré qu'ils possédaient un potentiel insecticide en
général (Bassolé et al., 2003 ; Drabo et
al., 2017 ; Wangrawa et al., 2016 ; Gnankiné et
Bassolé, 2017) et des propriétés larvicides en particulier
(Yaméogo et al., 2021, Wangrawa et al., 2022a). Par
contre, très peu d'études ont concerné la
sensibilité des HE aux larves de An. gambiae et de Ae.
aegypti, respectivement vecteurs de la dengue et du paludisme, de la
partie occidentale du pays. De plus, les études
précédentes n'ont pas pris en compte le pyriproxyfène
comme contrôle positif dans les différents tests larvaires.
Notre travail avait pour objectif d'étudier les
propriétés larvicides des HE de cinq (5) plantes aromatiques
locales du Burkina Faso, que sont Cymbopogon citratus (D.C.) Stapf.,
Cymbopogon nardus (Linn.) Rendle, Eucalyptus camaldulensis
Dehn., Lippia multiflora Moldenke, Ocimum americanum (Wild.) A.J.
Paton, en termes de concentrations létales (CL50 et CL90) sur des
populations de terrain de Aedes aegypti et de Anopheles gambiae
collectées respectivement à Bobo-Dioulasso et à la
Vallée du Kou (VK).
3-1-2. Méthodologie : tests larvaires
Les tests ont été réalisés dans
l'un des laboratoires d'entomologie médicale de l'IRSS/DRO dans les
conditions décrites dans la méthodologie générale.
Les tests ont consisté à évaluer la mortalité des
larves de An. gambiae et de Ae. aegypti en contact avec des
solutions diluées d'HE suivant une méthodologie inspirée
du protocole de l'Organisation Mondiale de la Santé (OMS, 2017). Des
expériences préliminaires ont permis de retenir une gamme de
concentrations devant servir aux tests proprement dits.
Des larves de stades 3 et 4 ont été
utilisées pour ces tests. Ces larves ont été
isolées (Figure 16A) grâce à des tamis et aux
critères morphologiques caractérisant celles-ci, puis
triées à l'aide des pipettes Pasteur et gardées en
observation pendant 30 minutes. Pendant ce temps, les larves qui ont
présenté des difficultés de mouvement ou un aspect anormal
ont été remplacées.
Les tests ont été réalisés dans
des gobelets en plastique transparents (Figure 16B) d'une capacité de
200 ml. Une quantité appropriée de chaque HE a été
dissoute dans de l'acétone pour préparer 1 ml de solution
mère, en fonction des concentrations voulues, 50, 100, 150 et 200 ppm.
Dans chaque gobelet contenant initialement un volume d'eau distillée de
149 ml avec 20 larves de moustiques (Figure 16B), 1 ml de la solution
mère d'HE préparée avec l'acétone a
été ajouté (Figure 16C) afin d'obtenir les concentrations
finales voulues dans un volume total de 150 ml. Pour chaque concentration,
quatre (4) répétitions ont été faites plus quatre
(4) témoins. Dans les témoins, 20 larves ont été
introduites dans 149 ml d'eau distillée et 1 ml d'acétone. Le
pyriproxyfène a été utilisé comme témoin
positif.
Les larves mortes et les larves moribondes (celles qui
bougeront lentement après agitation de l'eau) considérées
comme mortes ont été dénombrées pour
l'évaluation de la mortalité larvaire 24 heures après leur
mise en contact avec les HE.
Thèse de Doctorat unique - 54
-

A B C
Figure 16: Quelques étapes du test
larvaire
A : Tri des larves de stades 3 et 4 ;
B : Les larves au repos dans l'eau distillée ;
C : Ajout du mélange d'acétone et l'huile
essentielle aux concentrations 50, 100, 150 et 200 PPM (Cliché
Balboné, 2020).
3- 1-3. Résultats
3- 1-3.1. Caractérisation chimique des huiles
essentielles
Les différents composés de chacun des 5 huiles
essentielles sont résumés dans le tableau II. L'HE de C.
citratus s'avère riche en géranial (48,1%), néral
(35,8%) et myrcène (11%). Celle de C. nardus est principalement
composée de citronellal (41,7%), de géraniol (20,8%) et de
f3-élémène (11%). L'HE de E. camaldulensis
était riche en 1,8-cinéole (59,5%) et en
á-pinène (9,17%). L'HE de L. multiflora était
caractérisée par du p-cymène (25,27%), du
f3-caryophyllène (12,7%) et du thymol (11,88%). L'HE de O.
americanum se caractérise par un pourcentage élevé de
1,8-cinéole (31,22%) suivi du camphre (12,73%).
Thèse de Doctorat unique - 55
-
Tableau II : Composition chimique des huiles
essentielles des 5 plantes Cymbopogon citratus, Cymbopogon nardus,
Eucalyptus camaldulensis, Lippia multiflora et Ocimum americanum
|
Composés JR Cymbopogon
citratus (%)
|
Cymbopogon
nardus (%)
|
Eucalyptus
Camaldulensis (%)
|
Lippia
multiflora (%)
|
Ocimum
americanum (%)
|
|
á-Thujene
|
925
|
-
|
-
|
|
1,6
|
0,13
|
|
á-Pinene
|
933
|
-
|
-
|
9,17
|
0,9
|
6,87
|
|
Camphene
|
945
|
-
|
-
|
0,19
|
-
|
2,77
|
|
Sabinene
|
975
|
-
|
-
|
-
|
-
|
-
|
|
f3-pinene
|
981
|
-
|
-
|
2,49
|
-
|
0,65
|
|
Myrcene
|
992
|
-
|
-
|
0,15
|
-
|
3,71
|
|
2-carene
|
999
|
-
|
-
|
-
|
-
|
2,04
|
|
á-Phellandrene
|
1003
|
-
|
-
|
0,32
|
3,1
|
0,39
|
|
á- Terpinene
|
1017
|
-
|
-
|
-
|
1,41
|
0,40
|
|
p-Cymene
|
1027
|
-
|
-
|
4,73
|
14,6
|
0,21
|
|
Limonene
|
1028
|
-
|
-
|
8,76
|
-
|
4,66
|
|
1,8-cineole
|
1034
|
-
|
-
|
59,55
|
11,6
|
31,22
|
|
f3-Ocimene
|
1048
|
-
|
-
|
-
|
9,4
|
-
|
|
ã-Terpinene
|
1061
|
-
|
-
|
1,39
|
-
|
1,13
|
|
Terpinolène
|
1081
|
-
|
-
|
0,21
|
-
|
0,65
|
|
Camphor
|
1124
|
-
|
-
|
-
|
-
|
12,73
|
|
Citronellal
|
1158
|
-
|
41,7
|
-
|
-
|
-
|
|
Citronellol
|
1230
|
-
|
8,0
|
-
|
-
|
-
|
|
Borneol
|
1156
|
-
|
-
|
0,46
|
-
|
0,13
|
|
4-Terpineol
|
1168
|
-
|
-
|
1,14
|
-
|
0,92
|
|
á-Terpineol
|
1177
|
-
|
-
|
2,65
|
-
|
2,08
|
|
Neral
|
1242
|
44,7
|
-
|
|
-
|
|
|
Piperitone
|
1252
|
-
|
-
|
0,09
|
-
|
2,44
|
|
Geraniol
|
1253
|
-
|
20,8
|
-
|
-
|
-
|
|
Geranial
|
1268
|
55,2
|
-
|
-
|
-
|
-
|
|
Bornyl acetate
|
1269
|
-
|
-
|
-
|
-
|
3,96
|
|
Thymol
|
1288
|
-
|
-
|
-
|
8,3
|
-
|
|
Thymol acetate
|
1355
|
-
|
-
|
-
|
12,0
|
-
|
|
f3-Elemene
|
1372
|
-
|
11,0
|
-
|
-
|
-
|
|
á-Copaene
|
1390
|
-
|
3,7
|
-
|
-
|
-
|
|
f3-Caryophyllene
|
1415
|
-
|
-
|
-
|
20,1
|
3,55
|
|
Trans-á-Bergamotene
|
1433
|
-
|
-
|
-
|
-
|
5,32
|
|
á-Humulene
|
1442
|
-
|
-
|
-
|
4,8
|
0,25
|
|
allo-Aromadendrene
|
1446
|
-
|
-
|
1,40
|
-
|
-
|
|
á -Amorphene
|
1485
|
-
|
-
|
-
|
1,4
|
-
|
|
Germacrene D
|
1495
|
-
|
-
|
-
|
1,5
|
0,24
|
|
(Z, E)-á-farnesène
|
1497
|
-
|
-
|
-
|
-
|
3,64
|
|
Â-himachalene
|
1499
|
-
|
-
|
-
|
-
|
-
|
|
Hedycaryol
|
1520
|
-
|
7,4
|
-
|
-
|
-
|
|
Elemol
|
1545
|
-
|
-
|
-
|
2,1
|
1,6
|
|
f3-eudesmol
|
1650
|
-
|
-
|
-
|
2,5
|
-
|
|
Caryophyllene oxyde
|
1581
|
-
|
-
|
-
|
4,5
|
0,08
|
|
Hydrocarbon monoterpenes
|
|
-
|
-
|
24,89
|
33,01
|
23,61
|
|
Oxygenated monoterpenes
|
|
99,9
|
77,9
|
66,96
|
36,5
|
53,48
|
|
Hydrocarbon sesquiterpenes
|
|
-
|
14,7
|
1,4
|
25,8
|
13,03
|
|
Oxygenated sesquiterpenes
|
|
-
|
-
|
0,34
|
4,5
|
1,68
|
|
Total
|
|
99,9
|
92,6
|
93,59
|
99,81
|
91,8
|
NB : Les composes en gras représentent les composes
majeurs de chaque HE ; JR : Jndice de rétention
Thèse de Doctorat unique - 56
-
3- 1-3.2. Activités larvicides des huiles
essentielles sur Anopheles gambiae
Les huiles essentielles (HE) des cinq (5) espèces
végétales ont démontré une activité
larvicide vis-à-vis des larves de stades 3 et 4 des deux (2) souches de
An. gambiae, la souche sensible aux insecticides chimiques (Kisumu) et
celle collectée à la Vallée du Kou (VK). Dans l'ensemble,
toutes les cinq (5) HE ont été plus toxiques sur les larves des
stades 3 et 4 de la souche sensible Kisumu avec des valeurs de CL50 et de CL90
qui ont été respectivement de 3,9 à 75,8 ppm et de 29,5
à 193,5 ppm (Tableau III). Sur les larves de An. gambiae de VK,
les valeurs des CL50 et CL90 étaient comprises entre 39,5 et 138,1 ppm
et 90,2 et 328,9 ppm, respectivement (Tableau IV).
Tableau III : Les concentrations létales
à 50 et 90 % (CL50 et CL90) et leurs intervalles de confiance des huiles
essentielles de plantes contre les larves de la souche sensible de An.
gambiae Kisumu
|
Traitements
|
CL50 (ppm)
|
IC 95%
|
CL90 (ppm)
|
IC 95%
|
X2(df)
|
Slope (#177;SE)
|
|
Pyriproxyfen
|
3,4a
|
0,8-5,8
|
13,6a
|
9,5-18,4
|
16,6
|
2,2#177;0,52
|
|
C. citratus
|
49,1c
|
42,1-54,8
|
87,6c
|
78,2-102,9
|
53,6
|
5,0#177;0,69
|
|
C. nardus
|
30,7b
|
17,9-40,0
|
74,7c
|
63,1-90,8
|
26,4
|
3,3#177;0,64
|
|
O. americanum
|
75,8d
|
65,4-85,5
|
193,5d
|
164,6-244,4
|
74,8
|
3,1#177;0,36
|
|
L. multiflora
|
3,9a
|
1,5-6,6
|
29,5b
|
22,0-40,8
|
38,5
|
1,4#177;0,23
|
|
E. camaldulensis
|
29,4b
|
15,6-40,1
|
90,3c
|
75,3-113,1
|
27,4
|
2,6#177;0,50
|
CL50 et CL90 : Concentration
létal à 50 et 90 ; IC : Intervalle de confiance
; ppm : Partie par million. Les produits dont les
CL50 sont suivies de lettres alphabétiques identiques ne
diffèrent pas statistiquement par le test (HSD) de Tukey p<0,001.
Tableau IV : Les concentrations létales
à 50 et 90 % (CL50 et CL90) et leurs intervalles de confiance des huiles
essentielles des plantes contre les larves de la souche résistante de
An. gambiae de VK
|
Traitments
|
CL50 (ppm)
|
IC 95%
|
CL90 (ppm)
|
IC 95%
|
X2(df)
|
Slope (#177;SE)
|
|
Pyriproxyfen
|
23,7a
|
9,3-35,5
|
83,3a
|
66,6-106,2
|
11,5
|
1,4#177;0,41
|
|
C. citratus
|
138,1c
|
124,5-155,3
|
328,9c
|
267,4-451
|
72,4
|
3,3#177;0,39
|
|
C. nardus
|
76,5b
|
67,6-84,9
|
163b
|
143,9-193,5
|
97,5
|
3,9#177;0,39
|
|
O. americanum
|
89,3b
|
81,1-97,4
|
173,0b
|
154,2-201,4
|
114,0
|
4,4#177;0,41
|
|
L. multiflora
|
39,5a
|
28,6-47,8
|
90,2a
|
78,3-108
|
45,1
|
3,2#177;0,48
|
|
E. camaldulensis
|
121,1c
|
109,9-133,6
|
267,3c
|
226,6-339,4
|
87,7
|
3,7#177;0,39
|
CL50 et CL90 : Concentration
létal à 50 et 90 ; IC : Intervalle de confiance
; ppm : Partie par million. Les produits dont les CL50 sont
suivies de lettres alphabétiques identiques ne diffèrent pas
statistiquement par le test (HSD) de Tukey p<0,001.
Thèse de Doctorat unique - 57
-
Thèse de Doctorat unique - 58
-
L'HE de L. multiflora a été plus
efficace sur les 2 souches de An. gambiae avec des valeurs de CL50 et
de CL90, qui ont été respectivement de 3,9 et 29,5 ppm pour les
larves de Kisumu et, de 39,5 et 90,2 ppm pour les larves de VK.
L'HE de O. americanum a montré la plus faible
activité larvicide sur Kisumu la souche sensible aux insecticides
chimiques avec des valeurs de CL50 = 75,8 ppm et de CL90 = 193,5 ppm, tandis
que celle de C. citratus a montré la plus faible
activité larvicide sur les larves de la souche de terrain VK avec des
valeurs CL50 = 138,1 ppm et CL90 = 328,9 ppm.
En outre, sur les larves de Kisumu, les HE de E.
camaldulensis, C. nardus et C. citratus ont
montré de fortes activités larvicides après l'HE de L.
multiflora, avec des valeurs CL50 < 50 ppm et CL90 < 91 ppm. Sur les
larves VK, les HE de C. nardus, de O. americanum et de E.
camaldulensis ont montré une forte activité larvicide
après l'HE de L. multiflora avec des valeurs CL50 <140 ppm
et une valeur CL90 < 270 ppm.
Seule l'HE de L. multiflora a donné des
valeurs CL50 et CL90 proches de celles du témoin positif, le
pyriproxyfène, sur les larves de Kisumu et de VK. En effet, au niveau
des valeurs CL50 et CL90, aucune différence significative n'a
été observée entre L. multiflora et le
pyriproxyfène sur les deux souches de An. gambiae
testées (p = 0,95) avec un chevauchement des intervalles de
confiance.
En ce qui concerne les mortalités obtenues sur les
larves de Kisumu la souche sensible aux insecticides chimiques, l'HE de L.
multiflora a montré une mortalité de 90 et 100%
respectivement à 50 et 100 ppm (Figure 17). Elle a été
suivie par les HE de C. citratus, E. camaldulensis et C. nardus
qui ont donné des mortalités supérieures à 50%
déjà à 50 ppm et supérieures à 80% à
la concentration 100 ppm. L'HE de O. americanum avait
donné la mortalité la plus faible (35% à 50 ppm et 50%
à 100 ppm). Toutes les HE ont donné 100% de mortalités
à partir de 150 ppm (Figure 17).
Sur les larves de la souche VK, seule l'HE de L.
multiflora a donné une mortalité supérieure à
65% à 50 ppm, pendant que les autres HE ont donné des
mortalités inférieures à 30% (Figure 18). A 100 ppm, l'HE
de L. multiflora a donné des mortalités de 87,1% suivie
de l'HE de C. nardus qui a donné des mortalités de
64,58%. Tandis que les trois (3) autres HE ont donné des
mortalités inférieures à 50%. A 150 ppm, l'HE de L.
multiflora a donné des mortalités de 100% et celles de
C. nardus et O. americanum ont donné des
mortalités supérieures à 80%
suivies de l'HE de E. camaldulensis dont les
mortalités produites ont été supérieures à
50%. A 200 ppm, toutes les cinq (5) HE testées ont donné des
mortalités supérieures à 85% (Figure 18).
Souche sensible de An. gambiae "Kisumu"

Mortalités
100
40
90
70
20
60
50
30
80
10
0
|
Cc Cn Ec Lm Oa Pyr
|
Cc Cn Ec Lm Oa Pyr
|
Cc Cn Ec Lm Oa Pyr
|
Cc Cn Ec Lm Oa Pyr
|
|
50 ppm
|
100 ppm
|
150 ppm
|
200 ppm
|
Traitements et concentrations
Figure 17: Mortalités des larves de la
souche de An. gambiae « Kisumu » sensible aux
insecticides chimiques en fonction des concentrations des HE. Les barres
d'erreurs représentent l'intervalle de confiance à 95%. Les
mortalités moyennes (#177;intervalle de confiance) ont été
obtenues au seuil de probabilité de 5% d'après le test LSD de
Fisher (p?0,05).
|
Mortalités
|
100 90 80 70 60 50 40 30 20 10 0
|
Souche de An. gambiae collectée à VK

|
Cc Cn Ec Lm Oa Pyr
|
Cc Cn Ec Lm Oa Pyr
|
Cc Cn Ec Lm Oa Pyr
|
Cc Cn Ec Lm Oa Pyr
|
|
50 ppm
|
100 ppm
|
150 ppm
|
200 ppm
|
Traitements et concentrations
Figure 18: Mortalités des larves de la
souche de terrain de An. gambiae « VK » en fonction
des
concentrations des HE. Les barres d'erreurs
représentent l'intervalle de confiance à 95%. Les
mortalités moyennes (#177;intervalle de confiance) ont été
obtenues au seuil de probabilité de 5% d'après le test LSD de
Fisher (p?0,05).
Thèse de Doctorat unique - 59
-
3- 1-3.3. Activités larvicides des huiles
essentielles sur Aedes aegypti
Toutes les cinq (5) HE testées ont montré une
toxicité contre les larves de stades 3 et 4 des deux (2) souches de
Ae. aegypti, sensibles (Bora Bora) et collectée sur le terrain
à Bobo-Dioulasso (Tableaux V et VI ; Figures 19 et 20) . Comme dans le
cas des populations de An. gambiae, parmi les HE, l'HE de L.
multiflora a été la plus toxique sur les deux (2) souches de
Ae. aegypti testées. Cette toxicité est perçue
à travers les valeurs des concentrations létales (CL50 et CL90)
et les mortalités produites sur les différentes souches de
moustiques testées.
Tableau V : Les concentrations létales
à 50 et 90 % (CL50 et CL90) et leurs intervalles de confiance des huiles
essentielles contre les larves de la souche de Ae. aegypti sensible
Bora Bora aux insecticides chimiques
|
Traitments
|
CL50 (ppm)
|
IC 95%
|
CL90 (ppm)
|
IC 95%
|
X2(df)
|
Slope(#177;SE)
|
|
Pyriproxifixen
|
9,5a
|
6,4 - 12,3
|
43,3a
|
34,0-61,8
|
49,7
|
1,9#177;0,27
|
|
C. citratus
|
61,5c
|
51,4 -70,4
|
132,0b
|
119,4-150,1
|
71,9
|
3,2#177;0,38
|
|
C. nardus
|
62,4c
|
50,2 - 72,5
|
108,8b
|
98,4-124,0
|
74,2
|
3,09#177;0,35
|
|
O. americanum
|
91,8d
|
83,3-100,3
|
180,9c
|
160,8-211,5
|
112,3
|
4,3#177;0,41
|
|
L. multiflora
|
41,9b
|
31,8-48,7
|
68,5a
|
61,3-84,2
|
39,5
|
2,2#177;0,35
|
|
E. camaldulensis
|
101,3d
|
73,1-132,7
|
188,8c
|
169,5-217,6
|
120,1
|
1,2#177;0,31
|
Les différences significatives entre les produits
testés par le test LSD de Fisher (P<0,05) ; Les produits dont les
CL50 sont suivies de lettres alphabétiques identiques ne
diffèrent pas statistiquement par le test (HSD) de Tukey p<0,001.
CL50 et CL90 : Concentration
létal à 50 et 90 ; IC : Intervalle de confiance
; ppm : Partie par million
Tableau VI : Les concentrations létales
à 50 et 90 % (CL50 et CL90) et leurs intervalles de confiance des huiles
essentielles contre les larves de la souche de Ae. aegypti de
Bobo-Dioulasso
|
Traitments
|
CL50 (ppm)
|
IC 95%
|
CL90 (ppm)
|
IC 95%
|
X2(df)
|
Slope (#177;SE)
|
|
Pyriproxifen
|
11,04a
|
8,2 - 13,7
|
43,2a
|
35,3-56,1
|
80,8
|
2,1#177;0,24
|
|
C. citratus
|
74,6c
|
67,7-81,2
|
152,3c
|
131,9-186,0
|
116,2
|
5,1#177;0,48
|
|
C. nardus
|
63,5c
|
57,3 - 69,4
|
148,5c
|
128,4-182,6
|
74,2
|
5,4#177;0,54
|
|
O. americanum
|
79,4e
|
67,6-90,2
|
226,3d
|
186,9-302,9
|
64,4
|
2,8#177;0,35
|
|
L. multiflora
|
42b
|
33,4-47,3
|
74,6b
|
65,3-92,5
|
22,0
|
6,0#177;1,28
|
|
E. camaldulensis
|
103,8d
|
95,4-112,3
|
311,3d
|
238-503,1
|
18,3
|
4,9#177;0,45
|
Les différences significatives entre les produits
testés par le test LSD de Fisher (P<0,05) ; Les produits dont les
CL50 sont suivies de lettres alphabétiques identiques ne
diffèrent pas statistiquement par le test (HSD) de Tukey p<0,001.
CL50 et CL90 : Concentration
létal à 50 et 90 ; IC : Intervalle de confiance
; ppm : Partie par million
Thèse de Doctorat unique - 60
-
Thèse de Doctorat unique - 61
-
En effet, les valeurs de CL50 et CL90 ont été
respectivement de 42 et 74,6 ppm pour l'HE de L. multiflora
testées sur les stades larvaires 3 et 4 de la souche de terrain de
Ae. aegypti collectée à Bobo-Dioulasso. Ces valeurs ont
été légèrement plus faibles que celles obtenues sur
les larves des mêmes stades de la souche sensible Bora Bora (Tableaux V
et VI). Également, les valeurs CL50 et CL90 obtenues avec l'HE de L.
multiflora sur les larves de Bobo-Dioulasso ont été
significativement inférieures à celles obtenues avec les autres
HE testées pour lesquelles les valeurs de CL50 et CL90 ont varié
respectivement de 63,5 à 103,8 ppm et de 148,5 à 311,3 ppm sur la
souche collectée à Bobo-Dioulasso (Tableau VI).
Sur la souche Bora bora, les valeurs de CL50 et CL90 ont
varié respectivement de 61,5 à 101,3 ppm et de 132 à 188,8
ppm pour les HE de C. citratus, C. nardus, E.
camaldulensis, et O. americanum (Tableau V). L'HE de E.
camaldulensis reste la moins toxique sur les deux souches de Ae.
aegypti au regard des valeurs CL50 et CL90 qui ont été
respectivement de 101,3 à 188 ppm pour Boro Bora et de 103,8 à
311,3 ppm pour la souche collectée à Bobo-Dioulasso. L'HE de
L. multiflora et le pyriproxyfène à la CL90 sur Bora
Bora ont présenté un niveau de toxicité
élevé avec un chevauchement des limites de confiance à
95%, leurs taux de mortalités a été supérieur
à 95% à 100 ppm. Nous constatons qu'il n'y a pas de
différence significative entre l'HE de L. multiflora et le
pyriproxyfène sur la souche sensible de Ae. aegypti, Bora Bora
(F= 0,02; DDL=8, p= 0,97).
De même, il n'y a pas eu de différences
significatives entre C. citratus et C. nardus concernant les
valeurs CL50 et CL90 sur les deux souches de Ae. aegypti
testées. De même, il n'y a pas eu de différences
significatives entre les HE de E. camaldulensis et O. americanum
concernant la CL90 sur les larves des deux souches de Ae. aegypti
testées et la CL50 sur les larves de Bora Bora.
Aussi, sur les larves de la souche sensible Bora Bora, l'HE de
L. multiflora a montré une mortalité de 67,5 et 98,75%
respectivement à 50 et 100 ppm. A partir de 150 ppm, cette HE a
donné 100% de mortalités sur les mêmes larves (Figure 19).
Par contre, les autres HE ont donné des mortalités
inférieures à 40% à 50 ppm. A 100 ppm, les HE de C.
citratus et C. nardus ont donné respectivement des
mortalités de 77,5 et 90% sur les larves de Bora Bora. Cependant, les
mortalités des HE de E. camaldulensis et O. americanum
ont été inférieures à 50% à 100 ppm. A
partir de 150 ppm, toutes les HE ont donné des mortalités
supérieures à 80% (Figure 19).
Thèse de Doctorat unique - 62
-
Sur les larves de la souche de Bobo-Dioulasso, les
mortalités obtenues à 50 ppm avec l'HE de L. multiflora
ont été de 64,65% tandis que celles des autres HE ont
été inférieures à 30%. Les mortalités
obtenues à 100 ppm avec l'HE du L. multiflora étaient
supérieures à 95% et à partir de 150 ppm, elles ont
été de 100%. Les mortalités obtenues avec les HE de C.
citratus et C. nardus ont été respectivement de 70
et 74,13% à 100 ppm et à partir de 150 ppm, elles ont
été supérieures à 85% (Figure 20). Tandis que
celles obtenues avec les HE de E. camaldulensis et O. americanum
ont été inférieures à 50% à 100 ppm et
à 150 ppm, elles ont été respectivement de 51,25 et 78,75%
(Figure 20). A 200 ppm, les mortalités de toutes les HE ont
été supérieures à 90% sauf celles de l'HE de E.
camaldulensis.
Souche sensible de Ae. aegypti "Bora
Bora"
Traitements et concentrations

Taux de mortalité
100
40
20
90
70
60
30
80
50
10
0
|
Cc Cn Ec Lm Oa Pyr
|
Cc Cn Ec Lm Oa Pyr
|
Cc Cn Ec Lm Oa Pyr
|
Cc Cn Ec Lm Oa Pyr
|
|
50 ppm
|
100 ppm
|
150 ppm
|
200 ppm
|
Figure 19: Mortalités en fonction des
concentrations des HE des larves de la souche de Ae.
aegypti Bora Bora sensible aux insecticides
chimiques. (Les barres d'erreurs représentent l'intervalle de
confiance à 95%). Les mortalités moyennes (#177;intervalle
de confiance) ont été obtenues au seuil de probabilité de
5% d'après le test LSD de Fisher (p?0,05).
Souche de Ae. aegypti collectée à
Bobo-Dioulasso

Taux de mortalité
100
40
20
90
70
60
50
30
80
10
0
|
Cc Cn Ec Lm Oa Pyr
|
Cc Cn Ec Lm Oa Pyr
|
Cc Cn Ec Lm Oa Pyr
|
Cc Cn Ec Lm Oa Pyr
|
|
50 ppm
|
100 ppm
|
150 ppm
|
200 ppm
|
Traitement et concentrations
Thèse de Doctorat unique - 63
-
Figure 20: Mortalités en fonction des
concentrations des HE des larves de la souche de Ae.
aegypti de Bobo-Dioulasso. (Les barres d'erreurs
représentent l'intervalle de confiance à 95%). Les
mortalités moyennes (#177;intervalle de confiance) ont été
obtenues au seuil de probabilité de 5% d'après le test LSD de
Fisher (p?0,05).
3- 1-4. Discussion
A l'heure actuelle, les moustiquaires imprégnées
d'insecticide à longue durée d'action (MILD) et les
pulvérisations intra domiciliaires à effet rémanent (PID)
restent les deux principaux outils ciblant principalement les adultes de
An. gambiae et, dans une moindre mesure, Ae. aegypti. Ainsi,
il y a un besoin urgent de développer des outils et des techniques
innovantes, y compris l'utilisation des HE contre les oeufs, les stades
larvaires et les adultes afin d'augmenter le succès de la lutte
antivectorielle (Bassolé et al., 2003 ; Yaméogo et
al., 2021).
Le statut de résistance des populations du complexe
An. gambiae aux insecticides recommandés pour la lutte anti
vectorielle a été signalé dans la partie occidentale du
Burkina Faso (Dabiré et al., 2014 ; Namountougou et
al., 2019). Aussi, d'autres études ont confirmé le
statut de résistance de la population de Ae. aegypti de la
ville de Bobo-Dioulasso (Namountougou et al., 2020).
Thèse de Doctorat unique - 64
-
Notre travail visait à étudier la
bio-efficacité de cinq (5) HE de plantes locales sur les larves de
Ae. aegypti et de An. gambiae selon les méthodes
standard de l'Organisation Mondiale de la Santé (OMS). Il est connu que
la plupart des études sur les tests larvicides, n'ont pas pris en compte
le Pyriproxyfène comme témoin chimique, un Régulateur de
Croissance des Insectes (RCI). Les RCI agissent en imitant l'une des hormones
de croissance des insectes ou en perturbant directement la formation de la
cuticule ou la biosynthèse des lipides. Le pyriproxyfène est
recommandé par l'OMS contre les larves de moustiques à des
concentrations comprises entre 0,02 et 0,05 mg/L (5 à 10 g/ha) avec un
temps d'activité de 6 semaines (OMS, 2001, 2006).
Dans cette étude, toutes les cinq HE testées ont
montré une activité insecticide variable contre les larves de
An. gambiae et de Ae. aegypti. En ce qui concerne les valeurs
CL50 et CL90, les HE de C. citratus, C. nardus, E. camaldulensis, L.
multiflora et O. americanum, ont présenté une
activité larvicide plus élevée contre les larves de
troisième et quatrième stade des souches de laboratoire et de
terrain de An. gambiae et Ae. aegypti après 24 heures
d'exposition. La plus efficace de toutes ces HE a été celle de
L. multiflora. La CL50 de l'HE de E. camaldulensis a
été la moins efficace sur Ae. aegypti, alors que l'HE de
C. citratus reste la moins efficace sur An. gambiae. Ces
données ne sont pas en accord avec celles trouvées par Ho Dung
Manh et al. (2020) qui ont rapporté que sur les larves de
Ae. aegypti, l'HE de C. citratus (CL50 = 120,6 ppm) est moins
efficace que celle de E. camaldulensis (CL50 = 33,7 ppm).
Nos résultats obtenus avec l'HE de C. nardus
sur An. gambiae dans cette étude sont inférieurs
à ceux obtenus par Ahouansou et al. (2019) qui ont obtenu une
valeur de 97,3 ppm pour la CL50 sur An. gambiae. Nos résultats
sont similaires à ceux rapportés par Cavalcanti et al.
(2004) sur les populations de Ae. aegypti. Dans leur étude, les
HE de O. americanum et C. citratus ont donné des
valeurs de CL50 égales à 67 et 69 ppm respectivement. Cependant,
nos résultats obtenus avec l'HE de O. americanum sont
inférieurs à ceux rapportés par Wangrawa et al.
(2016) sur les lerves de An. gambiae dont la CL50 était de
209,84 ppm.
Les valeurs de CL50 et CL90 obtenues avec l'HE de L.
multiflora dans notre étude sont plus faibles que celles
rapportées par Bassolé et al. (2003). Récemment,
la même tendance a été observée avec Yameogo et
al. (2021) qui ont également montré l'effet toxique de
l'HE de L. multiflora contre les populations de Ae. aegypti
de Tabtenga à Ouagadougou.
Il est intéressant de noter que l'activité
élevée de l'HE du L. multiflora peut résulter de
la présence de trois composants majeurs : le thymol, le p-cymène
et le â-caryophyllène. Selon
Thèse de Doctorat unique - 65
-
Folashade et Omoregie (2012), le thymol, le germacrène
D, le ñ-cymène, l'acétate de thymyle et le sabinène
ont été trouvés dans l'HE de L. multiflora au
Ghana et semblent être impliqués dans son activité contre
les larves de moustiques. Inversement, l'activité larvicide plus faible
des HE de C. citratus, C. nardus, E. camaldulensis et O.
americanum peut s'expliquer par l'effet mineur de la pipéritone, du
géraniol et du 1,8-cinéole sur les larves de Ae. aegypti
et de An. gambiae (Bossou et al., 2013). La
diversité de composition chimique des HE testées pourrait
expliquer les différences observées dans leurs activités
larvicides observées dans cette étude.
En ce qui concerne les valeurs CL50 et CL90, la
bio-efficacité de l'HE de L. multiflora sur les larves des
souches de An. gambiae est plus proche de celle du
pyriproxyfène, le contrôle positif utilisé dans cette
étude qui est le larvicide de référence. Cela ouvrirait
une nouvelle alternative pour le contrôle des moustiques.
Globalement, dans les populations des deux (2) souches de
An. gambiae, les larves de la souche Kisumu se sont
avérées les plus sensibles aux HE que celles de la population de
terrain (VK), connues pour leur résistance aux pyréthroïdes
(Namountougou et al., 2019 ; Chandre, et al., 1999 ; Poda et
al., 2018).
Comme obtenu avec An. gambiae, les tests avec les
larves de Ae. aegypti ont aussi montré une sensibilité
de l'HE de L. multiflora proche de celle du pyriproxyfène. Les
valeurs de CL50 trouvées dans cette étude ont été
légèrement inférieures à celles observées
dans les populations de Ae. aegypti de Ouagadougou (Yaméogo et
al., 2021) qui pourrait s'expliquer par le développement
très prononcée de la résistance phénotypique chez
les populations de Ae. aegypti de Ouagadougou aux principaux produits
chimiques. Cette résistance phénotypique aux insecticides
chimiques chez les populations de Ae. aegypti de Ouagadougou ont
été montré par Namountougou et al. (2020)
à travers les tests réalisés avec la deltaméthrine
sur des populations de Ae. aegypti collectées à
Bobo-Dioulasso et à Ouagadougou. En effet, ces études ont
montré des taux de mortalité atteignant 89,62% et 82,72%
respectivement pour 2013 et 2014, avec les populations de Ae. aegypti
collectées à Bobo-Dioulasso et 50,7% et 20,7% respectivement
pour 2013 et 2014, avec Ae. aegypti collectées à
Ouagadougou. Toutes ces valeurs étaient inférieures à 90%,
suggérant une résistance.
Il est très urgent de rechercher des alternatives aux
produits chimiques. Nos données permettront de développer des
stratégies innovantes à base d'HE.
3- 1-5. Conclusion partielle
Nos résultats ont montré que l'utilisation des
HE comme larvicides est une stratégie prometteuse. Par
conséquent, les HE pourraient faire l'objet d'une attention
particulière dans la recherche de nouveaux produits larvicides naturels,
sélectifs et biodégradables qui peuvent être
utilisés dans les programmes de santé publique de lutte
antivectorielle contre An. gambiae et Ae. aegypti en
particulier.
Dans la perspective de valorisation de ces HE, il serait
intéressant d'évaluer l'efficacité de ces HE sur les
adultes de ces deux populations de moustiques.
Thèse de Doctorat unique - 66
-
Thèse de Doctorat unique - 67
-
Chapitre 2 : Évaluation des
propriétés adulticides des huiles essentielles de cinq plantes
locales et des combinaisons de deux d'entre elles sur des populations de
Aedes aegypti et de Anopheles gambiae (Diptera : culicidae)
de l'Ouest du Burkina Faso.
Les résultats présentés dans ce chapitre
ont fait l'objet de deux articles publiés dans Journal of
Medical Entomology (Article 2) et Scientific report
(Article 3).
3- 2-1. Introduction
Les moustiquaires et la PID à effet rémanent
sont les méthodes sur lesquelles se basent la LAV actuelle (OMS 2017).
Les insecticides chimiques de la famille des pyréthrinoïdes sont
ceux utilisés en santé publique pour l'imprégnation des
moustiquaires et la PID (OMS, 2019). Cependant, la résistance aux
pyréthrinoïdes constitue une menace pour l'efficacité de ces
outils de protection, surtout lorsque la résistance est présente
à des niveaux élevés (Churcher et al. 2016 ; Hemingway et
al. 2016). Et au Burkina Faso, nous crayons que l'objectif de
l'utilisation des MILDA à base de pyréthrinoïdes ne soit pas
atteint (Dabire et al. 2012b).
Les extraits de plantes tels que les HE peuvent être
utilisés comme alternative aux insecticides chimiques auparavant
utilisés dans la LAV (Zoubiri et Baaliouamer 2014. Tripathi et
al., 2009 ; Balbone et al., 2022a).
Des études antérieures avaient montré les
propriétés adulticides des HE sur des moustiques (Chansang et
al., 2018; Wangrawa et al., 2018; Yaméogo et
al., 2021).
Tout récemment, les études de Balboné et
al. (2022a) ont montré des activités larvicides
intéressantes sur les populations de Anopheles et Aedes
au Burkina Faso. D'autres études avaient montré que la
toxicité des HE est liée à certains de leurs
composés bioactifs (Sarma et al., 2019 ; Isman, 2000).
Certaines études avaient également tenté de formuler des
insecticides efficaces en combinant différents extraits de plantes avec
des insecticides chimiques pour augmenter la toxicité globale et
minimiser les effets secondaires (Mansour, Foda et Aly, 2012). Bien que des
études récentes aient montré que des combinaisons des HE
de L. multilora et de Cymbopogon schoenanthus ont
donné des effets synergiques contre les moustiques des populations de
An. gambiae de la souche sensible Kisumu (Wangrawa et al.,
2022b), peu de connaissances sont disponibles sur l'effet du mélange
d'HE sur les populations de An. gambiae résistantes et les
populations sensibles et résistantes de Ae. aegypti.
Thèse de Doctorat unique - 68
-
Dans cette partie nous présenterons les principaux
résultats des tests adulticides des HE de Cymbopogon citratus,
Cymbopogon nardus, Eucalyptus camaldulensis, Lippia multiflora, et
Ocimum americanum et des combinaisons des HE de Cymbopogon nardus
et Ocimum americanum sur des populations sensibles et
résistantes de Ae. aegypti et de An. gambiae,
respectivement de la ville de Bobo-Dioulasso et de la Vallée du Kou,
à l'Ouest du Burkina Faso.
3- 2-2. Méthodologie : test de sensibilité
en tubes OMS
Les tests de sensibilité des HE sur les populations de
An. gambiae et de Ae. aegypti ont été
réalisés à l'aide des kits de tests de sensibilité
aux insecticides de l'OMS et selon les procédures standard (OMS, 2017)
(Figure 21). Pour chaque concentration d'HE, quatre (4) lots de 20 à 25
femelles de moustiques à jeun âgés de 2 à 3 jours
ont été introduits dans des tubes OMS contenant les papiers
imprégnés où ils ont été mis en contact
forcé avec le produit pendant une (1) heure, temps pendant lequel le
nombre de moustiques femelles ayant subi un effet Knock Down (KD),
c'est-à-dire les moustiques qui sont tombés sur le dos ou sur le
côté, a été évalué à des
intervalles de 5 minutes. Pour chaque concentration, un lot de 25 femelles de
moustiques à jeun âgés de 2 à 3 jours, servant de
témoin, a toujours été placé dans un tube contenant
du papier neutre. Après le temps d'exposition aux HE ou aux combinaisons
d'HE, les moustiques ont été transférés dans les
tubes d'observation, contenant des papiers neutres, puis nourris avec du jus
sucré (glucose 5%) et conservés pendant 24h. L'effet létal
des HE ou des combinaisons d'HE testé a été observé
à partir des taux de mortalité déterminés.
Les concentrations appliquées sur les adultes lors de
ces tests en tubes OMS sont 0,1%, 0,5% et 1%. La perméthrine a
été utilisée comme témoin positif.
Pour chaque HE ou combinaison d'HE testée, les souches
de An. gambiae « Kisumu » et de Ae. aegypti «
Bora bora » ont servi de souches de référence sensible.
Lorsque la mortalité des moustiques témoins était
inférieure à 5%, le test était validé. Par contre,
si elle était comprise entre 5 et 20%, la mortalité des
moustiques exposées aux insecticides était corrigée par la
formule d'Abbott (Abbott, 1925). Si la mortalité des témoins
était supérieure à 20%, le test était repris.
Pour la combinaison des deux (2) HE, neuf (9) combinaisons ont
été obtenues selon les proportions de chaque HE dans la
combinaisons : i) C.n 10 % : O.a 90 % ; ii) C.n 20 % : O.a 80 % ; iii) C.n 30 %
: O.a 70 % ; iv) C.n 40 % : O.a 60 % ; v) C.n 50 % : O.a 50 % ; vi) C.n 60 %
:
O.a 40 % ; vii) C.n 70 % : O.a 30 % ; viii) C.n 80 % : O.a 20 %
et ix) C.n 90 % : O.a 10 % correspondant respectivement à C1, , C3, C4,
C5, C6, C7, C8 et C9.

A
B C
Figure 21: Quelques étapes du
déroulement des tests bioessais
A : Aspiration des moustiques femelles de 3
à 5 jours non gorgés ; B : Mise en contact des
moustiques avec les papiers imprégnés ; C : Mise
en observation des moustiques pour 24 heures après le contact avec les
papiers imprégnés (Cliché Balboné, 2020)
3- 2-3. Résultats
3- 2-3.1. Caractérisation chimique des huiles
essentielles
Les différents composés chimiques de chacune des
cinq huiles essentielles sont résumés dans le tableau II. La
description de leurs composés majeurs a été faite dans le
chapitre 1 partie 31.3.1.
Thèse de Doctorat unique - 69
-
Thèse de Doctorat unique - 70
-
3- 2-3.2. Tests adulticides sur les populations de
Anopheles gambiae
Les HE et les combinaisons d'HE testées ont
présenté une activité adulticide plus ou moins efficaces
sur les deux souches de An. gambiae. Cette activité a
été perçue à travers les mortalités des
HE/combinaisons et leurs concentrations létales.
3- 2-3.2.1. L'activité des huiles
essentielles
Avec les HE seules, les mortalités obtenues sur la
souche de An. gambiae de terrain VK ont varié de 0,0 à
13,16 % à la concentration 0,1 % ; de 1,12 à 23,56 % à la
concentration 0,5% et de 3,16 à 96,88 % à la concentration 1 %
(Figure 22).
L'HE de L. multiflora seule a montré une forte
activité avec une mortalité de 100 et 96,88 % à la
concentration de 1 %, respectivement sur la souche sensible Kisumu et la souche
de terrain VK. De même, l'activité élevée de l'HE de
L. multiflora a été observée avec des valeurs
CL50 de 0,21 et 0,67 %, de CL99 de 0,74 et 1,17 %, respectivement sur les
souches Kisumu et VK, (Tableau VII). Également, cette HE a donné
les plus faibles valeurs de KDT50 et KDT95 sur les deux souches de An.
gambiae testées (KDT50 = 19,8 et 58,8; KDT95 = 87,2 et 142,7 min,
respectivement pour Kisumu et VK à la concentration plus faible, 0,1 %)
(Tableau VIII).
L'HE de E. camaldulensis a été la moins
toxique avec une mortalité inférieure à 10 % à la
concentration de 1 % sur la souche sensible Kisumu (Figure 22), des valeurs de
KDT50 et KDT95 élevée (KTD50 = 144,8 et 166,1 min, respectivement
pour les souches Kisumu et VK à la concentration la plus
élevée, 1 %) et des valeurs CL50 de 2,86 et 2,94 %, CL99 de 5,05
et 5,26 %, respectivement sur les souches Kisumu et VK.
De plus, les HE de C. nardus (mortalités de
86,36 et 40,63 %, CL50 de 0,63 et 1,12 %, respectivement sur Kisumu et VK) et
de O. americanum (mortalités de 41,49 et 6,38 %, des CL50 de
2,18 et 2,21 %, respectivement sur Kisumu et VK) ont des activités
adulticides plus élevées que celle de l'HE de C. citratus
(mortalités de 35,29 et 4,76 %, CL50 de 2,3 et 2,7% sur Kisumu et
VK, respectivement) (Figure 22 et Tableau VII).
Pour la souche sensible Kisumu, aucune différence
significative n'a été observée avec la CL50 et la CL99
pour les HE de C. citratus, E. camaldulensis et O.
americanum. Cependant, sur la souche de terrain VK, il y avait une
différence significative avec toutes les HE (Tableau VII).
La concentration diagnostique a été obtenue
à partir de deux fois la CL99 sur la souche sensible (OMS, 2017). La
concentration diagnostique la plus faible (1,48%) a été obtenue
avec l'HE de L.
multiflora. Cette concentration diagnostique n'a pas
été significativement différente de la concentration
diagnostique de la perméthrine 0,75%, le contrôle positif. Les
concentrations diagnostiques les plus élevées ont
été obtenues avec les HE de O. americanum (9,18%),
C. citratus (9,4%) et E. camaldulensis (10,1%).
Mortalité des adultes de Anopheles gambiae aux
huiles essentielles
100 Kisumu VK 90
80 70 60 50 40 30
Taux de mortalité
10

Les traitements et les concentrations (%)

|
Cc
|
Cn
|
Ec
|
Lm
|
Oa
|
Cc
|
Cn
|
Ec
|
Lm
|
Oa
|
Cc
|
Cn
|
Ec
|
Lm
|
Oa
|
Perm
|
|
|
0,1
|
|
|
|
|
0,5
|
|
|
|
|
1
|
|
|
0,75
|
0

Figure 22: Taux de Mortalité des adultes
de An. gambiae Kisumu et VK en fonction des
concentration des HE. (Les barres d'erreurs
représentent l'intervalle de confiance à 95%). Les
mortalités moyennes (#177;intervalle de confiance) ont été
obtenues au seuil de probabilité de 5% d'après le test LSD de
Fisher (p?0,05).
Thèse de Doctorat unique - 71
-
Tableau VII : Concentrations létales 50
et 99 (CL50, CL99) et concentrations diagnostiques pour les huiles essentielles
et les combinaisons de C. nardus et O. americanum
testées sur Anopheles gambiae
|
Kisumu
|
VK
|
Diagnostic
concentration
(%)
|
Rapport de résistance (RR)
|
|
Traitements
|
CL50 (%)
(IC95)
|
CL99 (%)
(IC95)
|
CL50 (%)
(IC95)
|
CL99 (%) (IC95)
|
RR50
|
RR99
|
|
2,3
|
4,7
|
2,7
|
4,84
|
|
|
|
|
C. citratus
|
(1,9-2,7)
|
(4,4-6)
|
-
|
-
|
9,4
|
1,17
|
0,97
|
|
0,63
|
1,66
|
1,12
|
2,16
|
|
|
|
|
C. nardus
|
(0,6-0,7)
|
(1,4-2)
|
(1-1,3)
|
(1,8-2,7)
|
3,32
|
1,78
|
0,77
|
|
E. camaldulensis
|
2,86
(1,6-9,3)
|
5,26
(4,1-5,5)
|
2,94
-
|
5,05
-
|
10,1
|
1,028
|
1,04
|
|
0,21
|
0,74
|
0,67
|
1,17
|
|
|
|
|
L. multiflora
|
0,16-0,3
|
(0,6-0,9)
|
(0,6-0,7)
|
(1,1-1,3)
|
1,48
|
3,19
|
0,63
|
|
2,18
|
4,13
|
2,21
|
4,59
|
|
|
|
|
O. americanum
|
(1,5-3)
|
(2,6-5,5)
|
(1,5-3,5)
|
(2,9-5,8)
|
9,18
|
1,01
|
0,9
|
|
C1
|
1,37
|
2,95
|
2,9
|
6,4
|
|
|
|
|
(1,1-1,8)
|
(2,3-3,4)
|
-
|
-
|
5,9
|
2,12
|
0,46
|
|
0,76
|
1,69
|
1,18
|
2,45
|
|
|
|
|
(0,7-0,8)
|
(1,5-2)
|
(1,0-1,4)
|
(2-3,3)
|
3,38
|
1,55
|
0,69
|
|
C3
|
0,61
|
1,31
|
2,07
|
5
|
|
|
|
|
(0,5-0,7)
|
(1,2-1,5)
|
(1,5-5)
|
(4,2-5,9)
|
2,62
|
3,39
|
0,26
|
|
C4
|
0,46
|
1,19
|
1,25
|
2,48
|
|
|
|
|
(0,4-0,5)
|
(1-1,4)
|
(1,2-1,5)
|
(2-3,4)
|
2,38
|
2,72
|
0,48
|
|
C5
|
0,57
|
1,16
|
1,36
|
3,26
|
|
|
|
|
(0,5-0,6)
|
(1-1,3)
|
(1,1-2)
|
(2,4-5,5)
|
2,32
|
2,38
|
0,35
|
|
C6
|
0,28
|
1
|
1,08
|
2,15
|
|
|
|
|
(0,2-0,3)
|
(0,9-1,2)
|
-
|
-
|
2
|
3,86
|
0,46
|
|
C7
|
1,93
|
4,3
|
2,44
|
5,07
|
|
|
|
|
(1,4-4)
|
(3-4,7)
|
(1,6-3,2)
|
(3,1-5,6)
|
8,6
|
1,26
|
0,85
|
|
C8
|
0,23
|
0,58
|
0,89
|
1,3
|
|
|
|
|
(0,2-0,3)
|
(0,5-0,7)
|
(0,8-1)
|
(1,9-3)
|
1,16
|
1,17
|
0,97
|
|
C9
|
0,22
|
0,52
|
0,32
|
0,59
|
|
|
|
|
(0,2-0,3)
|
(0,4-0,6)
|
(0,3-0,4)
|
(0,5-0,7)
|
1,04
|
3,87
|
0,12
|
|
0,63
|
1,1
|
1,75
|
2,4
|
|
|
|
|
Permethrine
|
(0,59-0,8)
|
(0,9-1,3)
|
(1,7-2,1)
|
(2,1-2,8)
|
2,2
|
1,17
|
0,97
|
CL = Concentration létale ; IC = Intervalle de confiance ;
Cn = Cymbopogon nardus; Oa = Ocimum americanum
Thèse de Doctorat unique - 72
-
Tableau VIII: KDT50, KDT95 obtenus avec les
huiles essentielles des 5 plantes sur les deux souches de Anopheles gambiae
(Kisumu et de VK)
Traitements Anopheles gambiae « Kisumu »
Anopheles gambiae « VK »
Doses KDT50 KDT95 KDT50 KDT95
(%) (min) (min) (min) (min)
C. citratus 0,1 103,24 204,66 140,2 318,7
0,5 77,10 155,86 124,9 275,8
1 60,19 132,39 116,5 233,6
C. nardus 0,1 88,37 196,99 148,6 241,8
0,5 33,3 108,9 90,2 149,5
1 5,8 11,5 12,4 70,7
E. camaldulensis 0,1 192,2 289,7 227,3 309,7
0,5 157,1 275,1 189,9 286,7
1 144,8 266,5 166,1 280
L. multiflora 0,1 19,8 58,8 87,2 142,7
0,5 10,5 19 32 57,7
1 -28,3 -8,2 -5,9 1,5
O. americanum 0,1 137,5 225,6 156,4 267,5
0,5 87,06 146,64 144,7 248,9
1 30,04 60,76 116,3 204,6
Permethrine 0,75 16,3 30 41,2 100
KDT50 : temps nécessaire pour assommer 50% des
moustiques et KDT95 : temps nécessaire pour assommer 95% des
moustiques
3.2.3.2.2. L'activité des combinaisons des huiles
essentielles
En utilisant les combinaisons sur les deux souches de An.
gambiae (Kisumu et VK), les mortalités sur la souche de terrain VK
ont varié de 1,15 à 12,15 %; 5,21 à 94 % et 9,62 à
100 %, respectivement aux concentrations de 0,1 ; 0,5 et 1 % (Figure 23). Les
mortalités sur la souche Kisumu ont été plus remarquables
aux mêmes concentrations (Figure 23).
Thèse de Doctorat unique - 73
-

100
90
Mortalité des adultes de Anopheles gambiae aux
combinaisons d'HE de C. nardus et de O. americanum
Kisumu VK
80
70
Taux de mortalité
60
50
40
30
20
10
0
C1
C3
C4
C5
C6
C7
C8
C9
C1
C3
C4
C5
C6
C7
C8
C9
C1
C3
C4
C5
C6
C7
C8
C9
0,5
Traitements et concentrations (%)
1 0,75
0,1
Perm
Figure 23: Taux de Mortalité des adultes
de An. gambiae de Kisumu et VK en fonction des
concentration des combinaisons des HE de C. nardus et
O. americanum. (Les barres d'erreurs représentent
l'intervalle de confiance à 95%). Les mortalités
moyennes (#177;intervalle de confiance) ont été obtenues au seuil
de probabilité de 5% d'après le test LSD de Fisher (p?0,05).
La combinaison C9 présentait une toxicité
élevée sur toutes les souches. En effet, cette combinaison a
donné une mortalité de 100% à la concentration de 1% sur
les deux souches de An. gambiae testées, 96,7 et 94 % à
la concentration de 0,5 %, respectivement sur les souches Kisumu et VK. De
plus, C9 a présenté les plus faibles valeurs de KDT (Tableau IX)
et les plus faibles valeurs de CL50 et CL99 sur les deux souches (CL50 de 0,22
et 0,32 %, CL99 de 0,52 et 0,59 %, respectivement sur Kisumu et VK) (Tableau
VIII). Également, C9 a été la seule combinaison qui a
produit un effet synergique sur les deux souches (Tableaux X et XI).
En outre, les combinaisons C6 et C8 ont présenté
une toxicité élevée avec des taux de mortalité
supérieurs à 98% à la concentration de 1 % sur la souche
Kisumu. Sur la souche VK, la toxicité de ces deux combinaisons
était relativement élevée avec des mortalités de
45,21 et 80,7
Thèse de Doctorat unique - 74
-
Thèse de Doctorat unique - 75
-
% à la concentration de 1%, respectivement pour C6 et
C8. Avec ces deux combinaisons, les valeurs de KDT étaient
légèrement faibles sur les deux souches (KDT95 = 20.7 min 12.2
min à la concentration de 1% sur la souche VK, respectivement pour C6 et
C8) aussi, les CL50 et CL99 étaient légèrement
élevées par rapport à C9 sur les deux souches (CL50 = 1.08
et 0.89%, CL99 =1.3 et 2.15%, respectivement). Sur la souche Kisumu, C8 a
produit un effet synergique et C6 un effet additif (Tableau X).
Les combinaisons , C4 et C6 ont donné des valeurs CL50
et CL99 respectivement inférieures à 1,5 et 2,5% avec la souche
VK. Toutes les autres combinaisons ont donné des CL50 supérieures
à 2 et des CL99 supérieures à 5%, sauf C5 qui a
donné 1,36% comme CL50 et 3,26% pour CL99 sur la souche VK (Tableau
VIII).
Les plus faibles concentrations diagnostiques de 1,04%, 1,16%
et 1,48% ont été obtenues respectivement avec les C9 et C8, et
l'HE de L. multiflora (Tableau VIII).
Les CL50 et CL99 obtenues sur les deux souches de An.
gambiae ont été significativement plus faibles pour les
combinaisons C9, C8 et C6 que celles obtenues avec chacune des 2 HE qui ont
servi à la combinaison (Tableau VIII). Les valeurs de CL50 obtenues avec
les combinaisons C8 sur la souche VK n'ont montré aucune
différence avec celles obtenues avec l'HE de C. nardus avec des
intervalles de confiance qui se chevauchent, de même les CL50 obtenues
avec C3, C4, C5 et C7 n'ont montré aucune différence avec celles
obtenues avec l'HE de O. americanum sur la souche VK (p < 0,0001)
(Tableau VIII).
Les ratios de résistance obtenus avec toutes les HE
ainsi qu'avec toutes les combinaisons étaient inférieurs à
5 (Tableau VIII). Cela indique que même s'il y a une résistance
avec certaines HE et les combinaisons, elle serait très faible.
L'HE L. multiflora et la combinaison C9 ont produit
des mortalités plus élevées et des KDT plus faibles
à la concentration de 0,5% que la perméthrine 0,75%.
Les concentrations diagnostiques les plus faibles ont
été obtenues respectivement avec C9 et C8 avec des valeurs de
1,04 et 1,16 % respectivement. Ces deux concentrations diagnostiques n'ont pas
été significativement différentes de la concentration
diagnostique de perméthrine 0,75%, le contrôle positif (p = 0,91).
Les concentrations diagnostiques les plus élevées ont
été obtenues avec C1 (5,9%) et C7 (8,6%).
Thèse de Doctorat unique - 76
-
Tableau IX: KDT50, KDT95 avec les combinaisons
d'huiles essentielles de C. nardus et de O. americanum sur
les souches de Anopheles gambiae (Kisumu et VK)
|
Codes
|
Traitements
|
Doses
(%)
|
Anopheles gambiae
"Kisumu"
|
Anopheles gambiae
"VK"
|
|
KDT50
(min)
|
KDT95
(min)
|
KDT50
(min)
|
KDT95
(min)
|
|
C1
|
C.n 10 % : O.a 90 %)
|
0,1
|
102
|
132,9
|
171,6
|
321,3
|
|
|
0,5
|
9,6
|
22,1
|
33
|
57,3
|
|
|
1
|
4,4
|
13,2
|
27,4
|
50,3
|
|
C.n 20 % : O.a 80 %
|
0,1
|
131,7
|
232,7
|
222
|
310
|
|
|
0,5
|
3,3
|
13,2
|
35
|
73,3
|
|
|
1
|
2,4
|
10,2
|
16
|
25,9
|
|
C3
|
C.n 30 % : O.a 70 %
|
0,1
|
142,8
|
232,7
|
178,1
|
304
|
|
|
0,5
|
10,8
|
21
|
25
|
38,5
|
|
|
1
|
5,5
|
13,4
|
16
|
16,1
|
|
C4
|
C.n 40 % : O.a 60 %
|
0,1
|
108,7
|
147,1
|
142,4
|
172,1
|
|
|
0,5
|
7,3
|
16,9
|
20,3
|
47,6
|
|
|
1
|
6,7
|
12,4
|
7,7
|
14,3
|
|
C5
|
C.n 50 % : O.a 50 %
|
0,1
|
91
|
153,6
|
106,7
|
182,8
|
|
|
0,5
|
11,2
|
18,6
|
23,5
|
78,7
|
|
|
1
|
0,5
|
13,1
|
7,1
|
16,5
|
|
C6
|
C.n 60 % : O.a 40 %
|
0,1
|
77,4
|
145
|
116,1
|
168,1
|
|
|
0,5
|
15,7
|
37,6
|
48,1
|
64,9
|
|
|
1
|
8,6
|
13,4
|
8,9
|
20,7
|
|
C7
|
C.n 70 % : O.a 30 %
|
0,1
|
131,9
|
245,3
|
166,1
|
303,3
|
|
|
0,5
|
48,7
|
99,6
|
137,2
|
225
|
|
|
1
|
11,6
|
17,4
|
13,2
|
28,8
|
|
C8
|
C.n 80 % : O.a 20 %
|
0,1
|
76,4
|
150,6
|
119
|
218,2
|
|
|
0,5
|
-25,2
|
28,8
|
24,2
|
52,7
|
|
|
1
|
-26,9
|
1,4
|
-2,1
|
12,2
|
|
C9
|
C.n 90 % : O.a 10 %
|
0,1
|
23,5
|
77
|
53,5
|
126,7
|
|
|
0,5
|
-32,3
|
3,7
|
-5
|
7,4
|
|
|
1
|
-227,9
|
-70,1
|
-227,3
|
-69,6
|
|
Perméthrine
|
0,75
|
16,3
|
30
|
41,2
|
90,4
|
KDT50 : temps nécessaire pour assommer 50% des moustiques
et KDT95 : temps nécessaire pour assommer 95% des moustiques
Thèse de Doctorat unique - 77
-
Tableau X: Effets des interactions des HE de
Cymbopogon nardus (C.n) et
Ocimum americanum (O.a) dans les combinations sur les
adultes de la souche sensible de An. gambiae Kisumu (n = 150).
|
Rapport des huiles
dans les combinaisons
|
Codes
|
CL50 %
|
FICCn
|
FICO.a
|
FIC
|
Effet
|
|
C.n 0% : O.a 100%
|
-
|
2,18
|
-
|
-
|
-
|
-
|
|
C.n 10% : O.a 90%
|
C1
|
1,37
|
2,17
|
0,63
|
2,80
|
Sans effet
|
|
C.n 20% : O.a 80%
|
|
0,76
|
1,21
|
0,35
|
1,55
|
Sans effet
|
|
C.n 30% : O.a 70%
|
C3
|
0,61
|
0,97
|
0,28
|
1,25
|
Sans effet
|
|
C.n 40% : O.a 60%
|
C4
|
0,46
|
0,73
|
0,21
|
0,94
|
Sans effet
|
|
C.n 50% : O.a 50%
|
C5
|
0,57
|
0,90
|
0,26
|
1,17
|
Sans effet
|
|
C.n 60% : O.a 40%
|
C6
|
0,28
|
0,44
|
0,13
|
0,57
|
Additif
|
|
C.n 70% : O.a 30%
|
C7
|
1,93
|
3,06
|
0,89
|
3,95
|
Sans effet
|
|
C.n 80% : O.a 20%
|
C8
|
0,23
|
0,37
|
0,11
|
0,47
|
Synergiste
|
|
C.n 90% : O.a 10%
|
C9
|
0,22
|
0,35
|
0,10
|
0,45
|
Synergiste
|
|
C.n 100% : O.a 0%
|
-
|
0,63
|
-
|
-
|
-
|
-
|
FIC = FICCn + FICOa; Synergiste: FIC < 0.5; Additif;
05 = FIC = 1; Sans effet: 1 = FIC = 4; Antagoniste: FIC > 4.
Tableau XI: Effets des interactions des HE de
Cymbopogon nardus (C.n) et Ocimum americanum (O.a) dans les
combinations sur les adultes de la souche de An. gambiae de VK (n =
150).
|
Rapport des huiles
dans les combinaisons
|
Codes
|
CL50 %
|
FICCn
|
FICO.a
|
FIC
|
Effet
|
|
C.n 0% : O.a 100%
|
-
|
2,21
|
-
|
-
|
-
|
-
|
|
C.n 10% : O.a 90%
|
C1
|
2,9
|
1,31
|
2,59
|
3,9
|
Sans effet
|
|
C.n 20% : O.a 80%
|
|
1,18
|
0,53
|
1,05
|
1,58
|
Sans effet
|
|
C.n 30% : O.a 70%
|
C3
|
2,07
|
0,94
|
1,85
|
2,79
|
Sans effet
|
|
C.n 40% : O.a 60%
|
C4
|
1,25
|
0,56
|
1,12
|
1,68
|
Sans effet
|
|
C.n 50% : O.a 50%
|
C5
|
1.36
|
0,61
|
1,2
|
1,81
|
Sans effet
|
|
C.n 60% : O.a 40%
|
C6
|
1,08
|
0,49
|
0,96
|
1,45
|
Sans effet
|
|
C.n 70% : O.a 30%
|
C7
|
2,44
|
1,1
|
2,17
|
3,27
|
Sans effet
|
|
C.n 80% : O.a 20%
|
C8
|
0,89
|
0,40
|
0,79
|
1,19
|
Sans effet
|
|
C.n 90% : O.a 10%
|
C9
|
0,32
|
0,14
|
0,28
|
0,42
|
Synergiste
|
|
C.n 100% : O.a 0%
|
-
|
1,12
|
-
|
-
|
-
|
-
|
FIC = FICCn + FICOa; Synergiste: FIC < 0.5; Additif;
05 = FIC = 1; Sans effet: 1 = FIC = 4; Antagoniste: FIC > 4.
Thèse de Doctorat unique - 78
-
3- 2-3.3. Tests adulticides sur les populations de
Aedes aegypti 3- 2-3.3.1. L'activité des huiles
essentielles
Le tableau XII résume les temps nécessaires pour
assommer 50 et 95% de moustiques (KDT50 et KDT95) avec les intervalles de
confiance de 95% (IC95%) obtenus sur les deux souches de Ae. Aegypti
testées (Bora bora et de Bobo-Dioulasso) avec les HE.
Sur la souche de Bobo-Dioulasso, les valeurs de KDT50 et KDT95
variaient respectivement de 234,1 à 113,5 min et 343,9 à 182,8
min à la concentration 0,1%, de 209,4 à 43 min et 297,2 à
75 min à 0,5% et de 190,5 à 20,5 et 287 à 32,8 à
1%. Sur cette souche, les valeurs de KDT les plus faibles ont été
obtenues avec l'HE de L. multiflora, suivies par les HE de C.
nardus et O. americanum, et les valeurs de KDT les plus
élevées ont été obtenues avec l'HE de E.
camaldulensis.
À la concentration la plus élevée (1%),
il n'y a pas de différences significatives entre les valeurs de KDT
obtenues avec les HE testées sur les deux souches de Ae.
aegypti, à l'exception de celles obtenues avec les HE de C.
nardus et de L. multiflora.
Sur la souche sensible Bora Bora, les valeurs du KDT50 et du
KDT95 des HE de L. multiflora et de C. nardus ont
été respectivement de -3,9 ; 7,8 min et 24 ; 33,7 min à
une concentration de 1%. Sur la souche sensible Bora Bora, les KDT ont
été les plus faibles et les mortalités les plus
élevées que celles obtenues sur la souche Bobo-Dioulasso.
Tableau XII : les temps nécessaires pour
assommer 50 et 95% (KDT50 et KDT95) avec les intervalles de confiance à
95% (IC95%) obtenus sur les deux souches de Ae. Aegypti testées
(Bora bora et de Bobo-Dioulasso) avec les HE.
Aedes aegypti "Bora bora" Aedes aegypti
"Bobo-Dioulasso"
KDT50 KDT95
(min) (min) (min) (min)
Huiles
essentielles Concentrations
KDT50 KDT95
C. citratus 0,1 193,3 291,1 221,2 311,2
0,5 192,6 290,2 228,1 298,5
1 140,6 230,4 142,5 244,8
C. nardus 0,1 88,6 134 179 278
0,5 35,6 53,8 88,7 143,9
1 24 33,7 35,6 57,2
E. camaldulensis 0,1 211,3 299,1 234,1 343,9
0,5 178,1 285,7 209,4 297,2
1 156,5 267,5 190,3 287,2
L. multiflora 0,1 107 178,7 113,5 182,8
0,5 40,9 72 43 75
1 -3,9 7,8 20,5 32,8
O. americanum 0,1 131,57 194,82 151,7 264,3
0,5 128,1 188,4 145,3 247,5
1 125,7 210,6 133,3 249
Permethrin 0,75 16,6 29,1 144 188,7
KDT50 et KDT95 : Temps de knock down de 50 et 95% de moustiques ;
min : minute
Les mortalités (Figure 24) et les valeurs de CL50 et
CL99 (Tableau XIII) ont varié en fonction des HE testées, de
leurs concentrations et de la souche de Ae. aegypti sur laquelle les
HE ont été testées. Comme dans le cas de An.
gambiae, L'HE de L. multiflora a été toujours celle
qui a l'activité la plus élevée quelle que soit la souche
de Ae. aegypti sur laquelle elle a été testée. En
effet, elle a produit les mortalités les plus élevées et
les concentrations létales les plus faibles (mortalité = 85%
à la concentration de 1% ; CL50 = 0,79% et CL99 = 1,25 pour la souche de
Bobo-Dioulasso et une mortalité de 100% à la concentration 1%
avec pour CL50 = 0,57% et CL99 = 1,03 pour la souche Bora Bora). A la
concentration 1%, l'HE de C. nardus a produit des mortalités de
20,34% et 12,75%, respectivement sur les souches Bora Bora et Bobo-Dioulasso.
L'HE de E. camaldulensis a l'activité la plus faible avec les
plus faibles mortalités sur les deux
Thèse de Doctorat unique - 79
-
souches (7,14 et 0,7% à la concentration 1%,
respectivement sur les souches de Bora Bora et Bobo-Dioulasso).
La concentration diagnostique la plus faible de 2,06 %, a
été obtenue avec l'HE de L. multiflora. La concentration
diagnostique la plus élevée a été obtenue avec l'HE
de E. camaldulensis (15,62 %).
Sur les deux souches de Ae. aegypti, les
mortalités obtenues avec l'HE de L. multiflora ont
été significativement plus élevées que celles
obtenues avec la perméthrine 0,75%.

Mortalités des adultes de Aedes aegypti aux HE
100
Bora Bora Bobo-Dioulasso
90
80
70
60
50
40
30
20
Mortalités
|
Cc
|
Cn
|
Ec
|
Lm
|
Oa
|
Cc
|
Cn
|
Ec
|
Lm
|
Oa
|
Cc
|
Cn
|
Ec
|
Lm
|
Oa
|
Perm
|
|
|
0,1
|
|
|
|
|
0,5
|
|
|
|
|
1
|
|
|
0,75%
|
Traitements et concentrations
10
0
Figure 24: Mortalité des adultes de
Ae. aegypti en fonction des concentrations des HE.
(Les barres d'erreurs représentent l'intervalle de
confiance à 95%). Les mortalités moyennes (#177;intervalle
de confiance) ont été obtenues au seuil de probabilité de
5% d'après le test LSD de Fisher (p?0,05).
Thèse de Doctorat unique - 80
-
Tableau XIII : Concentrations létales 50
et 99 (CL50, CL99) et concentrations diagnostiques pour les huiles essentielles
et les combinaisons de C. nardus et O. americanum
testées sur Aedes aegypti
|
Bora Bora
|
Bobo-Dioulasso
|
Diagnostic
concentration
(%)
|
Rapport de résistance (RR)
|
|
Traitements
|
CL50 (%)
(IC95)
|
CL99 (%)
(IC95)
|
CL50 (%)
(IC95)
|
CL99 (%) (IC95)
|
RR50
|
RR99
|
|
C. citratus
|
2,7
(-)
|
4,9
(-)
|
-
|
-
|
9,88
|
-
|
-
|
|
2,24
|
4,3
|
2,94
|
5,9
|
|
|
|
|
C. nardus
|
(1,6-2,7)
|
(2,7-4,9)
|
(1,4-3,8)
|
(5,7-8,7)
|
8,6
|
1,31
|
1,37
|
|
E. camaldulensis
|
3,58
|
7,81
|
-
|
-
|
|
|
|
|
(3,3-4,2)
|
( - )
|
|
|
15,62
|
-
|
-
|
|
0,57
|
1,03
|
0,79
|
1,25
|
|
|
|
|
L. multiflora
|
(0,5-0,6)
|
(0,9-1,2)
|
(0,7-0,8)
|
(1,1-1,4)
|
2,06
|
1,38
|
1,21
|
|
2,7
|
4,9
|
3,1
|
5,3
|
|
|
|
|
O. americanum
|
(-)
|
(3,4-5,3)
|
(-)
|
(-)
|
9,8
|
1,14
|
1,08
|
|
C1
|
3,63
|
6,41
|
3,9
|
6,8
|
|
|
|
|
( - )
|
( - )
|
(-)
|
(-)
|
12,72
|
1,07
|
1,06
|
|
0,77
|
1,28
|
0,84
|
1,3
|
|
|
|
|
(0,7-0,8)
|
(1,2-1,4)
|
(0,8-0,9)
|
(1,2-1,4)
|
2,56
|
1,09
|
1,01
|
|
C3
|
2,68
|
4,5
|
2,6
|
4,9
|
|
|
|
|
(1,46-5)
|
(3,2-5,9)
|
( - )
|
( - )
|
8,4
|
0,97
|
1,09
|
|
C4
|
1,49
|
2.66
|
1,98
|
3,9
|
|
|
|
|
(1,2-2,2)
|
(2-4,6)
|
(1,5-2,3)
|
(2,4-4,6)
|
5,06
|
1,33
|
1,47
|
|
C5
|
3,83
|
8,3
|
4,02
|
9,7
|
|
|
|
|
( - )
|
( - )
|
( - )
|
( - )
|
16,6
|
1,05
|
1,17
|
|
C6
|
1,68
|
2,92
|
1,79
|
3,27
|
|
|
|
|
(1,4-3,5)
|
(2,3-7,7)
|
1,3-3,3
|
(2,1-3,1)
|
6,54
|
1,06
|
1,11
|
|
C7
|
1,7
|
2,94
|
3,47
|
6,1
|
|
|
|
|
(1,3-1,9)
|
(1,9-4,4)
|
( - )
|
( - )
|
5,88
|
2,04
|
2,07
|
|
C8
|
0,6
|
1,08
|
0,7
|
1,2
|
|
|
|
|
(0,5-0,6)
|
(1-1,2)
|
0,6-0,8
|
(1,1-1,3)
|
2,16
|
1,17
|
1,11
|
|
C9
|
0,97
|
2,29
|
0,99
|
2,56
|
|
|
|
|
(0,8-1,1)
|
(1,9-3)
|
(0,9-1.3)
|
(2-3,5)
|
4,58
|
1,02
|
1,12
|
|
0,75
|
1,69
|
2,2
|
3,5
|
|
|
|
|
Permethrine
|
(0,6-1,1)
|
(1,6-1,8)
|
(2,1-2,6)
|
(2,3-5,8)
|
3,38
|
2,93
|
2,07
|
CL = Concentration létale ; IC = Intervalle de confiance ;
Cn = Cymbopogon nardus; Oa = Ocimum americanum
Thèse de Doctorat unique - 81
-
3- 2-3.3.2. L'activité des combinaisons des huiles
essentielles
Les valeurs des KDT50 et KDT95 (Tableau XIV) et les
mortalités obtenues avec les combinaisons préparées
à partir des HE de C. nardus et de Ocimum americanum
sur les deux souches de Ae. aegypti ont varié selon les
proportions des HE combinées et les concentrations des combinaisons
(Figure 25).
Mortalité des adultes dAedes aegypti aux
combinaisons d'HE de C.
nardus et de O. americanum

Taux de mortalité
70
60
50
40
30
20
10
0
100
90
Bora Bora Bobo-Dioulasso
80
C1
C3
C4
C5
C6
C7
C8
C9
C1
C3
C4
C5
C6
C7
C8
C9
C1
C3
C4
C5
C6
C7
C8
C9
1 0,7
0,1
0,5
Perm
Traitements et les concentrations (%)
Figure 25: Mortalité des adultes de
Ae. aegypti en fonction des concentration des combinaisons
des HE de C. nardus et O. americanum. (Les
barres d'erreurs représentent l'intervalle de confiance à
95%). Les mortalités moyennes (#177;intervalle de
confiance) ont été obtenues au seuil de probabilité de 5%
d'après le test LSD de Fisher (p?0,05).
Thèse de Doctorat unique - 82
-
Thèse de Doctorat unique - 83
-
Sur les deux souches de Ae. aegypti, les valeurs de
KDT les plus faibles ont été obtenues par la combinaison C8,
suivie de . Par contre, les valeurs les plus élevées ont
été obtenues avec C3 et C1. En effet, les valeurs de KDT50 et
KDT95 avec C8 ont été respectivement de 48,9 et 77 min à
la concentration 1% sur la souche Bora Bora, 60,6 et 79,8 min sur la souche de
Bobo-Dioulasso. Globalement, toutes les combinaisons ont montré de
faibles valeurs de KDT. En effet, sur les deux souches de Ae. aegypti,
les valeurs de KDT95 ont été inférieures à 60 min
à 1%, sauf pour les combinaisons C3 et C1 qui ont montré des
valeurs de KDT95 respectivement de 186 et 172.4 min à 1%. Les valeurs de
KDT obtenues avec les combinaisons C8, et C9 ont été
significativement plus faibles que celles des deux (2) HE testées
individuellement à toutes les concentrations.
En ce qui concerne les mortalités, les valeurs les plus
élevées à la concentration de 1% ont été de
100 et 86,67% sur la souche Bora Bora et 95,09 et 81,99% sur la souche
Bobo-Dioulasso obtenues respectivement avec les combinaisons C8 et . Quant
à la combinaison C9, elle a donné une mortalité de 51,76%
à la concentration de 1%. C'est seulement avec ces trois (3)
combinaisons, , C8 et C9, que les mortalités obtenues ont
été significativement plus élevées que celles
obtenues avec les 2 HE testées séparément. Les
mortalités les plus faibles ont été obtenues avec la
combinaison C1 (2,66 et 1,6% à la concentration de 1%, respectivement
sur les souches de Bora Bora et de Bobo-Dioulasso).
Les effets interactifs entre les deux HE dans les combinaisons
(Tableaux XV et XVI) ont été obtenus à partir des indices
de concentration inhibitrice/létale fractionnelle (FIC). Ces effets de
combinaison ont été classés comme synergistes, additifs,
indifférents ou antagonistes. Les combinaisons les plus efficaces en ce
qui concerne les KDT, les concentrations létales et les
mortalités ont été celles qui donnaient des effets
synergiques et additifs. En effet, l'effet synergique a été
obtenu sur les deux souches avec la combinaison C8 et l'effet additif a
été trouvé avec les combinaisons et C9.
Le tableau XIII résume les CL50 et CL99 ainsi que les
concentrations diagnostiques pour toutes les cinq (5) HE testées et les
combinaisons préparées avec les HE de C. nardus et
O. americanum. Sur les deux souches de Ae. aegypti, les CL50
obtenues avec les combinaisons C8, et C9 ont été
inférieures à 1%, tandis que celles de C4 et C6 ont
été légèrement inférieures à 2%.
Les concentrations diagnostiques les plus faibles de 2,16 % et
2,56 % ont été obtenues respectivement avec les combinaisons C8
et . Les concentrations diagnostiques les plus élevées ont
été obtenues avec C5 (19,4 %) et C1 (12,72 %). A l'exception de
C5 et C1, toutes les combinaisons ont donné des concentrations
diagnostiques plus faibles que celles des HE de C. nardus et O.
americanum.
Tableau XIV : KDT50, KDT95 produits par les
combinaisons d'huiles essentielles de C. nardus et de O.
americanum sur les souches de Aedes aegypti (Bora bora et de
Bobo-Dioulasso)
|
Codes
|
Combinaisons d'huiles essentielles
|
Concentrations
|
Aedes aegypti Bora Bora
|
Aedes aegypti
Bobo-Dioulasso
|
|
KDT50(min)
|
KDT95(min)
|
KDT50(min)
|
KDT95(min)
|
|
C1
|
C.n 10% : O.a 90%
|
0,1
|
11,75
|
15
|
127.3
|
187,4
|
|
|
0,5
|
95
|
136,3
|
118.3
|
180,7
|
|
|
1
|
76,5
|
116,3
|
110,7
|
172,4
|
|
C.n 20% : O.a 80%
|
0,1
|
103,1
|
169,7
|
125,7
|
173,7
|
|
|
0,5
|
65
|
113,4
|
103,3
|
163,4
|
|
|
1
|
-4
|
0,9
|
1,2
|
9.2
|
|
C3
|
C.n 30% : O.a 70%
|
0,1
|
147,7
|
228,1
|
175,7
|
273,7
|
|
|
0,5
|
98,2
|
164,8
|
118,6
|
252,7
|
|
|
1
|
28,4
|
48,5
|
77,5
|
186
|
|
C4
|
C.n 40% : O.a 60%
|
0,1
|
173,5
|
281,3
|
190,3
|
287,2
|
|
|
0,5
|
65,5
|
107,3
|
113,3
|
184,5
|
|
|
1
|
15,2
|
33,2
|
17
|
42,2
|
|
C5
|
C.n 50 % : O.a 50 %
|
0,1
|
123,4
|
197,3
|
131,7
|
222,4
|
|
|
0,5
|
76,6
|
139,4
|
102,2
|
168,8
|
|
|
1
|
17,1
|
28,2
|
27
|
47,1
|
|
C6
|
C.n 60% : O.a 40%
|
0,1
|
96,2
|
161,2
|
151,7
|
252,3
|
|
|
0,5
|
24,2
|
36,7
|
106,1
|
160,1
|
|
|
1
|
10,5
|
16,7
|
17,1
|
22
|
|
C7
|
C.n 70% : O.a 30%
|
0,1
|
146
|
217
|
189,9
|
286,7
|
|
|
0,5
|
115,3
|
184,1
|
130,8
|
199,7
|
|
|
1
|
25,5
|
37,3
|
38,5
|
57,1
|
|
C8
|
C.n 80% : O.a 20%
|
0,1
|
48,9
|
77
|
60,6
|
79,8
|
|
|
0,5
|
11,6
|
59,2
|
14,3
|
46,5
|
|
|
1
|
-9,8
|
0,6
|
-3,9
|
7,8
|
|
C9
|
C.n 90% : O.a 10%
|
0,1
|
92,3
|
137,2
|
115,4
|
157,8
|
|
|
0,5
|
13.5
|
40,5
|
20,5
|
53,8
|
|
|
1
|
7.7
|
12,3
|
8,5
|
17,1
|
|
Permethrin
|
0,75
|
16.6
|
29,1
|
144
|
188,7
|
KDT50 et KDT95: temps de knock down de 50 et 95% de moustiques ;
min : minute
Thèse de Doctorat unique - 84
-
Tableau XV : Effets des interactions des huiles
essentielles de C. nardus (C.n) et O. americanum (O.a) dans
les combinations sur les adultes de la souche sensible de Aedes aegypti
Bora Bora (n = 150).
|
Rapport des huiles dans
les combinaisons
|
Codes
|
CL50 (%)
|
FICCn
|
FICO.a
|
FIC
|
Effet
|
|
C.n 0% : O.a 100%
|
O.a
|
2,7
|
-
|
-
|
-
|
-
|
|
C.n 10% : O.a 90%
|
C1
|
3,61
|
1,61
|
1,34
|
2,95
|
Sans effet
|
|
C.n 20% : O.a 80%
|
|
0,77
|
0,34
|
0,29
|
0,63
|
Additif
|
|
C.n 30% : O.a 70%
|
C3
|
2,35
|
1,05
|
0,87
|
1,92
|
Sans effet
|
|
C.n 40% : O.a 60%
|
C4
|
1,48
|
0,66
|
0,55
|
1,21
|
Sans effet
|
|
C.n 50% : O.a 50%
|
C5
|
3,31
|
1,48
|
1,23
|
2,70
|
Sans effet
|
|
C.n 60% : O.a 40%
|
C6
|
1,79
|
0,80
|
0,66
|
1,46
|
Sans effet
|
|
C.n 70% : O.a 30%
|
C7
|
1,78
|
0,79
|
0,66
|
1,45
|
Sans effet
|
|
C.n 80% : O.a 20%
|
C8
|
0,6
|
0,27
|
0,22
|
0,49
|
Synergiste
|
|
C.n 90% : O.a 10%
|
C9
|
0.97
|
0.43
|
0.36
|
0,79
|
Additif
|
|
C.n 100% : O.a 0%
|
C.n
|
2.24
|
-
|
-
|
-
|
-
|
FIC = FICCn + FICOa; Synergiste: FIC < 0.5; Additif;
05 = FIC = 1; Sans effet: 1 = FIC = 4; Antagoniste: FIC > 4.
|
Tableau XVI : Effets des interactions des huiles
essentielles de C. nardus (C.n) et O. americanum (O.a) dans
les combinations sur les adultes de la souche de Aedes aegypti de
Bobo-Dioulasso (n = 150).
|
|
Rapport des huiles dans
les combinaisons Codes CL50 (%) FICCn FICO.a FIC Effet
|
|
C.n 0% : O.a 100%
|
O.a
|
3,1
|
-
|
-
|
-
|
-
|
|
C.n 10% : O.a 90%
|
C1
|
3,9
|
1,25
|
1,32
|
2,57
|
Sans effet
|
|
C.n 20% : O.a 80%
|
|
0,84
|
0,27
|
0,28
|
0,55
|
Additif
|
|
C.n 30% : O.a 70%
|
C3
|
2,6
|
0,83
|
0,88
|
1,71
|
Sans effet
|
|
C.n 40% : O.a 60%
|
C4
|
2,18
|
0,7
|
0,74
|
1,44
|
Sans effet
|
|
C.n 50% : O.a 50%
|
C5
|
3,83
|
1,23
|
1,3
|
2,53
|
Sans effet
|
|
C.n 60% : O.a 40%
|
C6
|
1,68
|
0,54
|
0,57
|
1,11
|
Sans effet
|
|
C.n 70% : O.a 30%
|
C7
|
3,47
|
1,11
|
1,18
|
2,29
|
Sans effet
|
|
C.n 80% : O.a 20%
|
C8
|
0,7
|
0,22
|
0,24
|
0,46
|
Synergistee
|
|
C.n 90% : O.a 10%
|
C9
|
1,05
|
0,34
|
0,36
|
0,7
|
Additif
|
|
C.n 100% : O.a 0%
|
C.n
|
2,94
|
-
|
-
|
-
|
-
|
FIC = FICCn + FICOa; Synergiste: FIC < 0.5; Additif;
05 = FIC = 1; Sans effet: 1 = FIC = 4; Antagoniste: FIC > 4.
Thèse de Doctorat unique - 85
-
Thèse de Doctorat unique - 86
-
3- 2-4. Discussion
Jusqu'à présent, la gestion de la
résistance aux insecticides reste un défi majeur pour parvenir
à une élimination efficace du paludisme (OMS, 2012). En effet, la
résistance aux pyréthrinoïdes a été
signalée dans 27 pays d'Afrique sub-saharienne, soulignant l'urgence de
trouver des alternatives à ces insecticides (Tchoumbougnang et
al., 2009 ; Ranson et Lissenden, 2016). La recherche d'alternatives
aux insecticides chimiques à base d'extraits de plantes peut
représenter de nouvelles pistes pour le contrôle des populations
de moustiques vecteurs du paludisme.
Ici, nous avons évalué le niveau
d'efficacité de cinq (5) HE, à savoir les HE de Cymbopogon
citratus, Cymbopogon nardus, Eucalyptus camaldulensis, Lippia
multiflora et Ocimum americanum sur des populations de An.
gambiae et de Ae. aegypti. Aussi, l'efficacité des
combinaisons de C. nardus (C.n) et O. americanum (O.a) et des
effets de ces HE dans la combinaison ont été examinés dans
cette étude.
Globalement, presque toutes les HE testées ont
montré un effet adulticide sur les souches de An. gambiae
sensible Kisumu et résistante collectée à VK et sur
les souches de Aedes aegypti sensible Bora Bora et résistante
collectée à Bobo-Dioulasso. Cet effet insecticide, mis en
évidence par des effets « knock-down », des concentrations
létales et des mortalités des moustiques adultes testés, a
varié significativement selon les concentrations et les HE
utilisées.
Les résultats de la présente étude
confirment partiellement les travaux de Yameogo et al. (2021) qui ont
montré les effets adulticides de certaines HE identiques testées
sur des populations de Ae. aegypti collectées à
Ouagadougou. Ils confirment également les travaux réalisés
par Drabo et al. (2017) qui ont montré les
propriétés adulticides des HE de C. citratus et O.
americanum sur des populations de Bemisia tabaci, confirmant
ainsi l'efficacité de ces HE sur une large gamme d'insectes.
En effet, parmi les HE testées, celle de L.
multiflora a été la plus efficace sur les adultes des deux
souches de An. gambiae testées, suivie de l'HE de C.
nardus. L'HE de E. camaldulensis a été la moins
efficace. Il est intéressant de noter que l'HE de L. multiflora
peut constituer une bonne alternative au regard de la mortalité
à la concentration 1% qui atteignait 96,88% et 85%, respectivement sur
les souches résistantes de An. gambiae collectée
à VK et de Ae. aegypti collectées à
Bobo-Dioulasso. L'efficacité de l'HE de L. multiflora dans la
présente étude a été significativement
supérieure à celles des HE de Lantana camara, Hyptis
spicigera, Hyptis
Thèse de Doctorat unique - 87
-
suaveolens évaluées sur des souches de
An. gambiae, Kisumu et VK dans les travaux de Wangrawa et al.
(2018).
La différence relative de l'efficacité entre les
HE testées dans nos travaux pourrait s'expliquer par leur composition
chimique. En effet, plusieurs études antérieures ont
montré que les composés majeurs étaient le facteur
responsable de la bio-activité d'une HE, car ils constitueraient la
partie la plus importante des composés totaux de l'HE (Lucia et al.,
2007 ; Gbolade et Lockwood, 2008 ; Vani, Cheng et Chuah, 2009). Ainsi,
l'efficacité de l'HE de L. multiflora peut être due
à ses principaux composés qui sont le
ß-caryophyllène, le p-cymène, l'acétate de thymol et
le 1,8 cinéol. En effet, selon des études antérieures
réalisées par Bassolé et al. (2003), la
toxicité de l'HE de L. multiflora sur les larves de An.
gambiae et de Ae. aegypti est due à la présence de
trois composants majeurs : le thymol, le p-cymène et l'acétate de
thymol. L'HE de Hyptis suaveolens contenant également du
â-caryophyllène et 1,8 cinéol (Peerzada, 1997) a une
activité insecticide élevée (Ilboudo et al.
2010). Ainsi, l'activité insecticide élevée de l'HE
de L. multiflora a été attribuée au
â-caryophyllène et au 1,8 cinéol qui sont des
composés majeurs dans l'étude actuelle. Cependant, la faible
activité insecticide de l'HE de E. camaldulensis peut
être expliquée par l'absence de â-caryophyllène, dans
la mesure où cette HE était riche en 1,8 cinéol.
Également, l'HE de C. nardus a montré un effet
adulticide intermédiaire sur les populations de An. gambiae
testées contrairement à ce qui a été
trouvé par Zulfikar, Aditama et Sitepu (2019). Selon ces auteurs,
l'activité la plus élevée de C. nardus est due
à la présence de géraniol, le même composé
trouvé dans C. nardus testé dans notre étude.
D'autres études antérieures ont rapporté
que les propriétés insecticides de l'HE de O. americanum
est dues aux composés 1,8-cinéole, camphre et
á-pinène trouvés dans cette HE (Koul, Walia et Dhaliwal,
2008). Ces composés ont été les mêmes que ceux
trouvés dans l'HE de O. americanum testée dans la
présente étude et pour lesquels nous avons obtenu la faible
efficacité. Selon Ntonga et al. (2017), le 1,8-cinéole
contribue fortement à l'efficacité de l'HE de Callistemon
citrinus contre les adultes femelles de An. coluzzii. Cependant,
l'HE de E. camaldulensis, riche en 1,8-cinéole, était la
moins efficace sur les adultes femelles de Ae. aegypti. Cette faible
efficacité peutt être due à l'absence du composé
sabinène parmi les principaux composés de l'HE de E.
camaldulensis. En effet, Liu et al. (2020) ont rapporté
qu'il y a un effet additif entre le 1,8-cinéole et le sabinène
sur Sitophilus oryzae, un ravageur du riz.
Thèse de Doctorat unique - 88
-
Les HE qui ont été moins efficaces comme
adulticides dans la présente étude pourraient être
efficaces comme répulsifs. En effet, des études
précédentes ont montré l'effet répulsif de ces HE
sur les moustiques (Ojewumi, Adeyemi et Ojewumi, 2018 ; Gnankiné et
Bassolé, 2017 ; Bossou et al., 2013). Les valeurs de KDT de ces
HE principalement à la concentration de 1% peut justifier cette
propriété répulsive mise en évidence par
l'activité excito-répulsive.
Si la préexposition des moustiques au PBO peut
restaurer totalement ou partiellement la susceptibilité aux
pyréthrinoïdes (Hien et al., 2021), il est fort probable
que l'efficacité d'une HE peut être améliorée par
ses combinaisons avec d'autres HE. Dans la présente étude, cette
amélioration a été mise en évidence par les valeurs
KDT, CL50, CL99 et les mortalités obtenues avec certaines combinaisons
qui ont été supérieures à celles des HE
testées seules. En termes d'efficacité après l'HE de
L. multiflora, les HE de C. nardus et O. americanum
ont donné des taux de mortalités relativement
élevées. C'est pourquoi, dans cette étude, nous avons
examiné les effets de leurs combinaisons à travers des
concentrations binaires.
En effet, les combinaisons qui ont été plus
efficaces que les HE de C. nardus et O. americanum
testées individuellement étaient C6, C8 et C9 sur les
populations de An. gambiae et, et C8 sur Ae. aegypti. Cela
peut etre dû à l'effet toxique simultané des
composés des HE combinées. Ceci est en accord avec les travaux de
Bekele et Hassanali (2001) et de Pavela (2014) qui ont rapporté que
l'activité biologique des HE dépend non seulement de leur
composition qualitative, mais aussi du rapport quantitatif de leurs composants.
On peut penser que l'HE de C. nardus a besoin d'une certaine
quantité des principaux composés de l'HE de O. americanum
pour être plus efficace. Inversement, l'HE de O. americanum
a besoin de certains constituants de l'HE de C. nardus pour agir
efficacement. En effet, des études ont montré que l'ajout d'un
peu de citronellal renforce l'effet du mélange citral-myrcène
contre Ae. aegypti. Cependant, le citronellal seul ne peut pas
réduire de manière significative le comportement de recherche
d'hôte des moustiques (Hao et al. 2008).
L'amélioration de l'efficacité par les
combinaisons des 2 HE peut être expliquée par l'effet toxique
combiné des principaux composés. En effet, des études ont
montré que la toxicité des HE est due aux effets combinés
de différents composants, avec ou sans action toxique individuelle
significative contre les insectes (Tanprasit, 2005 ; Park et al.
2011). Selon Burt (2004), les HE individuelles contiennent des composants
complexes qui, lorsqu'ils sont combinés entre eux, peuvent
entraîner des effets indifférents, additifs, synergiques ou
antagonistes. Dans
Thèse de Doctorat unique - 89
-
une étude antérieure, Abbassy, Abdelgaleil et
Rabie (2009) ont rapporté que dans certains cas, l'HE entière
peut avoir une activité insecticide plus élevée que ses
composants majeurs isolés. Pour ces auteurs, les composés mineurs
sont essentiels pour l'activité et peuvent permettre un effet synergique
ou une influence potentielle. A partir de ces informations, nous pouvons dire
que les combinaisons qui ont montré un effet synergique ou additionnel
auraient comme composés majeurs, d'une part certains composés
majeurs de l'HE de C. nardus et d'autre part ceux de l'HE de O.
americanum, mais aussi une variété de composés
mineurs.
Des études précédentes ont montré
que la bio-activité de l'HE est une conséquence de l'interaction
entre les composants majeurs, mais aussi d'autres composés,
éventuellement des oligoéléments. Cela peut être
dû à des effets combinés, à une action additive
entre les classes chimiques et à une synergie ou à un antagonisme
(Bassolé et al., 2003 ; Chiasson et al., 2001 ; Luz et
al., 2020). En général, il semble que l'effet d'un
composé actif puisse être renforcé par d'autres
composés majeurs et/ou stimulé par des composés mineurs
pour donner des effets additifs ou synergiques (Deletre et al., 2015).
Par conséquent, selon Berenbaum et Neal (1985), les composants mineurs
présents en faibles pourcentages peuvent agir comme des synergistes,
améliorant la bio-efficacité des composants majeurs par divers
mécanismes. En effet, des combinaisons de 1,8-cinéole et de
citronellal ainsi que de plusieurs composés mineurs et de citronellal
ont donné des effets synergistes sur les larves de Spodoptera
littoralis (Pavela, 2014).
Selon Hyldgaard, Mygind et Meyer (2012), chaque composé
d'une HE avait un mode d'action spécifique, mais ces composés
pouvaient interagir avec les composés d'une autre HE dans une
combinaison pour donner d'autres modes d'action. Ainsi, la combinaison de
composés avec différents modes d'action pourrait augmenter les
actions létales totales dans les mélanges (Sarma et al.,
2019).
Il est intéressant de noter que seules les combinaisons
C8 et C9 ont fourni un effet synergiste respectivement sur les populations
résistantes de Ae. aegypti et de An. gambiae. L'effet
synergiste obtenu par cette combinaison peut également s'expliquer par
l'action simultanée des principaux composés. De plus, cet effet
synergiste peut être dû à l'apparition de nouveaux
composants qui n'existaient pas dans les HE individuelles (Muturi et al.,
2017; Wangrawa et al., 2022b). Des études
antérieures ont montré que certaines HE ou leurs composés
peuvent interagir pour créer un effet synergiste à certains
ratios et un effet antagoniste à d'autres ratios (Intirach et al.,
2012; Pavela, 2015).
3- 2-5. Conclusion partielle
Notre étude a examiné les
propriétés adulticides des huiles essentielles de cinq (5)
espèces de plantes traditionnellement utilisées au Burkina Faso,
Cymbopogon nardus, Cymbopogon citratus, Eucalyptus camaldulensis, Lippia
multiflora et Ocimum americanum, et des combinaisons de deux (2)
de ces HE contre les adultes de moustiques de Anopheles gambiae,
vecteur du paludisme et de Aedes aegypti, vecteur de la dengue au
Burkina Faso. Les HE de Cymbopogon nardus et Ocimum americanum
ont été moins toxiques, mais leurs toxicités ont
été améliorées par leurs combinaisons, à
certaines proportions. L'HE de L. multiflora et les combinaisons de C9
(Cn 90% : Oa 10%), C8 (Cn 80% : Oa 20%), C6 (Cn 60% : Oa 40%) et dans une
moindre mesure (Cn 20% : Oa 80%) peuvent être des alternatives
prometteuses dans les stratégies de contrôle contre les adultes de
Ae. aegypti, le vecteur de la dengue et de An. gambiae,
vecteur du paludisme.
Pour une valorisation de ces HE testées, il serait bon
d'examiner leur activité excito-répulsive sur les deux
populations de moustiques, comme c'est le cas des pyréthrinoïdes
qui malgré la présence de résistance vis-à-vis de
certains insectes, peuvent procurer une activité excito-repulsive ou
irritante qui peuvent être exploitée dans les stratégies de
lutte antivectorielle.
Thèse de Doctorat unique - 90
-
Thèse de Doctorat unique - 91
-
Chapitre 3 : Activité excito-répulsive de
cinq huiles essentielles extraites de plantes locales contre les vecteurs de la
dengue et du paludisme au Burkina Faso
3- 3-1. Introduction partielle
Dans les chapitres précédents, nous avons
expliqué le contexte qui a motivé l'utilisation des huiles
essentielles comme insecticides alternatifs ou complémentaires. Vu que
l'homme n'est pas permanemment sous les MILDA et surtout que certains
moustiques ont des activités diurnes (Ae. aegypti), il est donc
nécessaire de chercher des outils de protection individuelle tels que
les répulsifs. Les répulsifs sont des produits qui agissent
localement ou à distance afin d'empêcher un arthropode de se poser
sur la peau d'un homme ou d'un animal (ou sur toute autre surface en
général), de voler vers lui ou de le piquer (Boulanger et
Gentile, 2012).
Des études ont montré que la perméthrine
et le DEET, deux produits chimiques, sont des répulsifs (Badolo et
al., 2004; Deletre et al., 2019; Achee et al.,
2009). D'autres études ont montré des pouvoirs répulsifs
des plantes productrices d'HE sur les espèces d'arthropodes nuisibles
(Deletre et al., 2013, 2016; Tawatsin et al., 2001; Gillij,
Gleiser et Zygadlo, 2008; Omolo et al., 2004; Oyedele et al.,
2002) et les propriétés de dissuasion de l'alimentation des
moustiques (Hummelbrunner et Isman, 2001; Moretti, Zerba et Alzogaray,
2013).
Cinq phénomènes répulsifs ont
été identifiés par Deletre et al. (2016) :
répulsion-expulsion, répulsion-masquage,
répulsion-irritation, répulsion-anti-appétence et
répulsion visuelle. Un répulsif-expulsion est une substance qui
agit à distance, faisant fuir l'insecte du stimulus (Bernier et al.,
2006; Nerio, Olivero-Verbel et Stashenko, 2009 ; Nolen et
al., 2002). Un répulsif masquant est défini comme un
inhibiteur volatil qui empêche la recherche et la localisation de
l'hôte (OMS, 2013b). Un répulsif irritant appelé
«inhibiteur d'atterrissage» selon l'OMS (Koul, Walia et Dhaliwal,
2008), provoque un mouvement de fuite du stimulus après un contact
physique avec celui-ci (Deletre et al., 2016). Les répulsifs
anti-appétant agissent sur le comportement alimentaire de l'insecte en
l'empêchant, l'interrompant ou l'interférant (Schoonhoven et Van,
2002).
Bien que de nombreuses études aient été
menées sur les propriétés des HE au Burkina Faso, peu
d'études ont été menées sur les
propriétés répulsives des HE sur les moustiques encore
moins sur les activités répulsives-irritantes au Burkina Faso.
Thèse de Doctorat unique - 92
-
Dans ce chapitre, nous présenterons les principaux
résultats des tests répulsifs d'irritation de contact des HE de
cinq plantes (Cymbopogon citratus, Cymbopogon nardus, Eucalyptus
camaldulensis, Lippia multiflora et Ocimum americanum), du DEET
(N, N-diethyl-3-methylbenzamide) et de la perméthrine, deux (2)
témoins positifs, réalisé sur des souches de Ae.
aegypti collecté à Bobo-Dioulasso et de An. gambiae
de la Vallée du Kou.
3- 3-2. Méthodologie : test
répulsif-irritant par contact
La technique d'imprégnation des papiers Whatman avec HE
a été décrite par Balboné et al. (2022b).
La procédure de test répulsif irritant de Grieco et al.
(2005) mise en place pour Ae. aegypti a été
adaptée pour An. gambiae (Figure 26). Pour ce test, trois (3)
concentrations ont été testées : 0,1%, 0,5% et 1%. Ces
concentrations ont été retenues après des tests
préliminaires. Pour chaque concentration et le témoin
(acétone pur), 3 lots de 20 moustiques ont été
testés. En effet, des lots de 20 moustiques femelles non nourris au sang
et âgés de 3 à 7 jours ont été aspirés
(Figure 28A) puis introduits dans trois tubes contenant du papier
imprégné (Tube rouge) (Figure 27A). Ensuite, chaque tube
«imprégné» contenant des moustiques a été
fixé sur un tube de contrôle (Tube vert) contenant du papier
neutre (Figure 27B). Après 30 secondes d'exposition (Figure 28B), le
tiroir séparant le tube imprégné du tube neutre (contenant
le papier neutre) a été ouvert (Figure 27C). Les moustiques ont
ensuite été laissés libres pendant 10 minutes. Les
moustiques passant du tube imprégné au tube neutre étaient
considérés comme «échappés». A l'inverse,
les moustiques qui restaient dans le tube imprégné étaient
considérés comme des moustiques «restés».
Après la fermeture du tiroir, on a compté le nombre de moustiques
«échappés» et «restés» dans chaque
tube (Figure 28C). Parmi les moustiques «restés», certains ont
été assommés.
Pour le témoin, les moustiques ont été
mis dans un tube neutre qui a été fixé sur un autre tube
neutre. Le test est validé lorsque la proportion de moustiques
«échappés» dans le témoin a été
inférieure à 50%.
L'effet répulsif-irritant de contact d'un produit a
été évalué sur la base de la proportion de
moustiques qui s'échappent. Les moustiques assommés ont
été enregistrés. Le DEET et la perméthrine ont
été utilisés comme témoins positifs.
Les proportions du nombre de moustiques
«échappés» ont été comparées par
paire avec le témoin par le test de Fisher et corrigées avec la
méthode de Bonferroni-Holm. Un modèle linéaire
généralisé (distribution binomiale) a
été étudié pour connaître l'effet du produit,
de la concentration et de l'interaction concentration-produit (dose
dépendante) sur l'effet irritant sur le moustique. Enfin, une
classification ascendante hiérarchique a été
effectuée pour classer les extraits de plantes.

Figure 26: Dispositif de Grieco et al. (2005)
adapté à Anopheles gambiae (Deletre et al. 2013)
A : Séquence de test ; B : Photo du
dispositif
(1) : un papier filtre (12*15cm) est
traité avec 2mL de solution ; (2) : le papier est
placé dans le tube traité ; (3) : les moustiques
sont introduits dans le tube traité ; (4) : la porte
est ouverte après 30s d'acclimatation ; (5) : les
moustiques sont laissés libres pendant 10 min ; (6) :
après fermeture de la porte, le nombre de moustiques
échappés est calculé.
Thèse de Doctorat unique - 93
-

p to osy o t e Rrc
pour e Déve oppement ntpe
Figure 27: Présentation des tubes OMS
(OMS 2022b) (A : Tube rouge, B : Tube vert,
C : Tube
o
rouge fixé au tube vert.)
St 2 Mito

Am C
Bub
Figure 28: Déroulement des tests
répulsifs irritants de contact
Transfer mosquitoes into the holdng tubes
A : Aspiration des moustiques femelles de 3
à 7 jours non gorgés ; B : Les moustiques libres
dans
Provide them access to a water-sugar
le tube contenant les papiers imprégnés
après l'ouverture du tiroir ; C : Dénombrement
des
solution. Read mortality at the end of the 2h
moustiques échappés (Cliché
Balboné, 2020)
Thèse de Doctorat unique - 94
-
Thèse de Doctorat unique - 95
-
3.3.3. Résultats
L'effet répulsif irritant de contact a
été différent selon la souche de moustique et le produit
testé. De plus, il a été dose-dépendant.
Globalement, chez les populations de An. gambiae, les HE
testées ont montré un effet irritant de contact (taux
d'échappement supérieur à 30%). Ce qui n'a pas
été le cas avec les populations de Ae. aegypti. Les HE
des cinq extraits de plantes ainsi que les deux produits chimiques
synthétiques, le DEET et la perméthrine, ont montré des
effets irritants de contact significatifs à de faibles concentrations
pour les HE et à des concentrations élevées pour les
produits chimiques (Figures 29 et 32). Dans toutes les populations de
moustiques testées, la classification ascendante hiérarchique
(CAH) est résumée en 3 classes en fonction de la
similarité de la réponse comportementale du moustique (Figures
29-32).
3.3.3.1. Réponses comportementales avec les
populations de Anopheles gambiae
Sur la souche sensible de An. gambiae
«Kisumu», la classe 1 est constituée de l'HE de C.
citratus et le DEET présentant des taux d'échappés
légèrement supérieurs à 50 % à la
concentration la plus faible (0,1 %) et des taux d'échappés,
respectivement de 84,63 et 85 % à la concentration de 0,5 % (Figure 29).
À la concentration la plus élevée, l'HE de C. citratus
a été moins répulsif-irritante (31,16 % de taux
d'échappés) par rapport au DEET (56 % de taux
d'échappés), tandis que les effets knock-down (KD) ont
été élevés chez les moustiques restants (Tableau
XVII).
La classe 2 a été constituée par les HE
de C. nardus et O. americanum qui ont été
significativement plus répulsif-irritantes à faible concentration
avec une efficacité décroissante avec la concentration et leurs
activités diminuaient avec l'augmentation de la concentration (60,05 et
51,88% à la concentration 0,1%, 32,27 et 40,53% à 0,5%, 19,76 et
36,82% à 1%, respectivement pour C. nardus et O.
americanum). En même temps, ces deux HE ont produit des effets KD
croissants en fonction de la concentration du produit au niveau des moustiques
restés (Tableau XVII). La classe 3 a été constituée
par les HE de E. camaldulensis, de L. multiflora et la
perméthrine qui ont été les produits les moins irritants
à la faible concentration (taux d'échappement inférieur
à 45 % à la concentration de 0,1 %) mais les activités de
l'HE de E. camaldulensis et de la perméthrine ont varié
en fonction de la concentration du produit (taux d'échappement compris
entre 52,3 et 69,72%, 58,33 et 78,84 %, respectivement aux
Thèse de Doctorat unique - 96
-
concentrations de 0,5 et 1%). L'HE de L. multiflora a
produit des effets KD plus élevés que les 2 autres et cet effet
KD augmentait avec la concentration (Tableau XVII).
Sur la souche de An. gambiae de terrain VK, la classe
1 a regroupé l'HE de C. citratus et le DEET qui ont
été répulsif-irritants dès la faible concentration
avec une efficacité qui augmentait avec la concentration. La classe 2 a
été constituée par les HE de C. nardus, L.
multiflora et O. americanum qui ont présenté une
activité décroissante de la faible à la forte
concentration. Au même moment, l'HE de C. nardus a produit des
effets KD qui augmentaient avec la concentration (taux KD = 29,46% à
0,1%, 32,33% à 0,5% et 37,62% à 1%). D'autre part, l'HE de L.
multiflora a produit des effets KD élevés. La classe 3 a
été constituée de l'HE de E. camaldulensis et de
la perméthrine qui n'ont pas été
répulsif-irritantes à faible concentration mais sont devenues
plus répulsif-irritantes lorsque la concentration augmentait (Figure
30).
Hormis l'HE de L. multiflora, toutes les HE
testées ont été plus répulsif-irritantes sur la
souche VK que sur la souche Kisumu à la concentration la plus
élevée, 1% (Figures 29 et 30). Car sur la souche Kisumu, l'effet
KD a été plus perçu.
Tableau XVII: Taux de KD obtenus parmi les
moustiques qui ne se sont pas échappés
|
Traitements
|
|
Anopheles gambiae
|
Aedes aegypti
|
|
Kisumu
|
VK
|
Bora Bora
|
Bobo-Dioulasso
|
|
Concentrations
|
KD (%)
|
KD (%)
|
KD (%)
|
KD (%)
|
|
Cymbopogon
|
0,1
|
1,67
|
0
|
3,03
|
0
|
|
citratus
|
0,5
|
5
|
0
|
0
|
0
|
|
1
|
76,93
|
6,25
|
16,67
|
0
|
|
Cymbopogon
|
0,1
|
25
|
0
|
3,14
|
0
|
|
nardus
|
0,5
|
75,84
|
32,33
|
34,81
|
15,74
|
|
1
|
80,24
|
37,62
|
71,73
|
44,09
|
|
Eucalyptus
|
0,1
|
0
|
0
|
0
|
0
|
|
camaldulensis
|
0,5
|
0
|
0
|
0
|
0
|
|
1
|
0
|
0
|
0
|
0
|
|
Lippia
|
0,1
|
29,46
|
5,37
|
18,43
|
3,33
|
|
multiflora
|
0,5
|
32,85
|
49,61
|
76,94
|
20,1
|
|
1
|
49,58
|
68,43
|
87,75
|
61,55
|
|
Ocimum
|
0,1
|
3,45
|
0
|
0
|
0
|
|
americanum
|
0,5
|
8,4
|
0,33
|
2,5
|
0
|
|
1
|
19,41
|
3,03
|
3,33
|
0
|
|
DEET
|
0,1
|
3,18
|
0
|
0
|
0
|
|
0,5
|
5
|
0
|
4,85
|
0
|
|
1.
|
10
|
18,98
|
41,06
|
0
|
|
Permethrin
|
0,1
|
0
|
0
|
0
|
0
|
|
0,5
|
8,33
|
0
|
3,33
|
0
|
|
1
|
26,67
|
5,33
|
29,46
|
0
|
KD: Knock down
Thèse de Doctorat unique - 97
-
|
|
|
Treatments 0.1%
|
0.5%
|
1%
|
P-value2
|
|
C. nardus 60.05
(58.65-61.45)
51.88
O. americanum
(50.48-53.28)
|
32.27
(30.85-33.69)
40.53
(39.11-41.95)
|
19.76
(18.34-21.18)
36.82
(35.40-38.24)
|
<
<
|
0.0001
0.0001
|
|
|
C1
|
|
|
|
|
C. citratus 50.95
(49.55-52.35)
DEET 58.18
(56.78-59.58)
|
84.63
(83.21-86.05)
85
(83.58-86.42)
|
31.16
(29.74-32.58)
56.48
(55.22-57.73)
|
<
<
|
0.0001
0.0001
|
|
C3
|
|
|
|
|
|
|
|
|
22.28
E. camaldulensis
(20.88-23.68)
39.9
L. multiflora
(38.5-41.30)
Permethrin 43.5
(42.1-44.9)
|
69.72
(68.30-71.14)
63.72
(62.30-65.14)
52.3
(50.88-53.72)
|
78.84
(77.42-80.26)
58.33
(56.91-59.75)
67.3
(65.88-68.72)
|
<
<
<
|
0.0001
0.0001
0.0001
|
|
|
|
|
|
|
|
|
|
|
|
|
KIS
|
|
8
|
6 4 2
Dissimilarity
|
0
|
Figure 29: Taux d'échappés des
femelles de la souche sensible de Anopheles gambiae «Kisumu»
aux 5 HE, au DEET et à la perméthrine et, le dendrogramme
représentant les réactions comportementales obtenues par le
regroupement hiérarchique de ces insecticides selon leurs effets
irritants de contact. (Les intervalles de confiance ont été
calculés par la méthode de Wald).
|
C1
|
|
Treatments
|
0.1%
|
0.5%
|
1%
|
P-value2
|
|
C. citratus
|
40.32
(39.08-41.56)
|
80.11
(78.85-81.37)
|
93.75
(92.49-95.01)
|
< 0.0001
|
|
|
|
DEET
|
50.7
|
87.96
|
90
|
|
|
|
|
|
(49.46-51.94)
|
(86.70-89.21)
|
(88.58-91.42)
|
< 0.0001
|
|
|
|
|
|
|
|
|
|
|
|
E. camaldulensis
|
28.97
|
52.53
|
76,36
|
|
|
|
|
C3
|
|
(27.73-30.21)
|
(51.27-53.78)
|
(75,10-77,61)
|
< 0.0001
|
|
|
|
|
Permethrin
|
17.5
|
39.8
|
55.56
|
|
|
|
|
|
|
|
(16.26-18.74)
|
(38.54-41.05)
|
(54.3-56.81)
|
< 0.0001
|
|
|
|
|
C.
nardus
|
54,1
(52,86-55,34)
|
57,55
(56,29-58,81)
|
50.74
(49.48-51.99)
|
< 0.0001
|
|
|
|
|
|
|
|
|
|
|
|
|
|
L. multiflora
|
37,78
(36,54-39,02)
|
45,66
(44,40-46,91)
|
24.44
(23.18-25.69)
|
< 0.0001
|
|
|
|
|
|
|
|
|
|
O. americanum
|
37.7
(36.46-38.94)
|
38.49
(37.23-39.74)
|
48.78
(47.52-50.03)
|
< 0.0001
|
|
10 8 6 4 2 0
VK
Dissimilarity
Figure 30: Taux d'échappés des
femelles de la souche de terrain de Anopheles gambiae «VK»
aux 5 HE, au DEET et à la perméthrine et, le dendrogramme
représentant les réactions comportementales obtenues par le
regroupement hiérarchique de ces insecticides selon leurs effets
irritants de contact. (Les intervalles de confiance ont été
calculés par la méthode de Wald).
Thèse de Doctorat unique - 98
-
Thèse de Doctorat unique - 99
-
3- 3-3.2. Réponses comportementales avec les
populations de Aedes aegypti
Pour la souche sensible de Ae. aegypti Bora Bora, le
groupe de classe 1 a été constituée par les HE de C.
citratus, E. camaldulensis, O. americanum et le DEET qui ont donné
des taux d'échappés croissant avec la concentration, sauf l'HE de
O. americanum et le DEET (Figure 31). Tous les produits de cette
classe ont produit des effets KD faibles (Tableau XVII).
La classe 2, constituée des HE de C. nardus et
de L. multiflora, a regroupé les produits dont les effets
irritants ont été décroissants à mesure que la
concentration augmentait. Par contre, ils ont produit des effets KD
élevés et croissants avec la concentration. Pour la classe 3, la
perméthrine n'a présenté aucun effet
répulsif-irritant à faible concentration (0,1 % et 0,5 %) mais
elle est devenue répulsif-irritante à la concentration (1 %)
(Tableau XVII).
Pour la souche de Ae. aegypti de Bobo-Dioulasso, la
classe 1 a été constituée par les HE C. citratus,
E. camaldulensis, O. americanum, le DEET et la perméthrine qui
ont présenté des effets répulsif-irritants faibles (taux
d'échappé inférieur à 50 %) à la
concentration de 1% même si leurs effets répulsif-irritants
augmentent avec la concentration. (Figure 32). Ces substances ont produit de
très faibles effets KD. La classe 2 a été
constituée de l'HE de C. nardus qui a été la plus
répulsif-irritante à la plus faible concentration (72,22 % de
taux d'échappés à la concentration de 0,1 %), mais cette
activité diminuait au fur à mesure que la concentration
augmentait. Inversement, cette HE a produit des effets KD élevés
lorsque la concentration augmente. La classe 3 a été
constituée de l'HE de L. multiflora qui a été
plus répulsif-irritante à des concentrations plus
élevées (taux d'échappés de 52,79 et 58,79,
respectivement aux concentrations de 0,5 et 1%) ; son activité
augmentait avec la concentration (Figure 32). De plus, cette HE a produit des
effets KD qui augmentaient avec la concentration (Tableau XVII).
Aux faibles concentrations, l'HE de C. nardus a
produit des effets répulsifs de contact les plus élevés
sur toutes les souches de Ae. aegypti (Figure 32). Les effets de cette
HE ont été significativement supérieurs à ceux du
DEET et de la perméthrine.
Thèse de Doctorat unique - 100
-
|
|
|
0.1%
|
0.5%
|
1%
|
P-value2
|
|
C. nardus
|
68.8
(67.82-69.78)
57.35
(56.37-58.33)
|
31,99
(31-32,98)
43.33
(42.34-44.32)
|
31.39
(30.4-32.38)
33.39
(32.4-34.38)
|
< 0.0001
< 0.0001
|
|
C3
|
|
|
L. multiflora
|
|
|
|
Permethrin
|
12.4
(11.42-13.38)
|
29.2
(28.21-30.19)
|
41.7
(40.71-42.69)
|
< 0.0001
|
|
|
|
|
|
|
61.51
(60.53-62.49)
40.61
(39.63-41.59)
32.91
(31.93-33.89)
33.99
(33.01-34.97)
|
54.4
(53.41-55.39)
60.38
(59.39-61.37)
51.11
(50.12-52.1)
35.97
(34.98-36.96)
|
48.51
(47.52-49.5)
44.09
(43.1-45.08)
57.17
(56.18-58.16)
53.08
(52.09-54.07)
|
< 0.0001 < 0.0001 < 0.0001 < 0.0001
|
|
|
O. americanum
|
|
DEET
|
|
C1
|
|
|
C.
citratus
|
|
|
|
E. camaldulensis
|
|
|
|
8 7 6 5 4 3 2 1 0
|
Bora Bora
|
|
Dissimilarity
|
|
Figure 31: Taux d'échappés des
femelles de la souche sensible de Aedes aegypti «Bora Bora»
aux 5 HE, au DEET et à la perméthrine et, le dendrogramme
représentant les réactions comportementales obtenues par le
regroupement hiérarchique de ces insecticides selon leurs effets
irritants de contact. (Les intervalles de confiance ont été
calculés par la méthode de Wald).
|
|
0.1%
|
0.5%
|
1%
|
P-value2
|
|
|
59.61
(58.47-60.75)
|
15.25
(14.11-16.39)
|
< 0.0001
|
|
C3
|
|
|
C. nardus 72.22
(71.09-73.35)
|
|
|
52.79
(51.65-53.93)
|
58.79
(57.65-59.93)
|
< 0.0001
|
|
|
|
L. multiflora 44.76
(43.63-45.89)
|
|
|
Permethrin
|
21.66
(20.52-22.80)
37.26
(36.12-38.40)
27.01
(25.87-28.15)
34.81
(33.67-35.95)
31.81
(30.67-32.95)
|
35.8
(34.66-36.94)
42.99
(41.85-44.13)
37.4
(36.26-38.54)
39.92
(38.78-41.06)
38.1
(36.96-39.24)
|
< 0.0001 < 0.0001 < 0.0001 < 0.0001 < 0.0001
|
|
C1
|
|
7.42
(6.29-8.55)
O. americanum 26.1
(24.97-27.23)
20
C. citratus (18.87-21.13)
22.92
E. camaldulensis (21.79-24.05)
18.61
DEET (17.48-19.74)
|
|
|
12 10 8 6 4 2
Dissimilarity Bobo-Dsso
Figure 32: Taux d'échappés des
femelles de la souche de terrain de Aedes aegypti
«Bobo-Dioulasso» aux 5 HE, au DEET et à la
perméthrine et, le dendrogramme représentant les réactions
comportementales obtenues par le regroupement hiérarchique de ces
insecticides selon leurs effets irritants de contact. (Les intervalles de
confiance ont été calculés par la méthode de
Wald).
Thèse de Doctorat unique - 101
-
3- 3-4. Discussion
Le contrôle des maladies à transmission
vectorielle passe par une approche qui implique une protection personnelle
contre les piqûres de moustiques (Debboun et Strckman, 2012). Cette
approche utilise des répulsifs commerciaux qui sont principalement
basés sur le DEET (N, N-diethyl-3-methylbenzamide) (Badolo et
al., 2004; Calafat et al., 2012). Cependant, le DEET peut avoir
des effets secondaires nocifs (Briassoulis, Narlioglou et Hatzis, 2001; Clem,
Havemann et Raebel, 1993) et semble être toxique. Il est donc urgent
d'évaluer l'effet d'autres répulsifs ou ingrédients
irritants, en particulier les HE qui possèdent des
propriétés répulsives, irritantes et toxiques sur les
moustiques. Ici, les propriétés répulsif-irritantes de
contact des HE de Cymbopogon citratus, Cymbopogon nardus,
Eucalyptus camaldulensis, Lippia multiflora et Ocimum
americanum ont été mesurées, en utilisant le
procédé de Grieco et al. (2005), sur des populations
de Anopheles et de Aedes, respectivement de Bobo-Dioulasso et
de la «Vallée du Kou» où la résistance aux
pyréthrinoïdes était répandue.
Dans la présente étude, l'exposition des
moustiques aux 5 HE a montré des degrés variables
d'activité irritante par contact de ces HE. L'effet irritant d'un
produit pourrait être dû à son action sur le système
nerveux par l'intermédiaire des tarses des insectes (White, 2007).
Certains composés individuels des HE sont clairement
détectés et évités par les moustiques grâce
à leurs antennes. Pourtant, l'influence physiologique des HE conduisant
à la répulsion reste largement inconnue (Dekker et al.,
2011; Ramirez et al., 2012).
En effet, l'HE de L. multiflora s'est
avérée moins répulsif-irritante sur les deux souches de
An. gambiae et sur la souche sensible de Ae. aegypti
«Bora Bora», surtout aux concentrations les plus
élevées. Cependant, des études précédentes
ont montré les propriétés répulsives par irritation
du â-caryophyllène et du p-cymène (Nararak et al.,
2019; Ndirangu, Opiyo et Ng'ang'a, 2020; Azeem et al. 2019), 2
composés majeurs de l'HE de L. multiflora qui a
été testée dans la présente étude. Cette
faible activité irritante de l'HE de L. multiflora est en
accord avec son effet «knockdown» élevé (90, 88,24 et
87,88 % KD à une concentration de 1%, respectivement pour Kisumu, VK et
Bora Bora) qui a empêché les moustiques de s'échapper. De
même, dans d'autres études récentes, cette HE a
donné des effets KD élevés sur les mêmes populations
de Ae. aegypti et An. gambiae (Balboné et
al., 2022b, 2022c). En plus de son effet toxique montré
récemment par Balboné et al. (2022a, 2022b, 2022c), l'HE
de L. multiflora a exercé un effet irritant sur les
Thèse de Doctorat unique - 102
-
populations de Ae. aegypti. Cela s'avérerait
intéressant dans le cadre de son utilisation dans les stratégies
de lutte antivectorielle.
Dans la plupart des cas, l'HE de C. citratus dont les
activités irritantes sont proches de celles du DEET, a eu un effet
irritant significatif à faible concentration sur les 2 souches de
An. gambiae, alors que sur la souche sensible de Ae. aegypti
Bora Bora, elle a été efficace à forte concentration.
Nos résultats corroborent ceux de Deletré et al. (2013)
qui ont également montré des effets répulsifs irritants de
l'HE de C. citratus sur An. gambiae. Selon ces auteurs,
l'effet irritant était dû à la présence de
géranial, néral et l'activité de cette HE augmentait avec
la concentration.
L'effet répulsif-irritant obtenu avec les HE de C.
citratus et aussi de C. nardus serait facilité par le
grand nombre de moustiques non paralysés, connus pour produire de
faibles effets KD sur Ae. aegypti et An. gambiae
(Balboné et al., 2022b, 2022c). Selon ces auteurs, ces
deux HE testées récemment pour leur toxicité sur les
mêmes souches de moustiques ont donné des taux de mortalité
inférieurs à 5% et à 50% à la concentration de 1%,
respectivement pour l'HE de C. citratus et l'HE de C. nardus
confirmant ainsi leur faible toxicité (Balboné et
al., 2022b, 2022c).
Globalement, l'HE de O. americanum, une autre HE
moins toxique (Balboné et al., 2022b, 2022c), présente
un effet irritant de contact significatif sur les souches sensibles de Ae.
aegypti Bora Bora et de An. gambiae Kisumu. La
bio-activité irritante de contact relativement élevée de
l'HE de O. americanum pourrait être attribuée à
ses principaux composés, le 1,8 cinéole et le camphre. Des
études antérieures ont signalé que le 1,8 cinéole
et le camphre possédaient des effets répulsifs contre les
insectes, respectivement Blattella germanica et Sitophilus zeamais
(Cansian et al., 2015 ; Chooluck et al., 2019). De plus,
cette HE a eu de faibles effets KD à forte concentration. En outre,
certains auteurs ont montré dans leurs travaux que l'HE de O.
americanum a produit des effets KD plus élevés à
forte concentration sur les souches sensibles, Bora Bora et Kisumu, que sur les
souches de terrain de Ae. aegypti et de An. gambiae
collectées, respectivement à Bobo-Dioulasso et à VK
(Balboné et al., 2022b, 2022c). D'autre part, des études
menées en Guinée Bissau, Afrique de l'Ouest, avaient
rapporté que l'HE de O. americanum avait également un
effet répulsif sur les moustiques du genre Anopheles
(Pålsson et Jaenson 1999).
Les deux témoins positifs, le DEET et la
perméthrine, se sont également révélés
irritants. En effet, la perméthrine a montré un effet irritant de
contact légèrement élevé sur toutes les souches de
An. gambiae (Kisumu et VK) et un faible effet irritant de contact sur
toutes les
Thèse de Doctorat unique - 103
-
souches de Ae. aegypti (Bora Bora et Bobo-Dioulasso)
à toutes les concentrations, avec de faibles effets KD sur toutes les
souches des deux espèces de moustiques testés, par rapport aux HE
de C. nardus, L. multiflora et O. americanum. Nos
résultats sont similaires à ceux de Deletre et al.
(2013) qui ont montré que la perméthrine avait un faible effet
irritant de contact sur les populations résistantes de An. gambiae
à des concentrations élevées. On pourrait penser que
le faible pouvoir répulsif de la perméthrine serait dû
à la résistance accrue des moustiques aux insecticides chimiques.
Cependant, des études antérieures ont signalé que la
perméthrine peut encore être appliquée comme
répulsif contre les piqûres de moustiques dans de nombreux
endroits, même si la résistance aux pyréthrinoïdes
était répandue (Bowman et al., 2018). Alors, selon la
présente étude, il serait intéressant d'utiliser la
perméthrine comme un répulsif irritant au moins à la
concentration (0,5%).
Quant au DEET, il a été répulsif-irritant
pour toutes les souches de An. gambiae et a provoqué moins
d'effet KD. Ces résultats obtenus sont en accord avec ceux obtenus par
Deletre et al. (2013) qui ont montré que le DEET est irritant
à des concentrations élevées sur toutes les populations de
An. gambiae testées. Cependant, sur la souche de Ae.
aegypti de Bobo-Dioulasso, le DEET a été moins irritant que
toutes les HE testées et n'a pas provoqué de KD. Ces
résultats ne sont pas en accord avec ceux trouvés par Licciardi
et al. (2006) qui ont montré que le DEET donne un effet
répulsif-irritant significatif et provoque des KD à des
concentrations élevées. Cela pourrait s'expliquer par le fait que
nos concentrations étaient plus faibles que celles utilisées par
Licciardi et al. (2006). De plus, nos résultats montrent que le
DEET était plus irritant sur les souches de An. gambiae que sur
les souches de Ae. aegypti testées alors que des études
précédentes avaient montré des données contraires
(Travis 1947; Rutledge et al., 1983; Curtis et al., 1987;
Badolo et al., 2004). Cette contradiction pourrait être due aux
différents protocoles expérimentaux utilisés.
3- 3-5. Conclusion partielle
Toutes les huiles essentielles testées dans cette
étude ont montré des effets répulsifs-irritants. Sur
An. gambiae, les effets répulsifs irritants de contact des HE
de Cymbopogon citratus, Cymbopogon nardus et Eucalyptus
camaldulensis ont été très proches de ceux du DEET,
le répulsif de référence. Sur Ae. aegypti, toutes
nos HE ont des effets répulsifs-irritants supérieurs pour
certaines et très proches du DEET pour les autres. Les HE testées
dans la présente étude
pourraient être des répulsifs potentiels contre
les moustiques en tant qu'alternatives aux répulsifs
synthétiques, les pyréthroïdes et le DEET.
Thèse de Doctorat unique - 104
-
Thèse de Doctorat unique - 105
-
DISCUSSION GENERALE, CONCLUSION GENERALE ET
PERSPECTIVES
Thèse de Doctorat unique - 106
-
Cette étude s'inscrit dans le cadre
général de la recherche d'alternatives de lutte contre les
moustiques résistants aux pyréthrinoïdes. En effet, les
pyréthrinoïdes, insecticides de synthèse, constituent
jusqu'à présent les principaux insecticides dans la lutte contre
les maladies qui peuvent être transmises par piqûres de moustiques.
Cela, à cause de leurs propriétés qui permettent un
contrôle efficace de la transmission de ces maladies lorsqu'ils sont
utilisés en pulvérisations spatiales ou sur des moustiquaires
(Zaim, Aitio et Nakashima, 2000).
La recherche d'alternative aux pyréthrinoïdes est
un axe de recherche majeur depuis quelques années car l'usage massif des
pyréthrinoïdes à des fins de santé publique et
surtout en agriculture a entraîné la sélection de
moustiques résistants, ce qui compromet l'efficacité des
campagnes de LAV (Cohuet, 2020).
L'efficacité d'un insecticide repose sur sa
capacité à prévenir la piqûre de l'utilisateur ou
à tuer les moustiques vecteurs. Ainsi, les nouveaux insecticides
à base des HE qui sont utilisées comme alternative doivent avoir
des propriétés larvicides ou adulticides soit répulsives
pour assurer une bonne gestion de la résistance
pyréthrinoïdes. Nos objectifs opérationnels nous ont
amené à conduire des études au laboratoire avec des HE sur
des moustiques An. gambiae et Ae. aegypti. Dans cette partie
nous rappellerons et discuterons les principaux résultats obtenus avant
de développer les perspectives ouvertes par ce travail.
1. Discussion générale
1.1. Les huiles essentielles comme des
larvicides
A travers cette étude, nous avons mis en
évidence les propriétés larvicides des huiles essentielles
de cinq (5) plantes locales qui sont C. citratus, C. nardus, E.
camaldulensis, L. multiflora et O. americanum. Parmi ces
5 HE testées, l'HE de L. multiflora a été la plus
efficace sur les larves des souches de Aedes aegypti et de
Anopheles gambiae sensibles et résistantes aux insecticides de
synthèse. En effet, cette HE n'a pas présenté de
différence significative avec le pyriproxyfène, un larvicide de
référence (p = 0,86). Récemment, Yameogo et al.
(2021) et Wangrawa et al. (2022a) ont montré l'effet
toxique de l'HE de L. multiflora sur des populations de An.
gambiae, Ae. aegypti, An. funestus et Culex
quinquefasciatus. Aussi, excepté l'HE de E. camaldulensis,
toutes les autres HE ont montré une toxicité considérable.
Cette toxicité de ces HE a été rapportée par des
études antérieures (Dayananda et Ranaweera, 1996 ; Yaméogo
et al., 2021 ; Ntonga et al., 2014).
Thèse de Doctorat unique - 107
-
Les HE ont été plus toxiques sur les larves de
An. gambiae que sur celles de Ae. aegypti. Cependant, il y a
plus de 19 ans, Bassolé et al. (2003) ont rapporté que
les larves de Ae. aegypti étaient plus sensibles que celles de
An. gambiae s.l. aux HE de L. multiflora et O.
americanum. Ce changement de tendance de la toxicité
vis-à-vis des 2 populations de moustiques testées dans notre
étude peut être due à la différence de
localité de collecte des larves de moustiques et aux facteurs favorisant
l'apparition de la résistance surtout au sein des populations de Ae.
Aegypti, vu le nombre d'années passées entre ces deux (2)
études. En effet, Namountougou et al. (2020) ont
rapporté que Ae. aegypti de Bobo-Dioulasso était plus
résistant que celui de Ouagadougou aux insecticides chimiques
(Deltamethrine, bendiocard, chlorpyrifos-methyl).
L'HE de L. multiflora et dans une moindre les quatre
autres HE utilisées dans cette étude peuvent constituer en cela
de bons outils de gestion de la résistance des moustiques des moustiques
aux insecticides de synthèse.
1.2. Les cinq (5) HE et les combinaisons de deux (2)
d'entre elles comme adulticides
Dans cette étude, la toxicité des 5 HE (HE de
C. citratus, C. nardus, E. camaldulensis, L.
multiflora et O. americanum) et les combinaisons de C. nardus
(C.n) et O. americanum (O.a) ont été
évaluées sur les adultes de An. gambiae et de Ae.
aegypti.
Dans l'ensemble, presque toutes les HE et les combinaisons
testées ont montré des effets adulticides plus ou moins
intéressantes sur les souches de An. gambiae, sensible (Kisumu)
et de terrain (VK) résistante aux pyréthrinoïdes. Ces effets
adulticides, mis en évidence par des effets knock-down (KD), des
concentrations létales faibles et des taux de mortalité
élevés des moustiques adultes testés, ont
été par contre plus faibles sur Ae. aegypti. Cela montre
que les populations de An. gambiae sont plus sensibles aux HE
testées que les populations de Ae. aegypti. Des études
menées par Amerasan et al. (2012) et Murugan et Kumar (2012)
ont trouvé des résultats similaires avec les HE de Citrus
sinensis et de Cassia tora en Taïwan et en Inde où
Anopheles sp est plus sensibles que Ae. aegypti.
L'HE de L. multiflora a été la plus
efficace sur les adultes de An. gambiae et de Ae. aegypti
testées, suivie de l'HE de C. nardus. L'HE la moins
toxique était celle de E. camaldulensis. Il est
intéressant de noter que L. multiflora peut constituer une
bonne alternative au regard du taux de mortalité qui atteint 96,88% sur
An. gambiae, largement supérieure au taux de mortalité
obtenu avec la perméthrine.
Thèse de Doctorat unique - 108
-
L'efficacité des 5 HE testées dans cette
étude serait due à leurs composés majeurs. En effet,
plusieurs études antérieures ont montré que les
composés majeurs sont le facteur responsable de la bio-activité
d'une HE, car ils constitueraient la partie la plus importante des
composés totaux de l'HE (Lucia et al., 2007; Gbolade et
Lockwood, 2008; Vani, Cheng et Chuah, 2009). En effet, des études ont
montré que le p-cymène et le f3-caryophyllène
présentent des propriétés adulticides sur An. gambiae
et Ae. aegypti (Almadiy, 2020; Bossou et al., 2013).
Ainsi, l'activité adulticide élevée de l'HE de L.
multiflora serait attribuée au f3-caryophyllène et au
p-cymène qui font partie de ses composés majeurs dans la
présente étude.
Globalement, toutes les combinaisons obtenues avec les 2 HE
(C. nardus et O. americanum) ont amélioré
l'efficacité globale des HE par rapport aux HE individuelles. Dans la
présente étude, l'amélioration du potentiel adulticide par
la combinaison des deux HE peut être due par leur proportion dans la
combinaison. Nos résultats corroborent ceux des travaux
antérieurs qui ont rapporté que l'activité biologique des
HE dépend non seulement de leur composition qualitative, mais aussi du
rapport quantitatif de leurs composants (Bekele et Hassanali, 2001 ; Pavela,
2008).
L'amélioration du potentiel adulticide par les
combinaisons des HE a été prouvée par les effets
synergiques et additifs obtenus. Cette amélioration de la
toxicité par les combinaisons des 2 HE serait due à l'effet
toxique combiné des composés majeurs des 2 HE prises
individuellement. Des travaux antérieurs ont montré que l'action
toxique des HE est due aux effets combinés de différents
composants, avec ou sans action toxique individuelle significative contre les
insectes (Tanprasit, 2005; Park et al., 2011). D'autres études
ont montré que des combinaisons de 1,8-cinéole et de citronellal
ainsi que de plusieurs composés mineurs et de citronellal ont
donné des effets synergiques sur les larves de Spodoptera littoralis
(Abbassy, Abdelgaleil et Rabie, 2009). Recement, Wangrawa et al.
(2022b) ont montré que l'amélioration des HE par les
combinaisons est due à l'apparition de nouveaux composés
préalablement absents dans les HE individuelles.
La mise en évidence de l'effet adulticide des HE seules
et des combinaisons de certaines de ces HE est une étape importante dans
la recherche de nouveaux types d'insecticides.
En effet, nos études ont montré qu'il y avait un
gain d'efficacité à combiner les HE, en termes de
mortalité induite, d'effet Knock Down (KD) et de concentration
létale induite. Il faut noter que, pour la première fois, une
interaction synergique a été observée en combinant les HE
de C.
Thèse de Doctorat unique - 109
-
nardus et de O. americanum sur des
populations de Ae. aegypti et de An. gambiae au Burkina
Faso.
Le système nerveux est généralement le
principal site cible des insecticides utilisés dans les programmes de
lutte contre les vecteurs du paludisme (Rants'o et al. 2022). Ces
auteurs ont montré l'existence d'un lien entre les modes d'action de
certains insecticides chimiques et les HE. En effet, selon ces auteurs, les HE
agissent au niveau du système nerveux central sur
l'acétylcholinestérase (AChE) comme les organophosphorés
et les carbamates. Kiendrebeogo et al. (2011) ont montré qu'en
utilisant des conditions expérimentales et des concentrations d'enzyme
AChE similaires, les HE de Ocimum canum (Sims.) du Burkina Faso ont
inhibé l'AChE.
De plus, Selon d'autres auteurs, les HE et leurs constituants
inhibent les enzymes de détoxification P450 monooxygénase et
glutathione-S-transférase impliquées dans la résistance
à de multiples insecticides dont les pyréthroïdes, les
organophosphorés et les carbamates (Norris et al., 2018 ; Gaire
et al., 2021).
1.3. Les huiles essentielles comme répulsifs anti
moustiques
Toutes les 5 HE testées ont montré des effets
répulsif-irritants de contact. Cependant, l'HE de L. multiflora
s'est montrée moins répulsive sur les deux souches de
An. gambiae et la souche sensible de Ae. aegypti « Bora
Bora ». Cette faiblesse de l'effet répulsif-irritant de l'HE de
L. multiflora a été plus remarquable surtout aux
concentrations les plus élevées. Cela serait dû au taux
élevé de KD que produit cette HE sur les différents types
de moustiques testés. Nos études antérieures ont
montré que l'HE de L. multiflora produit des effets KD
élevés sur les populations de Ae. aegypti et An.
gambiae (Balboné et al. 2022b; Balboné et al. 2022c). Il est
évident que les moustiques assommés ne peuvent pas
s'échapper. L'HE de L. multiflora peut être un bon
répulsif à faible dose.
Compte tenu du fait que les HE de C. citratus, C.
nardus et de E. camaldulensis ont montré des effets
répulsif-irritants de contact très proches ou dans certains cas
supérieurs à ceux causés par le DEET, ces HE peuvent
être de bons répulsif-irritants de contact. En effet, des auteurs
ont montré que les HE de C. nardus et de Eucalyptus spp
qui ont été citées dans de nombreuses inventions
brevetées ont un pouvoir répulsif contre les espèces de
Anopheles et de Aedes, dans certains cas comparables à celui du DEET
(Tawatsin et al., 2001; Moore, Lenglet et
Thèse de Doctorat unique - 110
-
Hill, 2002 ; Sultana et al., 2008). En outre,
d'autres auteurs ont montré que l'HE de C. citratus a une
propriété répulsive assez significatives (Amer et
Mehlhorn, 2006 ).
L'HE de O. americanum a produit des effets
répulsifs irritants de contact élevés ou
modérés sur les souches de terrain de Ae. aegypti et de
An. gambiae (respectivement de Bobo-Dioulasso et VK) à toutes
les concentrations, mais de manière croissante. De plus, cette HE a
produit de faibles effets KD même à la concentration
élevée. Ces résultats corroborent ceux des études
antérieures menées en Guinée Bissau, en Afrique de
l'Ouest, qui ont rapporté que l'HE de O. americanum a un effet
répulsif sur les moustiques Anophèles (Palsson et Jaenson,
1999).
Les différences dans la spécificité
d'espèce des profils de répulsion de ces HE peuvent motiver leur
utilisation en combinaison afin de générer des formulations
à large spectre pour la répulsion simultanée des deux
espèces de moustiques.
Il faut noter que, pour la première fois, l'effet
répulsif irritant par contact des HE a été testé
sur des populations de moustiques des espèces de Ae. aegypti et
de An. gambiae au Burkina Faso.
2. Conclusion générale et
perspectives
L'objectif général de cette thèse
était d'évaluer les propriétés insecticides de 5
huiles essentielles et des combinaisons de deux (2) d'entre elles sur des
populations de Ae. aegypti et de An. gambiae
reconnues résistantes aux insecticides chimiques. Dans cette
thèse, nous avons évalué trois propriétés
insecticides, à savoir les propriétés larvicides,
adulticides et répulsives irritantes de contact.
Concernant les propriétés larvicides, les
travaux ont permis de montrer que l'HE de L. multiflora serait un bon
larvicide dans la mesure où cette HE a donné une toxicité
élevée sur les larves de Ae. aegypti et de An.
gambiae, sensiblement proche de celle produite du pyriproxyfène, un
larvicide de référence. Cependant, les HE de C. nardus
et de O. americanum ne seraient pas négligeables comme des
larvicides.
En termes d'efficacité adulticide, l'HE de L.
multiflora serait un candidat privilégié, puisqu'elle a
donné des taux de mortalités et de knock-down très
élevés. Aussi, les combinaisons aux rations 90 : 10, 80 : 20 et
20 : 80, respectivement des HE de C. nardus et de O. americanum
ont produit des effets adulticides élevés.
Toutes les 5 HE testées ont produit des effets
répulsifs irritants de contact modérés pour certaines et
élevés pour d'autres. Les HE de C. nardus, C.
citratus et E. camaldulensis peuvent être de bons
répulsifs.
Compte tenu de ces différentes propriétés
utiles de ces HE dans la lutte antivectorielles, il serait intéressant
de vulgariser leur utilisation.
Cette étude nous a donné un autre goût.
Donc, en perspective, nous envisageons :
- Entreprendre des tests larvicides, répulsifs et
adulticides avec les huiles essentielles en milieu semi contrôlé
pour la phase II de l'évaluation ;
- Tester les combinaisons intéressantes des HE sur une
large gamme de populations naturelles de moustiques ;
- Tester les combinaisons d'HE avec des insecticides de la
famille des pyréthrinoïdes sur une large gamme de populations
naturelles de moustiques ;
- Déterminer les compositions chimiques des
combinaisons ayant donne des effets synergistes ;
- Mettre au point des formulations insecticides à base
des HE de plantes locales microencapsulés pour améliorer
l'efficacité dans le temps en collaboration avec les firmes locales.
Thèse de Doctorat unique - 111
-
Thèse de Doctorat unique - 112
-
REFERENCES BIBLIOGRAPHIQUES
Abbassy, M.A., Abdelgaleil, S.A., & Rabie, R. (2009).
Insecticidal and synergistic effects of Majorana hortensis essential
oil and some of its major constituents. Entomologia Experimentalis et
Applicata, 131 (3): 225-32.
https://doi.org/10.1111/j.1570-7458.2009.00854.x.
Abbott, W S. (1987). A Method of Computing the Effectiveness
of an Insecticide. 1925. Journal of the American Mosquito Control
Association 3 (2): 302-3.
Achee, N. L., Sardelis M. R., Dusfour I., Chauhan K. R. &
Grieco J. P. (2009). Characterization of spatial repellent, contact irritant,
and toxicant chemical actions of standard vector control compounds. Journal
of the American Mosquito Control Association, 25(2), 156-167.
Adams, R. P. (2007). Identification of essential oil
components by gas chromatography/mass spectrometry (Vol. 456, pp. 544-545).
Carol Stream: Allured publishing corporation.
Agence Nationale de Sécurité Sanitaire de
l'alimentation, de l'Environnement et du travail (ANSES), 2020. Rôle des
arthropodes dans la transmission de la peste porcine africaine. Avis de
l'Anses, Rapport d'expertise collective. Saisine n° « 2019-SA-0028
». France.
Agence Nationale de Sécurité Sanitaire de
l'alimentation, de l'Environnement et du travail (ANSES), (2013). Avis relatif
à la recherche d'insecticides potentiellement utilisables en lutte
antivectorielle (Classement des 32 substances actives
sélectionnées par l'analyse multicritère SIRIS en trois
classes selon le niveau de connaissances sur leur efficacité contre les
moustiques). Saisine n° 2012-SA-0028 (Maisons-Alfort, Anses).
Ahouansou, A. C., Fagla, S. R. M., Tokoudagba, J. M.,
Toukourou, H., Badou, Y. K., & Gbaguidi, F. A. (2019). Chemical composition
and larvicidal activity of the essential oil of Cymbopogon nardus (L.)
Rendle on Anopheles gambiae. International Journal of Biological
and Chemical Sciences, 13(3), 1861-1869.
https://doi.org/10.4314/ijbcs.v13i3.53.
Akrout, A. (2004). Étude des huiles essentielles de
quelques plan tes pastorales de la région de Matmata (Tunisie). In :
Ferchichi A. (comp.), Ferchichi A. (collab.). Réhabilitation des
pâturages et des parcours en milieux méditerranéens.
Zaragoza : CIHEAM, 2004. p. 289-
; n. 62).
292 (Cahiers Options Méditerranéennes
http://om.ciheam.org/om/pdf/c62/04600172.pdf
Thèse de Doctorat unique - 113
-
Aliota, M. T., Peinado, S. A., Velez, I. D., & Osorio, J.
E. (2016). The WMel Strain of Wolbachia Reduces Transmission of Zika Virus by
Aedes aegypti. Scientific Reports 6 (June): 1-7.
https://doi.org/10.1038/srep28792.
Aldridge, W. N. (1950) `Some properties of specific
cholinesterase with particular reference to the mechanism of inhibition by
Diethyl p-Nitrophenyl Thiophosphate (E 605) and Analogues', Biochemical
Journal, 46(4), pp. 451-460. doi: 10.1042/bj0460451.
Almadiy, A. A. (2020). Chemical Composition, Insecticidal and
Biochemical Effects of Two Plant Oils and Their Major Fractions against
Aedes aegypti, the Common Vector of Dengue Fever.» Heliyon
6 (9): e04915.
https://doi.org/10.1016/j.heliyon.2020.e04915.
Alphey, L. (2014). Genetic Control of Mosquitoes. Annual
Review of Entomology 59: 205-26.
https://doi.org/10.1146/annurev-ento-011613-162002.
Amer, A., & Mehlhorn, H. (2006). Repellency effect of
forty-one essential oils against Aedes, Anopheles, and Culex mosquitoes.
Parasitol Res; 99: 478-490
Amerasan, D., Murugan, K., Kovendan, K., Mahesh Kumar, P.,
Panneerselvam, C., Subramaniam, J., ... & Hwang, J. S. (2012). Adulticidal
and repellent properties of Cassia tora Linn. (Family: Caesalpinaceae)
against Culex quinquefasciatus, Aedes aegypti, and
Anopheles stephensi. Parasitology research,
111(5), 1953-1964.
https://doi.org/10.1007/s00436-012-3042-3.
Azeem, M., Zaman, T., Tahir, M., Haris, A., Iqbal, Z., Binyameen,
M., ... Mozûraitis, R.
(2019). Chemical composition and repellent activity of native
plants essential oils against dengue mosquito, Aedes aegypti. Industrial
Crops and Products, 140, 111609.
https://doi.org/10.1016/j.indcrop.2019.1116.
https://doi.org/10.1016/j.indcrop.2019.111609.
Badolo, A., Ilboudo-Sanogo, E., Ouédraogo, A. P., &
Costantini, C. (2004). Evaluation of the sensitivity of Aedes aegypti
and Anopheles gambiae complex mosquitoes to two insect
repellents: DEET and KBR 3023. Tropical Medicine & International
Health, 9(3), 330-334.
https://doi.org/10.1111/J.1365-3156.2004.01206.X.
Badolo, A., Sombié, A., Pignatelli, P. M., Sanon, A.,
Yaméogo, F., Wangrawa, D. W., Sanon, A., Kanuka, H., McCall, P. J.,
& Weetman, D. (2019). Insecticide resistance levels and mechanisms in Aedes
aegypti populations in and around Ouagadougou, Burkina Faso. PLoS
Thèse de Doctorat unique - 114
-
neglected tropical diseases, 13(5), e0007439.
https://doi.org/10.1371/journal.pntd.0007439.
Balboné, M., Soma, D. D., Namountougou, M., Drabo, S.
F., Konaté, H., Toé O., Bayili, K., Meda, G. B., Dabiré,
R. K. and Gnankine, O. (2022a). Essential oils from five local plants: an
alternative larvicide for Anopheles gambiae s.l. (Diptera: Culicidae)
and Aedes aegypti (Diptera: Culicidae) Control in Western Burkina
Faso. Front. Trop. Dis. 3:853405. doi: 10.3389/fitd.2022.853405.
Balboné, M., Diloma Soma, D., Fogné Drabo, S.,
Namountougou, M., Konaté, H., Benson Meda, G., Sawadogo, I., Romba, R.,
Bilgo, E., Nebié, R. C. H., Bassolé, I. H. N., Dabire, R. K.,
& Gnankine, O. (2022). Alternatives to Pyrethroid Resistance : Combinations
of Cymbopogon nardus and Ocimum americanum Essential Oils Improve the
Bioefficiency Control Against the Adults' Populations of Aedes aegypti
(Diptera: Culicidae). Journal of medical entomology,
59(6), 2102-2109. https://doi.org/ 10.1093/jme/tjac148.
Balboné, M., Sawadogo, I., Soma, D. D., Drabo, S. F.,
Namountougou, M., Bayili, K., Romba,
R., Meda, G. B., Nebié, H. C. R., Dabire, R. K.,
Bassolé, I. H. N., & Gnankine, O. (2022). Essential oils of plants
and their combinations as an alternative adulticides against Anopheles gambiae
(Diptera: Culicidae) populations. Scientific reports, 12(1),
19077. https://doi.org/ 10.1038/s41598-022-23554-6.
Banks, S. D., Murray, N., Wilder-Smith, A., & Logan, J. G.
(2014). Insecticide-treated clothes for the control of vector-borne diseases: a
review on effectiveness and safety. Medical and veterinary entomology,
28 Suppl 1, 14-25.
https://doi.org/10.1111/mve.12068
Barreaux, A. M. G., Oumbouke W. A., Tia I. Z., Brou N'G., Koffi
A. A., N'Guessan R. and Thomas M. B. (2019) `Semi-field evaluation of the
cumulative effects of a lethal House Lure on malaria mosquito mortality',
Malaria Journal, 18(1), pp. 1-9. https://doi.org/ 10.1186/s12936-019-2936-2
.
Bassolé, I.H.N., Ouattara, A.S., Nebieb, R. C. H.,
Ouattara, C. A. T., Kabore, Z. I., Traore, S.A. (2003). Ovicidal and Larvicidal
Activity against Aedes aegypti and Anopheles gambiae complex
mosquitoes of essential oils extracted from three spontaneous plants of Burkina
Faso. Parasitologia 45 :23-26. Parasitologia 45 (1): 23-26.
Bassole, I. H. N., Nebie, R., Savadogo, A., Ouattara, C. T.,
Barro, N., & Traore, S. A. (2005).
Thèse de Doctorat unique - 115
-
Composition and antimicrobial activities of the leaf and
flower essential oils of Lippia chevalieri and Ocimum canum
from Burkina Faso. African Journal of Biotechnology 4 (10):
1156-60.
https://doi.org/10.5897/AJB2005.000-3230.
Bassolé, I.H.N. and Juliani, H.R. (2012). Essential Oils
in Combination and Their Antimicrobial Properties. Molecules, 17 :3989-4006.
https://doi.org/10.3390/molecules17043989.
Bayili, K., Namountougou M., Sanou R., Ndo S., Ouattara A.,
Dabiré R. K., Malone D. and Diabaté A. (2015). `The sterilizing
effect of pyriproxyfen on the malaria vector Anopheles gambiae: physiological
impact on ovaries development', Malaria Journal, 14(101), pp. 1-8.
https://doi: 10.1186/s12936-015-0609-3.
Bekele, J., and Hassanali, A.. (2001). Blend Effects in the
toxicity of the essential oil constituents of Ocimum kilimandscharicum
and Ocimum kenyense (Labiateae) on two postharvest insect pests.
Phytochemistry 57 (3): 385-91.
https://doi.org/10.1016/S0031-9422(01)00067-X.
Bendali, F., Djebbar, F. et Soltani, N. (2001).
Efficacité comparée de quelques espèces de poissons
à l'égard de divers stades de Culex pipiens L. dans des
conditions de laboratoire résumé. Parasitica 57:
255-65.
Benelli, G., Jeffries, C. L., & Walker, T. (2016). Biological
Control of Mosquito Vectors: Past, Present, and Future. Insects,
7(4), 52.
https://doi.org/10.3390/insects7040052
Benz, G. W., Roncalli R. A. and Gross S. J. (1989) `Use of
ivermectin in Cattle, Sheep, Goats, and Swine', in Ivermectin and Abamectin.
New York, NY: Springer New York, pp. 215229.
https://doi: 10.1007/978-1-4612-3626-9_15.
Berenbaum, M. A. Y., and Neal J. J. (1985). Synergism between
myristicin and xanthotoxin, a naturally cooccurring plant toxicant. Journal
of Chemical Ecology 11 (10): 1349-58.
Bernier, U. R., Kline, D., Posey, K. H., Ernier, U. B., Kline,
D. L. and Posey, H. (2006). Human emanations and related natural compounds that
inhibit human emanations and related natural compounds that inhibit mosquito
host-finding abilities mosquito host-finding abilities human emanations and
related natural compounds that inhibit mosquito ho. Insect
repellent:
principales, methods and uses. p 77-100.USA
https://digitalcommons.unl.edu/usdaarsfacpubFaculty.948.https://digitalcommons.unl.edu/us
Thèse de Doctorat unique - 116
-
daarsfacpub/948.
Bharati, M., & Saha, D. (2018). Multiple insecticide
resistance mechanisms in primary dengue vector, Aedes aegypti (Linn.)
from dengue endemic districts of sub-Himalayan West Bengal, India. PloS
one, 13(9), e0203207.
https://doi.org/10.1371/journal.pone.0203207
Bhatt, S., Gething, P. W., Brady, O. J., Messina, J. P.,
Farlow, A. W., Moyes, C. L., Drake, J. M., Brownstein, J. S., Hoen, A. G.,
Sankoh, O., Myers, M. F., George, D. B., Jaenisch, T., Wint, G. R., Simmons, C.
P., Scott, T. W., Farrar, J. J., & Hay, S. I. (2013). The global
distribution and burden of dengue. Nature, 496(7446),
504-507.
https://doi.org/10.1038/nature12060.
Bilgo, E., Lovett, B., Fang, W., Bende, N., King, G. F.,
Diabate, A., & St Leger, R. J. (2017). Improved efficacy of an arthropod
toxin expressing fungus against insecticide-resistant malaria-vector
mosquitoes. Scientific reports, 7(1), 3433.
https://doi.org/10.1038/s41598-017-03399-0.
Bøgh, C., Pedersen, E. M., Mukoko, D. A., & Ouma,
J. H. (1998). Permethrin-impregnated bednet effects on resting and feeding
behaviour of lymphatic filariasis vector mosquitoes in Kenya. Medical and
veterinary entomology, 12(1), 52-59.
https://doi.org/10.1046/j.1365-2915.1998.00091.x.
Bossou, A. D., Mangelinckx, S., Yedomonhan, H., Boko, P. M.,
Akogbeto, M. C., De Kimpe, N., Avlessi, F., and Sohounhloue, D. C. K. (2013).
Chemical composition and insecticidal activity of plant essential oils from
benin against Anopheles gambiae ( Giles ).
Boulanger, N., & de Gentile, L. (2012). Les
répulsifs cutanés. In Duvallet G., de Gentile L. Ed., Protection
personnelle antivectorielle, IRD Éditions, Marseille : 50-116.
Boulanger, N., & Lipsker, D. (2015). Protection contre les
piqûres de tiques [Protection against tick bites]. Annales de
dermatologie et de venereologie, 142(4), 245-251.
https://doi.org/ 10.1016/j.annder.2014.11.018.
Boussès, P. and Granouillac, B. (2011). Les Anopheles
de La région Afro-Tropicale, IRD éditions. ISBN 2-7099-1380-1.
http://vmpinsarim-dev.mpl.ird.fr/xper2/web/index.html.
Bouyer, J., Gentile L. and Chandre F. (2017) `Chapitre 5- La
lutte antivectorielle', in Entomologie médicale et
vétérinaire IRD éditions. Marseille, pp. 89-120.
http://doi:
Thèse de Doctorat unique - 117
-
10.4000/books.irdeditions.22031.
Bowman, N. M., Akialis, K., Cave, G., Barrera, R., Apperson,
S. and Meshnick, S. R. (2018). Pyrethroid insecticides maintain repellent
effect on knock-down resistant populations of Aedes aegypti
mosquitoes.» PLoS ONE 5 (13): 1-14.
Boyce, R., Lenhart A., Kroeger A., Velayudhan R., Roberts B.
and Horstick O. (2013). Bacillus Thuringiensis israelensis (Bti) for
the control of dengue vectors: systematic literature review.» Tropical
Medicine and International Health 18 (5): 564-77.
https://doi.org/10.1111/tmi.12087.
Boyer, S., Toty C., Jacquet M., Lempérière G.
and Fontenille D. (2012). Evidence of multiple inseminations in the field in
Aedes albopictus. PLoS ONE 7 (8).
https://doi.org/10.1371/journal.pone.0042040.
Brady, O. J., Gething, P. W., Bhatt, S., Messina, J. P.,
Brownstein, J. S., Hoen, A. G., Moyes, C. L., Farlow, A. W., Scott, T. W.,
& Hay, S. I. (2012). Refining the global spatial limits of dengue virus
transmission by evidence-based consensus. PLoS neglected tropical
diseases, 6(8), e1760.
https://doi.org/10.1371.
Briassoulis, G., Narlioglou M. and Hatzis T. (2001). Toxic
encephalopathy associated with use of deet insect repellents: a case analysis
of its toxicity in children. Human & Experimental Toxicology, 20
(October 2000): 8-14.
Bruneton, J. (1993). Pharmacognosie: phytochimie plantes
médicinales (No. 581.634 B7).
Burt, S. (2004). Essential oils: their antibacterial
properties and potential applications in foods - a review. International
Journal of Food Microbiology 94 (3): 223-53.
https://doi.org/10.1016/j.ijfoodmicro.2004.03.022.
Calafat, A. M. (2012). The U.S. National Health and Nutrition
Examination Survey and human exposure to environmental chemicals.
International journal of hygiene and environmental health,
215(2), 99-101.
https://doi.org/10.1016/j.ijheh.2011.08.014.
Caly, L., Druce, J. D., Catton, M. G., Jans, D. A., &
Wagstaff, K. M. (2020). The FDA-
approved drug ivermectin inhibits the replication of SARS-CoV-2
in vitro. Antiviral research, 178, 104787.
https://doi.org/10.1016/j.antiviral.2020.104787
Thèse de Doctorat unique - 118
-
Campbell, W. C., Fisher M. H., Stapley E. O.,
Albers-Schönberg G. and Jacob T. A. (1983) `Ivermectin: A potent new
antiparasitic agent', Science, 221(4613), pp. 823-828. doi:
10.1126/science.6308762.
Cansian, R. L., Astolfi V., Cardoso R. I., Paroul N., Roman S.
S., MIelniczki-Pereira, A. A., Pauletti G. F. and Mossi A. J. (2015).
Insecticidal and repellent activity of the essential oil of Cinnamomum
camphora Var . Linaloolifera Y . Fujita ( Ho-Sho ) and
Cinnamomum camphora ( L .) J Presl . Var . Hosyo ( Hon-Sho ) on
Sitophilus zeamais Mots . ( Coleoptera , Curculionedae ).»
Revue Bras. Pl. Med. 17: 769-73.
Carnevale, P, and Robert, V. (2009). Les Anopheles: biologie,
transmission du plasmodium et lutte antivectorielle, Marseille: IRD
Editions, 391 p. (Didactiques). ISBN 978-2-7099-16622. ISSN 1142-2580.
Casida, J. E. and Quistad G. B. (1998) `Golden Age of Insecticide
Research: Past, Present, or Future?' Annual Review of Entomology,
43(1), pp. 1-16. doi: 10.1146/annurev.ento.43.1.1.
Cavalcanti, E. S. B., Morais, S. M. de, Lima, M. A. A., &
Santana, E. W. P. (2004). Larvicidal Activity of essential oils from
Brazilian plants against Aedes aegypti L. Memórias Do Instituto Oswaldo
Cruz, 99(5), 541-544. doi:10.1590/s0074-0276200400050.
Chaccour, C., Lines, J. and Whitty, C. J. M. (2010) `Effect of
Ivermectin on Anopheles gambiae Mosquitoes Fed on Humans: The potential of oral
insecticides in malaria control', The Journal of Infectious Diseases, 202(1),
pp. 113-116. doi: 10.1086/653208.
Chaccour, C. J., Kobylinski, K. C., Bassat, Q., Bousema, T.,
Drakeley, C., Alonso, P. and Foy, B. D. (2013) `Ivermectin to reduce malaria
transmission: a research agenda for a promising
new tool for elimination', Malaria Journal, 12(153): 1-8. doi:
10.1186/1475-287512-153.
Chandre, F., Darrier, F., Manga, L., Akogbeto, M., Faye, O.,
Mouchet, J., & Guillet, P. (1999). Status of pyrethroid resistance in
Anopheles gambiae sensu lato. Bulletin of the World Health
Organization, 77(3): 230-234.
Chansang, A., Champakaew D., Junkum A., Jitpakdi A.,
Amornlerdpison D., Aldred A. K., Riyong D. and Pitasawat B. (2018). Synergy in
the adulticidal efficacy of essential oils for the improvement of permethrin
toxicity against Aedes aegypti L. (Diptera: Culicidae).»
Parasites & Vectors 11 (1): 417.
https://doi.org/10.1186/s13071-018-3001-7.
Thèse de Doctorat unique - 119
-
Chapman, R F. (1969). The Insects, Structure and Function 1th
Edition, American Elsevier Pub. Co. 819 pages. ISBN-10- 0444197583 ISBN-13-
978-0444197580.
Chippaux, J-P., Boussinesq M. and Prod'hon J. (1995)
`L'ivermectine dans le contrôle', Cahiers Santé, 5: 149-158.
Chiasson, H., Bélanger A., Bostanian N., Vincent C., &
Poliquin A. (2001). Acaricidal
properties of Artemisia absinthium and Tanacetum
vulgare (Asteraceae) essential oils obtained by three methods of
extraction. Journal of economic entomology, 94(1), 167-171.
https://doi.org/10.1603/0022-0493-94.1.167.
Chooluck, K., Teeranachaideekul V., Jintapattanakit A., Lomarat
P., & Phechkrajang C.
(2019). Repellency effects of essential oils of Cymbopogon
winterianus, Eucalyptus globulus, Citrus hystrix and their major
constituents against Adult German cockroach (Blattella germanica
Linnaeus (Blattaria: Blattellidae). Jordan Journal of Biological Sciences
Short Communication, 12(4), 519-523.
Churcher, T. S., Lissenden N., Griffin J. T., Worrall E. and
Ranson H. (2016). The impact of pyrethroid resistance on the efficacy and
effectiveness of bednets for malaria control in Africa. ELife 5
(AUGUST).
https://doi.org/10.7554/eLife.16090.
Clem, J. R, Havemann D. F, and Raebel M. A. (1993). Insect
repellent (N,N-Diethyl-m-Toluamide) cardiovascular toxicity in an adult.
Annals of Pharmacotherapy 27 (March): 289-93.
Clevenger, J. F. (1928) Apparatus for Volatile Oil
Determination, Description of New Type. The Journal of the American
Pharmaceutical Association (1912), 17, 345-349.
https://doi.org/10.1002/jps.3080170407.
Centre National d'Expertise sur les Vecteurs (CNEV), (2014)
Rapport relatif à l'utilisation
des insecticides et gestion de la résistance
https://www.anses.fr/fr/system/files/CNEV-Ft
Fev2014-Rapport_Utilisation_insecticides_gestion_resistance.pdf.
Cohuet, A. (2020). L'efficacité des principaux
répulsifs contre les moustiques les plus dangereux. Les cahiers de
la Recherche. Santé, Environnement, Travail, (15), 39-42.
Corbel, V., Fonseca, D. M., Weetman, D., Pinto, J., Achee, N. L.,
Chandre, F., Coulibaly, M. B.,
Thèse de Doctorat unique - 120
-
Dusfour, I., Grieco, J., Juntarajumnong, W., Lenhart, A.,
Martins, A. J., Moyes, C., Ng, L. C., Raghavendra, K., Vatandoost, H., Vontas,
J., Muller, P., Kasai, S., Fouque, F., ... David, J. P. (2017). International
workshop on insecticide resistance in vectors of arboviruses, December 2016,
Rio de Janeiro, Brazil. Parasites & vectors, 10(1), 278.
https://doi.org/10.1186/s13071-017-2224-3
.
Costantini, C., Badolo, A., & Ilboudo-Sanogo, E. (2004).
Field evaluation of the efficacy and persistence of insect repellents DEET,
IR3535, and KBR 3023 against Anopheles gambiae complex and other
Afrotropical vector mosquitoes. Transactions of the Royal Society
of
Tropical Medicine and Hygiene, 98(11),
644-652.
https://doi.org/10.1016/j.trstmh.2003.12.015
Cuisance, D., Politzar H., Clair M., Sellin E., and
Tazé Y. (1978). Impact des lâchers de mâles stériles
sur les niveaux de deux populations sauvages de <em> Glossina
palpalis Gambiensis</Em> En Haute-Volta (Sources de La Volta Noire).
Revue d'élevage et de Médecine Vétérinaire Des
Pays Tropicaux 31 (3): 315.
https://doi.org/10.19182/remvt.8126.
Curtis, C. F., Lines J. D., Ijumba J., Callaghan A., and Hill
N. (1987). The relative efficacy of repellents against mosquito vectors of
disease. Medical and Veterinary Entomology 1: 109- 19.
Dabire, K. R., Diabaté, A., Agostinho, F., Alves, F.,
Manga, L., Faye, O., & Baldet, T. (2008). Distribution of the members of
Anopheles gambiae and pyrethroid knock-down resistance gene (kdr) in
Guinea-Bissau, West Africa. Bulletin de la Societe de pathologie exotique
(1990), 101(2), 119-123.
Dabiré, K. R., Diabaté, A., Namountougou, M.,
Toé, K. H., Ouari, A., Kengne, P., Bass, C., and Baldet, T. (2009).
Distribution of pyrethroid and ddt resistance and the l1014f kdr mutation in
Anopheles gambiae s.l . from Burkina Faso ( West Africa ).
Transactions of the Royal Society of Tropical Medicine and Hygiene
103: 1113-20.
https://doi.org/10.1016/j.trstmh.2009.01.008.
Dabiré, K. R., Diabaté, A., Namountougou, M.,
Djogbenou, L., Wondji, C., Chandre, F., Simard, F., Ouédraogo, J.,
Martin, T., Weill, M., & Baldet, T. (2012a). Trends in Insecticide
Resistance in Natural Populations of Malaria Vectors in Burkina Faso, West
Africa: 10
Thèse de Doctorat unique - 121
-
Years' Surveys. In (Ed.), Insecticides - Pest
Engineering. IntechOpen.
https://doi.org/10.5772/28749.
Dabiré, R. K., Namountougou, M., Sawadogo, S. P., Yaro,
L. B., Toe, H. K., Ouari, A., Gouagna, L-C., Simard, F., Chandre, F., Baldet,
T., Bass, C. and Diabate, A. (2012b). Population Dynamics of
Anopheles gambiae s.l. in Bobo-Dioulasso City: Bionomics, Infection
Rate and Susceptibility to Insecticides. Parasites and Vectors 5 (1):
1-9.
https://doi.org/10.1186/1756-3305-5-127.
Dabire, R. K., Namountougou, M., Diabaté, A., Soma, D. D.,
Bado, J., Toé, H. K., Bass, C. & Combary, P. (2014). Distribution
and frequency of kdr mutations within Anopheles gambiae sl populations
and first report of the ace. 1 G119S mutation in Anopheles arabiensis
from
Burkina Faso (West Africa). PloS one, 9(7),
e101484.
https://doi.org/10.1371/journal.pone.0101484
Darriet, F. (1998). La lutte contre les moustiques nuisants et
vecteurs de maladies : l'évaluation de nouveaux insecticides utilisables
contre les moustiques en Afrique tropicale. Paris (FRA) ; Paris :
Karthala ; ORSTOM, 114 p. (Economie et Développement). ISBN
2-86537-864-0.
Dayananda, K. and Ranaweera, S., (1996). Mosquito-larvicidal
activity of Ceylon citronella {Cymbopogon Nardus (L.) Rendle} oil
fractions. Journal of the National Science Foundation of Sri Lanka,
24(4), pp.247-252.
http://doi.org/10.4038/jnsfsr.v24i4.5557
de Araújo, A. P., Paiva, M., Cabral, A. M., Cavalcanti,
A., Pessoa, L., Diniz, D., Helvecio, E., da Silva, E., da Silva, N. M.,
Anastácio, D. B., Pontes, C., Nunes, V., de Souza, M., Magalhães,
F., de Melo Santos, M., & Ayres, C. (2019). Screening Aedes aegypti
(Diptera: Culicidae) populations from Pernambuco, Brazil for Resistance to
Temephos, Diflubenzuron, and Cypermethrin and Characterization of Potential
Resistance Mechanisms. Journal of insect science (Online),
19(3), 16.
https://doi.org/10.1093/jisesa/iez054
Debboun, M., & Strickman, D. (2013). Insect repellents and
associated personal protection for a reduction in human disease. Medical
and Veterinary Entomology, 27(1), 1-9.
https://doi.org/10.1111/j.1365-2915.2012.01020.x.
Dekker, T., Ignell, R., Ghebru, M., Glinwood, R., &
Hopkins, R. (2011). Identification of mosquito repellent odours from Ocimum
forskolei. Parasites & vectors, 4, 183.
Thèse de Doctorat unique - 122
-
https://doi.org/10.1186/1756-3305-4-183.
Deletre, E., Martin, T., Campagne, P., Bourguet, D., Cadin,
A., Menut, C., Bonafos, R. and Chandre, F. (2013). Repellent, irritant and
toxic effects of 20 plant extracts on adults of the malaria vector Anopheles
gambiae mosquito. PloS One, 8(12) : e82103.
https://doi.org/10.1371/journal.pone.0082103
Deletre, E., Chandre, F., Williams, L., Duménil, C.,
Menut, C., & Martin, T. (2015). Electrophysiological and behavioral
characterization of bioactive compounds of the Thymus vulgaris,
Cymbopogon winterianus, Cuminum cyminum and Cinnamomum
zeylanicum essential oils against Anopheles gambiae and prospects
for their use as bednet treatments. Parasites & vectors,
8, 316.
https://doi.org/10.1186/s13071-015-0934-y
Deletre, E., Schatz, B., Bourguet, D., Chandre, F., Williams,
L., Ratnadass, A., & Martin, T. (2016). Prospects for repellent in pest
control : current developments and future challenges. Chemoecology,
26(4), 127-142. https://doi.org/ 10.1007/s00049-016-0214-0.
Deletre, E., Martin, T., Duménil, C., & Chandre, F.
(2019). Insecticide resistance modifies mosquito response to DEET and natural
repellents. Parasites & vectors, 12(1): 1-10.
https://doi: 10.1186/s13071-019-3343-9.
Dell'Agli, M., Sanna, C., Rubiolo, P., Basilico, N., Colombo, E.,
Scaltrito, M. M., ... & Bosisio, E. (2012). Anti-plasmodial and
insecticidal activities of the essential oils of aromatic plants growing in the
Mediterranean area. Malaria journal, 11(1): 219.
https://doi: 10.1186/14752875-11-219.
Dhadialla, T. S., Carlson, G. R. and Le, D. P. (1998) `New
insecticides with ecdysteroidal and juvenile hormone activity', Annual Review
of Entomology, 43(1), pp. 545-569.
https://doi.org/10.1146/annurev.ento.43.1.545
.
Diabate, A., Baldet, T., Chandre, F., Akoobeto, M., Guiguemde,
T. R., Darriet, F., Brengues, C., Guillet, P., Hemingway, J., Small, G. J.,
& Hougard, J. M. (2002). The role of agricultural use of insecticides in
resistance to pyrethroids in Anopheles gambiae s.l. in Burkina Faso.
The American journal of tropical medicine and hygiene, 67(6):
617-622.
https://doi.org/10.4269/ajtmh.2002.67.617.
Drabo, S. F., Gnankiné, O., Bassolé, I. H.,
Nébié, R. C., & Laurence, M. (2017). Susceptibility of
Thèse de Doctorat unique - 123
-
MED-Q1 and MED-Q3 Biotypes of Bemisia tabaci
(Hemiptera: Aleyrodidae) populations to essential and seed oils.
Journal of economic entomology, 110(3), 1031-1038.: 1031-38.
https://doi.org/10.1093/jee/tox100.
Dua, V. K., Pandey, A. C., and Dash, A. P. (2010). Adulticidal
activity of essential oil of Lantana camara leaves against mosquitoes.
Indian Journal of Medical Research 131 (3): 434-39.
Duvallet, G., Fontenille, D., and Robert, V. (2017) Entomologie
médicale et vétérinaire. IRD éditions. Edited by
Éditions Quae.
https://doi:
10.4000/books.irdeditions.22031.
Enayati, A. A., Ranson, H., and Hemingway, J. (2005). Insect
glutathione transferases and insecticide resistance. Insect Molecular
Biology 14 (1): 3-8.
https://doi.org/10.1111/j.1365-2583.2004.00529.x.
Fegan, G. W., Noor, A. M., Akhwale, W. S., Cousens, S., &
Snow, R. W. (2007). Effect of expanded insecticide-treated bednet coverage on
child survival in rural Kenya: a longitudinal study. The Lancet,
370(9592): 1035-1039.
Ffrench-Constant, R. H., Daborn, P. J., & Le Goff, G. (2004).
The genetics and genomics of
insecticide resistance. Trends in genetics: TIG,
20(3), 163-170.
https://doi.org/10.1016/j.tig.2004.01.003.
Foley, D. H., Bryan, J. H. and Lawrence, G. W. (2000) `The
potential of ivermectin to control the malaria vector Anopheles farauti',
Transactions of the Royal Society of Tropical Medicine and Hygiene, 94(6), pp.
625-628. doi: 10.1016/S0035-9203(00)90211-6.
Flannery, D. J., Todres, J., Bradshaw, C. P., Amar, A. F.,
Graham, S., Hatzenbuehler, M., ... & Rivara, F. (2016). Bullying
prevention: A summary of the report of the National
Academies of Sciences, Engineering, and Medicine. Prevention
Science, 17(8), 1044-1053. 1044-53.
https://doi.org/10.1007/s11121-016-0722-8.
Folashade, K. O., & Omoregie, E. H. (2012). Essential oil of
Lippia multiflora Moldenke: A review. Journal of Applied
Pharmaceutical Science, (Issue), 15-23.
Fournet, F., Kassié, D., Dabiré, R. K., &
Salem, G. (2015). Analyse de la distribution socio-spatiale du paludisme dans
une ville moyenne ouest africaine, Bobo-Dioulasso (Burkina Faso).
Dynamiques environnementales. Journal international de géosciences
et de l'environnement, (36), 146-165.
https://doi.org/10.4000/dynenviron.1004.
Thèse de Doctorat unique - 124
-
Fradin, M. S., & Day, J. F. (2002). Comparative efficacy of
insect repellents against mosquito bites. The New England journal of
medicine, 347(1), 13-18.
https://doi.org/10.1056/NEJMoa011699
Gaire, S., Zheng, W., Scharf, M. E., & Gondhalekar, A. D.
(2021). Plant essential oil
constituents enhance deltamethrin toxicity in a resistant
population of bed bugs (Cimex lectularius L.) by inhibiting cytochrome
P450 enzymes. Pesticide biochemistry and physiology, 175,
104829.
https://doi.org/10.1016/j.pestbp.2021.104829
Gbolade, A. A., and Lockwood, G. B. (2008). Toxicity of
Ocimum sanctum L. Essential oil to Aedes aegypti larvae and
its chemical composition. Journal of Essential Oil-Bearing Plants 11
(2): 148-53.
https://doi.org/10.1080/0972060X.2008.10643611.
Georges, S. O. (1979) « Les huiles essentielles -
généralités et définitions », dans
Traité de phytothérapie et d'aromathérapie,
éd. Maloine, p. 141-142.
Gillies, M. T., & Coetzee, M. (1987). A supplement to the
Anophelinae of Africa South of the Sahara. Publ S Afr Inst Med Res,
55, 1-143.
Gillij, Y. G., Gleiser, R. M., and Zygadlo J. A. (2008). Mosquito
repellent activity of essential oils of aromatic plants growing in
Argentina.» Bioresource Technology 99 (7): 2507-15.
https://doi.org/10.1016/J.BIORTECH.2007.04.066.
Gnankiné, O., & Bassolé, I. H. N. (2017).
Essential oils as an alternative to pyrethroids' resistance against Anopheles
species complex giles (Diptera: Culicidae). Molecules,
22(10), 1321.
https://doi.org/10.3390/MOLECULES22101321.
Gnankiné, O., Bassolé, I. H., Chandre, F., Glitho,
I., Akogbeto, M., Dabiré, R. K., & Martin, T. (2013). Insecticide
resistance in Bemisia tabaci Gennadius (Homoptera: Aleyrodidae) and
Anopheles gambiae Giles (Diptera: Culicidae) could compromise the
sustainability of malaria vector control strategies in West Africa. Acta
Tropica, 128(1), 7-17.
https://doi.org/10.1016/j.actatropica.2013.06.004.
Grieco, J. P., Achee, N. L., Sardelis, M. R., Chauhan, K. R.,
& Roberts, D. R. (2005). A Novel high-throughput screening system to
evaluate the behavioral response of adult mosquitoes to chemicals1. Journal
of the American Mosquito Control Association, 21(4), 404-411.
https://doi.org/10.2987/8756-971X(2006)21[404:ANHSST]2.0.CO;2.
Thèse de Doctorat unique - 125
-
Guarrera, P. M. (1999). Traditional antihelmintic, antiparasitic
and repellent uses of plants in Central Italy. Journal of
ethnopharmacology, 68(1-3), 183-192.
https://doi.org/10.1016/s0378-8741(99)00089-6.
Hao, H., Wei, J., Dai, J., & Du, J. (2014). Host-seeking and
blood-feeding behavior of Aedes albopictus (Diptera: Culicidae)
exposed to vapors of geraniol, citral, citronellal, eugenol, or anisaldehyde.
Journal of Medical Entomology, 45(3), 533-539.
https://doi.org/10.1603/0022-2585(2008)45[533:HABBOA]2.0.CO;2.
Harbach, R. E. (2007). The Culicidae (Diptera): a review of
taxonomy, classification and phylogeny. Zootaxa, 1668(1),
591-638.
doi.org/10.11646/zootaxa.1668.1.28
Hardstone, M. C., Leichter, C. A., and Scott, J. G. (2009).
Multiplicative interaction between the two major mechanisms of permethrin
resistance, kdr and cytochrome p450-monooxygenase detoxification, in
mosquitoes. Journal Evol. Biol 22: 416-23.
https://doi.org/10.1111/j.1420-9101.2008.01661.x.
Heath, H. B. (1981). Source Book of Flavors: (AVI Sourcebook and
Handbook Series) 1981st Edition.
· ISBN-10 : 0870553704
·
ISBN-13 : 978-0870553707
Hemingway, J., Hawkes, N. J., McCarroll, L., & Ranson, H.
(2004). The molecular basis of insecticide resistance in mosquitoes. Insect
biochemistry and molecular biology, 34(7), 653665.
https://doi.org/10.1016/j.ibmb.2004.03.018.
Hemingway, J., Ranson, H., Magill, A., Kolaczinski, J., Fornadel,
C., Gimnig, J., Coetzee, M., Simard, F., Roch, D. K., Hinzoumbe, C. K.,
Pickett, J., Schellenberg, D., Gething, P., Hoppé, M., & Hamon, N.
(2016). Averting a malaria disaster: will insecticide resistance derail malaria
control?. Lancet (London, England), 387(10029), 1785-1788.
https://doi.org/ 10.1016/S0140-6736(15)00417-1.
Henry, M. C., Assi, S. B., Rogier, C., Dossou-Yovo, J., Chandre,
F., Guillet, P., & Carnevale, P. (2005). Protective efficacy of
lambda-cyhalothrin treated nets in Anopheles gambiae pyrethroid
resistance areas of Côte d'Ivoire. The American journal of tropical
medicine and hygiene, 73(5), 859-864.
Hervy, J-P. and Sales, S. (1980) Évaluation de la
rémanence de deux pyréthrinoïdes de synthèse
Thèse de Doctorat unique - 126
-
-OMS-1821 et OMS-1998 - après imprégnation de
différents tissus entrant dans la confection de moustiquaires.
Bobo-Dioulasso : OCCGE, pp. 1- 10.
https://doi: fdi:10000.
Hien, A. S., Soma, D. D., Maiga, S., Coulibaly, D.,
Diabaté, A., Belemvire, A., Diouf, M. B., Jacob, D., Koné, A.,
Dotson, E., Awolola, T. S., Oxborough, R. M., & Dabiré, R. K.
(2021). Evidence supporting deployment of next generation insecticide treated
nets in Burkina Faso : bioassays with either chlorfenapyr or piperonyl butoxide
increase mortality of pyrethroid-resistant Anopheles gambiae. Malaria
journal, 20(1), 406.
https://doi.org/10.1186/s12936-021-03936-3
.
Hoffmann, A. A., Montgomery, B. L., Popovici, J.,
Iturbe-Ormaetxe, I., Johnson, P. H., Muzzi,
F., Greenfield, M., Durkan, M., Leong, Y. S., Dong, Y., Cook,
H., Axford, J., Callahan, A.
G., Kenny, N., Omodei, C., McGraw, E. A., Ryan, P. A.,
Ritchie, S. A., Turelli, M., & O'Neill, S. L. (2011). Successful
establishment of Wolbachia in Aedes populations to
suppress dengue transmission. Nature,
476(7361), 454-457.
https://doi.org/10.1038/nature10356
Hummelbrunner, L. A., and Isman, M. B. (2001). Acute,
sublethal, antifeedant, and synergistic effects of monoterpenoid essential oil
compounds on the Tobacco cutworm, Spodoptera Litura (Lep., Noctuidae).
Journal of Agricultural and Food Chemistry 49 (2): 715-20.
https://doi.org/10.1021/JF000749T.
Hyldgaard, M., Mygind, T., & Meyer, R. L. (2012).
Essential oils in food preservation: mode of action, synergies, and
interactions with food matrix components. Frontiers in microbiology,
3, 12.
https://doi.org/10.3389/fmicb.2012.00012.
Ilboudo, Z., L. Dabiré C.B., Nébié R.
C.H., Dicko I. O., Dugravot S., Cortesero A. M., and Sanon A. (2010).
Biological activity and persistence of four essential oils towards the main
pest of Stored Cowpeas, Callosobruchus maculatus (F.) (Coleoptera:
Bruchidae). Journal of Stored Products Research 46 (2): 124-28.
https://doi.org/10.1016/j.jspr.2009.12.002.
Ileke, K. D., Oyeniyi, E. A., Ogungbite, O. C., & Adesina, J.
M. (2015). Nicotiana tabacum a prospective mosquitocide in the
management of Anopheles gambiae (Giles). International Journal of
Mosquito Research, 2(4): 19-23.
Institut National de la Statistique et de la Démographie
(INSD), (2020). Résultats préliminaires
Thèse de Doctorat unique - 127
-
du cinquième recensement général de la
population et de l'habitation du Burkina Faso.
Intirach, J., Junkum, A., Tuetun, B., Choochote, W., Chaithong,
U., Jitpakdi, A., ... &
Pitasawat, B. (2012). Chemical constituents and combined
larvicidal effects of selected essential oils against Anopheles cracens
(Diptera: Culicidae). Psyche, 2012.
.
https://doi.org/10.1155/2012/591616.
Ishak, I. H., Kamgang, B., Ibrahim, S. S., Riveron, J. M.,
Irving, H., & Wondji, C. S. (2017). Pyrethroid resistance in Malaysian
populations of dengue vector Aedes aegypti is mediated by CYP9 family
of cytochrome P450 genes. PLoS neglected tropical diseases, 11(1):
e0005302.
https://doi.org/10.1371/journal.pntd.0005302.
Isman, M. B. (2000). Plant essential oils for pest and disease
management. Crop Protection 19 (8-10): 603-8.
https://doi.org/10.1016/S0261-2194(00)00079-X.
Iwu, M. W., Duncan, A. R., & Okunji, C. O. (1999). New
antimicrobials of plant origin. Perspectives on new crops and new uses.
ASHS Press, Alexandria, VA, 457, 462.
Jones, J. W., Meisch, M. V., Meek, C. L. and Bivin, W. S. (1992)
`Lethal effects of ivermectin on Anopheles quadrimaculatus.', Journal
of the American Mosquito Control Association, 8(3), pp. 278-280.
https://pubmed.ncbi.nlm.nih.gov/1402865/.
Kalemba, D, and Kunicka A. (2003). Antibacterial and antifungal
properties of essential oils. Current Medicinal Chemistry 10 (10):
813-29.
Kamgang, B., Marcombe, S., Chandre, F., Nchoutpouen, E.,
Nwane, P., Etang, J., Corbel, V., & Paupy, C. (2011). Insecticide
susceptibility of Aedes aegypti and Aedes albopictus in
Central Africa. Parasites & vectors, 4: 79.
https://doi.org/ 10.1186/1756-3305-4-79 .
Katz, T. M., Miller, J. H., & Hebert, A. A. (2008). Insect
repellents: historical perspectives and new developments. Journal of the
American Academy of Dermatology, 58(5), 865-871.
https://doi.org/10.1016/j.jaad.2007.10.005
Kawada, H., Oo, S. Z. M., Thaung, S., Kawashima, E., Maung, Y. N.
M., Thu, H. M., ... & Minakawa, N. (2014). Co-occurrence of point mutations
in the voltage-gated sodium channel of pyrethroid-resistant Aedes aegypti
populations in Myanmar. PLoS Neglected Tropical Diseases,
8(7): e3032.
https://doi.org/10.1371/journal.pntd.0003032.
Kawada, H., Higa, Y., Futami, K., Muranami, Y., Kawashima, E.,
Osei, J. H., ... & Minakawa,
Thèse de Doctorat unique - 128
-
N. (2016). Discovery of point mutations in the voltage-gated
sodium channel from African
Aedes aegypti populations: potential phylogenetic
reasons for gene introgression. PLOS Neglected Tropical Diseases,
10(6):
e0004780.
doi.org/10.1371/journal.pntd.0004780.
Kiendrebeogo, M., Coulibaly, A. Y., Nebie, R. C., Zeba, B.,
Lamien, C. E., Lamien-Meda, A., & Nacoulma, O. G. (2011).
Antiacetylcholinesterase and antioxidant activity of essential oils from six
medicinal plants from Burkina Faso. Revista Brasileira de
Farmacognosia, 21, 63-69.
Knols, B. G. J., Farenhorst, M., Andriessen, R., Snetselaar, J.,
Suer, R. A., Osinga, A. J., Knols, J. M. H., Deschietere, J., Ng 'habi, K. R.,
Lyimo, I. N., Kessy, S. T., Mayagaya, V. S., Sperling, S., Cordel, M.,
Sternberg, E. D., Hartmann, P., Mnyone, L. L., Rose, A. and Thomas, M. B.
(2016) `Eave tubes for malaria control in Africa: an introduction', Malaria
Journal, 15(404): 1-7. doi: 10.1186/s12936-016-1452-x.
Kobylinski, K. C., Sylla M., Chapman P. L., Sarr M. D. and Foy B.
D. (2011) `Ivermectin mass drug administration to humans disrupts malaria
parasite transmission in Senegalese villages', American Journal of Tropical
Medicine and Hygiene, 85(1), pp. 3-5. doi: 10.4269/ajtmh.2011.11-0160.
Kobylinski, K. C., Alout H., Foy B. D., Clements, A.,
Adisakwattana, P., Swierczewski, B. E. and Richardson, J. H. (2014) `Rationale
for the coadministration of albendazole and ivermectin to humans for malaria
parasite transmission control', American Journal of Tropical Medicine and
Hygiene, 91(4), pp. 655-662. doi: 10.4269/ajtmh.14-0187.
Kory, P., Meduri, G. U., Varon, J., Iglesias, J., & Marik, P.
E. (2021). Review of the emerging evidence demonstrating the efficacy of
ivermectin in the prophylaxis and treatment of COVID-19. American journal
of therapeutics, 28(3), e299. doi:
10.1097/MJT.0000000000001377
Koul, O., Walia, S., & Dhaliwal, G. S. (2008). Essential oils
as green pesticides: potential and constraints. Biopesticides
international, 4(1), 63-84.
Kpatinvoh, B., Adjou E. S., Dahouenon-Ahoussi E., Konfo C. T. R.,
Atrevi B., Soumanou M. M., Sohounhloue D. C. K. (2017). Efficacité des
huiles essentielles de trois plantes aromatiques contre la mycoflore
d'altération du niébé collecté dans les magasins de
vente du
Thèse de Doctorat unique - 129
-
Sud-Bénin. Journal of Applied Biosciences 109 :
10680-10687.
https://doi.org/10.4314/jab.v109i1.12.
Kraemer, M. U., Sinka, M. E., Duda, K. A., Mylne, A. Q., Shearer,
F. M., Barker, C. M., Moore, C. G., Carvalho, R. G., Coelho, G. E., Van Bortel,
W., Hendrickx, G., Schaffner, F., Elyazar, I. R., Teng, H. J., Brady, O. J.,
Messina, J. P., Pigott, D. M., Scott, T. W., Smith, D. L., Wint, G. R., ...
Hay, S. I. (2015). The global distribution of the arbovirus vectors Aedes
aegypti and Ae. albopictus. eLife, 4, e08347.
https://doi.org/10.7554/eLife.08347
Kweka, E. J., Nyindo, M., Mosha, F., & Silva, A. G. (2011).
Insecticidal activity of the essential oil from fruits and seeds of Schinus
terebinthifolia Raddi against African malaria vectors. Parasites &
Vectors, 4(1), 1-10.
https://doi.org/10.1186/1756-3305-4-129.
Lacey, L. A. (1990). The medical importance of riceland mosquito
and their control using alternatives to chemical insecticides. Journal of
the American Mosquito Control Association, no. 7.
Lee, H. S. (2006). Mosquito larvicidal activity of aromatic
medicinal plant oils against aedes aegypti and culex Pipiens pallens.
Journal of the American Mosquito Control Association
22 (2): 292-95.
https://doi.org/10.2987/8756-971X(2006)22[292:MLAOAM]2.0.CO;2.
Lehmann, T., Dao, A., Yaro, A. S., Diallo, M., Timbiné,
S., Huestis, D. L., ... & Traoré, A. I. (2014). Seasonal variation
in spatial distributions of Anopheles gambiae in a Sahelian village:
evidence for aestivation. Journal of medical entomology,
51(1), 27-38.
Li, C., Gao, Y., Zhao, Z., Ma, D., Zhou, R., Wang, J., ... &
Liu, Q. (2021). Potential geographical distribution of Anopheles gambiae
worldwide under climate change. Journal of Biosafety and Biosecurity,
3(2),
125-130.
doi.org/10.1016/j.jobb.2021.08.004
Licciardi, S., Hervé, J. P., Darriet, F., Hougard, J. M.,
& Corbel, V. (2006). Lethal and behavioural effects of three synthetic
repellents (DEET, IR3535 and KBR 3023) on Aedes aegypti mosquitoes in
laboratory assays. Medical and veterinary entomology, 20(3),
288293.
https://doi.org/10.1111/j.1365-2915.2006.00630.x.
Liu, T. T., Chao, L. K. P., Hong, K. S., Huang, Y. J., &
Yang, T. S. (2019). Composition and
Thèse de Doctorat unique - 130
-
insecticidal activity of essential oil of Bacopa caroliniana
and interactive effects of individual compounds on the activity.
Insects, 11(1), 23.
https://doi.org/10.3390/insects11010023.
Lovett, B., Bilgo, E., Millogo, S. A., Ouattarra, A. K., Sare,
I., Gnambani, E. J., Dabire, R.
K., Diabate, A., & St Leger, R. J. (2019). Transgenic
Metarhizium rapidly kills mosquitoes in a malaria-endemic region of
Burkina Faso. Science (New York, N.Y.), 364(6443), 894- 897.
https://doi.org/10.1126/science.aaw8737
Lucia, A., Audino, P. G., Seccacini, E., Licastro, S., Zerba, E.,
& Masuh, H. (2007). Larvicidal effect of Eucalyptus grandis essential oil
and turpentine and their major components on Aedes aegypti larvae.
Journal of the American Mosquito Control Association, 23(3),
299303.
https://doi.org/10.2987/8756-971X(2007)23[299:LEOEGE]2.0.CO;2.
Lundwall, E., Pennetier, C., Corbel, V., de Gentile, L., Legros,
F. (2005) Paludisme: se protéger des piqûres d'anophèles.
La Revue du Praticien. 55
Luz, T. R. S. A., de Mesquita, L. S. S., do Amaral, F. M. M.,
& Coutinho, D. F. (2020). Essential oils and their chemical constituents
against Aedes aegypti L.(Diptera: Culicidae) larvae. Acta
Tropica, 212, 105705.
https://doi.org/10.1016/j.actatropica.2020.105705.
Maïga, H., Damiens, D., Niang, A., Sawadogo, S. P.,
Fatherhaman, O., Lees, R. S., Roux, O., Dabiré, R. K., Ouedraogo, G. A.,
Tripet, F., Diabaté A. & Gilles, J. R. (2014). Mating
competitiveness of sterile male Anopheles coluzzii in large cages.
Malaria Journal, 13(1), 16. https://doi.org/
10.1186/1475-2875-13-460.
Manh, H. D., Hue, D. T., Hieu, N. T. T., Tuyen, D. T. T., &
Tuyet, O. T. (2020). The Mosquito larvicidal activity of essential oils from
Cymbopogon and Eucalyptus Species in Vietnam. Insects, 11(2),
128.
https://doi.org/10.3390/insects11020128.
Mansour, S. A., Foda, M. S., & Aly, A. R. (2012).
Mosquitocidal activity of two Bacillus bacterial endotoxins combined
with plant oils and conventional insecticides. Industrial crops and
products, 35(1), 44-52. https://doi.org/
10.1016/j.indcrop.2011.06.001.
Marcombe, S., Fustec, B., Cattel, J., Chonephetsarath, S.,
Thammavong, P., Phommavanh, N., David, J. P., Corbel, V., Sutherland, I. W.,
Hertz, J. C., & Brey, P. T. (2019).
Thèse de Doctorat unique - 131
-
Distribution of insecticide resistance and mechanisms involved in
the arbovirus vector Aedes aegypti in Laos and implication for vector
control. PLoS neglected tropical diseases, 13(12), e0007852.
https://doi.org/10.1371/journal.pntd.0007852.
Marshall, J. M., White, M. T., Ghani, A. C., Schlein, Y., Muller,
G. C. and Beier ,J. C. (2013) `Quantifying the mosquito's sweet tooth:
Modelling the effectiveness of attractive toxic sugar baits (ATSB) for malaria
vector control', Malaria Journal, 12(291), pp. 1-13. doi:
10.1186/1475-2875-12-291.
Martinez-Torres, D., Chandre, F., Williamson, M. S., Darriet, F.,
Berge, J. B., Devonshire, A. L., ... & Pauron, D. (1998). Molecular
characterization of pyrethroid knockdown resistance (kdr) in the major malaria
vector Anopheles gambiae ss. Insect molecular biology,
7(2): 179-184.
https://doi.org/10.1046/j.1365-2583.1998.72062.x.
Mbare, O., Lindsay, S. W., & Fillinger, U. (2014).
Pyriproxyfen for mosquito control: female sterilization or horizontal transfer
to oviposition substrates by Anopheles gambiae sensu stricto and
Culex quinquefasciatus. Parasites & vectors,
7(1), 1-12.
https://doi.org/10.1186/1756-3305-7-280
Ministère de la Sante du Burkina Faso, Direction Des
Statistiques Sectorielles, (2022). Paludisme Au Burkina: Bulletin
Epidemiologique, 4-7.
Ministère de la Santé du Burkina Faso, Direction
Des Statistiques Sectorielles, (2017). Flambée de Cas de Dengue Au
Burkina Faso. Sitrep Dengue. no. 26: 11
Minjas, J. N., & Sarda, R. K. (1986). Laboratory observations
on the toxicity of Swartzia madagascariensis (Leguminosae) extract to
mosquito larvae. Transactions of the Royal Society of Tropical Medicine and
Hygiene, 80(3), 460-461.
https://doi.org/10.1007/s11101-010-9170-4.
Moore, S. J., Lenglet, A., & Hill, N. (2002). Field
evaluation of three plant-based insect repellents against malaria vectors in
Vaca Diez Province, the Bolivian Amazon. Journal of the American Mosquito
Control Association, 18(2), 107-110.
Moretti, A. N., Zerba E. N., and Alzogaray, R. A. (2013).
Behavioral and toxicological responses of rhodnius prolixus and triatoma
infestans (Hemiptera: Reduviidae) to 10 monoterpene alcohols. Journal of
Medical Entomology 50 (5): 1046-54.
Thèse de Doctorat unique - 132
-
https://doi.org/10.1603/ME12248.
Mosqueira, B., Duchon S., Chandre F., Hougard J. M., Carnevale
P. and Mas-Coma S. (2010) `Efficacy of an insecticide paint against
insecticide-susceptible and resistant mosquitoes - Part 1: Laboratory
evaluation', Malaria Journal, 9(340): 1-6. doi:
10.1186/14752875-9-340.
Mouchès, C., Magnin, M., Bergé, J. B., De
Silvestri, M., Beyssat, V., Pasteur, N., &
Georghiou, G. P. (1987). Overproduction of detoxifying esterases
in organophosphate-resistant Culex mosquitoes and their presence in other
insects. Proceedings of the National Academy of Sciences,
84(8): 2113-2116.
Müller, G. C., Beier, J. C., Traore, S. F., Toure, M. B.,
Traore, M. M., Bah, S., Doumbia, S. and Schlein, Y. (2010) `Field experiments
of Anopheles gambiae attraction to local fruits/seedpods and flowering
plants in Mali to optimize strategies for malaria vector control in Africa
using attractive toxic sugar bait methods', Malaria Journal, 9(1):
111.
https://doi.org/10.1186/1475-2875-9-262.
Murugan, K., and Kumar P. M. (2012). Larvicidal, pupicidal ,
repellent and adulticidal activity of citrus sinensis orange peel extract
against Anopheles stephensi, Aedes Aegypti and Culex
quinquefasciatus (Diptera : Culicidae). Parasitology Research
111: 1757-69.
https://doi.org/10.1007/s00436-012-3021-8.
Muthu, C., Ayyanar M., Raja N., and Ignacimuthu S. (2006).
Medicinal plants used by traditional healers in kancheepuram district of Tamil
Nadu, India. Journal of Ethnobiology and Ethnomedicine 2: 1-10.
https://doi.org/10.1186/1746-4269-2-43.
Muturi, E. J., Ramirez, J. L., Doll, K. M., & Bowman, M.
J. (2017). Combined toxicity of three essential oils against Aedes aegypti
(Diptera: Culicidae) larvae. Journal of Medical Entomology,
54(6), 1684-1691.
https://doi.org/10.1093/jme/tjx168.
Namountougou, M., Diabaté, A., Etang, J., Bass, C.,
Sawadogo, S. P., Gnankiné, O., Baldet T., Martin T., Chandre F., Simard
F. & Dabiré, R. K. (2013). First report of the L1014S kdr mutation
in wild populations of Anopheles gambiae M and S molecular forms in
Burkina Faso (West Africa). Acta tropica, 125(2): 123-127.
https://doi.org/10.1016/j.actatropica.2012.10.012.
Namountougou, M., Soma, D. D., Kientega, M., Balboné, M.,
Kaboré, D. P. A., Drabo, S. F.,
Thèse de Doctorat unique - 133
-
Coulibaly A. Y., Fournet F., Baldet T., Diabaté A.,
Dabiré R. K. & Gnankine, O. (2019). Insecticide resistance
mechanisms in Anopheles gambiae complex populations from Burkina
Faso, West Africa. Acta tropica, 197:
105054. https://doi.org/
10.1016/j.actatropica.2019.105054.
Namountougou, M., Soma, D. D., Balboné, M., Kaboré,
D. A., Kientega, M., Hien, A., Coulibaly A., Ouattara P. E., Meda B. G., Drabo
S., Koala L., Nignan C., Kagone T., Diabate A., Fournet F., Gnankine O. &
Dabiré, R. K. (2020). Monitoring insecticide susceptibility in Aedes
Aegypti populations from the two biggest cities, Ouagadougou and
Bobo-Dioulasso, in Burkina Faso: implication of metabolic resistance.
Tropical Medicine and Infectious Disease, 5(2), 84.
https://doi.org/ 10.3390/tropicalmed5020084.
Nararak, J., Sathantriphop, S., Kongmee, M., Mahiou-Leddet, V.,
Ollivier, E., Manguin,
S., & Chareonviriyaphap, T. (2019). Excito-repellent
activity of â-caryophyllene oxide against Aedes aegypti and
Anopheles minimus. Acta tropica, 197, 105030.
Ndirangu, E. G., Opiyo, S., & Ng'ang'a, M. W. (2020).
Chemical composition and repellency of Nigella sativa L. seed
essential oil against Anopheles gambiae sensu stricto. Trends in
Phytochemical Research, 4(2), 77-84.
Nerio, L. S., Olivero-Verbel, J., & Stashenko, E. E. (2009).
Repellent activity of essential oils from seven aromatic plants grown in
Colombia against Sitophilus zeamais Motschulsky (Coleoptera).
Journal of Stored Products Research, 45(3): 212-214.
https://doi.org/10.1016/j.jspr.2009.01.002.
N'Guessan, R., Corbel, V., Akogbéto, M., & Rowland,
M. (2007). Reduced efficacy of insecticide-treated nets and indoor residual
spraying for malaria control in pyrethroid resistance area, Benin. Emerging
infectious diseases, 13(2): 199.
https://doi.org/10.3201/eid1302.060631.
Nikou, D., Ranson H., and Hemingway J. (2003). An
adult-specific CYP6 P450 gene is overexpressed in a pyrethroid-resistant strain
of the malaria vector, Anopheles gambiae.» gene 318:
91-102.
https://doi.org/10.1016/S0378-1119(03)00763-7.
Nolen, J. A., Bedoukian R. H., Maloney R. E., and Kline D. L.
(2002). Method, apparatus and compositions for inhibiting the human scent
tracking ability of mosquitoes in
Thèse de Doctorat unique - 134
-
environmentally defined three dimensional spaces. U.S. Patent
No 6,362,235, 26 Mars 2002.
Nolan, T., Papathanos P., Windbichler N., Magnusson K., Benton
J., Catteruccia F., Crisanti A. (2011) Developing transgenic Anopheles
mosquitoes for the sterile insect technique. Genetica. 139(1):33-9.
Norris, E. J., Johnson, J. B., Gross, A. D., Bartholomay, L. C.,
& Coats, J. R. (2018). Plant essential oils enhance diverse pyrethroids
against multiple strains of mosquitoes and inhibit detoxification enzyme
processes. Insects, 9(4), 132.
https://doi.org/10.3390/insects9040132
Ntonga, P. A., Baldovini, N., Mouray, E., Mambu, L., Belong,
P., & Grellier, P. (2014). Activity of Ocimum basilicum,
Ocimum canum, and Cymbopogon citratus essential oils against
Plasmodium falciparum and mature-stage larvae of Anopheles
funestus ss. Parasite, 21 (6): 33.
https://doi.org/10.1051/parasite/2014033.
Ntonga, A. P., Jazet, D. P. M., Tonga, C., Mache, N. P., &
Kekeunou, S. (2017). Evaluation de la toxicité des huiles essentielles
des feuilles de Callistemon citrinus, Cinnamomum zeylanicum
et Psidium guajava sur les adultes de Anopheles coluzzii
Coetzee et Wilkerson 2013, vecteur du paludisme urbain au Cameroun.
Cameroon Journal of Biological and Biochemical Sciences, 25,
12-21.
Ojewumi, M. E., Adeyemi, A. O., & Ojewumi, E. O. (2018).
Oil extract from local leaves-an alternative to synthetic mosquito repellants.
Pharmacophore, 9(2), 1-6.
http://www.pharmacophorejournal.com.
Omolo, M. O., Okinyo D., Ndiege I. O., and Hassanali A.
(2004). Repellency of essential oils of some Kenyan plants against
Anopheles gambiae 65: 2797-2802.
https://doi.org/10.1016/j.phytochem.2004.08.035.
Oparaocha, E. T., Iwu, I., & Ahanaku, J. E. (2010).
Preliminary study on mosquito repellent and mosquitocidal activities of
Ocimum gratissimum (L.) grown in eastern Nigeria. Journal of
Vector Borne Diseases, 47(1), 45.
Organisation Mondiale de la Santé (OMS). (1992). Vector
resistance for pesticides. World Health Organization technical report serial
818, p. 62. OMS, Geneve, Suisse.
Organisation Mondiale de la Santé (OMS). (2001). Report of
the fourth WHOPES working
Thèse de Doctorat unique - 135
-
group meeting. Review of: IR3535; KBR3023; (RS)-methoprene 20%
EC; pyriproxyfen 0.5% GR and lambda-cyhalothrin 2.5% CS. Document
WHO/CDS/WHOPES/2001.2. OMS, Geneve, Suisse.
Organisation Mondiale de la Santé (OMS). (2002).
Stratégie de l ' OMS pour la médecine traditionnelle pour 2002 -
2005.» OMS, Geneve, Suisse.
Organisation Mondiale de la Santé (OMS). (2006).
Pesticides and their application for the
control of vectors and pests of public health importance.
Document WHO/CDS/WHOPES/GCDPP/2006.1. OMS, Geneve, Suisse.
Organisation Mondiale de la Santé (OMS). (2012). Global
plan for insecticide resistance
management in malaria vectors.
http://apps.who.int/iris/bitstream/10665/44846/1/9789241564472_eng.pdf.
OMS, Geneve, Suisse.
Organisation Mondiale de la Santé (OMS). (2013).
Guidelines for efficacy testing of spatial repellents. OMS, Geneve, Suisse.
Organisation Mondiale de la Santé (OMS). (2014).
Entomologie du paludisme et lutte antivectorielle, 1-200, OMS, Geneve,
Suisse.
Organisation Mondiale de la Santé (OMS). (2017).
Procédures pour tester la résistance aux insecticides chez les
moustiques vecteurs du paludisme Seconde Édition. OMS, Geneve, Suisse
Organisation Mondiale de la Santé (OMS). (2019).
Guidelines for malaria vector control. OMS, Geneve, Suisse.
Organisation Mondiale de la Santé (OMS). (2020). World
Malaria Report. World Health. Vol. WHO/HTM/GM. OMS, Geneve, Suisse.
https://doi.org/ISBN 978 92 4
1564403.
Organisation Mondiale de la Santé (OMS). (2021).
Éthique et maladies à transmission vectorielle : orientations de
l'OMS. OMS, Geneve, Suisse
Organisation Mondiale de la Santé (OMS). (2022a). Dengue
et Dengue Sévère. OMS, Geneve, Suisse.
Organisation Mondiale de la Santé (OMS). (2022b). Standard
Operating Procedure for Testing
Thèse de Doctorat unique - 136
-
Insecticide Susceptibility of Adult Mosquitoes in WHO Tube Tests.
OMS, Geneve, Suisse.
Osborn, F. R., Herrera, M. J., Gómez, C. J., &
Salazar, A. (2007). Comparison of two
commercial formulations of Bacillus thuringiensis var.
israelensis for the control of Anopheles aquasalis (Diptera:
Culicidae) at three salt concentrations. Memórias do Instituto
Oswaldo Cruz, 102: 69-72.
Ouattara, L. P. E., Sangaré, I., Namountougou, M., Hien,
A., Ouari, A., Soma, D. D., ... & Dabiré, K. R. (2019). Surveys of
arboviruses vectors in four cities stretching along a railway transect of
Burkina Faso: risk transmission and insecticide susceptibility status of
potential vectors. Frontiers in Veterinary Science, 6, 140.
https://doi.org/10.3389/fvets.2019.00140.
Ouédraogo, S., Benmarhnia, T., Bonnet, E., Somé, P.
A., Barro, A. S., Kafando, Y., ... &
Ridde, V. (2018). Evaluation of effectiveness of a
community-based intervention for control of dengue virus vector, Ouagadougou,
Burkina Faso. Emerging infectious diseases, 24(10), 1859.
Oyedele, A. O., Gbolade A. A., Sosan M. B., Adewoyin F. B.,
Soyelu O. L., and Orafidiya O. O. (2002). Formulation of an effective
mosquito-repellent topical product from lemongrass oil. Phytomedicine
9 (3): 259-62.
https://doi.org/10.1078/0944-7113-00120.
Pagès, F., Orlandi-pradines, E., Corbel, V. (2007).
Vecteurs du paludisme: biologie, diversité, contrôle et protection
individuelle. Médecine Malafies Infect. 37, 153-161.
https://doi.org/10.1016/j.medmal.2006.10.009.
Pålsson, K., and Jaenson T. G.T. (1999). Plant products
used as mosquito repellents in Guinea Bissau, West Africa. Acta Tropica
72 (1): 39-52.
https://doi.org/10.1016/S0001-706X(98)00083-7.
Paluch, G., Bartholomay, L., & Coats, J. (2010). Mosquito
repellents: a review of chemical structure diversity and olfaction. Pest
management science, 66(9), 925-935.
https://doi.org/10.1002/ps.1974.
Park, H. M., Kim, J., Chang, K. S., Kim, B. S., Yang, Y. J., Kim,
G. H., ... & Park, I. K. (2011). Larvicidal activity of Myrtaceae essential
oils and their components against Aedes aegypti, acute toxicity on
Daphnia magna, and aqueous residue. Journal of medical
entomology, 48(2), 405-410.
https://doi.org/10.1603/ME10108.
Thèse de Doctorat unique - 137
-
Pavela, R. (2008). Acute and synergistic effects of some
monoterpenoid essential oil compounds on the house fly (Musca Domestica
L.). Journal of Essential Oil-Bearing Plants 11 (5): 451-59.
https://doi.org/10.1080/0972060X.2008.10643653.
Pavela, R. (2014). Acute, synergistic and antagonistic effects of
some aromatic compounds on the Spodoptera littoralis Boisd.(Lep.,
Noctuidae) larvae. Industrial crops and products, 60, 247258.
https://doi.org/10.1016/j.indcrop.2014.06.030.
Pavela, R. (2015). Acute toxicity and synergistic and
antagonistic effects of the aromatic compounds of some essential oils against
Culex quinquefasciatus Say larvae. Parasitology Research, 114(10), 3835-3853.
https://doi.org/10.1007/s00436-015-4614-9.
Peerzada, M., N. (1997). Molecules chemical composition of the
essential oil of Hyptis Suaveolens. Molecules 2 (11): 165-68.
Plapp, F. W. (1984). The genetic basis of insecticide resistance
in the house fly: evidence that a single locus plays a major role in metabolic
resistance to insecticides. Pesticide Biochemistry and Physiology 201:
194-201.
Poda, S. B., Soma, D. D., Hien, A., Namountougou, M.,
Gnankiné, O., Diabaté, A., ... & Dabiré, R. K. (2018).
Targeted application of an organophosphate-based paint applied on windows and
doors against Anopheles coluzzii resistant to pyrethroids under real
life conditions in Vallée du Kou, Burkina Faso (West Africa).
Malaria Journal, 17(1): 1-9.
https://doi.org/10.1186/s12936-018-2273-x.
Pohlit, A. M., Lopes, N. P., Gama, R. A., Tadei, W. P., &
Neto, V. F. (2011). Patent literature on mosquito repellent inventions which
contain plant essential oils--a review. Planta medica, 77(6)
: 598-617.
https://doi.org/10.1055/s-0030-1270723
.
Pooda H. S., Rayaisse J. B., Hien D. F. D. S., Lefèvre T.,
Yerbanga S. R., Bengaly Z., Dabiré R. K., Belem A. M. G., Sidibé
I., Solano P. and Mouline K. (2015) `Administration of ivermectin to
peridomestic cattle: A promising approach to target the residual transmission
of human malaria', Malaria Journal, 14(486): 1-12. doi:
10.1186/s12936-015-1001-z.
Ramirez, G. I. J., Logan J. G., Loza-Reyes E., Elena Stashenko
E., and Moores G. D. (2012) Repellents inhibit P450 enzymes in
Stegomyia (Aedes) aegypti. PLoS One 7: e48678.
https://doi.org/ 10.1371/journal.pone.0048698 .
Thèse de Doctorat unique - 138
-
Ranson, H., Jensen, B., Vulule, J. M., Wang, X., Hemingway, J.,
& Collins, F. H. (2000). Identification of a point mutation in the
voltage-gated sodium channel gene of Kenyan Anopheles gambiae
associated with resistance to DDT and pyrethroids. Insect molecular
biology, 9(5), 491-497.
Ranson, H., N'guessan, R., Lines, J., Moiroux, N., Nkuni, Z.,
& Corbel, V. (2011). Pyrethroid resistance in African anopheline
mosquitoes: what are the implications for malaria control?. Trends in
parasitology, 27(2): 91-98.
https://doi.org/10.1016/j.pt.2010.08.004.
Ranson, H., & Lissenden, N. (2016). Insecticide Resistance in
African Anopheles Mosquitoes: A Worsening Situation that Needs Urgent Action to
Maintain Malaria Control. Trends in parasitology, 32(3) :
187-196. https://doi.org/ 10.1016/j.pt.2015.11.010.
Rants'o, T. A., Koekemoer, L. L., Panayides, J. L., & van
Zyl, R. L. (2022). Potential of Essential Oil-Based Anticholinesterase
Insecticides against Anopheles Vectors: A Review. Molecules
(Basel, Switzerland), 27(20), 7026.
https://doi.org/10.3390/molecules27207026.
Redwane, A., Lazrek H. B., Bouallam S., Markouk M., Amarouch H.,
and Jana M. (2002). «Larvicidal activity of extracts from Quercus
lusitania Var. Infectoria galls (Oliv.). Journal of
Ethnopharmacology 79 (2): 261-263.
https://doi.org/10.1016/S0378-8741(01)00390-7.
Rehman, J. U., Ali, A., & Khan, I. A. (2014). Plant based
products: use and development as repellents against mosquitoes: A review.
Fitoterapia, 95, 65-74.
https://doi.org/10.1016/j.fitote.2014.03.002.
Robert, V., Ayala D. and Simard F. (2017) `Chapitre 10. Les
anophèles (Diptera : Culicidae : Anophelinae)', in Entomologie
médicale et vétérinaire. IRD éditions. Marseille,
pp. 181241. doi: 10.4000/books.irdeditions.22031.
Rodhain, F., & Perez, C. (1985). Precis d'entomologie
medicale et veterinaire; notions d'epidemiologie des maladies a vecteurs.
Rohrer, S. P., Birzin, E. T., Eary, C. H., Schaeffer, J. M. and
Shoop, W. L. (1994) `Ivermectin binding sites in sensitive and resistant
Haemonchus contortus', The Journal of Parasitology, 80(3):
493-493. doi: 10.2307/3283426.
Rübsamen, H., Montgomery, M., Hess, G. P., Eldefrawi, A. T.,
& Eldefrawi, M. E. (1976).
Thèse de Doctorat unique - 139
-
Identification of a calcium-binding subunit of the
acetylcholine receptor. Biochemical and Biophysical Research
Communications, 70(3), 1020-1027.
Rutledge, L. C., Collister, D. M., Meixsell, V. E., and
Eisenberg, G. H. G. (1983). Comparative sensitivity of representative
mosquitoes (DIPTERA: CULICIDAE) to repellents. Journal of Medical
Entomology 20 (5): 506-10.
Rutledge, L. C., Hooper, R. L., Wirtz, R. A., & Gupta, R.
K. (1989). Efficacy of diethyl methylbenzamide (DEET) against Aedes
dorsalis and a comparison of two end points for
protection time. Journal of the American Mosquito Control
Association, 5(3): 363-368.
Samba, N., Aitfella-Lahlou, R., Nelo, M., Silva, L., Coca, R.,
Rocha, P., & López Rodilla, J. M. (2020). Chemical Composition and
Antibacterial Activity of Lippia multiflora Moldenke Essential Oil
from Different Regions of Angola. Molecules (Basel, Switzerland),
26(1), 155.
https://doi.org/10.3390/molecules26010155.
Sampaio, V. S., Beltrán, T. P., Kobylinski, K. C., Melo,
G. C., Lima, J. B. P., Silva, S. G. M., Rodriguez, Í. C., Silveira H.,
Guerra M. G. V. B., Bassat Q., Pimenta P. F. P., Lacerda M. V. G. and Monteiro
W. M. (2016) `Filling gaps on ivermectin knowledge: e ects on the survival and
reproduction of Anopheles aquasalis, a Latin American malaria vector',
Malaria Journal, 15(491): 1-9. doi: 10.1186/s12936-016-1540-y.
Sarma, R., Adhikari, K., Mahanta, S., & Khanikor, B.
(2019). Combinations of plant essential oil based terpene compounds as
larvicidal and adulticidal agent against Aedes aegypti (Diptera:
Culicidae). Scientific reports, 9(1): 1-12.
https://doi.org/10.1038/s41598-019-45908-3.
Sawadogo, I., Paré, A., Kaboré, D., Montet, D.,
Durand, N., Bouajila, J., ... & Bassolé, I. H. N. (2022). Antifungal
and antiaflatoxinogenic effects of Cymbopogon citratus, Cymbopogon
nardus, and Cymbopogon schoenanthus essential oils alone and in
combination. Journal of Fungi, 8(2): 117.
https://doi.org/10.3390/jof8020117.
Sawadogo, S. P., Diabaté, A., Toé, H. K., Sanon,
A., Lefevre, T., Baldet, T., ... & Dabiré, R. K. (2013). Effects of
age and size on Anopheles gambiae ss male mosquito mating success.
Journal of medical entomology, 50(2): 285-293.
https://doi.org/10.1603/ME12041.
Schreck, C. E., & McGovern, T. P. (1989). Repellents and
other personal protection strategies against Aedes albopictus.
Journal of the American Mosquito Control Association, 5(2):
247-
Thèse de Doctorat unique - 140
-
250.
Semmler, M., Abdel-Ghaffar, F., Schmidt, J., & Mehlhorn, H.
(2014). Evaluation of biological and chemical insect repellents and their
potential adverse effects. Parasitology research, 113(1),
185-188.
https://doi.org/10.1007/s00436-013-3641-7.
Sengottayan, S. N. (2007). The use of Eucalyptus tereticornis
sm. (Myrtaceae) oil (Leaf Extract) as a natural larvicidal agent against
the malaria vector Anopheles stephensi Liston (Diptera :
Culicidae). Bioresource Technology 98: 1856-60.
https://doi.org/10.1016/j.biortech.2006.07.044.
Sinka, M. E., Bangs, M. J., Manguin, S., Coetzee, M., Mbogo, C.
M., Hemingway, J., ... & Hay, S. I. (2010). The dominant Anopheles vectors
of human malaria in Africa, Europe and the Middle East: occurrence data,
distribution maps and bionomic précis. Parasites & vectors,
3(1): 1-34.
https://doi.org/10.1186/1756-3305-3-117.
Sinka, M. E., Bangs, M. J., Manguin, S., Rubio-Palis, Y.,
Chareonviriyaphap, T., Coetzee,
M., ... & Hay, S. I. (2012). A global map of dominant malaria
vectors. Parasites & vectors, 5(1): 1-11.
https://doi.org/10.1186/1756-3305-5-69.
Sinkins, S. P., and Gould, F. (2006). Gene drive systems for
insect disease vectors.» Nature Reviews Genetics 7 (6): 427-35.
https://doi.org/10.1038/nrg1870.
Slater, H. C., Walker, P. G., Bousema, T., Okell, L. C., &
Ghani, A. C. (2014). The potential impact of adding ivermectin to a mass
treatment intervention to reduce malaria transmission: a modelling study.
The Journal of infectious diseases, 210(12), 1972-1980.
https://doi.org/10.1093/infdis/jiu351.
Slater, H. C., Foy, B. D., Kobylinski, K., Chaccour, C., Watson,
O. J., Hellewell, J., Aljayyoussi, G., Bousema, T., Burrows, J., D'Alessandro,
U., Alout, H., Ter Kuile, F. O., Walker, P., Ghani, A. C., & Smit, M. R.
(2020). Ivermectin as a novel complementary malaria control tool to reduce
incidence and prevalence: a modelling study. The Lancet. Infectious
diseases, 20(4), 498-508.
https://doi.org/10.1016/S1473-3099(19)30633-4.
Smith, David L., Perkins T. A., Tusting L. S., Scott T. W., and
Lindsay S. W. (2013). Mosquito population regulation and larval source
management in heterogeneous environments.» PLoS ONE 8 (8):
e71247.
https://doi.org/10.1371/journal.pone.0071247.
Thèse de Doctorat unique - 141
-
Snetselaar, J., Njiru, B. N., Gachie, B., Owigo, P., Andriessen,
R., Glunt, K., Osinga, A. J., Mutunga, J., Farenhorst, M. and Knols, B. G. J.
(2017) `Eave tubes for malaria control in Africa: Prototyping and evaluation
against Anopheles gambiae s.s. and Anopheles arabiensis under
semi-field conditions in western Kenya Lucy Tusting, Jo Lines', Malaria
Journal, 16(1), pp. 1-11. doi: 10.1186/s12936-017-1926-5.
Soma, D. D., Zogo, B. M., Somé, A., Tchiekoi, B. N.,
Hien, D. F. de S., Pooda, H. S., ... Dabiré, R. K. (2020). Anopheles
bionomics, insecticide resistance and malaria transmission in southwest Burkina
Faso: A pre-intervention study. PLOS ONE, 15(8), e0236920.
https://doi.org/10.1371/journal.pone.0236920.
Sombié, A., Saiki, E., Yaméogo, F., Sakurai, T.,
Shirozu, T., Fukumoto, S., Sanon, A.,
Weetman, D., McCall, P. J., Kanuka, H., & Badolo, A. (2019).
High frequencies of F1534C and V1016I kdr mutations and association
with pyrethroid resistance in Aedes aegypti from Somgandé
(Ouagadougou), Burkina Faso. Tropical medicine and health,
47, 2.
https://doi.org/10.1186/s41182-018-0134-5.
Sternberg, E. D., Ng'habi, K. R., Lyimo, I. N., Kessy, S. T.,
Farenhorst, M., Thomas, M. B., Knols, B. G. J. and Mnyone, L. L. (2016) `Eave
tubes for malaria control in Africa: initial development and semi-field
evaluations in Tanzania', Malaria Journal, 15(447): 111.
https://doi.org/10.1186/s41182-018-0134-5.
Sultana, S, Ali M, Ansari, SH, Bagri, P. (2008). The effect of
physical factors on chemical composition of the essential oil of Eucalyptus
citriodora Hook. leaves. J Essent Oil bearing Plants; 11: 69-74.
https://doi.org/10.1080/0972060X.2008.10643600.
Suputtamongkol, Y., Premasathian, N., Bhumimuang, K., Waywa, D.,
Nilganuwong, S., Karuphong, E., Anekthananon, T., Wanachiwanawin, D., &
Silpasakorn, S. (2011). Efficacy and safety of single and double doses of
ivermectin versus 7-day high dose albendazole for chronic strongyloidiasis.
PLoS neglected tropical diseases, 5(5), e1044.
https://doi.org/10.1371/journal.pntd.0001044.
Sylla, M., Gray, M., Chapman, P. L., Sarr, M. D. and Rasgon, J.
L. (2010) `Mass drug
Thèse de Doctorat unique - 142
-
administration of ivermectin in south-eastern Senegal reduces the
survivorship of wild-caught, blood fed malaria vectors', Malaria Journal,
9(365): 1-10.
https://doi.org/10.1186/14752875-9-365.
Tanprasit, P. (2005). Biological control of dengue fever
mosquitoes (Aedes aegypti Linn.) using leaf extracts of chan
(Hyptis suaveolens (l.) Poit.) and hedge flower (Lantana camara
Linn.).
Tawatsin, A., Wratten, S. D., Scott, R. R., Thavara, U., &
Techadamrongsin, Y. (2001). Repellency of volatile oils from plants against
three mosquito vectors. Journal of vector ecology: journal of the Society
for Vector Ecology, 26(1), 76-82.
Tchoumbougnang, F., Dongmo P. M. J., Sameza M. L., Mbanjo E. G.
N., Fotso G.B. T., Zollo P. H. A., and Menut C. (2009). Activité
larvicide sur Anopheles gambiae Giles et composition chimique des
huiles essentielles extraites de quatre plantes cultivées au
Cameroun.» Biotechnol. Agron. Soc. Environ. Vol. 13 numéro
1.
Toé, H. K., Zongo, S., Guelbeogo, M. W., Kamgang, B.,
Viana, M., Tapsoba, M., Sanon A., Traoré A., McCall P. J., & Sagnon,
N. F. (2022). Multiple insecticide resistance and first evidence of V410L kdr
mutation in Aedes (Stegomyia) aegypti (Linnaeus) from
Burkina
Faso. Medical and Veterinary Entomology, 36(3),
309-319.
https://doi.org/10.1111/mve.12602.
Tomé, H. V., Pascini, T. V., Dângelo, R. A., Guedes,
R. N., & Martins, G. F. (2014). Survival and swimming behavior of
insecticide-exposed larvae and pupae of the yellow fever mosquito Aedes
aegypti. Parasites & Vectors, 7(1): 1-9.
https://doi.org/10.1186/1756-3305-7-195.
Traore, M. M., Junnila, A., Traore, S. F., Doumbia, S., Revay, E.
E., Kravchenko, V. D., Schlein, Y., Arheart, K. L., Gergely, P., Xue R. D.,
Hausmann A., Beck R., Prozorov A., Diarra R. A., Kone A. S., Majambere S.,
Bradley, J., Vontas, J., Beier, J. C. and Müller, G. C. (2020)
`Large-scale field trial of attractive toxic sugar baits (ATSB) for the control
of malaria vector mosquitoes in Mali, West Africa', Malaria Journal, 19(72) :
1-16. https://doi.org/ 10.1186/s12936-020-3132-0.
Thèse de Doctorat unique - 143
-
Travis, B. V. (1947). Relative Effectiveness of various
Repellents against Anopheles farauti Laveran. Journal of the
National Malaria Society, 6(3): 180-83.
Tripathi, A. K., Upadhyay, S., Bhuiyan, M., & Bhattacharya,
P. R. (2009). A review on prospects of essential oils as biopesticide in
insect-pest management. J. Pharmacognosy Phytotherapy, 1, 052-063.
https://doi.org/10.5897/JPP.9000003.
Trpis, M., McClelland, G. A. H., Gillett, J. D., Teesdale, C.,
& Rao, T. R. (1973). Diel periodicity
in the landing of Aedes aegypti on man. Bulletin of
the World Health Organization, 48(5): 623.
Vani, R. S., Cheng S. F., and Chuah C. H. (2009). Comparative
study of volatile compounds from genus Ocimum. American Journal of Applied
Sciences 6 (3): 523-28.
https://doi.org/10.3844/ajas.2009.523.528.
Wangrawa, D. W., Kosgei, J., Machani, M., Opala, J., Agumba, S.,
Yaméogo, F., ... &
Ochomo, E. (2022a). Larvicidal Activities and Synergistic Effects
of Essential Oils against Anopheles funestus and Culex
quinquefasciatus (Diptera: Culicidae) from Kisumu, Kenya. Psyche: A
Journal of Entomology, 2022.
https://doi.org/10.1155/2022/8302696.
Wangrawa, D. W., Ochomo, E., Upshur, F., Zanré, N.,
Borovsky, D., Lahondere, C., ... & Sanon, A. (2022b). Essential oils and
their binary combinations have synergistic and antagonistic insecticidal
properties against Anopheles gambiae sl (Diptera: Culicidae).
Biocatalysis and Agricultural Biotechnology, 42, 102347.
https://doi.org/10.1016/j.bcab.2022.102347.
Wangrawa, D. W., Badolo, A., Ilboudo, Z., Guelbéogo, W.
M., Kiendrébeogo, M., Nébié, R., Sagnon, N., & Sanon,
A. (2018). Insecticidal Activity of Local Plants Essential Oils Against
Laboratory and Field Strains of Anopheles gambiae s. l. (Diptera:
Culicidae) From Burkina
Faso. Journal of economic entomology, 111(6):
2844-2853.
https://doi.org/10.1093/jee/toy276.
Wangrawa, D. W., Badolo, A., Guenne, S., & Sanon, A. (2016).
Larvicidal and oviposition-deterrence activities of four local plant extracts
from Burkina Faso against Anopheles gambiae S. l. (Diptera:
Culicidae). Int J Mosq Res, 3(6): 11-19.
Thèse de Doctorat unique - 144
-
Wangrawa, D. W., Badolo, A., Guelbéogo, W. M.,
Kiendrébeogo, M., Nébié, R. C. H., Sagnon, N., and Sanon,
A. (2015). Biological activities of four essential oils against Anopheles
gambiae in Burkina Faso and their in vitro inhibition of
acetylcholinesterase. International Journal of Biological and Chemical
Sciences 9 (2): 793.
https://doi.org/10.4314/ijbcs.v9i2.19.
Weill, W., Lutfalla, G., Mogensen, K., Chandre, F., Berthomieu,
A., Berticat, C., ... &
Raymond, M. (2003). Corrigendum: Insecticide resistance in
mosquito vectors. Nature, 425, 366.
Weill, M., Malcolm, C., Chandre, F., Mogensen, K., Berthomieu,
A., Marquine, M., &
Raymond, M. (2004). The unique mutation in ace-1 giving high
insecticide resistance is easily detectable in mosquito vectors. Insect
molecular biology, 13(1): 1-7.
White, G. (2007) Terminology of Insect Repellents. In: Debboun M,
Frances S, Strickman D, Editors. Insect Repellents: Principles, Methods, and
Uses. CRC Press. 31-46.
WHOPES (2016) `WHOPES-recommended compounds and formulations for
control of mosquito larvae'. Geneva: World Health Organization, Updated 18
March 2016, p. 1.
Yaméogo, F., Wangrawa, D. W., Sombié, A., Sanon,
A., and Badolo, A. (2021). Insecticidal activity of essential oils from six
aromatic plants against Aedes Aegypti , dengue vector from two
localities of Ouagadougou , Burkina Faso.» Arthropod-Plant
Interactions 15 (4): 627- 34.
https://doi.org/10.1007/s11829-021-09842-4.
Zaim, M., Aitio, A., & Nakashima, N. (2000). Safety of
pyrethroid-treated mosquito nets. Medical and veterinary entomology,
14(1): 1-5.
https://doi.org/10.1046/j.1365-2915.2000.00211.x
.
Zoubiri, S., and Baaliouamer A. (2014). Potentiality of plants
as source of insecticide principles.
Journal of Saudi Chemical Society 18 (6): 925-38.
https://doi.org/10.1016/j.jscs.2011.11.015.
Zulfikar, Aditama, W., and Sitepu F. Y. (2019). The Effect of
Lemongrass (Cymbopogon Nardus) Extract as Insecticide against Aedes
aegypti. International Journal of Mosquito Research 6 (1):
101-3.
Thèse de Doctorat unique - 145
-
ANNEXES
Annexe 1
Tableau montrant les ratios des combinaisons d'huiles
essentielles
|
Huiles essentielles
|
C1
|
|
C3
|
C4
|
C5
|
C6
|
C7
|
C8
|
C9
|
|
Cymbopogon nardus (ul)
|
10
|
20
|
30
|
40
|
50
|
60
|
70
|
80
|
90
|
|
Ocimum americanum (ul)
|
90
|
80
|
70
|
60
|
50
|
40
|
30
|
20
|
10
|
NB : A partir d'une dilution en cascade, on obtient les
concentrations de 0,1 %, 0,5 % et 1 %,
Annexes 2 :
Les trois (3) articles publiés
ORIGINAL RESEARCH published: 06 July 2022 doi:
10.3389/!td.2022.853405
Essential Oils From Five Local Plants: An Alternative
Larvicide for Anopheles gambiae s.l. (Diptera: Culicidae) and
Aedes aegypti (Diptera: Culicidae) Control in Western Burkina
Faso
Mahamoudou Balbone'
1, Dieudonne'
Diloma Soma2, Moussa Namountougou2,3, Samuel
Fogne' Drabo1, Hamadou
Konate' 2,3,
Oumarou Toe3, Koama Bayili2, Georges Benson
Meda2, Roch Kounbobr Dabiré2 and Olivier
Gnankine1*
Edited by: Cleber Galvão, Oswaldo Cruz Foundation
(Fiocruz), Brazil
1 Laboratoire d'Entomologie Fondamentale et
Applique'e, Unite' de Formation et de Recherche en Sciences
de la Vie et de la Terre (UFR-SVT), Universite' Joseph KI-ZERBO,
Ouagadougou, Burkina Faso, 2 Institut de Recherche en Sciences de la
Sante' /Centre Muraz, Département d'Entomologie Médicale,
Bobo-Dioulasso, Burkina Faso, 3 Universite Nazi Boni, Institut des
Sciences de la Santé, Bobo-Dioulasso, Burkina Faso
Reviewed by: Carlos Manuel Dutok-Sa'nchez,
Universidade Federal do Amapa', Brazil Sarita Kumar, University of
Delhi, India Paloma Mendonca, University of Vassouras,
Brazil
*Correspondence: Olivier Gnankine
olignankine@gmail.com
Introduction: Malaria and dengue are two main
vector-borne infectious diseases transmitted by Anopheles gambiae and
Aedes aegypti, respectively, in tropical and subtropical regions. The
concern for environmental safety and the increasing development of resistance
to the chemical in main arthropod vectors raises interest in the search for
botanicals such as essential oils (EOs) that can be used in vector control.
Specialty section: This article was submitted to Vector
Biology, a section of the journal Frontiers in Tropical Diseases
Received: 12 January 2022 Accepted: 30 March 2022 Published:
06 July 2022
Methods: Larvicidal bioassays were performed
according to the WHO standard methods using Ae. aegypti and An.
gambiae larvae collected from Bobo-Dioulasso and in the Kou Valley (VK),
respectively, two areas located in Houet Province of western Burkina Faso.
Kisumu and Bora bora, the susceptible strains of An. gambiae and
Ae. aegypti, respectively, were used as controls. OEs extracted from
leaves of five aromatic plants, Cymbopogon citratus, Cymbopogon
nardus, Eucalyptus camaldulensis, Lippia multiflora, and
Ocimum americanum, naturally growing in Burkina Faso were tested. The
pyriproxyfen was used as a positive control.
Citation: Balbone' M, Soma DD, Namountougou M,
Drabo SF, Konate' H, Toe O, Bayili K, Meda GB, Dabiré RK and
Gnankine O (2022) Essential Oils From Five Local Plants: An Alternative
Larvicide for Anopheles gambiae s.l. (Diptera: Culicidae) and Aedes aegypti
(Diptera: Culicidae) Control in Western Burkina Faso. Front. Trop. Dis.
3:853405. doi: 10.3389/fitd.2022.853405
Results: As a result, the lethal
concentrations (LC50) for Ae. aegypti from Bobo-Dioulasso and An.
gambiae from VK ranged from 41.9 to 103.8 ppm and 39.5 to 138.1 ppm,
respectively. As for LC90 values, they ranged from 74.6 to 311.3 ppm
for Ae. aegypti from Bobo-Dioulasso and from 90.2 to 328.9 ppm for
An. gambiae from VK. Among the EOs tested, L. multiflora
showed the highest activity against all the strains of An. gambiae
and Ae. aegypti larvae. No difference in terms of LC50
values was found between L. multiflora and pyriproxyfen used as a
positive control on An. gambiae larvae. It is not the case for
Aedes aegypti populations, where pyriproxyfen remains the most toxic.
Overall, An. gambiae populations were the most susceptible to EOs
tested as compared to Ae. aegypti populations.
Thèse de Doctorat unique - 146
-
Frontiers in Tropical Diseases |
www.frontiersin.org 1 July 2022
| Volume 3 | Article 853405
Balbone' et al. Larvicidal Activities in Mosquitoes
Conclusion: Our study furthers our knowledge of
the larvicidal activity of EOs in the western part of Burkina and opens new
avenues in their putative use in vector control strategies.
Keywords: resistance, essential oils, larvicidal
activities, lethal concentration, Bobo-Dioulasso
BACKGROUND
Vector-borne diseases are human diseases caused by parasites,
viruses, or bacteria transmitted by vectors. Each year, more than 700,000
deaths occur worldwide due to vector-borne diseases such as dengue, yellow
fever, Japanese encephalitis, leishmaniasis, Chagas disease, onchocerciasis,
malaria, schistosomiasis, and human African trypanosomiasis (1). Among these
diseases, malaria remains the most serious vector-borne disease, affecting
between 300 and 500 million people, and 1.4 to 2.6 million deaths annually
throughout the world were recorded. More than 40% of the world's population
lives in malarious areas (2).
According to the epidemiological bulletin, in the first half
of 2018, Burkina Faso recorded 3,501,245 cases of malaria, including 1,002
deaths, for a case-fatality rate of 0.7% (3). The same is true for dengue,
where the number of reported cases worldwide peaked in 2019, and all WHO
regions were affected (4). In Burkina Faso, an increase in the weekly incidence
of dengue cases was noted from week 31 of the year 2017 (5).
Current mosquito control strategies depend primarily on
chemical insecticides. The discovery, development, and use of chemicals have
reduced the interest in plant products. However, widespread use of these
insecticides in public health and agriculture for the control of vector and
pest species has favored many concerns such as the increasing physiological
resistance in major vector species, environmental pollution, and toxic hazards
to human and other non-target organisms due to their broad spectrum of activity
(6-9). As a result, there has been an increased interest in developing
potential alternative or additional control methods/tools that are effective
against the target vector species, which are environmentally safe,
biodegradable, and low cost and can be used by individuals and communities in
specific situations (10, 11). Therefore, in recent years, various workers have
been concentrating their efforts on the search for natural products derived
from plants as an alternative to conventional insecticides used in controlling
vectors for which resistance was detected (12). Among many natural products,
essential oils (EOs) and their constituents have received considerable
attention in the search for new pesticides and have been found to possess an
insecticidal potential (13).
EOs show several interesting properties. First, they easily
penetrate insect cuticles, which increases their bioavailability (14). This
property could be of interest if it results in a shortened stay of insects on
treated surfaces. Second, EO compounds such as acyclic or monocyclic
monoterpenes are small and volatile molecules that might have spatial
repellency properties. For example, insect sensilla are specialized for
detecting odorants and have been shown to respond to volatile monoterpenes
(14). Finally, active compounds in EOs may have a specific mode of action,
which makes them good alternatives to the use of pyrethroids.
The EO of Lippia multi!ora is used as a
spice, a meal condiment, a drink flavoring (15), and a mouthwash. In addition
to insecticidal activities, Abena et al. (16) found analgesic, antipyretic, and
anti-inflammatory effects of L. multi!ora oil. Cymbopogon
citratus EO has antimicrobial activity against Helicobacter
pylori, a bacterium responsible for gastroduodenal diseases (17).
Cymbopogon nardus is a medicinal plant because of its analgesic effect
and is widely used in gastronomy (18). Also, several studies noticed the
insecticidal properties of EO of C. nardus, C. citratus,
Ocimum americanum, and Eucalyptus camaldulensis (18-21).
In Burkina Faso, some studies on the insecticidal effects of
EOs with mosquitoes in general and mosquito larvae in particular have involved
strains restricted to Ouagadougou (21-23). Little is known about the EO
susceptibility in Anopheles and Aedes populations in the
western part of this country. Moreover, previous studies did not take into
account the positive control in the various tests.
Our study aimed at evaluating the larvicidal activities of EOs
of five local aromatic plants from Burkina Faso, including C.
citratus, C. nardus (DC.) Stapf, E. camaldulensis Dehn,
L. multi!ora, and O. americanum (Wild.) A.J. Paton
in terms of lethal concentrations (LC50 and LC90)
upon field populations of Aedes aegypti from Bobo-Dioulasso and
Anopheles gambiae from the Valleìe du Kou (VK).
MATERIAL AND METHODS
Mosquito Larval Collection and Rearing
An. gambiae larvae were collected from district
number 7 of the Valleìe du Kou (Bama) (11°24'N and 4°24'O), a
rice-growing area located 30 km north of Bobo-Dioulasso. Ae. aegypti
larvae were collected from tires in various urban settings in
Bobo-Dioulasso, the economic capital city of Burkina Faso. Bobo-Dioulasso and
Bama are two localities in the province of Houet in western Burkina Faso. The
larvae were collected from June to October 2021 and transported to the
insectary of the Institute of Research in Health Sciences (IRSS) located in
Bobo-Dioulasso where 3 and 4 larval instars were sorted according to Filho
(24). Larvae from laboratory reference strains were used as controls. The
insectary conditions were 27°C #177; 2°C temperature, 80% #177; 10%
relative humidity, and 12-h light and 12-h dark photoperiod.
Plant Materials and Essential Oil Procurement
The five plant species tested, C. citratus, C.
nardus (Linn.), E. camaldulensis, L. multi!ora,
and O. americanum, were used in
Thèse de Doctorat unique - 147
-
Frontiers in Tropical Diseases |
www.frontiersin.org 2 July 2022
| Volume 3 | Article 853405
Balbone' et al. Larvicidal Activities in Mosquitoes
this current study. They were chosen firstly due to endogenous
data provided from informants questioned in areas investigated as well as the
data from the literature. These plants were collected from the garden of the
Research Institute of Applied Sciences and Technologies (IRSAT). The
identification of the plants and extraction of EOs were performed by IRSAT. All
the EOs were extracted from the leaves of the test plants by hydrodistillation
(HD) using a clevenger-type apparatus and stored in a dark glass
bottle at 4°C prior to use. The oils thus obtained were separated from
water in the condenser and stored in airtight containers under refrigeration
(4°C) till their later use for larval bioassays. The major compounds of
these EOs were obtained by gas chromatography-mass spectrometry (GC-MS).
Larvicidal Bioassays in the Laboratory
The larval bioassay tests were carried out following the
standard WHO larval bioassay test method (25). They were carried out in the
laboratory of the Institute of Research in Health Sciences located in
Bobo-Dioulasso. Clear plastic cups with capacities of 200 ml each were used for
the larvicidal bioassays. An appropriate amount of each EO was dissolved in
acetone to prepare 1 ml of stock solution. Fresh stock solutions of each of the
above stock solutions were prepared by adding distilled water to produce the
required concentrations (50, 100, 150, and 200 ppm). Four replicates were
carried out for each test concentration and species of mosquito larvae. Twenty
active third and fourth larval instars of An. gambiae and Ae.
aegypti in 10 ml of distilled water were transferred into each clear
plastic cup that contained 139 ml of distilled water. One milliliter of the
mixing solution of EO and acetone was added to each cup that contained 149 ml
of distilled water to give a final solution of 150 ml with the desired
concentrations. Two replicates of the control were carried out simultaneously
with 149 ml of distilled water and 1 ml of acetone. Pyriproxyfen, the reference
chemical larvicidal, was used at different concentrations as a positive
control.
Data Analysis
Analyses were performed by using the statistical software
XLSTAT version 2,015.1.01. The LC50, LC90, and the 95% CIs were calculated by
probit analysis using the same statistical
software in order to compare the larvicidal potency of the
plants and susceptibility of the test mosquito larvae. LC50 and LC90
values were judged as significantly different between the EOs (p < 0.05) if
the CIs did not overlap (14, 26). In all the tests, no control mortality was
detected after the 24-h exposure; hence, no correction was required based on
Abbot's formula.
RESULTS
Chemical Characterization of the Essential
Oils
The major compounds of the 5 EOs are summarized in
Table 1. The EO of C. citratus was found to be rich
in geranial (48.1%), neral (35.8%), and myrcene (11%). The EO of C. nardus
was predominantly composed of citronellal (41.7%), geraniol (20.8%), and
p-elemene (11%). The EO of E. camaldulensis was rich in 1,8-cineole
(59.5%) and a-pinene (9.17%). The OE of L. multi!ora was
characterized by p-cymene (25.27%), p-caryophyllene (12.7%), and
thymol (11.88%). O. americanum EO was characterized by a high
percentage of 1,8-cineole (31.22%) followed by camphor (12.73%).
Larvicidal Activities of Essential Oils Against
Anopheles gambiae
EOs from 5 plant species demonstrated larvicidal activities
against susceptible strains and field-collected 3 and 4 larval instars of
An. gambiae. Overall, five EOs were the most toxic on 3 and 4 larval
instars of An. gambiae susceptible strain. On the susceptible strain
larvae of An. gambiae (Kisumu), the LC50 and LC90 values
were from 3.9 to 75.8 ppm and from 29.5 to 193.5 ppm, respectively
(Table 2). On field-collected larvae of An. gambiae
(VK), the LC50 and LC90 values were
between 39.5 to 138.1 ppm and from 90.2 to 328.9 ppm, respectively
(Table 3).
Regarding LC50 and LC90
values, L. multi!ora exhibited the highest larvicidal
activity against the 2 strains of An. gambiae (LC50 = 3.9 ppm, LC90 =
29.5 ppm for Kisumu larvae and LC50 = 39.5 ppm and LC90 = 90.2 ppm for VK
larvae).
As for O. americanum, it exhibited the weakest
larvicidal activity (LC50 = 75.8 ppm; LC90 = 193.5 ppm) for Kisumu larvae,
while C.
Thèse de Doctorat unique - 148
-
TABLE 1 | Major compounds of the 5 essential
oils tested on larvae of Anopheles gambiae and Aedes
aegypti.
|
Essential oils
|
Major compounds
|
Retention time (min)
|
Percentage (%)
|
|
Cymbopogon citratus
|
Geranial
|
21.181
|
48.1
|
|
Neral
|
21.130
|
35.8
|
|
Myrcene
|
12.481
|
11
|
|
Cymbopogon nardus
|
Citronellal
|
18.994
|
41.7
|
|
Geraniol
|
22.121
|
20.8
|
|
p-Elemene
|
24.880
|
11
|
|
Eucalyptus camaldulensis
|
1,8-Cineol
|
14.022
|
59.55
|
|
a-Pinene
|
10.505
|
9.17
|
|
Lippia multillora
|
p-Cymene
|
13.740
|
25.27
|
|
p-Caryophyllene
|
25.116
|
12.70
|
|
Thymol
|
21.791
|
11.88
|
|
Ocimum americanum
|
1,8-Cineol
|
14.022
|
31.22
|
|
Camphor
|
17.733
|
12.73
|
Frontiers in Tropical Diseases |
www.frontiersin.org 3 July 2022
| Volume 3 | Article 853405
Balbone' et al. Larvicidal Activities in Mosquitoes
TABLE 2 | Median and 90% lethal concentrations
and their Confidence Limits (CLs) of plant essential oils against 3 and 4
larval instars of Anopheles gambiae susceptible
|
strain from Kisumu.
|
|
|
|
|
|
|
|
Treatment
|
LC50 (ppm)
|
Confidence limit 95%
|
LC90 (ppm)
|
Confidence limit 95%
|
X2(df)
|
Slope ( #177; SE)
|
|
Pyriproxyfen
|
3.4a
|
0.8-5.8
|
13.6a
|
9.5-18.4
|
16.6
|
2.2 #177; 0.52
|
|
Cymbopogon citratus
|
49.1c
|
42.1-54.8
|
87.6c
|
78.2-102.9
|
53.6
|
5.0 #177; 0.69
|
|
Cymbopogon nardus
|
30.7b
|
17.9-40.0
|
74.7c
|
63.1-90.8
|
26.4
|
3.3 #177; 0.64
|
|
Ocimum americanum
|
75.8d
|
65.4-85.5
|
193.5d
|
164.6-244.4
|
74.8
|
3.1 #177; 0.36
|
|
Lippia multillora
|
3.9a
|
1.5-6.6
|
29.5b
|
22.0-40.8
|
38.5
|
1.4 #177; 0.23
|
|
Eucalyptus camaldulensis
|
29.4b
|
15.6-40.1
|
90.3c
|
75.3-113.1
|
27.4
|
2.6 #177; 0.50
|
LC (lethal concentration) in ppm (part per million). LC
values followed by different letters are significantly different.
citratus showed the weakest larvicidal activity (LC50
= 138.1 ppm; LC90 = 328.9 ppm) on VK larvae.
Furthermore, oils from E. camaldulensis, C.
nardus, and C. citratus still showed strong larvicidal activities
after L. multi!ora with LC50 values <50 ppm and
LC90 values <91 ppm on Kisumu larvae. On VK larvae, EOs of C.
nardus, O. americanum, and E. camaldulensis showed
strong larvicidal activities after L. multi!ora with
LC50 values <140 ppm and LC90 values <270 ppm.
Only the EO of L. multi!ora gives
LC50 and LC90 values close to that of the
positive control pyriproxyfen against Kisumu and VK larvae.
Based on the overlap of the CIs of the LC50
and LC90 values, no significant difference was observed
between L. multi!ora and pyriproxyfen on the two An.
gambiae strains tested.
Larvicidal Activities of Essential Oils Against
Aedes aegypti
All EOs from five (5) plant species exhibited toxicity against
susceptible strain larvae and 3 and 4 larval instars of Ae. aegypti
field-collected strain. Tables 4 and 5
show the LC50 and LC90 values of the
EOs of five (5) plants tested against susceptible strains and 3 and 4 larval
instars of Ae. aegypti field-collected strain.
As in the case of An. gambiae populations, among the
EOs tested, L. multi!ora was the most toxic EO on the two (2)
strains of Ae. aegypti tested. Indeed, LC50
and LC90 values were 42 and 74.6 ppm, respectively, for L.
multi!ora tested on the susceptible strain of Ae.
aegypti (Bora bora) and 3 and 4 larval instars of Ae. aegypti
field-collected strain from Bobo-Dioulasso and lower for those from other
EOs tested where the LC50 and LC90 values
ranged from 61.5 to 103.8 ppm and 108.8 to 311.3 ppm, respectively.
For the Bora bora strain, LC50 and
LC90 values were 61.5, 62.4, 91.8, 41.9, and 101.3 ppm and 132, 108.8,
180.9, 68.5, and 188.8 ppm for EOs from C. citratus, C.
nardus, E. camaldulensis, L. multi!ora, and
O. americanum, respectively (Table 4). These
values were close to those obtained with the field strain
collected from Bobo-Dioulasso (LC50 and LC90
values were 74.6, 63.5, 79.4, 41.9, and 103.8 ppm and 152.3, 148.5, 226.3,
74.6, and 1,053.6 ppm with EOs from C. citratus, C. nardus,
E. camaldulensis, L. multi!ora, and O.
americanum, respectively) (Table 5). EO of E.
camaldulensis remains the least toxic to both strains of Ae. aegypti
regarding the LC50 and LC90 values above
100 and 188 ppm, respectively.
Based on the overlap of the CIs of the LC50
and LC90 values, there were no significant differences between
L. multi!ora and pyriproxyfen at LC90 with Bora
bora. Also, there were no significant differences between C. citratus
and C. nardus regarding LC50 and
LC90 values with the two Ae. aegypti strains tested. Also, there
were no significant differences between E. camaldulensis and O.
americanum regarding LC90 with the two Ae. aegypti strains tested
and LC50 with Bora bora. It is also the same with C. citratus
and C. nardus, in regard to LC50 and LC90 values found
in two Ae. aegypti strains tested.
DISCUSSION
Up to now, long-lasting insecticidal nets (LLIN) and indoor
residual spraying (IRS) remain the two main tools targeting mainly adults
An. gambiae and to lesser extent Ae. aegypti vectors. Thus,
there is an urgent need to develop innovative tools and techniques including
EOs used against eggs, larvae instar, and adults in order to increase the
success of vector control (11).
Our study aimed at evaluating the bioefficacy of five EOs on
Ae. aegypti and An. gambiae larvae according to the WHO
standard methods. Most studies have already performed the larvicidal tests but
did not include the chemical control pyriproxyfen, an insect growth regulator
(IGR). IGR acts by mimicking one of these hormones or directly perturbating
cuticle formation/deposition or lipid biosynthesis.
Thèse de Doctorat unique - 149
-
TABLE 3 | Median and 90% lethal concentrations
and their Confidence Limits (CLs) of plant essential oils against 3 and 4
larval instars of Anopheles gambiae from VK,
|
field strain.
|
|
|
|
|
|
|
|
Treatment
|
LC50 (ppm)
|
Confidence limit 95%
|
LC90 (ppm)
|
Confidence limit 95%
|
X2(df)
|
Slope ( #177; SE)
|
|
Pyriproxyfen
|
23.7a
|
9.3-35.5
|
83.3a
|
66.6-106.2
|
11.5
|
1.4 #177; 0.41
|
|
Cymbopogon citratus
|
138.1c
|
124.5-155.3
|
328.9c
|
267.4-451
|
72.4
|
3.3 #177; 0.39
|
|
Cymbopogon nardus
|
76.5b
|
67.6-84.9
|
163b
|
143.9-193.5
|
97.5
|
3.9 #177; 0.39
|
|
Ocimum americanum
|
89.3b
|
81.1-97.4
|
173.0b
|
154.2-201.4
|
114.0
|
4.4 #177; 0.41
|
|
Lippia multillora
|
39.5a
|
28.6-47.8
|
90.2a
|
78.3-108
|
45.1
|
3.2 #177; 0.48
|
|
Eucalyptus camaldulensis
|
121.1c
|
109.9-133.6
|
267.3c
|
226.6-339.4
|
87.7
|
3.7 #177; 0.39
|
LC (lethal concentration) in ppm (part per million). LC
values followed by different letters are significantly different.
Frontiers in Tropical Diseases |
www.frontiersin.org 4 July 2022
| Volume 3 | Article 853405
Balbone' et al. Larvicidal Activities in Mosquitoes
TABLE 4 | Median and 90% lethal concentrations
and their Confidence Limits (CLs) of plant essential oils against 3 and 4
larval instars of Aedes aegypti susceptible strain
|
from the Bora bora.
|
|
|
|
|
|
|
|
Treatment
|
LC50 (ppm)
|
Confidence limit 95%
|
LC90 (ppm)
|
Confidence limit 95%
|
X2(df)
|
Slope ( #177; SE)
|
|
Pyriproxyfen
|
9.5a
|
6.4-12.3
|
43.3a
|
34.0-61.8
|
49.7
|
1.9 #177; 0.27
|
|
Cymbopogon citratus
|
61.5c
|
51.4-70.4
|
132.0b
|
119.4-150.1
|
71.9
|
3.2 #177; 0.38
|
|
Cymbopogon nardus
|
62.4c
|
50.2-72.5
|
108.8b
|
98.4-124.0
|
74.2
|
3.09 #177; 0.35
|
|
Ocimum americanum
|
91.8d
|
83.3-100.3
|
180.9c
|
160.8-211.5
|
112.3
|
4.3 #177; 0.41
|
|
Lippia multillora
|
41.9b
|
31.8-48.7
|
68.5a
|
61.3-84.2
|
39.5
|
2.2 #177; 0.35
|
|
Eucalyptus camaldulensis
|
101.3d
|
73.1-132.7
|
188.8c
|
169.5-217.6
|
120.1
|
1.2 #177; 0.31
|
LC (lethal concentration) in ppm (part per million). LC
values followed by different letters are significantly different.
In this current study, all EOs tested exhibited variable
insecticide activity against the larvae of An. gambiae and Ae.
aegypti. Regarding LC50 and LC90 values,
the EOs from C. citratus, C. nardus, E.
camaldulensis, L. multi!ora, and O. americanum
exhibited higher larvicidal activities against third and fourth instar
laboratory-reared larvae of An. gambiae and Ae. aegypti after
24 h of exposure, the most toxic of all being that of L.
multi!ora. LC50 of EO from E. camaldulensis
was the least toxic against Ae. aegypti, whereas C. citratus
remains the least toxic against An. gambiae. These data are not
in agreement with those found by Manh et al. (27), who reported that on Ae.
aegypti larvae, C. citratus EO (LC50 = 120.6 ppm) was less
effective than that of E. camaldulensis (LC50 = 33.7 ppm).
Our results obtained with C. nardus on An.
gambiae in this study were below those obtained by Ahouansou et al. (19),
who obtained a value of 97.3 ppm for LC50 on An. gambiae.
Our results were similar to those reported by Solon et al. (28) on Ae.
aegypti populations. In their study, O. americanum and C.
citratus exhibited values of LC50 equaling 67 and 69 ppm, respectively.
However, the results with O. americanum were below those reported by
Wangrawa et al. (21) on An. gambiae whose LC50 was 209.84
ppm.
The LC50 and LC90 values
obtained with the L. multi!ora in this current study were
lowest than those reported by Bassole et al. (23). Recently, the same trend was
observed by Yameogo et al. (22), who showed also the toxic effect of L.
multi!ora against Ae. aegypti populations from Tabtenga,
Ouagadougou.
Interestingly, the high toxicity of the L.
multi!ora EO could result in the presence of three major
components: thymol, p-cymene, and 13-caryophyllene. According to
Folashade (29), thymol, germacrene D, p-cymene, thymyl acetate, and
sabinene were found in EOs of L. multi!ora in Ghana and seem
to be involved in Lippia toxicity. Conversely, the lower larvicidal
activities of C. citratus, C. nardus, E.
camaldulensis, and O. americanum oils could be explained by the
minor effect of piperitone, geraniol, and
1.8-cineole against Ae. aegypti and An. gambiae
larvae. This could explain the differences observed in biological activity
among the EOs.
Regarding the LC50 and LC90
values, the bioef!cacy of L. multi!ora on An. gambiae
strains is closer to that of the positive control used in this study,
which is pyriproxyfen, the reference larvicide used against larvae. This would
open new alternatives for mosquito control.
Globally, in An. gambiae strain populations, the
laboratory-reared larvae were found to be the most susceptible to EOs than
those from the field population (VK), known for their resistance to pyrethroid
(30-32).
As observed in An. gambiae populations, Ae.
aegypti larvae were the most susceptible to L. multi!ora
after the chemical pyriproxyfen. The LC50 values found in this
study were slightly lower than those observed in Ae. aegypti
populations from Ouagadougou (22), explaining the occurrence of the
phenotypic resistance to the main chemical.
As shown by Namountougou et al. (33), tests performed with
deltamethrin on Ae. aegypti populations collected from Bobo-Dioulasso
showed mortality rates reaching 89.62% and 82.72% for 2013 and 2014,
respectively. Mortality rates of Ae. aegypti collected from
Ouagadougou were 50.7% and 20.7% for 2013 and 2014, respectively. All these
values were lower than 90%, suggesting a resistance. It is very urgent to
search for an alternative to chemicals. Our data will help to develop
innovative strategies based on EOs.
CONCLUSION
Our results showed that the use of EOs as larvicides is a
promising strategy. Therefore, they could be the object of
Thèse de Doctorat unique - 150
-
TABLE 5 | Median and 90% lethal concentrations
and their Confidence Limits (CLs) of plant essential oils against 3 and 4
larval instars of Aedes aegypti from Bobo-
|
Dioulasso, field strain.
|
|
|
|
|
|
|
|
Treatment
|
LC50 (ppm)
|
Confidence limit 95%
|
LC90 (ppm)
|
Confidence limit 95%
|
X2(df)
|
Slope ( #177; SE)
|
|
Pyriproxyfen
|
11.04a
|
8.2-13.7
|
43.2a
|
35.3-56.1
|
80.8
|
2.1 #177; 0.24
|
|
Cymbopogon citratus
|
74.6c
|
67.7-81.2
|
152.3c
|
131.9-186.0
|
116.2
|
5.1 #177; 0.48
|
|
Cymbopogon nardus
|
63.5c
|
57.3-69.4
|
148.5c
|
128.4-182.6
|
74.2
|
5.4 #177; 0.54
|
|
Ocimum americanum
|
79.4e
|
67.6-90.2
|
226.3d
|
186.9-302.9
|
64.4
|
2.8 #177; 0.35
|
|
Lippia multitlora
|
42b
|
33.4-47.3
|
74.6b
|
65.3-92.5
|
22.0
|
6.0 #177; 1.28
|
|
Eucalyptus camaldulensis
|
103.8d
|
95.4-112.3
|
311.3d
|
238-503.1
|
18.3
|
4.9 #177; 0.45
|
LC (lethal concentration) in ppm (part per million). LC
values followed by different letters are significantly different.
Frontiers in Tropical Diseases |
www.frontiersin.org 5 July 2022
| Volume 3 | Article 853405
Balbone' et al. Larvicidal Activities in
Mosquitoes
particular attention in the search for new natural,
selective, and biodegradable larvicidal products that can be used in public
health vector control programs against An. gambiae
and Ae. aegypti in
particular.
DATA AVAILABILITY STATEMENT
The original contributions presented in the study are
included in the article/supplementary materials, further inquiries can be
directed to the corresponding author/s.
AUTHOR CONTRIBUTIONS
MB and OG designed the study. DS critically supervised
the study. MB, HK, GM, and OT carried out the laboratory experiments. MB, SD,
and OG analyzed and interpreted the data and drafted the manuscript. OG, RD,
and MN revised the
REFERENCES
1. WHO. (2020) 2507(February).
2. WHO. WHO. World malaria report, Briefing kit/Global
messaging (2021).
3. Ministere de la Santé du Burkina Faso,
Direction des statistiques sectorielles. Rapport
Final. (2018).
4. WHO. Noncommunicable Diseases
(2021). Available at: https://www.who.int/
news-room/fact-sheets/detail/n.
5. MinisteÌ re de la
Santeì.
«MinisteÌre de la Santé du
Burkina Faso, Direction des statistiques
sectorielles«Flambée de cas de dengue au Burkina
Faso,». In: Sitrep Dengue, vol.
26 p.11. (2017).
6. Minjas JN. «Laboratory
Observation on the Toxicity of Swartzia Madaguscariensis (Leguminosae) Extract
to Mosquito Larvae. Trans R Soc Trop Med Hyg (1986)
80:460-1. doi: 10.1016/0035-9203(86)90345-7
7. WHO. Vector Resistance for
Pesticides. World Health Organization Technical Report Serial 818
Vol. 17. . Geneva: WHO (1992) p. 62 pp.
499-504.
8. Hemingway J. Parasitology: Enhanced New Ways to
Control Malaria. Science (2004)
303:1984-5. doi: 10.1126/science.1096548
9. Gnankine O, Bassoleì IHN,
Chandre F, Glitho IA, Akogbeto M, Dabireì RK, et al.
Insecticide Resistance in Bemisia Tabaci Gennadius
(Homoptera: Aleyrodidae) and Anopheles Gambiae Giles
(Diptera: Culicidae) Could Compromise the Sustainability of Malaria Vector
Control Strategies in West Africa. Acta Tropica
(2013) 128(1):7-17. doi:
10.1016/j.actatropica.2013.06.004
10. Redwane A, Lazrek HB, Bouallam S, Markouk M,
Amarouch H, Jana M. Larvicidal Activity of Extracts From Querus Lusitania Var.
Infectoria Galls (Oliv). J Ethnophamacol (2002)
79:261-3. doi: 10.1016/S0378-8741(01)00390-7
11. Gnankineýì O,
Bassoleýì ILHN. Essential Oils as an Alternative
to Pyrethroids ` Resistance Against Anopheles Species Complex
Giles. molecules (2017), 22 (10):1321. doi:
10.3390/molecules22101321
12. Zoubiri S, Baaliouamer A. Potentiality of Plants
as Source of Insecticide Principles. J Saudi Chem Soc
(2014) 18(6):925-38. doi:
10.1016/j.jscs.2011.11.015
13. Tripathi AK, Upadhyay S, Bhuiyan M, Bhattacharya
PR. A Review on Prospects of Essential Oils as Biopesticide in Insect-Pest
Management. Pharmacol Phytother (2009)
1(5):52-63.
14. Deletre E, Martin T, Campagne P, Bourguet D,
Cadin A, Menut C, et al. Repellent, Irritant and Toxic Effects of 20 Plant
Extracts on Adults of the Malaria Vector Anopheles Gambiae Mosquito.
PloS one (2013) 8(12):1-10. doi:
10.1371/journal.pone.0082103
15. Abegaz B, Asfaw N, Lwande W. Constituents of the
Essential Oils From Wild and Cultivated Lippia Adoensis Hochst. Ex Walp.
J Essent Oil Res (1993) 5
(5):487-91. doi: 10.1080/10412905.1993.9698268
manuscript. All authors contributed to the article
and approved the submitted version.
FUNDING
Funding for this study was provided partly by the
TWAS 18-163 RG/BIO/AF/AC_G-FR3240303649 and the Centre
d'excellence Africain (CEA) en Innovations biotechnologiques
pour l'elimination des maladies a transmission vectorielle. I
also thanks LAMIVECT (Laboratoire Mixte International sur les Maladies à
transmissions Vectorielle) for supporting publication fees.
ACKNOWLEDGMENTS
We are indebted to «Institut de
recherche en Sciences Appliqueìes et
technologiques» (IRSAT) for providing us with essential
oils.
16. Daferera BD, Sokmena A, Sokmen M, Polissiou M.
Antimicrobial and Antioxidant Activities of the Essential Oil and Various
Extracts of Salvia Tomentosa Miller (Lamiaceae). Food Chem
(2005) 90(3):333-40. doi:
10.1016/j.foodchem.2003.09.013
17. Ohno T, Kita M, Yamaoka Y, Imamura S, Yamamoto T,
Mitsufuji S, et al. Antimicrobial Activity of Essential Oils and Other Plant
Extracts. Helicobacter (2003)
8:207-15. doi: 10.1046/j.1523-5378.2003.00146.x
18. Abena AA, Diatewa GM, Gakosso M, Gbeassor TH,
Hondi-Assah, Ouamba JM. Comparative Chemical and Analgesic Properties of
Essential Oils of Cymbopogon Nardus (L) Rendle of
Benin and Congo. Afr J Tradit Complement Altern Med
(2007) 4(3):267-72. doi:
10.4314/ajtcam.v4i3.31218
19. Ahouansou AC, Fagla SRM, Tokoudagba JM, Toukourou
H, Badou YK, Gbaguidi FA. Chemical Composition and Larvicidal Activity of the
Essential Oil of Cymbopogon Nardus (L.) Rendle on
Anopheles Gambiae. Int J Biol Chem Sci
(2019) 13(3):1861. doi: 10.4314/ijbcs.v13i3.53
20. Drabo SF, Olivier G, Bassoleì
IHN, Neìbieì RC,
Laurence M. Susceptibility of MED-Q1 and MED-Q3 Biotypes of Bemisia Tabaci
(Hemiptera: Aleyrodidae) Populations to Essential and Seed Oils. J
Econ Entomol (2017) 110(3):1031-8. doi:
10.1093/jee/tox100
21. Wangrawa DW, Badolo A, Guenne S,
Guelbeýìogo WM,
Kiendreýìbeogo M, Sagnon N, et al. Larvicidal
and Oviposition- Deterrence Activities of Four Local Plant Extracts From
Burkina Faso Against Anopheles Gambiae s. L. (Diptera: Culicidae).
Int J Mosquito Res (2016)
3(6):11-9.
22. Yameìogo F, Wangrawa DW,
Sombieì A, Sanon A, Badolo A. Insecticidal Activity of
Essential Oils From Six Aromatic Plants Against Aedes Aegypti, Dengue Vector
From Two Localities of Ouagadougou, Burkina Faso. Arthropod Plant
Interact (2021) 15(4):627-34. doi:
10.1007/s11829-021-09842-4
23. Bassoleýì IHN,
Guelbeýìogo WM,
Neýìbieýì R,
Costantini C, Sagnon NF, Kabore ZI, et al. Ovicidal and Larvicidal Activity
Against Aedes Aegypti and Anopheles Gambiae Complex Mosquitoes of Essential
Oils Extracted From Three Spontaneous Plants of Burkina Faso.
Parasitologia (2003) 45:23-6. doi:
10.1007/s11829-021-09842-4
24. Pereira Filho AA, Pessoa GCD, Yamaguchi LF,
Stanton MA, Serravite AM, Pereira RHM, et al. Larvicidal Activity of Essential
Oils From Piper Species Against Strains of Aedes Aegypti
(Diptera: Culicidae) Resistant to Pyrethroids. Front
Plant Sci (2021) 12:685864. doi:
10.3389/fpls.2021.685864
25. WHO. World Malaria Report 2015 -
Summary. (2015). Available at: http://
www.who.int/malaria/publications/world-malaria-report-2015/report/en/.
26. Petersen JL, Floore TG, Brogdon WG. Diagnostic
Dose of Synergized D-Phenothyrin for Insecticide Susceptibility Testing by
Bottle Bioassay. J Am Mosq Control Assoc (2004)
20:183-8.
Thèse de Doctorat unique - 151
-
Frontiers in Tropical Diseases |
www.frontiersin.org
6 July 2022 | Volume 3 | Article 853405
Balbone' et al. Larvicidal Activities in
Mosquitoes
27. Manh HD, Hue DT, Hieu NTT, Tuyen DTT, Tuyet OT. The
Mosquito Larvicidal Activity of Essential Oils From Cymbopogon and Eucalyptus
Species in Vietnam. Insects (2020) 11(2):1-7. doi:
10.3390/insects11020128
28. Cavalcanti ES, Morais SM, Lima MA, Santana EW. Larvicidal
Activity of Essential Oils from Brazilian Plants Against Aedes aegypti
L. Mem Inst Oswaldo Cruz (2004) 99(5):541-4.
doi: 10.1590/S0074-02762004000500015
29. Folashade KO, Omoregie EH. Essential Oil of Lippia
Multiflora Moldenke : A Review. J Appl Pharm Sci (2012)
02(1):15-23.
30. Namountougou M, Soma DD, Kientega M,
Balboneýì M, Kaboreýì DPA, Drabo SF, et al.
Insecticide Resistance Mechanisms in Anopheles Gambiae Complex Populations From
Burkina Faso, West Africa. Acta Tropica (2019) 197:1-
93201-12. doi: 10.1016/j.actatropica.2019.105054
31. Chandre F, Darrier LM, Akogbeto M, Faye O, Mouchet J,
Guillet P. Status of Pyrethroid Resistance in Anopheles Gambiae Sensu Lato.
Bulletin of the World Health Organization (1999)
77(3):230-4.
32. Poda SB, Soma DD, Hien A, Namountougou M,
Gnankineýì O, Diabateýì A, et al. Targeted
Application of an Organophosphate - Based Paint Applied on Windows and Doors
Against Anopheles Coluzzii Resistant to Pyrethroids Under Real Life Conditions
in Vallýìe Du Kou, Burkina Faso (West Africa). Malaria J
(2018) 17(136):1-9. doi: 10.1186/s12936-018-2273-x
33. Namountougou M, Soma DD, Balboneýì M,
Kaboreýì AD, Kientega M, Hien A, et al. Monitoring Insecticide
Susceptibility in Aedes Aegypti Populations
From the Two Biggest Cities, Ouagadougou and Bobo-Dioulasso,
in Burkina Faso: Implication of Metabolic Resistance. Trop Med Infect Dis
(2020) 5:84. doi: 10.3390/tropicalmed5020084
Conflict of Interest: The authors declare that the research
was conducted in the absence of any commercial or financial relationships that
could be construed as a potential conflict of interest.
Publisher's Note: All claims expressed in this article are
solely those of the authors and do not necessarily represent those of their
affiliated organizations, or those of the publisher, the editors and the
reviewers. Any product that may be evaluated in this article, or claim that may
be made by its manufacturer, is not guaranteed or endorsed by the publisher.
Copyright(c) 2022 Balboneì, Soma,
Namountougou, Drabo, Konateì, Toe, Bayili, Meda, Dabiré
and Gnankine. This is an open-access article distributed under the terms of the
Creative Commons Attribution License (CC BY). The use, distribution or
reproduction in other forums is permitted, provided the original author(s) and
the copyright owner(s) are credited and that the original publication in this
journal is cited, in accordance with accepted academic practice. No use,
distribution or reproduction is permitted which does not comply with these
terms.
Thèse de Doctorat unique - 152
-
Frontiers in Tropical Diseases |
www.frontiersin.org
7 July 2022 | Volume 3 | Article 853405
Vector Control, Pest Management, Resistance, Repellents
Downloaded from
https://academic.oup.com/jme/advance-article/doi/10.1093/jme/tjac148/6759614
by guest on 14 October 2022
Alternatives to Pyrethroid Resistance: Combinations of
Cymbopogon nardus and Ocimum americanum Essential Oils
Improve the Bioefficiency Control Against the Adults' Populations of Aedes
aegypti (Diptera: Culicidae)
Mahamoudou Balboné,1 Dieudonné
Diloma Soma,2 Samuel Fogné Drabo,1 Moussa
Namountougou,2,3 Hamadou Konaté,2,3 Georges Benson
Meda,2 Ignace Sawadogo,4 Rahim Romba,1 Etienne
Bilgo,2 Roger C. H. Nebié,4 Imaël H. N.
Bassolé,1 Roch K. Dabire,2 and Olivier
Gnankine1,5,
1Laboratoire d'Entomologie Fondamentale et
Appliquée, Unité de Formation et de Recherche en Sciences de la
Vie et de la Terre (UFR-SVT), Université Joseph KI-ZERBO, Ouagadougou,
Burkina Faso, 2Institut de Recherche en Sciences de la
Santé/Centre Muraz, Bobo-Dioulasso BP 545, Burkina Faso,
3Université Nazi Boni, Bobo-Dioulasso, Burkina Faso,
4Institut de Recherche en Sciences Appliquées et
Technologies, Ouagadougou 03 BP 7047, Burkina Faso, and
5Corresponding author,
e-mail:
olignankine@gmail.com;
olivier.gnankine@ujkz.bf
Subject Editor: Athanase Badolo
Received 8 June 2022; Editorial decision 23 August 2022.
Abstract
Dengue vector control strategies are mostly based on chemicals
use against Aedes aegypti populations. The current study aimed at
investigating the insecticidal effects of essential oils (EOs) obtained from
five plant species, Cymbopogon citrates (D. C.) Stapf. (Poaceae),
Cymbopogon nardus (Linn.) Rendle (Poaceae), Eucalyptus
camaldulensis Linn. (Myrtaceae), Lippia multiflora Moldenke
(Verbenaceae), and Ocimum americanum Linn. Lamiaceae, and combinations
of Cymbopogon nardus and Ocimum americanum on Ae. aegypti
populations from Bobo-Dioulasso. For this purpose, adults of the
susceptible and field strains of Ae. aegypti were tested in WHO tubes
with EO alone and binary combinations of O. americanum (OA) and C.
nardus (CN; scored from C1 to C9). The extraction of the essential oils
was done by hydrodistillation, and their components were determined by GC/MS.
Among the 5 EOs tested, L. multiflora essential oil was the most
efficient, with KDT50 values below 60 min on all Ae. aegypti strains
tested, and also with a rate of mortality up to 100 and 85% for Bora Bora and
Bobo-Dioulasso strains, respectively. This efficacy may be due to its major
compounds which are with major compounds as â-caryophyllene, p-cymene,
thymol acetate, and 1.8 cineol. Interestingly, on all strains, C8 combination
showed a synergistic effect, while showed an additive effect. These
combinations exhibit a rate of mortality varying from 80 to 100%. Their
toxicity would be due to the major compounds and the putative combined effects
of some major and minor compounds. More importanly, L. multiflora EO
and combinations of C. nardus and O. americanum EO, may be
used as alternatives against pyrethroid resistant of Ae. aegypti.
Key words: resistance, essential oil,
combination, major compound, rate of mortality
Arboviral diseases have been recognized as a global threat
during the last 20 years (Mayer et al. 2017). According to WHO (2021),
approximately 3.9 billion people worldwide are at risk of arboviral diseases.
These diseases are caused by viruses (arboviruses) usually transmitted, under
natural conditions, from vertebrate to vertebrate, by hematophagous insect
vector (Aubry and Gauzère 2020) such as
Ae. aegypti mosquitoes. Zika, chikungunya, yellow
fever, and dengue are arboviruses whose main vector is Ae. aegypti
(Cuervo-Parra et al. 2016; Souza-neto et al. 2019). According to WHO (2020),
among the arboviroses, dengue is the most prevalent in the subtropics and
tropics areas. Thus, it is a major international public health problem (Guzman
et al. 2010). In recent years, it has been detected in several
Thèse de Doctorat unique - 153
-
(c) The Author(s) 2022. Published by Oxford University Press on
behalf of Entomological Society of America. All rights reserved. For
permissions, please e-mail: 1
journals.permissions@oup.com.
2 Journal of Medical Entomology, 2022,
Vol. XX, No. XX
African cities including Ouagadougou and Bobo-Dioulasso, the
major cities of Burkina Faso (Sessions et al. 2013, Ministère de la
Santé du Burkina Faso 2017).
Vector control remains the most effective measure to control
the transmission of this arboviral diseases (Bhatt et al. 2015). The use of
insecticides is the main strategy for controlling Ae. aegypti (WHO
2012) when a dengue epidemic is detected in a city (Achee et al. 2015).
Long-lasting insecticide-treated nets (LLINs) and indoor residual spraying
(IRS) remain the main vector control methods (WHO 2012).
However, in many countries, resistance to insecticides has
been observed in natural populations of disease vectors, and this resistance is
increasing. Indeed, previous studies in Burkina Faso reported multiple
resistance to chemical insecticides commonly used against Ae. aegypti
populations (Sombié et al. 2019), particularly in the Ae.
aegypti population from Bobo-Dioulasso (Ouattara et al. 2019). Recently,
Namountougou et al. (2020) highlighted this resistance in Ae. aegypti
populations in Ouagadougou and Bobo-Dioulasso according to metabolic
activities such as nonspecific esterase, cytochrome P450, and glutathione
S-transferase activities.
To manage concern related to increasing chemical resistance,
which has become an obstacle to fight vector-borne diseases in general and
dengue specifically, the use of natural products derived from plants with
proven insecticidal efficiency is strongly recommended as an alternative. Among
the many natural products, EOs and their constituents have received
considerable attention in the search for new pesticides exhibiting insecticidal
properties (Tripathi et al. 2009). Plant products are used worldwide to protect
people against blood-sucking arthropods, and many studies have reported the
adulticidal effects of essential oils (Zoubiri and Baaliouamer 2014). These
natural compounds are biodegradable in nature and environmentally safe
(Regnault-roger et al. 2012) and generally exhibit low toxicity to mammals
(Isman 2000). Moreover, traditional medicine is largely based on plants (herbs
or shrubs) and is available at low cost in most tropical areas (de Boer et al.
2010).
EOs have several valuable properties. First, they easily
penetrate the cuticle of insects, which increases their bioavailability
(N'Guessan et al. 2007). This property reduces mosquito knockdown time.
Regarding the weak toxicity of most EOs against vectors, strategies based on
their combination may improve their efficiency. Recent studies on Ae.
aegypti populations from Ouagadougou (Burkina Faso) showed low toxicity of
3 of the 5 EOs tested in the present study, namely Ocimum americanum,
Cymbopogon nardus, Eucalyptus camaldulensis (Yaméogo et
al. 2021). According to Chansang et al. (2018), combination of EO-Permethrin
shown a synergist effect on Aedes populations from Thailand.
To the best of our knowledge, even if studies have been
carried out on the toxicity of EOs in Burkina Faso, studies on their
combinations on Ae. aegypti populations are limited. In this study,
our objective was to evaluate the insecticidal properties of EOs extracted from
five local plants, namely L. multifiora, C. nardus, O.
americanum, C. citratus, and E. camaldulensis, and binary
combinations of 2 of them, namely O. americanum and C.
nardus, against adults of Ae. aegypti populations from western
Burkina Faso.
Materials and Methods
Essential Oil Extraction
The first step consisted in collecting the aerial parts of the
following species: L. multifiora, C. nardus, C.
citratus, E. camaldulensis, and O. americanum. The
collection was conducted at the botanic garden of the Institut de Recherche en
Sciences Appliquées et Technologies
(IRSAT), Ouagadougou. The extraction of EOs was achieved
through hydrodistillation using Clevenger apparatus. A dark glass bottle was
used for storage at a temperature of 4°C, according to the works done by
Drabo et al. (2017). Indeed, the combinations of C. nardus and O.
americanum EOs tests were carried out, after having done the bioassays
with the individual EOs, at the `Institut de Recherche en Sciences de la
Santé/Direction Régionale de l'Ouest' (IRSS/DRO).
Analysis by Means of Gas Chromatography With
Flame Ionization Detector
Downloaded from
https://academic.oup.com/jme/advance-article/doi/10.1093/jme/tjac148/6759614
by guest on 14 October 2022
Essential oils obtained from the leaves of L.
multifiora, C. citratus, C. nardus, E.
camaldulensis, and O. americanum were analyzed by gas
chromatography (GC) with flame ionization detection (GC- FID) using an Agilent
6890N GC instrument which is FID equipped, along with a DB-5 narrow bore
column. Experimental procedures are detailed in Drabo et al. (2017) and
Balboné et al. (2022).
Gas Chromatography/Mass Spectrometry Analysis
For the GC/MS analysis, a GC HP 6890 connected to an MSD HP
5972 (Hewlett Packard, Palo Alto, CA) with a Zebron ZB-5MS capillary column (30
m long, ID 0.25 mm and film thickness 0.25 mm; Agilent) was used. Experimental
procedures are detailed in Drabo et al. (2017) and Balboné et al.
(2022).
Collection and Rearing of Mosquitoes
The collection of pupae and larvae of the Ae. aegypti
field strain was carried out from June to October 2021, in Bobo-Dioulasso,
West Burkina Faso. Bobo-Dioulasso (11°10'37.7"N, 4°17'52.4"W), the
economic capital of Burkina Faso, is located in the western part of the
country. The pupae and larvae were reared in the insectarium located in the
`Institut de Recherches en Sciences de la Santé, Direction
Régionale de l'Ouest' (IRSS/DRO) in Bobo-Dioulasso. Larvae were fed with
tetraMin Baby Fish Food (Tetrawerke, Melle, Germany). Adult mosquitoes, which
emerged from pupae of the field strain, were placed in cages and fed with a 10%
sugar solution. Female mosquitoes of first-generation field strain and
second-generation Ae. aegypti `Bora Bora' strain maintained at the
insectarium, as a reference strain, were used for susceptibility tests.
Mosquitoes were reared under conditions of temperature 27 #177; 2°C,
relative humidity 70 #177; 5%, 12 h of light and 12 h of dark.
Adult Mosquitoes Bioassays
Susceptibility tests were performed with WHO tubes according
to standard procedures (WHO 2017). Whattman papers were used for impregnation
according to the protocol adopted by N'Guessan et al. (2007). For this purpose,
four rectangular papers (size 12 cm x 15 cm) were impregnated with 2 ml of a
given concentration of an essential oil/combination of EOs diluted in acetone.
For combination tests, 10 binary combinations varying from C1 to C9 were
prepared. Thus, 1) CN 10%: OA 90%; 2) CN 20%: OA 80%; 3) CN 30%: OA 70%; 4) CN
40%: OA 60%; 5) CN 50%: OA 50%; 6) CN 60%: OA 40%; 7) CN 70%: OA 30%; 8) CN
80%: OA 20%; and 9) CN 90%: OA 10% corresponding to C1, , C3, C4, C5, C6, C7,
C8, and C9, respectively, led us to carry out the combination tests.
Preliminary bioassay tests were used to select a range of EO
concentrations for the current tests. The concentrations chosen were: 0.1, 0.5,
and 1% for each EO or combination of EOs. Acetone was used as a negative
control and permethrin 0.75% was used as a positive control. The test
conditions were: temperature 25°C (#177; 2°C) and humidity 70-80%.
Diagnostic concentrations were derived from the susceptible Ae. aegypti
`Bora Bora' strain.
Thèse de Doctorat unique - 154
-
Journal of Medical Entomology, 2022, Vol. XX, No. XX
3
Data Analysis
The data obtained were analyzed using the statistical software
XLSTAT version 2015.1.01. By probity analysis, the knockdown times (KDT50
and KDT95), lethal concentrations (LC50 and
LC99), and 95% confidence limits (95% CL) were calculated to compare
the toxicity of the EOs and combinations against the adult mosquitoes tested.
The relationship between KDT, mortality, and concentrations was evaluated by
probity regression. The LC50, LC99, and mortality values were significantly
different between the EOs and combinations (P < 0.05) if their
confidence intervals did not overlap. Corrections were not necessary as no
mortality was found in the negative controls. According to WHO (2017), the
diagnostic concentration corresponds to twice the LC99 on
susceptible strain.
Calculation of the Fractional Inhibitory
Concentration indices
Determination of EO interactions in the combinations was done
using fractional inhibitory concentration (FIC) indices. The calculation and
interpretation procedures have been described in Schelz et al. (2006) and
Bassolé and Juliani (2012).
FIC indices were obtained by using the following formula: FIC
= FICA + FICB and FICA = MICA(A+B)/MICA and
FICB = MICB(A+B)/ MICB where MICA and
MICB are the minimum inhibitory concentrations that kill adult
mosquitoes for EOs A and B, respectively, MICA(A+B) and
MICB(A+B) are the minimum inhibitory concentrations of A and
B, respectively in the combination. Also, FICA and FICB
are the fractional inhibitory concentrations of A and B, respectively.
The effects were classified as additive, synergistic, indifferent, and
antagonistic as follows: 1) Synergistic if FIC < 0.5; 2) additive, if 0.5 ~
FIC ~ 1; 3) indifferent if 1 ~ FIC ~ 4; or 4) antagonistic if FIC > 4.
Results
Chemical Characterization of the Essential Oils
Data on the chemical analysis of the five EO samples are given
in Table 1. The compounds of all these EOs were dominated by monoterpenes. The
EO of C. citratus was composed of neral (44.7%) and geranial (55.2%).
As for C. nardus EO, it was characterized by six compounds, dominated
in majority by citronellal (41.7%), ge-raniol (20.8%), and â-elemene
(11%). Sixteen compounds were found in E. camaldulensis EO with
1.8-cineole (59.55%) as major compound. L. multifiora EO consisted 16
compounds including â-caryophyllene (20.1%), p-cymene (14.6%), thymol
(12.0%) acetate, and 1,8-cineole (11.6%) as the major compounds. Twenty-six
compounds were found in O. americanum EO with 1,8-cineole (31.22%) and
camphor (12.73%) the major compounds.
Knockdown Times and Adulticidal Effects of EOs
and Combinations
KDT values and mortalities were depending of the EO or
combination. Also, they varied in connection with the treatment concentration
and the Ae. aegypti strain tested.
Indeed, the lowest KDT values and the highest mortalities were
obtained on the susceptible strain Bora Bora. All the EOs tested in the present
study showed more or less high insecticidal properties on the both strains of
Ae. aegypti. Lippia multifiora EO was the most toxic to all
Ae. aegypti strains with a KDT95 value of 113.5 min and a
mortality rate of 85% at the 1% concentration (Table 2) on Ae. aegypti
of Bobo-Dioulasso. Also, this EO gave a proportion of 0.79 and 1.25% for
LC50 and LC99, respectively (Table 3), on Ae. aegypti
from Bobo-Dioulasso.
As for E. camaldulensis EO, it was the least toxic
with a mortality of 0.7% at the 1% concentration on Ae. aegypti from
Bobo-Dioulasso (Table 2).
At the 1% concentration, C. nardus and O.
americanum EO showed mortalities of 12.75 and 2.3%, LC50 values
of 2.94 and 3.1%, respectively, on Ae. aegypti from Bobo-Dioulasso.
At the 1% concentration, there were no significant differences
between the KDT obtained with the EOs on both strains of Ae. aegypti
tested, except for those of C. nardus and L.
multifiora.
Downloaded from
https://academic.oup.com/jme/advance-article/doi/10.1093/jme/tjac148/6759614
by guest on 14 October 2022
Overall, all combinations showed low KDT values (Table 4).
Combinations C8 (CN 80%; OA 20%), (CN 20%; OA 80%), and C9 (CN 90%; OA 10%)
with LC50 values below 1%, whereas those of C4 (CN 40%; OA 60%) and
C6 (CN 60%; OA 40%) were below 2%. The LC50 values and diagnostic
concentrations obtained with these combinations were significantly lower than
those obtained with the two EOs taken individually and with permethrin (Table
3). These combinations also had significantly higher mortalities than the
individual EOs and permethrin (Tables 2 and 4).
The synergistic effect was obtained on both strains with the
C8 combination, and the additive effect was found with the and C9 combinations
(Tables 5 and 6). No antagonistic effect was observed but some combinations
showed no effect.
Discussion
Vector control strategies have mainly consisted of the use of
chemicals against mosquitoes. The frequent use of chemicals has raised many
concerns in the environment and human public health (Cuervo-Parra et al. 2016)
and caused increasing resistance in most mosquito populations (Mahanta et al.
2019) and particularly Ae. aegypti population of Bobo-Dioulasso
(Namountougou et al. 2020); (Badolo et al. 2019). Regarding this situation,
plants extracts seem to be an alternative because they contain large number of
bioactive, effective, biodegradable compounds and have been used currently for
mosquito control (Boonyuan et al. 2014; Yaméogo et al. 2021). From the
present knowledge, these are the first time that works on toxicity of
combinations of whole EOs on Ae. aegypti populations were
investigated.
Here, our current study showed the variable adulticidal
effects of EOs of C. nardus, C. citratus, O.
americanum, L. multifiora, and E. camadulensis on
susceptible Bora Bora and resistant Aedes aegypti strain collected in
Bobo-Dioulasso. These results partially confirm the work of Yaméogo et
al. (2021) who showed the toxicity of six EOs including C. nardus,
E. camaldulensis, Lippia multifiora, and O.
americanum on Ae. aegypti populations collected in Ouagadougou.
They also confirm the works done by Drabo et al. (2017) who had shown the
adulticidal properties of C. citratus and O. americanum on
Bemisia tabaci populations confirming their broad-spectrum efficiency
against most of insects.
Interestingly, the EO of L. multifiora was the most
toxic on both strains of Ae. aegypti. This toxicity of L.
multifiora EO could be explained by the insecticidal effect of the most
dominant compounds which are thymol acetate, p-cymene and
â-caryophyllene. Indeed, previous studies reported that
â-caryophyllene exhibits insecticidal properties (Almadiy 2020) and
toxicity of Eucalyptus tereticornis EO could be explained by the
presence of the other component as p-cymene (Bossou et al. 2013) found as a
major component in L. multifiora. Similarly, lethal toxicity of the
main components of Ocimum kilimandscharicum (such as camphor,
1.8-cineole and â-caryophyllene) EOs had been reported against two insect
pests (Rhyzopertha dominica and Sitophilus zeamais; Bekele
and Hassanali 2001).
Thèse de Doctorat unique - 155
-
4 Journal of Medical Entomology,
2022, Vol. XX, No. XX
Table 1. Chemical composition of Lippia
multiflora, Cymbopogon nardus,
Ocimum americanum, Cymbopogon
citratus, and Eucalyptus camaldulensis
essential oils
Downloaded from
https://academic.oup.com/jme/advance-article/doi/10.1093/jme/tjac148/6759614
by guest on 14 October 2022
|
Retention
Compounds indices
|
Cymbopogon
citratus(%)
|
Cymbopogon
nardus (%)
|
Eucalyptus
camaldulensis(%)
|
Lippia multi-
flora (%)
|
Ocimum
americanum(%)
|
|
á-Thujene 925
|
--
|
--
|
--
|
1.6
|
0.13
|
|
á-Pinene 933
|
--
|
--
|
9.17
|
0.9
|
6.87
|
|
Camphene 945
|
--
|
--
|
0.19
|
--
|
2.77
|
|
Sabinene 975
|
--
|
--
|
--
|
--
|
--
|
|
â-Pinene 981
|
--
|
--
|
2.49
|
--
|
0.65
|
|
Myrcene 992
|
--
|
--
|
0.15
|
--
|
3.71
|
|
2-Carene 999
|
--
|
--
|
--
|
--
|
2.04
|
|
á-Phellandrene 1,003
|
--
|
--
|
0.32
|
3.1
|
0.39
|
|
á-Terpinene 1,017
|
--
|
--
|
--
|
1.41
|
0.40
|
|
p-Cymene 1,027
|
--
|
--
|
4.73
|
14.6
|
0.21
|
|
Limonene 1,028
|
--
|
--
|
8.76
|
--
|
4.66
|
|
1,8-Cineole 1,034
|
--
|
--
|
59.55
|
11.6
|
31.22
|
|
â-Ocimene 1,048
|
--
|
--
|
--
|
9.4
|
--
|
|
?-Terpinene 1,061
|
--
|
--
|
1.39
|
--
|
1.13
|
|
Terpinolene 1,081
|
--
|
--
|
0.21
|
--
|
0.65
|
|
Camphor 1,124
|
--
|
--
|
--
|
--
|
12.73
|
|
Citronellal 1,158
|
--
|
41.7
|
--
|
--
|
--
|
|
Citronellol 1,230
|
--
|
8.0
|
--
|
--
|
--
|
|
Borneol 1,156
|
--
|
--
|
0.46
|
--
|
0.13
|
|
4-Terpineol 1,168
|
--
|
--
|
1.14
|
--
|
0.92
|
|
á-Terpineol 1,177
|
--
|
--
|
2.65
|
--
|
2.08
|
|
Neral 1,242
|
44.7
|
--
|
|
--
|
|
|
Piperitone 1,252
|
--
|
--
|
0.09
|
--
|
2.44
|
|
Geraniol 1,253
|
--
|
20.8
|
--
|
--
|
--
|
|
Geranial 1,268
|
55.2
|
--
|
--
|
--
|
--
|
|
Bornyl acetate 1,269
|
--
|
--
|
--
|
--
|
3.96
|
|
Thymol 1,288
|
--
|
--
|
--
|
8.3
|
--
|
|
Thymol acetate 1,355
|
--
|
--
|
--
|
12.0
|
--
|
|
â-Elemene 1,372
|
--
|
11.0
|
--
|
--
|
--
|
|
á-Copaene 1,390
|
--
|
3.7
|
--
|
--
|
--
|
|
â-Caryophyllene 1,415
|
--
|
--
|
--
|
20.1
|
3.55
|
|
Trans-á-Bergamotene 1,433
|
--
|
--
|
--
|
--
|
5.32
|
|
á-Humulene 1,442
|
--
|
--
|
--
|
4.8
|
0.25
|
|
allo-Aromadendrene 1,446
|
--
|
--
|
1.40
|
--
|
--
|
|
á-Amorphene 1,485
|
--
|
--
|
--
|
1.4
|
--
|
|
Germacrene D 1,495
|
--
|
--
|
--
|
1.5
|
0.24
|
|
(Z, E)-á-farnesène 1,497
|
--
|
--
|
--
|
--
|
3.64
|
|
B-himachalene 1,499
|
--
|
--
|
--
|
--
|
--
|
|
Hedycaryol 1,520
|
--
|
7.4
|
--
|
--
|
--
|
|
Elemol 1,545
|
--
|
--
|
--
|
2.1
|
1.6
|
|
â-Eudesmol 1,650
|
--
|
--
|
--
|
2.5
|
--
|
|
Caryophyllene oxyde 1,581
|
--
|
--
|
--
|
4.5
|
0.08
|
|
Hydrocarbon monoterpenes
|
-
|
--
|
24.89
|
33.01
|
23.61
|
|
Oxygenated monoterpenes
|
99.9
|
77.9
|
66.96
|
36.5
|
53.48
|
|
Hydrocarbon sesquiterpenes
|
--
|
14.7
|
1.4
|
25.8
|
13.03
|
|
Oxygenated sesquiterpenes
|
--
|
--
|
0.34
|
4.5
|
1.68
|
|
Total
|
99.9
|
92.6
|
93.59
|
99.81
|
91.8
|
The numbers in bold represent the major compounds of each
essential oil.
Other previous studies reported that the insecticidal
properties of an additive effect between 1.8-cineole and sabinene on
Sitophilus
O. americanum EO were due to 1.8-cineole, camphor,
and á-pinene oryzae.
(Koul et al. 2008). These compounds were the same of those
found If the pre-exposure of mosquitoes to PBO can restore totally or
in O. americanum EO tested here and for which we
obtained the partially the susceptibility to pyrethroids (Hien et al. 2021),
there
weak ef!cacy. According to Ntonga et al. (2017), 1.8-cineole
is re is no doubt that the toxicity of EOs could be improved by binary
ported to contribute strongly to the toxicity of
Callistemon citrinus combinations of certain EOs.
oil against adult females of Anopheles coluzzii. On
the contrary, E. In the current study, this improvement was outlined
through
camaldulensis EO, rich in 1,8-cineole was the least
toxic against the KDT, LC50 values and rate of mortality obtained
with certain
adult females of Ae. aegypti. This low toxicity
could be due prob combinations which were higher than those of the EOs tested
alone
ably to the absence of sabinene among the main compounds of
E. and positive control. It is suggested that combinations reduce
the
camaldulensis EO. Indeed, Liu et al. (2020) reported
that there was time required to paralyze mosquitoes. Interestingly, the
combination
Thèse de Doctorat unique - 156
-
Journal of Medical Entomology, 2022, Vol. XX, No. XX
5
Table 2. KDT50, KDT95 and
mortalities from essential oils tested on Aedes aegypti susceptible
(Bora bora) and field (Bobo-Dioulasso) strains
Downloaded from
https://academic.oup.com/jme/advance-article/doi/10.1093/jme/tjac148/6759614
by guest on 14 October 2022
|
|
|
Aedes aegypti `Bora bora'
|
Aedes aegypti `Bobo-Dioulasso'
|
|
Treatments
|
Concentrations
|
KDT50 (Min)
|
KDT95 (Min)
|
Mortality (%)
|
KDT50 (Min)
|
KDT95 (Min)
|
Mortality (%)
|
|
C. citratus
|
0.1
|
193.3
|
291.1
|
0
|
221.2
|
311.2
|
0
|
|
0.5
|
192.6
|
290.2
|
4.04
|
228.1
|
298.5
|
0
|
|
1
|
140.6
|
230.4
|
8.26
|
142.5
|
244.8
|
0.9
|
|
C. nardus
|
0.1
|
88.6
|
134
|
3.1
|
179
|
278
|
0.98
|
|
0.5
|
35.6
|
53.8
|
9.86
|
88.7
|
143.9
|
5
|
|
1
|
24
|
33.7
|
20.34
|
35.6
|
57.2
|
12.75
|
|
E. camaldulensis
|
0.1
|
211.3
|
299.1
|
0
|
234.1
|
343.9
|
0
|
|
0.5
|
178.1
|
285.7
|
3.3
|
209.4
|
297.2
|
0.1
|
|
1
|
156.5
|
267.5
|
7.14
|
190.3
|
287.2
|
0.7
|
|
L. multiflora
|
0.1
|
107
|
178.7
|
12.35
|
113.5
|
182.8
|
4.1
|
|
0.5
|
40.9
|
72
|
29.33
|
43
|
75
|
16.02
|
|
1
|
-3.9
|
7.8
|
100
|
20.5
|
32.8
|
85
|
|
O. americanum
|
0.1
|
131.57
|
194.82
|
2.08
|
151.7
|
264.3
|
0
|
|
0.5
|
128.1
|
188.4
|
5.56
|
145.3
|
247.5
|
0.2
|
|
1
|
125.7
|
210.6
|
9.14
|
133.3
|
249
|
2.3
|
|
Permethrin
|
0.75
|
16.6
|
29.1
|
98.8
|
144
|
188.7
|
10.1
|
Table 3. Lethal concentrations at 50 and 99%
(LÇ and LÇ) and diagnostic concentrations of all essential oils,
combinations, and per-methrin of O. americanum and C.
nardus tested with Aedes aegypti
|
Treatments
|
Aedes aegypti
Bora Bora
|
Aedes aegypti
Bobo-Dioulasso
|
Diagnostic
concentration
|
Diagnostic
concentration
|
Diagnostic
concentration
|
|
LC50 (%)
(CL95)
|
LC99 (%)
(CL95)
|
LC50 (%)
(CL95)
|
LC99 (%)
(CL95)
|
(%)
|
(mg/ml)
|
(mg/cm2)
|
|
C. citratus
|
2.7
|
4.9
|
--
|
--
|
9.88
|
98.8
|
1.10
|
|
(-)
|
(-)
|
|
|
|
|
|
|
C. nardus
|
2.24
|
4.3
|
2.94
|
5.9
|
8.6
|
86
|
0.95
|
|
(1.6-2.7)
|
(2.7-4.9)
|
(1.4-3.8)
|
(5.7-8.7)
|
|
|
|
|
E. camaldulensis
|
3.58
|
7.81
|
--
|
--
|
15.62
|
156.2
|
1.73
|
|
(3.3-4.2)
|
(-)
|
|
|
|
|
|
|
L. multiflora
|
0.57
|
1.03
|
0.79
|
1,25
|
2.06
|
20.6
|
0.23
|
|
(0.5-0.6)
|
(0.9-1.2)
|
(0.7-0.8)
|
(1.1-1.4)
|
|
|
|
|
O. americanum
|
2.7
|
4.9
|
3.1
|
5.3
|
9.8
|
98
|
1.09
|
|
(-)
|
(3.4-5.3)
|
(-)
|
(-)
|
|
|
|
|
C1(CN 10%:OA
|
3.63
|
6.41
|
3.9
|
6.8
|
12.72
|
127.2
|
1.41
|
|
90%)
|
(-)
|
(-)
|
(-)
|
(-)
|
|
|
|
|
(CN 20%:OA
|
0.77
|
1.28
|
0.84
|
1.297
|
2.56
|
25.6
|
0.28
|
|
80%)
|
(0.7-0.8)
|
(1.2-1.4)
|
(0.8-0.9)
|
(1.2-1.4)
|
|
|
|
|
C3(CN 30%:OA
|
2.683
|
4.9
|
2.6
|
4.5
|
8.4
|
84
|
0.93
|
|
70%)
|
(1.46-5)
|
(3.2-5.9)
|
(-)
|
(-)
|
|
|
|
|
C4(CN 40%:OA
|
1.49
|
2.66
|
1.98
|
3.9
|
5.06
|
50.6
|
0.56
|
|
60%)
|
(1.2-2.2)
|
(2-4.6)
|
(1.5-2.3)
|
(2.4-4.6)
|
|
|
|
|
C5(CN 50%:OA
|
4.02
|
9.697
|
3.83
|
8.3
|
19.4
|
194
|
2.16
|
|
50%)
|
(-)
|
(-)
|
(-)
|
(-)
|
|
|
|
|
C6(CN 60%:OA
|
1.79
|
3.27
|
1.68
|
2.92
|
6.54
|
65.4
|
2.16
|
|
40%)
|
(1.4-3.5)
|
(2.3-7.7)
|
1.3-3.3
|
(2.1-3.1)
|
|
|
|
|
C7(CN 70%:OA
|
1.7
|
2.94
|
3.47
|
6.1
|
5.88
|
58.8
|
0.65
|
|
30%)
|
(1.3-1.9)
|
(1.9-4.4)
|
(-)
|
(-)
|
|
|
|
|
C8(CN 80%:OA
|
0.6
|
1.08
|
0.7
|
1.2
|
2.16
|
21.6
|
0.24
|
|
10%)
|
(0.5-0.6)
|
(1-1.2)
|
0,6-0.8
|
(1.1-1.3)
|
|
|
|
|
C9 (CN 90%:OA
|
0.97
|
2.29
|
0.99
|
2.56
|
4.58
|
45.8
|
0.51
|
|
10%)
|
(0.8-1.1)
|
(1.9-3)
|
(0.9-1.3)
|
(2-3.5)
|
|
|
|
|
Permethrin
|
0.75
|
1.69
|
2.2
|
3.5
|
3.38
|
33.8
|
0.37
|
|
(0.6-1.1)
|
(1.6-1.8)
|
(2.1-2.6)
|
(2.3-5.8)
|
|
|
|
CL, conidence limit.
of C8 (CN 80%: OA 20%) and (CN 20%: OA 80%) improved the
toxicity on the Aedes populations. This would be due to the
simultaneous toxic effect of the compounds in the combined EOs. It could
be thought that C. nardus EO needed a certain amount
of the major compounds of O. americanum EO. Conversely, O.
americanum EO needed some constituents of C. nardus EO to
perform. Studies had
Thèse de Doctorat unique - 157
-
6 Journal of Medical Entomology, 2022,
Vol. XX, No. XX
Table 4. KDT50, KDT95, and
mortalities of binary combinations of C. nardus (CN) and O.
americanum (OA) tested on Aedes aegypti susceptible (Bora bora)
and field (Bobo-Dioulasso) strains
Aedes aegypti «Bora bora» Aedes aegypti
`Bobo-Dioulasso'
|
Codes Combination of essential oil Concentrations
|
KDT50(Min) KDT95 (Min) Mortality(%) KDT50
(Min) KDT95 (Min) Mortality(%)
|
Downloaded from
https://academic.oup.com/jme/advance-article/doi/10.1093/jme/tjac148/6759614
by guest on 14 October 2022
C1 CN 10%:OA 90% 0.1 117.5 159 0 127.3 187.4 0
0.5 95 136.3 0.6 118.3 180.7 0
1 76.5 116.2 2.66 110.7 172.4 1.6
CN 20%:OA 80% 0.1 103.1 169.7 1.23 125.7 173.7 0.4
0.5 65 113.4 7.23 103.3 163.4 6.90
1 -4 0.9 86.67 1.2 9.2 81.99
C3 CN 30%:OA 70% 0.1 147.7 228.1 0 175.7 273.7 0
0.5 98.2 164.8 1.16 118.6 252.7 0.3
1 28.4 48.5 5.49 77.5 186 4.27
C4 CN 40%:OA 60% 0.1 173.5 281.3 0 190.3 287.2 0.9
0.5 65.5 107.3 2.47 113.3 184.5 2.19
1 15.2 33.2 15.96 17 42.2 7.49
C5 CN 50%:OA 50% 0.1 123.4 197.3 4.65 131.7 222.4 2.30
0.5 76.6 139.4 8.33 102.2 168.8 4.55
1 17.1 28.2 10.11 27 47.1 7.82
C6 CN 60%:OA 40% 0.1 96.2 161.2 0 151.7 252.3 0
0.5 24.2 36.7 2.44 106.1 160.1 1.10
1 10.5 16.7 10.31 17.1 22 9.89
C7 CN 70%:OA 30% 0.1 146 217 0 189.9 286.7 0
0.5 115.3 184.1 1.1 130.8 199.7 0.31
1 25.5 37.3 6.02 38.5 57.1 2.20
C8 CN 80%:OA 20% 0.1 48.9 77 3.37 60.6 79.8 3.19
0.5 11.6 59.2 20.99 14.3 46.5 13.75
1 -9.8 0.6 100 -3.9 7.8 95.09
C9 CN 90%:OA 10% 0.1 92.3 137.2 2.38 115.4 157.8 1.28
0.5 13.5 40.5 39.73 20.5 53.8 30.23
1 7.7 12.3 58.24 8.5 17.1 51.76
Permethrin 0.75 16.6 29.1 98.8 144 188.7 10.1
KDT, knockdown time.
Table 5. The effects of interaction of essential
oil combinations from Cymbopogon nardus (CN) and Ocimum americanum
(OA) on Aedes aegypti adults of the susceptible strain (Bora
Bora) and the type of interaction (n = 150 adults)
Combination of essential oil (%) Codes Mortality at LC50
(%) FICCn FICO.a FIC Effect
CN 0%:OA 100% OA 2.7 -- -- -- --
CN 10%:OA 90% C1 3.61 1.61 1.34 2.95 No effect
CN 20%:OA 80% 0.77 0.34 0.29 0.63 Addition
CN 30%:OA 70% C3 2.35 1.05 0.87 1.92 No effect
CN 40%:OA 60% C4 1.48 0.66 0.55 1.21 No effect
CN 50%:OA 50% C5 3.31 1.48 1.23 2.70 No effect
CN 60%:OA 40% C6 1.79 0.80 0.66 1.46 No effect
CN 70%:OA 30% C7 1.78 0.79 0.66 1.45 No effect
CN 80%:OA 20% C8 0.6 0.27 0.22 0.49 Synergistic
CN 90%:OA 10% C9 0.97 0.43 0.36 0.79 Additive
CN 100%:OA 0% CN 2.24 -- -- -- --
FIC = FICA + FICB; Additive: 0,5 ~ FIC ~ 1;
Synergistic: FIC < 0,5; Antagonistic: FIC > 4; No effect: 1 ~ FIC ~ 4.
shown that the addition of a little citronellal enhanced the
effect of the citral-myrcene mixture against Ae. aegypti.
Nevertheless, mosquito host-seeking behavior was not significantly reduced by
citron-ellal alone (Hao et al. 2008).
Interestingly, only C8 combination provides synergistic effect
on Aedes resistant populations. Synergistic effect obtained by this
combination could also be explained by the simultaneous action of the major
compounds. Also, this synergistic effect could be due to the appearance of a
new components that does not exist in the individual EOs (Muturi et al. 2017;
Wangrawa et al. 2022). Previous studies had shown that some essential oils or
their compounds could interact to create a synergistic effect at some ratio and
an antagonistic effect at other ratios (Intirach et al. 2012; Pavela 2015).
Further studies will evaluate the combination 80:20 ratio on a large wild
Aedes populations to appreciate the phenotypic data. As well,
component of this mixture will determine. It is necessary before evaluating
this combination in semifields.
Indeed, combinations of 1.8-cineole and citronellal as well as
several minor compounds and citronellal gave synergistic effects on
Spodoptera littoralis larvae (Pavela 2014).
Thèse de Doctorat unique - 158
-
Journal of Medical Entomology, 2022, Vol. XX,
No. XX 7
Table 6. The effects of interaction of essential oil
combinations from Cymbopogon nardus (CN) and Ocimum americanum
(OA) on Aedes aegypti adults of the field strain (Bobo-Dioulasso)
and the type of interaction (n = 150 adults)
|
Combination of essential oil (%)
|
Codes
|
Mortality at LC50 (%)
|
FICOa
|
FICCn
|
FIC
|
Effect
|
|
CN 0%:OA 100%
|
OA
|
3.1
|
--
|
--
|
--
|
--
|
|
CN 10%:OA 90%
|
C1
|
3.9
|
1.25
|
1.32
|
2.57
|
No effect
|
|
CN 20%:OA 80%
|
|
0.84
|
0.27
|
0.28
|
0.55
|
Additive
|
|
CN 30%:OA 70%
|
C3
|
2.6
|
0.83
|
0.88
|
1.71
|
No effect
|
|
CN 40%:OA 60%
|
C4
|
2.18
|
0.7
|
0.74
|
1.44
|
No effect
|
|
CN 50%:OA 50%
|
C5
|
3.83
|
1.23
|
1.3
|
2.53
|
No effect
|
|
CN 60%:OA 40%
|
C6
|
1.68
|
0.54
|
0.57
|
1.11
|
No effect
|
|
CN 70%:OA 30%
|
C7
|
3.47
|
1.11
|
1.18
|
2.29
|
No effect
|
|
CN 80%:OA 20%
|
C8
|
0.7
|
0.22
|
0.24
|
0.46
|
Synergistic
|
|
CN 90%:OA 10%
|
C9
|
1.05
|
0.34
|
0.36
|
0.7
|
Additive
|
FIC = FICA + FICB; Additive: 0.5
~ FIC ~ 1; Synergistic: FIC < 0.5;
Antagonistic: FIC > 4; No effect: 1 ~ FIC ~
4.
According to Hyldgaard et al. (2012), each compound of
an EO had a specific mode of action but these compounds could
interact with compounds of another EO in a combination to give other modes of
action. Thus, the combination of compounds with different modes of action could
increase the total lethal actions in mixtures (Sarma et al. 2019).
This study opens new perspectives of valorization of
EOs. According to Gnankiné and Bassolé
(2017), microencapsulation technologies may improve the duration of
action of EOs in terms of application taking into consideration the fact that
the EOs are volatiles.
Conclusion
Our study investigated the adulticidal effects of the
essential oils of five plants used traditionally in Burkina
Faso, Lippia multifiora,
Cymbopogon nardus, Ocimum
americanum, Cymbopogon citrates, and
Eucalyptus camaldulensis, and combinations of two of
these EOs against adults of Aedes aegypti, the
mosquito vector of dengue. Lippia multifiora
EO was the most toxic on both strains of Aedes
aegypti tested. EOs of C. nardus and
O. americanum were less toxic, but their combinations
were more toxic, in some proportions, to both strains of Ae.
aegypti. Lippia multifiora
EO and combinations of C8 (CN 80%: OA 20%), (CN 20%: OA 80%), and
to a lesser extent C9 (CN 90%: OA 10%) could be promising alternatives to
pyrethroid resistance in control strategies against Ae.
aegypti, the dengue vector. As far as we know, this study
demonstrates the first time that the binary combinations
namely C8 and exhibit high rates of mortality on Bobo-Dioulasso resistant
strain to chemicals.
Acknowledgments
We sincerely thank `Institut de recherche en Sciences
Appliquées et technologiques' (IRSAT) for supplying us
with essential oils. We also thank Casimir Gnankiné for
editing this article.
Funding
Funding of this study was provided partly by the TWAS
18-163RG/ BIO/AF/AC_G-FR3240303649 and the centre d'excellence African (CEA) en
Innovations des maladies a transmission vectorielle.
References Cited
Achee, N. L., F. Gould, T. A. Perkins, R. C. Reiner,
A. C. Morrison, S. A. Ritchie, D. J. Gubler, R. Teyssou, and T. W. Scott. 2015.
A critical assessment of vector control for dengue prevention. J.
Vector Ecology 39:112-122.
Almadiy, A. A. 2020. chemical composition,
insecticidal and biochemical effects of two plant oils and their major
fractions against Aedes aegypti, the common vector of
dengue fever. Heliyon 6: e04915.
Downloaded from
https://academic.oup.com/jme/advance-article/doi/10.1093/jme/tjac148/6759614
by guest on 14 October 2022
Aubry, P., and Gauzére, B. A. 2020.
Arboviroses tropicals. Centre René
Labusquiére. Institut de Médecine
Tropicale, Université de Bordeaux.
33076:1-20.
Badolo, A., A. Sombié, P. M. Pignatelli, A.
Sanon, F. Yaméogo, D. W. Wangrawa, A. Sanon, H. Kanuka, P. J. McCall,
and D. Weetman. 2019. Insecticide resistance levels and mechanisms in
Aedes aegypti populations in and around Ouagadougou,
Burkina Faso. PLoS Negl.Trop. Dis. 13:
e0007439.
Balboné, M., D. D. Soma, M. Namountougou, S. F.
Drabo, H. Konate, O. Toe, K. Bayili, G. B. Meda, R. K. Dabiré, and O.
Gnankine. 2022. Essential oils from five local plants: an
alternative larvicide for anopheles gambiae s.l. (Diptera: Culicidae) and Aedes
aegypti (Diptera: Culicidae) control in Western burkina faso.
Front. Trop. Dis. 3:853405. doi:10.3389/
fitd.2022.853405
Bassolé, I. H. N., and H. R. Juliani. 2012.
Essential oils in combination and their antimicrobial properties.
Molecules 17: 3989-4006.
Bekele, J., and A. Hassanali. 2001. Blend effects in
the toxicity of the essential oil constituents of Ocimum
kilimandscharicum and Ocimum kenyense
(Labiateae) on two post-harvest insect pests.
Phytochemistry 57: 385-391.
Bhatt, V. G., P. Chavan, S. Ojha, and P. K. Nair.
2015. Challenges in the laboratory diagnosis and management of dengue
infections. Open Microbiol. J. 9.
Boonyuan, W., J. P. Grieco, M. J. Bangs, A.
Prabaripai, S. Tantakom, and T. Chareonviriyaphap. 2014. Excito-repellency of
essential oils against an Aedes aegypti (L.)
field population in Thailand. J. Vector Ecology
39(1): 112-122.
Bossou, A. D., S. Mangelinckx, H. Yedomonhan, P. M.
Boko, M. C. Akogbeto, N. De Kimpe, F. Avlessi, and D. C. K. Sohounhloue. 2013.
Chemical composition and insecticidal activity of plant essential oils from
Benin against Anopheles gambiae (Giles).
Parasit. Vectors 6: 1-17.
Chansang, A., D. Champakaew, A. Junkum, A. Jitpakdi,
D. Amornlerdpison, A. K. Aldred, D. Riyong, A. Wannasan, J. Intirach, R.
Muangmoon, et al. 2018. Synergy in the adulticidal
efficacy of essential oils for the improvement of permethrin
toxicity against Aedes aegypti L.(Diptera:
Culicidae). Parasit. Vectors 11: 1-16.
Cuervo-Parra, J. A., T. R. Cortés, and M.
Ramirez-Lepe. 2016. Mosquito-borne diseases, pesticides used for
mosquito control, and development of resistance to insecticides, Chapter 7.
Insecticides Resistance. Rijeka: InTechOpen.
de Boer, H., C. Vongsombath, K. Pålsson, L.
Björk, and T. G. T. Jaenson. 2010. Botanical repellents and pesticides
traditionally used against hematoph-agous invertebrates in Lao people's
democratic republic: a comparative study of plants used in 66 villages.
J. Med. Entomol. 47: 400-414.
Drabo, S. F., O. Gnankine, I. H. N. Bassolé, R.
C. Nébié, and M. Laurence. 2017. Susceptibility of MED-Q1 and
MED-Q3 biotypes of Bemisia tabaci (Hemiptera:
Aleyrodidae) populations to essential and seed oils. J. Econ.
Entomol. 110(3):1031-1038.
Gnankiné, O., and I. H. N. Bassolé.
2017. Essential oils as an alternative to pyrethroids' resistance against
Anopheles species complex Giles (Diptera: Culicidae).
Molecules 22: 1321.
Guzman, M. G., S. B. Halstead, H. Artsob, P. Buchy, J.
Farrar, D. J. Gubler, E. Hunsperger, A. Kroeger, H. S. Margolis, E.
Martínez, et al. 2010. Dengue: a continuing
global threat. Nat. Rev. Microbiol. 8:
S7-S16.
Thèse de Doctorat unique - 159
-
8 Journal of Medical Entomology, 2022, Vol. XX,
No. XX
Hao, H., J. Wei, J. Dai, and J. Du. 2008. Host-seeking and
blood-feeding behavior of Aedes albopictus (Diptera: Culicidae)
exposed to vapors of ge-raniol, citral, citronellal, eugenol, or anisaldehyde.
J. Med. Entomol. 45: 533-539.
Hien, A. S., D. D. Soma, S. Maiga, D. Coulibaly, A.
Diabaté, A. Belemvire, M. B. Diouf, D. Jacob, A.
Koné, E. Dotson, et al. 2021. Evidence
supporting deployment of next generation insecticide treated nets in burkina
faso: bioassays with either chlorfenapyr or piperonyl butoxide increase
mortality of pyrethroid-resistant Anopheles gambiae. Malar. J. 20:
1-12.
Hyldgaard, M., T. Mygind, and R. L. Meyer. 2012. Essential
oils in food pres-ervation: mode of action, synergies, and interactions with
food matrix components. Front. Microbiol. 3: 12.
Intirach, J., A. Junkum, B. Tuetun, W. Choochote, U.
Chaithong, A. Jitpakdi, D. Riyong, D. Champakaew, and B. Pitasawat. 2012.
Chemical constituents and combined larvicidal effects of selected essential
oils against Anopheles cracens (Diptera: Culicidae). Psyche
(London) 2012. doi:10.1155/2012/591616
Isman, M. B. 2000. Plant essential oils for pest and disease
management. Crop Prot. 19: 603-608.
Koul, O., S. Walia, and G. S. Dhaliwal. 2008. Essential oils
as green pesticides: potential and constraints. Biopestic. Int. 4:
63-84.
Liu, T. T., L. K. P. Chao, K. S. Hong, Y. J. Huang, and T. S.
Yang. 2020. Composition and insecticidal activity of essential oil of
Bacopa caroliniana and interactive effects of individual compounds on
the activity. Insects 11: 23.
Mahanta, S., R. Sarma, and B. Khanikor. 2019. The Essential
oil of Lippia alba mill (lamiales:verbenaceae) as mosquitocidal and
repellent agent against Culex quinquefasciatus say (Diptera:
Culicidae) and Aedes aegypti Linn (Diptera: Culicidae). J. Basic
Appl. Zool. 80: 1-17.
Mayer, S. V., R. B. Tesh, and N. Vasilakis. 2017. The
emergence of arthropod-borne viral diseases: a global prospective on dengue,
chikungunya and zika fevers. Acta Trop. 166: 155-163.
doi:10.1016/j.actatropica.2016.11.020
Ministère de la Santé. 2017. Flambée de
cas de dengue au Burkina Faso. Sitrep Dengue 11.
Muturi, E. J., J. L. Ramirez, K. M. Doll, and
M. J. Bowman. 2017. Combined toxicity of three essential oils against Aedes
aegypti (Diptera: Culicidae) larvae. J. Med. Entomol. 54:
1684-1691.
N'Guessan, R. N., V. Corbel, M.
Akogbéto, and M. Rowland. 2007. Reduced ef!cacy of
insecticide- treated nets and indoor residual spraying for malaria control in
pyrethroid resistance area, Benin. Emerg. Infect. Dis. 13: 199-206.
Namountougou, M., D. D. Soma, M.
Balboné, D. A. Kabore, M. Kientega, A. Hien, A.
Coulibaly, P. E. Ouattara, B. G. Meda, S. Drabo, et al. 2020.
Monitoring insecticide susceptibility in Aedes aegypti populations
from the two biggest cities, Ouagadougou and Bobo-Dioulasso, in Burkina Faso:
implication of metabolic resistance. Tropical Med. Infectious Dis. 5:
84.
Ntonga, A., J. Dongmo, and M. P. Nkouandou. 2017. Toxicity
evaluation of essential oils from Callistemon citrinus, Cinnamomum
zeylanicum and Psidium guajava leaves on adult of Anopheles
coluzzii Coetzee and Wilkerson 2013. The Urban Malaria Vector Species in
Cameroon. Cameroon J Biol Biochecm Sci. 25:12-21.
Ouattara, L. P. E., I. Sangare, M. Namountougou, A. Hien, A.
Ouari, D. D. Soma, D. Kassie, A. Diabate, O. Gnankine, E. Bonnet, et
al. 2019. Surveys
of arboviruses vectors in four cities stretching along a
railway transect of Burkina Faso: risk transmission and insecticide
susceptibility status of potential vectors. Front. Vet. Sci. 6:
140.
Pavela, R. 2014. Acute, synergistic and antagonistic effects
of some aromatic compounds on the Spodoptera littoralis Boisd. (Lep.,
Noctuidae) larvae. Ind. Crops Prod. 60: 247-258.
Pavela, R. 2015. Acute toxicity and synergistic and
antagonistic effects of the aromatic compounds of some essential oils against
Culex quinquefasciatus say larvae. Parasitol. Res. 114:
3835-3853.
Regnault-Roger, C., C. Vincent, and J. T. Arnason. 2012.
Essential oils in insect control: low-risk products in a high-stakes world.
J. Chem. Soc. 57: 405-424.
Downloaded from
https://academic.oup.com/jme/advance-article/doi/10.1093/jme/tjac148/6759614
by guest on 14 October 2022
Sarma, R., K. Adhikari, S. Mahanta, and B. Khanikor. 2019.
Combinations of plant essential oil based terpene compounds as larvicidal and
adulticidal agent against Aedes aegypti (Diptera: Culicidae). Sci.
Rep. 9: 1-13.
Schelz, Z., J. Molnar, and J. Hohmann. 2006. Antimicrobial and
antiplasmid activities of essential oils. Fitoterapia 77: 279-285.
Sessions, O. M., K. Khan, Y. Hou, E. Meltzer,
M. Quam, E. Schwartz, D. J. Gubler, and A. Wilder-Smith. 2013. Exploring the
origin and potential for spread of the 2013 dengue outbreak in Luanda, Angola.
Glob. Health Action 6: 20100.
Sombié, A., E. Saiki, F.
Yaméogo, T. Sakurai, T. Shirozu, S. Fukumoto, A. Sanon,
D. Weetman, P. J. Mccall, and H. Kanuka. et al. 2019. High frequencies
of f1534c and v1016i kdr mutations and association with pyrethroid resistance
in Aedes aegypti from Somgandé (Ouagadougou), Burkina Faso.
Trop. Med. Health 47: 2.
Souza-neto, J. A., J. R. Powell, and M. Bonizzoni. 2019.
Infection, genetics and evolution Aedes aegypti vector competence
studies: a review. Infect. Genet. Evol. 67: 191-209.
Tripathi, A. K., S. Upadhyay, M. Bhuiyan, and P. R.
Bhattacharya. 2009. A review on prospects of essential oils as biopesticide in
insect-pest management. J. Pharmacogn. Phytother. 1: 52-63.
Wangrawa, D. W., E. Ochomo, F. Upshur, N.
Zanré, D. Borovsky, C. Lahondere, C. Vinauger, A.
Badolo, and A. Sanon. 2022. Biocatalysis and agricultural biotechnology
antagonistic insecticidal properties against Anopheles gambiae s.l.
(Diptera: Culicidae). Biocatal. Agric. Biotechnol. 42: 102347.
WHO. 2012. Global plan for insect management. p. 130.
Switzerland; World Health Organization, Geneve.
WHO. 2017. Procédures pour tester la
résistance aux insecticides chez les moustiques vecteurs du
paludisme, 2nd ed. Switzerland; World Health Organization, Geneve.
WHO. 2020. World health statistics 2020: monitoring health
for the SDGs, sustainable development goals. Switzerland; World Health
Organization, Geneve.
https://apps.who.int/iris/handle/10665/332070.
WHO. 2021. Dengue and severe dengue. Switzerland;
World Health Organization, Geneve.
https://www.who.int/news-room/fact-sheets/detail/
dengue-and-severe-dengue (accessed 26 March 2022).
Yaméogo, F., D. W. Wangrawa, A.
Sombié, A. Sanon, and A. Badolo. 2021. Insecticidal
activity of essential oils from six aromatic plants against Aedes
aegypti, dengue vector from two localities of Ouagadougou, Burkina Faso.
Arthropod Plant Interact. 15: 627-634.
Zoubiri, S., and A. Baaliouamer. 2014. Potentiality of plants
as source of insecticide principles. J. Saudi Chem. Soc. 18:
925-938.
Thèse de Doctorat unique - 160
-

www.nature.com/scientificreports
Thèse de Doctorat unique - 161
-
OPEN
|
Essential oils of plants and their
combinations as an alternative
adulticides against Anopheles
gambiae (Diptera: Culicidae)
populations
Mahamoudou Balboné1,
Ignace Sawadogo2, Dieudonné Diloma
Soma3, Samuel Fogné Drabo1,
Moussa Namountougou3,4, Koama
Bayili3, Rahim Romba1,
Georges Benson Meda3, Honorat Charles Roger
Nebié2, Roch K. Dabire3, Imaël H. N.
Bassolé1 & Olivier
Gnankine1
The persistence of malaria and the increasing of
resistance of Anopheles gambiae species to chemicals
remain major public health concerns in sub-Saharan Africa. Faced to these
concerns, the search for alternative vector control strategies as use of
essential oils (EOs) need to be implemented. Here, the five EOs from
Cymbopogon citratus, Cymbopogon nardus, Eucalyptus
camaldulensis, Lippia
multiflora, Ocimum americanum
obtained by hydro distillation were tested according to World
Health Organization procedures on An. gambiae
«Kisumu» and field strains collected in
«Vallée du Kou». Also, the binary combinations of
C. nardus (Cn) and O. americanum
(Oa) were examined. As results, among the EOs tested, L.
multiflora was the most efficient on both An. gambiae
strains regarding KDT50 (50% of mosquitoes knock down
time) and KDT95 and rate of morality values. Our current study
showed that C8 (Cn 80%: Oa 20%) and C9 (Cn 90%: Oa 10%), were the most toxic to
An. gambiae strain «Vallée de Kou»
(VK) with the mortality rates reaching 80.7 and 100% at 1% concentration,
respectively. These two binary combinations shown a synergistic effect on the
susceptible population. However, only C9 gave a synergistic effect on VK
population. The bioactivity of the two EOs, C. nardus
and O. americanum, was improved by the
combinations at certain proportions. The resistance ratios of all EOs and of
the combinations were low (< 5). The combinations of C. nardus
and O. americanum EOs at 90: 10 ratio
and to a lesser extent L. multiflora EO, could be used as alternative
bio-insecticides against malaria vectors resistant to pyrethroids in vector
control programmes.
|
Malaria remains one of the world's deadliest diseases. It is a
life-threatening disease caused by parasites that are transmitted to people
through the bites of infected female Anopheles mosquitoes. Each year, 154 to
289 million persons are infected with 490-836 thousand deaths recorded mostly
in children under 5. About 90% of this burden is recorded in
Africa1. In Burkina Faso, malaria is a major health issue and
accounts for 43% of medical consultations and 22% of deaths were recorded. This
country is among the 10 most affected (3% of cases and 4% of deaths
worldwide)2 by malaria disease.
Until now, long-lasting insecticidal nets (LLINs) and indoor
residual spraying (IRS) remain the two main tools commonly used in controlling
adults of Anopheles gambiae, the vector of malaria3.
Pyrethroids are only products used for LLINs4. However, pyrethroid
resistance is a threat to the efficiency of these protective tools, especially
when resistance is occurred at high levels5,6. In Burkina Faso,
pyrethroid resistance has been observed throughout the country for several
years and still a concern because the use of pyrethroid-based LLINs does not
provide the expected levels of individual and community
protection7.
1Laboratoire d'Entomologie Fondamentale et
Appliquée, Unité de Formation et de Recherche en Sciences de la
Vie et de la Terre, Université Joseph KI-ZERBO, 03 BP 7021, Ouagadougou,
Burkina Faso. 2Institut de Recherche en Sciences Appliquées
et Technologies, 03 BP 7047, Ouagadougou, Burkina Faso. 3Institut de
Recherche en Sciences de la Santé/Centre Muraz, BP 545, Bobo-Dioulasso,
Burkina Faso. 4Université Nazi Boni, 01 BP 1091,
Bobo-Dioulasso, Burkina Faso.
email:
olignankine@gmail.com;
olivier.gnankine@ujkz.bf
Scientific Reports | (2022) 12:19077 |
https://doi.org/10.1038/s41598-022-23554-6
1
Thèse de Doctorat unique - 162
-
Codes essential oils
|
C1
|
|
C3
|
C4
|
C5
|
C6
|
C7
|
C8
|
C9
|
|
Cn (%):
|
10
|
20
|
30
|
40
|
50
|
60
|
70
|
80
|
90
|
|
Oa (%):
|
90
|
80
|
70
|
60
|
50
|
40
|
30
|
20
|
10
|
Table 1. Combination codes with proportions of
the two essential oils. Cn, C. nardus; Oa, O. americanum; %,
percentage.
To improve the effectiveness of vector control tools, the
World Health Organization (WHO) has developed a global plan for the management
of insecticide resistance (GPIRM)8. Key elements of this plan
include: (1) insecticide rotation; (2) mixtures of at least two different
insecticides; (3) alternate use of at least two insecticides of different
classes; and, (4) mosaic use of insecticides. Today, a limiting factor in the
development of these strategies were the absence of alternative classes of
insecticides for LLINs. However, in recent years, several studies have shown
that the use of piperonyl butoxide (PBO) as a synergist restores susceptibility
to deltamethrin or permethrin in several regions of the
country9,10.
To manage the resistance of insects generally and mosquitoes
specifically to chemical insecticides, many research programmes have focused on
natural products derived from plants as an alternative to conventional
insecticides used in vector control for which resistance has been
detected11. Among the many natural products, essential oils (EOs)
and their constituents have received considerable attention in the search for
new pesticides and have been found to possess insecticidal
properties12.
EOs from plants are secondary metabolites comprising different
bioactive compounds and have gained importance in terms of alternative to
chemicals. They are biodegradable, environmentally safe and easy to use and
compose of a mixture of different bioactive compounds which offer less chance
for emerging resistance13.
Previous studies have identified more than 3000 compounds from
17,500 aromatic plants14. Most of them have been tested for their
insecticidal properties and have been reported to have insecticidal
effects15,16. Other studies have shown equal or higher toxicity of
the major compounds compared to its whole EO17. Some studies have
also attempted to formulate efficient insecticides by combining different
plants with chemical insecticides to increase the overall toxicity and minimize
the secondary effects18. Other studies have shown insecticidal
properties of EOs of Cymbopogon nardus, Eucalyptus
camaldulensis, Lippia multi!ora, and Ocimum
americanum19. These studies focused on Aedes aegypti
populations in the city of Ouagadougou, Central Burkina Faso. Although
recent studies have shown that combinations of EO of L. multi!ora and
Cymbopogon schoenanthus gave synergistic effects against mosquitoes
from the An. gambiae populations Kisumu strain20,
little is known about the effect of EOs mixture on resistant An.
gambiae populations.
The objective of the current study aimed at examining the
adulticidal activities of EOs of five aromatic plants of Cymbopogon
citratus, Cymbopogon nardus, Eucalyptus camaldulensis, Lippia
multi!ora and Ocimum americanum, on susceptible and resistant An.
gambiae populations collected in «Vallée du Kou» (Bama),
Western Burkina Faso. They were chosen firstly due to endogenous data provided
from informants questioned in areas investigated as well as the data from the
literature. This current study, also evaluate the toxicity level of binary
combinations of EOs of C. nardus and O. americanum, on the
two An. gambiae populations.
Materials and methods
Sampling of larvae and rearing. Larvae and
pupae of the resistant strain of Anopheles gambiae «VK» were
collected from June to October 2021, in the «Vallée du Kou»
(Bama). The frequency of the kdr L1014 F mutation in this strain was
closed to fixation (F = 0.99). The "Vallée du Kou" (VK) is a district of
the Bama department (11° 23' 59» N, 4° 25' 46» W) in the province of
Houet, the economic capital of Burkina Faso. The larvae were brought and reared
in the insectarium of the «Institut de Recherches en Sciences de la
Santé/Direction Régionale de l'Ouest» (IRSS/DRO) located in
Bobo-Dioulasso. The larvae were fed with tetraMin (Tetrawerke, Melle, Germany).
Adult mosquitoes emerging from the pupae of the collected strain were placed in
cages and fed with 10% sugar solution. Female mosquitoes of the resistant
strain were used for susceptibility tests. It is the same for the susceptible
strain of An. gambiae "Kisumu" maintained at the insectary, and used
as a reference strain in this current study.
Mosquitoes were reared at a temperature of 27 #177; 2 °C,
a relative humidity of 70 #177; 5%, 12 h of light and 12 h of darkness.
Essential oils extraction. The essential oils
were obtained from the leaves of five aromatic plant species, Cymbopogon
citratus (DC.) Stapf, Cymbopogon nardus (Linn.) Rendle,
Eucalyptus camaldulensis Dehnh., Lippia multi!ora Moldenke,
and Ocimum americanum (Willd.) A.J. Paton. The collection of
these plants was done at botanical garden located in «Institut de
Recherche en Sciences Appliquées et Technologies» (IRSAT). They
were extracted at the IRSAT by hydrodistillation (HD) using a
clevenger-type apparatus and stored in a dark glass bottle at 4
°C prior to use. The EO extraction process has been described following
the protocol described by Drabo et al.21. The combinations
of two EOs were made, after having done the bioassay tests with the whole EOs.
Table 1 shows all combinations and concentrations tested.
Analysis by gas chromatography/flame ionization
detector (GC/FID). Gas chromatography/flame ionization detector
(GC-FID) analysis of essential oils of C. citratus, C. nardus, E.
camaldulensis, L. multi!ora and O. americanum obtained from their
leaves was performed on an Agilent 6890 N GC instrument equipped
Scientific Reports | (2022) 12:19077 |
https://doi.org/10.1038/s41598-022-23554-6
2
Thèse de Doctorat unique - 163
-
with a FID, with a narrow bore DB-5 column (length 10 m, inner
diameter 0.1 mm, film thickness 0.17 mm; Agilent, Palo Alto, CA) according to
protocol previously used by Drabo et al.21. The oven
temperature was programmed from 60 °C to 165 °C
at 8 °C/min and from 165 °C to 280
°C at 20 °C/min, with 1 min of post-operation
at 280 °C. Diluted samples (1/100 in sample) were subjected to
an ionization test. Diluted samples (1/100 in acetone) of 1.0 ul were injected
manually and without fractionation. The percentage peak area was calculated on
the basis of the FID signal using the GC HP-Chemstation software (Agilent
Technologies).
Gas chromatography/mass spectrometry (GC/MS) analysis.
GC/MS analysis was performed on a GC HP 6890 coupled to MSD HP 5972
(Hewlett Packard, Palo Alto, CA), and was equipped with a ZB-5MS Zebron
capillary column (length 30 m, ID 0.25 mm, film thickness 0.25 mm; Agilent).
The carrier gas used was helium and the oven temperature were maintained at 45
°C for 2 min and then increased from 45 °C to 165 °C (4
°C/min) and then from 165 °C to 280 °C (15 °C/min).
Bioassays on adult mosquitoes. Susceptibility
tests were carried out using WHO insecticide susceptibility test-kits and
standard procedures3. Impregnation of Whatman n°1 papers were
done according to the protocol adopted by N'Guessan et al22 and
WHO23 standard procedure. Four rectangular papers (size 12 cm x 15
cm) were impregnated with 2 ml of a given concentration of an essential
oil/combination of EOs diluted in acetone at varying proportions. Three
concentrations (0.1%, 0.5% and 1%), prepared using serial dilutions (v/v) of
EOs in acetone, were used for each EO or combination of Cymbopogon nardus
(Cn) and Ocimum americanum (Oa).
For combination of EOs and for each concentration (0.1; 0.5
and 1%), 9 binary combinations were done (Table 1).
Control papers were impregnated with 2 ml of acetone only.
Tests were carried out at 25 °C (#177; 2 °C) and 70-80% relative
humidity (RH). The number of mosquitoes knocked down was recorded every 5 min.
Permethrin 0.75% was used as positive control insecticide. After the exposure
time, mosquitoes were transferred to holding tubes and were fed with 10% sugar
juice for 24 h. Subsequently, the mortality was recorded. The susceptible
strain Anopheles gambiae «Kisumu» was used as reference to
determine the diagnostic concentrations.
Data analysis. The data obtained from the
bioassays performed were analyzed using XLSTAT statistical software version
2015.1.01. The knock-down time (KDT50 and KDT95), lethal
concentrations (LC50 and LC99) and 95% confidence limits
(95% CL) were calculated by probity analysis using the same statistical
software in order to compare the toxicity of the plant EOs against the tested
mosquito adults. The KDT50, KDT95, CL50, CL99 values and
mortalities were considered significantly different between the EOs (p <
0.05) if the 95% CL (Confident Limits) did not overlap. In all tests, no
control mortality was detected after the 24-h exposure; therefore, no
correction was required based on Abbot's formula24.
According to WHO23 criteria, mosquitoes populations
were «resistant» if less than 90% mortality was observed,
«suspected resistant» if mortality rates were between 90 and 98% and
«susceptible» for more than 98% mortality rate.
Interactions between the combinations performed were
determined using the Fractional Inhibitory Concentration indices or FIC
indices. These indices were calculated in the following way: FIC indice =
FICA + FICB and FICA =
MICAB/MICA and FICB =
MICAB/MICB where FICA and FICB are
the minimum inhibitory concentrations that kill 50% of adult mosquitoes for EO
A and B respectively.
Thus, we have (1) FICA: Fractional Concentration of
A; (2) FICB: Fractional Concentration of B; (3) MICAB:
Minimum Inhibitory Concentration of A or B in the combination; (4) MICA:
Minimum Inhibitory Concentration of A; (5) MICB: Minimum Inhibitory
Concentration of B.
The results were interpreted as follows: (1) Synergy: FIC <
0.5; (2) additive: 0.5 < FIC < 1; (3) indifferent: 1 < FIC < 4; or
(4) antagonism: FIC > 425,26.
The diagnostic concentration was obtained from twice the
LC99 on susceptible strain3. The resistance ratio (RR)
between the VK and Kisumu strains was calculated by dividing the
LC50 of the VK strain by the LC50 of the Kisumu strain.
According to WHO27, RR < 5 indicates low resistance, RR 5-10
denotes moderate resistance, and RR > 10 indicates high resistance.
Statement on research involving plant species.
The collection of targeted plants was done at botanical garden located
in «the Institut de Recherche en Sciences Appliquees et Technologies
(IRSAT)», in Ouagadougou, Burkina Faso and comply with institutional,
national and international guidelines and legislation.
Before extracting essential oils, Cymbopogon citratus,
Cymbopogon nardus, Lippia multi!ora, Eucalyptus camaldulensis, Ocimum
americanum plants were identified by Cyrille SINARE and specimen were
deposited in herbarium of «laboratoire de Biologie et Ecologie
vegetale» of Joseph KI-ZERBO University, Ouagadougou, Burkina Faso as
under ID number: :17949; 17950; 17951; 17971; 17988 respectively.
Results
Chemical composition of the essential oils.
The main compounds of the 5 essential oils are summarized in Table 2.
The EO of C. citratus, consisting only of oxygenated monoterpenes
(99.9%) which were neral (44.7%) and geranial (55.2%). The EO of C. nardus
consisted of six compounds mostly oxygenated monoterpe-nes (77.9%),
characterized by citronellal (41.7%), geraniol (20.8%) and p-elemene (11%). As
for EO of E. cama-ldulensis, it consisted of sixteen compounds mainly
hydrocarbon monoterpenes, rich in 1,8-cineole (59.5%). The EO of L.
multi!ora consisted of sixteen compounds dominated by monoterpenes
(69.51%), characterized by p-Caryophyllene (20.1%), p-cymene (14.6%), thymol
acetate (12.0%) and 1.8 cineol (11.6%) whereas that of O.
Scientific Reports | (2022) 12:19077 |
https://doi.org/10.1038/s41598-022-23554-6
3
Thèse de Doctorat unique - 164
-
Essential oils
|
Major compounds
|
Retention indices
|
Mono Hydro (%)
|
Mono Oxy (%)
|
Sesqui Hydro (%)
|
Sesqui Oxy (%)
|
|
C. citratus
|
Geranial
|
1268
|
-
|
55.2
|
-
|
-
|
|
Neral
|
1242
|
-
|
44.7
|
-
|
-
|
|
Total other compounds
|
-
|
-
|
-
|
-
|
|
C. nardus
|
Citronellal
|
1158
|
-
|
41.7
|
-
|
-
|
|
Geraniol
|
1253
|
-
|
20.8
|
-
|
-
|
|
â-Elemene
|
1372
|
-
|
-
|
11
|
-
|
|
Total other compounds
|
-
|
15.4
|
3.7
|
-
|
|
E. camaldulensis
|
1,8 cineol 1034
|
-
|
59.55
|
-
|
-
|
|
Total other compounds
|
24.89
|
7.41
|
1.4
|
0.34
|
|
L. multi!ora
|
â-caryophyllene
|
1415
|
-
|
-
|
20.1
|
-
|
|
p-cymene
|
1027
|
14.6
|
-
|
-
|
-
|
|
Thymul acetate
|
1355
|
-
|
12
|
-
|
-
|
|
1.8 cineol
|
1034
|
-
|
11.6
|
-
|
-
|
|
Total other compounds
|
18.41
|
12.9
|
5.7
|
4.5
|
|
O. americanum
|
1,8 cineol
|
1034
|
-
|
31.22
|
-
|
-
|
|
Camphor
|
1151
|
-
|
12.73
|
-
|
-
|
|
Total other compounds
|
29.59
|
43.95
|
13.03
|
0.99
|
Table 2. Major compounds of the 5 essential oils
tested on adults of Anopheles gambiae. Mono: monoterpenes ; Sesqui :
sesquiterpenes, Hydro : Hydrocarbon and oxy : Oxygenated.
americanum consisted of twenty-six (26) compounds
characterized by a high percentage of 1.8-cineole (31.22%) followed by camphor
(12.73%).
Knock-down times (KDT) and adulticidal effects of EOs
and combinations. Lippia multi!ora EO alone exhibited high
toxicity with LC50 values of 0.21 and 0.67%, LC99 values
of 0.74 and 1.17%, respectively (Table 3) and also with a rate of mortality of
100 and 96.88% at concentration (1%) on the susceptible Kisumu strain and the
field strain VK, respectively (Table 4). This EO exhibited the lowest
KDT50 and KDT95 values on both An. gambiae
strains tested (19.8 and 87.2 min on Kisumu, 58.8 and 142.7 min on VK,
respectively) (Table 4).
E. camaldulensis EO was the least toxic with rate of
mortality above 10% at concentration (1%) on the susceptible Kisumu strain
(Table 4), KDT50 values of 144.8 min on the Kisumu strain, 166.1 min
on the VK strain and LC50 of 2.86 and 2.94%, LC99 of 5.05
and 5.26% on Kisumu and VK strains, respectively. Moreover, EOs of C.
nardus (LC50 of 0.63 and 1.12% on Kisumu and VK, respectively)
and O. americanum (LC50 of 2.18 and 2.21% on Kisumu and VK,
respectively) were more toxic than C. citratus (LC50 of 2.3
and 2.7% on Kisumu and VK, respectively) (Table 3). For the susceptible strain
Kisumu, no difference was observed between EOs of C. citratus, E.
camaldulensis and O. americanum regarding the LC50
and LC99. However, for the field strain VK, the
confidence limits at 95% for the LC50 and LC99
do not overlap for all OEs tested (Table 3).
Regarding the combinations on both An. gambiae
strains (Kisumu and VK), the C9 combination exhibited high toxicity on all
strains. Indeed, this combination shown a rate of mortality reaching 100% at
concentration (1%) on both strains (Table 5). Conversely, with Permethrin, the
rate of mortality reached 62.5% confirming the presence of phenotypic
resistance on VK populations. In addition, C9 was the only combination that
produced a synergistic effect on both strains (Tables 6 and 7). Also, this
combination exhibited the lowest KDT values (Table 5) and the lowest LC50
and LC99 values on both strains (0.22 and 0.52%
with Kisumu, 0.32 and 0.59% with VK) (Tables 5).
Moreover, the combinations C6 and C8 exhibited high toxicity
with rates of mortality above 98% at concentration (1%) on the Kisumu strain
while on VK strain, the toxicity of these two combinations was 45.21 and 80.7%
at concentration (1%). With these two combinations, the KDT values were
slightly low on both strains (on strain VK: KDT95 = 20.7 min 12.2 min at the 1%
concentration for C6 and C8, respectively) and, the LC50 and
LC99 were low on both strains (LC50 = 1.08 and 0.89%, LC99 =
1.3 and 2.15%, respectively).
On the Kisumu strain, C8 produced a synergistic effect while
C6 shown an additive effect (Table 6). The lowest diagnostic concentrations of
1.04%, 1.16% and 1.48% were obtained with C9 and C8 and L. multi!ora
EO, respectively (Table 3).
The LC50 obtained with the C8 combinations on VK
strain showed no difference with those obtained with C. nardus EO with
no overlapping confidence intervals. As well, the LC50 obtained with
C3, C4, C5 and C7 showed no difference with those obtained with O.
americanum EO on VK strain (Table 3). The resistance ratios obtained with
all EOs as well as those of all combinations were below 5 (Table 3).
Scientific Reports | (2022) 12:19077 |
https://doi.org/10.1038/s41598-022-23554-6
4
Thèse de Doctorat unique - 165
-
EOs/ Combinations
|
Anopheles gambiae "Kisumu"
|
Anopheles gambiae "VK"
|
Diagnostic concentration (%)
|
Resistance ratios (RR)
|
|
LC50 (%) (CL95)
|
LC99 (%) (CL95)
|
LC50 (%) (CL95)
|
LC99 (%) (CL95)
|
RR50
|
RR99
|
|
C. citratus
|
2.3
|
4.7
|
2.7
|
4.84
|
|
|
|
|
(1.9-2.7)
|
(4.4-6)
|
-
|
-
|
9.4
|
1.17
|
0.97
|
|
C. nardus
|
0.63
|
1.66
|
1.12
|
2.16
|
|
|
|
|
(0.6-0.7)
|
(1.4-2)
|
(1-1.3)
|
(1.8-2.7)
|
3.32
|
1.78
|
0.77
|
|
E. camaldulensis
|
2.86
|
5.26
|
2.94
|
5.05
|
|
|
|
|
(1.6-9.3)
|
(4.1-5.5)
|
-
|
-
|
10.1
|
1.028
|
1.04
|
|
L. multi!ora
|
0.21
|
0.74
|
0.67
|
1.17
|
|
|
|
|
0.16-0.3
|
(0.6-0.9)
|
(0.6-0.7)
|
(1.1-1.3)
|
1.48
|
3.19
|
0.63
|
|
O. americanum
|
2.18
|
4.13
|
2.21
|
4.59
|
|
|
|
|
(1.5-3)
|
(2.6-5.5)
|
(1.5-3.5)
|
(2.9-5.8)
|
9.18
|
1.01
|
0.9
|
|
C1 (Cn 10%: Oa 90%)
|
1.37
|
2.95
|
2.9
|
6.4
|
|
|
|
|
(1.1-1.8)
|
(2.3-3.4)
|
-
|
-
|
5.9
|
2.12
|
0.46
|
|
(Cn 20%: Oa 80%)
|
0.76
|
1.69
|
1.18
|
2.45
|
|
|
|
|
(0.7-0.8)
|
(1.5-2)
|
(1.0-1.4)
|
(2-3.3)
|
3.38
|
1.55
|
0.69
|
|
C3 (Cn 30%: Oa 70%)
|
0.61
|
1.31
|
2.07
|
5
|
|
|
|
|
(0.5-0.7)
|
(1.2-1.5)
|
(1.5-5)
|
(4.2-5.9)
|
2.62
|
3.39
|
0.26
|
|
C4 (Cn 40%: Oa 60%)
|
0.46
|
1.19
|
1.25
|
2.48
|
|
|
|
|
(0.4-0.5)
|
(1-1.4)
|
(1.2-1.5)
|
(2-3.4)
|
2.38
|
2.72
|
0.48
|
|
C5 (Cn 50%: Oa 50%)
|
0.57
|
1.16
|
1.36
|
3.26
|
|
|
|
|
(0.5-0.6)
|
(1-1.3)
|
(1.1-2)
|
(2.4-5.5)
|
2.32
|
2.38
|
0.35
|
|
C6 (Cn 60%: Oa 40%)
|
0.28
|
1
|
1.08
|
2.15
|
|
|
|
|
(0.2-0.3)
|
(0.9-1.2)
|
-
|
-
|
2
|
3.86
|
0.46
|
|
C7 (Cn 70%: Oa 30%)
|
1.93
|
4.3
|
2.44
|
5.07
|
|
|
|
|
(1.4-4)
|
(3-4.7)
|
(1.6-3.2)
|
(3.1-5.6)
|
8.6
|
1.26
|
0.85
|
|
C8 (Cn 80%: Oa 20%)
|
0.23
|
0.58
|
0.89
|
1.3
|
|
|
|
|
(0.2-0.3)
|
(0.5-0.7)
|
(0.8-1)
|
(1.28-3)
|
1.16
|
3.87
|
0.45
|
|
C9 (Cn 90%: Oa 10%)
|
0.22
|
0.52
|
0.32
|
0.59
|
|
|
|
|
(0.2-0.3)
|
(0.4-0.6)
|
(0.3-0.4)
|
(0.5-0.7)
|
1.04
|
1.17
|
0.97
|
Table 3. LC50, LC99, diagnostic concentration
and resistance ratios for all essential oils and combinations of C. nardus
and O. americanum tested on Anopheles gambiae
populations. LC50: lethal concentration for 50% mortality;
CL95= Confidence limit at 95%; Cn : Cymbopogon nardus; Oa :
Ocimum americanum; % : percentage; RR50 : Resistance ratios with
LC50; VK : Vallée du Kou.
Discussion
Up to now, the management of insecticide resistance remains a
major challenge to achieving effective malaria elimination1. Indeed,
pyrethroid resistance has been reported in 27 sub-Saharan African countries,
raising the urgency of finding alternatives to these
insecticides28,29. Searching for alternatives to chemical
insecticides based on plant extracts may constitute new avenues for controlling
malaria mosquito vectors populations.
Here, we evaluate the toxicity level of C. citratus, C.
nardus, E. camaldulensis, L. multi!ora and O. americanum EOs.
Also, the binary combinations of C. nardus and O. americanum
EOs were examined in terms of toxicity.
Overall, almost all the EOs tested have shown an adulticidal
effect on the susceptible (Kisumu) and on the resistant (VK) strain of An.
gambiae. This insecticidal effect, which is highlighted through knock-down
effects, lethal concentrations (LC) and rates of mortality (%) of the adult
mosquitoes tested, varied significantly according to the concentrations and
kind of EOs used. Our study confirmed the presence of resistance to permethrin
in Anopheles populations that raise the question of its use in vector
control strategies.
Among the EO tested, that of L. multi!ora remains the
most toxic on the two strains of An. gambiae tested followed by C.
nardus. The least toxic EO was E. camaldulensis. Interestingly,
L. multi!ora may constitute an alternative regarding the rate of
mortality reaching 96.88% in comparison with that found with permethrin. The
toxicity of EO of L. multi!ora in the current study was significantly
better than that of Lantana camara, Hyptis spicigera, Hyptis suaveolens
EOs evaluated on An. gambiae strains from Kisumu and fields by
Wangrawa et al.30.
The difference observed in toxicity between the EOs tested in
our investigations could be explained by their chemical composition. Indeed,
several previous studies had shown that the bioactivity of an EO is attributed
to the major compounds as they may constitute the most important part of the
total compounds of the EO15,31,32. Hence, the toxicity of L. multi!ora
could be explained by its major compounds which are ß caryophyllene,
p-cymen, thymol acetate and 1.8 cineol. According to previous studies done by
Bassolé et al.33, the toxicity of L. multi!ora EO on
Anopheles gambiae and Aedes aegypti larvae was due to the
presence of three major components: thymol, p-cymene and thymol acetate.
Hyptis suaveolens EO containing also p-caryophyllene and 1.8
cineol34 has a high insecticidal activity35. Thus, the
high insecticidal activity of L. multi!ora EO was attributed to
Scientific Reports | (2022) 12:19077 |
https://doi.org/10.1038/s41598-022-23554-6
5
Thèse de Doctorat unique - 166
-
Essential oils
|
Concentrations (%)
|
Anopheles gambiae « VK »
|
Anopheles gambiae « VK »
|
|
KDT50 (min)
|
KDT95 (min)
|
Mortality (%)
|
KDT50
(min)
|
KDT95 (min)
|
Mortality (%)
|
|
C. citratus
|
0.1
|
103.24
|
204.66
|
11.05
|
140.2
|
318.7
|
2.15
|
|
0.5
|
77.10
|
155.86
|
17.35
|
124.9
|
275.8
|
3.33
|
|
1
|
60.19
|
132.39
|
35.29
|
116.5
|
233.6
|
4.76
|
|
C. nardus
|
0.1
|
88.37
|
196.99
|
18.48
|
148.6
|
241.8
|
2.15
|
|
0.5
|
33.3
|
108.9
|
26.09
|
90.2
|
149.5
|
15.21
|
|
1
|
5.8
|
11.5
|
86.36
|
12.4
|
70.7
|
40.63
|
|
E. camaldulensis
|
0.1
|
192.2
|
289.7
|
1.05
|
227.3
|
309.7
|
0
|
|
0.5
|
157.1
|
275.1
|
6.45
|
189.9
|
286.7
|
1.12
|
|
1
|
144.8
|
266.5
|
9.78
|
166.1
|
280
|
3.16
|
|
L. multi!ora
|
0.1
|
19.8
|
58.8
|
30.30
|
87.2
|
142.7
|
13.16
|
|
0.5
|
10.5
|
19
|
90
|
32
|
57.7
|
63.56
|
|
1
|
-28.3
|
-8.2
|
100
|
-5.9
|
1.5
|
96.88
|
|
O. americanum
|
0.1
|
137.5
|
225.6
|
1.10
|
156.4
|
267.5
|
0
|
|
0.5
|
87.06
|
146.64
|
6.73
|
144.7
|
248.9
|
2.2
|
|
1
|
30.04
|
60.76
|
41.49
|
116.3
|
204.6
|
6.38
|
|
Permethrin
|
0.75
|
16.3
|
30
|
100
|
41.2
|
90.4
|
62.5
|
Table 4. KDT50, KDT95
and rates of mortality of essential oils tested on the susceptibility (Kisumu)
and field (VK) strains of Anopheles gambiae. KDT50: 50% of
mosquitoes knock down time; KDT95: 95% of mosquitoes knock down
time; VK : Vallée du Kou; %: percentage; min : minutes.
p-caryophyllene and 1.8 cineol which are major compounds, in
the current study. The low insecticidal activity of E. camaldulensis
EO could be explained probably by the absence of p-caryophyllene. Here,
C. nardus EO do show intermediate adulticidal effect on An.
gambiae populations tested unlike that found by Zulfikar36.
According to these authors, the highest bioactivity from C. nardus was
due to the presence of geraniol, the same compound found also in C. nardus
tested in our current study. In fact, no effect was detected with C.
nardus. The EOs which were less efficient as adulticides in the current
study could be efficient as repellents. Indeed, previous studies shown the
repellent effect of these EO on mosquitoes37-39. The KDT values of
these EO mainly at the concentration of 1% could explain this repellent
property highlighted by irritant activity.
In addition to their adulticide activity, L. multi!ora
exhibits also toxic effect on larval populations of An. gambiae
from the same locality40.
Overall, C. nardus and O. americanum EOs
provide intermediate rate of mortality. Do their combinations may
improve the bioefficiency against An. gambiae populations? For this
purpose, combinations from C1 to C9 were made, each concentration combining a
certain proportion of each EO.
Globally, all combinations of the 2 EOs have improved the
overall efficiency of the EOs compared to individual EOs. In the current study,
the improvement of the adulticidal potential by the combination of the two EOs
depends on their ratio in the combination. Indeed, combinations containing 60%,
80% and 90% of C. nardus EO were more effective than C. nardus
EO tested alone. This is in agreement with the work of Bekele and
Hassanali41; Pavela42 who had reported that the
biological activity of EOs depends not only on their qualitative composition,
but also on the quantitative ratio of their constituents.
Improved efficiency was observed when knock down times were
reduced and also synergistic and additive effects were observed for the
combinations where the proportions of C. nardus EO reach 90%, 80% and
60% and 40%, respectively. This improved toxicity by the combinations of the 2
EOs, could be explained by the combined toxic effect of the major compounds.
Previous works have showed that the toxic action of EOs is due to the combined
effects of different components, with or without significant individual toxic
action against insects43,44. According to Burt45,
individual EOs contain complex components that, when combined with each other,
can lead to indifferent, additive, synergistic or antagonistic effects. In an
earlier study, Abbassy et al46 reported that, in some cases, the
whole EO may have a higher insecticidal activity than its isolated major
components. For these authors, the minor compounds were essential for the
bioefficiency and could allow a synergistic effect or potential influence.
The combinations showing a synergistic or additive effect
would have, both some major compounds of the EOs of C. nardus and
O. americanum coupled with a variety of minor compounds. Previous
studies have shown that the bioactivity of the EO is a consequence of
interaction between the major components, but also other compounds, eventually
oligoelements explaining combined effects, additive action between chemical
classes and synergism or antagonism33,47,48. Generally, it seems
that the effect of an active compound can be boosted by other major compounds
and/or stimulated by minor compounds to give additive or synergistic
effects49. Therefore, according to Berenbaum and Neal50,
minor components present in low percentages can act as synergists, enhancing
the bio-efficiency of major constituents by various mechanisms.
Interestingly, among different combinations tested, only the
C9 combination provided a synergistic effect on the resistant An. gambiae
population. Earlier studies had shown that some compounds in EOs could
interact to create a synergistic or antagonistic effect according to the ratios
of the different EOs in the combination51,52.
Scientific Reports | (2022) 12:19077 |
https://doi.org/10.1038/s41598-022-23554-6
6
Thèse de Doctorat unique - 167
-
Thèse de Doctorat unique - 168
-
Codes
|
Combination of essential oil
|
Concentrations (%)
|
Anopheles gambiae "Kisumu"
|
Anopheles gambiae "VK"
|
|
KDT50 (min)
|
KDT95 (min)
|
Mortality (%)
|
KDT50
(min)
|
KDT95 (min)
|
Mortality (%)
|
|
C1
|
Cn%10% : Oa 90
|
0.1
|
102
|
132.9
|
3.61
|
171.6
|
321.3
|
2.53
|
|
0.5
|
9.6
|
22.1
|
18.49
|
33
|
57.3
|
16.17
|
|
1
|
4.4
|
13.2
|
29.79
|
27.4
|
50.3
|
19.78
|
|
Cn 80%0% : Oa
|
0.1
|
131.7
|
232.7
|
1.94
|
222
|
310
|
1.15
|
|
0.5
|
3.3
|
13.2
|
32.29
|
35
|
73.3
|
13.25
|
|
1
|
2.4
|
10.2
|
68.97
|
16
|
25.9
|
26.08
|
|
C3
|
Cn%30% : Oa 70
|
0.1
|
142.8
|
232.7
|
6.66
|
178.1
|
304
|
6.25
|
|
0.5
|
10.8
|
21
|
32.04
|
25
|
38.5
|
13.68
|
|
1
|
5.5
|
13.4
|
91.67
|
16
|
16.1
|
20.21
|
|
C4
|
Cn %% : Oa
601
|
0.1
|
108.7
|
147.1
|
22.06
|
142.4
|
172.1
|
4.1
|
|
0.5
|
7.3
|
16.9
|
78.49
|
20.3
|
47.6
|
17.11
|
|
6.7
|
12.4
|
98.78
|
7.7
|
14.3
|
42.39
|
|
C5
|
Cn%50% : Oa 50
|
0.1
|
91
|
153.6
|
4.55
|
106.7
|
182.8
|
3.66
|
|
0.5
|
11.2
|
18.6
|
28.89
|
23.5
|
78.7
|
19.48
|
|
1
|
0.5
|
13.1
|
97.78
|
7.1
|
16.5
|
30.38
|
|
C6
|
Cn %% : Oa
401
|
0.1
|
77.4
|
145
|
19.39
|
116.1
|
168.1
|
7.08
|
|
0.5
|
15.7
|
37.6
|
91.67
|
48.1
|
64.9
|
22.38
|
|
8.6
|
13.4
|
98.9
|
8.9
|
20.7
|
45.21
|
|
C7
|
Cn%70% : Oa 30
|
0.1
|
131.9
|
245.3
|
3.49
|
166.1
|
303.3
|
1.19
|
|
0.5
|
48.7
|
99.6
|
17.84
|
137.2
|
225
|
15.21
|
|
1
|
11.6
|
17.4
|
37.98
|
13.2
|
28.8
|
19.62
|
|
C8
|
Cn%80% : Oa 20
|
0.1
|
76.4
|
150.6
|
15.12
|
119
|
218.2
|
8.75
|
|
0.5
|
-25.2
|
28.8
|
95.65
|
24.2
|
52.7
|
27.38
|
|
1
|
-26.9
|
1.4
|
100
|
-2.1
|
12.2
|
80.7
|
|
C9
|
Cn
10% 90% : Oa
|
0.1
|
23.5
|
77
|
13.98
|
53.5
|
126.7
|
12.15
|
|
0.5
|
-32.3
|
3.7
|
96.7
|
-5
|
7.4
|
94
|
|
1
|
-227.9
|
-70.1
|
100
|
-227.3
|
-69.6
|
100
|
|
Permethrin
|
0.75
|
16.3
|
30
|
100
|
41.2
|
90.4
|
62.5
|
Table 5. KDT50, KDT95 and rates of mortality of
essential oils combinations of C. nardus (C.n) and O. americanum
(O.a) tested on the susceptibility (Kisumu) and field (VK) strains of
Anopheles gambiae populations. KDT50: 50% of mosquitoes
knock down time; KDT95: 95% of mosquitoes knock down time; VK:
Vallée du Kou; % : percentage; min : minutes; Cn : Cymbopogon
nardus; Oa : Ocimum americanum.
|
Combinations of essential oils (%)
|
Codes
|
LC50 (%)
|
FICCn
|
FICOa
|
FIC
|
Effect
|
|
Cn 0% : Oa 100%
|
Oa
|
2.18
|
-
|
-
|
-
|
-
|
|
Cn 10% : Oa 90%
|
C1
|
1.37
|
2.17
|
0.63
|
2.80
|
No effect
|
|
Cn 20% : Oa 80%
|
|
0.76
|
1.21
|
0.35
|
1.55
|
No effect
|
|
Cn 30% : Oa 70%
|
C3
|
0.61
|
0.97
|
0.28
|
1.25
|
No effect
|
|
Cn 40% : Oa 60%
|
C4
|
0.46
|
0.73
|
0.21
|
0.94
|
Additive
|
|
Cn 50% : Oa 50%
|
C5
|
0.57
|
0.90
|
0.26
|
1.17
|
No effect
|
|
Cn 60% : Oa 40%
|
C6
|
0.28
|
0.44
|
0.13
|
0.57
|
Additive
|
|
Cn 70% : Oa 30%
|
C7
|
1.93
|
3.06
|
0.89
|
3.95
|
No effect
|
|
Cn 80% : Oa 20%
|
C8
|
0.23
|
0.37
|
0.11
|
0.47
|
Synergistic
|
|
Cn 90% : Oa 10%
|
C9
|
0.22
|
0.35
|
0.10
|
0.45
|
Synergistic
|
|
Cn 100% : Oa 0%
|
Cn
|
0.63
|
-
|
-
|
-
|
-
|

Scientific Reports | (2022) 12:19077 |
https://doi.org/10.1038/s41598-022-23554-6
7
Table 6. Effects of combinations of essential
oils of Cymbopogon nardus (Cn) and Ocimum americanum (Oa) on
adults of Anopheles gambiae susceptible strain (Kisumu) and type of
interaction (n = 125 adult). LC50: lethal concentration for 50%
mortality FIC: FICCn + FICOa; Synergistic: FIC < 0.5;
Additive; 05 < FIC < 1; No effect: 1 < FIC < 4; Antagonistic: FIC
> 4; Cn: Cymbopogon nardus; Oa : Ocimum americanum; % :
percentage.
|
www.nature.com/scientificreports/
|
|
Combinations of essential oils (%)
|
Codes
|
LC50 (%)
|
FICCn
|
FICOa
|
FIC
|
Effect
|
|
Cn 0% : Oa 100%
|
Oa
|
2.21
|
-
|
-
|
-
|
-
|
|
Cn 10% : Oa 90%
|
C1
|
2.9
|
1.31
|
2.59
|
3.9
|
No effect
|
|
Cn 20% : Oa 80%
|
|
1.18
|
0.53
|
1.05
|
1.58
|
No effect
|
|
Cn 30% : Oa 70%
|
C3
|
2.07
|
0.94
|
1.85
|
2.79
|
No effect
|
|
Cn 40% : Oa 60%
|
C4
|
1.25
|
0.56
|
1.12
|
1.68
|
No effect
|
|
Cn 50% : Oa 50%
|
C5
|
1.36
|
0.61
|
1.2
|
1.81
|
No effect
|
|
Cn 60% : Oa 40%
|
C6
|
1.08
|
0.49
|
0.96
|
1.45
|
No effect
|
|
Cn 70% : Oa 30%
|
C7
|
2.44
|
1.1
|
2.17
|
3.27
|
No effect
|
|
Cn 80% : Oa 20%
|
C8
|
0.89
|
0.40
|
0.79
|
1.19
|
No effect
|
|
Cn 90% : Oa 10%
|
C9
|
0.32
|
0.14
|
0.28
|
0.42
|
Synergistic
|
|
Cn 100% : Oa 0%
|
Cn
|
1.12
|
-
|
-
|
-
|
-
|
Table 7. Effects of combinations of essential
oils of Cymbopogon nardus (Cn) and Ocimum americanum (Oa) on
adults of Anopheles gambiae field strain of VK and type of interaction
(n = 125 adult). LC50: lethal concentration for 50% mortality FI :
FICCn + FICOa; Synergistic: FIC < 0.5; Additive; 05 < FIC <
1; No effect: 1 < FIC < 4; Antagonistic: FIC > 4; Cn : Cymbopogon
nardus; Oa : Ocimum americanum; % : percentage.
In addition, the appearance of new compounds in the
combination of some EOs that do not exist in individual EOs20,53
could explain the synergistic effect of C9 combinations. Further studies will
evaluate this combination on a large wild Anopheles population to
assess the phenotypic data as well as determination of their components. Also,
other combinations including L. multi!ora need to be evaluated on
mosquitoes' populations.
Conclusion
The current study confirmed that the essential oils of
Cymbopogon citratus, Cymbopogon nardus, Eucalyptus camaldulensis, Lippia
multi!ora and Ocimum americanum have insecticidal properties.
L. multi!ora EO was efficient in comparison with the others tested.
Our current study showed that the activity of the two combined EOs, C.
nardus and O. americanum, was improved by the combinations at
certain proportions regarding the values of rate of mortality reaching at least
98%.
The EO of L. multi!ora and combinations of EO of
C. nardus and O. americanum could be valuable alternatives in
the malaria vector control.
Data availability
The datasets generated and analyzed during the current study
are available from the corresponding author on reasonable request. Requests to
access these datasets should be directed to the corresponding author.
Received: 30 April 2022; Accepted: 2 November 2022
References
1. WHO. Global plan for insecticide management. (World
Health Organisation, Geneva, Switzerland 130, 2012).
2. WHO. Paludisme: situation mondiale. vol. 2507. World Health
Organisation, Geneva, Switzerland, (2020).
3. WHO. Procédures pour tester la
résistance aux insecticides chez les moustiques vecteurs du paludisme
Seconde édition. (World Health Organisation, Geneva,
Switzerland, 2017).
4. WHO. Guidelines for Malaria Vector Control.
(World Health Organisation, Geneva, Switzerland, 2019).
5. Churcher, T. S., Lissenden, N., Griffin, J. T., Worrall,
E. & Ranson, H. The impact of pyrethroid resistance on the efficacy and
effectiveness of bednets for malaria control in Africa. Elife
5, 16090 (2016).
6. Hemingway, J. et al. Averting a malaria disaster:
Will insecticide resistance derail malaria control?. Lancet
387, 1785-1788 (2016).
7. Dabiré, K. R. et al. Trends in insecticide
resistance in natural populations of malaria vectors in Burkina Faso, West
Africa: 10 Years surveys K. INTECH 32, 479-502
(2012).
8. WHO. WHO Global Malaria Programme: Global Plan for
insecticide resistance management. (World Health Organisation,
Geneva, Switzerland, 2012).
9. Toe, K. H. et al. Do bednets including piperonyl
butoxide offer additional protection against populations of Anopheles gambiae
s.l. that are highly resistant to pyrethroids? An experimental hut evaluation
in Burkina Faso. Med. Vet. Entomol. 32, 407-416
(2018).
10. Hien, A. S. et al. Evidence supporting
deployment of next generation insecticide treated nets in Burkina Faso:
Bioassays with either chlorfenapyr or piperonyl butoxide increase mortality of
pyrethroid-resistant Anopheles gambiae. Malar. J.
20, 1-12 (2021).
11. Zoubiri, S. & Baaliouamer, A. Potentiality of plants
as source of insecticide principles. J. Saudi Chem. Soc.
18, 925-938 (2014).
12. Tripathi, A. K., Upadhyay, S., Bhuiyan, M. &
Bhattacharya, P. R. A review on prospects of essential oils as biopesticide in
insect-pest management. J. Pharmacogn. Phytother. 1,
52-63 (2009).
13. Isman, M. B. Plant essential oils for pest and disease
management. Crop Prot. 19, 603-608 (2000).
14. Mossa, A. T. H. Green pesticides: Essential oils as
biopesticides in insect-pest management. J. Environ. Sci. Technol.
9, 354-378 (2016).
15. Lucia, A. et al. Larvicidal effect of
Eucalyptus grandis essential oil and turpentine and their major
components on Aedes aegypti larvae. J. Am. Mosq. Control Assoc.
23, 299-303 (2007).
16. Singh, R., Koul, O. & Rup, P. J. Toxicity of some
essential oil constituents and their binary mixtures against Chilo partellus
(Lepi-doptera: Pyralidae). Int. J. Tropical Insect Sci.
29, 93-101 (2009).
17. Sarma, R., Adhikari, K., Mahanta, S. & Khanikor, B.
Combinations of plant essential oil based terpene compounds as larvicidal and
adulticidal agent against Aedes aegypti (Diptera: Culicidae). Sci.
Rep. 9, 1-13 (2019).
Scientific Reports | (2022) 12:19077 |
https://doi.org/10.1038/s41598-022-23554-6
8
18.
Thèse de Doctorat unique - 169
-
Mansour, S. A., Foda, M. S. & Aly, A. R. Mosquitocidal
activity of two Bacillus bacterial endotoxins combined with plant oils and
conventional insecticides. Ind. Crops Prod. 35, 44-52 (2012).
19. Yaméogo, F., Wendgida, D. W., Sombié, A.,
Sanon, A. & Badolo, A. Insecticidal activity of essential oils from six
aromatic plants against Aedes aegypti, dengue vector from two
localities of Ouagadougou Burkina Faso. Arthropod. Plant. Interact. 15,
627-634 (2021).
20. Wangrawa, D. W. et al. Essential oils and their
binary combinations have synergistic and antagonistic insecticidal properties
against Anopheles gambiae s l. (Diptera: Culicidae). Biocatal. Agric.
Biotechnol. 42, 102347 (2022).
21. Drabo, S. F., Olivier, G., Bassolé, I. H. N.,
Nébié, R. C. & Laurence, M. Susceptibility of MED-Q1 and
MED-Q3 biotypes of Bemisia tabaci (Hemiptera: Aleyrodidae) populations
to essential and seed oils. J. Econ. Entomol. 110, 1031-1038
(2017).
22. N'Guessan, R., Corbel, V., Akogbéto, M. &
Rowland, M. Treated nets and indoor residual reduced efficacy of
insecticide-pyrethroid resistance area benin. Emerg. Infect. Dis. 13,
199-206 (2007).
23. WHO. Standard operating procedure for testing
insecticide susceptibility of adult mosquitoes in WHO tube tests. (World
Health Organisation, Geneva, Switzerland 2022).
24. Abbott, W. S. A method of computing the effectiveness of
an insecticide. J. Econ. Entomol. 18, 265-267 (1925).
25. Schelz, Z., Molnar, J. & Hohmann, J. Antimicrobial
and antiplasmid activities of essential oils. Fitoterapia 77, 279-285
(2006).
26. Bassolé, I. H. N. & Juliani, H. R. Essential
oils in combination and their antimicrobial properties. Molecules 17,
3989-4006 (2012).
27. WHO. Test Procedures for Insecticide Resistance
Monitoring in Malaria Vector Mosquitoes Second edition. (World Health
Organisation, Geneva, Switzerland 2016).
28. Tchoumbougnang, F. et al. Activité
larvicide sur Anopheles gambiae giles et composition chimique des
huiles essentielles extraites de quatre plantes cultivées au Cameroun.
Biotechnol. Agron. Soc. Environ. 13, 77-84 (2009).
29. Ranson, H. & Lissenden, N. Insecticide resistance in
African Anopheles mosquitoes: A worsening situation that needs urgent action to
maintain malaria control. Trends Parasitol. 32, 187-196 (2016).
30. Wangrawa, D. et al. Insecticidal activity of
local plants essential oils against laboratory and field strains of Anopheles
gambiae s. L. (Diptera: Culicidae) from Burkina Faso. J. Econ. Entomol.
111, 2844-2853 (2018).
31. Gbolade, A. A. & Lockwood, G. B. Toxicity of
Ocimum sanctum L. essential oil to Aedes aegypti larvae and its
chemical composition. J. Essent. Oil Bearing Plants 11, 148-153
(2008).
32. Vani, R. S., Cheng, S. F. & Chuah, C. H. Comparative
study of volatile compounds from genus Ocimum. Am. J. Appl. Sci. 6,
523-528 (2009).
33. Bassolé, et al. Ovicidal and larvicidal
activity against Aedes aegypti and Anopheles gambiae complex
mosquitoes of essential oils extracted from three spontaneous plants of Burkina
Faso. Parasitologia 45, 23-26 (2003).
34. Peerzada, N. Chemical composition of the essential oil of
Hyptis Suaveolens. Molecules 2, 165-168 (1997).
35. Ilboudo, Z. et al. Biological activity and
persistence of four essential oils towards the main pest of stored cowpeas,
Callosobruchus maculatus (F.) (Coleoptera: Bruchidae). J. Stored Prod. Res.
46, 124-128 (2010).
36. Zulfikar, A. & Sitepu, F. Y. The effect of lemongrass
(Cymbopogon nardus) extract as insecticide against Aedes
aegypti. Int. J. Mosq. Res. 6, 101-103 (2019).
37. Ojewumi, E. M., Oladipupo, A. A. & Ojewumi, O. E. Oil
extract from local leaves an alternative to synthetic mosquito repellants.
Pharmacophore 9, 1-6 (2018).
38. Gnankiné, O. & Bassolé, I. H. N.
Essential oils as an alternative to pyrethroids resistance against Anopheles
species complex giles (Diptera: Culicidae). Molecules 22, 1321
(2017).
39. Bossou, A. D. et al. Chemical composition and
insecticidal activity of plant essential oils from Benin against Anopheles
gambiae (Giles). Parasit. Vectors 6, 337 (2013).
40. Balboné, et al. Essential oils from five
local plants: An alternative larvicide for Anopheles gambiae s. I. (Diptera:
Culicidae) and Aedes aegypti (Diptera: Culicidae) control in Western Burkina
Faso. Front. Trop. Dis. 3, 853405 (2022).
41. Bekele, J. & Hassanali, A. Blend effects in the
toxicity of the essential oil constituents of Ocimum kilimandscharicum
and Ocimum kenyense (Labiateae) on two post-harvest insect pests.
Phytochemistry 57, 385-391 (2001).
42. Pavela, R. Acute and synergistic effects of some
monoterpenoid essential oil compounds on the house fly (Musca domestica).
J. Essent. Oil Bearing Plants 11, 451-459 (2008).
43. Tanprasit, P. Biological control of dengue fever
mosquitoes (Aedes aegypti Linn.) using leaf extracts of Chan
(Hyptis suaveolens (L) poit.) and hedge flower Lantana camara
Linn.). (2005).
44. Park, H. M. et al. Larvicidal activity of
myrtaceae essential oils and their components against Aedes aegypti,
acute toxicity on Daphnia magna, and aqueous residue. J. Med.
Entomol. 48, 405-410 (2011).
45. Burt, S. Essential oils: Their antibacterial properties
and potential applications in foods--A review. Int. J. Food Microbiol. 94,
223-253 (2004).
46. Abbassy, M. A., Abdelgaleil, S. A. M. & Rabie, R. Y.
A. Insecticidal and synergistic effects of Majorana hortensis
essential oil and some of its major constituents. Entomol. Exp. Appl.
131, 225-232 (2009).
47. Chiasson, H., Bélanger, A., Bostanian, N.,
Vincent, C. & Poliquin, A. Acaricidal properties of Artemisia absinthium
and Tanacetum vulgare (Asteraceae) essential oils obtained by three methods of
extraction. J. Econ. Entomol. 94, 167-171 (2001).
48. Luz, T. R. S. A., deMesquita, L. S. S., Amaral, F. M. M.
& Coutinho, D. F. Essential oils and their chemical constituents against
Aedes aegypti L. (Diptera: Culicidae) larvae. Acta Trop. 212, 105705
(2020).
49. Deletre, E., Mallent, M., Menut, C., Chandre, F. &
Martin, T. Behavioral response of Bemisia tabaci (Hemiptera:
Aleyrodidae) to 20 plant extracts. J. Econ. Entomol. 108, 1890-1901
(2015).
50. Berenbaum, M. A. Y. & Neal, J. J. Synergism between
myristicin and xanthotoxin, a naturally cooccurring plant toxicant. J.
Chem. Ecol. 11, 1349-1358 (1985).
51. Intirach, J. et al. Chemical constituents and
combined larvicidal effects of selected essential oils against Anopheles
cracens (Diptera: Culicidae). Psyche (London) https:// doi. org/
10. 1155/ 2012/ 591616 (2012).
52. Pavela, R. Acute, synergistic and antagonistic effects of
some aromatic compounds on the Spodoptera littoralis Boisd. (Lep., Noctuidae)
larvae. Ind. Crops Prod. 60, 247-258 (2014).
53. Muturi, E. J., Ramirez, J. L., Doll, K. M. & Bowman,
M. J. Combined toxicity of three essential oils against Aedes aegypti
(Diptera: Culicidae) larvae. J. Med. Entomol. 54, 1684-1691
(2017).
Acknowledgements
We are indebted to «Institut de recherche en Sciences
Appliquées et technologiques» (IRSAT) for providing us with
essential oils. Mahamoudou Balboné is the recipient of a PhD studentship
of University Joseph KI-ZERBO. I also thank Casimir Gnankiné for editing
this manuscript.
Author contributions
M.B. and O.G. designed the study. D.D.S., critically
supervised the study. M.B., I.S., K.B., and G.B.M., carried out the laboratory
experiments. M.B., S.F.D., and O.G. analyzed and interpreted the data and
drafted the
Scientific Reports | (2022) 12:19077 |
https://doi.org/10.1038/s41598-022-23554-6
9
manuscript. O.G., R.K.D., H.C.R.N., M.N., I.H.N.B., revised
the manuscript. All authors contributed to the article and approved the
submitted version.
Funding
Funding for this study was provided partly by the TWAS 18-163
RG/BIO/AF/AC_G-FR3240303649 and the «Centre d'excellence Africain (CEA) en
Innovations biotechnologiques pour l'elimination des maladies a transmission
vectorielle».
Competing interests
The authors declare no competing interests.
Additional information
Correspondence and requests for materials should
be addressed to O.G.
Reprints and permissions information is
available at
www.nature.com/reprints.
Publisher's note Springer Nature remains
neutral with regard to jurisdictional claims in published maps and
institutional affiliations.
Open Access This article is licensed under a Creative Commons
Attribution 4.0 International
License, which permits use, sharing, adaptation, distribution
and reproduction in any medium or format, as long as you give appropriate
credit to the original author(s) and the source, provide a link to the Creative
Commons licence, and indicate if changes were made. The images or other third
party material in this article are included in the article's Creative Commons
licence, unless indicated otherwise in a credit line to the material. If
material is not included in the article's Creative Commons licence and your
intended use is not permitted by statutory regulation or exceeds the permitted
use, you will need to obtain permission directly from the copyright holder. To
view a copy of this licence, visit
http:// creat iveco mmons. org/ licen ses/
by/4. 0/.
(c) The Author(s) 2022
Thèse de Doctorat unique - 170
-
Scientific Reports | (2022) 12:19077 |
https://doi.org/10.1038/s41598-022-23554-6
10
|
|



