|

UNIVERSITEDECARTHAGE
FACULTE DES SCIENCES DE
BIZERTE
Département Sciences de la Vie
Institut National des
Sciences et Technologies
de
la Mer
MEMOIRE
En vue de l'obtention du
DIPLOME DE MASTER PROFESSIONNEL
En
Biosurveillance de l'environnement
Intitulé
Etude de la croissance, de la composition biochimique
et
de la faune associée de l'algue rouge Gracilaria
gracilis
(Hudson) Papenfuss de la lagune de Bizerte
Présenté par :
Zouhour MSIHLI
Soutenu le 14/12/2019 devant le Jury :
Mr. Mohamed DELLALI Président (FSB)
Mme. Hajer KAABI Examinateur (FSB)
Mme. Neziha GHANEM BOUGHANMI Encadrant Universitaire
(FSB)
Mr. Fethi MENSI Encadrant Externe (INSTM)
Mr. Mohamed CHALGHAF Invité (ISPA
Bizerte)
Année universitaire: 2018 / 2019
Keywords: Gracilaria gracilis, Growth,
biochemical composition, associated fauna, Bizerte lagoon.
Résumé
Une importante faune associée à l'algue rouge
Gracilaria gracilis cultivée dans la lagune de Bizerte a
été observée. Ce travail représente la
première étude sur la faune associée à l'algue dans
cette lagune. Notre objectif est d'étudier la structure et l'interaction
de cette faune en fonction de la biomasse et la composition biochimique de
l'algue, afin d'établir une stratégie pour sa récolte dans
le futur. Le taux de croissance spécifique (TCS) est de 5,60 #177; 0,94
% j-1 ; 3,29 #177; 0,70 % j-1 et 2,55 #177; 0,16 %
j-1 pour les mois d'Avril, Mai et Juin respectivement et une moyenne
durant toute la période de 3,0 5#177; 0,78 %j-1. La
quantité de sucre soluble est de 35,42 #177; 11,85% ; 48,86 #177; 9,16%
et 34,12 #177; 8,74 % pour les mois d'Avril, Mai et Juin respectivement et une
moyenne durant toute la période de 39,47 #177; 9,92 %. La
quantité de protéines est de 21,96 #177; 5,15 % ; 18,56 #177;
1,90 % et 21,90 #177; 1,74 % pour les mois d'Avril, Mai et Juin respectivement
et une moyenne durant toute la période de 20,81 #177; 2,93 %. Au total,
nous avons trouvé six groupes zoologiques qui sont les crustacés
amphipodes, les crustacés isopodes, les mollusques, les cnidaires, les
annélides polychètes et les échinodermes. Les ordres
dominants sont les amphipodes (25,86 % ; 17,85 % et 5,36 % respectivement en
Avril, Mai et Juin) et les isopodes (64,48 % ; 76,84 % et 66,27 %
respectivement en Avril, Mai et Juin) dont l'espèce Idotea balthica
est dominante durant la période de culture. L'abondance de
l'isopode (Idotea balthica) est positivement corrélée
aux différentes réponses étudiées (TCS, agar,
protéines et R-phycoérythrine). En conclusions, pour une
exploitation durable de la culture de G. gracilis, en se basant sur
l'adéquation entre le TCS, la composition biochimique et la faune
associée (nombre d'individus et types d'espèces), nous proposons
de commencer la culture au mois de Mars et de faire la récolte, selon un
plan déterminé, à la fin du mois de Mai.
Mots clés : Gracilaria gracilis,
Croissance, composition biochimique, faune associée, lagune de
Bizerte.
Abstract
An important fauna associated with the red algae
Gracilaria gracilis grown in the Bizerte lagoon has been observed.
This work represents the first study of algae-associated wildlife in this
lagoon. Our aims are to study the structure and interaction of this fauna based
on the biomass and biochemical composition of algae, in order to establish a
strategy for its harvest in the future. The specific growth rate (TCS) is 5,60
#177; 0,94 % j(-1) ; 3,29 #177; 0,70 % j(-1) and 2,55 #177; 0,16
%j(-1) for the months of April, May and June respectively and an
average throughout the period of 3,05 #177; 0,78 %j-1. The amount of soluble
sugar is 35,42 #177; 11,85% ; 48,86 #177; 9,16% and 34,12 #177; 8,74% for the
months of April, May and June respectively and an average throughout the period
of 39,47 #177; 9,92%. The amount of protein is 21,96 #177; 5,15% ; 18,56 #177;
1,90% and 21,90 #177; 1,74% for the months of April, May and June respectively
and an average throughout the period of 20,81 #177; 2,93%. In total, we found
six zoological groups that are amphipod crustaceans, isopod crustaceans,
molluscs, cnidarians, polychaete annelids and echinoderms. The dominant orders
are amphipods (25,86 % ; 17,85 % and 5,36 % for the months of April, May and
June respectively) and isopods (64,48 % ; 76,84 % and 66,27 % for the months of
April, May and June respectively), of which the species Idotea balthica
is the most dominant during the growing period. The abundance of isopod
(Idotea balthica) is positively correlated with the various responses
studied (TCS, agar, proteins and R-phycoerythrin). In conclusion, for a
sustainable exploitation of the cultivation of G. gracilis, based on
the adequacy between TCS, biochemical composition and associated fauna (number
of individuals and species types), we propose to start G. gracilis
culture in later March and the harvest, according to a certain plan, at
the end of May.
1
Introduction générale
La connaissance du monde végétal aquatique a
énormément évolué au cours de ces dernières
décennies en s'appuyant sur les acquis récents de la science dans
les domaines de la biologie moléculaire, de la cytologie, de la
physiologie et de la génétique. Pérez (1997) met en
exergue deux concepts fondamentaux donnant aux algues leur dimension actuelle :
d'une part, leur rôle fondamental dans l'équilibre de
l'écosystème aquatique et, au-delà, de la biosphère
toute entière et d'autre part, leur place capitale dans
l'économie. Sur le plan écologique, les végétaux
marins, en général et les macro-algues en particulier constituent
les premiers maillons de la chaine alimentaire et leurs peuplements constituent
des refuges ainsi que des frayères pour une faune très
diversifiée ; elles sont aussi des bio-indicateurs signalant les
agressions subies par le milieu et les tendances de l'environnement. Sur le
plan économique, les macro-algues ne cessent d'attirer de plus en plus
l'attention des chercheurs et des industriels, essentiellement pour la
découverte et la valorisation de molécules ayant un potentiel
économique important (les protéines, les glucides, les lipides,
les sels minéraux).A ce niveau, plus de 25 millions de tonnes des
macro-algues dans le monde, qui sont utilisés dans différents
secteurs (FAO, 2016).
Les algues rouges sont l'une des groupes les plus
recherchés du fait de leur richesse en polysaccharides (les
carraghénanes et les agars) utilisés comme agents structuraux,
filmogènes ou émulsifiants dans de nombreux domaines de
l'industrie agro-alimentaire ou pharmaceutique (Viana, 2002). Cependant,
l'extraction de ces phycocolloïdes constitue un important créneau
pour l'exploitation des algues marines à l'échelle mondiale.
Parmi les algues agarophytes les plus recherchés, figure Gracilaria
qui constitue la principale matière première pour la
préparation de l'agar à échelle mondiale (Marinho-Soriano
et Bourret, 2003). La Tunisie, avec sa façade
méditerranéenne, qui s'étale sur plus de 1300 km, ne
produit qu'une une biomasse totale de Gracilaria gracilis,
estimée à 573 tonnes en poids sec par an. Cette quantité
est insuffisante pour le démarrage d'une activité industrielle et
par conséquence la culture de l'algue a été
recommandée (Ksouri et Ben saïd, 1998). Cependant, les nombreuses
tentatives ont été confrontées à l'impact des
facteurs environnementaux et la disponibilité limitée des
superficies pour la culture benthique. Ces techniques n'étaient
applicables que dans des zones situées à moins de 2 m de
profondeur, ce qui correspond à 10 % de la superficie totale de la
lagune de Bizerte (Mensi et al., 2014). De plus, l'agar obtenu dans la
lagune (force de gel est inférieure à 400 g cm-2) est
de qualité moyenne selon la
2
classification de l'American Pharmacopeia (Ben Saïd
et al., 2018). Par conséquent, aucune installation à
grande échelle pour la culture de G. gracilis n'est
présente aujourd'hui.
Les travaux de cette mémoire se sont articulés
autour de trois axes, déclinés dans ce manuscrit en chapitres :
Le premier chapitre présente un état de l'art sur les gracilaires
et en particulier sur Gracilaria gracilis, y sont décrites sa
morphologie, sa biologie, sa taxonomie et les facteurs abiotiques
régissant son développement. Cette partie présente
également la faune qui s'associé aux thalles de G. gracilis
et son effet sur la croissance de l'algue. Le deuxième chapitre est
réservé à la présentation de l'aire d'étude,
au protocole de préparation des touffes de G. gracilis,
à la modalité de culture (culture sur corde tendue) et à
la méthodologie de détermination de la composition biochimique de
l'algue ainsi qu'à la méthode de collecte, d'identification et
d'analyse de la faune collectée. Le troisième et dernier chapitre
résume les résultats et les discussions. Une conclusion
générale de l'ensemble des travaux réalisés
clôturera ce manuscrit laissant place à de nouvelles
perspectives.
3
Objectifs du travail
En Tunisie, les traveaux de recherches relatives à la
culture de Gracilaria ont commencés depuis 1995. En effet, ces
travaux ont été menés essentiellement à l'INSTM sur
la culture de l'algue rouge Gracilaria gracilis. Les premiers travaux
ont concerné l'évaluation des biomasses de Gracilaria et
leur cartographie dans le lac de Tunis (Ksouri et al., 1996 ; Ksouri
et al., 1997) et la lagune de Bizerte (Ksouri et Ben Saïd, 1998 ;
Ksouri et al., 1999, 2000 et 2006). D'autres recherches ont
porté sur la valorisation de cette ressource à travers
l'extraction de molécules d'intérêt à savoir la
R-phycoérythrine, les protéines, les sucres solubles (Mensi
et al., 2009) ainsi que l'agar-agar (Ben Saïd et al.,
2000). Ces précédents travaux de recherche relatifs à
la culture de Gracilaria dans le lac de Bizerte ont permis de
sélectionner le mode de culture approprié et d'ajuster certains
paramètres de culture (Ksouri et al., 1999 ; 2000). Cependant,
les résultats obtenus montrent que la croissance et le
développement de cette algue sont tributaires, principalement des
facteurs physicochimiques du milieu tels que, la lumière, la
température, la salinité, la teneur en oxygène et
l'enrichissement du milieu en sels nutritifs (Mensi et al., 2009).
Depuis l'initiation des cultures de Gracilaria, le
problème de l'épiphytisme demeure sérieux. Durant les 30
dernières années, plusieurs travaux ont été
consacrés à la description de ce phénomène et
à la recherche de solutions. Les plus importants facteurs qui
influencent la structure de la faune associée aux macrophytes regroupent
la structure physique du macrophyte et ses épiphytes, le nombre de micro
habitats, la nature du sédiment, les sources de nourriture, les refuges
de prédateurs et la courantologie (Lewis, 1984). L'algue rouge
Gracilaria fournit l'habitat pour une faune diversifiée,
répartie essentiellement entre les groupes zoologiques suivants,
Crustacés, Mollusques et Annélides (Nicotri, 1977 ; Anderson
et al., 1998 ; Smit et al., 2003). Le fait que Gracilaria
est une espèce préférée pose un
problème pour la culture dans le milieu naturel lorsque la population
d'animaux brouteurs est élevée. La perte peut être
considérable même dans le cas de la culture en milieu
contrôlé (Nicotri, 1977 ; Shacklock et Croft, 1981 ; Smit et
al., 2003 ; Njobeni, 2005). En Tunisie, les études concernant la
faune associée au Gracilaires en milieu lagunaire sont rares (Zaabar
et al., 2017) et surtout lorsque celles-ci sont cultivées.
Cependant, l'objectif de ce travail est d'étudier la croissance et la
composition biochimique de l'algue rouge G. gracilis et l'interaction
avec sa faune associée au cours d'un cycle de développement.
4
I. Synthèse bibliographique
1. Généralité sur les algues 1.1.
Introduction
Les algues sont des êtres vivants
photosynthétiques dont le cycle de vie se déroule
généralement en milieu aquatique. Ce sont des thallophytes
(plante à ramification) dépourvues de tige, de graines, de
racines et de vaisseaux (Gayral, 1975). Elles constituent un groupe très
diversifié de plantes cryptogames, dont un grand nombre sont
unicellulaires. (Gayral, 1975 ; Reviers, 2002). Elles sont la base principale
de la chaine alimentaire des eaux douces, saumâtres et marines.
1.2. Classification
Les algues peuvent être classées selon leurs
tailles, leurs compositions pigmentaires, leurs polysaccharides de
réserve ou des caractéristiques structurales. En plus de
chlorophylle, les algues possèdent d'autres pigments accessoires, qui
captent les rayons lumineux. Le mélange de pigment détermine la
couleur de chaque variété d'algue ce qui est un moyen permettant
de différencier les espèces des unes aux autres (Reviers, 2002).
On distingue quatre groupes d'algues : bleues, brunes, vertes et rouges
(Hillison, 1977).
1.2.1. Les algues bleues (Cyanophycées)
Les cyanophycées ou les cyanobactéries sont des
microorganismes procaryotes. Ces algues renferment environ 4400 espèces
qui se répartissent sur au moins 150 genres (Laplace-Treyture, 2016).
Elles possèdent des pigments surnuméraires dont la phycocyanine
qui donne la couleur bleue ou la phycoérythrine (couleur rouge)
(Genvès, 1990).
1.2.2. Les algues brunes (Phéophycées)
La classe des phéophycées renferme 1500
espèces. Ces algues possèdent principalement les chlorophylles a
et c et d'autres pigments (fucoxanthine). Ces sont des organismes
photosynthétiques pluricellulaires, majoritairement marins, que l'on
retrouve principalement dans les zones côtières des régions
tempérées (Bonin, 2015).
5
1.2.3. Les algues vertes (Chlorophycées)
Les algues vertes réunissent entre 6000 et 7000
espèces, constituent le plus grand groupe d'algues. Elles
possèdent 2 chlorophylles (a et b) avec des carotènes et des
xanthophylles. Elles comportent tous types d'algues : unicellulaire,
flagellées, filamenteuses, ramifiées, etc. (Bouchoukh, 2017).
1.2.4. Les algues rouges (Rhodophycées)
Les rhodophycées comptent environ 700 genres et 6600
espèces presque toutes pluricellulaires, macroscopiques, marines et
peuvent se reproduire de façon sexuée et/ou asexuée
(Guiry, 2013 ; Collén et al., 2014). Leurs pigments sont
constitués par des chlorophylles a et d, des ? et ? carotènes,
des xanthophylles et surtout des phycobiliprotéines
(phycoérythrine). Elles sont représentées par deux classes
; Bangiophyceae et Floridiophyceae (Genvès, 1990).
2. Les Gracilaires (Gracilaria)
2.1. Généralité
Gracilaria est un genre d'algues rouges de la famille
des Gracilariaceae. Cette algue, qui constitue la matière
première pour la production industrielle d'agar, est largement
distribuée autour du monde dont on recense plus de 110 espèces
(Rueness, 2005). Six espèces de Gracilaria (armata,
bursa-pastoris, arcuata, cervicornis, corallicola et gracilis) ont
été signalées par Ben Maiz (1993) en Tunisie dans
plusieurs sites sur tout le littoral tunisien. Les lagunes
côtières constituent de véritables lieux à leur
développement (Ksouri et al., 1999). Au niveau de la lagune de
Bizerte, deux espèces (Gracilaria bursa-pastoris et
Gracilaria gracilis) (Figure 1) sont présentes principalement
dans la partie Nord-Est sous forme d'une bande dont G. gracilis
génère une biomasse totale estimée à 573
tonnes en poids sec par an et ses populations couvrant 9 % de la superficie
(Mensi et al., 2014). Le genre Gracilaria se
caractérise par la présence de cellules nutritives tubulaires et
de spermaties non superficielles. La récolte mondiale annuelle de
Gracilaria a dépassé les 37 000 tonnes sèches
(Ye et al., 2006).
6
2.2. Description de l'espèce Gracilaria
gracilis
2.2.1. Présentation de l'espèce
Gracilaria gracilis est une algue de couleur rouge
bordeaux en hiver à orangé clair en été, elle
devient jaunâtre voire blanchâtre lorsqu'elle est soumise à
une forte luminosité. Selon Remond et al. (2014), les thalles
des Gracilaires sont généralement rouges, mais peuvent être
brunâtres, verts ou presque noires (Figure 2), en fonction de la
lumière et des conditions nutritives. Ce qui distingue G. gracilis
des autres gracilaires c'est que le thalle de cette algue atteint jusque
20 cm de longueur, formant des touffes denses et dressées et des
ramifications jamais palmée (Pérez, 1997).
Comme pour beaucoup d'espèces de gracilaires, G.
gracilis peut avoir des aspects différents avec une forme trapue ou
allongée et des filaments de diamètres différents sur le
même thalle (Figure 3). Une coupe transversale du filament est
nécessaire pour distinguer G. gracilis des espèces
morphologiquement comparables. Cependant, la coupe transversale ressemble
à celle de G. bursa-pastoris. On observe une couronne de
petites cellules colorées par les plastes, puis des cellules incolores
de plus en plus grosses vers le centre de la coupe (Réseau de Suivi
Lagunaire, 2011).
Selon Calvados (2007), G. gracilis est
présente sur les rochers et graviers de la partie inférieure de
l'étage médiolittorale et dans la frange infralittorale, surtout
dans les cuvettes ensablées et peu profondes. Sur les rochers, elle
croît souvent au travers du sable superficiel.
2.2.2. Classification taxonomique
Au cours de ces dernières années, des techniques
moléculaires ont été développées pour
l'identification des espèces marines d'intérêt
économique. Ces techniques ont été testées avec
succès pour l'identification de différents espèces
d'algues rouges (Antoine et Fleurence, 2003 in Mensi et al., 2014) et
la distinction entre G. gracilis et Gracilariopsis sp. de la lagune de
Bizerte (Joubert et al., 2009).
Selon Pérez (1997), la classification taxonomique de
l'espèce Gracilaria gracilis est la suivante :
7
Phylum : Rhodophyta
Classe : Florideophyceae
Ordre : Gracilariales
Famille : Gracilariacae
Genre : Gracilaria et
Graciliariopsis
Espèce : verrucosa (gracilis)
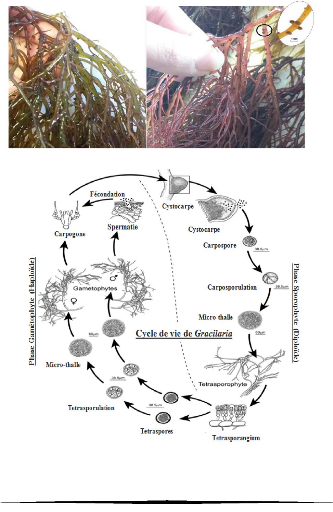
2.2.3. Cycle de reproduction
Le cycle de reproduction de Gracilaria gracilis est
caractéristique des algues rouges (cycle
trigénétique). Les gamétophytes
haploïdes (n) sont à sexes séparés. Les
gamètes mâles (spermaties) sont produits en grand nombre dans des
cryptes superficielles du thalle, ils sont non-pigmentés et
non-flagellés et transportés passivement par l'eau jusqu'à
la femelle. Les organes reproducteurs femelles sont formés de quelques
cellules peu différentiables des autres cellules de la couche corticale
et forment le rameau carpogonial. La fécondation à lieu sur la
femelle, et la fusion des noyaux mâle et femelle est suivie de processus
cytologiques complexes (Hommersand et Fredericq, 1990). En effet, le noyau
diploïde se divise par mitoses, des connexions s'établissent entre
cellules haploïdes (n) maternelles et diploïdes (2n) issues du
zygote, aboutissant à la formation d'un carposporophyte (2n). Le
cystocarpe (Figure 4) est formé d'une enveloppe de cellules
haploïdes (le péricarpe) entourant un tissu diploïde qui
produira à maturité quelques milliers de spores diploïdes
(carpospores). Les carpospores libérés donnent les individus
diploïdes (tétrasporophytes). A maturité,
les tétrasporophytes, par méiose produisent des spores
haploïdes groupées par tétrades (tétraspores) qui
redonnent des gamétophytes mâles et femelles
(Destombe, 2001) (Figure 5).
Les individus de G. gracilis consistent en un disque
pérenne fixé au substrat rocheux et des thalles annuels où
apparaissent les organes de reproduction. C'est donc seulement durant la
période de reproduction que l'on peut identifier facilement le sexe et
la génération (à l'oeil nu pour les femelles, à la
loupe binoculaire pour les mâles et les tétrasporophytes)
(Destombe, 2001).
En effet, outre le cycle de la reproduction sexuée
relativement complexe à trois phases, G. gracilis est
également capable de se reproduire de manière asexuée, par
propagation végétative. Suite à une fragmentation
continue, un seul individu a la capacité de générer des
centaines, voire des milliers d'individus. Chaque fragment produit grandira et
deviendra un
8
individu, et ces lames pourront être fragmentées
davantage en plusieurs individus, et ainsi de suite. Cela permet un moyen de
propagation beaucoup plus simple et crée également une
cohérence dans un environnement de culture (Remond et al.,
2014). La multiplication végétative est le moyen de culture
le plus répandu. En effet, elle est plus rapide, plus simple et plus
efficace que les spores. Elle permet une meilleure cohérence, car toutes
les lames d'une culture peuvent être génétiquement
identiques, toutes ayant le même parent.
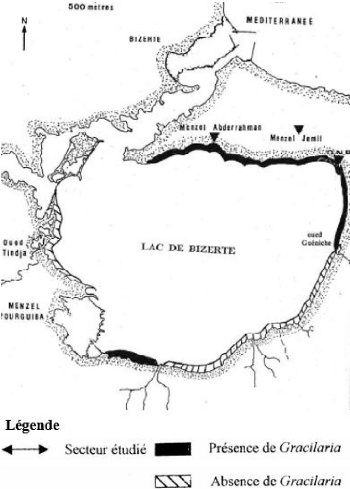
Figure 1 : Prospection des peuplements de
Gracilaria (bande en noir) sur les bordures du lac de Bizerte au cours
des mois de Juin et Juillet 1997 (Ksouri et al., 1998).

9
Figure 2: Les différentes couleurs des
thalles du Gracilaria gracilis (Msihli, 2019)

Figure 3: Aspect général du thalle
de Gracilaria gracilis du lac de Bizerte (Ksouri et al.,
2006)
10
Figure 4: Thalle du Gracilaria gracilis
avec cystocarpes (Msihli, 2019)
Figure 5 : Cycle de vie de Gracilaria
gracilis (Remond et al., 2014)
11
3. Les facteurs influençant la croissance de
Gracilaria
La croissance de Gracilaria gracilis est
principalement influencée par deux facteurs ; abiotique (liés aux
conditions physico-chimiques du milieu : la température, la
salinité, la lumière, les mouvements d'eau, les nutriments, etc.)
et biotique (liés aux composantes biologiques, interactions du vivant
sur le vivant, intraspécifique et interspécifique).
3.1. Les facteurs abiotiques
Plusieurs facteurs abiotiques clés affectant la
croissance et le développement de Gracilaria ont
été identifiés, notamment la lumière, la
température, la salinité, les éléments nutritifs et
l'hydrodynamisme (Yang et al., 2015).
3.1.1. La lumière
L'environnement lumineux sous-marin est très variable
et dynamique car la lumière, qui passe à travers l'eau, est
absorbée et dispersée par les molécules et les particules
d'eau. Les algues, comme les plantes terrestres, utilisent la
photosynthèse rayonnement actif ou photosynthetic active radiation
(PAR), qui est la portion de lumière disponible pour la
photosynthèse. Leur développement dépend essentiellement
de la lumière disponible pour la photosynthèse, de sa
quantité en termes d'intensité et de sa qualité en termes
de spectre. Cette lumière est soumise à des changements
momentanés, diurnes et saisonniers (Talarico et Maranzana, 2000).
L'intensité lumineuse reçue à la surface de l'eau
dépend de la profondeur de la colonne d'eau et des
phénomènes d'absorption et de diffusion. Ces
phénomènes sont liés à la présence de
phytoplanctons, de la matière organique dissoute, des particules en
suspensions et de l'eau en elle-même (Loiselle et al., 2008). En
effet, la variation de l'un de ces composants a une incidence sur la
pénétration de la lumière dans la colonne d'eau.
Les Gracilaires nécessitent généralement
une intensité lumineuse élevée pour une croissance
normale. Par exemple, l'intensité lumineuse optimale pour Gracilaria
lemaneiformis est de 40 à 60 umol.m- 2.s- 1
(Lei, 2007 ; Zhao, 2007). Cependant, lorsque les algues sont cultivées
dans la mer, soit suspendues horizontalement à différentes
profondeurs dans la plupart des cas, soit parfois verticalement dans la colonne
d'eau, elles sont soumises à une grande fluctuation de la
disponibilité de l'éclairement énergétique due
principalement aux profondeurs de l'eau, au jour et à l'auto-ombrage.
12
Selon Talarico et Maranzana (2000), les rhodophycées
développent généralement des mécanismes
d'adaptation à la quantité et à la qualité de la
lumière en développant des stratégies et des
mécanismes d'adaptation à échelle individuelle impliquant
des changements dans l'anatomie du thalle et des parois cellulaires ainsi que
dans la structure chloroplastique et thylacoïdale, cellulaires (adaptation
à court terme) et moléculaire (adaptation à long terme)
à travers une modification dans la pigmentation et dans la composition
de la membrane photosynthétique. Certaines espèces de
rhodophycées semblent capables d'adapter leurs caractéristiques
photosynthétiques à des conditions supérieures ou
inférieures aux gammes optimales d'irradiance. Elles s'adaptent à
ces fluctuations environnementales avec un potentiel d'acclimatation
photosynthétique plus élevé, ce qui leur permet de
transformer leurs caractéristiques photosynthétiques de concert
avec les modifications des niveaux de lumière dans leur habitat naturel.
Xu et Gao (2008) ont étudié la réponse de G.
lemaneiformis à la réduction du rayonnement solaire à
des profondeurs accrues. Ils ont constaté que cette algue est capable
d'augmenter le contenu cellulaire des pigments photosynthétiques et de
diminuer ainsi la teneur en composés en absorbant les ultraviolets
(UVAC) pour atténuer le faible rayonnement solaire. Cette
stratégie peut permettre à l'algue de capter plus de
lumière pour la photosynthèse et de réduire le coût
métabolique de la production des produits secondaires et des UVAC (Xu et
Gao, 2008).
La lumière est l'un des facteurs environnementaux les
plus importants influant sur la croissance et le développement des
gracilaires. Nejrup et al. (2013) ont montré que le taux de
croissance de Gracilaria vermiculophylla augmente significativement
avec la lumière. Selon les mêmes auteurs, le taux de croissance le
plus élevé (0,045 #177; 0,001 % jour - 1, moyenne #177; DS)
était observé pour la combinaison de 20 °C et de 225
ìmol de photons jour-1.s-1. Cependant, G.
vermiculophylla est capable de pousser avec de très faible
luminosité (<1 ìmol de photons m- 2. s-
1) et à haute température allant jusqu'à au moins 25
°C. À une température de 30 °C, une respiration
élevée dépasse la photosynthèse (Mensi et al.,
2014).
L'intensité lumineuse reçue à la surface
de l'eau diminue proportionnellement avec la profondeur selon la loi de
Beer-Lambert (Iz = I0· e- Kd · Z) (Mensi et al.,
2014). Buschmann et al. (1995) montrent que les gracilaires sont
capables de se développer dans des profondeurs atteignant les 8 à
10 m, sauf qu'au-delà de 4-5 m, la croissance et la biomasse sont
largement affectées, surtout dans les milieux troubles qui ne laissent
pas passer la lumière.
13
L'espèce Gracilaria gracilis supporte de
très fortes intensités lumineuses allant jusqu'à 1000
ìmol m-2s-1. A cette intensité, les frondes
se décolorent et la croissance s'arrête (Mensi et al.,
2014). La durée de vie des thalles dépend des valeurs
extrêmes de l'intensité lumineuse et de l'adaptation de l'algue
aux conditions de stress lumineux. Selon Ksouri et al. (1999), dans la
lagune de Bizerte et à des profondeurs inférieures à 3 m,
la croissance de G. gracilis s'arrête fin mai sous l'effet d'un
ensoleillement trop fort. De même, les gracilaires semblent capables de
supporter de très faibles intensités lumineuses allant
jusqu'à 80 ìmol. m-2. s-1.
3.1.2. Température et
salinité
Les taux de croissance des végétaux marins sont
largement influencés par les saisons. Ils se caractérisent par
une augmentation pendant le printemps et l'été, et une chute
pendant l'automne et l'hiver. Chez les algues rouges, la croissance est
influencée par l'insolation, la salinité et la température
ou par une interaction entre ces différents facteurs (Friedlander et
al., 1990 ; Marinho-sorino et al., 2006).
La température a une influence considérable sur
la distribution saisonnière et géographique, ainsi que le taux de
croissance de Gracilaria. Selon Yang et al. (2015), plus de
100 espèces des gracilaires ont été décrites dans
le monde et elles se développent principalement dans les zones
tempérées, subtropicales et tropicales, une corrélation
entre la température de l'eau et la croissance a été
signalée par Silkin et Mironova (2007). En effet, la plupart des
espèces de Gracilaria enregistrent une croissance maximale, et
probablement une production, dans les zones d'eaux chaudes
caractérisées par des températures comprises entre 25 et
30°C, mais certaines ont une limite supérieure au-delà de
laquelle la croissance peut être réduite ou même
arrêter par les basses températures (McLachlan et Bird, 1986).
Wang et al. (1984) ont observé que G. gracilis a
disparu dans les zones où la température de surface de l'eau de
mer dépasse 30 °C. Lefebvre, (1968) montre qu'une basse
température empêche l'apparition de frondes ; mais elle favorise
le développement du disque basal qui constitue un moyen de survie et de
résistance vis à vis aux différents facteurs du stress. Un
hiver très froid pourrait détruire les frondes alors que la base
résiste pour assurer la croissance l'année suivante.
Dans des conditions de culture en eau de mer enrichie en
nutriments, le TCS (Taux de Croissance Spécifique) quotidien de
Gracilaria coronopifolia était positivement
corrélée à une température allant de 15 à 35
°C, atteignant un taux de production maximal à 30 °C (Tsai
14
et al., 2005). La température favorable pour
la croissance de G. lemaneiformis varie de 12 à 23 °C.
Lorsque la température de l'eau est inférieure à
10°C, le TCS moyen des espèces de Gracilaria devient
négatif et lorsqu'elle dépasse les 26°C, l'algue meurt.
Donc, la période de croissance de G. lemaneiformis est
d'environ six mois (Yang et al., 2015). La température de l'eau
contrôle la croissance de cette algue, ce qui en fait l'un des facteurs
limitants les plus importants. Elle peut également influer sur plusieurs
processus physiologiques, tels que les taux de diffusion et d'absorption des
nutriments. Des études antérieures ont montré que le taux
d'absorption de NO3- par Gracilaria tikvahiae augmente avec
l'augmentation des températures (Yang et al., 2015).
De nombreux chercheurs considèrent la
température et la salinité comme deux facteurs fondamentaux de
contrôle de la croissance saisonnière dont il est difficile de
séparer leurs effets. D'après Mensi et al. (2014), il y
a une interaction entre la salinité et la température pour la
croissance de G. gracilis. En effet, avec une température
comprise entre 20 et 30 °C et une salinité comprise entre 25 et 30
%o, la croissance est optimale. Cependant, une chute de la croissance a
été enregistrée avec des températures se situant
entre 25 et 30 °C et une salinité inférieure à 25
%o.
Les algues rouges marines dans leur ensemble sont
considérées comme sensibles aux conditions mésohaline
(5-18 %o), relativement peu de représentants étant
enregistrés pour des salinités inférieures à 15 %o
(Coutinho et Seeliger, 1984). En général, les algues du genre
Gracilaria sont euryhalines. Cependant, McLachlan et Bird (1986) ont
montré que certains gracilaires (G. tikvahiae et G.
coronopifolia) présentent une croissance maximale uniquement
à des salinités inférieures à 30 %o, tandis que
d'autres (G. gracilis et Gracilaria sp.) préfèrent des
milieux plus concentrés. Des résultats obtenus avec G.
tikvahiae suggèrent également une préférence
pour les habitats saumâtres (Connor, 1980). De même pour G.
gracilis (Mathieson et al., 1981). McLachlanet Bird (1986) ont
montré que la plupart des espèces de Gracilaria ont une
croissance limitée à des salinités inférieures
à 33 %o et 43 %o représente la salinité la plus
élevée à laquelle le genre se trouvait.
L'algue G. gracilis semble capable de supporter une
large gamme de variation des salinités (Turan et al., 2006). En
effet, elle est présente à des salinités
inférieures à 20 %o dans la mer Baltique, à des
salinités d'environ 17,5 %o dans la mer Noire et à environ 38 %o
en Méditerranée (Ketchum, 1983). Cependant, le succès
écologique de G. gracilis dans différents
15
régimes de salinité peut reposer sur une
adaptation écotypique ou sur une réduction de la concurrence
d'espèces moins halotolérantes. Simonetti et al. (1970)
ont rapporté que des peuplements presque purs de cette espèce
prospèrent durant la saison de leur croissance dans une plage de
salinité allant de 5 à 23 %o. À l'exception de G.
gracilis, même les gracilaires qui se développaient
raisonnablement bien à 45%o et pouvaient donc également se
développer à des salinités plus élevées mais
toujours inférieures à 60 %o, ont atteint leur croissance
maximale dans la partie inférieure de leur plage de tolérance
à 30 %o ou moins. Cirik et al. (2010) montrent que la
production optimale de G. gracilis a été
déterminée à 42 %o.
L'amplitude des fluctuations saisonnières et annuelles
de la température et de la salinité qui caractérisent la
lagune de Bizerte explique les fortes variations de croissance des gracilaires.
En se basant sur les études de Mansouri (1996), il paraît que dans
la lagune de Bizerte, la période correspondant aux conditions optimales
de croissance de Gracilaria gracilis est très courte et ne
dépasse pas deux mois (Mars-Avril). En effet, durant la période
pluvieuse, les précipitations provoquent une chute de la salinité
jusqu'à des valeurs inférieures à 28%o. Par contre,
pendant la saison estivale, les eaux du lac ont une salinité tout
à fait similaire à celle de l'eau de mer (38 %o) pouvant
atteindre des valeurs extrêmes de 41 %o.
3.1.3. Eléments nutritifs
Le développement des algues est particulièrement
important dans les lagunes soumises à de fortes charges en sels
nutritifs. Pour leur développement, les macroalgues exigent
essentiellement du carbone, de l'azote et du phosphore. Elles tirent leur
besoin en CO2 des bicarbonates qui sont rarement limitants dans l'eau de mer.
Cependant, le phosphore et l'azote sont d'habitude disponibles à des
concentrations limitantes pour la croissance des algues.
Il a été démontré que l'azote est
l'élément nutritif le plus limitant pour la croissance dans les
écosystèmes marins tandis que dans les écosystèmes
d'eau douce, c'est plutôt le phosphore qui est considéré
comme facteur limitant (Hanisak, 1990). L'azote se trouve dans l'eau de mer
sous différents états d'oxydation : nitrite (NO2-),
nitrate (NO3-) et ammonium (NH4+). Les macroalgues ont
des mécanismes physiologiques permettant d'acquérir, d'utiliser
et de stocker ces différentes formes d'azote. Ces mécanismes
physiologiques seraient variables en fonction de l'espèce. Selon Hanisak
(1990), il y a des différences dans la capacité des macroalgues
à utiliser les sources d'azote inorganique (NO3-,
NO2-, NH4+) et organique (forme d'urée). Pour les
algues rouges, les deux principales formes d'azote habituellement
16
utilisées sont le NO3- et le
NH4+, avec une meilleure assimilation de l'ammonium dans certains
cas et des nitrates dans d'autre cas selon leur disponibilité dans le
milieu. Plusieurs études ont montré que l'ammonium est
absorbé par les macroalgues plus rapidement que les nitrates ou les
nitrites et sa présence dans le milieu inhibe l'assimilation de ces
derniers. Selon Touchette et Burkholder (2000), les taux d'absorption
d'ammonium varient entre 5 et 270 mmol. g-1 (dw).h-1 et
ceux des nitrates entre 3.7 et 75 mmol.g-1 (dw).h-1.
Les deux algues Gracilaria gracilis et Gracilaria
bursa-pastoris ont montré une nette préférence pour
l'utilisation de la forme ammoniacale. Cette préférence peut
être expliquée par le fait que l'ammonium présente
l'avantage sur les autres formes d'azote d'être assimilé sans
réduction au préalable (Chebil et al., 2005). Quel que
soit la concentration en ammonium testée G. gracilis semble
être un candidat plus performant que G. bursa-pastoris dans
l'absorption de l'azote. Ceci pourrait être expliqué par le fait
que G. gracilis possède une capacité de stockage plus
importante que celle de G. bursa-pastoris. En effet, elle ne montre
aucune augmentation de poids quand elle est exposée à un ajout
d'azote dans le milieu et donc des taux de croissances spécifiques plus
élevés que ceux de G. bursa-pastoris. Il semble que
G. gracilis utilise la majeure partie de l'azote assimilée pour
la reconstitution de sa structure cellulaire et la synthèse de pigments
photosynthétiques et d'enzymes (Chebil et al., 2005). Ryther
et al. (1981) ont démontré que Gracilaria
sp.non alimentée préalablement en azote, a pu
assimiler rapidement de l'azote ammoniacal de façon à doubler son
contenu total en azote dans moins de 8 heures. De plus, ils ont montré
que Gracilaria tikvahiae a pu absorber suffisamment d'azote au bout de
6 heures ce qui lui a permis de survivre jusqu'à deux semaines dans un
milieu dépourvu d'azote.
Des travaux antérieurs ont montrés que les taux
d'assimilation et d'absorption de nitrate et d'ammonium chez certaines
gracilaires augmentent avec l'élévation de la température
et de la lumière ; C'est le cas de G. tikvahiae qui montre une
meilleure croissance en présence d'ammonium et lors des conditions de
faible éclairement alors que, lors d'un fort ensoleillement, G.
tikvahiae a crû de façon égale, que ce soit en
présence d'ammonium ou de nitrate (Lapointe et Ryther, 1978).
Il est à signaler que les rendements maximaux de
Gracilaria ne sont possibles que lorsque les conditions nutritives ne
limitent pas la croissance. Hanisak (1978) montre qu'un ajout continu de
nutriments maximiserait la croissance, mais il peut entraîner une
réduction du
17
rendement en raison du risque de croissance
d'épiphytes, qui sont souvent considérés comme la menace
la plus grave pour la préservation des cultures d'algues.
3.1.4. Hydrodynamisme
L'hydrodynamisme conditionne et accélère les
taux de diffusion des gaz et des nutriments entre la masse d'eau et les
différentes parties de l'algue, créant ainsi des conditions
environnementales favorables à la croissance rapide de Gracilaria
(Mensi et al., 2014). D'après Nagler et al.
(2003), l'hydrodynamisme est, généralement, trois à quatre
fois plus faible dans les bassins de culture que dans les lagunes, mais
l'échange eau-air reste presque au même taux. L'insuffisance de la
lumière et du mouvement de l'eau limiteraient la croissance des algues.
Par exemple, les taux de croissance de G. parvispora étaient
beaucoup plus faibles dans les bassins (2,6 % jour-1) que dans une
lagune (8-10 % jour-1) (Nagler et al., 2003) ; lorsque les
nutriments étaient suffisants, le débit d'eau devenait donc un
facteur limitant la croissance des thalles de G. parvispora (Ryder
et al., 2004). En général, le mouvement de l'eau exerce des
effets importants sur la croissance de Gracilaria. Ces effets ont
été largement rapportés par Ryther et al. (1983)
qui ont démontré que l'aération périodique
était aussi efficace que l'aération continue.
L'aération présente des effets
bénéfiques sur les algues qui peuvent être attribués
aux facteurs suivants : elle augmente l'efficacité de la
photosynthèse en faisant pivoter les algues de manière à
ce qu'elles soient en mesure de maximiser l'absorbance de la lumière
plutôt que de présenter un degré élevé
d'auto-ombrage ; elle augmente les taux d'absorption des nutriments en
réduisant les couches limites de diffusion ; elle augmente la
disponibilité des gaz métaboliques (CO2, O2), en facilitant la
circulation des éléments nutritifs et du dioxyde de carbone entre
la masse d'eau et les différentes parties de l'algue ; et elle
élimine aussi les épiphytes qui se fixent sur l'algue (Mensi
et al., 2014).
Chez Gracilaria, le mouvement de l'eau affecte d'une
manière significative la croissance et la sporulation pour des vitesses
allant jusqu'à 13 m.s-1 (Ryder et al., 2004). Des
travaux antérieurs ont montré que les déplacements des
masses d'eau ont une répercussion sur la composition biochimique de
l'algue. En effet, plus il ya des turbulences, moins il y a des alginates
(Weisner et al., 1997).
18
3.2. Facteurs biotiques
Dans les zones inter et subtidales, la distribution et
l'abondance, ainsi que la croissance des gracilaires sont également
contrôlées par des facteurs biotiques. Ces facteurs peuvent
être bénéfiques comme ils peuvent être
néfastes pour Gracilaria.
La biocénose des macroalgues jouent un rôle
essentiel dans la bande côtière de la mer
Méditerranée (Vázquez-Luis et al., 2008), en
particulier en tant que producteurs primaires et en tant qu'habitants,
fournissant de l'espace, un abri et de la nourriture à l'épifaune
associées (Nyberg et al., 2009). Selon Lutz et al.
(2010), les principaux facteurs biologiques, physiques et chimiques qui
influencent la structure de la communauté épifaunale
associée aux macroalgues incluent la morphologie des algues (Schmidt et
Scheibling, 2007), les environnements chimiques (modifications des niveaux
d'oxygène dissous et du pH), la disparition des habitats (Arponen et
Bostrom, 2011) et le statut d'attachement, la disponibilité et la
qualité (richesse en nutriments) des algues ou des épiphytes
associées en tant que source de nourriture (Sotka, 2007).
Les gracilaires hébergent divers assemblages de petits
herbivores, dominés par des annélides (vers polychètes),
des arthropodes (crustacés), des échinodermes (oursins) et des
mollusques (bivalves et gastéropodes).
3.2.1. Annélides
Les annélides sont des vers marins avec un corps
segmenté comme celui des vers de terre. Ils se divisent en trois classes
essentielles selon la présence ou l'absence de soies jouant le
rôle de pattes : les polychètes (nombreuses), les
oligochètes (rares) et les achètes (absentes) (Csakb, 2013). Les
polychètes sont divisés selon leur mode de vie en deux grands
groupes, les polychètes errants qui nagent et les polychètes
sédentaires qui passent leur vie dans un tube qu'elles
sécrètent à partir de matériaux spécifiques
(Ben Mustapha et al., 2016).
D'après Gillet (2017), Un total de 884 espèces
d'annélides a été décrites dans les zones
côtières et profondes de la méditerranée dont 375
espèces ont été marqué en Tunisie. Environ 10
espèces habitent les lagunes et 40 dans les milieux à la fois
marin et lagunaire. Les polychètes sont significativement plus abondants
dans les zones colonisées par les gracilaires. Elles vivent dans des
tubes mucilagineux fixés aux algues et consomment les diatomées
et les petites algues filamenteuses (Hay et al., 1988). Gracilaria
est connu comme un « ancien
19
habitat » qui interagit de manière
écologique avec la faune autochtone (Thomsen et McGlathery, 2005)
crée des habitats pour des annélides associés (Thomsen
et al., 2006). Les espèces Polyophtalamus pictus,
Pseudonereis anomala, Streblosoma persica, Syllis krochnii, S.
prolifera, Thelepus plagiostema (James et al., 1986),
Platynereis dumerilii et Nereis diversicolor (Hay et al.,
1988) sont les principaux polychètes qui se trouvent au niveau des
thalles des gracilaires (G. edulis, G. tikuahiae et G.
vermiculophylla).
Les annélides associés aux gracilaires ont aussi
un rôle dans la prédation et dans la compétition. Joseph
(1978 a) a montré que l'alimentation par les algivores mentionnés
au-dessus entraîne la destruction partielle ou totale des frondes de
Gracilaria et la quantité de dommages causés aux pointes
de croissance des algues est énorme. Le même auteur (1978 b) a
montré que les habitudes alimentaires influent aussi sur la distribution
des gracilaires. Selon lui (1978 b), G. edulis est l'une des algues
préférées des polychètes comme aliment, mais elle
est moins préférée que Padina, Codium, et
Dictyota (Hay et al., 1988). Il est évident que ces
organismes se rassemblent autour des algues pour se nourrir ou s'abriter, ou
les deux, sans pour autant s'attaquer directement aux algues (James et
al., 1986).
3.2.2. Arthropodes
Les arthropodes représentent le groupe animal le plus
abondant du monde marin. Ils possèdent un squelette externe et bougent
grâce à l'articulation de pièces rigides. Les
crustacés font partie des arthropodes et se distinguent grâce
à la présence de deux paires d'antennes (Chabot et Rossignol,
2003). En Tunisie, les arthropodes comptent environ 120, 27 et 24
espèces respectivement dans les golfes de Tunis, de Hammamet et de
Gabès (Afli et al., 2005). Selon Hauxwell et al.
(1998), les crustacés colonisent généralement les
lagunes, les rivières, les estuaires, les étangs et les mers.
Selon Arrontes et Anadón (1990), les crustacés
sont des constituants normaux de la faune qui habitent les macroalgues. Une
analyse des échantillons de faune prélevés sur des
gracilaires cultivées (G. edulis, G. foliifera, G. compressa, G.
debilis, G. tikvahiae, G. graciliset G. vermiculophylla) a
montré que des crustacés isopodes à savoir : Idotea
balthica (Nicotri, 1977), Paridotea reticulata (Anderson et
al., 1998), Erichsone et Edotea (Hauxwell et
al., 1998) ; des crustacés amphipodes tels que :
Microdeutopus gryllotalpa (Heckscher et al., 1996), Jassa
falcata (Anderson et al., 1998), Ampithoe longimana, Gammarus
mucronatus, Elasnurpus levis (Hauxwell et al., 1998) et
Gammarus insensibilis (Mancinelli et
Rossi, 2001) ; des crustacés décapodes
: les crabes Thalamita crenata, T. Integra et les genres
Plagusia, Charybdi (James et al., 1986),
Palaemonetes et Crangon (Mancinelli et Rossi, 2001) et autres
copépodes sont associés au Gracilaria. Cependant, Afli
et al. (2009) ont montré que l'isopode Idotea balthica
est l'espèce dominante, en particulier au printemps et au
début de l'été, habitant Gracilariopsis
longissima, G. bursa-pastoris et G. vermiculophylla.
Malgré de nombreux changements écologiques au cours des
dernières décennies dans la lagune de Bizerte, elle reste
l'espèce dominante.
Selon Arrontes et Anadón (1990), les crustacés
ont une grande variété d'habitudes alimentaires : carnivores ou
omnivores et parfois détritivores. Ainsi, les algues font partie, avec
une faible proportion, de régime alimentaire des espèces de la
zone côtière (Anonyme, 2016). Les crustacés associés
au Gracilaria peuvent exercer des pressions de pâturage pouvant
modifier la dominance des espèces de macroalgues.
Les isopodes qui se trouvent dans les lagunes et les estuaires
en associations avec Gracilaria peuvent présenter des effets
importants sur la productivité, la biomasse et la structure des thalles
de l'algue. En effet, de forts taux de pâturage de G. vermiculophylla
par Idotea balthica ont été signalés par
Weinberger et al. (2008). Selon Nicotri (1977), le
pâturage par cet isopode entraîne une réduction importante
de la productivité de G. foliifera lorsque les populations de
crustacés sont abondantes et la productivité algale est faible.
De même, elle provoque de forte diminution d'environ 31,8% de la biomasse
humide de l'espèce hôte (Shacklock et Doyle, 1983). Gracilaria
peut être considérée comme un aliment de
prédilection pour les isopodes. En effets, des forts taux de
pâturage de G. gracilis par l'isopode Paridotea reticulata
ont été observés lorsque des populations de
l'épiphyte Ceramium diaphanum atteints de faibles
densités (Anderson et al., 1998).
Les herbivores non seulement choisissent de manière
sélective les différentes sources de nourriture proposées,
et les preuves suggèrent que le pâturage peut aussi cibler une
partie spécifique du thalle d'algues (Smit et al., 2003). Par
exemples, Idotea balthica préfère les branches apicales
de G. gracilis et de Gracilaria sp. ce qui délimite la
structure du thalle (Cruz-Rivera et Hay, 2001). Aussi, Paridotea reticulata
qui se trouve en abondance au cours de l'été, consomme
fortement les sommets des thalles de G. gracilis ce qui entraîne
une réduction importante de la croissance et de la production algale.
Une étude a admis que cette préférence pour les branches
latérales est probablement due à la différence de
ténacité entre
20
21
les branches latérales et l'axe principal (Smit et
al., 2003). D'autres études ont montré que la
préférence pour certaines algues est corrélée aux
concentrations tissulaires d'azote (N) (Kraufvelin et al., 2006).
Les amphipodes aussi qui se trouvent en association avec les
gracilaires peuvent grandement influencer la biomasse des algues. Nicotri
(1977) a émis l'hypothèse que le pâturage peut affecter de
manière marquée la croissance des algues si les amphipodes ne se
nourrissent que de certaines parties du thalle, telles que les
extrémités de croissance contenant les méristèmes
apicaux (Smit et al., 2003). Mancinelli et Rossi (2001) ont
étudié les préférences alimentaires de Gammarus
insensibilis et ses effets sur la biomasse de G. gracilis. Ils
ont constaté que cette espèce manifeste une nette
préférence pour les structures apicales et les
extrémités coupées de G. gracilis, ce qui
entraine une réduction de 13,9 % de la biomasse humide de cette
espèce hôte.
Ces organismes peuvent choisir les aliments en se basant sur
des indices chimiques (nutrition) et/ou sur la morphologie des macroalgues
(Heckscher et al., 1996). La sélection des aliments par les
amphipodes est clairement corrélée à la teneur en azote ;
Microdeutopus gryllotalpa a montré une préférence
significative même lorsque les différences de teneur en N est
aussi faibles que 0,7 % (Galàn Jiménez et al., 1996). La
préférence ne peut pas être uniquement due à la
teneur en N ; d'autres signaux chimiques peuvent être
corrélés à la teneur en N des macroalgues et peuvent
également être importants pour les herbivores. Heckscher et
al. (1996) ont trouvé dans des expériences similaires sur
l'agar consistant à comparer les préférences alimentaires
de M. gryllotalpa entre Cladophora vagabunda (4,5 % de N) et
G. tikvahiae (2,1 % de N), que G. tikvahiae est le
préféré ; dans ce cas, un signal chimique en plus de la
teneur en N influe sur la palatabilité. Par conséquent, il est
probable que, en l'absence de signaux morphologiques, l'N ainsi que des
composés défensifs déterminent les
préférences alimentaires des herbivores.
La morphologie et le volume du thalle sont aussi des facteurs
importants expliquant la hiérarchie de préférences. En
effet, la plus forte densité d'amphipodes a été
trouvée sur les macroalgues ramifiées ; (Fukunaga et
al., 2014) Où, Galàn Jimenez et al. (1996) ont
observé que M. gryllotalpa construit davantage de tubes dans
les algues filamenteuses vivantes. De même, Cruz-Rivera et Friedlander
(2011) ont montré que l'amphipode Ampithoe ramondi
22
possède des pièces buccales pouvant trancher
beaucoup plus la surface de G. lemaneiformis que celles de
Gracilaria conferta ou de Gracilaria cornea.
Les crabes sont des décapodes qui se nourrissent
préférentiellement d'herbiers. Stachowicz et Hay (1999) ont
montré que le crabe Libinia dubia a consommé des
quantités considérables d'Hypnea et de G.
tikvahiae, avec davantage d'Hypnea que de Gracilaria ;
dans ce cas, Gracilaria peut être considéré
comme aliment de préférence inferieure pour les crabes. Ces
préférences ne sont pas liées au contenu nutritionnel des
algues. Mais elles sont liées aux volumes et au degré de
ramification du thalle. Une étude a montré que G.
conferta, la plus préférée, et G. lemaneiformis
sont deux espèces finement ramifiées qui peuvent être
facilement coupées par les chélas d'Acanthonyx
lunulatus. En revanche, G. cornea est plus large et
ramifiée plus grossièrement, ce qui rend plus difficile la
manipulation de cette algue par les crabes (Cruz-Rivera et Friedlander, 2011).
Il s'est avéré que les crabes s'associent autour des algues pour
se nourrir ou se mettre à l'abri, ou les deux, mais ne se nourrissent
pas directement des algues. Une étude a montré que la coupe par
les crabes ne peut pas expliquer la quantité énorme de dommages
causés aux pointes de croissance des algues (James et al.,
1986).
3.2.3. Echinodermes
Les herbivores marins, en particulier les échinodermes,
jouent un rôle clé dans l'organisation et le fonctionnement des
communautés benthiques marines. Ces organismes présentent une
symétrie pentamérique unique dans le règne animal et ont
un corps entouré d'ossicules calcaires portant des épines (Chabot
et Rossignol, 2003). Cet embranchement comprend les crinoïdes, les
astérides (étoiles de mer), les holothurides, les
échinides (oursins) et les ophiurides (Ben Mustapha et al.,
2016). Les échinodermes peuvent se déplacer de façon plus
ou moins aisée et rapide selon les espèces sauf les
crinoïdes fixés.
Ces organismes sont abondants dans toutes les mers, aussi bien
dans les eaux côtières que dans les grands fonds. On compte
environ 7000 espèces d'échinodermes dans le monde dont 21
espèces sont présentes en Tunisie. Leur taille varie de quelques
centimètres à plus d'un mètre (Bouchard, 2004). Selon Hay
(1981), les oursins (échinides : Diadema, Echinomnetra
et Eucidaris), présents en abondance sur le récif,
sont rares dans l'habitat des plaines sablonneuses où Gracilaria
est abondante. Deux espèces d'oursins courantes des
communautés rocheuses (Diadema setosum et Heliocidaris
erythrogramma) ont été signalés
23
par Shunula et Ndibalema (1986) sur les bancs de sable en
association avec G. crassa. De même, un oursin Tripneustes
sp. a été observé près du site
expérimental de culture d'algues rouges (Ganesan et al., 2006).
L'analyse d'échantillons de faune prélevés sur des algues
cultivées (G. edulis) a montré que quelques holothuries
sont associées aux algues.
On trouve tous les types de régimes alimentaires chez
les échinodermes. La plupart des oursins sont omnivores, ils se
déplacent lentement et raclent les rochers pour arracher les algues et
les petits invertébrés à l'aide de cinq dents dures. Les
étoiles de mer se nourrissent de Mollusques, de Crustacés et
d'Ophiures, etc. ainsi que les ophiurides se nourrissent de plancton (Bouchard,
2004). Les oursins ont connu une croissance variable en fonction de
l'alimentation. Ils ne se nourrissent pas de tous les rhodophytes au même
taux, et montrent même des préférences entre les
espèces disponibles (Westbrook et al., 2015). Selon des essais
de laboratoire, Arbacia punctulata a consommé en moyenne
174-216 mg de G. foliifera / g d'oursins / 24 h (Hay et al.,
1986) et 44,3 ? 7,4 % de G. tikvahiae (Pfister et Hay, 1988). Ces
préférences sont fortement liées à la morphologie
et/ou à la qualité nutritionnelle des algues. Par exemple,
Tripneustes sp. a montré plus de préférence pour
les thalles de G. edulis (grossièrement ramifiés) que
pour celles de G. dura et de G. corticata (Ganesan et
al., 2006). De même, González et al. (1993) ont
étudié les effets de trois régimes algaux sur
l'énergie disponible (protéine) pour la croissance des
juvéniles de Loxechinus albus et ont découvert que les
oursins obtiennent la plus grande quantité d'énergie lorsqu'ils
se nourrissent de Gracilaria sp. En générale, les
juvéniles de L. albus se nourrissent de chlorophycée et
de phéophycée. Cependant, Francisco Cárcamo (2015) a
démontré que l'alimentation avec G. chilensis est une
alternative prometteuse pour le développement de ces
juvéniles.
Les forts taux de pâturage peuvent grandement influencer
la croissance, la dominance ainsi que la distribution des algues. Shunula et
Ndibalema (1986) ont montré que l'élimination des oursins
entraîne une augmentation de la densité et de la diversité
des espèces d'algues et peut conduire à l'apparition de grandes
algues formant le couvert forestier. Selon Ogden et al. (1973), le
pâturage des oursins est un facteur primordial des récifs
surexploités. Anderson et al. (1993) ont marqué la
disparition de tous les gracilaires greffés après un mois de
culture et la présence de nombreux oursins (Parechinus
angulosus) sur les restes des algues au fond du milieu de culture. Hay
(1981) a constaté que 13 % des individus de Gracilaria qui ont
été transplantés sur le récif ont montré des
signes de dommages causés par le pâturage des oursins.
24
3.2.4. Mollusques
L'embranchement des mollusques représente un groupe
d'animaux de formes très différentes. Ils regroupent les classes
des bivalves (moule, huitre et palourde), des gastéropodes (limace,
escargot), des céphalopodes (pieuvre, calamar, seiche) et des
polyplacophores (Chabot et Rossignol, 2003). Ses représentants habitent
principalement le milieu marin, mais certains groupes ont colonisé avec
succès les milieux dulcicoles et terrestres (Chaffai, 2014). Les
bivalves n'ont pas de tête définie et leur corps compressé
latéralement est enfermé dans une coquille constituée de
deux valves. Les gastéropodes présentent une tête bien
définie avec des yeux et des tentacules -sensoriels. Leur corps est
généralement enfermé dans une coquille univalve souvent
spiralée (Chabot et Rossignol, 2003). Dans la lagune de Bizerte, on
compte environ 93 espèces de mollusque réparties sur 3 classes et
41 familles (Belkhodja Mahjoub et al., 2007).
Environ 75% des mollusques ont été
signalés avec leurs coquilles colonisées par des algues. En
effet, les invertébrés (moules, coques et escargots) fournissent
un substrat pour l'attachement durable et l'incorporation des thalles,
augmentant très probablement la stabilité des populations locales
de Gracilaria (Thomsen et al., 2007). Par exemple, les
coquilles des gastéropodes Scurria araucana et S. cebrina
sont couramment utilisées par les algues comme substrat primaire
(Correa et al., 2000).
La très grande majorité des bivalves sont des
filtreurs et la plupart des gastéropodes sont des brouteurs ou des
prédateurs. Ces organismes s'enfouissent dans les sédiments,
vivent sur le fond marin, ou se fixent sur des rochers ou autres surfaces dures
(Chabot et Rossignol, 2003). Mancinelli et Rossi (2001) ont trouvé des
petits individus de bivalve sessile Mytilaster marioni et de
gastéropode Hydrobia sp. attachés au thalle de G.
gracilis. Aussi plusieurs animaux à savoir ; la moule bleue
Mytilus edulis et le gastéropode Pusillina sarsi ont
été trouvés en association avec G.
Vermiculophylla (Nyberg et al., 2009). Il s'est
avéré que ces mollusques s'associent autour des algues pour se
nourrir ou s'abriter, ou les deux, sans pour autant s'attaquer directement aux
algues (James et al., 1986).
L'herbivorie peut jouer un rôle important dans la
détermination de la faible diversité et de l'abondance des
algues. Par exemple, le développement rapide d'un gazon d'algues
à la surface des disques (à l'exclusion des mollusques) et
l'absence de la même algue à la surface rocheuse autour et
au-dessous des disques (en présence des mollusques) montrent
clairement
25
que la pression exercée par les mollusques est assez
élevée (Correa et al., 2000). Joseph (1978 a) a
observé que l'alimentation par les mollusques entraine la destruction
partielle ou totale des frondes d'algues. Il a observé que les habitudes
alimentaires influentes sur la distribution des algues (1978 b). Selon lui
(1978 b), G. edulis est l'une des algues
préférées des gastropodes (Pyrène
versicolor, Aplysia benedicti et A. leneolata) et de
bivalve Modiolus striatus comme aliment.
Ces méso-herbivores ont été
signalés comme nuisibles dans la culture d'algues (Hansen et
al., 2006). Anderson et al. (1993) ont observé la
disparition de tous les gracilaires greffés en un mois et l'apparition
de nombreuses patelles Dendrofissurella scutellum et quelques
Fissurella mutabilis sur les restes des algues au fond de site de
culture. Le même auteur (1993) a démontré à partir
d'une expérience que les patelles Dendrofissurella
capturées ont mangé une moyenne de 0,43 ? 0,06 g de
Gracilaria / 72 h. Cependant, les escargots et certaines patelles
présentant de petites aires d'alimentation ont moins d'impact sur la
productivité, la biomasse et la répartition des algues que les
macro-herbivores, à moins d'avoir des densités
élevées (Hay, 1992).
26
II. Matériel et méthodes
1. Présentation du site d'étude (Lagune de
Bizerte)
La lagune de Bizerte (Figure 6), située au Nord-Est de
la Tunisie à 59 Km de Tunis et 5 Km au sud de Bizerte, se
caractérise par une superficie d'environ 150 Km2 et une
profondeur maximale de 7-12 m. Elle communique au Nord avec la mer
Méditerranée par un chenal de navigation et à l'Ouest avec
le lac Ichkeul à travers l'oued Tinja. Elle constitue un bassin de forme
elliptique qui reçoit plusieurs cours d'eau (oueds El Merdj, Merazig,
Halima, Soula, Guenniche, El Hella, Djedara, Guennine, Ben Hassine, El Gouraya
et Tliba, etc.) (Figure 7).
Le climat de la région de Bizerte est de type
méditerranéen avec un été chaud et sec et un hiver
doux et pluvieux. La courantologie générale dans la lagune de
Bizerte est animée essentiellement par les vents Ouest et Nord-Ouest qui
balaient la surface de la lagune en accélérant la propagation
suivant la direction Ouest-Est le long de la côte Sud et Nord, un rappel
central s'établit ce qui explique l'accumulation au centre et dans le
canal de navigation des sédiments fins (Béjaoui, 2009). Il y a
dominance des substrats vaseux et par conséquent la turbidité
augmente et la lumière est d'autant plus atténuée dans la
partie centrale (Brahim et al., 2008). Ce schéma de circulation
favorise le renouvellement des eaux au niveau des rives Ouest, Sud et Nord et
une zone de faible circulation au centre et à l'Est de la lagune.
D'après Béjaoui (2009), la salinité
moyenne mensuelle de la lagune varie entre 34 psu (en hiver) et 36,5 psu (en
été) et les températures mensuelles sont comprises entre
11 °C (Janvier) et 29 °C (Août). Selon le même auteur, la
lagune se caractérise par des faibles concentrations en N total (entre
10,7 et 14,3 ìmol.L(-1)) et en P total (entre 1,1 en
été et 1,9 ìmol. L (-1) en hiver). En effet,
Les teneurs moyennes en ammonium et en nitrates varient de 0,7 à 2,3
ìmol. L (-1) et de 4,2 à 0,8 ìmol. L
(-1), respectivement. Quant aux phosphates, ses concentrations
oscillent entre 0,12 et 0,4 ìmol. L (-1).
La flore de la lagune de Bizerte comporte une cinquantaine
d'espèces. Au niveau de la région de Menzel Jemil, Djellouli
(1988) a dénombré 35 espèces (18 Rhodophycées, 12
Ulvophycées et 5 Phaéophycées) dont 26 nouvelles pour la
lagune de Bizerte et une nouvelle espèce pour la Tunisie. D'après
Ben Mustapha et Hattour (2016), cette flore est marquée par la dominance
de posidonie dont la couverture varie de 30 à 80 %. Les fonds rocheux
sont tapissés par des herbiers de Cymodcea nodosa (80 %),
de Caulerpa racemosa, de C. prolifera
27
et d'ulves vers les faibles profondeurs. Des travaux
effectués à l'INSTM (Ksouri et Ben Saïd, 1998) ont
porté sur la distribution des Gracilaires au niveau de la frange
comprise entre les rivages et l'isobathe (-3m). Il en ressort que les
Gracilaires (G. gracilis et G. bursa-pastoris) sont présentes
sous forme d'une bande entre Menzel Abderahmen et Oued Gueniche sur une
couverture de 384 ha.
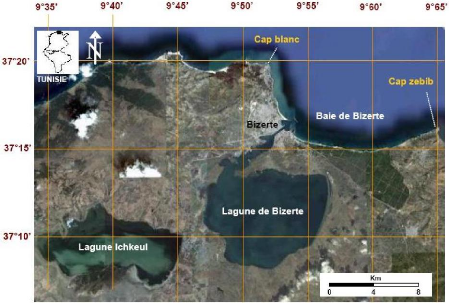
Figure 6: Image satellitaire montrant la
situation géographique de la lagune de Bizerte
(Boufahja, 2010).
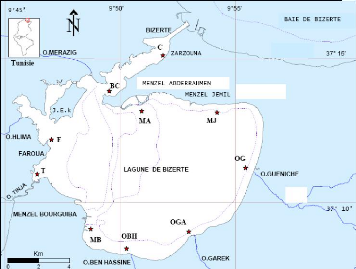
28
Figure 7: La lagune de Bizerte. Canal (C) ;
Baie des carrières (BC) ; Faroua (F) ; Oued Tinja
(T) ; Menzel
Bourguiba (MB) ; Oued Ben Hassine (OBH) ; Oued Garek (OGA) ; Oued
Gueniche
(OG) ; Menzel Jemil (MJ) ; Menzel Abderrahmen (MA) ; Jazira El Kebira
(J.E.K)
(Boufahja, 2010).
2. Préparation des touffes de Gracilaria
gracilis
Des touffes de Gracilaria gracilis en bon état
ont été collectées dans les peuplements naturels. La
collecte des touffes été effectuée manuellement au mois de
Mars 2019 de la lagune de Bizerte (37°22'33"N ; 9°91'63"E). Le site
de collecte est aussi celle de culture. La zone de collecte est
caractérisée par une profondeur variant de 0.5 à 1 m, une
salinité de 35 psu et une température de 17°C. Les algues
ont été transportées dans des bacs en plastiques
fermés pour éviter le séchage des thalles et de conserver
un environnement similaire à celui de la lagune afin de minimiser le
stress des thalles. Par la suite, les échantillons ont été
entreposés dans un bac contenant de l'eau de mer au laboratoire de
l'INSTM (Annexe 1.A), par la suite, débarrassées de leurs
éventuels épiphytes (Ulves, etc.) et épifaunes
(anémones, polychètes, étoiles de mer, mollusques,
amphipodes et isopodes) (Annexes 1.B et 2). Elles ont été
rincées à l'eau de mer et acclimatées pendant une semaine
dans des bacs en plastiques remplis avec de l'eau de mer ayant des
paramètres physicochimiques (O2 dissous, température et
salinité) similaires à celles de la lagune de Bizerte au moment
de la collecte. En prenant soin de bien immergés les thalles. Des
touffes de G. gracilis en bon état (Annexe1.C) ont
été sélectionnées ; c'est-à-dire ayant des
stades de développement similaires, de mêmes couleurs
29
et ayant des longueurs et des ramifications similaires avec le
même degré de pigmentation. Les thalles blanchâtres ont
été éliminés. Par la suite, elles ont
été bien débarrassées de leurs épiphytes et
épifaune.
3. Modalité de culture
Les touffes nettoyées, triées et
sélectionnées (Annexe 1.D) ont été essuyées
par un papier absorbant avant d'être pesées à l'aide d'une
balance ayant une précision de 0,1 g ; 96 touffes de 100 #177; 2 g ont
été attachées sur 3 cordes (C1, et C3) par un fil
tressé (Annexe 3). Par la suite, les cordes ont été
immergées dans des bacs en plastique contenant 2 m3 d'eau de
mer filtrée et enrichie avec de l'ammonium et du nitrate en attendant
leur transfert vers le site de culture. Un suivi journalier des
paramètres physico-chimiques (oxygène dissous, température
et salinité) a été effectué quotidiennement pour
chaque bac et suivi un renouvèlement total de la quantité d'eau
de chaque bac suivi d'un ajout de 70 mg/l du nitrate et de 32 mg/l d'ammonium.
Les bacs ont été munis par un système d'aération
permettant, aussi, de faciliter l'absorption des éléments
nutritifs grâce à un brassage continu (Annexe 4).
Pour le mode de culture, nous avons opté pour
l'utilisation d'un cordage tendu sur le substrat entre trois piquets de fer
(Figure 8). Les cordes restent à 50 cm de la surface de l'eau même
à marée basse. Chaque touffe constitue une unité
expérimentale. La distance entre les touffes est de 50 cm et celle entre
les rangées de cordages est de 75 cm. Pour cette expérimentation,
un entretien de culture a été réalisé une à
deux fois par semaine. Ce suivi a pour objectif de contrôler la
résistance mécanique des systèmes de culture, notamment au
niveau des fixations des cordes sur les piquets en fer. De même, le suivi
permet d'enlever les algues épiphytes, ce qui rend facile l'étude
de la relation de l'algue et sa faune associée uniquement. Au cours de
la période de culture qui est de 90 jours (Avril, Mai et Juin), trois
prélèvements ont été effectuées, soit une
corde par prélèvement (Figure 9. A). Cependant, le
prélèvement des touffes a été effectué
à l'aide de sacs en plastiques afin d'éviter l'effritement et
faciliter leur séparation. Les touffes d'algues ont été
coupées (Figure 9. B), retirées de la corde et placées
avec leurs éventuels faunes dans des sacs en plastique (une touffe par
sac) pour mesurer ensuite la masse de chaque touffe, évaluer le taux de
croissance de croissance spécifique, ensuite faire l'analyse
biochimique au laboratoire. Ainsi que, pour faire le tri et prélever
toute la faune associée à l'algue. Un suivi journalier de la
température a été effectué in situ durant
toute la période de culture, à l'aide d'une sonde
multiparamétrique. Alors que pour la mesure de la salinité (psu)
et le dosage des nutriments, ont été effectués par
quinzaine
30
(Figure 9. C). Le poids final de chaque touffe a
été déterminée et le taux de croissance
spécifique (TCS) est calculé selon la formule suivante (Glenn
et al., 1998):
TCS (%) = 100 ln ( poids final
poids initial) /Nombre de jours de culture
Enfin, 20 g de chaque touffe de G. gracilis ont
été prélevés, coupées,
numérotés et conservés à - 20°C pour faire les
analyses (Annexe 5). Le reste des touffes ont été stockés
dans les sacs en plastique pour étudier la faune associée.
4. Détermination de la composition biochimique de
Gracilaria gracilis
Des échantillons de 20 g ont été
décongelés puis séchés avec du papier absorbant. 1g
de cette biomasse fut broyé dans un mortier en présence de 20 ml
de tampon phosphate KH2PO4 de pH =6. Le broyat a été
homogénéisé à l'aide d'un vortex puis les extraits
ont été incubés dans un bain marie à 50°C
pendant 10 heures et filtrés à l'aide d'une membrane de 0.5 ?m de
diamètre. Le filtrat a été par la suite,
récupéré et centrifugé à 4000 rpm à
20°C pendant 15 minutes. Enfin, le surnageant a été
récupéré afin d'être utilisé pour le dosage
de la R-phycoérythrine (RPE), des protéines et des sucres
solubles (Annexe 6).
La teneur en protéines solubles a été
déterminée par la méthode de Bradford (Bradford, 1976)
(Annexe 7). C'est une méthode sensible et rapide. Ce dosage
détermine la concentration protéique basée sur une
réaction colorimétrique entre les protéines et le colorant
bleu de Coomassie G250. Ce réactif, rouge/brun à l'état
libre, prend une teinte bleue lorsqu'il se lie aux protéines et
possède un coefficient d'extinction molaire élevé dans le
visible (à 595 nm). La quantité de protéines Q (mg/g
d'algue fraiche), que renferme chaque échantillon a été
déterminée selon l'équation suivante : Q = 0.1*20*C. C
étant la concentration de protéines de l'échantillon,
dégagée à partir de la courbe d'étalonnage (Annexe
8).
Les teneurs de la RPE des différents
échantillons sont estimées par mesure de l'absorbance à
565 nm, longueur d'onde du maximum d'absorbance. Par ailleurs, les spectres
d'absorbance entre 450 nm et 600 nm de la phycoérythrine ont
été également établis. La loi de Beer-Lambert
établit l'absorbance à 565 nm par la formule suivante : A = ?
×I.×C1 = ? ×I.× / PM, Avec = A×260.000/ (2.106) =
0.13×A ; A : absorbance à 565 nm ; ? : coefficient d'extinction
molaire de la RPE ; l : longueur du trajet optique = 1 cm ; C1 :
31
concentration molaire en phycoérythrine (M) ; :
concentration massique en RPE (mg/ml) ; PM : poids moléculaire de la
RPE.
Les sucres hydrosolubles ont été
déterminés par la méthode colorimétrique
modifiée de Dubois et al. (1956) (Annexe 9). Les sucres
simples, les oligosaccharides, les polysaccharides et leurs
dérivés forment du furfural ou de l'hydroxylméthyl
furfural lorsqu'on les traite avec du phénol et de l'acide sulfurique
concentré. La réaction est sensible et la coloration
orangée est stable. On peut ainsi doser les glucides totaux par
spectrophotométrie (490 nm). La quantité de sucre Q' (mg/g
d'algue fraiche) que renferme chaque échantillon a été
déterminée selon l'équation suivante : Q = 1*20*C. C
étant la concentration de sucres de l'échantillon,
dégagée à partir de la courbe d'étalonnage (Annexe
10).
Pour déterminer la teneur de l'algue en matière
sèche (MS), 2 g de matière première fraîche
coupé en particules de 3 mm sont mises à sécher à
l'étuve durant une nuit à 60°C. La masse de l'algue est
prise avant et après le séchage jusqu'à masse constante.
Le taux de MS est calculé selon la formule suivante :
% MS = (Masse de l'échantillon après séchage
x 100) / Masse de l'échantillon avant séchage.
5. Identification et analyse de la faune
collectée
Les sacs contenant les touffes ont été
numéroté afin de réaliser le traitement, la conservation,
l'analyse et l'identification des animaux de chaque touffe. Les touffes
numérotées ont été trempées chacune dans de
petits réservoirs contenants de l'eau de mer. Ce trempage sert à
récupérer la majorité des individus qui se trouvent dans
l'eau. La quantité d'eau a été filtrée et
tamisée. Cette opération a été
répétée deux à trois fois, la majorité de la
faune a été ainsi récupérée. Les individus
restant attachés à l'algue ont été alors
enlevés manuellement. Par la suite, les animaux
récupérés ont été conservés dans des
boites en plastique en présence du formol neutre à 1 % pour
analyse et identification (Annexe 11).
La faune collectée, a été isolées
sous loupe binoculaire modèle MOTIC ST-30 SERIES pour leur
identification à l'aide des clés de détermination
spécifiques. La faune prélevée de chaque corde passe par
plusieurs étapes. La première étape concerne
l'identification de la faune associée. En effet, pour analyser la
structure taxonomique des peuplements, les données suivantes ont
été obtenues : embranchement, familles, genres et espèces.
La détermination de
32
ces données a été faite en se basant sur
les clés de détermination de Fauvel (2007), de Hibberd et Moore
(2009) et de Massimo Pandolfi (2010). La seconde étape concerne le
comptage des individus. En effet, le comptage des différents groupes
zoologiques a été effectué sous loupe binoculaire. La
troisième étape est le dénombrement d'individus pour
chaque embranchement et la détermination des fréquences.
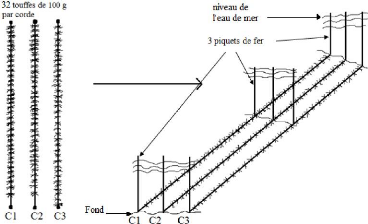
Figure 8: Système de culture des
touffes de Gracilaria gracilis sur corde tendu sur le
substrat
entre trois piquets de fer (Mensi et al., 2009,
modifié).

Figure 9: (A) Corde à prélever ;
(B) Coupe de touffe à l'aide d'un ciseau et (C) Flacon en
PVC
contenant 100 ml d'échantillon d'eau à analyser.
33
III. Résultats et discussion
1. Les paramètres physicochimiques
Au cours de la période de culture la température
moyenne de l'eau varie entre 16,50 #177; 1,70°C et 22,63 #177; 3,29°C
au cours de la période de culture (Figure 10). La salinité
moyenne de l'eau varie entre 34,6 psu et 35,4 psu au cours de la période
de culture (Tableau 1). A l'opposé, la Vitesse du vent au niveau du site
de culture montre une diminution significative (Figure 11). Et elle passe de
54,25 #177; 9,81 Km/h à 26,50 #177; 5,98 Km/h. Cette variation est de
l'ordre de 27,75 #177; 3,83 Km/h. On remarque que c'est au printemps, que les
vents les plus forts (entre 37,75 #177; 9,36 km/h et 57,75 #177; 14,76 km/h).
La concentration de l'ammonium diminue d'une manière significative et
elle passe de 94,40 #177; 9,75 ìM au mois d'Avril à 53,40 #177;
13,61 ìM au mois Juin (Figure 12). Quant aux nitrates, les formes les
plus stables de l'azote inorganique dissous, leurs concentrations augmentent au
cours de la période de culture et passent de 58,46 #177; 13 ìM au
mois d'Avril, à 105,68 #177; 14,46 ìM au mois de Juin (Figure
13).
La gamme de température enregistrée
été globalement très proche de celle signalée au
cours de la même période dans la lagune de Bizerte, la lagune de
Ghar El Melh et Lac Ichkeul (Béjaoui, 2009 ; Boufahja, 2010 ; Mahmoudi,
2003). En ce qui concerne la salinité sont proches de Béjaoui
(2009) pour la même période. Mais elles sont beaucoup
inférieures à celles signalés par Boufahja (2010) dans le
même milieu, La différence des résultats entre les auteurs
pourrait être expliquée par l'effet des facteurs
météorologiques qui varient d'une année à l'autre.
En effet, la lagune est sous influence de son bassin versant, qui apporte une
grande quantité d'eau douce, d'une part et sous l'influence de la
marée d'autre part. Ceci entraîne un brassage lent de la masse
d'eau douce avec l'eau salée de la lagune, entrainant un dessalement des
eaux (Mitchell et al., 2007). L'échange important de la lagune
de Bizerte avec le méditerrané augmente la teneur en sel des eaux
de la lagune. Cependant, il se produirait durant la période allant du
Mai à Juin une incursion d'eaux marines vers la lagune à cause de
la rareté des précipitations et de la forte évaporation
(Mitchell et al., 2007). De ce fait, les valeurs élevées
de la température et de la salinité des eaux de surface de la
lagune qui s'associent à des faibles marées et des vents
classiquement peu fréquents et peu intenses à la fin du mois Mai
et au début de Juin confirment cette hypothèse.
34
En comparant les charges maximales en nitrates et ammonium,
nos valeurs sont proches de celles observées par Boufahja (2010) mais
nettement plus élevées que celles relevées par
Béjaoui (2009). Cette variation serait liée aux charges
polluantes contenues dans les eaux usées domestiques, dans les eaux de
lessivage des terres agricoles (culture de blé et d'orge...) et aux
conditions climatiques. Selon Boufahja (2010), les précipitations
augmentent le débit des rivières (l'oued de Guenniche) et des
fleuves qui se déversent dans la lagune. De même, les eaux douces
des pluies lessivent les terres et arrivent alors chargées en
matière minérale (nitrate, phosphate et silicate). Par ailleurs,
la dégradation et l'hydrolyse de ces produits chimiques par les
bactéries peuvent enrichir les eaux en azote. Ce fait rend facile
d'interpréter la concentration relativement élevée en
ammonium relevée en Avril (94,40 ? 9,75 uM). Ces hypothèses
s'accordent aussi avec les résultats de Mensi (2012) qui indique que les
sels nutritifs (ammonium et orthophosphates) dans la lagune sont
élevés. Généralement, les engrais phosphatés
ne sont appliqués dans les grandes cultures qu'au cours de la
préparation des sols, au mois d'octobre et novembre. Leur lessivage vers
le milieu lagunaire se fait progressivement au cours du temps (De Marco et
al., 2005 ; Marcovecchio et al., 2006).
Tableau 1: La salinité (psu) des eaux
de la lagune de Bizerte au cours de la période d'étude
(Avril,
Mai et Juin 2019).
Mois Avril Mai Juin
Salinité (psu) 34,6 35 35,4
S1 S2 S3 S4 S5 S6 S7 S8
Temperature (°C)
25
20
15
10
0
5
Semaines de culture
Figure 10: Variation de la température
(°C) des eaux de la lagune de Bizerte.
S1 S2 S3 S4 S5 S6 S7 S8
Vitesse (km/h)
40
70
60
30
20
50
10
0
Semaines de culture
35
Figure 11: Variation des vitesses du vent
(Km/h) dans la lagune de Bizerte.
|
150 130 110 90 70 50 30 10 -10
|
|
|
|
94,40613027
|
|
90,36015326
|
|
|
|
53,4068965
|
|
|
5
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Avril Mai Juin
|
Mois de culture
Ammonium (uM)
Figure 12: La concentration moyenne de
l'ammonium (?M) dans les eaux de la lagune de
Bizerte (Avril -Juin 2019).
140
120
105,68
78,04
58,46
Nitrate (uM)
100
40
80
60
20
0
Avril Mai Juin
Mois de culture
Figure 13: La concentration moyenne des nitrates
(?M) dans les eaux de la lagune de Bizerte (Avril - Juin 2019).
36
2. Croissance et composition biochimique du Gracilaria
gracilis
Dans les eaux de la lagune de Bizerte, le TCS
(%j-1) enregistre une baisse significative en fonction du temps. Il
passe de 5,60 #177; 0,94 % j-1 au mois d'Avril à 2,55 #177;
0,16 % j-1 au mois de Juin, avec une moyenne durant toute la
période de culture de l'ordre de 3,05 #177; 0,78 %j-1. Une
baisse sensible est observée entre le mois de Mai (3,29 #177; 0,70 %
j-1) et le mois de Juin (figure 14). La variation de la teneur en
sucres solubles (%) en fonction du temps est représentée par la
figure 15. Cette dernière montre une variation importante de la teneur
en sucres solubles au cours de la période de culture. La teneur la plus
élevée a été enregistrée au mois de Mai, qui
est égale à 48,86 #177; 9,16 %, alors que la teneur la plus
faible a été enregistrée au mois de Juin (34,12 #177; 8,74
%). En moyenne, la teneur en sucres solubles est de 39,46 #177; 9,92 %. Quant
à la teneur en protéines, une variation peu importante de sa
teneur d'Avril à Juin 2019 (Figure 16). Sa valeur varie d'une moyenne de
20,26 #177; 3,52 % (Avril et Mai) à 21,92 #177; 1,74 % au mois du Juin.
La variation de la teneur en R-phycoérythrine en fonction du temps,
exprimée en mg.g-1 est présentée par la figure
17. La teneur moyenne de RPE, produite après 90 jours de culture varie
entre 1,43 #177; 0,62 et 2,35 #177; 0,82 mg.g-1.
Les valeurs du TCS sont supérieures à ceux
obtenus par Ksouri et al. (2006), Santelices et Doty (1989), Largo
et al. (1989) et Kim (1970). En effet, pour une durée de
culture similaires (30 jours), le TCS moyen de G. gracilis auquel a
conduit notre étude est de l'ordre de 5,60 #177; 0,94 %j-1
alors que pour celle de Ksouri et al. (2006) n'atteigne pas le 1
%j-1 ainsi que ceux mentionnés par Kim (1970) et Largo et
al. (1989) dont les valeurs varient de 4,29 à 4,95 %j-1.
Par contre, nos résultats sont similaires à ceux de Ksouri et
al. (2008) dans le même milieu et avec la même méthode
de culture (4 %j-1). La différence entre les résultats
pourrait être attribuée à la richesse du milieu en
nutriments, la température et la salinité (Marinho-sorino et
al., 2006). Selon Choi et al. (2006) et Yang et al.
(2006), la plupart des espèces de Gracilaria se
développent bien quand la température est supérieure ou
égale à 20 °C. Dans notre étude l'algue s'est bien
développée car la température a été
favorable (16,50 #177; 1,70°C à 22,38 #177; 4,03°C). Nos
résultats concordent avec ceux de Mensi et al. (2012) qui
montrent que G. gracilis s'est bien développé à
une température comprise entre 15 et 26°C et qu'au-dessus de
30°C la croissance chute et il y a dégénérescence des
thalles de l'algue. De même, nos résultats, sont proches de ceux
mentionnés par Yang et al. (2015) pour G. lemaneiformis
(12 à 23°C) et Ksouri et al. (2008) pour G.
gracilis. La température et la salinité sont
considérées comme deux facteurs fondamentaux qui contrôlent
la croissance saisonnière dont il est
37
difficile de séparer leurs effets. L'algue G.
gracilis semble capable de supporter une large gamme de variation des
salinités (Cirik et al., 2006 ; Turan et al., 2006).
D'après le tableau 2, les valeurs obtenues au cours de notre travail et
qui sont comprises entre 34,6 et 35,4 psu, correspondent à celles
signalées par Simonetti et al. (1970) et McLachlan et Bird
(1985). De même, une croissance optimale entre 25 et 42 psu et une bonne
croissance avec des salinités comprises entre 5 et 23 psu sont obtenus
par Cirik et al. (2010) et Simonetti et al. (1970). Une nette
diminution de la croissance à des salinités qui varient entre 18
psu et 25 psu et une chute lorsque la salinité est inférieure
à 15 psu (Munda, 1978 ; Mensi et al., 2014).
L'ensemble des éléments nutritifs constitue un
facteur abiotique clé en relation avec les autres paramètres
environnementaux, qui influencent la croissance des algues (Harrison et Hurd,
2001). Dans notre expérience avec des taux en ammonium et en nitrates
respectivement de 94,40 ? 9,75 ?M et de 58,46 ? 13 ?M en Avril, G. gracilis
présente un TCS maximale. Cependant, lorsque les teneurs en
NH4+ diminuent et celles de NO3- augmentent, le TCS de
Gracilaria chute. Nos résultats s'accordent avec ceux de
Hanisak (1978) qui montre qu'un ajout continu de nutriments maximiserait la
croissance. Dans notre étude, la chute progressive de la teneur en
ammonium dans les eaux de la lagune entre Avril et Juin, est accompagnée
par une diminution du TCS. Ceci montre que G. gracilis a une nette
préférence pour l'ammonium par rapport aux nitrates. Nos
résultats concordent avec celui de Smit (2002) qui indique que cette
préférence peut être expliquée par le fait que
l'ammonium présente l'avantage sur les autres formes d'azote
d'être assimilé sans réduction au préalable. De
même la vitesse du vent qui diminue au cours de la période de
culture et par conséquent la diminution de la turbidité de l'eau
et du déplacement de la masse d'eau affecte la croissance de l'algue.
Ces observations sont en concordance avec celles de Mensi et al.
(2014) qui indiquent que le déplacement des masses d'eau et la
turbulence provoquée par les vents sont d'importants facteurs
susceptibles d'influencer l'absorption des éléments nutritifs et
cela en augmentant la surface de contact des thalles, ce qui améliore la
croissance et le développement de l'algue.
Le risque de pertes de touffes est un problème majeur
auquel se heurte la culture de Gracilaria sur corde. Durant toute la
période d'expérimentation, les pourcentages de perte des touffes
sont 25 %, 62,5 % et 68,75 % pour les mois d'Avril, Mai et Juin respectivement.
Ces valeurs sont similaires à celles de Ksouri et al. (1999)
qui indiquent une valeur de 54 %. Cette valeur élevée pourrait
être attribué au fait que les thalles de Gracilaria gracilis
étant fragiles, se détachent de la corde, sous l'effet
mécanique de brassage par les mouvements de l'eau. Ces
38
pertes sont aussi liées à des difficultés
d'insertion des touffes sur les cordes (Ksouri et al., 1999), à
l'épiphytisme (Fletcher, 1995) et à la faune associée
contenant plusieurs groupes zoologiques exploitant le genre Gracilaria
comme source de nourriture préférée (Smit et al.,
2003 ; Hansen et al., 2006). En conclusion, sous des conditions
de température (16,50 °C à 22,38 °C), de
salinité (34,6 à < 35 psu,) une vitesse de vent (50 à
55 km/h) et des teneurs en ammonium (94,40 ?M) et en nitrates (58,46 ?M), nous
obtenons des TCS acceptable dont la moyenne est de l'ordre de 5,60
%j-1.
Tableau 2: Croissance de Gracilaria
selon différente teneur en sel.
|
Bonne croissance
|
Croissance
maximale
|
Croissance
optimale
|
Chute de la
croissance Salinité létale
|
Munda (1978) > 18 psu 5-15 psu
Mensi (2014) 25- 30 psu > 25 psu
McLachlan et Bird (1985) > 30 psu
Simonetti et al. (1970) 5 à 23 psu = 30 psu
Cirik et al. (2010) 42 psu
La concentration moyenne en sucres solubles est proche de
celles enregistrée par Mensi et al. (2009) dans le même
milieu (34,10 #177; 0,15 %) avec la culture en mode suspendu de la même
espèce mais elle est nettement supérieure à celle
enregistrée par Nguyen (2017) sur la côte Atlantique (0,20 #177;
0,07 % MS). La différence entre les résultats pourrait être
due aux conditions du milieu. Cependant, en remarque qu'il y a une relation
entre la teneur en sucres solubles et la température de l'eau et la
salinité ainsi qu'avec la teneur en nitrate. En effet, d'avril à
mai lorsque la température, la salinité et la teneur en nitrate
augmentent, la concentration en sucres solubles augmente. Nos résultats
sont proches de ceux signalés par Burlot (2016) pour l'algue rouge
Solieria chordalis qui montre des corrélations positives entre
la teneur en sucres totaux et la température de l'eau (r = 0,49, p <
0,1) et la salinité (r = 0,47, p < 0,1).
Les teneurs de protéines sont proches de celles
trouvées par d'autres auteurs pour la même espèce
Gracilaria gracilis : 20-30 % (Mensi et al., 2009), 21,3 %
(Gómez-Ordóñez et al., 2010), 25,4 % (Marsham
et al., 2007) et 26 - 30 % signalés par Sfriso et al.
(1994) dans une partie polluée da la lagune de Venise en Italie.
Par contre, Ces teneurs sont beaucoup plus importantes que celles
enregistrées dans un milieu lagunaire peu pollué (Sfriso et
al., 1994) et
39
des milieux ouverts pour d'autres espèces de
Gracilaria et qui se situent entre 11 et 22 % (Morinho-Soriano et
al., 2006 ; Wen et al., 2006). La variabilité entre les
résultats peut s'expliquer par différents facteurs à
savoir la localisation géographique, les paramètres
physico-chimiques et environnementaux des milieux de culture et la saison de
récolte (Chye et al., 2017). Ceci est démontré
par Cirik et al. (2010) qui indiquent que les pourcentages de
protéines pour la culture de Gracilaria gracilis sous serre
varient selon les saisons. Les pourcentages les plus élevés de
protéines ont été trouvés en décembre (20,28
#177; 0,94 %) et les pourcentages les plus faibles ont été
enregistrés en mars (14,99 #177; 0,14 %). De plus, l'hypothèse
des effets des fluctuations des intensités lumineuses et des
températures qui caractérisent la lagune de Bizerte durant la
période de culture pourrait expliquer les fortes valeurs obtenues en
protéines. En effet, Mensi et al. (2009) notent que
l'augmentation de l'intensité lumineuse entraîne une augmentation
de la teneur en protéines brutes. La quantité d'azote dans la
lagune de Bizerte pourrait aussi être à l'origine des teneurs
élevés de protéines. Burlot (2016) indique que les fortes
pluies peuvent entrainer les nutriments azotés comme le nitrate et
l'ammonium. En effet, les protéines sont synthétisées
essentiellement à partir de l'azote que les algues
prélèvent de leur milieu. Durant notre expérimentation,
nous avons marqué de fortes teneurs en ammonium et en nitrate entre
Avril et Mai (figures 12 et 13). Ces observations s'accordent avec celles de
Mensi et al. (2009) qui indique que la variabilité entre les
résultats pourrait être due à la teneur en ammonium du
milieu qui est considéré comme étant un facteur limitant
très important et qui affecte positivement les teneurs en
protéines qui augmente avec l'élévation des concentrations
d'ammonium.
Les teneurs de R-phycoérythrine est supérieure
à ceux signalées par Mensi et al. (2009) pour le
même mode de culture sur corde tendue de G. gracilis dans la
lagune de Bizerte pendant une durée de 35 jours (0,86 ? 0,03
mg.g-1). Cependant, elle est nettement inférieure à la
valeur mentionnée par Francavilla et al. (2013) pour la
même espèce de G. gracilis (3,6- 7 mg) qui indiquent que
dans le milieu naturel, la teneur en RPE des algues rouges varie au cours de
l'année. Elle est maximale au printemps ; Une baisse sensible est
observée à partir du mois de Mai qui atteint un minimum à
la fin du mois de Juillet. Il parait que la variation de la teneur en RPE
pourrait être liée aux plusieurs facteurs tels que la
lumière, la température, les nutriments et le régime du
courant d'eau. Selon Mensi et al. (2009), les facteurs abiotiques de
milieu de culture, excepté la salinité, affectent
négativement la teneur de la R-phycoérythrine du G.
gracilis. Selon et Jing-Wen et Shuang-lin (2001), la forme et la
concentration de l'azote dans le milieu ainsi que l'interaction de cet
élément avec la lumière affectent les teneurs en R-
40
phycoérythrine de certaines espèces de
Gracilaria. Cependant, Nguyen (2017) montre que la concentration en
R-phycoérythrine est plus élevée en Janvier qu'en Octobre
dont elle chute de plus de la moitié. Cependant, cette baisse est due
à une destruction de la phycoérythrine suite à
l'augmentation de l'intensité lumineuse et aussi à la baisse de
la biosynthèse du fait de l'appauvrissement du milieu en ressources
azotées et de l'augmentation de la température des eaux.
Avril Mai juin
mois de culture
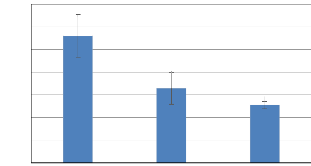
TCS (%.j-1)
4
7
6
3
2
0
5
1
5,60
3,29
2,55
Figure 14:Variation du taux de croissance
spécifique (TCS%.j-1) de Gracilaria gracilis
(Avril-Juin 2019).
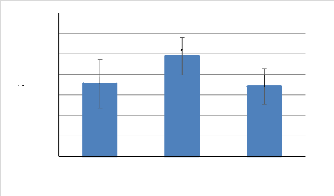
Sucre soluble(%)
70
60
50
40
30
20
10
0
35,42
34,12
48,86
Avril Mai Juin
mois de culture
Figure 15: Variation de la teneur en sucres
solubles (%) de Gracilaria gracilis (Avril-
Juin 2019).
Avril Mai Juin
mois de culture
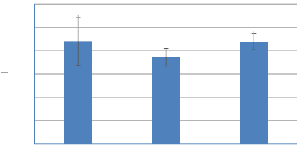
Proteines (%)
30
25
20
15
10
0
5
21,96
21,92
18,57
41
Figure 16: Variation de la teneur en
protéines (%) de Gracilaria gracilis (Avril-Juin
2019).
Avril Mai Juin
mois de culture
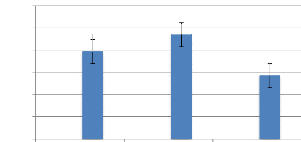
R-Phycoérythrine (mg.g-1)
2,5
0,5
1,5
3
2
0
1
2,35
1,97
1,43
Figure 17: Variation de la teneur en
R-phycoérythrine (mg.g-1) de Gracilaria
gracilis
(Avril-Juin 2019).
3. La faune associée à Gracilaria
gracilis
Au cours de nos analyses et identification de la faune
collectée à partir des touffes de Gracilaria gracilis
six groupes zoologiques ont été identifiés (Figures
18, 19 et 20). Ces groupes sont les crustacés amphipodes, les
crustacés isopodes, les mollusques, les cnidaires, les annélides
polychètes et les échinodermes. Les crustacés amphipodes
sont moins fréquents en Juin qu'en Avril et Mai alors que les autres
groupes sont de plus en plus fréquents au cours du temps. Les
fréquences des annélides et des échinodermes sont faibles
au cours de la période de culture et qui ne dépassent pas les 2
%. Les crustacés isopodes sont toujours les plus abondants durant les
deux mois, (65 % en Avril et 77 % à Mai) suivis par les crustacés
amphipodes (26 % en Avril et 18 % à Mai). Le groupe le moins important
est celui des
42
échinodermes (0,2 %). Les crustacés isopodes
sont dominés par les Idoteidae et les Sphaeromatidea. En Juin (Figure
20), la fréquence des crustacés amphipodes collectés est
beaucoup plus faible que celle déterminée durant les autres mois
(au printemps). En effet, on a récolté 86 individus avec un
pourcentage de 5,36 %.
L'étude des proportions globales relatives aux
différents groupes dans les différentes périodes de
prélèvement des cordes met en évidence une dominance nette
des crustacés isopodes (65 %, 77 % et 67 % pour le mois d'Avril, Mai et
Juin respectivement), suivis par les crustacés amphipodes, les
mollusques, les cnidaires, les annélides et les échinodermes avec
une très faible différence entre les fréquences des quatre
derniers groupes durant les deux premiers mois. Ces herbivores qui vivent en
association avec Gracilaria se reproduisent rapidement au milieu des
algues cultivées et parviennent à constituer de véritables
colonies (Perez, 1992). Nos résultats semblent être très
voisine à ceux de Zaabar et al. (2017) qui ont trouvé un
total de 4280 individus de crustacés dans la lagune de Bizerte
appartenant à deux familles ; Idoteidea et Sphaeromatidea dont
Idotea balthica est l'espèce dominante (61 %). Cependant,
Prunus et al. (1978), en étudiant la faune de la station de
Menzel Jemil, signalent qu'elle est de type marin très marqué et
qu'elle comporte un grand nombre de crustacés souvent
représentées par des arthropodes. Par ailleurs, Zaouali (1980)
signale l'abondance des gammaridés et des Idoteidés dans
l'infralittoral de la lagune de Bizerte. Dans notre étude,
l'espèce Idotea balthica est toujours la dominante durant les
trois mois. Nos résultats sont en concordance avec ceux d'Afli et
al. (2009) et Zaabar et al. (2017) qui indiquent que l'isopode
Idotea balthica est l'espèce dominante, en particulier au
printemps et au début de l'été, et qui utilise
Gracilaria sp. comme habitat. De même, nos résultats sont
proches de ceux de Mancinelli et Rossi (2001) qui ont signalé la
dominance des isopodes (Idotea balthica), des gammaridés
(Gammarus insensibilis) et des bivalves qui représentaient
ensemble 91,1 ? 2,8 % des organismes échantillonnés sur les
thalles de Gracilaria gracilis dans la Lagune de Lesina.
Concernant les crustacés amphipodes, nos
résultats sont similaires de ceux de Fukunaga et al. (2014) qui
ont prouvé que leur nombre diminue suite à la diminution de la
biomasse de Gracilaria et qui pourrait être due à leur
comportement alimentaire en tant que brouteur. Les crustacés isopodes
sont toujours les plus abondants durant les trois mois. Molloy (1992) a
également trouvé d'importants isopodes associés à
G. gracilis dans la lagune de Luderitz en Namibie, où elles
représentaient plus de 20% du poids total de l'échantillon au
cours de l'été.
43
Quant aux mollusques et cnidaires, leurs fréquences
augmentent respectivement de 6,40 % et 2,17 % (Mai) à 22,69 % et 5,67 %
(Juin), alors que les annélides et les échinodermes ont
totalement disparus vers la fin du mois de Juin.
Le nombre des mollusques, des cnidaires et des isopodes
augmente durant le mois Juin pourraient être liées d'une part au
cycle vital des taxons considérés, d'autre part, aux fluctuations
des conditions environnementales qui agissent sur les préférences
écologiques de ces groupes (Dufour et al., 2007). Cependant,
ces facteurs biotiques ne dépendent pas forcément du mois de
l'année ou encore de l'heure de la journée, bien que des
études ont mis en évidence des interactions entre les facteurs
biotiques et abiotiques (Vairappan, 2006). Par exemple dans notre étude,
en juin, en présence de lumière et à des
températures extrêmes, la rhodophyte Gracilaria gracilis
blanchit et se décompose. Durant cette période, beaucoup
d'herbivores à savoir les crustacés isopodes, les mollusques et
les cnidaires ont été observés. Au cours du temps, ces
invertébrés marins se nourrissant des épiphytes et
d'algues sont alors plus nombreux. Cependant, dans notre expérience, des
signes de pâturage ont été marqués sur les thalles
de G. gracilis. Selon James et al. (1986), ces herbivores se
rassemblent autour des algues pour se nourrir ou s'abriter, ou les deux, sans
pour autant s'attaquer directement aux algues. En ce qui concerne les
crustacés amphipodes leurs nombres diminuaient avec la diminution de la
biomasse de Gracilaria. Une telle différence de nombre des
amphipodes pourrait être due à leur comportement alimentaire en
tant que brouteur ou à leur cycle de vie. Il est plus difficile de
prévoir l'impact de cette faune sur le TCS de G. gracilis. Leur
étude nécessite des observations sur le long terme, aussi bien
sur le terrain qu'en laboratoire.
65%
6% 2%
0,21%
1%
26%
Annelides Amphipodes Isopodes Mollusques Cnidaires
Echinodermes
44
Figure 18: Fréquence des
différents groupes zoologiques rencontrés en Avril 2019
77%
2%
3%
0,04%
0,04%
18%
Annelides Amphipodes Isopodes Mollusques Cnidaires
Echinodermes
Figure 19: Fréquence des
différents groupes zoologiques rencontrés à Mai 2019.
6%
23%
5% 66%
Amphipodes Isopodes Mollusques Cnidaires
Figure 20 : Fréquence des
différents groupes zoologiques rencontrés en Juin 2019.
45
4. Interaction de Gracilaria gracilis et sa faune
associée
Pour étudier l'interaction faune associé et
G. gracilis, nous avons choisi de focaliser notre étude sur
l'isopode (Idotea balthica) et l'amphipode (Gammarus sp.),
les espèces les plus abondants dans nos échantillons. On remarque
des corrélations positives entre les fréquences des isopodes
(Idotea balthica) et les différentes réponses
étudiées au cours des mois de Mai (TCS, sucre soluble et
protéines) et Juin (RPE) (Tableau 3). Par contre on remarque qu'il y a
une corrélation négative entre la fréquence des isopodes
et la teneur en matière sèche et les protéines en Avril et
avec la teneur de l'algue en sucre au mois de Juin. Cependant, la
fréquence de l'espèce Idotea balthica est fortement
corrélé positivement à la fois avec le poids des touffes
(r= 0,66 > 0,5), le TCS (r= 0,66) et la teneur en MS de G. gracilis
(r= 0,91) au mois de Mai. De ce fait, l'augmentation de la
fréquence des isopodes est liée au TCS et à la teneur en
matière sèche de l'algue. En effet, la fréquence la plus
élevée est mentionnée au mois de Mai où le TCS et
la biomasse de Gracilaria sont optimales. De même, la
fréquence des isopodes est fortement corrélée à la
fois avec les teneurs en protéines (0,57) et en MS de G. gracilis
(0,58) au mois de Juin, mais de moindre mesure avec le TCS (0,34) et le
poids des touffes (0,35). Les fréquences des amphipodes (Gammarus
sp.) sont corréler d'une manière significative aux Poids,
TCS, MS, protéines et RPE (Tableau 4).
Nos résultats sont proches de celles signalés de
Zaabar et al. (2017) qui ont montré une relation positive entre
la fréquence de l'espèce Idotea balthica et le TCS de
Gracilaria sp. dans la lagune de Bizerte. En effet, plus les
touffes sont volumineuses, riches en protéines et en sucres solubles et
plus elles sont présentes en couleur vive, plus le nombre d'isopode
attiré à l'algue est élevé. Les isopodes
s'associent donc au G. gracilis soit pour se mettre à l'abri
et/ou pour se nourrir. Selon Smit et al. (2003) et Cruz-Rivera et Hay
(2001), les isopodes préfèrent G. gracilis comme source
de nourriture et choisissent de manière sélective les
différentes parties du thalle de l'algue. Cependant, Idotea balthica
préfère les branches apicales riches en sucre soluble. Selon
Smit et al. (2003) et Kraufvelin et al. (2006), cette
préférence pour les branches latérales est probablement
due à la différence de ténacité entre les branches
latérales et l'axe principal ou bien aux concentrations tissulaires
d'azote (N) donc à la teneur de l'algue en protéine. Quant aux
amphipodes et d'après nos résultats, les individus de
Gammarus sp. ont bien proliféré dans la zone de culture
lorsque l'algue devient riche en nutriment (protéines) en Avril, le
poids des touffes augmente et l'algue devient riche en sucres solubles au mois
de Mai et de couleur vive en Juin. Nos résultats concordent
avec ceux de
46
Fukunaga et al. (2014) qui ont montré que
l'abondance totale des amphipodes est significativement corrélée
à la fois avec la biomasse de Gracilaria salicornia, le volume
du thalle et sa qualité nutritionnelle. Du fait que Gracilaria
ne contient aucun moyen de défense chimique connu contre les
herbivores (Amsler, 2009), la qualité nutritionnelle est probablement un
indice important pour les brouteurs. Cependant, Ces organismes sont connus
d'importants consommateurs de macroalgues (Hayward et Ryland, 2002). Ainsi, ils
peuvent choisir les aliments en se basant sur des indices chimiques (nutrition)
et/ou sur la morphologie des macroalgues (Heckscher et al., 1996).
Dans notre étude, le nombre de Gammarus sp. est
corrélé positivement à la fois avec la teneur en
protéines, la teneur en RPE et la teneur en sucres solubles. Nos
résultats concordent avec ceux de Galàn Jiménez et
al. (1996) qui ont montré que la sélection des aliments par
les amphipodes est clairement corrélée à la teneur en
azote et que l'amphipode Gammarus mucronatus a montré une
préférence significative pour G. tikvahiae même
lorsque les différences de teneur en N est aussi faibles que 0,7 %.
Enfin, plus le TCS, la MS, les protéines et les sucres solubles sont
importants, plus le nombre d'amphipode est élevé. Toutefois,
l'espèce Gammarus sp. vive souvent dans les macroalgues, ils
les consomment et doivent donc les considérer à la fois comme des
lieux de vie et d'alimentation (Hay et al., 1988).
Dans la lagune de Bizerte, les Gracilaires sont une composante
essentielle de son écosystème. En effet, l'algue rouge
Gracilaria gracilis est utilisée comme source de nourriture et
d'habitat pour les communautés faunistiques. Cependant, sa faune
associée est largement dominée par les crustacés isopodes
(Idotea balthica) et les crustacés amphipodes (Gammarus
sp.). Ainsi, avec chaque récolte de G. gracilis, nous
avons collecté un totale des isopodes par kilogramme d'algue fraiche de
506,53 N/kg en Avril ; 232,02 N/kg en Mai et 351,84 N/kg en Juin. Ces
récoltent pourraient entrainer la perturbation des assemblages
faunistiques, ce qui génère des perturbations au niveau de la
biodiversité, en particulier celle des isopodes et amphipodes. Peu
d'efforts ont été consacrés à l'étude de
l'interaction entre des méthodes de récolte et de la culture de
cette algue et sa faune associée dans la lagune de Bizerte. Il en
ressort qu'il faudrait approfondir les connaissances sur ces activités
et sur l'abondance des espèces faunistiques associées aux algues
mais aussi développer des méthodes de collecte et de culture des
algues sans toucher la diversité biologique en générale et
faunistique en particulier, afin de conserver les ressources naturelles et
leurs services écologiques et assurer un approvisionnement stable des
marchés émergents avec des produits de qualité. À
terme, ces informations seront indispensables pour anticiper les changements
47
causés par la culture de cette algue sur sa faune.
Cependant, afin d'éviter la destruction du cycle de vie de ces animaux,
une stratégie de récolte de ces algues, dite
écoresponsable doit être employée. En fait, nous
suggérons qu'à la fin du mois de Mai, nous procédons
à la collecte d'une partie de touffes. Ainsi nous conservons la faune
vivante établie au sein des gracilaires et nous maintenant
l'équilibre faune-algue dans la lagune.
Tableau 3: Coefficients de corrélation
entre le nombre de l'isopode (Idotea balthica) et les
différentes réponses étudiées à savoir le
poids des touffes, le taux de croissance spécifique (TCS), la teneur en
matière sèche (MS), le sucre soluble, les protéines et la
R-phycoérythrine (RPE) au cours de la période d'étude
(Avril, Mai et Juin 2019).
|
Poids (kg)
|
TCS (% j-')
|
MS (%)
|
Sucre (%)
|
Protéines (%)
|
RPE (mg.g-')
|
|
Avril
|
0,22
|
0,30
|
-0,03
|
|
-0,04
|
0,22
|
|
Mai
|
0,66
|
0,66
|
0,91
|
0,21
|
0,49
|
0,35
|
|
Juin
|
0,35
|
0,34
|
0,58
|
-0,06
|
0,57
|
0,54
|
Tableau 4: Coefficients de corrélation
entre le nombre de l'amphipode (Gammarus sp.) et les
différentes réponses étudiées à savoir le
poids des touffes, le taux de croissance spécifique (TCS), la teneur en
matière sèche (MS), le sucre soluble, les protéines et la
R-phycoérythrine (RPE) au cours de la période d'étude
(Avril, Mai et Juin 2019).
|
Poids (kg)
|
TCS (% j-')
|
MS (%)
|
Sucre (%)
|
Protéines (%)
|
RPE (mg.g-')
|
|
Avril
|
-0,20
|
-0,18
|
0,09
|
|
0,63
|
0,43
|
|
Mai
|
0,81
|
0,73
|
0,71
|
-0,04
|
0,84
|
0,45
|
|
Juin
|
0,08
|
-0,03
|
0,07
|
0,23
|
-0,09
|
0,05
|
48
Conclusion et perspectives
Ce travail préliminaire a permis de réaliser les
objectifs initialement fixés, sur une période de trois mois,
à savoir : l'étude du taux de croissance, de la composition
biochimique et de la faune associée à la rhodophycée
Gracilaria gracilis cultivée sur cordes tendues dans la lagune
de Bizerte (Nord de la Tunisie), ainsi que la relation faune-algue et la
stratégie d'exploitation de cette source. La connaissance de ces aspects
procède de la démarche visant à cerner les meilleures
conditions de culture de l'algue rouge G. gracilis dans la lagune de
Bizerte et permettre ultérieurement la mise en place d'un pilote de
culture avec une méthode d'exploitation non touchante de la
biodiversité faunistique.
La culture de G. gracilis en utilisant la
méthode des cordes tendues sur le substrat entre trois piquets de fer,
initiée à partir de fragments de thalles de 100 g, a abouti au
bout d'un seul mois à un TCS (%j-1) maximal, qui est égale
à 5,60 #177; 0,94 %j-1. Ce meilleur taux de croissance a
été obtenu sous des conditions de température (16,50
°C à 22,38 °C), de salinité (34,6 et < 35 psu,) une
vitesse de vent (50 à 55 km/h) et des teneurs en ammonium (94,40 #177;
9,75 tM) et en nitrates (58,46 #177; 13 tM). Etant donné que l'algue
rouge G. gracilis est riche en composés d'intérêt
économique à savoir la R-phycoérythrine, les
protéines et les sucres solubles, il est intéressant
d'étudier les meilleures conditions environnementales pour obtenir ces
composés en bonne quantités et qualités. Les
résultats de présent travail ont montré que l'algue G
.gracilis présente des teneurs élevées en
protéines (21,96 #177; 5,15% en Avril) avec des conditions de
température (16,50 - 22,38 °C), de salinité
(34,6 psu) et des teneurs en ammonium (94,40 #177; 9,75 ìM) et en
nitrates (58,46 #177; 13 ìM). Cette algue constitue aussi une source
riche en sucres solubles (48,86 #177; 9,16 %) et en R-phycoérythrine
(2,35 #177; 0,82 mg.g-1) dont les meilleurs teneurs ont
été obtenus avec des conditions de température (22,63
#177; 3,29°C), de salinité (35 psu) et des teneurs en ammonium
(90,36#177; 1,23 ìM) et en nitrates (78,04 #177; 5,88 ìM). Ces
valeurs peuvent être considérées comme des seuils,
au-dessus ou au-dessous de lesquels les teneurs en sucre et en RPE
diminuent.
Par l'étude de la faune associée à G.
gracilis au cours de la période de culture, nous avons
identifié six groupes zoologiques (les crustacés amphipodes, les
crustacés isopodes, les mollusques, les cnidaires, les annélides
polychètes et les échinodermes). Les crustacés sont le
groupe le mieux représentés. Au sein de ce groupe, l'isopode
Idotea balthica est l'espèce la plus abondante avec des
fréquences 65 ; 77 et 67 % respectivement en Avril, Mai et Juin, elle
49
est suivie par l'amphipode Gammarus sp. (26 à
5 % d'avril à juin). L'abondance de l'isopode (Idotea balthica)
est positivement corrélée aux différentes réponses
étudiées (TCS, agar, protéines et
R-phycoérythrine). Les fréquences des amphipodes (Gammarus
sp.) sont corréler d'une manière significative aux TCS, MS,
protéines et RPE. En conclusion, pour une exploitation durable de la
culture de G. gracilis, en se basant sur l'adéquation entre le
TCS, la composition biochimique et la faune associée (nombre d'individus
et types d'espèces), nous proposons de commencer la culture au mois de
Mars et de faire la récolte, selon un plan déterminé,
à la fin du mois de Mai.
En perspectives, nous envisageons d'orienter nos recherches
futures sur les axes suivants : l'étude de l'effet des animaux brouteurs
et des épiphytes sur la croissance de l'algue et les rendements de
culture ; l'évaluation de la valeur nutritive de G. gracilis
comme complément alimentaire du fait qu'elle constitue une source
potentielle de protéines et comme biocarburant du fait de leur richesse
en sucres solubles ; le développement des autres techniques d'extraction
de la RPE pour des éventuelles applications biotechnologiques.
50
Références bibliographiques
Afli A., Ben Mustapha K., Jarbuoi O., Bradai M. N.,
Hattour A., Langar H. & Sadok S. (2005). La Biodiversité
marine en Tunisie. Rapp. Inst. Sci. Tech. Mer de Salammbô, 21
p.
Afli A., Boufahja F., Sadraoui S., Ben Mustpha K.,
Aissa P. & Mrabet R. (2009). Functional organization of the
benthic macrofauna in the Bizerte lagoon (Sw Mediterranean Sea), semi-enclosed
area subject to strong environmental/anthropogenic variations. Cahiers de
Biol. Mar. (50), 105-117.
Amsler C. D. (2009). Algal chemical ecology.
1., Springer-Verlag; Berlin.
Anderson B. C., Smit A. J. & Bolton J. J. (1998).
Differential grazing effects by isopods on Gracilaria gracilis
and epiphytic Ceramium diaphanum in suspended raft culture, South
Africa. Aquaculture. (169), 99-109.
Anderson R. J., Levitt G. J., Keats D. W. & Simons
R. H. (1993).The role of herbivores in the collapse of the
Gracilaria resource at Saldanha Bay, South Africa. Hydrobiologia.
(260/261), 285-290.
Anderson R. J., Smit A. J. & Levitt G. J. (1999).
Upwelling and fish-factory waste as nitrogen sources for suspended
cultivation of Gracilaria gracilis in Saldanha Bay, South Africa.
Hydrobiologia (398/399), 455-462.
Anonyme (2016). Le manuel du plongeur
biologiste- les crustacés. Rapport DORIS et Flabelline
Plongée, 28 p.
Antoine E., & Fleurence J. (2003).
Species identification of red and brown seaweeds using ITS ribosomal
DNA amplification and RFLP patterns. J. Sci. Food. Agric. (83),
709-713.
Arrontes J. & Anadón R. (1990).
Distribution of intertidal isopods in relation to geographical changes in
macroalgal cover in the Bay of Biscay. J. Mar. Biol. Assoc. U. K.
(70), 283-293.
Arponen H. & Boström C. (2011).
Responses of mobile epifauna to small-scale seagrass patchiness: is
fragmentation important. Hydrobiologia. (680), 1-10.
Belkhodja Mahjoub H., Romdhane M. S. & Missaoui H.
(2007). Répartition spatiale de la faune malacologique de la
lagune de Bizerte : analyses écologiques. Rapp. Comm. int. Mer.
Médit., 430 p.
Ben Maiz N. (1993). Inventaire des algues et
phanérogames marines d'intérêt économique : Bilan
potentiel des ressources sur le littoral tunisien. Plan Directeur de
l'aquaculture, Ministère de l'agriculture de Tunis, Projet PNUD :
1-65.
Ben Mustapha K., Chaouch M. & Hattour A. (2016).
Zoobenthos Associe Aux Dictyoceratidae (Spongiares, Demospongiae) des
Cotes Tunisiennes. Bull. Inst. Sci. Tech. Mer de Salammbô. Vol.
(43), 71-83.
Ben Mustapha K. & Hattour A. (2016).
Estimation de la population des holothuries des regions Jarzouna
Metline, el Hawar et la lagune de Bizerte. Bull. Inst. Sci. Tech. Mer de
Salammbô. Vol. (43), 257-272.
Béjaoui B. (2009).
Développement d'un modèle tridimensionnel couplé
dynamique-écologie : Application à la lagune de Bizerte.
Thèse Doct. ENIT, 189 p.
Bird K. T. (1982). Nitrogen allocation and
storage patterns in Gracilaria Tikvahiae (Rhodophyta). J.
Phycol. (18), 344-348.
51
Bligh E. G. & Dyer W. J. (1959). A rapid
method of total lipid extraction and purification. Can. J. Biochem.
Physiol. (37), 911-917.
Bonin P. (2015). Etude du métabolisme
du mannitol chez l'algue brune modèle Ectocarpus siliculosus :
caractérisation de l'enzyme clé mannitol-1-phosphate
déshydrogénase. Thèse Doct. De Biologie, Université
Pierre et Marie Curie - Paris VI., 171 p.
Bouchoukh I. (2017). Cours de botanique.
Univesité de Costantine, Fac. Sc. Nat. Et de vie, 129
p.
Boufahja F. (2010). Approches communautaires
et populationnelles de biosurveillance du milieu marin chez les
nématodes libres (lagune et baie de Bizerte, Tunisie). Thèse
Doct. Université de Carthage, Fac. Sc. Bizerte, 278 p.
Bourgougnon N. & Stiger-Pouvreau V. (2011).
Chemodiversity and Bioactivity within Red and Brown Macro algae Along
the French coasts, Metropole and Overseas Departments and Territories. In S-K
Kim (ed), Handbook of Marine Macro algae. John Wiley & Sons, Ltd, pp
58-105.
Bradford M. M. (1976). A rapid and sensitive
method for the quantification of microgram quantities of protein utilizing the
principle of protein-dye binding. Analytical Biochem. (72),
248-254.
Brahim M., Bejaoui B. & Atoui A. (2008).
Etude de l'hydrodynamique sédimentaire de la lagune de Bizerte.
Bull. Inst. Sci. Tech. Mer de Salammbô. Vol. (35), 149-160.
Burlot A. S. (2016). Valorisation des
métabolites d'algues proliférantes par voie enzymatique:
applications dans les domaines de la nutrition et santé animale,
végétale et humaine, de la cosmétique et de
l'environnement. Thèse Doctoral dissertation, Université de
Bretagne Sud.
Buschmann A. H., Westermeier R. & Retamales C. A.
(1995). Cultivation of Gracilaria on the sea-bottom in
southern Chile: a review. J. applied. Phycol. (7), 291-301.
Calvados. (2007). Inventaire des algues de
l'estran du lac sur mer. France, 46 p.
Chabot A. & Rossignol A. (2003). Algues
et Faune du littoral du Saint-Laurent Maritime : Guide d'identification.
Institut des sciences de la mer de Rimouski, Rimouski ; Pêches et
Océans Canada (Institut Maurice-La montagne), Mont-Joli, 113 p.
Chaffai A. (2014). Embranchement des
mollusques. Université Virtuelle de Tunis, 24p.
Chebil-Ajjabi L., Romdhane M. S. & El Abed A.
(2005). Etude comparative de l'absorption de l'azote par deux
espèces d'algues rouges: Gracilaria verrucosa (Hudson)
Papenfuss, 1950 et Gracilaria bursa-pastoris (Gmelin) Silva, 1952.
Bull. Inst. Sci. Tech. Mer de Salammbô, 32 p.
Chopin T., Robinson S. M. C., Troell M., Neori A.,
Buschmann A. & Fang J. G. (2008). Multitrophic integration for
sustainable marine aquaculture. In Jørgensen, S.E., Fath, B.D. (Eds.),
The Encyclopedia of Ecology, Ecological Engineering, vol. 3.Elsevier, Oxford,
pp 2463-2475.
Chye F. Y., Padam B. S. & Ng S. Y. (2017).
Innovation and Sustainable Utilization of Seaweeds as Health Foods.
Sustainability Challenges in the Agro food Sector, 390 p.
Cirik Þ., Çetin Z., Ak ., Cirik S. &
Göksan T. (2010). Greenhouse cultivation of Gracilaria
verrucosa (Hudson) Papenfuss and determination of chemical composition.
Turkish J. Fisheries. Aquat. Sci.. 10 (4), 559-564.
Collén J., Cornish M. L., Craigie J.,
Ficko-Blean E., Hervé C., Krueger-Hadfield S.A., Leblanc C., Michel G.,
Potin P. & Tonon T. (2014). Chondrus crispus- A Present
and Historical Model Organism for Red Seaweeds. Advances in Botanical Research.
Elsevier, pp 53-89.
52
Connor J. L. (1980). Distribution and
seasonality of macroalgae on oyster communities of central Chesapeake Bay,
Maryland, U.S. A. Bot. Mär. (23), 711-718.
Conover J. T. (1964). The ecology seasonal
periodicity and distribution of benthic plants in some Texas lagoons. Bot.
Mär. (7), 4-41.
Correa J. A., Ramírez M. A., De La Harpe1 J.
P., Román D. & Rivera L. (2000). Copper, Copper mining
Effluents And Grazing As Potential Determinants Of Algal Abundance And
Diversity In Northern Chile. Environmental Monitoring and Assessment.
(61), 265-281.
Coutinho R. & Seeliger U. (1984). The
horizontal distribution of the benthic algal flora in the Patos Lagoon estuary,
Brazil, in relation to salinity, substratum and wave exposure. J. Exp.
Mär. Biol. Ecol. (80), 247-257.
Cruz-Rivera E. & Friedlander M. (2011).
Feeding preferences of méso-grazers on aquacultured
Gracilaria and sympatric algae. Aquaculture. 322 (323),
218-222.
Cruz-Rivera E. & Hay M. E. (2001).
Macroalgal traits and the feeding and fitness of an herbivorous
amphipod: the roles of selectivity, mixing, and compensation. Mar. Ecol.
Prog. Ser. (218), 249-266.
Csakb V. D. (2013). Les Vers Marins, 22 p.
De Marco S. G., Beltrame M. O., Freije R. H. &
Marcovecchio J. E. (2005). Phytoplankton dynamic in Mar Chiquita
coastal lagoon Argentina and its relationship with potential nutrient sources.
J. Coastal. Res. (21), 818-825.
Destombe C. (2001). Evolution des cycles de
reproduction et Biologie des populations chez l'algue rouge Gracilaria
gracilis. HABILITATION A DIRIGER DES RECHERCHES, Université de
Lille 1, le 4 septembre 2001, 33 p.
Djellouli A. S. (1988). Recherches sur le
macrophytobenthos de la lagune de Bizerte (Tunisie). DEA, Fac. Sc. Bizerte, 144
p.
Dubois M., Gilles K. A., Hamilton J., KRebers P. A.
& Smith F. (1956). Colorimetric Method for Determination of Sugars
and Related Substances. Analytical. chem. (28), 350-356.
Dufour C. M., Engels N. M. & Burns C. W. (2007).
Distribution, substrate preference and habitat enhancement of the
isopod Austridotea lacustris in Tomahawk Lagoon, Otago, New Zealand.
J. Mar. Freshwater Res. (41), 299-307.
Engkvist R., Malm T. & Nilsson J. (2004).
Interaction between isopod grazing and wave action: a structuring
force in macroalgal communities in the southern Baltic Sea. Aquat.
Ecol. (38), 403-413.
Fauvel P. (2007). Polychètes errantes.
Faune de France, Office Central de Faunistique, 90 p.
Fletcher R. L. (1995). Epiphytism and fouling
in Gracilaria cultivation: an overview. J. Applied phycol.
(7), 325-333.
Francavilla M., Franchi M., Monteleone M. &
Caroppo C. (2013). The red seaweed Gracilaria gracilis as a
multi products source. Mar. Drugs. (11), 3754-3776.
Francisco C. P. (2015). Effects of food type
and feeding frequency on the performance of early juveniles of the sea urchin
Loxechinus albus (Echinodermata: Echinoidea): Implications for
aquaculture and restocking. Aquaculture. (436), 172-178.
53
Friedlander M., Galai N. & Farbstein H. (1990).
A model of seaweed growth in an outdoor culture in Israel.
Hydrobiologia. (204), 367-373.
Fukunaga A., Peyton K. A. & Thomas F. I. M.
(2014). Epifaunal community structure and ammonium uptake compared for
the invasive algae, Gracilaria salicornia and Acanthophora
specifera, and the native alga, Padina thivyi. J. Exp.
Mari.Biol. Ecol. (456), 78-86.
Galàn Jiménez E., Hauxwell J., Heckscher
E., Rietsma C. & Valiela I. (1996). Selection of Nitrogen-Enriched
Macroalgae (Cladophora vagabunda and Gracilaria tikvahiae) by
the Herbivorous Amphipod Microdeutopus gryllotalpa. Bid. Bull. (191),
323-324.
Ganesan M., Thiruppathi S., Sahu N., Rengarajan N.,
Veeragurunathan V. & Jha B. (2006). In situ observations
on preferential grazing of seaweeds by some herbivores. Current Science,
Vol. 91, NO. (9), 1256- 1260.
Gayral P. (1975). Les algues : morphologie,
reproduction, écologie. Edition Dion. Paris, pp 55-70.
Genvès L. (1990). Biologie
végétale, thallophytes, et microorganisme. Edition Biosciences
Dunode. 159 p.
Ghribi R. (2003). Etude de l'évolution
spatio-temporelle du méso-zooplancton dans le canal de Bizerte.
Diplôme d'Etudes Approfondies en Sciences de l'Environnement,
faculté des Sciences de Bizerte, 103 p.
Gillet P. (2017). Liste des Annélides
Polychètes du Maroc - List of Annelida Polychaeta of Morocco. Bull.
Inst. Sci., Rabat, Section Sciences de la Vie. (39), 17-24.
Glenn E. P., Moore D., Brown J. J., Tanner R.,
Fitzsimmons K., Akutigawa M. & Napolean S. (1998). A sustainable
culture system for Gracilaria parvispora (Rhodophyta) using
sporelings, reef growout and floating cages in Hawaii. Aquaculture.
(165), 221-232.
Gómez-Ordóñez E.,
Jiménez-Escrig A. & Rupérez P. (2010). Dietary fibre
and physicochemical properties of several edible seaweeds from the
north-western Spanish coast. Food. Res. Inter. (43), 2289-2294.
González M. L., Pérez M. C.,
López D. A. & Pino C.A.(1993). Effects of algal diet on the
energy available for growth of juvenile sea urchins Loxechinus albus
(Molina, 1782). Aquaculture. (115), 87-95.
Guiry W. (2013). In M. D. Guiry, & G. M.
Guiry (Eds.), Algae Base. Galway: World-wide electronic publication,
National University of Ireland.
Hansen J. P., Robertson-Andersson D. & Troell M.
(2006). Control of the herbivorous gastropod Fissurellamut abilis
(Sow.) in a land-based integrated abalone-seaweed culture.
Aquaculture. (255), 384-388.
Hanisak M. D. & Harlin M. M. (1978).
Uptake of inorganic nitrogen by codium fragile subsp. Tomentosoides
(chlorophyta) 1. J. Phycology. (14), 450-454.
Hanisak M. D. (1983). The nitrogen
relashionships of marine macroalgae. In carpenter E.J. and Capone D.G. (Eds),
Nitrogen in the marine Environment. Academic Press Inc.
Hanisak M. D. (1990). The use of
Gracilaria tikvahiae (Gracilariales, Rhodophyta) as a model system to
underst and the nitrogen nutrition of cultured seaweeds. Hydrobiologia.
(204/205), 79 - 87.
Haouas Gharsallah I., Zammouri N., Jarboui O., Mrabet
R. & Missaoui H. (2008). Evaluation et cartographie des stocks de
coquillages comestibles dans la lagune de Bizerte (Nord de la Tunisie).
Bull. Inst. Sci. Tech. Mer. de Salammbô. (1), 33-40.
54
Harrison P. J. & Hurd C. L. (2001).
Nutrient physiology of seaweeds: application of concepts to
aquaculture. Cahiers de Biol. Mar., pp 1-2.
Hauxwell J., McClelland J., Behr P. J. & Valiela
I. (1998). Relative Biomass Importance of Grazing and Nutrient
Controls of Macroalgal in Three Temperate Shallow Estuaries. Boston University
Marine Program Marine Biological Laboratory Woods Hole, Massachusetts
02543, Estuaries Vol. (21), 347360.
Hay M. E., Lee R. R., J. R. & Guieb R. A. (1986).
Food Preference And Chemotaxis In The Sea Urchin Arbacia
punctulata (Lamarck) Philippi. J. Exp. Mar. Biol. Ecol., Vol.
(96), 147-153.
Hay M. E. (1981). Herbivory, Algal
Distribution, And The Maintenance Of Between-Habitat Diversity On A Tropical
Fringing Reef. The American Naturalist, Vol. (118).
Hay M. E. (1992). The role of seaweed
chemical defenses in the evolution of feeding specialization and in the
mediation of complex interactions. In: Paul VJ (ed.), Ecological roles of
marine natural products. Comstock Publishing Associates, Ithaca, pp 93-118.
Hayward P. J. & Ryland J. S. (2002).
Handbook of the marine fauna of North-West Europe. Oxford University
Press, Oxford.
Heckscher E., Hauxwell J., Jiménez E. G.,
Rietsma C. & Valiela I. (1996). Selectivity by the Herbivorous
Amphipod Microdeutopus gryllotalpa Among Five Species of Macroalgae.
Boston University Marine Program, Marine Biological Laboratory, Biol. Bull.
(191), 324-326.
Hermi M. (2001). Impact de la pollution
sévissant dans le lac Sud de Tunis sur la méiofaune. Thèse
Doct. Fac. Sc. de Bizerte, 300 p.
Hibberd T. & Moore K. (2009). Field
identification guide to Heard Island and McDonalds Islands benthic
invertebrates : A guide for scientific observers aboard fishing vessels.
Australian Government, Fisheries Research and Development Corporation,
149 p.
Hillison C. I. (1977). Seaweeds, a
color-coded, illustrated guide to common marine. Plants of east coast of the
United States, Keystone Books. The Pennsylvania State University Press, 5 p.
Hommersand M. H. & Fredericq S. (1990).
Sexual reproduction and cystocarp development. In Biology of the red
algae. In Cole K. M. and Sheath R. G. (ed.), Cambridge University Press,
Cambridge.
James P. S. B. R., Krishnamurty Chennuhotla V. S.
& Rodrigo J. X. (1986). Studies On The Fauna Associated With The
Cultured Seaweed Gracilaria Edulis. Proc. Symp. Coastal
Aquaculture. (4), 1193-1198.
Jing-Wen L. & Shuang-lin D. (2001).
Comparative studies on utilizing nitrogen capacity between two
macroalgae Gracilaria tenuistipitata var liui (rhodophyta) and
Ulva pertusa (chlorophyta) I. Nitrogen storage under nitrogen
enrichment and starvation. J. Envi. Sci. (13), 318-322.
Joseph M. Mohan. (1978 a). Ecological studies
on the fauna associated with the economical seaweed of South India: Species
composition, feeding habits and interrelationships. Seaweed. Res. Vlil.
(3), 9-25.
Joseph M. Mohan. (1978 b). Ecological studies
on the fauna associated with the economical seaweeds of South India:
Distribution in space and time. Ibid. (3), 26-37.
Joubert Y., Abdeladhim L. B., Ksouri J. &
Fleurence J. (2009). Development of a molecular method for the rapid
discrimination of red seaweeds used for agar production. Food. chem.
(113), 1384-1386.
55
Ketchum B. H. (1983). Enclosed
seas-introduction. In B. H. Ketchum (ed.), Ecosystems of the World. 26.
Estuaries and Enclosed Seas. Elsevier, Amsterdam, pp 209-218.
Khedhri I., Djabou H. & Afli A. (2014).
Trophic and functional organization of the benthic macrofauna in the
lagoon of Boughrara - Tunisia (SW Mediterranean Sea). J. Mar. Biol.
Association. U. K., 13 p.
Kim D. H. (1970). Economically Important
Seaweeds in Chile-I Gracilaria. Bot. Mar. (13), 140-162.
Kotta J., Orav-Kotta H., Paalme T., Kotta I. & Kukk
H. (2006). Seasonal changes in situ grazing of the mesoherbivores
Idotea balthica and Gammarus oceanicus on the brown algae
Fucus vesiculosus and Pilayella littoralis in the central Gulf of
Finland, Baltic Sea. Hydrobiologia. (554), 117-125.
Kraufvelin P., Salovius S., Christie H., Moy F., Karez R.
& Pedersen M. F. (2006). Eutrophication-induced changes in benthic
algae affect the behavior and fitness of the marine amphipod Gammarus
locusta. Aquat. Bot. (84), 199-209.
Ksouri J. & Ben Saïd R. (1998).
Potentialités en macroalgues: Cartographie et biomasse de
l'agorophyte Gracilaria dans le lac Bizerte. Bull. Inst. Sci.
Tech. Mer de Salammbô. (25), 17 - 34.
Ksouri J., Ben Saïd R. & Beji O. (1997).
Évaluation des potentialités quantitatives naturelles
des gracilaires (algues rouges) du lac nord de Tunis. Bull. Inst. Sci.
Tech. Mer de Salammbô. (24), 15-27.
Ksouri J., Ben Said R., Beji O., Guerbej H. &
Mrabet R. (1996). Cartographie des peuplements de la macroalgue
Gracilaria (Gigartinales, Gracilaires) dans le lac Nord de Tunis.
Ksouri J., Ben Said R., Guerbej H., Zaafrane S.,
Maatouk K., Sammari C. & Limayem Y. (1998). Potentialités
en macroalgues: Cartographie et biomasse de l'agorophyte Gracilaria
dans le lac Bizerte. Bull. Inst. Sci. Tech. Mer de
Salammbô. (25), 17-34.
Ksouri J., Ben Said R. & Pellegrini M. (1999).
Résultats des cultures expérimentales de la
rhodophycée Gracilaria verrucosa Papenfuss dans le lac Bizerte,
Tunisie septentrionale. Bull. Inst. Sci. Tech. Mer de Salammbô.
(26), 113-127.
Ksouri J., Challougui I. & Mensi F. (2008).
Culture en conditions optimisées de la macroalgue rouge
<Gracilaria gracilis> (stackhouse) steentofr et al.
dans le lac de Bizerte.
Ksouri J., Mensi F. & Ben Saïd R. (2000).
Ajustement de certains paramètres de culture par bouturage de
Gracilaria verrucosa (algue rouge), Hudson Papenfuss, dans le lac de
Bizerte. Bull. Inst. Sci. Tech. Mer de Salammbô. (27), 69 -
74.
Ksouri J., Mensi F. & Sahli-Hamza K. (2006).
Évaluation de la capacité
régénératrice de l'algue rouge Gracilaria verrucosa
(Hudson) Papenfuss du lac de Bizerte (Tunisie septentrionale). Bull.
Inst. Sci. Tech. Mer de Salammbô. (33), 59 - 68.
Laplace-Treyture C. (2016). Les
cyanobactéries d'eau douce, une nuisance ?.Irstea - UR EABX- Equipe
Contaminants Anthropiques et Réponses des Milieux Aquatiques - CARMA.
Colloque du GIS Cyano : Cyanobactéries et zones
récréatives, Biscarrosse, le 9 mars 2016, 12 p.
Lapointe B. E. & Ryther J. H. (1978).
Some aspects of the growth and yield of Gracilaria tikvahiae
in culture. Aquaculture. (15), 185-193.
Largo D. B., Bacolod T., Primitivo V., Cusi M. A.,
Orosco C. & Ohno M. (1989). Growth Rate of Gracilaria
verrucosa and Gracilaria salicornia (Gracilariales, Rhodophyta)
in an Intertidal and semi-enclosed Pond System in the Visayas, Philippines.
Bull. Mar. Sci. Fish., Kochi. Univ. (11), 95-100.
56
Lefebvre C. (1986). Comportement, en cultures
expérimentales, des deux générations diploïdes du
Gracilaria verrucosa (Hudson) Papenfuss: le carposporophyte à
carpospores et le tétrasporophyte immature. Thèse Doct.
dissertation, Lille 1.
Lei G. Y. ( 2007). Preliminary Study on
Experimental Ecology of Seaweed Gracilaria lemaneiformis, Ji'nan
University.
Lewis F. G. (1984). Distribution of
macrobenthic crustaceans associated with Thalassia, Halodule and bare
sand substrata. Mar. Ecol., Prog. Ser. (19), 101-113.
Loiselle S. A., Azza N., Cozar A., Bracchini L.,
Tognazzi A., Dattilo A. & Rossi C. (2008).Variability in factors
causing light attenuation in Lake Victoria. Freshwater. Biol. (53)
535-545.
Luhan R. J. (1996). Biomass and reproductive
studies of Gracilaria heteroclada Zhary et Xia collected from Jaro,
Central Philippines. Bot. Mar. (39), 207-211.
Lutz M. L., Davis A. R. & Minchinton T. E. (2010).
Non-indigenous macroalga hosts different epiphytic assemblages to
conspecific natives in southeast Australia. Mar. Biol. (157),
1095-1103.
Mahmoudi E. (2003). La méiofaune de
deux lagunes perturbées : Ghar El Melh et Bou Ghrara. Thèse Doct.
Fac. Sc. de Bizerte, 334 p.
Mancinelli G. & Rossi L. (2001).
Indirect, size-dependent effects of crustacean mesograzers on the
Rhodophyta Gracilaria verrucosa (Hudson) Papenfuss: evidence from a short-term
study in the Lesina Lagoon (Italy). Mar. Biol. (138), 1163-1173.
Mansouri T. (1996). Application de la
télédétection et des systèmes d'informations
géographiques à l'étude du
fonctionnement hydrologique du lac de Bizerte et de son bassin
versant. Thèse Doct. dissertation.
Marcovecchio J., Freije H., De Marco S., Gavio A.,
nFerrer L., Andrade S., Beltrame O. & Asteasuain R. (2006).
Seasonality of hydrographic variables in a coastal lagoon: Mar Chiquita,
Argentina. Aquat. Conservation: Mar. Freshwater. Ecosy. (16),
335-347.
Marinho-Soriano E. & Bourret E. (2003).
Effects of season on the yield and quality of agar from Gracilaria
species (Gracilariaceae, Rhodophyta)». Biores.Tech. (90),
329-333.
Marinho-Soriano E., Fonseca P. C., Carneiro M. A. A.
& Moreira W. S. C. (2006). Seasonal variation in the chemical
composition of two tropical seaweeds. Biores. Tech. (97),
2402-2406.
Marsham S., Scott G. W. & Tobin M. L. (2007).
Comparison of nutritive chemistry of a range of temperate seaweeds.
Food.. chem. (100), 1331-1336.
Mathieson A. C., Reynolds N. B. & Hehre E. J. (1981).
Investigations of New England marine algae. II. The species
composition, distribution and zonation of seaweeds in the Great Bay Estuary
System and the adjacent open coast of New Hampshire. Bot. Mär. (24),
533-545.
McLachlan J. & Bird C. J. (1986).
Gracilaria (Gigartinales, Rhodophyta) and productivity,
Aquat. Bot. (26), 27-49.
Mensi F., Ksouri J., Hammami W. & Romdhane M. S.
(2009). L'algue rouge Gracilaria verrucosa (Hudson) Papenfuss
de la lagune de Bizerte (Tunisie septentrionale) : essai de culture en mode
suspendu et composition biochimique. Bull. Inst. Sci. Tech.
Mer de Salammbô. Vol. (36), 125-137.
Mensi F., Ksouri J., Hammami W. & Romdhane M. S.
(2010). Choix du site de culture de l'algue rouge Gracilaria
verrucosa (Hudson) Papenfuss dans la lagune de Bizerte :
caractéristiques physicochimique de l'eau. Bull. INSTM. (37),
133-144.
57
Mensi F., Ksouri J., Hammami W. & Romdhane M. S.
(2014). Etat de connaissances et perspectives de recherches sur la
culture de Gracilariales (Gracilaria et Gracilariopsis): Application
de la lagune de Bizerte. Bull. Inst. Sci. Tech. Mer de
Salammbô, 41 p.
Middelboe A. L. & Markager S. (1997).
Depth limits and minimum light requirements of freshwater macrophytes.
Freshwater. Biol.. (37), 553-568.
Mitchell S. B., Theodoridou A. & Pope D. J.
(2007). Influence of fresh water discharge on nutrient distribution in
a macrotidal lagoon, West Sussex, UK. Hydrobiologia. (588),
261-270.
Molloy F. J. (1992). Studies on the Ecology
and Production of Seaweeds of Economic and Potential Economic Importance on the
Namibian Coast. PhD Thesis. University of Cape Town, South Africa, 252
p.
Molloy F. J. & Bolton J. J. (1995).
Distribution, biomass and production of Gracilaria in
Luderitz Bay, Namibia. J. Appl. Phycol. (7), 381-392
Munda I. (1978). Salinity dependent
distribution of benthic algae in estuarine areas of Icelandic fjords. Bot.
Mär. (21), 451-468.
Murthy M. S., Ramakrishna T., Rao Y. N. & Ghose D.
K. (1989). Ecological studies on some agarophytes from Veraval Coast,
India. I. Effects of aerial conditions on biomass dynamics. Bot. Mar.
(32), 515- 520
Nagler P. L., Glenn E. P., Nelson S. G. & Napolean
S. (2003). Effects of fertilization treatment and stocking density on
the growth and production of the economic seaweed Gracilaria parvispora
(Rhodophyta) in cage culture at Molokai, Hawaii, Aquaculture.
(219), 379-391.
Nejrup L. B., Staehr P. A. & Thomsen M. S. (2013).
Temperature- and light dependent growth and metabolism of the invasive
red algae Gracilaria vermiculophylla - a comparison with two native
macroalgae, European. J. Phycol. (48), 295-308
Neori A., Chopin T., Troell M., Buschmann A. H.,
Kraemer G. P., Halling C., Shpigel M. & Yarish C. (2004).
Integrated aquaculture: rationale, evolution and state of the art
emphasizing seaweed biofiltration in modern mariculture. Aquaculture.
(231), 361-391.
Njobeni A. (2005). The cultivation of
Gracilaria gracilis (Rhodophyta) in an integrated aquaculture system,
for the production of abalone feed and the bioremediation of aquaculture
effluent. Master thesis, University of Cape Town.
Nguyen H. P. T. (2017). Optimisation du
procédé d'hydrolyse enzymatique appliqué à
l'extraction du pigment rouge, la R-phycoérythrine à partir de
Mastocarpus stellatus et Gracilaria gracilis. Thèse
Doct. dissertation, Nantes.
Nicotri M. E. (1977). The impact of
crustacean herbivores on cultured seaweed populations. Aquaculture.
(12), 127-136.
Nyberg C. D., Thomsen M. S. & Wallentinus I.
(2009). Flora and fauna associated with the introduced red alga
Gracilaria vermiculophylla. European. J. Phycol. 44 (3), 395-403.
Ogden J. C., BrownR. & Salesky N. (1973).
Grazing by the echinoid Diadema antillarum Philippi:
formation of halos around West Indian patch reefs. Science. (182),
715-717.
58
Paul V. J., Cruz-Rivera E. & Thacker R. W. (2001).
Chemical mediation of macroalgal-herbivore interactions: ecological
and evolutionary perspectives. In: McClintock J. & Baker B. editors.
Mar. Chem. Ecol., pp 227-265.
Pérez R. (1997). Ces algues qui nous
entourent. Conception actuelle, rôle dans la biosphère,
Utilisations, culture. Édition IFREMER, Plouzané, 250 p.
Prunus G., Dridi M. S. & Savoure B. (1978).
Les peuplements littoraux et leur intérêt
écologique dans les milieux lagunaires du nord de la Tunisie.
Bull.off. Nat.. Pêches, Tunisie. (2), 227-234.
Redmond S., Green, L., Yarish C., Kim J. & Neefus
C. (2014). New England Seaweed Culture Handbook Nursery Systems.
Connecticut Sea Grant. (2), 14-19..
Reviers B. (2002). Biologie et
phylogénie des algues. Édition par Belin, Paris, Sup. de
Belin, pp 352-353.
Réseau de Suivi Lagunaire. (2011).
Guide de reconnaissance et de suivi des macrophytes des lagunes du
Languedoc-Roussillon. Ifremer, Cépralmar, Agence de l'Eau RM&C,
Région Languedoc-Roussillon, 148 p.
Rueness J. (2005). Life history and molecular
sequences of Gracilaria vermiculophylla (Gracilariales, Rhodophyta), a
new introduction to European waters. Phycologia. (44), 120-128.
Russell G. & Fielding A. H. (1981).
Individual's populations and communities. In C. S. Lobban and M. J.
Wynne (eds.), The Biology of Seaweeds. University of California Press,
Berkeley, pp 393-420.
Ryder E., Nelson S. G., McKeon C., Glenn E. P.,
Fitzsimmons K. & Napolean S. (2004). Effect of water motion on the
cultivation of the economic seaweed Gracilaria parvispora (Rhodophyta)
on Molokai, Hawaii. Aquaculture. (238), 207-219.
Ryther J. H., Corwin N., DeBusk T. A. & Williams
L. D., (1981). Nitrogen uptake and storage by the red algae
Gracilaria tikvahiae (McLachlan, 1979). Aquaculture. (26),
107-115.
Ryther J. H., DeBusk T. A., Andrews D. A. & Habig
C. (1983). Cultivation of Gracilaria as a biomass source for
energy. Proc. World Mariculture Soc. (In press).
Sakka Hlaili A., Chikhaoui M.A., El Grami B. &
Hadj Mabrouk H. (2003). Variation hiverno-estivale de la
communauté phytoplanctonique de la lagune de Bizerte en milieu naturel
et fertilisé en nutriments. Revue de la Fac. Sc. de Bizerte, pp 37 -
49.
Santelices B. & Doty M. S. (1989). A
review of Gracilaria farming. Aquaculture. (78), 95-133.
Schmidt A. L. & Scheibling R. E. (2007).
Effects of native and invasive macroalgal canopies on composition and
abundance of mobile benthic macrofauna and turfforming algae. J. Exp. Mar.
Biol. Ecol. (341), 110-130.
Sfriso A., Marcomini A. & Pavoni B. (1994).
Gracilaria distribution, production and composition in the
lagoon of Venice. Biores. tech. (50), 165-173.
Shacklock P.F. & Croft G.B. (1981).
Effect of grazers on Chondrus crispus in culture.
Aquaculture. (22), 331-342.
Shacklock P. F. & Doyle R. W. (1983).
Control of epiphytes in seaweed cultures using grazers.
Aquaculture. (31), 141-151.
Shunula J. P. & Ndibalema V. (1986).
Grazing Preferences Of Diadema setosum And Heliocidaris
erythrogramma (Echinoderms) On An Assortment Of Marine Algae. Aquat.
Bot. (25), 91-95.
59
Silkin V. A. & Mironova N. V. (2007).
Production properties of the red alga Gracilaria verrucosa
(Huds.) Papenfuss from the Black Sea under culture conditions. Inter.
J. Algae, 9 p.
Simonetti G., Giaccone G. & Pignatti S. (1970).
The seaweed Gracilaria confervoides, an important object for
an ecologic and cultivation research in the northern Adriatic Sea.
HeigoländerWiss, Meeresunters. (20), 89--96.
Skjermo J., Aasen I. M., Arff J., Broch O. J., Carvaja
A., Christie l. H., Forbord S., Olsen Y., Reitan K. I., Rustad T., Sandquist
J., Solba kken R., Steinhovden K. B., Wittgens B., Wolff R. & Handå
A. (2014). A New Norwegian bioeconomy based on cultivation and
processing of seaweeds: Opportunities and R&D needs. Report
A25881, Sintef Fisheries and Aquaculture, Trondheim, 46 p.
Smit A. J., Fourie A. M., Robertson B. L. & du
Preez D. R. (2003). Control of the herbivorous isopod, Paridotea
reticulata, in Gracilaria gracilis tank cultures.
Aquaculture. (217), 385-393.
Sotka, E. E. (2007). Restricted host use by
the herbivorous amphipod Peramphithoe tea is motivated by food quality
and abiotic refuge. Mar. Biol. (151), 1831-1838.
Stachowicz J. J. & Hay M. E. (1999).
Reducing predation through chemically mediated camouflage: indirect
effects of plant defenses on herbivores. Ecology. 80(2), 495-509.
Talarico L. & Maranzana G. (2000). Light
and adaptive responses in red macroalgae: an overview. J. Photochem.
Photobiol. B: Biology. (56), 1-11.
Thomsen M. S., McGlathery K. & Tyler A. C. (2006).
Macroalgal distribution pattern in a shallow, soft-bottom lagoon,
Virginia with emphasis on the alien Gracilaria vermiculophylla and
Codium fragile. Estuaries and Coasts. (29), 470-478.
Thomsen M. S., Staehr P. A., Nyberg C. D.,
Schwærter S., Krause-Jensen D. &Silliman B. R. (2007).
Gracilaria vermiculophylla (Ohmi) Papenfuss, 1967
(Rhodophyta, Gracilariaceae) in northern Europe, with emphasis on Danish
conditions and what to expect in the future. Aquat. Invasions ,Vol. 2.
(2), 8394.
Thomsen M. S. & McGlathery K. (2005).
Facilitation of macroalgae by the sedimentary tube forming polychaete
Diopatra cuprea. Estuarine Coastal and Shelf Science. (62),
63-73.
Touchette B. W. & Burkholder J. M. (2000).
Review of nitrogen and phosphorus metabolism in sea grasses. J.
Exp. Mar. Biol. Ecol.. 250 (1-2), 133-167.
Tsai C. C., Chang J. S., Sheu F., Shyu Y. T., Yu A. Y.
C., Wong S. L., Dai C. F. & Lee T. M. (2005). Seasonal growth
dynamics of Laurencia papillosa and Gracilaria coronopifolia
from a highly eutrophic reef in southern Taiwan: temperature limitation
and nutrient availability, J. Exp. Mar. Biol. Ecol. (315), 49-69.
Turan G., Ak I., Cirik S., Koru E. & Ba°aran A. K.
(2006). Entansif balýk kültüründe Gracilaria
verrucosa (Hudson) Papenfuss yetiþtiriciliði. E.Ü. Su
Ürünleri Dergisi. (2-3), 305-309.
Umamaheswara RaoM. (1973). Growth and
reproduction in some species of Gracilaria and Gracilariopsis
in the Palk Bay. Indian. J. Fish. (20), 182-192.
Vairappan C. S. (2006). Seasonal occurrences
of epiphytic algae on the commercially cultivated red algae Kappaphycus
alvarezii (Solieriaceae, Gigartinales, Rhodophyta). In: Eighteenth
International Seaweed Symposium. Springer Netherlands, Dordrecht, pp
385-391.
60
Vásquez J. A. & Alonso Vega J. M. (2001).
Chondracanthus chamissoi (Rhodophyta, Gigartinales) in
northern Chile: ecological aspects for management of wild populations. J.
Appl. Phycol. (13), 267- 277.
Vázquez-Luis M., Sanchez-Jerez P. &
Bayle-Sempere J. T. (2008). Changes in amphipod (Crustacea)
assemblages associated with shallow-water algal habitats invaded by
Caulerpa racemosa var.cylindracea in the western Mediterranean Sea.
Mar. Envi. Res. (65), 416-426.
Viana G. S. B., Freitas A. L. P., Lima M. M. L.,
Vieira L. A. P., Andrade M. C. H. & Benevides N. M. B. (2002).
Antinociceptive activity of sulfated carbohydrates from the red algae
Bryothamnion seaforthii (Thrner) Kütz. and B. triquetrum
(S.G. Gmel.) M. Howe». Brazilian. J. Med. Biol. Res. (35),
713-722.
Wang Y. C., Pan G. Y. & Chen L. C. M. (1984).
Studies on agarophytes II. Field observations and growth of
Gracilaria cf. verrucosa (Rhodophyta) in Shantou District,
Guangdong, P. R. C. Bot. Mar. (27), 265268.
Weinberger F., Buchholz B., Karez R. & Wahl M.
(2008). The invasive red alga Gracilaria vermiculophylla in
the Baltic Sea: adaptation to brackish water may compensate for light
limitation. Aquat. Biol., Vol. (3), 251-264.
Wen X., Peng C., Zhou H., Lin Z., Lin G., Chen S.
& Li P. (2006). Nutritional composition and assessment of
Gracilaria lemaneiformis Bory. J. Integrative Plant Biology.
(48), 1047-1053.
Westbrook C. E., Ringang R. R., Cantero S. M. A., HDAR
& TNC Urchin Team & Toonen R. J. (2015). Survivorship and
feeding preferences among size classes of out planted seaurchins,
Tripneustes gratilla, and possible use as biocontrol for invasive
alien algae. Peer. J.3: 1235 p.
Wu C. Y., Li R. Z., Lin G. H., Wen Z. C., Zhang J. P.,
Dong L. F. & Huang X. H. (1994). Study on the optimum
environmental parameters for the growth of Gracilaria tenuistipitata var.
liui in pond culture, Oceanol. Limnol. Sin. (25), 60-66.
Xu J. & Gao K. (2008). Growth, pigments,
UV-absorbing compounds and agar yield of the economic red seaweed
Gracilaria lemaneiformis (Rhodophyta) grown at different depths in the
coastal waters of the South China Sea. J. Appl. Phycol. (20),
681-686.
Yang Y., Chai Z., Wang Q., Chen W., He Z. & Jiang
S. (2015). Cultivation of seaweed Gracilaria in Chinese
coastal waters and its contribution to environmental improvements. Algal
research. (9), 236244.
Yarish C., Redmond S. & Kim Jang K. (2012).
Gracilaria Culture Handbook for New England. Wrack Lines, 72
p.
Ye N., Wang H. & Wang G. (2006). Formation
and early development of tetraspores of Gracilaria lemaneiformis
(Gracilaria, Gracilariaceae) under laboratory conditions.
Aquaculture. (254), 219-226.
Zaabar W., Charfi-Cheikhrouha F. & Achouri M. S.
(2017). The Influence of Environmental Factors on the Population
Structure and Reproductive Biology of Idotea balthica basteri
(Isopoda, Valvifera) of the Bizerte Lagoon (Northern Tunisia). Open J.
Ecology. (6), 206-218.
Zaouali J. (1980). Flore et faune benthiques de
deux lagunes tunisiennes : le lac de Bizerte, Tunisie septentrionale et la Mer
de Bou Ghrara, Tunisie méridionale. Bull. off. Nat. Péches,
Tunisie. (4), 169200.
Zhao X.T. (2007). Study on Gracilaria
lemaneiformis's Ability to Treat Mariculture Discharge, Ocean University
of China.
61
62
Annexes
Annexe 1 : Les étapes de
préparation des touffes de Gracilaria gracilis : (A) mise en
place de l'algue dans des bacs remplies de l'eau de mer ; (B) nettoyage des
touffes et élimination des épifaunes et épiphytes ; (C)
Tri choix et sélection des touffes et (D) touffes
sélectionnées.

Annexe 2 : Epifaunes et épiphytes
associées au Gracilaria gracilis.

63
Annexe 3 : Les étapes de
préparation des cordes : (A) Essuyage ; (B) Pesée des touffes de
Gracilaria gracilis et (C) l'attachement de 100 g ? 2 de touffe sur corde par
le fil tressé.

Annexe 4 : (a) Siphonage ; (b) Renouvellement
total de la quantité d'eau de chaque bac et (c) Aération des
bacs.

64
Annexe 5 : (A) Pesée de 20 g de G.
gracilis ; (B) découpage en petits morceaux et (C)
numérotation des échantillons découpées à
conserver dans la glace.
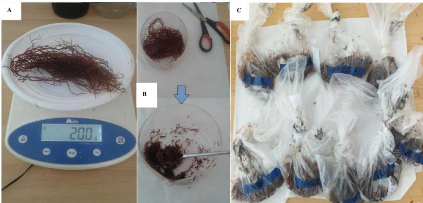
Annexe 6 : Les étapes de l'extraction
de la R-phycoérythrine : (a) Décongélation dans l'eau de
mer filtrée ; (b) Récupération des algues et
élimination de l'eau ; (c) Pesée de 1g ; (d) Broyage ; (e) Ajout
de la solution tampon ; (f) Homogénéisation à l'aide d'un
vortex ; (g) Incubation ; (h) Filtration ; (i) Centrifugation et (j)
Récupération de surnageant (RPE).

Annexe 7 : Les étapes de dosage des
protéines : (a) Prélèvement de 100 ul du volume de
surnageant conservé ; (b) Filtration de réactif de Bradford avant
utilisation ; (c) Ajout de 3 ml de réactif de Bradford ; d)
Homogénéisation ; (e) Mise en cuvette de la solution à
doser et (f) Lecture des absorbances à 595 nm après 5 minutes.
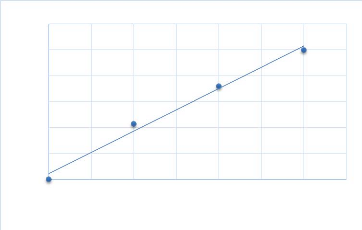
0 0,1 0,2 0,3 0,4 0,5 0,6 0,7
C (mg/ml )
0,6
0,5
Absorbance (A)
0,4
0,3
0,2
0,1
0
y = 0,821x + 0,0217 R2 =
0,9885
Annexe 8: Courbe d'étalonnage des
protéines
65
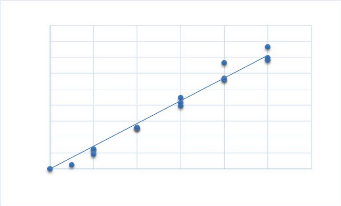
Absorbance A
0,9
0,8
0,7
0,6
0,5
0,4
0,3
0,2
0,1
0
0 0,02 0,04 0,06 0,08 0,1 0,12
C (mg/ml )
y = 7,1206x
R2 = 0,9779
Annexe 9 : Les étapes de dosage des
sucres solubles : (a) Mélange de 0,4 mL d'échantillon et 0,2 mL
de phénol 5% m/v dans un tube ; (b) Ajout de 1 mL d'acide sulfurique
concentré (H2SO4 à 98%) ; (c) Homogénéisation
à l'aide d'un vortex ; (d) Incubation des échantillons à
30°C et à l'obscurité pendant 20 minutes et (e) Lecture des
absorbances à 492 nm.
Annexe 10 : Courbe d'étalonnage des sucres
solubles
66
67
Annexe 11 : Les étapes de traitement
et de conservation de la faune collectée : (A) Pesée de touffe ;
(B) Touffe trempée dans un petit réservoir ; (C) Filtration de
l'eau ; (D) Collecte et conservation de la faune et (E) Boite de formole (1%)
utilisé dans la conservation de la faune.

68
Dédicace
Je ne peux consacrer mon travail de mémoire
qu'à mes chers parents, parce que vous êtes ce
que
j'ai de plus précieux :
,A mon Papa Tawfik, qui est pour moi beaucoup plus
qu'un père ordinaire. Je te dis infiniment merci,
car
sans toi je n'aurais jamais entamé le
mastère.
,A ma Maman Selma qui n'a cessé de me prêter
son
amour, son attention, son soutien et son
encouragement. Je t'exprime ma très vive
reconnaissance pour tes sacrifices et pour tout le
temps que tu as passée avec moi.
Le travail exposé dans ce mémoire n'aurait
pas
vu le jour sans le concours de mes proches :
,Mes soeurs Ahlem, Ichrak et Wejdene pour leurs
amours, leurs aides morale et matérielle et
l'environnement constructif qu'elles ont su
créer
autour de moi.
,Tous mes chers amis, En souvenir de nos éclats
de
rire et des bons moments. En souvenir de tout ce
qu'on a vécu ensemble. J'espère de tout mon
coeur
que notre amitié durera
éternellement.
69
Remerciements
Ce travail de mémoire a été
effectué dans le laboratoire de l'Institut National des Sciences et
Technologies de la mer (INSTM) de Kheireddine dans le cadre de l'obtention du
diplôme de mastère professionnel en Biosurveillance de
l'Environnement.
A l'issu de ces six mois de stage, je tiens tout d'abord
à remercier Monsieur HECHMI, Directeur
Général de l'INSTM pour m'avoir donné l'occasion de faire
un stage dans cet illustre institut.
Je tiens aussi à remercier les membres du jury pour
avoir accepté de juger ce travail. Je remercie Monsieur MOHAMED
DELLALI, enseignant chercheur à la FSB, qui m'a fait l'honneur
de présider le jury. Je remercie également Madame HAJER
KAAABI, enseignante à la FSB, qui a acceptée d'examiner
ce travail.
Mes plus sincères remerciements vont ensuite à
Monsieur FETHI MENSI, maître assistant et chercheur
à l'INSTM, qui m'a proposé le sujet et qui a accepté de
m'encadrer. Il a toujours sû me guider et me faire partager ses
connaissances de la phase expérimentale à la phase
rédactionnelle. Toutes nos longues discussions sur les démarches
analytiques et les tournures à prendre sur la rédaction du
manuscrit m'ont vraiment été très
bénéfiques. Je tiens aussi à lui exprimer toute ma
reconnaissance pour la confiance qu'il m'a témoignée en
m'intégrant dans son laboratoire et pour son soutien dans les moments
difficiles et merci pour ta confiance et l'autonomie que vous m'avez
laissée dès le début de mon travail.
Je suis également infiniment reconnaissante envers mon
encadrant de mémoire, Madame NEZIHA GHANEM BOUGHANMI,
Professeur à la FSB, qui m'a été d'un très grand
soutien tout au long de mon travail de mémoire. Ses suggestions, ses
remarques pertinentes, ses commentaires et ses qualités scientifiques et
humaines innombrables m'ont beaucoup apporté et m'ont permis
d'améliorer mon travail. Les mots ne pourront jamais exprimer ma
reconnaissance et ma profonde gratitude.
Je suis très redevable à Madame WAHIBA et
Mademoiselles CHAIMA et RIM, Techniciennes au Laboratoire de l'INSTM qui ont
m'a formée à l'extraction et le dosage des échantillons
biologiques. Mes remerciements s'adressent aussi à Monsieur MOHAMED
CHALGHAF, Ingénieur principal et chercheur chez l'ISPA Bizerte, et
à tout le personnel du centre de l'INSTM qui ont participé aux
sorties sur terrain dans la région de Bizerte et à tous ceux qui
de près ou de loin m'ont aidée à réaliser ce
projet.
70
Liste des abréviations
G. gracilis Gracilaria
gracilis
INSTM Institut National des Sciences et
Technologies de la Mer
MS matière sèche
|
PAR
|
Photosynthetic Active Radiation (en anglais) ou
Photosynthèse Rayonnement
|
Actif (en français)
psu Practical Salinity Units
Q Quantité
RPE R-phycoérythrine
rpm Route par minute
TCS Taux de Croissance Spécifique
UVAC Ultra-Violets Actifs
71
Liste des figures
Figure 1 : Prospection des peuplements de
Gracilaria (bande en noir) sur les bordures du lac
de Bizerte au cours des mois de Juin et Juillet 1997. 8
Figure 2: Les différentes couleurs des
thalles du Gracilaria gracilis 9
Figure 3: Aspect général du thalle
de Gracilaria gracilis du lac de Bizerte 9
Figure 4: Thalle du Gracilaria gracilis
avec cystocarpes 10
Figure 5 : Cycle de vie de Gracilaria
gracilis 10
Figure 6: Image satellitaire montrant la
situation géographique de la lagune de Bizerte. 27
Figure 7: La lagune de Bizerte. 28
Figure 8: Système de culture des touffes
de Gracilaria gracilis sur corde tendu sur le substrat
entre trois piquets de fer 32
Figure 9: (A)
Corde à prélever ; (B) Coupe de touffe à l'aide d'un
ciseau et (C) Flacon en
PVC contenant 100 ml d'échantillon d'eau à
analyser. 32
Figure 10: Variation de la température
(°C) des eaux de la lagune de Bizerte. 34
Figure 11: Variation des vitesses du vent (Km/h)
dans la lagune de Bizerte. 35
Figure 12: La concentration moyenne de
l'ammonium (?M) dans les eaux de la lagune de
Bizerte (Avril -Juin 2019). 35
Figure 13: La
concentration moyenne des nitrates (?M) dans les eaux de la lagune de
Bizerte
(Avril - Juin 2019). 35
Figure 14:Variation
du taux de croissance spécifique (TCS%.j-1) de Gracilaria
gracilis
(Avril-Juin 2019). 40
Figure 15: Variation de
la teneur en sucres solubles (%) de Gracilaria gracilis (Avril-Juin
2019). 40
Figure 16: Variation de la teneur
en protéines (%) de Gracilaria gracilis (Avril-Juin 2019).41
Figure 17: Variation de la teneur en R-phycoérythrine
(mg.g-1) de Gracilaria gracilis (Avril-
Juin 2019). 41
Figure 18: Fréquence des
différents groupes rencontrés en Avril 2019 44
Figure 19: Fréquence des
différents groupes rencontrés à Mai 2019. 44
Figure 20 : Fréquence des
différents groupes rencontrés en Juin 2019 44
72
Liste des tableaux
Tableau 1: La salinité (psu) des eaux de
la lagune de Bizerte au cours de la période d'étude
(Avril, Mai et Juin 2019). 34
Tableau 2: Croissance de Gracilaria
selon différente teneur en sel. 38
Tableau 3: Coefficients de corrélation
entre le nombre de l'isopode (Idotea balthica) et les
différentes réponses étudiées à savoir le
poids des touffes, le taux de croissance spécifique (TCS), la teneur en
matière sèche (MS), le sucre soluble, les protéines et la
R-phycoérythrine
(RPE) au cours de la période d'étude (Avril, Mai
et Juin 2019). 47
Tableau 4: Coefficients de
corrélation entre le nombre de l'amphipode (Gammarus sp.) et
les différentes réponses étudiées à savoir
le poids des touffes, le taux de croissance spécifique (TCS), la teneur
en matière sèche (MS), le sucre soluble, les protéines et
la R-phycoérythrine
(RPE) au cours de la période d'étude (Avril, Mai
et Juin 2019). 47
73
Sommaire
Introduction générale 1
Objectifs du travail 3
I. Synthèse bibliographique 4
1. Généralité sur les algues 4
1.1. Introduction 4
1.2. Classification 4
1.2.1. Les algues bleues (Cyanophycées) 4
1.2.2. Les algues brunes (Phéophycées)
4
1.2.3. Les algues vertes (Chlorophycées) 5
1.2.4. Les algues rouges (Rhodophycées) 5
2. Les Gracilaires (Gracilaria) 5
2.1. Généralité 5
2.2. Description de l'espèce Gracilaria gracilis
6
2.2.1. Présentation de l'espèce 6
2.2.2. Classification taxonomique 6
2.2.3. Cycle de reproduction 7
3. Les facteurs influençant la croissance de
Gracilaria 11
3.1. Les facteurs abiotiques 11
3.1.1. La lumière 11
3.1.2. Température et salinité 13
3.1.3. Eléments nutritifs 15
3.1.4. Hydrodynamisme 17
3.2. Facteurs biotiques 18
3.2.1. Annélides 18
3.2.2. Arthropodes 19
3.2.3. Echinodermes 22
74
3.2.4. Mollusques 24
II. Matériel et méthodes 26
1. Présentation du site d'étude (Lagune de
Bizerte) 26
2. Préparation des touffes de Gracilaria gracilis
28
3. Modalité de culture 29
4. Détermination de la composition biochimique de
Gracilaria gracilis 30
5. Identification et analyse de la faune collectée
31
III. Résultats et discussion 33
1. Les paramètres physicochimiques 33
2. Croissance et composition biochimique du Gracilaria
gracilis 36
3. La faune associée à Gracilaria gracilis
41
4. Interaction de Gracilaria gracilis et sa faune
associée 45
Conclusion et perspectives 48
Références bibliographiques
50
Annexes 62
|
|



