4.4. Effet du pH sur l'adsorption de BM sur le bioadsorbant
MA
4.1.9. Présentation des
résultats
Les
résultats sur l'effet du pH sur l'adsorption de BM sur le bioadsorbant
sont donnés par les figures 36 et 37.
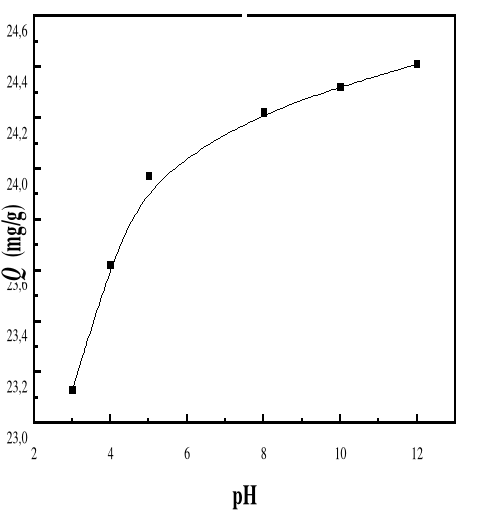
Figure 36 : Evolution de la capacité
d'adsorption maximale d'adsorption du bioadsorbant vis-à-vis de
BM en fonction du temps pour différents pH ; Ci : 50
mg/L ; T : 28#177;01 °C; V : 100 mL.
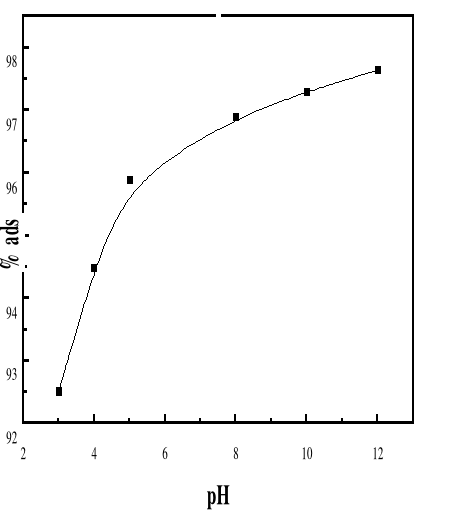
Figure 37 : Evolution du pourcentage maximal
d'adsorption du bioadsorbant vis-à-vis de BM en fonction du
temps pour différents pH ; Ci : 50 mg/L ; T :
28#177;01 °C; V : 100 mL.
4.1.10. Discussion des résultats
Les résultats ci-haut indiquent l'augmentation de la
capacité d'adsorption maximale avec le pH de la solution de BM.
La figure 39 montre une augmentation élevée du
pourcentage adsorption, lorsque le pH de la solution passe de 3 à 12.
Au-delà du pH 5, on remarque toujours l'augmentation du pourcentage mais
avec un rythme plus faible pour atteindre 97, 63 % à pH=12.
Le pHZPC permet de mieux appréhender ces
résultats. Le pHZPC est de 5, 73, ce qui signifie que la
surface de l'adsorbant est chargée positivement au pH inférieur
à 5, 73, et négativement au pH supérieur à 5, 73.
Plus le pH augmente au-delà du pHZPC, plus la densité
d'ions négatives sur la surface de MA augmente à son tour, ce qui
permet plus l'adsorption des cations du BM. Ceci est confirmé par la
faible fixation des molécules de BM en milieu fortement acide ; due
à la répulsion des molécules cationiques BM et la surface
de M.A à cause de l'attraction électrostatique
élevée entre la surface du M.A et les ions cationiques de BM ce
qui entraîne la réduction d'adsorption du colorant. Un maximum
d'adsorption du BM sur le bioadsorbant MA a été atteint au-dessus
du pHZPC.
A des faibles valeurs du pH, la surface de l'adsorbant serait
entourée par les ions H+ ce qui diminue l'interaction des
ions du bleu de méthylène (polluant cationique) avec les sites de
l'adsorbant, par contre au pH élevé, la concentration en
H+ diminue ce qui engendre une bonne interaction entre les ions du
colorant et les sites de la surface.
On observe une diminution de la concentration
résiduelle de BM avec le temps. Kifuani (2013), attribue cette
diminution à la fixation des molécules de BM sur la surface du
bioadsorbant M.A. Cette diminution se fait progressivement avec la
disponibilité des sites libres.
A la lumière de ces résultats, il ressort que
l'adsorption de BM sur MA est meilleure en milieu basique comparé au
milieu acide.
4.5. Adsorption de BM sur le bioadsorbant en fonction de la
concentration de BM
4.1.11. Présentation des résultats
Les figures 38 et 39 donnent l'évolution de la
capacité et du pourcentage d'adsorption du bioadsorbant M.A
vis-à-vis de BM en fonction de la concentration initiale.
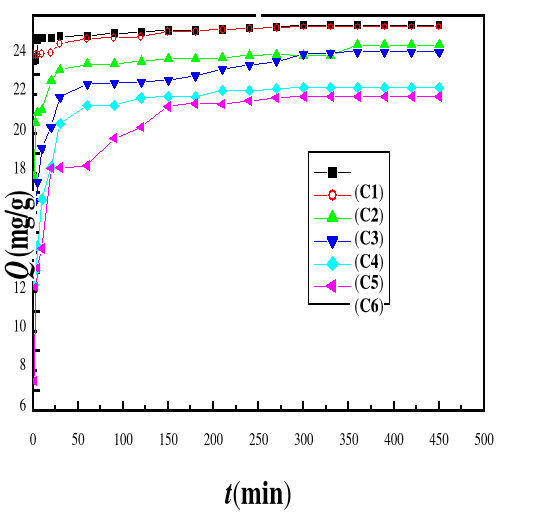
Figure 38 : Evolution de la capacité
d'adsorption du bioadsorbant MA vis-à-vis de BM en fonction de la
concentration, ë max : 664 ; C1 : 10 mg/L, : 20 mg/L,
C3 : 40 mg/L, C4 : 60 mg/L, C5 : 80 mg/L, C6 : 100 mg/L ;
T : 28#177;01 °C; V : 100 mL ; mBA : 200 mg; pH 6,69
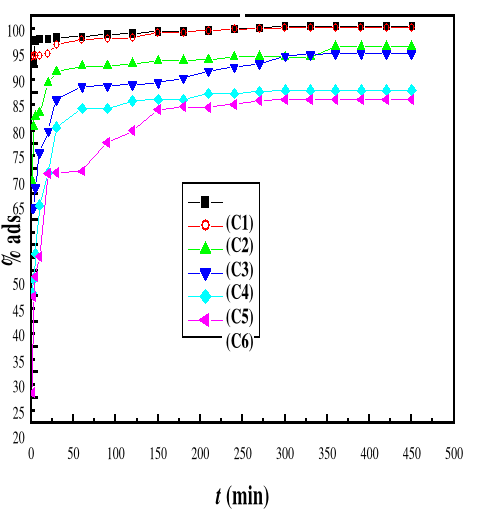
Figure 39 : Evolution du
pourcentage d'adsorption du bioadsorbant MA vis-à-vis de BM en fonction
de la concentration, ë max : 664 ; C1 : 10 mg/L, : 20
mg/L, C3 : 40 mg/L, C4 : 60 mg/L, C5 : 80 mg/L, C6 : 100
mg/L ; T : 28#177;01 °C; V : 100 mL ; mBA : 200 mg; pH 6,69
4.1.12. Discussion
Les résultats consignés dans les figures 38 et
39 indiquent que la capacité (Q) et le pourcentage
d'adsorption montrent une tendance à la baisse lorsque la concentration
initiale du BM augmentée. A des concentrations plus faibles, tous les BM
présents dans le milieu d'adsorption peuvent interagir avec les sites de
liaison sur la surface de l'adsorbant, donc des rendements plus
élevés d'adsorption ont été obtenus. A des
concentrations plus élevées, des rendements d'adsorption plus
faibles ont été observés, en raison de la saturation des
sites d'adsorption Abdallah et al. (2016) ont trouvé des
résultats similaires aux nôtres.
4.1.13. Formes d'Isothermes d'adsorption de BM sur le
bioadsorbant MA
4.1.13.1. Présentation des résultats
Les formes d'isothermes de l'adsorption de BM sur le bio
adsorbant M.A sont présentées par les figures 40 à 46.
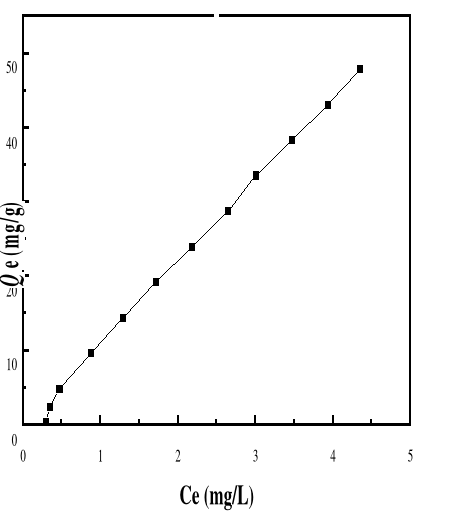
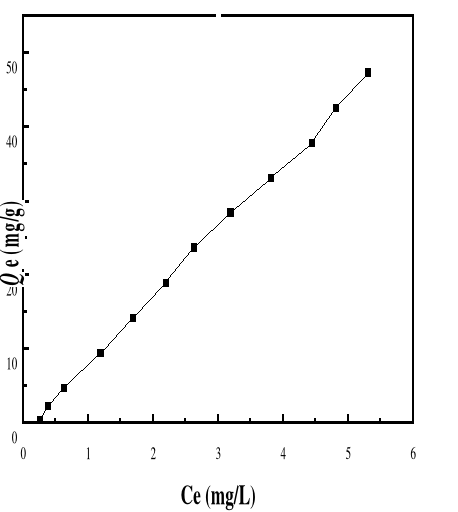
Figure 41 : Isotherme d'adsorption du BM sur le
Bioadsorbant MA à pH 4, 01; V : 100 mL ; mB : 200 mg ;
T°= 28,0#177;0,1°C ; ëmax= 664
Figure 40 : Isotherme d'adsorption du BM sur le
Bioadsorbant MA à pH 3, 05; V : 100 mL ; mB : 200 mg ;
T°= 28,0#177;0,1°C ; ëmax= 664
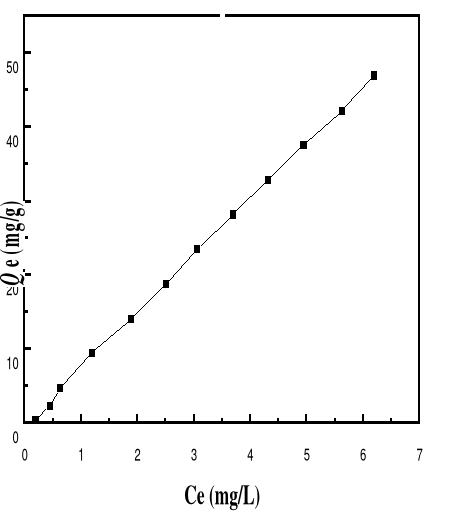
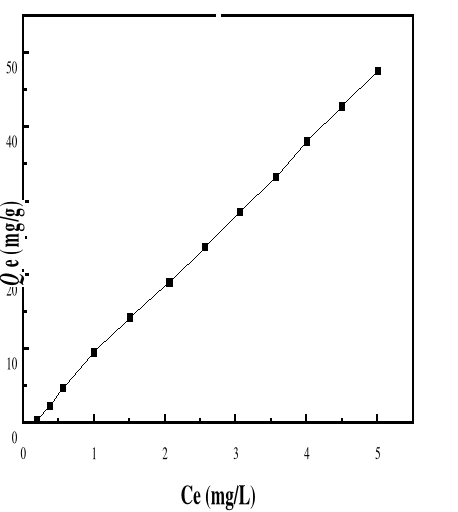
Figure 43 : Isotherme d'adsorption du BM sur le
Bioadsorbant à pH 6, 69; V : 100 mL ; mB : 200 mg ; T°=
28,0#177;0,1°C ; ëmax= 664
Figure 42 : Isotherme d'adsorption du BM sur le
Bioadsorbant à pH 5, 14; V : 100 mL ; mB : 200 mg ; T°=
28,0#177;0,1°C ; ëmax= 664
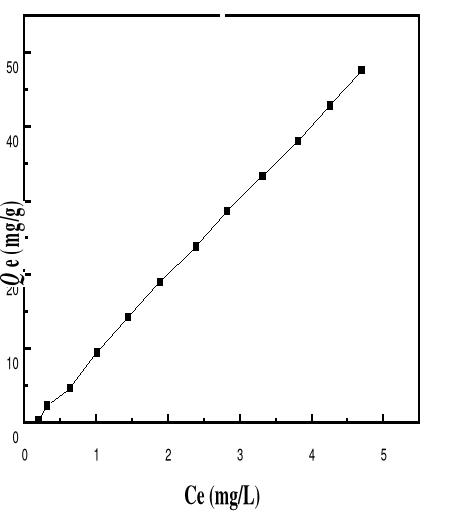
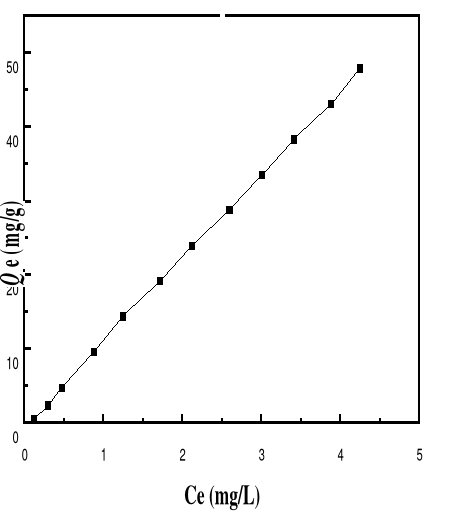
Figure 44 : Isotherme d'adsorption du BM sur le
Bioadsorbant MA à pH 8, 30; V : 100 mL ; mB : 200 mg ;
T°= 28,0#177;0,1°C ; ëmax= 664
Figure 45 : Isotherme d'adsorption du BM sur le
Bioadsorbant MAà pH 10, 01; V : 100 mL ; mB : 200 mg ;
T°= 28,0#177;0,1°C ; ëmax= 664
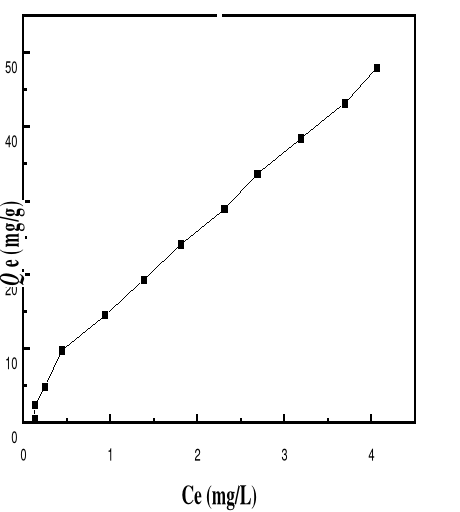
Figure 46 : Isotherme d'adsorption du BM sur le
Bioadsorbant MA à pH 12, 05; V : 100 mL ; mB : 200 mg ;
T°= 28,0#177;0,1°C ; ëmax= 664
4.1.13.2. Discussion
Les résultats obtenus pour la détermination des
isothermes (figures 40 à 46) montrent que les formes d'isothermes
obtenues sont toutes des types C pour le pH 3, 5, 6, 8 et 10 et des types S
pour le pH 4 et 12. La classe des isothermes de type C se caractérise
par une partition constante entre la solution et le substrat. La
linéarité montre que le nombre de sites libres reste constant au
cours de l'adsorption. Ceci signifie que les sites sont créés au
cours de l'adsorption. Les isothermes de cette classe sont obtenues quand les
molécules de soluté sont capables de modifier la texture du
substrat en ouvrant des pores qui n'avaient pas été ouverts
préalablement par le solvant. La classe des isothermes de type S
présente, à faible concentration, une concavité initiale
tournée vers le bas. Les molécules adsorbées favorisent
l'adsorption ultérieure d'autres molécules (adsorption
coopérative). Ceci est dû aux molécules qui s'attirent par
des forces de Van Der Waals, et se regroupent en îlots dans lesquels
elles se tassent les unes contre les autres (Benmakhlouf, 2011).
4.1.14. Modélisation des Isothermes
4.1.14.1. Présentation des résultats
La capacité maximale (Qmax) d'adsorption
vis-à-vis du BM a été déterminée à
partir des isothermes d'équilibre qui représentent la variation
de Qe=f (Ce). Les modèles d'adsorption
testés en phase liquide pour les résultats obtenus sont ceux de
Langmuir et Freundlich. L'analyse des résultats expérimentaux,
selon ces modèles a permis d'avoir les représentations graphiques
présentées par les figures 47 à 60 :
4.1.14.2. Modèle de
Langmuir
Les figures 47 à 53 présentent les figures
linéairises des isothermes de Langmuir pour l'adsorption de bleu
méthylène sur le bioadsorbant MA ;
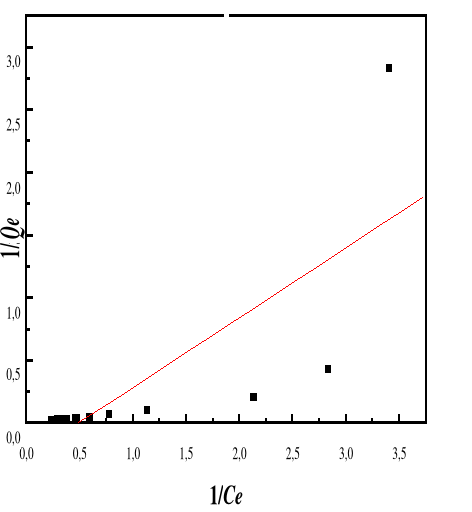
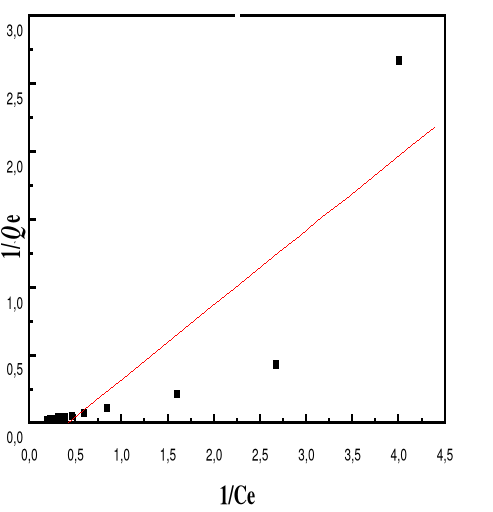
Figure 48: Isotherme d'adsorption
linéarisée du BM sur le MA à pH 4,00 (modèle de
Langmuir)
Figure 47 : Isotherme d'adsorption
linéarisée du BM sur le MA à pH 3,00 (modèle de
Langmuir)
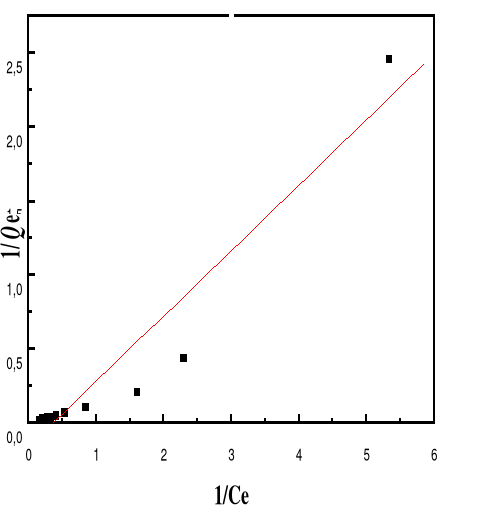
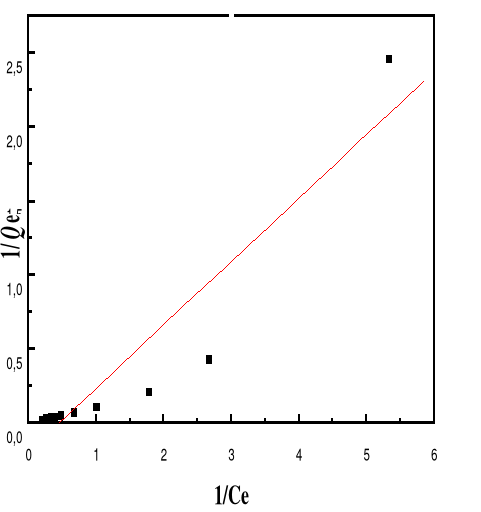
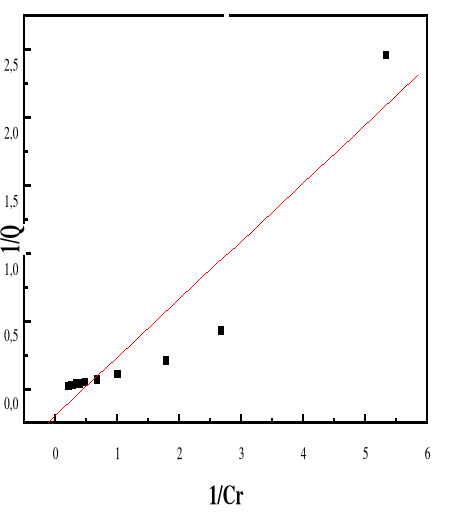
Figure 49 : Isotherme d'adsorption
linéarisée du BM sur le MA à pH 5,00 (modèle de
Langmuir)
Figure 50 : Isotherme d'adsorption
linéarisée du BM sur le MA à pH 6,00 (modèle de
Langmuir)
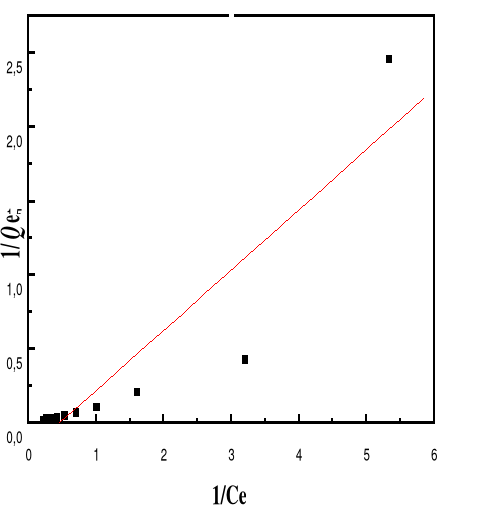
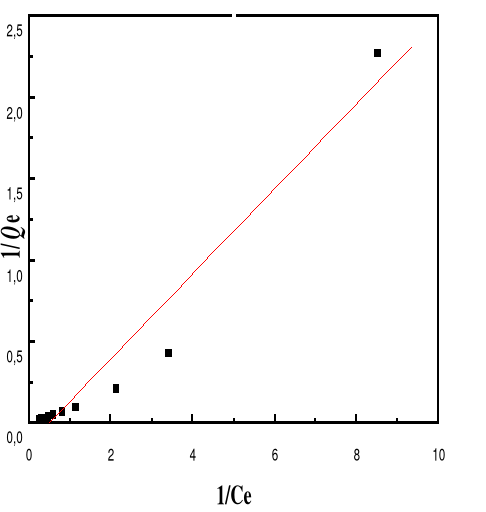
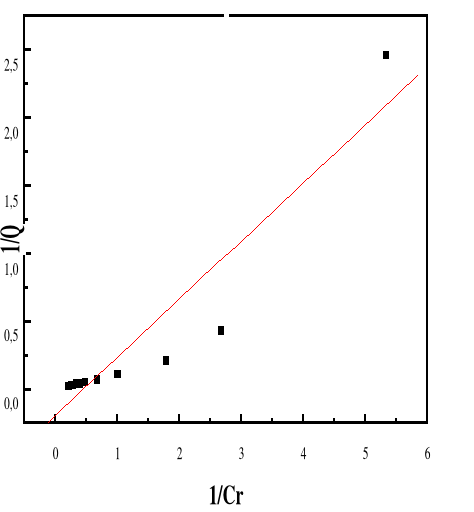
Figure 52 : Isotherme d'adsorption
linéarisée du BM sur le MA à pH 10,00 (modèle de
Langmuir)
Figure 51 : Isotherme d'adsorption
linéarisée du BM sur le MA à pH 8,00 (modèle de
Langmuir)
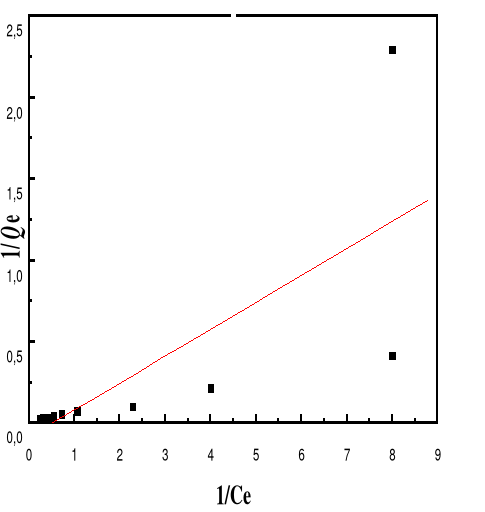
Figure 53 : Isotherme d'adsorption
linéarisée du BM sur le MA à pH 12,00 (modèle de
Langmuir)
4.1.14.3. Modèle de
Freundlich
Les figures 54 à 60 présentent les formes
linéaires des isothermes de Freundlich pour l'adsorption de bleu de
méthylène sur le bioadsorbant.
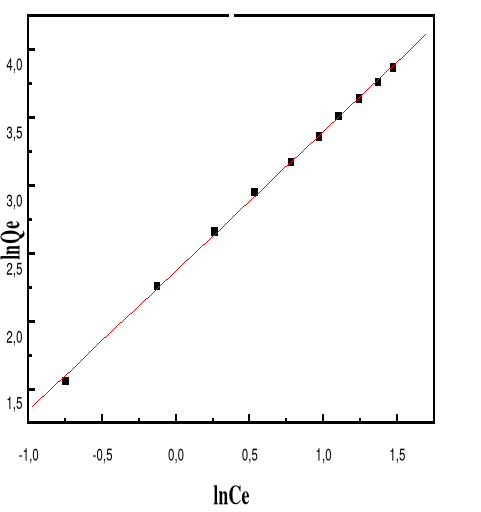

4.1.14.4. Figure 54 : Isotherme d'adsorption
linéarisée du BM sur le MA à pH 3,00 (modèle de
Freundlich)
Figure 55 : Isotherme d'adsorption
linéarisée du BM sur le MA à pH 4,00 (modèle de
Freundlich)
Figure 46 : Isotherme d'adsorption
linéarisée du BM sur le MA à pH 3,00 (modèle de
Freundlich)
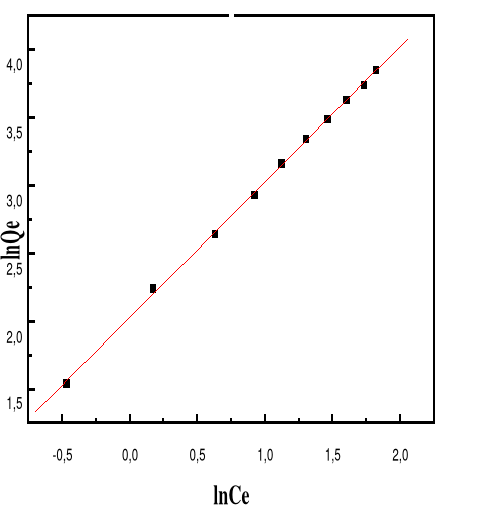
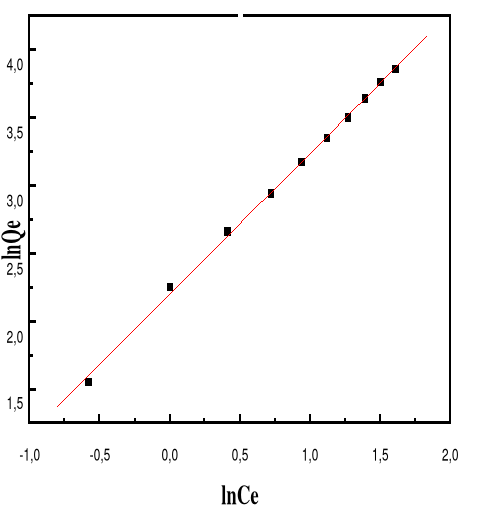
Figure 57 : Isotherme d'adsorption
linéarisée du BM sur le MA à pH 6,00 (modèle de
Freundlich)
Figure 56 : Isotherme d'adsorption
linéarisée du BM sur le MA à pH 5,00 (modèle de
Freundlich)
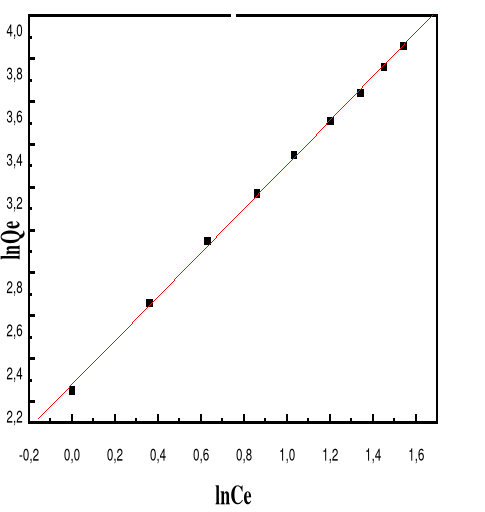
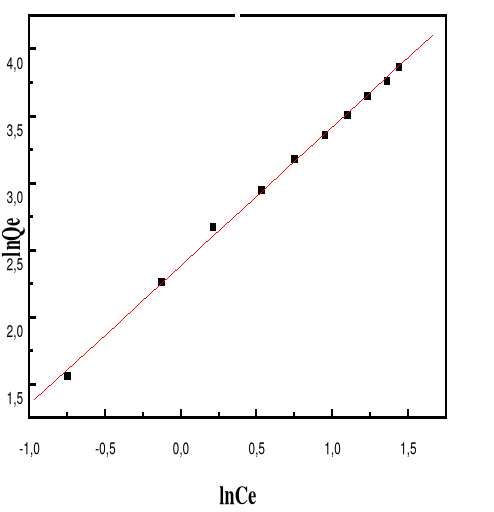
Figure 59 : Isotherme d'adsorption
linéarisée du BM sur le MA à pH 10,00 (modèle de
Freundlich)
Figure 58 : Isotherme d'adsorption
linéarisée du BM sur le MA à pH 8,00 (modèle de
Freundlich)
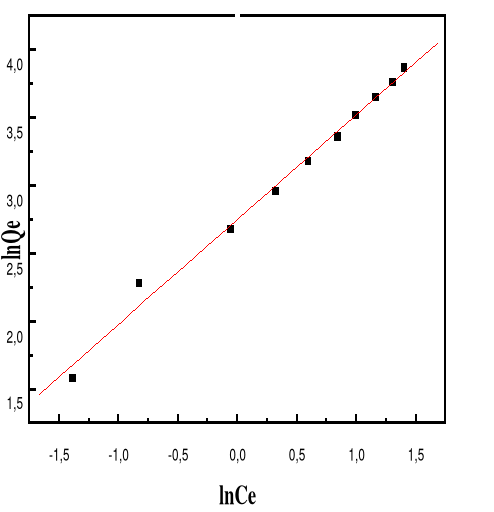
Figure 60 : Isotherme d'adsorption
linéarisée du BM sur le MA à pH 12,00 (modèle de
Freundlich)
Le tableau 11 donne les paramètres de Langmuir et de
Freundlich déterminés pour l'adsorption de bleu de
méthylène sur le bioadsorbant MA.
Tableau 11 : Paramètres de Langmuir et de
Freundlich pour l'adsorption du BM sur le bioadsorbant MA
|
pH
|
Paramètres de Langmuir
|
Paramètres de Freundlich
|
|
Qmax (mg g-1)
|
KL *
|
R2
|
Kf *
|
1/n
|
R2
|
|
3
|
47
|
0,22694
|
0,87705
|
2 ,07207
|
0,03037
|
0,99925
|
|
4
|
48
|
0,27932
|
0,76403
|
2,37096
|
0,02358
|
0,99954
|
|
5
|
48
|
0,1922
|
0,93925
|
2,19963
|
0,02885
|
0,99932
|
|
6
|
47
|
0,16152
|
0,95998
|
2,02898
|
0,02048
|
0,99965
|
|
8
|
48
|
0,18841
|
0,9179
|
2,27796
|
0,01721
|
0,99955
|
|
10
|
48
|
0,12957
|
0,97435
|
2,386
|
0,03364
|
0,99907
|
|
12
|
48
|
0,08778
|
0,75254
|
2,70822
|
0,01895
|
0,99909
|
· Unité de Kf : (mg
g-1) cmg L-1) -1/n
· Unité de KL (L
mg-1)
4.1.14.5. Discussion
Les résultats consignés dans le tableau 11
montre que :
- Les coefficients de corrélation sont
supérieurs à 0,75, ce qui indique que l'adsorption du BM sur le
bioadorbant M.A peut être décrite par le modèle de Langmuir
et le modèle de Freundlich. Toutefois, le modèle de Freundlich
est le mieux approprié pour décrire l'adsorption de BM sur le
bioadsorbant MA, car les coefficients de corrélation du modèle de
Freundlich sont plus élevés comparés à ceux obtenus
avec le modèle de Langmuir, pour tous les pH ;
- Les valeurs du paramètre de Freundlich 1/n sont
inférieurs à 1 pour tous les pH étudiés montrent
l'adsorption est favorable.
| 


