|
EPIGRAPHE
Or, à celui qui fait une oeuvre, le salaire est
imputé, non comme une grâce, mais comme une chose due;
Romains 4 :4
DEDICACE
Je dédie ce modeste travail
A mes chers parents
Affable, honorable, aimable : vous représentez pour moi
le symbole de la bonté par excellence, la source de tendresse et
l'exemple du dévouement qui n'a pas cessé de m'encourager et de
prier pour moi.
Votre prière et votre bénédiction m'ont
été d'un grand secours pour mener à bien mes
études.
Aucune dédicace ne saurait être assez
éloquente pour exprimer ce que vous méritez pour tous les
sacrifices que vous n'avez cessé de me donner depuis ma naissance,
durant mon enfance et même à l'âge adulte.
Je vous dédie ce travail en témoignage de mon
profond amour. Puisse Dieu, le tout puissant, vous préserves et vous
accordes santé, longue vie et bonheur.
A ma famille
En témoignage de l'attachement, de l'amour et de
l'affection que je porte pour vous. Je vous remercie de votre
hospitalité sans égal et de votre affection si
sincère.
A Aimé Tuti Nsimba et à mon cher Oncle
Dr. Alain Weller Etsale
Veuillez trouver dans ce modeste travail l'expression de mon
affection.
A tous ceux qui sont chers à mon
coeur
A ceux qui m'ont aidé pour préparer ce
travail, de prés ou de loin, même avec un mot d'encouragement et
de gentillesse.
A tous ceux que j'aime et qui ont une pensée
pour moi.
REMERCIEMENTS
Tout d'abord je remercie mon grand Dieu, le père de
notre Seigneur Jésus-Christ de m'avoir donné la santé, le
courage et la volonté d'achever mon travail et aussi d'avoir eu la
bonté de m'entourer de personnes formidables qui ont, chacune à
sa façon, et ce, à différentes étapes de mon
cheminement, contribué, d'une manière ou d'une autre, à la
réalisation de ce travail.
Les résultats présentés dans ce travail
ont été réalisés en concomitance avec le
Laboratoire de Chimie Organique,
Physique, Eau et Environnement «
LACOPE » en sigle, le Laboratoire de
Pédologie et le Laboratoire de Chimie
Analytique.
Je tiens à adresser mes sincères remerciements
à Monsieur Anatole KIFUANI KIA MAYEKO,
Professeur à l'Université de Kinshasa, qui a accepté de
m'encadrer, en me soutenant tout le long de l'élaboration de ce
mémoire. Votre sérieux, votre compétence et votre sens du
devoir m'ont énormément marqué. Veuillez trouver ici
l'expression de ma respectueuse considération et ma profonde admiration
pour toutes vos qualités scientifiques et humaines, pour avoir suivie de
près notre travail.
Je remercie Madame Kifline KIFUANI MILEBUDI,
Chef des travaux au département de Génie Energétique et
Environnemental de la Faculté de Pétrole et Gaz de
l'Université de Kinshasa. Sa rigueur a été pour nous un
motif d'encouragement dans la recherche d'un meilleur rendement. Ses conseils
ont été plus utiles. Je vous dis merci Madame.
Nos remerciements s'adressent aussi à madame
Irène KIBAL et à Monsieur José
TSHIBANDA, respectivement Assistante à la Faculté de
Pétrole, Gaz et Energies nouvelles et Chef de Travaux à la
Faculté des Sciences de l'Université de Kinshasa qui nous ont
accepté dans leur laboratoire. Que le Chef des Travaux Jean
MVONDO MBALA NGONFI, les Assistants Aristote MATONDO, Junior
KINDALA et Bernick TSHENE se reconnaissent dans ces
lignes pour leur soutien pendant les manipulations au laboratoire.
Ce travail n'aurait jamais pu se réaliser sans le
soutien continu des membres de ma famille. Que ce mémoire apporte la
fierté méritée à ma très chère maman
NGAMAMONGO MWABI Weller, mon cher papa John N'KWADY KANKOLONG,
mes soeurs et mes frères Stany et BH MOMENE, Brunelle NKASA,
Rose, Allégresse, Price, Kemuel, et Esther N'KWADY, Chavez, Sabrina et
Jonicia BATEKO, Jaspe et Béryl ETSALE, Eureka et Aurore EKOMISA,
Hénoch MOMENE, à mes tantes et mes oncles Natalie LOSAMBO, Alain
Weller et Nancy ETSALE.
Mes remerciements à la grande famille de Club des
étudiants en Sciences de l'environnement, en sigle,
CESEN/Asbl et à l'ensemble des membres de
l'ONGD Biogenèse.
Un grand merci à mes amies, en particulier Shekinah
NDEMBA, Ketsia MABIALA, Noelly WABI, Darmeline MUSIKA, Monique NGALULA, Jersey
MPANZU, Délices BASHIYA, Jemima MABIALA, Esther NSIMBA, Rebecca WASSA,
Merveille et Glody DJUNGA, Judith ILIABA, Arlette KALAMATA, Monique BADIMBA,
Christelle MANGOMBO, Edmond IMOWA, Valentin SANA, Alain LUKUSA, Arnold
SONGISA, Lynda MALUNDAMA, Jevic MBUNGU, Bonita NGINAMAWU, Grâce NZONZIMBU
et Elise LEKAEPELE qui ont eu confiance en moi et qui, par leur présence
et leur soutien, m'ont aidé à surmonter certains moments
difficiles.
Enfin, je rends hommage et j'exprime ma reconnaissance
à tous ceux qui, un jour ou l'autre, m'ont offert leur amitié et
des moments inoubliables.
LISTE DES TABLEAUX
|
Tableau 1
|
Principaux groupements chromophores et auxochromes (Benamraoui
2014)
|
11
|
|
Tableau 2
|
Classification des colorants synthétiques
|
13
|
|
Tableau 3
|
Principaux avantages et inconvénients des techniques de
traitements des colorants (Zawlotski et al, 2004).
|
21
|
|
Tableau 4
|
Caractéristiques et Propriétés
physico-chimiques du Bleu de Méthylène
|
22
|
|
Tableau 5
|
Principales Différences entre l'adsorption physique et
l'adsorption chimique
|
25
|
|
Tableau 6
|
Différents bioadsorbants
|
32
|
|
Tableau 7
|
Classification taxonomique de Musa acuminata
|
33
|
|
Tableau 8
|
Variation de l'absorbance en fonction des concentrations de la
solution de Bleu de Méthylène pour différents pH.
|
45
|
|
Tableau 9
|
Caractéristiques du bioadsorbant MA
|
50
|
|
Tableau10
|
Variation de la capacité et du pourcentage maximale
d'adsorption en fonction de la masse
|
57
|
|
Tableau 11
|
Paramètres de Langmuir et de Freundlich pour
l'adsorption du BM sur le bioadsorbant
|
70
|
|
Tableau 12
|
Capacité d'adsorption du bioadsorbant MA
vis-à-vis de BM en fonction du temps, ë max :
664 ; Ci : 50 mg/L ; T : 28#177;01°C; V : 100 mL ;
mBA : 10mg
|
79
|
|
Tableau 13
|
Capacité d'adsorption du bioadsorbant MA
vis-à-vis de BM en fonction du temps, ë max :
664 ; Ci : 50 mg/L ; T : 28#177;01°C; V : 100 mL ;
mBA : 50mg
|
80
|
|
Tableau 14
|
Capacité d'adsorption du bioadsorbant MA
vis-à-vis de BM en fonction du temps, ë max :
664 ; Ci : 50 mg/L ; T : 28#177;01°C; V : 100 mL ;
mBA : 100 mg
|
80
|
|
Tableau 15
|
Capacité d'adsorption du bioadsorbant MA
vis-à-vis de BM en fonction du temps, ë max :
664 ; Ci : 50 mg/L ; T : 28#177;01°C; V : 100 mL ;
mBA : 200 mg
|
81
|
|
Tableau 16
|
Capacité d'adsorption du bioadsorbant MA
vis-à-vis de BM en fonction du temps, ë max :
664 ; Ci : 50 mg/L ; T : 28#177;01°C; V : 100 mL ;
mBA : 400 mg
|
81
|
|
Tableau 17
|
Capacité d'adsorption du bioadsorbant MA
vis-à-vis de BM en fonction du temps, ë max :
664 ; Ci : 50 mg/L ; T : 28#177;01°C; V : 100 mL ;
mBA : 800 mg
|
82
|
|
Tableau 18
|
Capacité d'adsorption du bioadsorbant MA
vis-à-vis de BM en fonction du temps, ë max :
664 ; Ci : 50 mg/L ; T : 28#177;01°C; V : 100 mL ;
mBA : 1000 mg
|
82
|
|
Tableau 19
|
Capacité d'adsorption du bioadsorbant MA
vis-à-vis de BM en fonction du pH, ë max :
664 ; Ci : 50 mg/L ; T : 28#177;01°C; pH :
3,05 ; V : 100 mL ; mBA : 200 mg
|
83
|
|
Tableau 20
|
Capacité d'adsorption du bioadsorbant MA
vis-à-vis de BM en fonction du pH, ë max :
662 ; Ci : 50 mg/L ; T : 28#177;01°C; pH : 4, 01;
V : 100 mL ; mBA : 200 mg
|
83
|
|
Tableau 21
|
Capacité d'adsorption du bioadsorbant MA
vis-à-vis de BM en fonction du pH, ë max :
664 ; Ci : 50 mg/L ; T : 28#177;01°C; pH : 5, 14;
V : 100 mL ; mBA : 200 mg
|
84
|
|
Tableau 22
|
Capacité d'adsorption du bioadsorbant MA
vis-à-vis de BM en fonction du pH, ë max :
664 ; Ci : 50 mg/L ; T : 28#177;01°C; pH : 8,30;
V : 100 mL ; mBA : 200 mg
|
84
|
|
Tableau 23
|
Capacité d'adsorption du bioadsorbant MA
vis-à-vis de BM en fonction du pH, ë max :
662 ; Ci : 50 mg/L ; T : 28#177;01°C; pH : 10,01
; V : 100 mL ; mBA : 200 mg
|
85
|
|
Tableau 24
|
Capacité d'adsorption du bioadsorbant MA
vis-à-vis de BM en fonction du pH, ë max :
662 ; Ci : 50 mg/L ; T : 28#177;01°C; pH : 12,
05; V : 100 mL ; mBA : 200 mg
|
85
|
|
Tableau 25
|
Capacité d'adsorption du bioadsorbant MA
vis-à-vis de BM en fonction de la Concentration initiale,
ë max : 664 ; Ci : 10 mg/L ; T :
28#177;01°C; pH : 6,69 ; V : 100 mL ; mBA : 200 mg
|
86
|
|
Tableau 26
|
Capacité d'adsorption du bioadsorbant MA
vis-à-vis de BM en fonction de la Concentration initiale,
ë max : 664 ; Ci : 20 mg/L ; T :
28#177;01°C; pH : 6,69 ; V : 100 mL ; mBA : 200 mg
|
86
|
|
Tableau 27
|
Capacité d'adsorption du bioadsorbant MA
vis-à-vis de BM en fonction de la Concentration initiale,
ë max : 664 ; Ci : 40 mg/L ; T :
28#177;01°C; pH : 6,69 ; V : 100 mL ; mBA : 200 mg
|
87
|
|
Tableau 28
|
Capacité d'adsorption du bioadsorbant MA
vis-à-vis de BM en fonction de la Concentration initiale,
ë max : 664 ; Ci : 60 mg/L ; T :
28#177;01°C; pH : 6,69 ; V : 100 mL ; mBA : 200 mg
|
87
|
|
Tableau 29
|
Capacité d'adsorption du bioadsorbant MA
vis-à-vis de BM en fonction de la Concentration initiale,
ë max : 664 ; Ci : 80 mg/L ; T :
28#177;01°C; pH : 6,69 ; V : 100 mL ; mBA : 200 mg
|
88
|
|
Tableau 30
|
Capacité d'adsorption du bioadsorbant MA
vis-à-vis de BM en fonction de la Concentration initiale,
ë max : 664 ; Ci : 100 mg/L ; T :
28#177;01°C; pH : 6,69 ; V : 100 mL ; mBA : 200 mg
|
88
|
|
Tableau 31
|
Capacité d'adsorption du bioadsorbant MA
vis-à-vis de BM en fonction de la Concentration initiale,
ë max : 664 ; Ci : 50 mg/L ; T :
28#177;01°C; pH : 3, 05 ; V : 100 mL ; mBA : 200
mg
|
89
|
|
Tableau 32
|
Capacité d'adsorption du bioadsorbant MA
vis-à-vis de BM en fonction de la Concentration initiale,
ë max : 664 ; Ci : 50 mg/L ; T :
28#177;01°C; pH : 4, 01; V : 100 mL ; mBA : 200 mg
|
89
|
|
Tableau 33
|
Capacité d'adsorption du bioadsorbant MA
vis-à-vis de BM en fonction de la Concentration initiale,
ë max : 664 ; Ci : 50 mg/L ; T :
28#177;01°C; pH : 5, 14; V : 100 mL ; mBA : 200 mg
|
90
|
|
Tableau 34
|
Capacité d'adsorption du bioadsorbant MA
vis-à-vis de BM en fonction de la Concentration initiale,
ë max : 664 ; Ci : 50 mg/L ; T :
28#177;01°C; pH : 6, 69; V : 100 mL ; mBA : 200 mg
|
90
|
|
Tableau 35
|
Capacité d'adsorption du bioadsorbant MA
vis-à-vis de BM en fonction de la Concentration initiale,
ë max : 664 ; Ci : 50 mg/L ; T :
28#177;01°C; pH : 8, 30; V : 100 mL ; mBA : 200 mg
|
91
|
|
Tableau 36
|
Capacité d'adsorption du bioadsorbant MA
vis-à-vis de BM en fonction de la Concentration initiale,
ë max : 664 ; Ci : 50 mg/L ; T :
28#177;01°C; pH : 10, 01; V : 100 mL ; mBA : 200 mg
|
91
|
|
Tableau 37
|
Capacité d'adsorption du bioadsorbant MA
vis-à-vis de BM en fonction de la Concentration initiale,
ë max : 664 ; Ci : 50
mg/L ; T : 28#177;01°C; pH : 12, 05; V :
100 mL ; mBA : 200 mg
|
92
|
LISTE DES FIGURES
|
Figure 1
|
Bioaccumulation
|
16
|
|
Figure 2
|
Structure chimique du bleu de méthylène
|
22
|
|
Figure 3
|
Caractéristiques et interactions à prendre en
compte dans un système ternaire adsorbant/adsorbat/solvant,
d'après Sancey, 2011
|
25
|
|
Figure 4
|
Classification des isothermes d'adsorption selon Giles et
al
|
29
|
|
Figure 5
|
Etape de préparation d'un Bioadsorbant (Michée
N'kwady)
|
39
|
|
Figure 6
|
Epluchure de Musa acuminata à l'Etat brut
(Photo Michée N'KWADY)
|
39
|
|
Figure 7
|
Epluchure de Musa acuminata après deux
semaines de séchage (Photo Michée N'KWADY)
|
39
|
|
Figure 8
|
Bioadsorbant préparé
|
40
|
|
Figure 9
|
La traversée d'une lumière monochromatique
|
43
|
|
Figure 10
|
Evolution de l'absorbance en fonction de la concentration de
la solution de Bleu de Méthylène ë max 664 ;
T : 28#177;01°C ; V : 100 mL ; pH 3,05
|
45
|
|
Figure 11
|
Evolution de l'absorbance en fonction de la concentration de
la solution de Bleu de Méthylène ë max 664 ;
T : 28#177;01°C; V : 100 mL ; pH 4,01
|
45
|
|
Figure 12
|
Evolution de l'absorbance en fonction de la concentration de
la solution de Bleu de Méthylène ë max 662 ;
T : 28#177;01°C; V : 100 mL ; pH 5,14
|
45
|
|
Figure 13
|
Evolution de l'absorbance en fonction de la concentration de
la solution de Bleu de Méthylène ë max 664 ;
T : 28#177;01°C; V : 100 mL ; pH 6,69
|
45
|
|
Figure 14
|
Evolution de l'absorbance en fonction de la concentration de
la solution de Bleu de Méthylène ë max 664 ;
T : 28#177;01°C; V : 100 mL ; pH 8,30
|
46
|
|
Figure 15
|
Evolution de l'absorbance en fonction de la concentration de
la solution de Bleu de Méthylène ë max 662 ;
T : 28#177;01°C; V : 100 mL ; pH 10,01
|
46
|
|
Figure 16
|
Evolution de l'absorbance en fonction de la concentration de
la solution de Bleu de Méthylène ë max 662 ;
T : 28#177;01°C; V : 100 mL ; pH 12,05
|
46
|
|
Figure 17
|
Détermination du pHzpc
|
50
|
|
Figure 18
|
Evolution de la capacité d'adsorption du bioadsorbant
MA vis-à-vis de BM en fonction du temps, ë max : 664 ;
Ci : 50 mg/L ; T : 28#177;01°C; V : 100 mL ; mBA : 10 mg pH
6,69
|
51
|
|
Figure 19
|
Evolution du pourcentage d'adsorption du bioadsorbant MA
vis-à-vis de BM en fonction du temps, ë max
:664 ; Ci : 50 mg/L ; T : 28#177;01°C; V : 100 mL ;
mBA : 10 mg ; pH 6,69
|
52
|
|
Figure 20
|
Evolution de la capacité d'adsorption du bioadsorbant
MA vis-à-vis de BM en fonction du temps, ë max : 664 ;
Ci : 50 mg/L ; T : 28#177;01°C; V : 100 mL ; mBA : 50 mg
pH : 6,69
|
52
|
|
Figure 21
|
Evolution du pourcentage d'adsorption du bioadsorbant MA
vis-à-vis de BM en fonction du temps, ë max
:664 ; Ci : 50 mg/L ; T : 28#177;01°C; V : 100 mL ;
mBA : 50 mg ; pH 6,69
|
53
|
|
Figure 22
|
Evolution de la capacité d'adsorption du bioadsorbant
MA vis-à-vis de BM en fonction du temps, ë max : 664 ;
Ci : 50 mg/L ; T : 28#177;01°C; V : 100 mL ; mBA : 100 mg
pH : 6,69
|
53
|
|
Figure 23
|
Evolution du pourcentage d'adsorption du bioadsorbant MA
vis-à-vis de BM en fonction du temps, ë max
:664 ; Ci : 50 mg/L ; T : 28#177;01°C; V : 100 mL ;
mBA : 100 mg ; pH 6,69
|
54
|
|
Figure 24
|
Evolution de la capacité d'adsorption du bioadsorbant
MA vis-à-vis de BM en fonction du temps, ë max : 664 ;
Ci : 50 mg/L ; T : 28#177;01°C; V : 100 mL ; mBA : 200 mg; pH
6,69
|
54
|
|
Figure 25
|
Evolution du pourcentage d'adsorption du bioadsorbant MA
vis-à-vis de BM en fonction du temps, ë max
:664 ; Ci : 50 mg/L ; T : 28#177;01°C; V : 100 mL ;
mBA : 200 mg; pH 6,69
|
55
|
|
Figure 26
|
Evolution de la capacité d'adsorption du bioadsorbant
MA vis-à-vis de BM en fonction du temps, ë max : 664 ;
Ci : 50 mg/L ; T : 28#177;01°C; V : 100 mL ; mBA : 400 mg; pH 6,69
|
55
|
|
Figure 27
|
Evolution du pourcentage d'adsorption du bioadsorbant MA
vis-à-vis de BM en fonction du temps, ë max
:664 ; Ci : 50 mg/L ; T : 28#177;01°C; V : 100 mL ;
mBA : 400 mg; pH 6,69
|
56
|
|
Figure 28
|
Evolution de la capacité d'adsorption du bioadsorbant
MA vis-à-vis de BM en fonction du temps, ë max : 664 ;
Ci : 50 mg/L ; T : 28#177;01°C; V : 100 mL ; mBA : 800 mg; pH 6,69
|
56
|
|
Figure 29
|
Evolution du pourcentage d'adsorption du bioadsorbant MA
vis-à-vis de BM en fonction du temps, ë max
:664 ; Ci : 50 mg/L ; T : 28#177;01°C; V : 100 mL ;
mBA : 800 mg; pH 6,69
|
57
|
|
Figure 30
|
Evolution de la capacité d'adsorption du bioadsorbant
MA vis-à-vis de BM en fonction du temps, ë max : 664 ;
Ci : 50 mg/L ; T : 28#177;01°C; V : 100 mL ; mBA : 1000 mg; pH 6,69
|
57
|
|
Figure 31
|
Evolution du pourcentage d'adsorption du bioadsorbant MA
vis-à-vis de BM en fonction du temps, ë max :
664 ; Ci : 50 mg/L ; T : 28#177;01°C; V : 100 mL ;
mBA : 1000 mg; pH 6,69
|
58
|
|
Figure 32
|
Evolution de la capacité d'adsorption vis-à-vis
de différentes masses
|
58
|
|
Figure 33
|
Evolution du pourcentage maximal d'adsorption en fonction de
la masse
|
59
|
|
Figure 34
|
Evolution capacité d'adsorption du bioaadsorbant M.A
vis-à-vis de BM en fonction du temps pour différents
pH
|
60
|
|
Figure 35
|
Evolution du pourcentage d'adsorption de bioadsorbant M.A
vis-à-vis de BM en fonction du temps pour différents pH
|
61
|
|
Figure 36
|
Evolution de la capacité d'adsorption maximale
d'adsorption du Musa acuminata vis-à-vis de BM en fonction du
temps pour différents pH
|
62
|
|
Figure 37
|
Evolution du pourcentage maximal d'adsorption du Musa
acuminata vis-à-vis de BM en fonction du temps pour
différents pH
|
63
|
|
Figure 38
|
Evolution de la capacité d'adsorption du bioadsorbant
MA vis-à-vis de BM en fonction de la concentration, ë
max : 664 ; Ci : 50 mg/L ; T : 28#177;01°C; V : 100 mL ; mBA :
200 mg; pH 6,69
|
66
|
|
Figure 39
|
Evolution de la capacité d'adsorption du bioadsorbant
MA vis-à-vis de BM en fonction de la concentration, ë
max : 664 ; Ci : 50 mg/L ; T : 28#177;01°C; V : 100 mL ; mBA :
200 mg; pH 6,69
|
66
|
|
Figure 40
|
Isotherme d'adsorption du BM sur le Bioadsorbant à pH
3; V : 100 mL ; mB : 200 mg ; T°= 28,0#177;0,1°C ;
ëmax= 664
|
67
|
|
Figure 41
|
Isotherme d'adsorption du BM sur le Bioadsorbant à pH
4; V : 100 mL ; mB : 200 mg ; T°= 28,0#177;0,1°C ;
ëmax= 662
|
67
|
|
Figure 42
|
Isotherme d'adsorption du BM sur le Bioadsorbant à pH
5; V : 100 mL ; mB : 200 mg ; T°= 28,0#177;0,1°C ;
ëmax= 664
|
67
|
|
Figure 43
|
Isotherme d'adsorption du BM sur le Bioadsorbant à pH
6; V : 100 mL ; mB : 200 mg ; T°= 28,0#177;0,1°C ;
ëmax= 664
|
67
|
|
Figure 44
|
Isotherme d'adsorption du BM sur le Bioadsorbant à pH
8; V : 100 mL ; mB : 200 mg ; T°= 28,0#177;0,1°C ;
ëmax= 664
|
68
|
|
Figure 45
|
Isotherme d'adsorption du BM sur le Bioadsorbant à pH
10; V : 100 mL ; mB : 200 mg ; T°= 28,0#177;0,1°C ;
ëmax= 662
|
68
|
|
Figure 46
|
Isotherme d'adsorption du BM sur le Bioadsorbant à pH
12; V : 100 mL ; mB : 200 mg ; T°= 28,0#177;0,1°C ;
ëmax= 662
|
68
|
|
Figure 47
|
Isotherme d'adsorption linéarisée du BM sur le
MA à pH 3,05 (modèle de Langmuir)
|
69
|
|
Figure 48
|
Isotherme d'adsorption linéarisée du BM sur le
MA à pH 4,01 (modèle de Langmuir)
|
69
|
|
Figure 49
|
Isotherme d'adsorption linéarisée du BM sur le
MA à pH 5,14 (modèle de Langmuir)
|
69
|
|
Figure 50
|
Isotherme d'adsorption linéarisée du BM sur le
MA à pH 6,69 (modèle de Langmuir)
|
69
|
|
Figure 51
|
Isotherme d'adsorption linéarisée du BM sur le
MA à pH 8,30 (modèle de Langmuir)
|
70
|
|
Figure 52
|
Isotherme d'adsorption linéarisée du BM sur le
MA à pH 10,01 (modèle de Langmuir)
|
70
|
|
Figure 53
|
Isotherme d'adsorption linéarisée du BM sur le
MA à pH 12,05 (modèle de Langmuir)
|
70
|
|
Figure 54
|
Isotherme d'adsorption linéarisée du BM sur le
MA à pH 3,05 (modèle de Freundlich)
|
71
|
|
Figure 55
|
Isotherme d'adsorption linéarisée du BM sur le
MA à pH 4,01 (modèle de Freundlich)
|
71
|
|
Figure 56
|
Isotherme d'adsorption linéarisée du BM sur le
MA à pH 5,14 (modèle de Freundlich)
|
71
|
|
Figure 57
|
Isotherme d'adsorption linéarisée du BM sur le
MA à pH 6, 69 (modèle de Freundlich)
|
71
|
|
Figure 58
|
Isotherme d'adsorption linéarisée du BM sur le
MA à pH 8, 30 (modèle de Freundlich)
|
72
|
|
Figure 59
|
Isotherme d'adsorption linéarisée du BM sur le
MA à pH 10,01 (modèle de Freundlich)
|
72
|
|
Figure 60
|
Isotherme d'adsorption linéarisée du BM sur le
MA à pH 12,05 (modèle de Freundlich)
|
72
|
ABREVIATIONS
|
Dans ce manuscrit nous avons utilisé les
abréviations suivantes :
|
|
B.A
|
Bioadsorbant
|
|
BM
|
Bleu de Méthylène
|
|
DBO
|
Demande Biochimique en Oxygène
|
|
DCO
|
Demande Chimique en Oxygène
|
|
LACOPE
|
Laboratoire de Chimie Organique, Physique, Eau et
Environnement
|
|
MA
|
Musa acuminata
|
|
MES
|
Matière en Suspension
|
|
mg/L
|
Milligramme par litre
|
|
pH
|
Potentiel hydrogène
|
|
pHzpc
|
pH du point de charge nulle
|
|
R2
|
Coefficient de corrélation
|
RESUME
Dans cette étude, nous avons procédé
à l'élimination du colorant du bleu de méthylène en
solution aqueuse par l'adsorption sur un bioadsorbant issu des
épluchures de Musa acuminata. Le bioadsorbant Musa
acuminata a été utilisé à l'état brut.
Plusieurs paramètres ont été étudiés, tels
que le temps de contact, le pH, la concentration initiale en bleu de
méthylène et la masse du bioadsorbant.
Les résultats obtenus montrent que l'équilibre
est atteint pendant un temps de contact de 300 min, le pouvoir de
rétention du bleu de méthylène sur les épluchures
de Musa acuminata augmente avec le pH. L'augmentation de la
concentration du BM entraine un accroissement de l'adsorption.
Les isothermes de Langmuir et de Freundlich ont
été utilisées pour décrire l'adsorption de
BM ; le modèle de Freundlich à un meilleur coefficient de
corrélation et donc le mieux approprié pour décrire
l'adsorption du bleu de méthylène sur le bioadsorbant
étudié.
Mots clés : adsorption- Musa
acuminata, colorant, bleu de méthylène.
ABSTRACT
In this study, we removed methylene blue in aqueous solution
by adsorption on Musa acuminata peelings bioadsorbant. The
bioadsorbent Musa acuminata was used in the raw state. Several parameters were
studied, such as contact time, pH, initial concentration of methylene blue and
the mass of the bioadsorbant.
The results showed that the equilibrium is reached during a
contact time of 300 min the retention capacity of methylene blue on Musa
acuminata peelings bioadsorbant increases with the increase of pH, the
increase of the concentration of MB.
The Langmuir and Freundlich isotherms were used to describe
adsorption of MB from the results, the Freundlich model give a better
correlation coefficient.
Key words: adsorption-musa acuminata, dye, methylene
blue.
TABLE DE MATIERE
EPIGRAPHE
I
DEDICACE
II
REMERCIEMENTS
III
LISTE DES TABLEAUX
V
LISTE DES FIGURES
VII
ABREVIATIONS
IX
RESUME
X
ABSTRACT
XI
TABLE DE MATIÈRE
XII
INTRODUCTION GENERALE
1
PARTIE BIBLIOGRAPHIQUE
5
CHAPITRE I LES EAUX USEES
6
LES EAUX USÉES
6
Définition et Classification
6
1.1.1.
Les eaux usées domestiques
6
Les eaux usées industrielles
6
1.1.2.
Les eaux usées agricoles
7
1.2.
Traitement des eaux usées
7
Les objectifs d'épuration des eaux
usées
7
Étapes du traitement des eaux
usées
8
1.2.1.1.
Le prétraitement
8
1.2.1.2.
Le traitement primaire
8
Le traitement secondaire
8
1.2.1.3.
Le traitement tertiaire
9
1.3. LES COLORANTS
ORGANIQUES
10
1.3.1.
Introduction
10
1.3.2.
Généralités sur le
colorant
10
1.3.3.
Utilité et applications des
colorants
11
1.3.4.
Classification des colorants
12
1.3.5.
TOXICITÉ ET IMPACT ENVIRONNEMENTAL
14
1.3.5.1.
Généralités
14
1.3.5.2.
Impact sur l'environnement
15
1.3.6.
Traitement et Elimination des colorants
17
1.3.6.1.
Méthodes biologiques
17
a)
Méthode Aérobie
17
b)
Méthode anaérobie
18
1.3.6.2.
MÉTHODES PHYSICO-CHIMIQUES
18
a.
Coagulation - floculation
18
b.
Filtration sur membrane
19
c.
Adsorption
19
d.
Traitement par oxydation
19
1.4.
Bleu de méthylène
21
1.4.1.
Propriétés du bleu de
méthylène
21
1.4.2.
Utilisation
22
1.4.3.
Toxicité
22
CHAPITRE 2 ADSORPTION
23
2.1.
INTRODUCTION
23
2.2.
DÉFINITION ET PRINCIPE
23
2.3. SYSTÈME
TERNAIRE ADSORBANT/ADSORBAT/SOLVANT
25
2.4. LES DEUX
PRINCIPALES MÉTHODES D'ANALYSE DE L'ADSORPTION
25
2.5. CAPACITÉ
D'ADSORPTION
26
2.6.
CINÉTIQUE D'ADSORPTION
26
2.6.1.
Définition
26
2.6.2.
MODÈLES DE LA CINÉTIQUE D'ADSORPTION
27
2.6.2.1.
Modèle de pseudo-premier ordre
27
2.6.2.2.
Modèle de la cinétique du pseudo- second
ordre
27
2.7. ISOTHERMES
D'ADSORPTION
28
2.7.1.
Classification des isothermes d'adsorption
28
2.8. APPLICATIONS DE
L'ADSORPTION
29
2.9.
MATÉRIAUX ADSORBANTS
30
2.9.1.
Critères de sélection des
adsorbants
30
2.9.2.
Types d'adsorbant
31
2.10. MUSA
ACUMINATA
33
2.10.1.
Classification taxonomique de Musa
acuminata
33
2.10.2.
Composition intrinsèque du Musa
Acuminata
33
2.10.2.1.
Cellulose
33
2.10.2.2.
Lignine
34
2.10.2.3.
Chitine
34
2.10.2.4.
Les hémicelluloses
34
PARTIE EXPÉRIMENTALE
36
CHAPITRE III MATERIELS ET METHODES
37
3.1.
MATÉRIELS ET RÉACTIFS
37
3.1.1.
Matériels
37
3.1.2.
Appareillage
37
3.1.3.
Réactifs
38
MÉTHODES EXPÉRIMENTALES
38
3.1.4.
Préparation du Bioadsorbant
38
3.1.5.
Caractéristiques du bioadsorbant
40
a. Taux
d'humidité
40
b. Taux
des cendres
41
c.
Teneur en matières sèches
(MS)
41
d. pH
du point de charge zéro ou nulle (pHzpc)
41
CHOIX DE L'ADSORBAT ET PRÉPARATION DES
SOLUTIONS DU BLEU DE MÉTHYLÈNE
41
Choix de l'adsorbat
41
3.1.6.
Préparation des solutions du bleu de
méthylène
42
MÉTHODE ANALYTIQUE
42
a.
Droite d'étalonnage
42
b.
Principe de la loi de Lambert-Beer
42
ETUDE DE LA CAPACITÉ D'ADSORPTION DU
BIOADSORBANT VIS-À-VIS DU BM
47
Essais d'adsorption
47
Capacité d'adsorption du bioadsorbant en
fonction du temps d'adsorption
47
Capacité d'adsorption du B.A en fonction
de la masse du Bioadsorbant
48
3.1.7.
Capacité d'adsorption du bioadsorbant en fonction du
pH
48
3.1.8.
Capacité d'adsorption du bioadsorbant en fonction de la
concentration.
48
3.1.9.
Isothermes d'adsorption
49
3.1.10.
Modélisation des isothermes
d'adsorption
49
CHAPITRE IV RESULTATS ET DISCUSSION
51
4.1.
CARACTÉRISATION DU BIOADSORBANT MA
51
4.1.1.
Caractéristiques physiques
51
4.1.2.
pHZPC
52
4.2. EFFET DU TEMPS
D'ADSORPTION DE BM SUR LE BIOADSORBANT M A
52
Présentation des résultats
52
4.2.1.
Discussion des résultats
57
4.3. EFFET DE LA
MASSE SUR L'ADSORPTION DE BM SUR LE BIOADSORBANT M.A
58
4.3.1.
Présentation des résultats
58
LES RÉSULTATS DE LA CAPACITÉ ET DU
POURCENTAGE MAXIMAL D'ADSORPTION DE BM SUR LE BIOADSORBANT M.A POUR
LES MASSES 10 MG, 50 MG, 100 MG, 200 MG, 400 MG, 800 MG ET 1000 MG SONT
DONNÉS PAR LES FIGURES 32 ET 33 ET LE TABLEAU 10.
58
4.3.2.
Discussion des résultats en fonction de la
masse
59
4.3.3. ADSORPTION DU
BM POUR LES DIFFÉRENTS PH DES SOLUTIONS DE BM
60
4.3.3.1.
Présentation des résultats
60
4.3.4.
Discussion
61
4.4. EFFET DU PH SUR
L'ADSORPTION DE BM SUR LE BIOADSORBANT MA
61
4.4.1.
Présentation des résultats
61
LES RÉSULTATS SUR L'EFFET DU PH SUR
L'ADSORPTION DE BM SUR LE BIOADSORBANT SONT DONNÉS PAR LES FIGURES 38 ET
39.
61
4.4.2. DISCUSSION
DES RÉSULTATS
62
4.5. ADSORPTION DU
BM SUR LE BIOADSORBANT EN FONCTION DE LA CONCENTRATION DE BM
63
4.5.1.
Présentation des résultats
63
4.5.2.
Discussion
64
4.5.3. FORMES
D'ISOTHERMES D'ADSORPTION DE BM SUR LE BIOADSORBANT MA
64
4.5.3.1.
Présentation des résultats
64
4.5.3.2.
DISCUSSION
66
4.5.4.
MODÉLISATION DES ISOTHERMES
66
4.5.4.1.
Présentation des résultats
66
4.5.4.2.
Modèle de Langmuir
66
4.5.4.3.
Modèle de Freundlich
68
4.5.4.5.
Discussion
70
CONCLUSION
71
REFERENCES BIBLIOGRAPHIQUES
73
ANNEXES
78
INTRODUCTION GENERALE
Depuis des siècles, l'environnement
(atmosphérique, terrestre et aquatique) a été soumis
à la pression croissante des activités anthropiques et
industrielles dont les effets se font déjà ressentir (Zied,
2016). Les ressources en eau, menacées par l'évolution
climatique et par les activités humaines, industrielles et agricoles,
sont devenues un enjeu majeur, auquel la communauté internationale
attache une importance capitale ou cruciale.
L'eau est source de toute vie sur terre, une ressource
naturelle limitée, qui cependant, est abondamment utilisée en
usage domestique et, en plus larges quantités, dans les secteurs de
l'agriculture et de l'industrie. Suite à ces utilisations, l'eau est
souvent polluée et son rejet en milieu naturel pourrait avoir, à
long terme, des conséquences sur la santé humaine et sur
l'environnement (Aboussaoud, 2014,)
Les colorants, une fois dissous dans l'eau, sont difficiles
à traiter car ils ont une structure moléculaire complexe qui les
rend plus stables et difficiles à être biodégradé.
Ils peuvent ainsi constituer des facteurs de risque pour notre santé et
de nuisances pour notre environnement (Benamraoui, 2014).
Les Scientifiques ont mis en place depuis une décennie
plusieurs technologies conventionnelles pour le traitement du rejet des eaux
usées chargées en matières polluantes (organique ou
minérale) ; on peut citer la précipitation chimique,
l'échange d'ions, l'osmose inverse, le traitement
électrochimique, la coagulation et la floculation, la
biodégradation, la filtration membranaire, l'oxydation chimique,
l'ozonation et l'adsorption (Asmaa et al., 2010, Aarfane et
al., 2014).
La technologie d'adsorption est reconnue par de nombreux
auteurs comme l'une des meilleures techniques de traitement des eaux, en termes
de faible coût initial comparé à d'autres applications, de
flexibilité et de simplicité de conception (Benosman, 2011,
Yeddou et al., 2012, Sakr et al., 2014, Mira et al.,
2016, Kifuani et al., 2018) Elle présente l'avantage
d'être appliquée au traitement de divers effluents et apporte
ainsi des réponses aux exigences réglementaires pour la
protection de l'environnement. Le principe du traitement par adsorption est de
piéger les colorants par un matériau solide appelé
adsorbant. La littérature récence plusieurs matériaux
solides (argiles, zéolites, alumines activées, boue, biomasses,
résidus agricoles, sous-produits industriels et charbon actif, etc)
pouvant être utilisés dans des procédés de
décoloration des eaux (Sadki et al., 2014). Les nombreux
travaux font ressortir l'efficacité du charbon actif comme adsorbant
polyvalent ; mais son utilisation reste limitée, à cause des
difficultés liées à sa régénération
et à son coût élevé (Chawki, 2014.)
Les scientifiques recourent vers les bioadsorbants
synthétisés, à partir des résidus d'agricultures,
agroindustriels et aquatiques qui font l'objet de plusieurs recherches ces
dernières années, en raison de leur faible coût, leur
disponibilité locale, leur biodégradabilité leur structure
poreuse très importante, leur grande surface spécifique et leur
grande capacité d'adsorption pour traiter les effluents (Kumar et
al., 2011 ; Bouchemal et al., 2013 ; Daoud et
al., 2014), à l'exemple des Noyaux de Dattes (Mounir
et al, 2011), Noyaux de jujubes (Daoud et al., 2014),
Cucumeropsis mannii Naudin (Kifuani et al., 2018), l'argile
(Sadkie et al., 2014).
Le présent travail s'intéresse à
développer un bioadsorbant potentiel à l'adsorption des colorants
organiques, en utilisant comme matériaux précurseurs les
déchets ligno-cellulosiques des épluchures de Musa
acuminata. Ces déchets peuvent être à la base de la
pollution de l'environnement. La conversion de ces épluchures en
bioadsorbant potentiel constitue ainsi un moyen de valorisation de
déchets et d'assainissement de l'environnement.
Notre recherche s'attelle sur le traitement des eaux
polluées synthétiquement au laboratoire par le bleu de
méthylène. Les questions suivantes peuvent être
posées en guise de problématique:
· Le bioadsorbant préparé à partir
des épluchures de Musa acuminata peut-il être un
bioadsorbant potentiel pour l'adsorption du Bleu de méthylène en
solution aqueuse ?
· Les paramètres ci-après : masse du
bio adsorbant, temps de contact, pH et concentration en bleu de
méthylène ont-ils de l'influence sur l'adsorption de Bleu de
méthylène par le bioadsorbant Musa acuminata ?
· Comment modéliser les équilibres
d'adsorption de bleu de méthylène sur le bioadsorbant Musa
acuminata ?
· Quelles sont les mécanismes d'adsorption du Bleu
de méthylène sur les bioadsorbants Musa
acuminata ?
Sur base de cette série des questions, nous pouvons
émettre les hypothèses suivantes :
- Le bio adsorbant préparé à base du
résidu ligno-cellulosique des épluchures de Musa acuminata
constitue un bio adsorbant potentiel pour l'adsorption de bleu de
méthylène en solution aqueuse ;
- La capacité d'adsorption augmente en fonction du
temps de contact et du pH de la solution ; elle diminue en fonction de la
masse du bioadsorbant ;
- Le pourcentage d'adsorption augmente en fonction du temps de
contact, masse du bioadsorbant et pH de la solution.
L'objectif de cette étude est de valoriser un
résidu naturel ligno-cellulosique par l'évaluation de son
efficacité à l'élimination de bleu de
méthylène en solution aqueuse.
Les objectifs spécifiques de cette étude sont
:
· Préparer un bio adsorbant à partir d'un
résidu ligno-cellulosique (Musa acuminata).
· Déterminer l'influence des paramètres
ci-après sur l'adsorption du bleu de méthylène : la masse
du bio adsorbant, le temps de contact, le pH et la concentration de la solution
du bleu de méthylène.
· Modéliser l'équilibre d'adsorption du
bleu de méthylène sur le bioadsorbant
Pour bien mener notre recherche, nous avons utilisé
deux approches méthodologiques (Bibliographique et
Expérimentale).
n Approche Bibliographique
Elle est basée sur la collecte des données
primaires, et s'est faite à travers la consultation ou la lecture de
divers documents en rapport avec notre thème.
n Approche Expérimentale
Elle est consacrée sur la collecte des données
secondaires à travers l'échantillonnage des épluchures de
la banane au marché, de Matadi Kibala et des expérimentations au
laboratoire LACOPE où nous avons étudié la variation des
paramètres ci-après : La masse du bio adsorbant, le temps de
contact, le pH et la concentration de la solution du BM.
Le choix de ce thème se justifie par le désir de
vouloir apporter une contribution pragmatique dans le traitement des rejets
industriels, en utilisant des résidus agricoles ou bio naturels.
n Intérêt scientifique
Les résultats obtenus permettront à toute la
couche de la population, aux organisations non gouvernementales, aux
décideurs tant nationaux qu'internationaux de faire le choix d'utiliser
un purifiant non polluant pour traiter les eaux dans la perspective du
développement durable.
Ce mémoire est divisé en deux parties
principales. La première partie est consacrée à une revue
bibliographique sur le sujet, est composé de deux Chapitres ;
· Le premier chapitre traite les eaux usées, tout
en donnant les différentes origines et les différents modes de
traitement de l'eau usée ainsi qu'une théorie sur les colorants
organiques, leur toxicité et leur impact sur l'environnement.
· Le deuxième chapitre, décrit
l'adsorption en général en donnant sa définition, les
isothermes, les mécanismes ainsi que les différents types
d'adsorption, tout en présentant les matériaux adsorbants.
La deuxième partie de ce mémoire est
consacrée à une étude expérimentale; elle est
composée de deux chapitres ;
· Le troisième chapitre traite sur les
matériels et les méthodes ;
· Le quatrième chapitre traite des
résultats et discussion.
Partie Bibliographique
CHAPITRE 1
LES EAUX USEES
1. Les Eaux Usées
1.1. Définition et Classification
D'après Tangou (2016), les eaux usées ou les
eaux résiduaires urbaines sont toutes les eaux parvenant des
canalisations d'eaux résiduaires dont les propriétés
naturelles sont transformées par les utilisations domestiques, les
entreprises industrielles, agricoles et autres. On englobe aussi parmi ces
eaux, les eaux de pluie qui s'écoulent dans ces canalisations.
D'après Rejsek (2002), les eaux usées ou les
eaux résiduaires urbaines sont des eaux chargées des polluants
solubles ou non, provenant essentiellement de l'activité humaine.
D'après Ramade (2000), les eaux
usées ou les eaux résiduaires urbaines sont des eaux ayant
été utilisées pour des usages domestiques, industriels ou
même agricole, constituant donc un effluent pollué et qui sont
rejetées dans un émissaire d'égout.
1.1.1. Les eaux usées
domestiques
Elles proviennent des différents usages domestiques de
l'eau. Elles sont essentiellement porteuses de pollution organique. Elles se
répartissent en eaux ménagères et en eaux vannes. Les eaux
ménagères ont pour origine les salles de bains et les cuisines et
sont généralement chargées de détergents de
graisses, des solvants, des débris organiques. Les eaux vannes sont
constituées des rejets des toilettes, chargés de diverses
matières organiques azotées.
1.1.2. Les eaux usées
industrielles
Elles sont très différentes des eaux
usées domestiques. Leurs caractéristiques varient d'une industrie
à l'autre. En plus de matières organiques, azotées ou
phosphorées, elles peuvent également contenir des produits
toxiques, des solvants, des métaux lourds, des micropolluants
organiques, des hydrocarbures.
1.1.3. Les eaux usées
agricoles
Ce sont des eaux qui ont été polluées par
des substances utilisées dans les domaines agricoles. Dans le contexte
d'une agriculture performante et intensive, l'agriculture est conduite à
utiliser divers produits d'origines industrielles dont certains peuvent
présenter des risques pour l'environnement et plus
particulièrement pour la qualité des eaux.
1.2. Traitement des eaux
usées
Collectées par le réseau d'assainissement d'une
agglomération, les eaux usées urbaines contiennent de nombreux
éléments polluants, provenant de la population (eaux
ménagères, eaux des activités commerciales et
industrielles). Elles sont acheminées vers une station
d'épuration où elles subissent plusieurs phases de traitement
pour éviter des problèmes d'environnement et de santé
publique. Plusieurs techniques de traitement des eaux usées existent :
les traitements biologiques, chimiques et physiques.
1.2.1. Les objectifs
d'épuration des eaux usées
Trois principaux paramètres mesurent les
matières polluantes des eaux usées domestiques :
· Les matières en suspension
(MES) exprimées en mg par litre.
Ce sont les matières non dissoutes contenues dans
l'eau. Elles comportent à la fois des éléments
minéraux et organiques.
· La demande biochimique en oxygène
(DBO),
Exprimée en mg d'oxygène par litre. Elle exprime
la quantité de matières organiques biodégradables
présente dans l'eau. Plus précisément. Ce paramètre
mesure la quantité d'oxygène nécessaire à la
destruction des matières organiques grâce aux
phénomènes d'oxydation par voie aérobie. Pour mesurer ce
paramètre, on prend comme référence la quantité
d'oxygène consommée par les micro-organismes au bout de cinq
jours. C'est la DBO5, demande biochimique en oxygène sur cinq
jours.
· La demande chimique en oxygène
(DCO),
Exprimée en mg d'oxygène par litre. Elle
représente la teneur totale de l'eau en matières oxydables. Ce
paramètre correspond à la quantité d'oxygène qu'il
faut fournir pour oxyder par voie chimique ces matières.
Les teneurs en azote et en phosphore sont également des
paramètres très importants. Les rejets excessifs de phosphore et
d'azote contribuent à l'eutrophisation des lacs et des cours d'eau. Ce
phénomène se caractérise par la prolifération
d'algues et la diminution de l'oxygène dissous, ce qui appauvrit la
faune et la flore des eaux superficielles (cours d'eau, lacs, etc)
Les eaux usées contenant aussi des contaminants
microbiologiques, bactéries, virus pathogènes et parasites, le
rejet des eaux usées à proximité de lieux de baignade ou
de zone d'élevage de coquillages fait courir un risque pour la
santé. Il doit faire l'objet de précautions
particulières.
Pour quantifier globalement des matières polluantes
contenues dans les eaux usées domestiques (et assimilées), on
utilise comme unité de mesure `'l'équivalent
habitant''. La notion d'équivalent habitant est utilisée
pour quantifier la pollution émise par une agglomération à
partir de la population qui y réside et des autres activités non
domestiques.
1.2.2. Étapes du traitement des
eaux usées
La dépollution des eaux usées nécessite
une succession d'étapes. L'épuration doit permettre, au minimum,
d'éliminer la majeure partie de la pollution carbonée.
1.2.2.1. Le
prétraitement
Le prétraitement consiste à retirer des eaux les
déchets insolubles (sable, graviers, corps flottants branches,
plastiques) en vue d'une réduction préliminaire de la
turbidité de la protection des conduites et des
équipements contre l'introduction de sable, graviers,
corps flottants et éventuellement pour une pré
désinfection (Tangou, 2016).
1.2.2.2. Le traitement primaire
Le traitement primaire fait appel à des
procédés qui permettent de retirer le sable par filtration, les
graisses par flottaison et les matières en suspension par
décantation. (Raven et al, 2011).
1.2.2.3. Le traitement secondaire
Le traitement secondaire ou traitement biologique des eaux
usées consiste en la décomposition des polluants organiques dans
l'eau par les microorganismes. En effet, des micro- organismes
(bactéries, souvent aérobies) décomposent les
composés organiques (glucides, protéines, lipides) en suspension
dans les eaux issues du traitement primaire. Pour ce faire, cette biomasse
épuratrice qui a tendance à croitre aura besoin d'une source de
carbone organique (hétérotrophe) ou minéral (autotrophe),
des nutriments (N, P), des oligoéléments (Ca2+
Na+, Cu2+, etc.) et une source d'énergie
(lumière, soleil) pour la synthèse cellulaire.
Il existe de nombreux procédés de traitement
secondaire des eaux usées, notamment les procédés
intensifs d'épuration par boues activées (foc mobile, biomasse
libre), par lits bactériens et biodisques (biomasse fixée) et les
procédés extensifs d'épuration (lagunage
aéré, lagunages naturels à microphytes ou à
macrophytes).
1.2.2.4. Le traitement
tertiaire
Appelés aussi le traitement complémentaire, le
traitement tertiaire vise l'élimination de la pollution azotée et
phosphatée ainsi que la pollution biologique des eaux usées,
ayant déjà subies au préalable des traitements primaire et
secondaire qui s'avèrent insuffisants pour arriver ou bout de ces
polluants.
Pour cela le traitement tertiaire s'impose et devient plus que
nécessaire, afin de garantir une meilleure protection des milieux
naturels récepteurs. Le traitement tertiaire souvent
considéré comme facultatif ou complémentaire permet
d'affiner ou d'améliorer le traitement secondaire. De telles
opérations sont nécessaires pour assurer une protection
complémentaire de l'environnement récepteur ou une
réutilisation de l'effluent en agriculture ou en industrie.
Le traitement tertiaire vise à améliorer la
qualité générale de l'eau. Son utilisation s'impose
lorsque la nature des milieux récepteurs recevant l'eau polluée
l'exige. On distingue généralement les opérations
suivantes :
Ø La nitrification-dénitrification et
déphosphatation biologique ou mixte (biologique et
physicochimique) ;
Ø La désinfection bactériologique et
virologique.
Le traitement tertiaire vise aussi l'élimination de
certains polluants chimiques persistants notamment les métaux lourds et
les colorants organiques.
1.3. Les colorants organiques
Introduction
Depuis quelques décennies, l'industrie des colorants
constitue un secteur capital de la chimie moderne. L'industrie alimentaire
mondiale utilise une quantité importante de plus en plus importante de
colorants naturels ou artificiels. Les colorants sont employés dans
différents domaines à savoir : la coloration du papier, de
cuir, des matières plastiques, vernis, peintures, encres,
cosmétiques, fourrures, produits alimentaires et pharmaceutiques ainsi
qu'en photographie (sensibilisateurs) et en biologie (coloration des
préparations microscopiques) ainsi que les indicateurs colorés de
pH.
Ces derniers sont responsables de la coloration des eaux et
sont susceptibles de présenter une toxicité. En effet il est
connu que certains colorants se fixent plus ou moins efficacement malgré
l'emploi d'agents fixants. Il en résulte alors des eaux colorées,
qu'il est nécessaire de traiter avant rejet.
1.3.1. Généralités sur le colorant
Un colorant est une matière colorée par
elle-même, capable de se fixer sur un support. La coloration plus ou
moins intense des différentes substances est liée à leur
constitution chimique. Un colorant est un corps susceptible d'absorber
certaines radiations lumineuses et de réfléchir alors les
couleurs complémentaires. Ce sont des composés organiques
comportant dans leurs molécules trois groupes essentiels : le
chromophore, l'auxochrome et la matrice. Le site actif du colorant est le
chromophore, il peut se résumer à la localisation spatiale des
atomes absorbant l'énergie lumineuse. Le chromophore est
constitué de groupes d'atomes dont les plus classiques sont le nitro
(-NO2), le diazo (-N-N-), le nitroso (-N-O), le thiocarbonyl (-C-S),
le carbonyl (-C-O), ainsi que les alcènes (-C-C-).
L'absorption des ondes électromagnétiques par le
chromophore est due à l'excitation des électrons d'une
molécule. La molécule qui les contient devient chromogène.
La molécule chromogène n'a des possibilités tinctoriales
que par l'adjonction d'autres groupements d'atomes appelés
«auxochrome». Ces groupes auxochromes permettent la fixation des
colorants et peuvent modifier la couleur du colorant. Ils peuvent être
acides (COOH, SO3, OH) ou basiques (NH2, NHR,
NR2). Le reste des atomes de la molécule correspond à
la matrice, la troisième partie du colorant (Mehdjoubi et Belmimouni,
2010 ; Benaissa, 2012 ; Chawki, 2014 ; Benamraoui, 2014 ;,
Benmakhlouf et Bouiche, 2015). Le tableau 1 présente les principaux
groupements chromophores et auxchromes :
Tableau 1 : Principaux groupements chromophores et
auxochromes (Benamraoui, 2014)
|
Groupements chromophores
|
Groupements auxochromes
|
|
Azo (-N=N-)
|
Amino (-NH2)
|
|
Nitroso (-NO ou -N-OH)
|
Méthylamino (-NHCH3)
|
|
Carbonyl (=C=O)
|
Diméthylamino (-N(CH3)2)
|
|
Vinyl (-C=C-)
|
Hydroxyl (-HO)
|
|
Nitro (-NO2 ou =NO-OH)
|
Alkoxyl (-OR)
|
|
Sulphure (>C=S)
|
Groupements donneurs d'électrons
|
1.3.2. Utilité et applications des
colorants
Une alimentation sans additifs est
désormais inconcevable. Les aliments à l'état brut
paraîtraient aux yeux des consommateurs comme « moins bons ».
La couleur, l'aspect de la nourriture ont une influence psychologique sur le
goût perçu des aliments. On consommerait avec réticence des
aliments de couleur inhabituelle (poulet bleu, frites vertes, viande jaune),
alors que le goût resterait le même (Amrouche et Arouri, 2013)
Amrouche et Arouri (2013), stipulent que les colorants ont
parfois une utilité autre que commerciale comme les
caroténoïdes qui sont transformés en vitamine A1. La
tartrazine stabilise la vitamine C dans les boissons. Les couleurs sombres font
office d'écran solaire et protègent les éléments
photosensibles. Le marché des colorants alimentaires représente
plusieurs milliards de francs, ce qui montre bien l'importance des colorants
dans notre alimentation.
Les grands domaines d'application des colorants sont les
suivants (Saoudi et Hamouma, 2013) :
· dans l'industrie textile de la fourrure, du cuir
(textile à usage vestimentaire, de décoration de bâtiment,
de transport, textile à usage médical, etc) ;
· des matières plastiques (pigments),
pharmaceutique (colorants), des cosmétiques, agroalimentaire (colorants
alimentaires) ;
· diverses industries utilisées pour des
carburants et des huiles ;
· dans l'imprimerie (encre, papier).
1.3.3. Classification des colorants
Chawki (2014) rapporte qu'il existe
seulement une dizaine de colorants naturels, alors que l'on compte des milliers
de colorants synthétiques. Ces derniers peuvent être
classés en fonction de leur mode d'application sur les substrats ou de
leur structure chimique. La seconde classification est fondée sur la
nature du chromophore.
En fonction de la nature du chromophore, les colorants sont
regroupés selon certains dispositifs structuraux chimiques communs.
Suivant cette méthode de classification un colorant textile peut
être classé selon son groupement chromophore qui lui
confère la couleur, ou selon son groupement auxochrome, qui permet sa
fixation, (voire tableau 1)
En fonction du mode d'application sur les substrats, les
méthodes pour teinter varient avec la structure chimique de la fibre
à colorer. Un colorant approprié aux laines ou la soie peut
être insuffisant pour le coton. Le tableau 2 résume la
classification des colorants en fonction du mode d'application sur les
substrats.
Tableau 2 : Classification des colorants
synthétiques (Chawki,2014)
|
Colorant
|
Application
|
Systèmes
|
Exemple
|
|
Acides
|
Polyamide (70 à 75 %)
Laine (25 à 30 %)
Soie, fibres acryliques
|
Azoïques
|
|
|
Mordant
|
Laine
Soie
|
Azoïques avec du chrome favorisant sa fixation
|
|
|
Métallifères
|
Fibres polyamides
|
Mono-Azoïques
Contenant des groupements carboxyles et aminés pour
former des complexes métalliques (Cr, Co, Ni,Cu)
|
|
|
Directs
|
Viscose, le lin, le jute, la soie, les fibres polyamides et le
coton
|
Azoïques,
longues structures moléculaires planes qui permettent
à ces molécules de s`aligner avec les macromolécules
plates de cellulose
|
|
|
Basiques (cationiques)
|
Fibres : acryliques, polyamide
|
Azoïques
contiennent un groupe amine quaternaire
|
|
|
Au Soufre
|
Coton et viscose les polyamides et polyesters rarement la
soie
|
Structure chimique exacte n`est pas toujours connue
|
|
|
De Cuve et leurs Leuco-esters
|
Teinture et l`impression du coton et de fibres
cellulosiques
polyamide et de polyester avec des fibres cellulosiques
|
Indigoïdes et anthraquinoniques
|
Colorant de cuve

Colorant leuco-esters

|
|
Dispersés
|
Polyester fibres cellulosiques fibres de polyamide et
d'acrylique
|
- Azoïques 50%
- Anthraquinoniques (25 %), + méthine, nitro et
naphthoquinone.
Caractéristiques : l`absence de
groupes de solubilisation et un poids moléculaire faible
|
|
|
Réactifs
|
|
Azotiques,
ont la particularité de posséder des groupements
chimiques spécifiques capables de former des liaisons covalentes avec le
support textile
|
|
|
Pigments
|
Utilisés dans les procédés
d`impression
|
Les pigments organiques sont en grande partie des
dérivés benzoïques. Les pigments inorganiques
(minéraux) sont des dérivés de métaux tels que Ti,
Zn, Ba, Pb, Fe, Mo, Ca, Al, Ma, Cd, Cr.
|
|
1.3.4. Toxicité et Impact
environnemental
1.3.4.1. Généralités
La toxicité des différents types de colorants
(mortalité, effet muta génique et Cancérigène) a
été étudiée par plusieurs travaux de recherche
aussi bien sur des organismes aquatiques (poissons, algues, bactéries,
etc.) que sur les mammifères.
Kifuani (2018), Karim et al, (2018) indiquent que le colorant
organique Bleu de Méthylène, est susceptible de provoquer des
brûlures oculaires chez l'homme ou l'animal. L'inhalation induit des
difficultés respiratoires et l'ingestion buccale provoque des
nausées, des vomissements, transpiration et sueurs froides abondantes.
Un certain nombre de colorants
présente un caractère toxique sur le milieu aquatique provoquant
la destruction directe des communautés aquatiques (Madani, 2014).
· La fuchsine, en concentration supérieure
à 1mg/L, exerce un effet de ralentissement sur l'activité vitale
des algues (Madani, 2014).
· Les rejets des usines de teinturerie et de textile sont
à l'origine de diverses pollutions telles que : l'augmentation de la
DBO5 et la DCO, diminuant la capacité de
réaération des cours d'eau et retardant l'activité de
photosynthèse (Madani, 2014).
1.3.4.2. Impact sur l'environnement
Beaucoup de colorants sont visibles dans l'eau même
à de très faibles concentrations (< 1 mg L-1).
Ainsi, ils contribuent aux problèmes de pollution liés à
la génération d'une quantité considérable d'eau
usée contenant des colorants résiduels. Le rejet
de ces eaux résiduaires dans l'écosystème est une source
dramatique de pollution, d'eutrophisation et de perturbation non
esthétique dans la vie aquatique et par conséquent
présente un danger potentiel de bioaccumulation, qui peut affecter
l'homme par transport à travers la chaîne alimentaire.
Sous l'action des microorganismes, les colorants
libèrent des nitrates et des phosphates dans le milieu naturel. Ces ions
minéraux introduits en quantité trop importante peuvent devenir
toxiques pour la vie piscicole et altérer la production d'eau potable.
Leur consommation par les plantes aquatiques accélère leur
prolifération anarchique et conduit à l'appauvrissement en
oxygène par inhibition de la photosynthèse dans les strates les
plus profondes des cours d'eau et des eaux stagnantes (Errais, 2011 ;
Meroufel, 2015 ; BenHaoued, 2017)
Lorsque des charges importantes de matière organique
sont apportées au milieu aqueux via des rejets ponctuels, les processus
naturels de régulation ne peuvent plus compenser la consommation
bactérienne d'oxygène. Manahan (1994), estime que la
dégradation de 7 à 8 mg de matières organiques par des
micro-organismes suffit pour consommer l'oxygène contenu dans un litre
d'eau (Benmakhlouf et Bouiche, 2013 ; Meroufel, 2015).
L'accumulation des matières organiques dans les cours
d'eau induit l'apparition de mauvais goûts, une prolifération
bactérienne, des odeurs pestilentielles et des colorations anormales.
Willmott et al. (1998) ont évalué qu'une coloration
pouvait être perçue par l'oeil humain à partir de
5.10-6 g/L. En dehors de l'aspect inesthétique, les agents
colorants ont la capacité d'interférer avec la transmission de la
lumière dans l'eau, bloquant ainsi la photosynthèse des plantes
aquatiques (Belaroussi et Belkacem, 2013 ; Benmakhlouf et Bouiche,
2013 ; Meroufel, 2015, Ben Haoued, 2017)
Les colorants organiques synthétiques sont des
composés très difficiles à épurer par
dégradations biologiques naturelles (Meroufel, 2015). Cette persistance
est en étroite relation avec leur réactivité chimique
(Meroufel, 2015 et Ben Haoued, 2017):
- Les composés insaturés sont moins persistants
que les saturés ;
- Les alcanes sont moins persistants que les
aromatiques ;
- La persistance des aromatiques augmente avec le nombre des
substituants ;
- Les substituants halogènes augmentent la persistance
des colorants plus que les groupements alkyles.
Si un organisme ne dispose pas de mécanismes
spécifiques, soit pour empêcher la résorption d'une
substance, soit pour l'éliminer une fois qu'elle est absorbée,
alors cette substance s'accumule. Les espèces qui se trouvent à
l'extrémité supérieure de la chaîne alimentaire, y
compris l'homme, se retrouvent exposées à des teneurs en
substances toxiques pouvant être jusqu'à mille fois plus
élevées que les concentrations initiales dans l'eau (Errais,
2011 ; Benmakhlouf et Bouiche, 2013 ; Ben Haoued, 2017)

Figure 1: Bioaccumulation (BenHaoued, 2017)
Si la plupart des colorants ne sont pas toxiques directement,
une portion significative de leurs métabolites l'est. Leurs effets
mutagènes, tératogène ou cancérigène
apparaissent après dégradation de la molécule initiale en
sous-produits d'oxydation : amine cancérigène pour les
azoïques, leuco-dérivé pour les
triphénylméthanes (Gouarir, 2014).
1.3.5. Traitement et Elimination des colorants
Vu l'ampleur de dégât que peuvent avoir les
colorants sur l'environnement biophysique et la santé de l'homme, le
traitement des rejets industriels contenant les colorants s'avèrent d'un
grand intérêt. Une large variété de techniques
physiques, chimiques et biologiques a été
développée et testée dans le traitement des effluents
chargés en colorants. Ces procèdes incluent la floculation, la
précipitation, l'échange d'ions, la filtration sur membrane,
l'irradiation et l'ozonation. Toutefois, ces procédés sont
coûteux et ne peuvent être utilisés efficacement pour
traiter des larges gammes des eaux chargées en colorants.
1.3.5.1. Méthodes biologiques
Les procédés d'épuration par voie
biologique sont basés sur la biotransformation microbienne des
colorants. La majorité des colorants sont très stables et non
biodégradables ; néanmoins, beaucoup de recherche ont
démontré la biodégradation partielle ou complète
des colorants par voie biologique. Si ces techniques sont adaptées
à un nombre de polluants organiques, elles ne sont pas toujours
applicables sur les effluents industriels en raison de fortes concentrations de
polluants, de leur toxicité qui entraînent la mort des
microorganismes ou de leur très faible biodégradabilité.
De plus, ces techniques génèrent des quantités importantes
de boues biologiques, à retraiter. Selon Loehr, la
biodégradabilité est favorable pour les eaux usées
présentant un rapport DBO5/DCO > 0,5 ; par contre
elle est très limitée lorsque ce rapport devient inférieur
à 0,2. Ce rapport, appelé degré de dégradation
biochimique, sert de mesure pour la dégradation biochimique des
polluants dans les eaux usées (Bouafia, 2010). Principalement, on
distingue deux méthodes de biodégradation: aérobie et
anaérobie.
a) Méthode Aérobie
C'est un traitement biologique usant de micro-organismes, en
présence d'oxygène. Des réacteurs dits à lits
bactériens sont utilisés pour cet effet. Ils sont
constitués d'une unité de boue activée où les
polluants sont décomposés par des bactéries
aérobies. Après épuration, la boue est
séparée des eaux usées par sédimentation dans un
décanteur. Une partie des eaux est recyclée et le surplus est
évacué après pressage ou centrifugation. Ce
procédé est resté longtemps un moyen pour dégrader
un grand nombre de polluants organiques Il s'est avéré efficace
pour une certaine catégorie de rejets textiles. Notons cependant que des
colorants tels que les azoïques, les colorants acides et les colorants
réactifs se sont révélés persistants à ce
mode de traitement (Gouarir, 2014 ; Benaouda et Bentaiba 2016).
b) Méthode anaérobie
En l'absence d'oxygène, la digestion anaérobie
des composés organiques conduit à la formation du dioxyde de
carbone, du méthane et de l'eau. Ce procédé est d'une
grande efficacité dans le traitement des effluents très
chargés, caractérisés par une DCO relativement
élevée. Ce procédé utilisé dans les stations
d'épuration des eaux, permet de produire des quantités
importantes de méthane. Ce dernier est utilisé comme source
d'énergie notamment pour le chauffage et l'éclairage. Des
études ont montré que la réduction voire la disparition de
la couleur n'est pas synonyme d'une minéralisation totale des colorants.
Par-contre, la formation de composés intermédiaires plus
toxiques, notamment des amines a été signalée (Gouarir,
2014).
1.3.5.2. Méthodes physico-chimiques
a. Coagulation - floculation
La coagulation - floculation est un processus physico-chimique
par lequel des particules colloïdales ou des solides en fine suspension
sont transformés, à l'aide des coagulants et floculants chimiques
en espèces plus visibles et séparables (les flocs). Les
particules colloïdales sont déstabilisées tout d'abord par
l'addition des sels tels que Al2(SO4)3 ou
Fe2(SO4)3. Les floculants facilitent
l'agglomération des particules déstabilisées conduisant
à la formation des flocs. Les flocs formés sont ensuite
séparés par décantation et filtration, puis
évacués. Les coagulants inorganiques tels que l'alun,
(Al2(SO4)3.14H2O),
donnent les résultats les plus satisfaisants pour la décoloration
des effluents textiles contenant des colorants dispersés, de cuve et au
soufre, mais sont totalement inefficace pour les colorants réactifs,
azoïques, acides et basiques. Par ailleurs, la coagulation - floculation
ne peut être utilisée pour les colorants fortement solubles dans
l'eau. D'importantes quantités de boue sont formées avec ce
procédé : leur régénération ou
réutilisation reste la seule issue mais demande des investissements
supplémentaires (Bouafia, 2010).
b.
Filtration sur membrane
La filtration sur membrane pilotée par pression
hydraulique se décline en microfiltration, ultrafiltration,
nanofiltration et osmose inverse. L'effluent passe à travers une
membrane semi-perméable qui retient en amont les contaminants de taille
supérieure au diamètre des pores, pour produire un perméat
purifié et un concentrât qui reçoit les impuretés
minérales ou organiques. D'après Taylor et Jacobs, parmi les
quatre types de procédés, la nanofiltration et l'osmose inverse
sont les plus adaptés à la réduction partielle de la
couleur et des petites molécules organiques, mais selon Calabro,
l'osmose inverse reste la plus répandue (Bouafia, 2010). La
nanofiltration s'applique surtout au traitement des bains de teinture de
colorants réactifs en agissant comme un filtre moléculaire tandis
que la microfiltration retient les matériaux colloïdaux, tels que
les colorants dispersés ou de cuve grâce à une "membrane
écran". L'ultrafiltration ne s'applique qu'à la réduction
de DCO et des solides en suspension, et ne se montre réellement efficace
qu'en combinaison avec la coagulation/ floculation (Bouafia, 2010).
c.
Adsorption
L'adsorption est un procédé de transfert de
matière entre une phase liquide (ou gazeuse) chargée en
composés organiques ou inorganiques et une phase solide, l'adsorbant.
Pendant des décennies, les charbons actifs commerciaux ont
été les principaux, voire les seuls adsorbants utilisés
dans les filières de traitement d'eaux. En effet, l'adsorption sur
charbons actifs présente de nombreux avantages : elle permet
l'élimination d'une large gamme de polluants, dont différents
types de colorants, mais aussi d'autres polluants organiques et inorganiques,
tels que les phénols, les ions métalliques, les pesticides, les
substances humiques, les détergents, ainsi que les composés
responsables du goût et de l'odeur. A l'inverse de la
précipitation, l'adsorption est plutôt efficace dans le domaine
des faibles concentrations.
d. Traitement par oxydation
Les techniques d'oxydation chimiques sont
généralement appliquées quand les procédés
biologiques sont inefficaces. Elles peuvent être ainsi utilisées
en étapes de prétraitement pour les procédés
biologiques. L'oxydation chimique est souvent appliquée pour le
traitement des composés organiques dangereux présents en faibles
concentrations et des effluents chargés de constituants
résistants aux méthodes de biodégradation. Les
réactifs les plus souvent énumérés pour ce type de
traitement sont H2O2, Cl2 et O3. Le
peroxyde d'hydrogène est un oxydant moyennement fort et son application
pour le traitement des polluants organiques et inorganiques est bien
établie. L'oxydation seule par H2O2 n'est pas
suffisamment efficace pour de fortes concentrations en colorant. Hamada et al
(2009) ont proposé de traiter les colorants azoïques par
l'hypochlorure de sodium mais même si la molécule initiale est
oxydée, les halogènes sont susceptibles de former des
trihalométhanes cancérigènes pour l'homme avec les
sous-produits de dégradation (Bouafia, 2010).
Le tableau 3 présente les principaux avantages et
inconvénients des techniques citées précédemment
pour le traitement des colorants (Zawlotski et al, 2004). On peut constater que
chaque technique peut être employée en décoloration,
moyennant des objectifs bien établis et des conditions
opératoires de traitement bien déterminées.
Tableau 3 : Principaux avantages et
inconvénients des techniques de traitements des colorants (Zawlotski et
al, 2004).
|
Technologies
|
Exemples
|
Avantages
|
Inconvénients
|
|
Coagulation/
Floculation
|
Chaux,
FeCl3,
Polyélectrolyte
|
-Equipement simple
-Décoloration relativement rapide
-Réduction significative de la DCO
|
-Formation de boues
-Adjonction de produits
chimiques nécessaires
-Fonctionnement onéreux
-Coagulants non réutilisables
-Réduction spécifique de la
couleur
-Peu d'informations sur la
réduction de DBO et DCO
|
|
Filtration
sur
membranes
|
Osmose
inverse,
Nanofiltration,
Microfiltration,
Ultrafiltration.
|
-Utilisation simple et rapide
-Pas d'addition de produits chimiques
-Faible consommation
énergétique
-Réduction de la couleur
|
-Investissement important
-Sélectif
-Encrassement rapide des
membranes
-Pré et post traitement
Nécessaires
|
|
Adsorption
|
Charbon actif,
Silice,
|
-Réduction efficace de la
couleur
-Technologie simple
-Faible coût d'utilisation
pour certains adsorbants
|
-Investissement et coût de
fonctionnement élevés
-Lent et limité en volume
-Régénération des adsorbants
Onéreuse, voire impossible
-Sélectif
-Formation de boue
|
|
Oxydation
Chimique
|
Ozone
Réactifs de
Fenton
Chloration
|
-Traitement de gros volumes
-Diminution nette de la
Chloration
-Décoloration rapide et
efficace
-Opération simple
-oxydant puissant
|
Investissement et coût de
fonctionnement très élevés
-Efficacité limitée pour certains colorants
-Produits d'oxydation inconnus
-Cout élevé
-Produits d'oxydation inconnus
-Formation de sous produits de chloration
(cancérigènes)
|
|
Procédés
biologiques
|
Aérobie
|
-Approprié pour les colorants Insolubles
|
-Spécifique à certains colorants
-Décoloration variable
-Grandes quantités de boues
générées
-Besoins énergétiques
Importants
|
|
Anaérobie
|
Décolore la plupart des
colorants par un mécanisme
de réduction
-Réutilisation du méthane produit comme source
d'énergie sur le site
|
-Produits de dégradation
inconnus
-Beaucoup de produits toxiques non dégradés
-Nécessite de grands réservoirs
d'aération
|
1.4. Bleu de méthylène
1.4.1. Propriétés du bleu de
méthylène
Il est soluble dans l'eau (50 g/L à 20 °C) et
plus légèrement dans l'alcool (10 g/L dans l'éthanol
à 20 °C). Il existe sous plusieurs formes : poudre (appelé
aussi cristaux) d'un bleu sombre, soluble dans l'eau moins soluble dans
l'alcool. Les solutions aqueuses ou alcooliques ont une couleur bleu peu
profonde. C'est un colorant non toxique. Le bleu de méthylène est
utilisé comme colorant bactériologique et aussi comme
indicateur.

Figure 2: Structure chimique du bleu de
méthylène
Tableau 4: Caractéristiques et
Propriétés physico-chimiques du Bleu de Méthylène
(Zawlotski et al, 2004).
|
Nom Usuel
|
Bleu de méthylène (Chlorure de bis
dimethylamino)- 3,7 phenazathionium
|
|
Synonymes
|
Chlorure de méthylthioninium C.I. 52015 C.I. Basic bleu
9
|
|
Formule chimique
|
C16H18ClN3S
|
|
Masse molaire
|
319.86 g.mol-1
|
|
Solubilité dans l'eau
|
Elevée
|
|
ëmax (nm)
|
663
|
|
pKa
|
3.8
|
|
I.C.
|
52015
|
1.4.2. Utilisation
C'est le plus important des colorants basiques. On peut
utiliser le bleu de méthylène en prévention contre toutes
les maladies dues à un champignon. En biologie le bleu de
méthylène est un colorant extrêmement pratique pour
étudier les cellules en milieu aqueux. Il s'agit d'un colorant vital,
c'est à dire susceptible d'être utilisé sur les cellules
vivantes.
· Il sert d'indicateur coloré redox : sa forme
oxydée est bleue, tandis que sa forme réduite est incolore.
· Il est employé comme colorant histologique. Le
bleu de méthylène teint le collagène des tissus en bleu.
Il tache la peau durant plusieurs semaines. Il est donc utilisé comme
encre alimentaire pour les viandes, par tampon.
· Il permet de calculer le taux de dureté de
l'eau.
· En médecine, il est fréquemment
utilisé comme marqueur afin de tester la perméabilité
d'une structure.
· C'est un bon antiseptique à usage interne et
externe.
1.4.3. Toxicité
Le bleu de méthylène est le colorant le plus
couramment utilisé dans la teinture du coton, du bois et de la soie. Il
peut provoquer des brûlures oculaires responsables de blessures
permanentes aux yeux de l'homme et des animaux. Son inhalation peut donner lieu
à des difficultés respiratoires, entrainer des cas
d'anémie après une absorption prolongée et son ingestion
par la bouche produit une sensation de brûlure, provoque des
nausées, des vomissements, transpiration et sueurs froides abondantes.
Il est aussi toxique pour les algues et les petits crustacés à
partir des concentrations de 0,1 mg L-1 et 2 mg L-1 ,
respectivement.
CHAPITRE 2
ADSORPTION
Introduction
L'utilisation intensive des colorants dans la vie courante a
engendré des problèmes aussi bien dans l'environnement que dans
l'alimentation. Il sied de mentionner qu'environnement, la pollution est due
aux rejets d'effluents des industries textiles, tandis qu'en alimentation, la
toxicité est due à l'incorporation de plusieurs colorants
synthétiques dans les produits alimentaires.
Pour parer à cette situation, une large
variété des méthodes physiques, chimiques et biologiques
ont été développées, mais, ces méthodes sont
coûteuses et conduisent à la génération de grandes
quantités de boues ou à la formation de dérivés
(Karim et al., 2010).
L'adsorption s'est révélée être la
méthode la plus prometteuse et la plus efficace en raison de sa
commodité et de sa simplicité d'utilisation (Boumchita et
al,.2016). Le charbon actif est l'adsorbant le plus largement
utilisé en raison de sa grande capacité d'adsorption des
matériaux organiques, par contre, sa régénération
est une opération délicate et ne fait pas l'unanimité sur
son utilité et aussi son coût est très élevé
(Sadkie et al., 2014). La solution alternative consiste à
utiliser d'autres matériaux adsorbants efficaces, plus
économiques et disponible à partir de déchets
d'agriculture, agroindustriel et aquatique, et etc (Boumchita et al.,
2016).
2.1. Définition et Principe
Plusieurs définitions ont été
développées pour le terme adsorption parmi lesquels, nous
retenons :
n L'adsorption est l'un des traitements, voire le traitement
le plus répandu dans la dépollution des eaux ; un
phénomène physique de séparation (pas de réaction
chimique) par lequel des molécules (macromolécules ou ions)
polluantes présentes dans un liquide (solvant) se fixent à la
surface d'un matériau solide, de manière plus ou moins
réversible (Sancey, 2011).
n L'adsorption est un phénomène d'interface
(phénomène physique de fixation des molécules adsorbat sur
la surface d'un solide adsorbant), pouvant se manifester entre un solide et un
gaz, ou entre un solide et un liquide (Nouacer, 2014).
n L'adsorption est le processus au cours duquel des
molécules d'un fluide (gaz ou liquide), appelé un adsorbat,
viennent se fixer sur la surface d'un solide, appelé adsorbant.
Par la surface du solide, on sous-entend les surfaces externes
et internes engendrées par le réseau de pores et cavités
à l'intérieur de l'adsorbant. Le polluant peut s'adsorber non
seulement parce qu'il est attiré par le solide (par exemple pour former
une liaison physique ou une interaction chimique), mais aussi parce que la
solution peut le rejeter en raison de son hydrophobicité (dans le cas
d'un polluant organique).
Le mot adsorption indique qu'il s'agit d'un
phénomène de surface et ne doit pas être confondu avec le
mot absorption qui indiquerait que le fluide a pénétré
dans la masse du solide
Plusieurs auteurs rapportent dans la littérature qu'il
existe deux types d'adsorption à savoir :
· La physisorption dite adsorption physique
· La chimisorption dite adsorption chimique
La physisorption est un
phénomène réversible et spontané, qui
résulte des forces intermoléculaires d'attraction entre les
molécules du solide et celles de la substance adsorbée. Elle est
exothermique, et favorisé aux basses températures. Les forces
d'interaction mises en jeu sont de l'ordre de 30 à 40 kJ/mol (Forces de
Van der Waals), tandis que la chimisorption met en jeu une ou
plusieurs liaisons chimiques covalentes ou ioniques entre l'adsorbat et
l'adsorbant. La chimisorption est généralement
irréversible puisqu'elle produit une monocouche. La chaleur
d'adsorption, relativement élevée, est comprise entre 20 et 200
lcal/mol, la distance entre la surface et la molécule adsorbée
est plus courte que dans le cas de la physisorption ( Benaissa, 2012 ;
Saoudi et Hamoum, 2013). Le tableau 5 présente succinctement la
différence entre les deux types d'adsorption. La physisorption et la
chimisorption diffèrent par le type de forces qui retiennent les
solutés à la surface du solide.
Tableau 5 : Principales différences entre
l'adsorption physique et l'adsorption chimique
|
Propriétés
|
Adsorption physique
|
Adsorption chimique
|
|
Température du processus
|
Relativement basse
|
Plus élevé
|
|
Chaleur d'adsorption
|
5 lcal/mol (environ)
|
10 lcal/mol (environ)
|
|
Liaison
|
Physique : Vander waals
|
Chimique
|
|
Cinétique
|
Rapide, réversible
|
Lente irréversible
|
|
Spécificité
|
Processus non spécifique
|
Processus très spécifique
|
|
Désorption
|
Facile
|
Difficile
|
|
Couche formée
|
Mono ou multicouches
|
Uniquement monocouches
|
2.2. Système ternaire adsorbant/adsorbat/solvant
Le phénomène d'adsorption dépend de
l'adsorbant, de l'adsorbat et de la solution, et il faut donc tenir compte des
différentes interactions pouvant exister entre le trois systèmes
(ternaire) (Figure 3). L'efficacité de la technique dépend non
seulement des caractéristiques de l'adsorbant, mais aussi des
différentes interactions existant entre le matériau et le
polluant, le matériau et le solvant, le polluant et le solvant, et enfin
entre les molécules de polluant(s). Il est important de noter que, dans
le système ternaire, chaque composant possède ses
caractéristiques propres (Sancey, 2011).
Matériau adsorbant
ADSORBANT
Affinité
Solvatation
Présence d'impuretés
Granulométrie
Porosité
Surface spécifique
Site actif
Système ternaire
Polluant
ADSORBAT
Solution aqueuse
SOLVANT
Solubilité
pH
Température
Figure 3 : Caractéristiques et interactions
à prendre en compte dans un système ternaire
adsorbant/adsorbat/solvant, d'après Sancey, 2011.
2.3. Les deux principales méthodes d'analyse de
l'adsorption
D'après Sancey (2011), Il existe plusieurs techniques
d'adsorption, la plus utilisée étant la technique en mode
cuvé dite méthode en batch. On a aussi la
méthode dynamique en colonne ouverte.
La technique en mode cuvé dite méthode
en batch ou discontinu est une méthode statique qui consiste
à mettre en contact un volume fixe de solution à
épurer avec une masse d'adsorbant donnée, dans des
conditions préalablement établies (temps d'agitation,
concentration, pH, température, etc). L'ensemble
(solution + adsorbant) est alors agité pendant un certain temps, puis
séparé par centrifugation, sédimentation ou simple
filtration. La comparaison du surnageant et de la solution initiale par dosage
analytique permet de déterminer l'efficacité de l'adsorbant
utilisé. Les méthodes batch sont très
utilisées car elles sont simples, faciles à mettre en place
(constituées de trois étapes successives, d'abord une mise en
solution, suivie d'une étape de séparation, et terminé par
une étape de dosage analytique), et rapides. Elles permettent ainsi de
faire varier un nombre important de paramètres (type des particules,
granulométrie, masse de particules, concentration, force ionique, etc)
tout en obtenant des résultats reproductibles et facilement
interprétables.
La méthode dynamique en colonne ouverte ou
continu est une méthode largement utilisée en milieu
industriel du fait des volumes d'eau à traiter ; elle consiste
à utiliser un adsorbant sous forme d'un lit filtrant. La solution
à traiter traverse le matériau adsorbant placé à
l'intérieur d'un réacteur.
2.4. Capacité d'adsorption
La capacité d'adsorption d'un adsorbant est
définie comme étant la quantité de substrat (masse ou
volume) adsorbée par unité de masse d'adsorbant pour une
température donnée. Elle nécessite la prise en compte de
nombreux paramètres aussi bien pour l'adsorbat (taille des
molécules, solubilité dans l'eau, etc.) que pour l'adsorbant
(surface spécifique, structure et type de particules, le constituant,
etc.). Elle est exprimée par la relation suivante (Benmakhlouf et
Bouiche, 2015) :
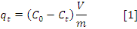
Avec :
V : Volume de la solution (L) ;
m : Masse de l'adsorbant (g) ;
C0 : Concentration initiale de la solution
(mg.L-1) ;
Ct: Concentration résiduelle de la solution
à l'instant t (mg.L-1).
2.5. Cinétique d'adsorption
2.1.1.
Définition
La cinétique d'adsorption est le second
paramètre indicateur de la performance épuratoire d'un adsorbant.
Elle permet d'estimer la quantité de polluants adsorbée en
fonction du temps. La cinétique fournit des informations relatives au
mécanisme d'adsorption et sur le mode de transfert des particules du
soluté de la phase liquide à la phase solide (Ben Haoued,
2017).
Les vitesses d'adsorption sont beaucoup plus faibles en phase
liquide qu'en phase gazeuse. Cette cinétique, relativement lente, se
traduit par des délais assez importants pour atteindre
l'équilibre d'adsorption.
2.1.2. Modèles de la cinétique
d'adsorption
La cinétique d'adsorption d'un matériau peut
être modélisée. A cet effet, la littérature rapporte
un certain nombre de modèles tels que le modèle de Lagergren
(modèle de pseudo-premier ordre), le modèle cinétique de
pseudo-second ordre et le modèle de diffusion intra particulaire
(BenHaoued, 2017).
2.1.2.1. Modèle de pseudo-premier
ordre
Il a été supposé dans ce modèle
que la vitesse d'adsorption à l'instant t est proportionnelle à
la différence entre la quantité adsorbée à
l'équilibre qe et la quantité qt
adsorbée à cet instant et que l'adsorption est
réversible. La constante de vitesse d'adsorption du premier ordre est
déduite à partir du modèle exprimé par
l'équation de Langergren:
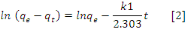
Avec :
qt : est la quantité du colorant
adsorbée (mg/g) à l'instant t,
qe : la capacité d'adsorption à
l'équilibre (mg/g).
t : temps de contact (min)
k1: constante de vitesse
d'adsorption pour le premier ordre (min-1)
2.1.2.2. Modèle de la cinétique du
pseudo- second ordre
L'équation du pseudo-second ordre est souvent
utilisée avec succès pour décrire la cinétique de
la réaction de fixation des polluants sur l'adsorbant. Le modèle
du pseudo-second ordre permet de caractériser la cinétique
d'adsorption en prenant en compte à la fois le cas d'une fixation rapide
des solutés sur les sites les plus réactifs et celui d'une
fixation lente sur les sites d'énergie faible. Ce modèle est
donné par l'équation suivante :
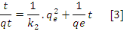
Avec :
k2: constante de vitesse d'adsorption pour le
pseudo-second ordre (g.mol-1.min-1).
qe : quantité d'adsorbât à
l'équilibre par gramme d'adsorbant (mg/g).
qt : la quantité du colorant adsorbée (mg/g)
à l'instant t,
1/qe : la pente de la droite de régression
linéaire.
2.6. Isothermes d'adsorption
Tous les systèmes
adsorbant/adsorbât ne se comportent pas de la même
manière. Les phénomènes d'adsorption sont souvent
abordés par leur comportement isotherme. Les courbes isothermes
décrivent la relation existant à l'équilibre d'adsorption
entre la quantité adsorbée et la concentration en soluté
dans un solvant donné à une température constante.
2.1.3. Classification des isothermes
d'adsorption
Expérimentalement, on distingue quatre classes
principales d'isothermes nommées :
S (Sigmoïde), L
(Langmuir), H (Haute affinité) et C
(partition Constante). La figure 4 illustre la forme de chaque type
d'isothermes.
Le solvant s'adsorbe sur les mêmes sites que le
soluté. Ceci implique l'existence d'une compétition d'adsorption
entre le solvant et le soluté.
Le nombre de sites susceptibles d'accueillir les
molécules de soluté à la surface du solide diminue quand
la quantité adsorbée augmente.
L'orientation des molécules à la surface. On
peut citer le cas où les molécules sont adsorbées
verticalement ou horizontalement sur la surface.
Enfin, les interactions attractives ou répulsives entre
les molécules adsorbées se manifestent d'une façon notable
dans le phénomène d'adsorption.
a) Classe L : les isothermes de classe L
présentent, à faible concentration en solution, une
concavité tournée vers le bas qui traduit une diminution des
sites libres au fur et à mesure de la progression de l'adsorption.
Ce phénomène se produit lorsque les forces
d'attraction entre les molécules adsorbées sont faibles. Elle est
souvent observée quand les molécules sont adsorbées
horizontalement, ce qui minimise leur attraction latérale. Elle peut
également apparaître quand les molécules sont
adsorbées verticalement et lorsque la compétition d'adsorption
entre le solvant et le soluté est faible. Dans ce cas, l'adsorption des
molécules isolées est assez forte pour rendre négligeable
les interactions latérales.
b) Classe S : Les isothermes de cette classe
présentent, à faible concentration, une concavité
tournée vers le haut. Les molécules adsorbées favorisent
l'adsorption ultérieure d'autres molécules (adsorption
coopérative). Ceci est dû aux molécules qui s'attirent par
des forces de Van Der Waals, et se regroupent en îlots dans lesquels
elles se tassent les unes contre les autres.
c) Classe H : La partie initiale de
l'isotherme est presque verticale, la quantité adsorbée
apparaît importante à concentration quasiment nulle du
soluté dans la solution. Ce phénomène se produit lorsque
les interactions entre les molécules adsorbées et la surface du
solide sont très fortes. L'isotherme de classe H est aussi
observée lors de l'adsorption de micelles ou de polymères
formées à partir des molécules de soluté.
d) Classe C : Les isothermes de cette classe
se caractérisent par une partition constante du soluté entre la
solution et le substrat jusqu'à un palier. La linéarité
montre que le nombre de sites libres reste constant au cours de l'adsorption.
Ceci signifie que les sites sont créés au cours de l'adsorption.
Ce qui implique que les isothermes de cette classe sont obtenues quand les
molécules de soluté sont capables de modifier la texture du
substrat en ouvrant des pores qui n'avaient pas été ouverts
préalablement par le solvant
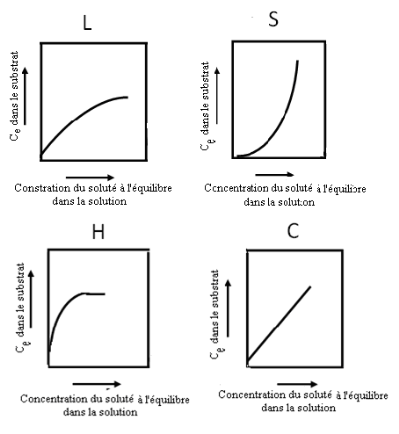
Figure 4: Classification des isothermes d'adsorption
selon Giles et al
2.7. Applications de
l'adsorption
La technologie de séparation par adsorption constitue
aujourd'hui une des méthodes de séparation la plus importante.
Elle est largement utilisée pour la séparation et la purification
des gaz et des liquides dans des domaines très variés, allant des
industries pétrolières, pétrochimiques et chimiques, aux
applications environnementales et pharmaceutiques, le traitements de l'air, des
eaux et des effluents pour l'élimination des polluants, le
séchage, la production de médicaments, etc.
Dans le cas du traitement des eaux, les applications sont
multiples. On trouve par exemple (Naima, 2016) :
· le traitement des eaux potables pour enlever les
goûts et odeurs résiduelles ;
· la décoloration des liqueurs ;
· l'élimination des polluants dans les eaux
résiduaires.
2.8. Matériaux adsorbants
2.1.4. Critères de sélection des
adsorbants
La littérature rapporte que plusieurs matériaux
et solides sont utilisés comme adsorbants pour traiter l'eau. Cependant,
seul les solides et/ou les matériaux répondant à la
définition de Chenine (2012) peuvent avoir des intérêts
pratiques un adsorbant est un solide microporeux présentant des surfaces
par unité de masse importantes (de 100 m2/g et jusqu'à
ou plus de 1000 m2/g) afin de maximiser la capacité
d'adsorption (quantité adsorbé par unité de masse
d'adsorbant).
Un adsorbant est caractérisé par un certain
nombre de propriétés physiques telle que : la porosité
interne, la masse volumique de la particule, la surface spécifique des
pores, le rayon moyen des pores et la capacité théorique
d'adsorption, correspondant à la quantité maximale de
soluté qui peut être adsorbée dans les conditions
opératoires par unité de masse d'adsorbant frais.
Le choix des adsorbants dépend étroitement des
applications visées. D'une manière générale,
l'évaluation des qualités d'un adsorbant peut être
basée sur plusieurs critères notamment la capacité, la
sélectivité, la régénérabilité, la
cinétique, la résistance et le coût de fabrication.
a. Capacité
Il s'agit des quantités adsorbées des
constituants à éliminer.
b. Sélectivité
Les sélectivités sont des capacités
relatives d'adsorption des constituants par rapport à d'autres
constituants.
c.
Régénérabilité
Pour les procédés avec
régénération in situ, les adsorbants doivent
être faciles à régénérer.
d. Cinétiques
La recherche des meilleurs coûts pour les
procédés d'adsorption conduit à l'utilisation de cycles
d'adsorption de plus en plus rapides afin d'augmenter les productivités
horaires et diminuer les investissements.
e. Résistances mécanique, chimique et
thermique
Les adsorbants doivent être résistants à
l'attraction, au changement de conditions opératoires et aux
éventuelles attaques des différentes impuretés
présentes pour assurer des durées de vie suffisantes.
f. Coûts de fabrication
Le coût des adsorbants peut représenter une part
importante de l'investissement global d'un procédé et il peut
même devenir un critère primordial dans certaines applications de
traitement des eaux.
2.1.5. Types d'adsorbant
Il existe dans la littérature les adsorbants
industriels et les bioadsorbants. Les premiers se sont
révélés être les adsorbants parfait à
l'occurrence du charbon actif qui est l'adsorbant le plus polyvalent. De
nombreux travaux font ressortir son efficacité, mais son utilisation
reste limitée à cause des difficultés de sa
régénération et de son coût élevé.
Pour cette raison, de nouveaux matériaux
(bioadsorbants) peux coûteux font l'objet de plusieurs recherches ces
dernières années. Ces nouveaux matériaux tirent leurs
origines de l'utilisation des matériaux précurseurs, disponibles
localement à partir des sources naturelles renouvelables, comme les
déchets agro-industriels ayant des propriétés
intrinsèques qui leur confèrent une capacité
d'adsorption.
Ce sont des déchets végétaux tels que
l'écorce de pin, l'écorce d'hêtre, la bagasse de canne
à sucre, le vétiver, les pulpes de betterave, les fibres de jute,
de noix de coco et de coton, les noyaux de tamarin, le sagou, les
écorces de riz, la biomasse bactérienne morte ou vivante, les
algues, les levures et les champignons (Chawki, 2014 ; Kifuani et al.,
2018).
Les zéolites, les gels de silice et les alumines
activées font aussi partis des adsorbants industriels. Notons que les
biosorbants peuvent être regroupés en deux catégories : les
biosorbants d'origine aquatique et ceux provenant du secteur agro-industriel.
Le tableau 6 présente les différents bioadsorbants et les
adsorbats utilisés au cours de ces dix dernières
années.
Les bioadsorbants agro-industriels regroupent les
matériaux d'origine végétale, qui sont riches en tanins
qui, grâce aux groupements polyhydroxy-polyphénol, leur
confère une grande efficacité dans la rétention des
polluants. Leur capacité d'adsorption est en général
attribuée aux polymères qui les constituent. Par ordre
d'abondance décroissant, ces polymères sont la cellulose,
l'hémicellulose, les pectines, la lignine et les protéines. En
moyenne, la matière ligno-cellulosique contient 40-60% de cellulose,
20-40% d'hemicelluloses et 10-25% de lignine (Chawki, 2014 ; Nouacer,
2015).
Tableau 6 : Différents
bioadsorbants
|
N°
|
Adsorbants / Matériaux
|
Adsorbats
|
Références
|
|
1. Albizzia Lebbeck
|
Bleu de méthylène et Bleu de coomassie G-250
|
Benaouda et Bentaiba, 2016
|
|
2. Argile de Safi
|
Bleu de Méthylène
|
Karim et al, 2010
|
|
3. Arundo donax
|
Bleu de Méthylène
|
Kharfallah et Fratsa, 2017
|
|
4. Cendres volantes et les mâchefers
|
Red195 et Bleu de méthylène
|
Aarfane et al, 2014
|
|
5. Coquilles d'oeufs
|
Bleu brillant (E133), Jaune (E102) et Rouge cochenille
(E124)
|
Yeddou et al, 2012
|
|
6. Cucumeropsis mannii Naudin
|
Bleu de Méthylène
|
Kifuani et al., 2018
|
|
7. Epluchure de pomme de terre
|
Bleu de méthylène
|
Boumchita et al, 2016
|
|
8. Eucalyptus Libanais
|
Bleu de Méthylène
|
Abdallah et al, 2016
|
|
9. Grignons d'olives
|
Rouge Congo
|
Nait et al, 2016
|
|
10. Kaolin ,diatomite
|
Bleu de Méthylène
|
KHALDI et al,
|
|
11. Kaolin, racines de Calotropis procera et Noyaux de
dattes
|
Rouge Congo et Violet de gentiane
|
MEROUFEL, 2015
|
|
12. Les feuilles de palmier et les déchets des
dattes
|
Bleu de Méthylène
|
Ben Haoued, 2017
|
|
13. Les graines de chardon de lait
|
Bleu de Méthylène
|
Chawki 2014
|
|
14. Noyaux des dattes
|
Bleu de méthylène
|
Dbik, et al, 2014
|
|
15. Peaux d'Orange et de Banane
|
|
Khalfaoui, 2012
|
|
16. Sciure de bois
|
Rouge basique Neutral Red
Bleu de méthylène
|
Belaid et al, 2011
Kifuani, 2013
|
|
17. Sciure de bois d'eucalyptus (Eucalyptus
globulus)
|
Rouge Congo
|
Venkat et al, 2013.
|
|
18. Tiges de Chardons
|
Bleu de Méthylène
|
Zoubida SMAHI, 2017
|
|
19. Noyaux des dattes et Grignons d'olives
|
|
Aksas, 2013
|
L'évaluation de l'efficacité d'un adsorbant est
réalisée par la détermination de la capacité
d'adsorption du matériau et des paramètres liés à
la cinétique d'adsorption. La capacité d'adsorption permet de
dimensionner l'adsorbeur, en termes de quantité de matériau
nécessaire, tandis que la cinétique permet l'estimation du temps
de contact entre le sorbant et les polluants.
2.9. Musa Acuminata
2.1.6. Classification taxonomique de Musa
acuminata
Le tableau 7 présente la classification taxonomique de
Musa acuminata
Tableau 7 : Classification taxonomique de
Musa acuminata
|
Règne
|
Plantae
|
|
Sous règne
|
Tracheobionta
|
|
Embranchement
|
Magnoliophyta (Angiospermes)
|
|
Classe
|
Liliopsida (Monocots)
|
|
Sous-classe
|
Zingiberidae
|
|
Ordre
|
Zingiberales
|
|
Famille
|
Musaceae
|
|
Genre
|
Musa
|
|
Espèce
|
Acuminata
|
|
Nom Vernaculaire
|
Bitabe (Lingala)
|
2.1.7. Composition intrinsèque du
Musa Acuminata
La banane est le fruit le plus répandu dans presque
tous les pays tropicaux. En tant que sous-produits agroalimentaires, les peaux
représentent environ 30-40 g /100g du poids du fruit et peuvent
contribuer, d'une manière significative, à certains
problèmes écologiques si des mesures adéquates pour leur
ramassage ne sont pas prises. La cellulose, la lignine et le contenu de
l'hémicellulose d'écorces de banane constituent les fractions
insolubles des fibres et sont variables allant de 7 à 12 g/ 100 g, de 6,
4 à 9, 6 g/100 g et de 6, 4 à 8, 4 g/100 g, respectivement, avec
le contenu en pectine s'étalant de 13, 0 à 21, 7 g/ 100 g.
(Khalfoui, 2012).
2.1.7.1. Cellulose
La cellulose est un glucide. Elle est un polymère du
glucose (ou polysaccharide du glucose), de formule
(C6H10O5)n (n compris entre 200 et
14000) et principal constituant des végétaux, en particulier de
la paroi cellulaire. Elle garantit la rigidité de la paroi cellulaire
des plantes. La cellulose constitue la molécule organique la plus
abondante sur terre (plus de 50 % de la biomasse) (Nouacer, 2015).
2.1.7.2. Lignine
La lignine est constituée d'un groupe de substances
chimiques appartenant aux composés phénoliques. Elle est le
deuxième bio polymère après la cellulose,
synthétisée par les végétaux. La biomasse
cumulée entre la cellulose et la lignine représente environ 70%
de la biomasse totale. La lignine est un polymère constitué par
trois types de monomères : le coniféryle, le p-coumaryle et les
alcools sinapiques. La lignine, étant très résistante
à la compression, confère aux cellules végétales de
la solidité. Grâce à ses groupements fonctionnels (alcool,
aldéhydes, éthers, hydroxydes de phénols, acides,
cétones), la lignine joue un rôle important au niveau des
mécanismes d'adsorption des biosorbants. Elle est d'ailleurs
isolée et extraite de certains biosorbants, pour être
utilisée dans la rétention des polluants. C'est le cas, entre
autres, de la lignine extraite de la bagasse, étudiée par
Peternel et al., dont la capacité d'adsorption vis-à-vis
du plomb (0,388 mmol/g) est plus de trois fois supérieure à celle
obtenue avec le charbon actif en poudre (0,13 mmol/g) dans des conditions
opératoires identiques (pH= 5, T= 30 °C).( Chawki, 2014).
2.1.7.3. Chitine
La chitine est un polymère linéaire contenant un
grand nombre de groupements fonctionnels aminés. Elle constitue le
squelette de différents arthropodes, comme les crustacés et les
insectes et dans la paroi des cellules de certaines espèces de
champignons. La chitine possède une bonne capacité d'adsorption.
Cependant son dérivé deacétylé, le chitosane, est
plus utilisé dans les processus d'adsorption, en raison de l'existence
de ses groupements aminés libres qui lui confèrent une plus
grande capacité d'adsorption. Le chitosane est obtenue soit chimiquement
ou naturellement dans les parois cellulaires de certains champignons (Chawki,
2014).
2.1.7.4. Les hémicelluloses
Contrairement à la cellulose, l'hémicellulose
est une famille de composés hétéropolysaccharidiques
variés. Les unités monomériques de ces
macromolécules glucidiques sont des pentoses (principalement xylose et
arabinose), des hexoses (principalement glucose, mannose, galactose, rhamnose
et fucose) et des acides carboxyliques (principalement les acides mannuronique
et galacturonique). Les unités monomériques sont
assemblées en chaînes ramifiées et constituent des
macromolécules de nature amorphe qui diffèrent par les
associations diverses d'oses et d'acides glucidiques, de degré de
polymérisation variant de quelques dizaines à plusieurs centaines
d'unités monomériques. (Nouacer, 2015).
Partie
Expérimentale
CHAPITRE 3
MATERIELS ET METHODES
Dans ce chapitre, nous abordons
les différents aspects pratiques de notre étude, à savoir
la méthodologie employée pour la préparation et la
caractérisation de l'adsorbant utilisé. Nous décrivons
ensuite le mode de préparation des solutions, les techniques de mesure
et d'analyse ainsi que le mode opératoire suivi pour l'étude de
la cinétique d'adsorption de l'adsorbat utilisé qui est le bleu
de méthylène sur le Musa acuminata.
3.1. Matériels et Réactifs
3.1.1. Matériels
Les matériels suivant ont été
utilisés au cours de cette étude :
1. Adsorbeur (LACOPE ADS- 3) ;
2. Ballon jaugé (100 mL, 1000 mL, 2000
mL) ;
3. Becher ;
4. Cellule de 1 cm en quartz et en verre ;
5. Creuset ;
6. Entonnoir ;
7. Flacon en verre et plastique ;
8. Papier aluminium ;
9. Pied gradué :
10. Pipette (0,5 mL, 2 mL, 5 mL, 10 mL, 23 mL, 50 mL) ;
11. Pissette (100 mL et 1000 mL) ;
12. Seringue (5 mL, 10 mL);
13. Tamis (diamètre de 1 mm) ;
14. Tube à essai (5 mL et 10 mL).
3.1.2. Appareillage
15. Agitateur oscillant (VEL 300 LEUVEN);
16. Balance analytique de marque JINNUO JT 2003B;
17. Broyeur ;
18. Centrifugeuse de
marque Labofuge 200 Heraeus ;
19. Dessiccateur ;
20. Etuve de marque
Heraeus de type électrique ;
21. Four de marque Heraeus ;
22. pH mètre (HANNA INSTRUMENTS);
23. Spectrophotomètre UV-visible de
marque Hack, SP1105.
3.1.3. Réactifs
1. Acide chlorhydrique (HCl); 37%
2. Bleu de méthylène trihydraté
(produit FLUKA AG, Bucha SG) ;
3. Chlorure de sodium (NaOH);
4. Eau distillée ;
5. Epluchures de Musa acuminata
3.2. Méthodes
Expérimentales
3.1.4. Préparation du Bioadsorbant
Les échantillons des épluchures de
Musa acuminata ont été collectés
dans le dépôt des bananes se trouvant au marché
Matadi Kibala dans la commune de Mont Ngafula.
Les épluchures de Musa acuminata ont
été coupés en petits morceaux et lavés à
l'eau de robinet, pour enlever les impuretés puis à l'eau
distillée pour la stérilisation des échantillons.
Ensuite, les échantillons de Musa acuminata ont
été séchés dans le Laboratoire de Chimie Organique,
Physique, Eau et Environnement, LACOPE, en sigle, au moyen de
l'énergie solaire, à l'air libre, pendant deux semaines, en vue
de prévenir toute éventuelle altération des
propriétés physicochimiques des échantillons.
La masse séchée a été
broyée à afin d'obtenir des échantillons homogènes
pour le besoin des études de laboratoire, donnant des grains de petite
taille, généralement inférieure à 1mm. Les figures
5 à 7 représentent les épluchures de Musa
acuminata dans leur état brut après collecte, après
deux semaines de séchage et après broyage. Ces
échantillons ont été ensuite isolés
mécaniquement au moyen d'un tamiseur dont la dimension des mailles
correspond à un diamètre inférieur à 1mm. Seuls les
grains représentant la masse d'échantillons qui passe par les
mailles de tamis de 1mm ont été considérés et
utilisés comme bioadsorbant MA pour les essais d'adsorption. Les tamisat
ainsi recueillis ont été mis à l'étuve pendant 48 h
à 105 oC pour chasser de l'eau ; c'est aussi une autre
forme de séchage. En somme la préparation du bioadsorbant
comporte cinq étapes, repris dans la figure 5.
Collecte
Séchage
Eau de Robinet
Broyage
Lavage
Eau distillée
Tamisage
Mise à l'étuve
Figure 5 : Etape de préparation d'un
Bioadsorbant (Michée N'kwady)



Figure 7 : Epluchure de Musa acuminata
après deux semaines de séchage (Photo Michée
N'KWADY)
Figure 6 : Epluchures de Musa acuminata
à l'Etat brut (Photo Michée N'KWADY)


Figure 8 : Echantillon de Musa acuminata
après broyage
3.1.5. Caractéristiques du
bioadsorbant
La connaissance des propriétés physico-chimiques
et structurelles d'un matériau quel qu'il soit, est nécessaire
pour contribuer à la compréhension de beaucoup de
phénomènes, tels que l'adsorption, la désorption,
l'échange ou autres. Dans ce but, le bioadsorbant MA a
été caractérisé en utilisant différents
paramètres de caractérisation.
a. Taux d'humidité
L'humidité a été déterminée
par séchage du Bioadsorbant dans une étuve. A cet effet, 5 g de
bioadsorbant MA contenus dans un creuset sont
placés dans une étuve (Heraeus de type électrique)
à 105°C pendant 48 h. La masse étuvée a
été pesée après refroidissement dans un dessicateur
et le taux d'humidité est alors déterminé par la relation
suivante :
% H =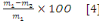 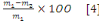
Avec :
% H : teneur d'humidité
m1 : masse initiale du B.A
m2 : masse du B. A après
séchage
b. Taux des cendres
Le pourcentage de la cendre a été
déterminé par calcination du 5 g du bioadsorbant M
A. A cet effet la masse du bioadsorbant a été
placée dans un four à moufles (Naber, model N7/H) à 550
°C pendant 8 h. Le taux de cendre est calculé selon la
relation :
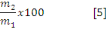
Avec :
m1 : Masse initiale du bioadsorbant
m2 : masse obtenue après
calcination
c. Teneur en matières sèches
(MS)
La teneur en matière sèche est
déterminée en déduisant la masse d'eau de la masse totale
du bioadsorbant.
d. pH du point de charge zéro ou nulle
(pHzpc)
La valeur de pH pour lequel, la charge nette de la surface du
adsorbant est nulle est appelée pHzpc. Ce paramètre est
très important dans les phénomènes d'adsorption, surtout
quand des forces électrostatiques sont impliquées dans les
mécanismes. Une façon simple et rapide pour déterminer le
pHzpc est de placer 1000 mg de bioadsorbant dans 100 mL de solutions de NaCl
0,01 M compris entre 3 et 12, pH ajustés par addition des solutions de
HCl 0,1M ou de NaOH 0,1M. Les suspensions sont maintenues en agitation,
à température ambiante, pendant 72 h. Le pH final de chacune des
solutions est alors déterminé. On porte sur un graphe le pH final
en fonction du pH initial. L'intersection de la courbe avec l'axe qui passe par
le zéro donne le point isoélectrique ou pHzpc.
3.3. Choix de l'adsorbat et
Préparation des solutions du bleu de méthylène
3.1.6. Choix de l'adsorbat
Le bleu de méthylène est choisi comme
modèle représentatif des colorants organiques, à cause de
sa large gamme d'utilisation en laboratoire, sa toxicité, sa persistance
dans l'environnement, sa solubilité dans l'eau, sa nature chimique et sa
disponibilité. C'est le prototype des colorants de taille moyenne.
3.1.7. Préparation
des solutions du bleu de méthylène
La solution mère du BM est préparée
à partir de la poudre du BM de masse molaire 371,91 g/mol. Nous avons
pesé 1600 mg de BM à l'aide d'une balance de précision
(JINNUO JT 2003B), et nous avons dissout cette masse dans deux litres de
solution.
A partir de cette solution mère, nous avons
prélevé une fine quantité avec laquelle nous avons
préparé par dilutions successives avec de l'eau distillée,
12 solutions filles de concentrations de: 1 mg/L à 100 mg/L.
3.4. Méthode analytique
Les solutions de bleu de méthylène avant et
après adsorption ont été analysées à l'aide
d'un spectrophotomètre UV-Visible (Hack, SP1105) dans des cellules en
quartz et en verre de 1 cm d'épaisseur.
a. Droite d'étalonnage
Pour établir, la droite d'étalonnage, nous avons
mis en application la loi de Lambert-Beer
A=å .l.c [6]
À une longueur d'onde donnée cette loi
établie une relation entre l'absorbance et la concentration de la
substance.
b. Principe de la loi de Lambert-Beer
En spectroscopie UV-Vis, on utilise l'énergie
émise par une lumière monochromatique. Si un faisceau
monochromatique d'intensité I0 traverse la
solution à analyser, une partie de cette lumière
d'intensité Ir sera reflétée,
une autre, d'intensité Ia, sera
absorbée par la solution et enfin une troisième,
d'intensité I, traversera la solution à
analyser. (Figure 9).
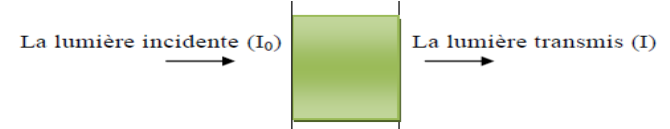
Figure 9. La traversée d'une lumière
monochromatique
On aura:
I0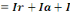 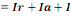 [7]
[7]
La lumière reflétée peut être
négligée, nous aurons :
I0= Ia+I
[8]
En mettant I0 et
Ia en relation, on trouve :
I=I0.10-ålc
[9]
Cette équation peut se réécrire
 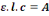 [10]
[10]
On obtient alors la loi de Beer-Lambert:
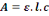
Avec :
A : absorbance ou densité optique (D.0) ;
å : coefficient d'absorption molaire
(L.mg-1.cm-1) ;
l : longueur du chemin optique ou épaisseur de la
cellule (1cm) ;
C : concentration du soluté
(mg.L-1).
L'absorption molaire traduit la probabilité de
transition entre la lumière et la solution c'est-à-dire plus
grande est l'absorption molaire plus l'interaction lumière-solution est
élevée.
La relation de Lambert-Beer prouve que l'absorbance d'un
faisceau monochromatique est directement proportionnelle à longueur du
chemin optique (å) à travers l'échantillon
(l), à la concentration de l'espèce absorbante
(C) et l'absorptivité, dépendant de la
substance.
Le tableau 8 présente les variations
de l'absorbances en fonction des concentrations de Bleu de
méthylène et les figure 10 à 16 donnent
l'évolution de l'absorbance en fonction de la concentration de la
solution pour différents pH de Bleu de Méthylène.
Tableau 8 : Variation de l'absorbance en fonction des
concentrations de la solution de Bleu de Méthylène pour
différents pH.
|
Ci (mg L-1)
|
pH 3,05
|
pH 4,01
|
pH 5,14
|
pH 6,69
|
pH 8,30
|
pH 10,01
|
pH 12,05
|
|
1
|
0,021
|
0,023
|
0,03
|
0,031
|
0,0 31
|
0,037
|
0,039
|
|
5
|
0,085
|
0,092
|
0,10
|
0,093
|
0,049
|
0,053
|
0,052
|
|
10
|
0,149
|
0,171
|
0,176
|
0,179
|
0,1
|
0,097
|
0,094
|
|
20
|
0,329
|
0,329
|
0,313
|
0332
|
0,192
|
0,101
|
0,186
|
|
30
|
0,495
|
0,488
|
0,453
|
0,502
|
0,389
|
0,319
|
0,237
|
|
40
|
0,669
|
0,658
|
0,62
|
0,637
|
0,503
|
0,496
|
0,393
|
|
50
|
0,855
|
0,819
|
0,786
|
0,756
|
0,748
|
0,698
|
0,594
|
|
60
|
0,999
|
1,008
|
0,925
|
0,902
|
0,898
|
0,998
|
0,881
|
|
70
|
1,173
|
1,167
|
1,098
|
1,07
|
1,089
|
1,054
|
1,029
|
|
80
|
1,302
|
1,322
|
1,251
|
1,245
|
1,399
|
1,203
|
1,371
|
|
90
|
1,497
|
1,5
|
1,408
|
1,420
|
1,425
|
1,448
|
1,417
|
|
100
|
1,625
|
1,659
|
1,547
|
1,575
|
1,599
|
1,501
|
1,561
|
|
R2
|
0,9961
|
0,99991
|
0,99982
|
0,9999
|
0,99979
|
0,99987
|
0,99979
|
|
(L.mg-1 cm-1)
|
0,016
|
0,017
|
0,016
|
0,016
|
0,016
|
0,017
|
0,016
|
|
ë max
|
664
|
662
|
664
|
664
|
664
|
662
|
662
|
Avec :
R : coefficient de corrélation
å : coefficient d'absorption molaire
(L.mg-1.cm-1)



Figure 10: Evolution de l'absorbance en fonction de la
concentration de la solution de Bleu de Méthylène ë
max 664 ; T : 28#177;01°C; V : 100 mL ;
pH 3,05
Figure 11: Evolution de l'absorbance en fonction de la
concentration de la solution de Bleu de Méthylène ë
max 664 ; T : 28#177;01 °C; V : 100 mL ;
pH 4,01
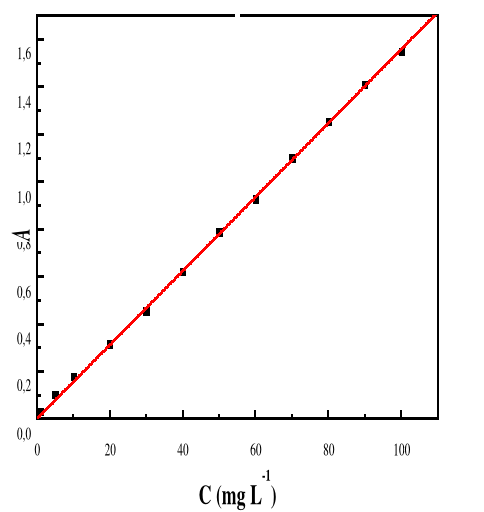
Figure 12: Evolution de l'absorbance en fonction de la
concentration de la solution de Bleu de Méthylène ë
max 662 ; T : 28#177;01°C ; V : 100 mL ; pH
5,14
Figure 13: Evolution de l'absorbance en fonction de la
concentration de la solution de Bleu de Méthylène ë
max 664 ; T : 28#177;01°C ; V : 100 mL ;
pH 6,69
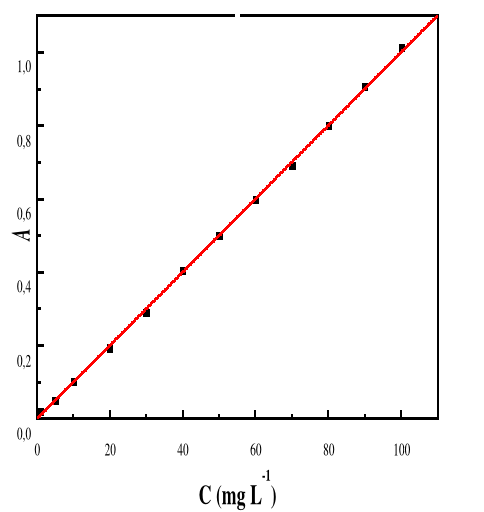
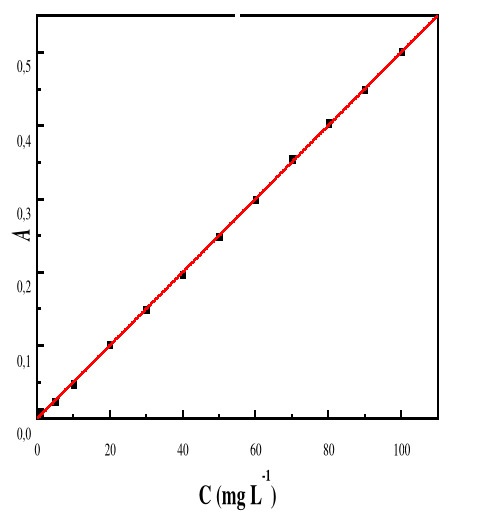
Figure 14: Evolution de l'absorbance en fonction de la
concentration de la solution de Bleu de Méthylène ë
max 664 ; T : 28#177;01°C ; V : 100 mL ;
pH 8,30
Figure 15: Evolution de l'absorbance en fonction de la
concentration de la solution de Bleu de Méthylène ë
max 662 ; T : 28#177;01°C ; V : 100 mL ;
pH 10,01
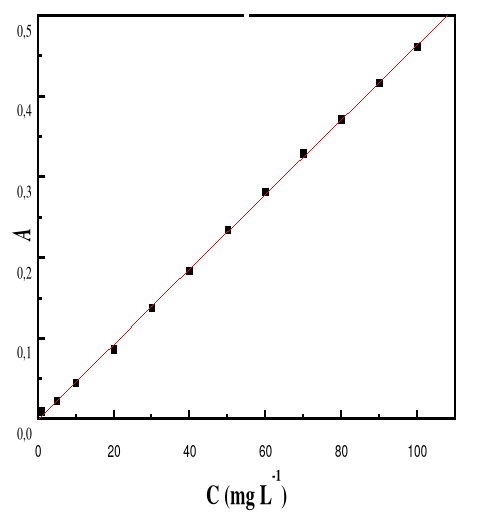
Figure 16: Evolution de l'absorbance en fonction de la
concentration de la solution de Bleu de Méthylène ë
max 662 ; T : 28#177;01°C ; V : 100 mL ;
pH 12,05
3.5. Etude de la capacité
d'adsorption du bioadsorbant vis-à-vis du BM
3.1.8. Essais d'adsorption
Les essais d'adsorption ont été effectués
dans un adsorbeur LACOPE avec 100 mL de solution du BM pour déterminer
l'adsorption en fonction de la masse, du temps, du pH et de la
concentration du bleu de méthylène.
Cette étude a permis de déterminer les
paramètres suivants : le temps nécessaire pour atteindre
l'équilibre entre l'adsorbant en solution et l'adsorbat fixé sur
le bioadsorbant, le pourcentage d'adsorption (%) et la capacité
d'adsorption (Q).
3.1.9. Capacité d'adsorption du
bioadsorbant en fonction du temps d'adsorption
Les expériences d'adsorption en fonction du temps
d'adsorption ont été effectuées suivant le mode
cuvé (batch ou discontinu) dans des adsorbeurs hermétiques
(LACOPE ADS X-3), avec les masses de 10 mg à 1000 mg de Bioadsorbant MA.
La solution de BM 50 mg L- 1 est utilisée pour toutes les
expériences d'adsorption en fonction du temps d'adsorption de
Bioadsorbant MA. L'adsorption en fonction du temps d'adsorption de bioadsorbant
BMA a été étudiée en solution aqueuse au pH
d'autoéquilibre (6,69).
Pour chaque expérience d'adsorption, une masse de
bioadsorbant est placée dans l'adsorbeur ; on ajoute 100 mL de la
solution de BM. La suspension est agitée pendant 1 à 450
minutes.
Après agitation, la suspension est centrifugée
(Centrifugeuse LABOFUGE 200 HERAEUS) pendant 30 minutes à 3000 rpm ; le
centrifugeât est alors analysé à la longueur d'onde
requise. La capacité d'adsorption du bioadsorbant MA a été
calculée selon la formule :
Q 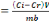  [11]
[11]
Avec :
Q : capacité d'adsorption
(mg/g) ;
Ci : concentration initiale (mg/L) ;
Cr : concentration résiduaire
(mg.L-1) ;
V : volume de la solution (L) ;
mb : masse du bioadsorbant
La concentration résiduelle de la solution après
adsorption est donnée par la relation suivante :
A  .l.Cr
[10] .l.Cr
[10]
Avec :
A : absorbance ou densité optique
(D.0) ;
å : coefficient d'absorption molaire
(L.mg-1.cm-1) ;
l : longueur du chemin optique (cm) ;
Cr : concentration résiduaire
(mg.L-1)
Le pourcentage d'adsorption est donné par
l'équation suivante :
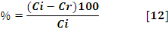
Avec :
Q : capacité d'adsorption (mg/g)
Ci : concentration initiale (mg/L)
Cr : concentration résiduaire
(mg.L-1).
3.1.10. Capacité d'adsorption du B.A en fonction de la
masse du Bioadsorbant
Les expériences d'adsorption en fonction de la masse du
Bioadsorbant ont été effectuées selon le même mode
et le même protocole expérimental que pour les expériences
d'adsorption en fonction du temps d'adsorption. Les masses de 10 mg à
1000 mg de Bioadsorbant ont été utilisées et le temps
d'agitation a été varié de 1 à 450 minutes. La
concentration résiduelle (Cr), la capacité d'adsorption (Q), le
pourcentage d'adsorption (% ads) ont été
calculés selon les formules présentées ci-haut.
3.1.11. Capacité d'adsorption du bioadsorbant en
fonction du pH
L'effet du pH de la solution de BM sur la capacité
d'adsorption du Bioadsorbant a été étudié aux pH
suivants : 3, 4, 5, 8, 10 et 12. Les expériences sont
réalisées suivant le mode discontinu en utilisant 100 mL de la
solution de BM 50 mg L-1 et 200 mg de Bioadsorbant, masse optimale
déterminée expérimentalement en étudiant
l'adsorption en fonction de la masse de bioadsorbant. Le temps d'adsorption est
varié de 0 à 450 minutes. Le même protocole
expérimental utilisé pour les expériences d'adsorption en
fonction du temps a été appliqué.
3.1.12. Capacité d'adsorption du
bioadsorbant en fonction de la concentration.
L'effet de la concentration initiale est réalisé
suivant le mode discontinu pour les concentrations des solutions de BM de 1 mg
L-1 à 100 mg L-1, en vue de déterminer les
isothermes d'adsorption. Le temps d'agitation est fixé à 240
minutes pour le pH 3 et pH 4 et à 300 minutes pour le pH 5, 8, 10 et 12,
temps se situant dans le domaine d'équilibre, pour tous les pH
étudiés. Le protocole expérimental est le même que
celui suivi pour l'adsorption en fonction du temps d'adsorption.
3.1.13. Isothermes d'adsorption
Les isothermes d'adsorption ont été obtenues en
étudiant l'adsorption de BM sur le Bioadsorbant 100 mL des solutions de
concentrations 1 mg L-1 à 100 mg L-1 ont
été utilisés. Les essais ont été
effectués avec 200 mg de bioadsorbant, masse optimale
déterminée expérimentalement.
3.1.14. Modélisation des isothermes
d'adsorption
La modélisation des isothermes d'adsorption a
été faite en recourant aux modèles d'équilibre de
Langmuir et de Freundlich (Kifuani, 2013).
a. Le modèle de Langmuir
Le modèle de Langmuir a été
utilisé sous sa forme linéaire donnée par
l'équation ci-dessous :
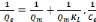 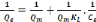 [13] [13]
Avec :
Qe: quantité du soluté
fixée par unité de masse de l'adsorbant (capacité
apparente d'adsorption) ;
Qm : quantité maximale du
soluté fixée par unité de masse d'adsorbant.
En portant 1/Qe en fonction de
1/Ce , Cette équation permet de calculer les
paramètres Qm et KL, à
partir de l'ordonnée à l'origine et de la pente,
respectivement.
b. Le modèle de Freundlich
L'équation linéaire de Freundlich a
été utilisée:
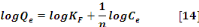
Avec
· Qe et Ce :
concentrations du soluté dans le complexe solide et en solution,
respectivement ;
· KF : constante de Freundlich,
une constante qui est relative à la capacité d'adsorption ;
C'est donc la capacité d'adsorption lorsque la
concentration à l'équilibre est unitaire.
La constante adimensionnelle n est en rapport avec
l'intensité d'adsorption. En portant log Qe en fonction de log
Ce, cette équation permet de calculer les paramètres
KL et 1/n à partir de l'ordonnée à
l'origine et de la pente, respectivement.
Chapitre 4
RESULTATS ET DISCUSSION
L'adsorption du bleu de méthylène sur le
bioadsorbant à base des épluchures de Musa acuminata a
été étudiée en fonction de la masse de
bioadsorbant, du temps d'adsorption, du pH de la solution de BM et de la
concentration initiale de la solution de BM. Pour chaque paramètre, la
capacité ultime d'adsorption apparente et le pourcentage d'adsorption
ont été calculés.
4.1. Caractérisation du Bioadsorbant MA
4.1.1. Caractéristiques physiques
Les résultats sur les caractéristiques physiques
du bioadsorbants MA sont présentés par le tableau 9 et la figure
17.
Tableau 9. Caractéristiques du bioadsorbant
MA
|
Paramètres
|
Valeurs
|
|
Granulométrie (mm)
Teneur en cendre (%)
Humidité (%)
Matière sèche
|
=1 mm
8,10
9,49
90,51
|
|
pHZPC
|
5,73
|
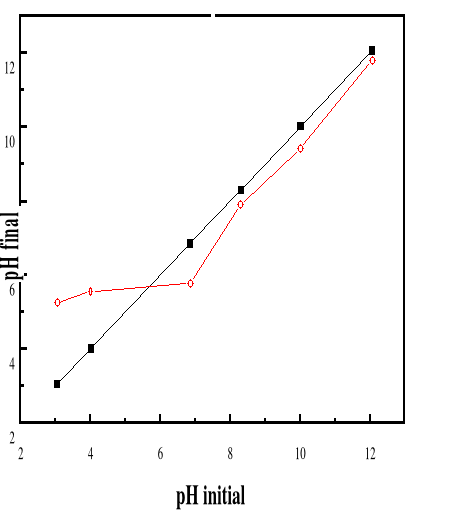
Figure 17: Détermination du
pHzpc
D'après les résultats présentés
par le tableau 9, le bioadsorbant M.A présente une teneur
d'humidité de 9, 49 %, un taux de cendre de 8, 10% et la teneur en
matière sèche de 90,51%. Derbal (2012), a déterminé
une teneur en matière sèche de 86.851%, la teneur en
humidité de 13.148% et le taux de cendre 19.05% pour la peau de banane
brute. Cet écart peut-être attribué au conditionnement de
travail tel que la différence des températures.
4.1.2. pHZPC
La figure 17 montre les graphes de la
dérivée du pH pour le bioadsorbant utilisé à partir
duquel la valeur du pHpzc est déduite. Le pH avec lequel la charge de la
surface est zéro est mentionné comme le point nul de charge
(pHpzc). Au-dessus du pHpzc, la charge extérieure de l'adsorbant est
négative en dessous la charge de la surface du bioadsorbant est
positive. La valeur obtenue dans ce travail est assez proche de la valeur
obtenue par Derbal (2012) ; soit 5,73 contre 5,60.
4.2. Effet du temps d'adsorption de BM sur le bioadsorbant
M A
4.1.3. Présentation des résultats
Cette étude a permis la détermination du temps
d'équilibre d'adsorption de BM sur le bioadsorbant M.A pour les
masses de 10 mg, 50 mg, 100 mg, 200 mg, 400 mg, 800 mg et 1000 mg, à une
température constante (28 oC) et au pH d'autoéquilibre
(6,69).
Elle a permis aussi de calculer la concentration
résiduelle, la capacité d'adsorption ainsi que le pourcentage
d'adsorption. Chaque valeur est une moyenne de 3 essais expérimentaux.
Les résultats obtenus sont présentés par les figures 18
à 31 donnent l'évolution de la capacité d'adsorption et du
pourcentage d'adsorption du bioadsorbant M.A vis-à-vis de BM en
fonction du temps. Les valeurs déterminées sont données
dans les tableaux 12 à 18, en annexes. Les résultats sont obtenus
avec un seuil de confiance supérieur ou égale à 95%.
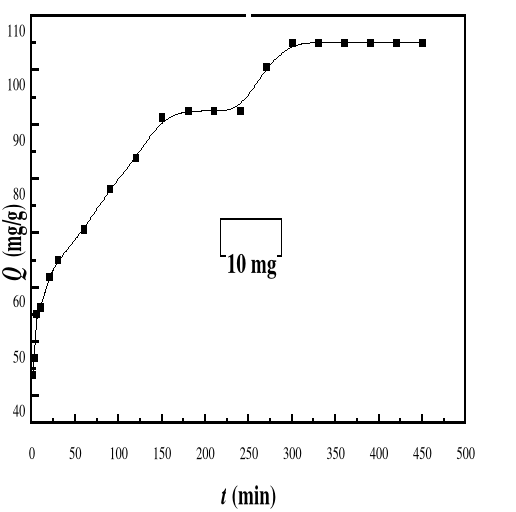
Figure 18 : Evolution de la capacité
d'adsorption du bioadsorbant MA vis-à-vis de BM en fonction du
temps ; ë max : 664 ; Ci : 50 mg/L ; T :
28#177;01 °C; V : 100 mL ; mBA : 10 mg ;
pH 6,69.
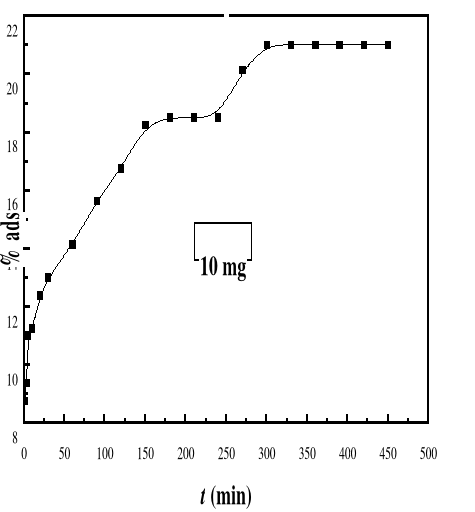
Figure 19 : Evolution du pourcentage d'adsorption du
bioadsorbant MA vis-à-vis de BM en fonction du temps ;
ë max : 664 ; Ci : 50 mg/L ;
T : 28#177;01 °C; V : 100 mL ;
mBA : 10 mg ; pH 6,69.
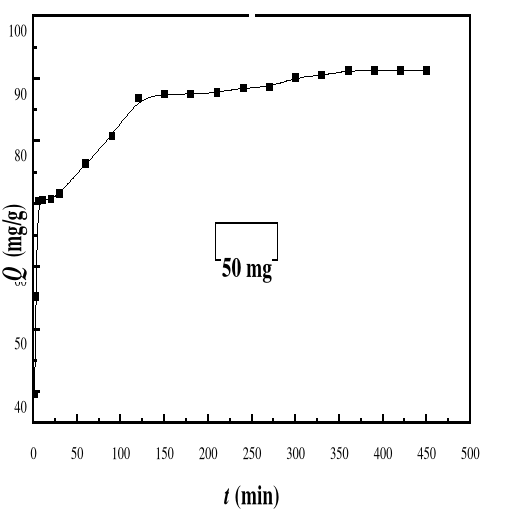
Figure 20 : Evolution de la capacité
d'adsorption du bioadsorbant MA vis-à-vis de BM en fonction du
temps ; ë max : 664 ; Ci : 50 mg/L ; T :
28#177;01 °C; V : 100 mL ; mBA : 50 mg ;
pH 6,69.
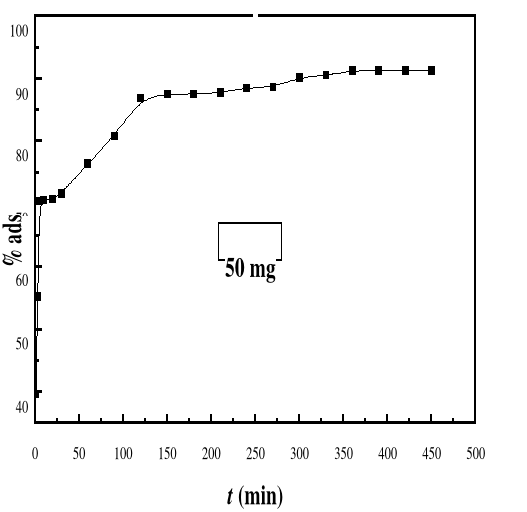
Figure 21 : Evolution du pourcentage d'adsorption du
bioadsorbant MA vis-à-vis de BM en fonction du temps ;
ë max : 664 ; Ci : 50 mg/L ;
T : 28#177;01 °C; V : 100 mL ;
mBA : 50 mg ; pH : 6,69.
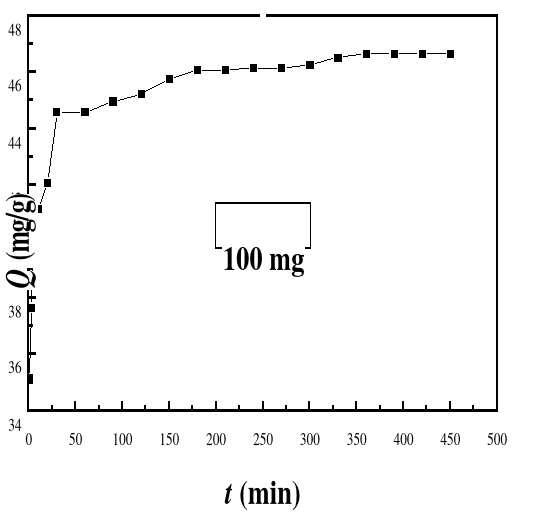
Figure 22 : Evolution de la capacité
d'adsorption du bioadsorbant MA vis-à-vis de BM en fonction du
temps ; ë max : 664 ; Ci : 50 mg/L ; T :
28#177;01 °C; V : 100 mL ; mBA : 100
mg ; pH : 6,69.
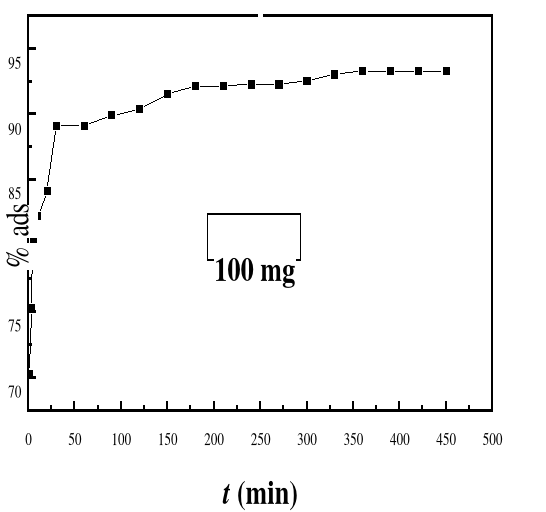
Figure 23 : Evolution du pourcentage d'adsorption du
bioadsorbant MA vis-à-vis de BM en fonction du temps ;
ë max : 664 ; Ci : 50 mg/L ;
T : 28#177;01 °C; V : 100 mL ;
mBA : 100 mg ; pH 6,69
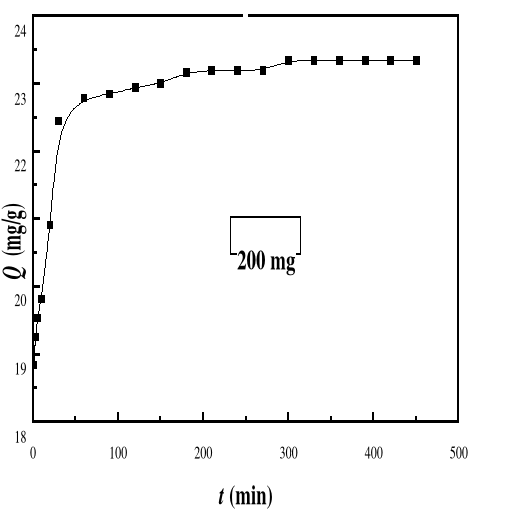
Figure 24 : Evolution de la capacité
d'adsorption du bioadsorbant MA vis-à-vis de BM en fonction du
temps ; ë max : 664 ; Ci : 50 mg/L ; T :
28#177;01 °C; V : 100 mL ; mBA : 200 mg; pH
6,69
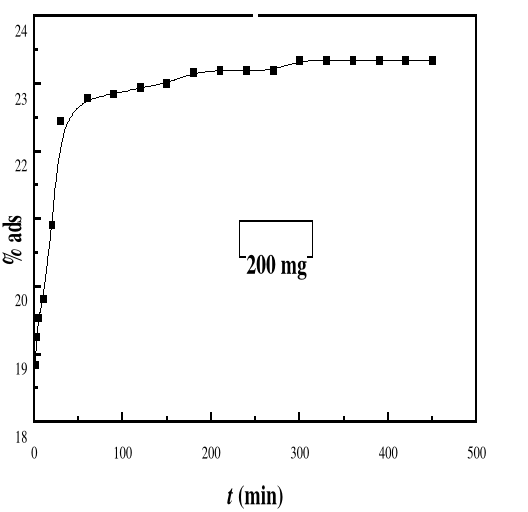
Figure 25 : Evolution du pourcentage d'adsorption du
bioadsorbant MA vis-à-vis de BM en fonction du temps ;
ë max : 664 ; Ci : 50 mg/L ;
T : 28#177;01 °C; V : 100 mL ;
mBA : 200 mg; pH 6,69
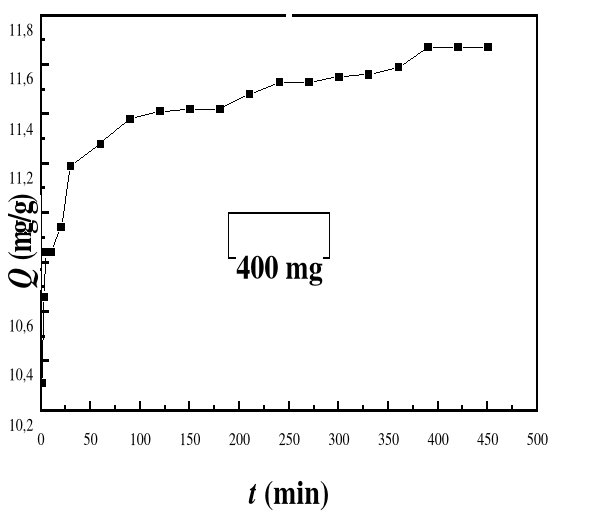
Figure 26 : Evolution de la capacité
d'adsorption du bioadsorbant MA vis-à-vis de BM en fonction du
temps ; ë max : 664 ; Ci : 50 mg/L ; T :
28#177;01 °C; V : 100 mL ; mBA :
400 mg; pH 6,69
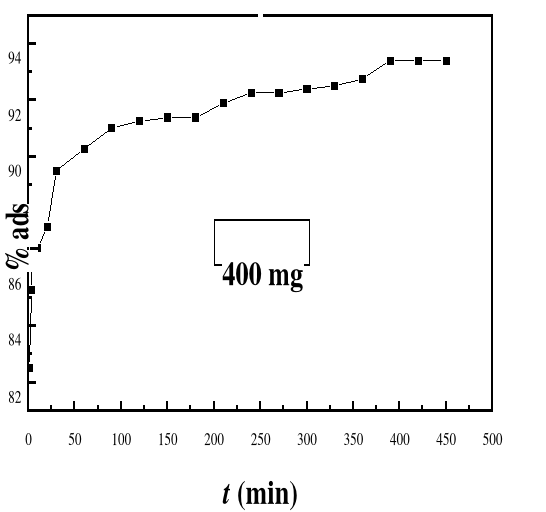
Figure 27 : Evolution du pourcentage d'adsorption du
bioadsorbant MA vis-à-vis de BM en fonction du temps ;
ë max : 664 ; Ci : 50 mg/L ;
T : 28#177;01 °C; V : 100 mL ;
mBA : 400 mg; pH 6,69
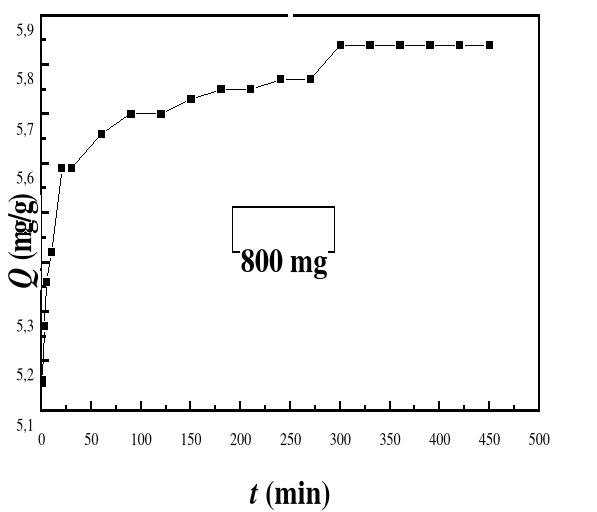
Figure 28 : Evolution de la capacité
d'adsorption du bioadsorbant MA vis-à-vis de BM en fonction du
temps ; ë max : 664 ; Ci : 50 mg/L ; T :
28#177;01 °C; V : 100 mL ; mBA : 800 mg; pH
6,69
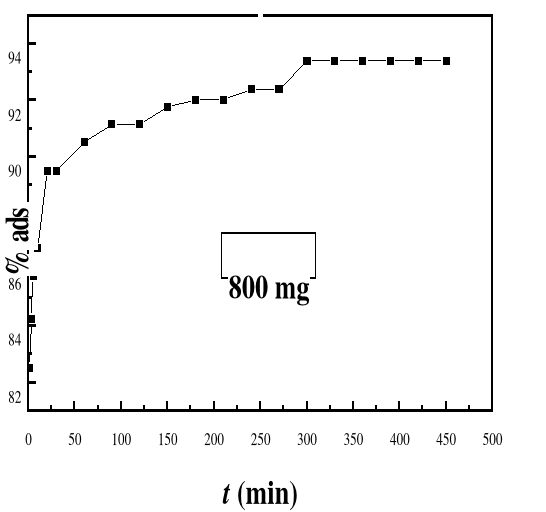
Figure 29 : Evolution du pourcentage d'adsorption du
bioadsorbant MA vis-à-vis de BM en fonction du temps,
ë max : 664 ; Ci : 50 mg/L ;
T : 28#177;01 °C; V : 100 mL ;
mBA : 800 mg; pH 6,69
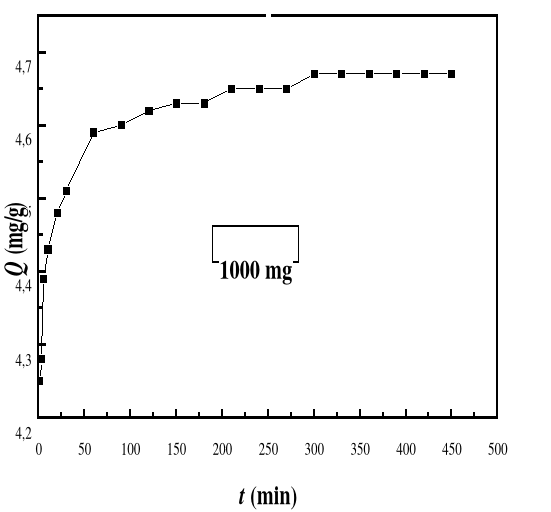
Figure 30 : Evolution de la capacité
d'adsorption du bioadsorbant MA vis-à-vis de BM en fonction du temps,
ë max : 664 ; Ci : 50 mg/L ; T : 28#177;01
°C; V : 100 mL ; mBA : 1000 mg; pH
6,69
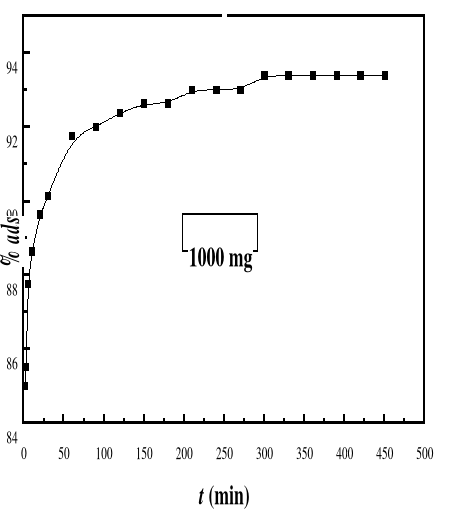
Figure 31 : Evolution du pourcentage d'adsorption du
bioadsorbant MA vis-à-vis de BM en fonction du temps,
ë max : 664 ; Ci : 50 mg/L ;
T : 28#177;01 °C; V : 100 mL ;
mBA : 1000 mg; pH 6,69
4.1.4. Discussion des résultats
L'étude de la capacité d'adsorption du
bioadsorbant vis-à-vis de BM en fonction du temps, décrite par
les figures 18 à 31, montre que la cinétique d'adsorption
présente trois étapes distinctes dans l'évolution de
l'élimination du BM. La première étape est rapide et
correspond au transfert de masse externe, la seconde est lente et est
liée au phénomène de diffusion (transfert de masse interne
en d'autre terme transfert de l'adsorbat de la phase liquide à la
surface du matériau) et la troisième étape correspond
à l'établissement d'un plateau qui suggère la saturation
des sites du bioadsorbant.
Au cours de la première étape, il y a
l'élimination rapide de colorant jusqu'à environ 120 min pour la
masse de 50 mg et environ 30 min pour les masses de 100, 200, 400, 800 et 1000
mg. L'adsorption avec la masse de 10 mg est quasi-rapide ; ceci se
justifie par le fait qu'en début d'adsorption le nombre des sites actifs
disponibles à la surface du matériau adsorbant, est beaucoup plus
important que celui des sites restant après un certain temps. La
deuxième étape est plus lente, elle correspond à
l'établissement d'un équilibre entre les vitesses d'adsorption et
de désorption.
On remarque une augmentation rapide du pourcentage
d'adsorption dans les 30 premières minutes pour atteindre un optimum 12,
38%, 70,75%, 84,13%, 89,69%, ce pourcentage reste à peu près
constant après 300 minutes, indiquant un état d'équilibre.
Puis, l'adsorption se ralentit progressivement. Cela est dû à la
disponibilité du nombre élevé de sites d'adsorption
vacants sur la surface du bioadsorbant M.A au stade initial de l'adsorption et
qui se saturent progressivement.
Abdallah et al., (2016), affirment que les
molécules de BM sont de moyenne taille et peuvent être facilement
diffusées dans les pores internes jusqu'à leur saturation, ce qui
réduira le transfert de masse entre la phase liquide et la phase solide
avec le temps. Ceux-ci mènent à une diminution de la vitesse
d'adsorption et on observe un plateau qui correspond à l'état
d'équilibre, après 300 minutes.
On observe aussi, une diminution progressive de la
concentration résiduelle jusque à une valeur qui reste constante
malgré l'accroissement du temps, Kifuani et al.,(2012),
indiquent que cette diminution traduit la saturation graduelle des pores de
l'adsorbant.
La capacité d'adsorption (Q) augmente avec le
temps de contact jusqu'à atteindre une valeur maximale qui reste
constante, malgré l'accroissement du temps. Cette valeur maximale
correspond à la capacité ultime d'adsorption.
4.3. Effet de la masse sur l'adsorption de BM sur le
bioadsorbant M.A
4.1.5. Présentation des résultats
Les
résultats de la capacité et du pourcentage maximal d'adsorption
de BM sur le bioadsorbant M.A pour les masses 10 mg, 50 mg, 100 mg,
200 mg, 400 mg, 800 mg et 1000 mg sont donnés par les figures 32 et 33
et le tableau 10.
Tableau 10 : Variation de la capacité et du
pourcentage maximale d'adsorption en fonction de la masse du
bioadsorbant
|
Masses du B.A (mg)
|
Q ads max
|
% ads max
|
T. E (min)
|
|
10
|
105,00
|
21,00
|
360
|
|
50
|
91,25
|
91,25
|
360
|
|
100
|
46,63
|
93,25
|
360
|
|
200
|
23,34
|
93,38
|
60
|
|
400
|
11,67
|
93,38
|
390
|
|
800
|
5,84
|
93,38
|
300
|
|
1000
|
4,67
|
93,38
|
300
|
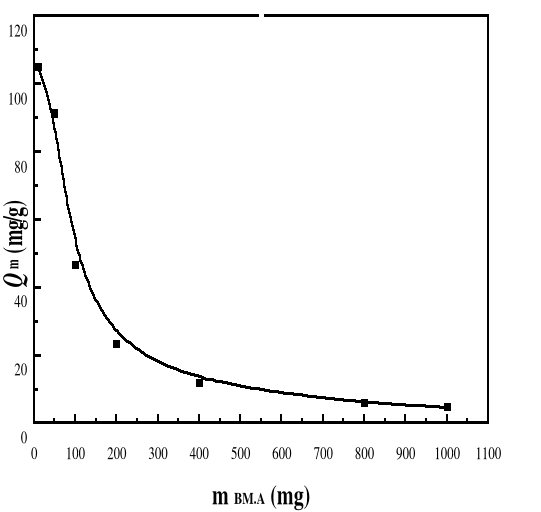
Figure 32: Evolution de la capacité maximale
d'adsorption vis-à-vis de différentes masses de bioadsorbant
ë max : 664 ; Ci : 50 mg/L ; T :
28#177;01 °C; V : 100 mL ; pH 6,69
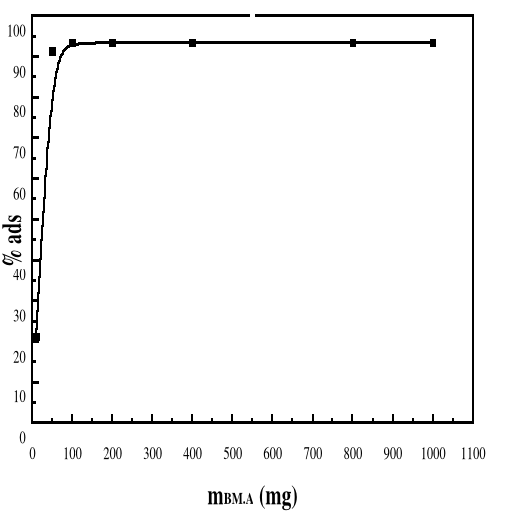
Figure 33: Evolution du pourcentage maximal
d'adsorption vis-à-vis de différentes masses de bioadsorbant
; ë max : 664 ; Ci : 50 mg/L ; T :
28#177;01 °C; V : 100 mL ; pH 6,69
4.1.6. Discussion des résultats en fonction de
la masse
Les résultats présentés par les Figures
31 et 32 montrent un décroissement brutal de la capacité maximale
d'adsorption (Qmax) avec l'accroissement de la
masse du bioadsorbant de 10 mg à 1000 mg. Par contre, on observe une
augmentation du pourcentage maximal d'adsorption avec l'augmentation de la
masse du Bioadsorbant. Le pourcentage maximal d'adsorption passe ainsi de 21,00
% à 93, 25 %, lorsque la masse du Bioadsorbant passe de 10 à 100
mg (Tableau 10). A partir de 200 mg, le pourcentage maximal d'adsorption
demeure pratiquement constante (93, 38 %) jusqu'à 1000 mg.
Cette augmentation est due à la disponibilité de
sites libres d'adsorption qui augmente avec la quantité d'adsorbant
jusqu'à la masse 50 mg. Aux faibles doses de Bioadsorbant, les cations
du colorant BM accèdent facilement aux sites d'adsorption du
bioadsorbant, d'où l'accroissement rapide de la quantité
adsorbée avec la masse du bioadsorbant. Au-delà de cette masse,
le nombre de sites libres accessibles devient stable. L'addition du
bioadsorbant ajoute le nombre des sites libres mais ces additions
supplémentaires entraînent la formation des agglomérations
des particules du bioadsorbant, et excluent certaines particules de
bioadsorbant du processus d'adsorption ; le pourcentage d'adsorption demeure
ainsi constant jusqu'à 1000 mg de bioadsorbant ajoutés. Cette
déduction est rapportée par différents auteurs (Mane et
al., 2007 ; Hui et al., 2011 ; Kifuani et al, 2018).
4.1.7. Adsorption du BM pour les différents pH
des solutions de BM
4.1.7.1. Présentation des résultats
Cette étude a permis la
détermination du temps d'équilibre d'adsorption de BM sur le
bioadsorbant MA pour la masse de 200 mg et à différents
pH. Elle a permis de calculer la concentration résiduelle, la
capacité d'adsorption ainsi que le pourcentage d'adsorption. Les
figures 36 et 37 donnent l'évolution de la capacité d'adsorption
du bioadsorbant MA vis-à-vis de BM en fonction du temps pour
différents pH.
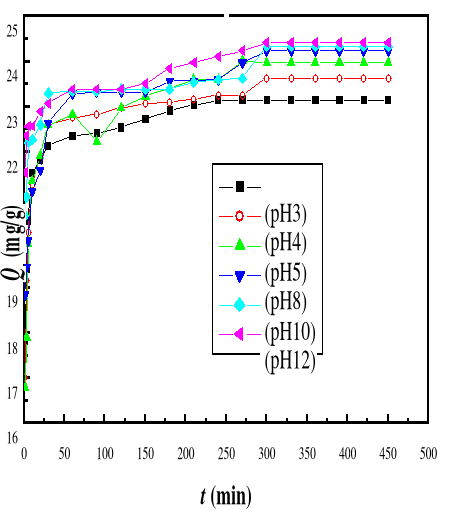
Figure 34 : Evolution de la capacité
d'adsorption du bioadsorbant MA vis-à-vis de BM en fonction du temps
pour différents pH ; Ci : 50 mg/L ; T :
28#177;01 °C; V : 100 mL.
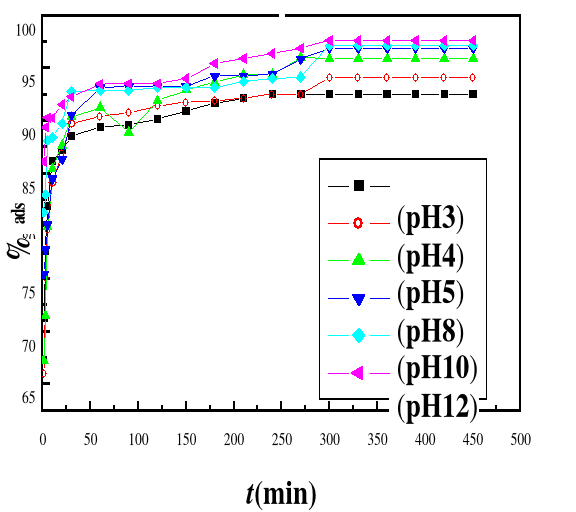
Figure 35 : Evolution du pourcentage du bioadsorbant
vis-à-vis de BM en fonction du temps pour différents pH ;
Ci : 50 mg/L ; T : 28#177;01 °C;
V : 100 mL.
4.1.8. Discussion
A la lumière de résultats obtenus et
présentés par les figures 36 et 37, nous observons une
augmentation lente de la capacité et du pourcentage d'adsorption avec
l'accroissement du pH. La capacité d'adsorption du MA passe de 23, 13
mg/g à 24,41 mg/g,. Lorsque le pH passe de 3,05 à 12,01.
4.4. Effet du pH sur l'adsorption de BM sur le bioadsorbant
MA
4.1.9. Présentation des
résultats
Les
résultats sur l'effet du pH sur l'adsorption de BM sur le bioadsorbant
sont donnés par les figures 36 et 37.
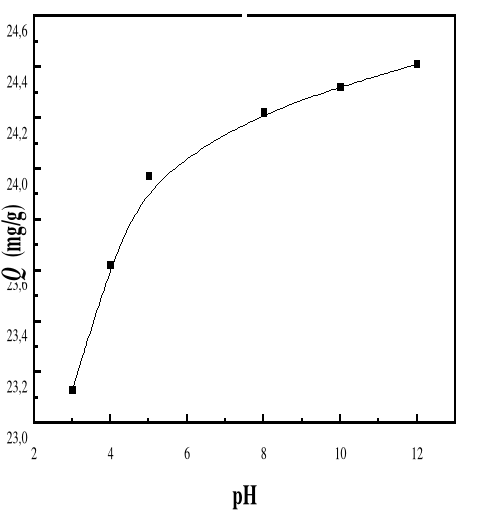
Figure 36 : Evolution de la capacité
d'adsorption maximale d'adsorption du bioadsorbant vis-à-vis de
BM en fonction du temps pour différents pH ; Ci : 50
mg/L ; T : 28#177;01 °C; V : 100 mL.
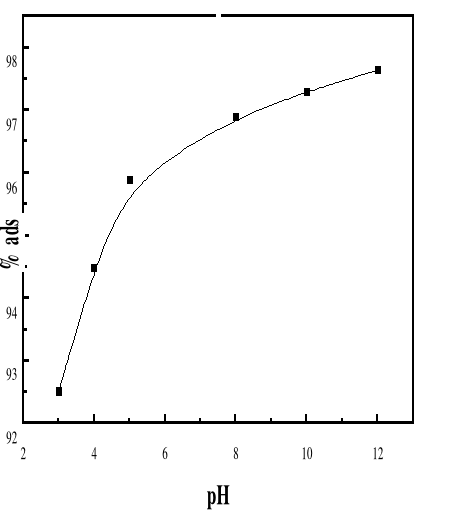
Figure 37 : Evolution du pourcentage maximal
d'adsorption du bioadsorbant vis-à-vis de BM en fonction du
temps pour différents pH ; Ci : 50 mg/L ; T :
28#177;01 °C; V : 100 mL.
4.1.10. Discussion des résultats
Les résultats ci-haut indiquent l'augmentation de la
capacité d'adsorption maximale avec le pH de la solution de BM.
La figure 39 montre une augmentation élevée du
pourcentage adsorption, lorsque le pH de la solution passe de 3 à 12.
Au-delà du pH 5, on remarque toujours l'augmentation du pourcentage mais
avec un rythme plus faible pour atteindre 97, 63 % à pH=12.
Le pHZPC permet de mieux appréhender ces
résultats. Le pHZPC est de 5, 73, ce qui signifie que la
surface de l'adsorbant est chargée positivement au pH inférieur
à 5, 73, et négativement au pH supérieur à 5, 73.
Plus le pH augmente au-delà du pHZPC, plus la densité
d'ions négatives sur la surface de MA augmente à son tour, ce qui
permet plus l'adsorption des cations du BM. Ceci est confirmé par la
faible fixation des molécules de BM en milieu fortement acide ; due
à la répulsion des molécules cationiques BM et la surface
de M.A à cause de l'attraction électrostatique
élevée entre la surface du M.A et les ions cationiques de BM ce
qui entraîne la réduction d'adsorption du colorant. Un maximum
d'adsorption du BM sur le bioadsorbant MA a été atteint au-dessus
du pHZPC.
A des faibles valeurs du pH, la surface de l'adsorbant serait
entourée par les ions H+ ce qui diminue l'interaction des
ions du bleu de méthylène (polluant cationique) avec les sites de
l'adsorbant, par contre au pH élevé, la concentration en
H+ diminue ce qui engendre une bonne interaction entre les ions du
colorant et les sites de la surface.
On observe une diminution de la concentration
résiduelle de BM avec le temps. Kifuani (2013), attribue cette
diminution à la fixation des molécules de BM sur la surface du
bioadsorbant M.A. Cette diminution se fait progressivement avec la
disponibilité des sites libres.
A la lumière de ces résultats, il ressort que
l'adsorption de BM sur MA est meilleure en milieu basique comparé au
milieu acide.
4.5. Adsorption de BM sur le bioadsorbant en fonction de la
concentration de BM
4.1.11. Présentation des résultats
Les figures 38 et 39 donnent l'évolution de la
capacité et du pourcentage d'adsorption du bioadsorbant M.A
vis-à-vis de BM en fonction de la concentration initiale.
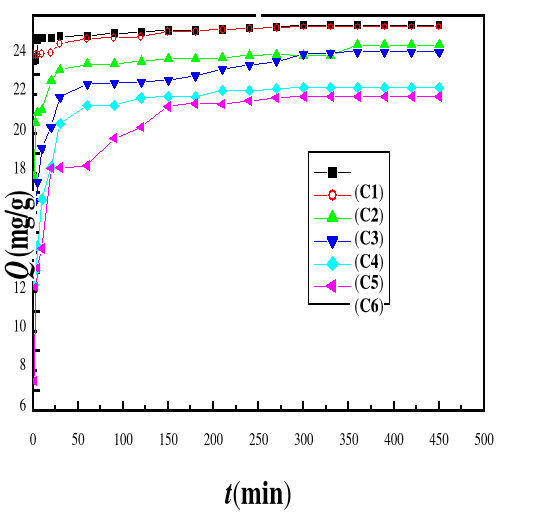
Figure 38 : Evolution de la capacité
d'adsorption du bioadsorbant MA vis-à-vis de BM en fonction de la
concentration, ë max : 664 ; C1 : 10 mg/L, : 20 mg/L,
C3 : 40 mg/L, C4 : 60 mg/L, C5 : 80 mg/L, C6 : 100 mg/L ;
T : 28#177;01 °C; V : 100 mL ; mBA : 200 mg; pH 6,69
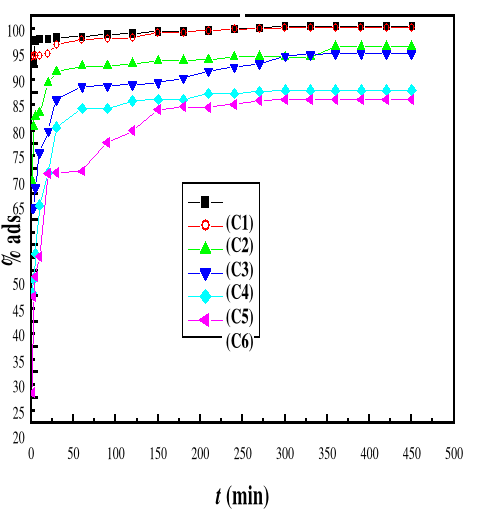
Figure 39 : Evolution du
pourcentage d'adsorption du bioadsorbant MA vis-à-vis de BM en fonction
de la concentration, ë max : 664 ; C1 : 10 mg/L, : 20
mg/L, C3 : 40 mg/L, C4 : 60 mg/L, C5 : 80 mg/L, C6 : 100
mg/L ; T : 28#177;01 °C; V : 100 mL ; mBA : 200 mg; pH 6,69
4.1.12. Discussion
Les résultats consignés dans les figures 38 et
39 indiquent que la capacité (Q) et le pourcentage
d'adsorption montrent une tendance à la baisse lorsque la concentration
initiale du BM augmentée. A des concentrations plus faibles, tous les BM
présents dans le milieu d'adsorption peuvent interagir avec les sites de
liaison sur la surface de l'adsorbant, donc des rendements plus
élevés d'adsorption ont été obtenus. A des
concentrations plus élevées, des rendements d'adsorption plus
faibles ont été observés, en raison de la saturation des
sites d'adsorption Abdallah et al. (2016) ont trouvé des
résultats similaires aux nôtres.
4.1.13. Formes d'Isothermes d'adsorption de BM sur le
bioadsorbant MA
4.1.13.1. Présentation des résultats
Les formes d'isothermes de l'adsorption de BM sur le bio
adsorbant M.A sont présentées par les figures 40 à 46.
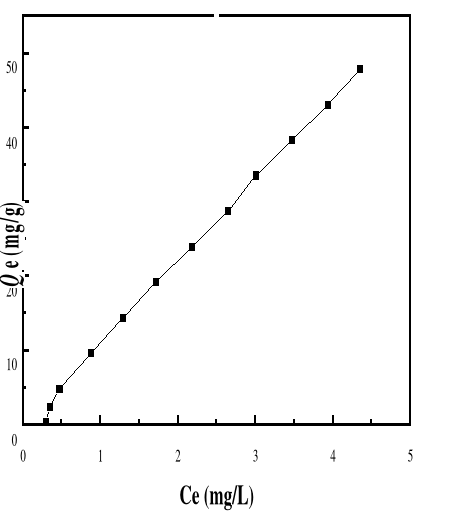
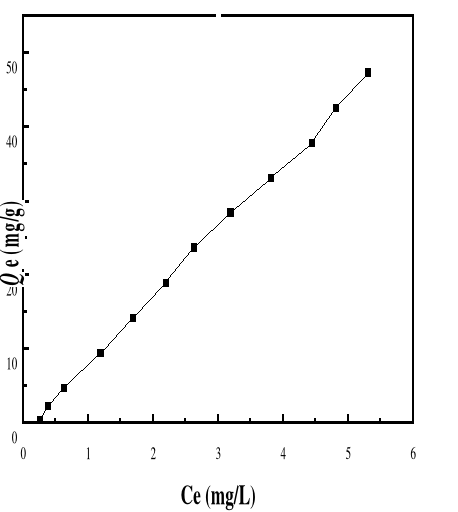
Figure 41 : Isotherme d'adsorption du BM sur le
Bioadsorbant MA à pH 4, 01; V : 100 mL ; mB : 200 mg ;
T°= 28,0#177;0,1°C ; ëmax= 664
Figure 40 : Isotherme d'adsorption du BM sur le
Bioadsorbant MA à pH 3, 05; V : 100 mL ; mB : 200 mg ;
T°= 28,0#177;0,1°C ; ëmax= 664
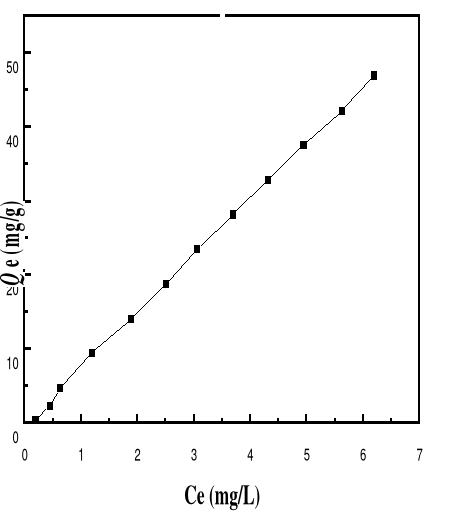
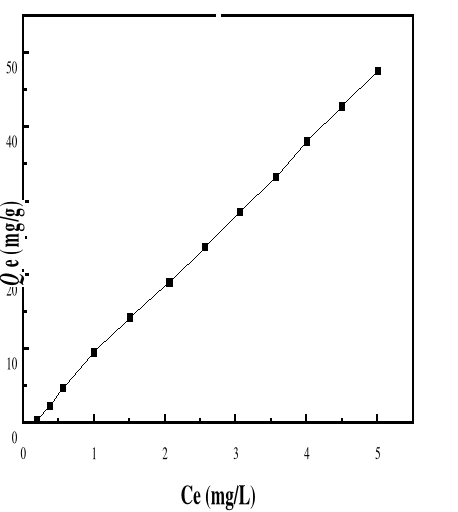
Figure 43 : Isotherme d'adsorption du BM sur le
Bioadsorbant à pH 6, 69; V : 100 mL ; mB : 200 mg ; T°=
28,0#177;0,1°C ; ëmax= 664
Figure 42 : Isotherme d'adsorption du BM sur le
Bioadsorbant à pH 5, 14; V : 100 mL ; mB : 200 mg ; T°=
28,0#177;0,1°C ; ëmax= 664
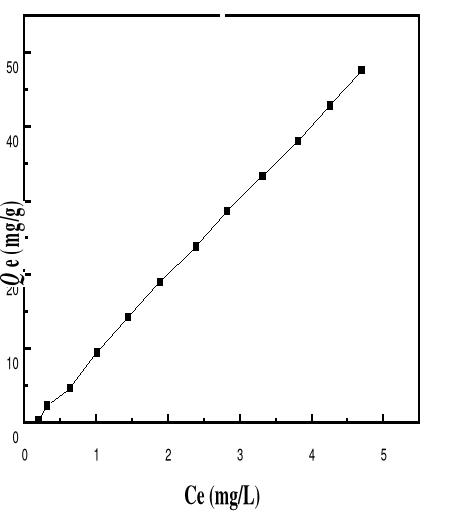
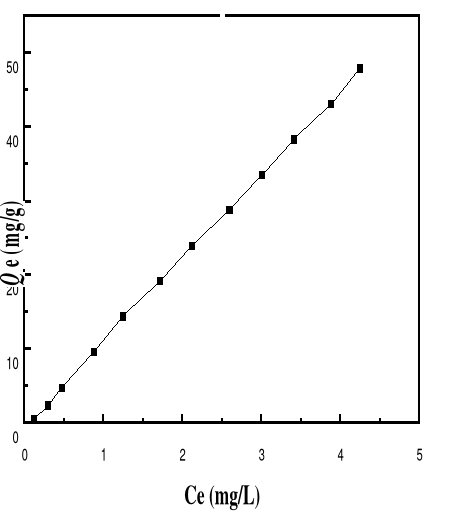
Figure 44 : Isotherme d'adsorption du BM sur le
Bioadsorbant MA à pH 8, 30; V : 100 mL ; mB : 200 mg ;
T°= 28,0#177;0,1°C ; ëmax= 664
Figure 45 : Isotherme d'adsorption du BM sur le
Bioadsorbant MAà pH 10, 01; V : 100 mL ; mB : 200 mg ;
T°= 28,0#177;0,1°C ; ëmax= 664
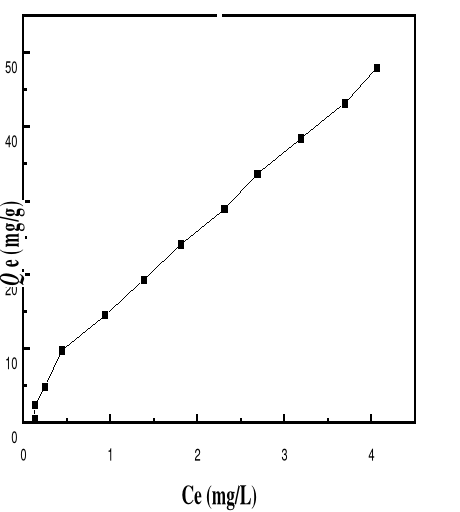
Figure 46 : Isotherme d'adsorption du BM sur le
Bioadsorbant MA à pH 12, 05; V : 100 mL ; mB : 200 mg ;
T°= 28,0#177;0,1°C ; ëmax= 664
4.1.13.2. Discussion
Les résultats obtenus pour la détermination des
isothermes (figures 40 à 46) montrent que les formes d'isothermes
obtenues sont toutes des types C pour le pH 3, 5, 6, 8 et 10 et des types S
pour le pH 4 et 12. La classe des isothermes de type C se caractérise
par une partition constante entre la solution et le substrat. La
linéarité montre que le nombre de sites libres reste constant au
cours de l'adsorption. Ceci signifie que les sites sont créés au
cours de l'adsorption. Les isothermes de cette classe sont obtenues quand les
molécules de soluté sont capables de modifier la texture du
substrat en ouvrant des pores qui n'avaient pas été ouverts
préalablement par le solvant. La classe des isothermes de type S
présente, à faible concentration, une concavité initiale
tournée vers le bas. Les molécules adsorbées favorisent
l'adsorption ultérieure d'autres molécules (adsorption
coopérative). Ceci est dû aux molécules qui s'attirent par
des forces de Van Der Waals, et se regroupent en îlots dans lesquels
elles se tassent les unes contre les autres (Benmakhlouf, 2011).
4.1.14. Modélisation des Isothermes
4.1.14.1. Présentation des résultats
La capacité maximale (Qmax) d'adsorption
vis-à-vis du BM a été déterminée à
partir des isothermes d'équilibre qui représentent la variation
de Qe=f (Ce). Les modèles d'adsorption
testés en phase liquide pour les résultats obtenus sont ceux de
Langmuir et Freundlich. L'analyse des résultats expérimentaux,
selon ces modèles a permis d'avoir les représentations graphiques
présentées par les figures 47 à 60 :
4.1.14.2. Modèle de
Langmuir
Les figures 47 à 53 présentent les figures
linéairises des isothermes de Langmuir pour l'adsorption de bleu
méthylène sur le bioadsorbant MA ;
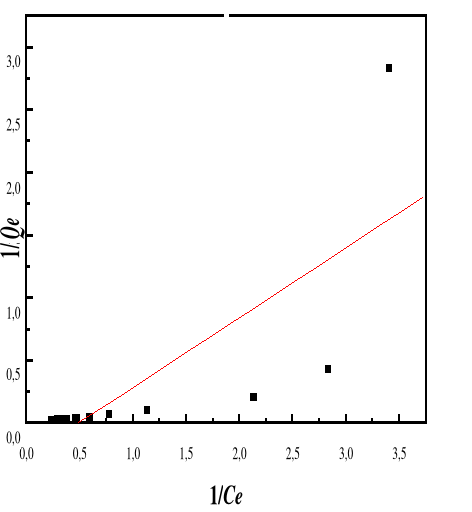
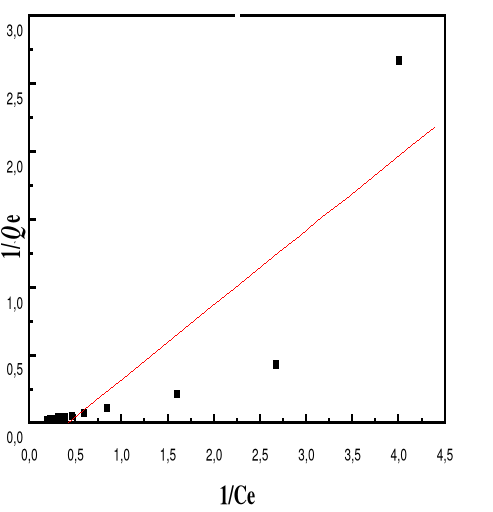
Figure 48: Isotherme d'adsorption
linéarisée du BM sur le MA à pH 4,00 (modèle de
Langmuir)
Figure 47 : Isotherme d'adsorption
linéarisée du BM sur le MA à pH 3,00 (modèle de
Langmuir)
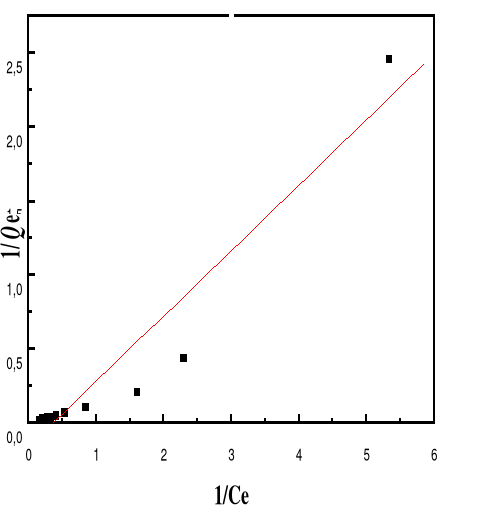
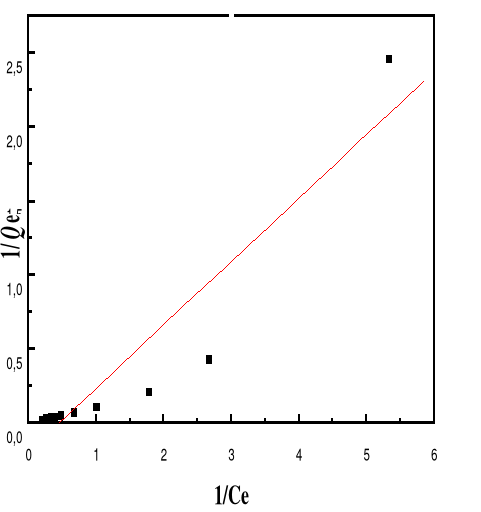
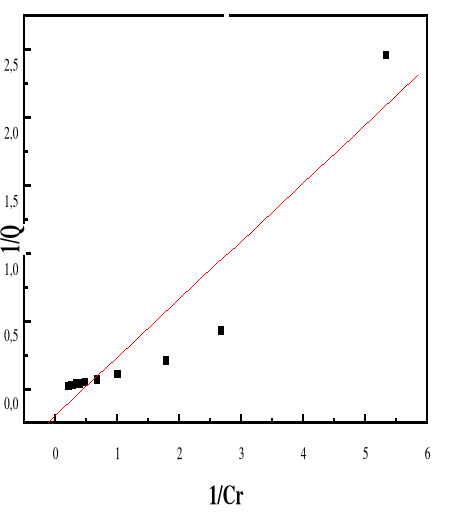
Figure 49 : Isotherme d'adsorption
linéarisée du BM sur le MA à pH 5,00 (modèle de
Langmuir)
Figure 50 : Isotherme d'adsorption
linéarisée du BM sur le MA à pH 6,00 (modèle de
Langmuir)
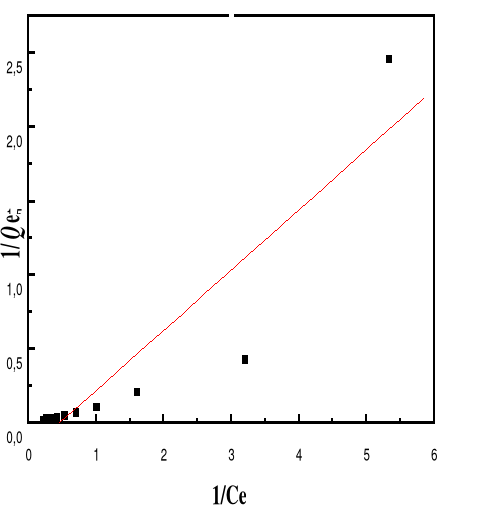
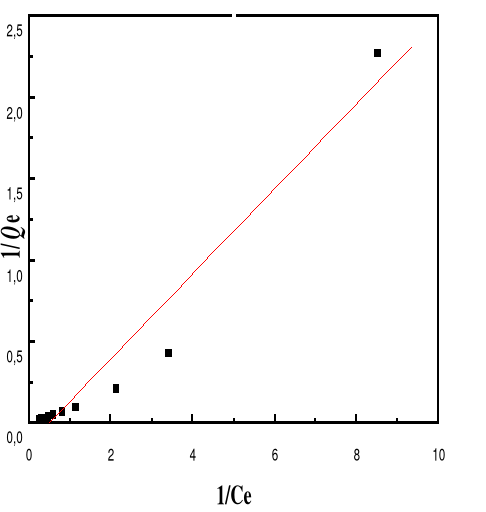
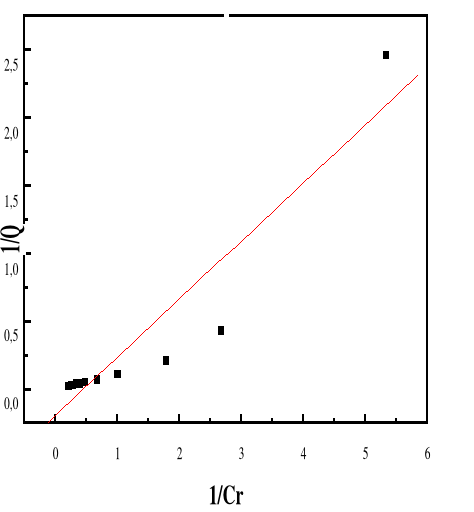
Figure 52 : Isotherme d'adsorption
linéarisée du BM sur le MA à pH 10,00 (modèle de
Langmuir)
Figure 51 : Isotherme d'adsorption
linéarisée du BM sur le MA à pH 8,00 (modèle de
Langmuir)
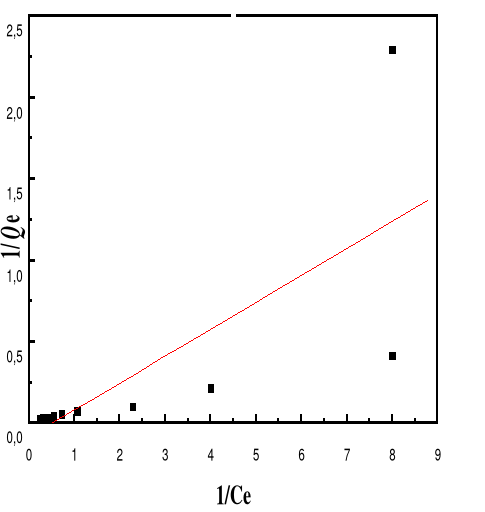
Figure 53 : Isotherme d'adsorption
linéarisée du BM sur le MA à pH 12,00 (modèle de
Langmuir)
4.1.14.3. Modèle de
Freundlich
Les figures 54 à 60 présentent les formes
linéaires des isothermes de Freundlich pour l'adsorption de bleu de
méthylène sur le bioadsorbant.
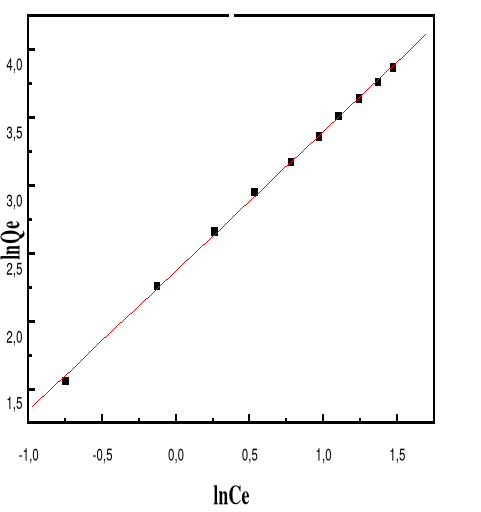

4.1.14.4. Figure 54 : Isotherme d'adsorption
linéarisée du BM sur le MA à pH 3,00 (modèle de
Freundlich)
Figure 55 : Isotherme d'adsorption
linéarisée du BM sur le MA à pH 4,00 (modèle de
Freundlich)
Figure 46 : Isotherme d'adsorption
linéarisée du BM sur le MA à pH 3,00 (modèle de
Freundlich)
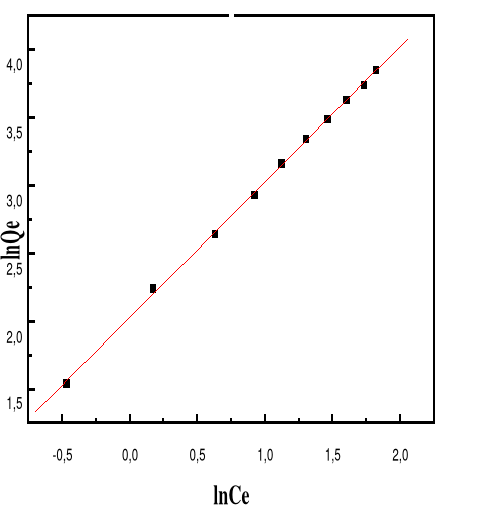
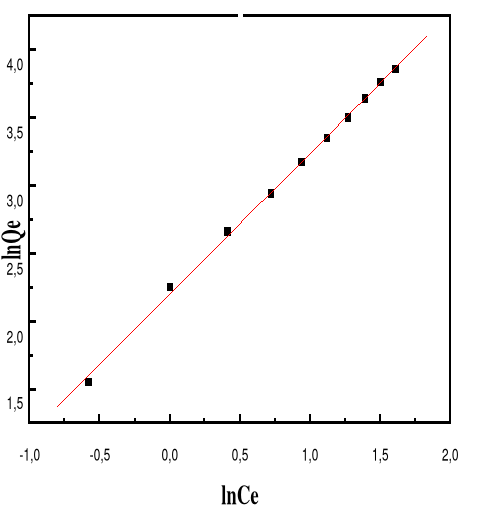
Figure 57 : Isotherme d'adsorption
linéarisée du BM sur le MA à pH 6,00 (modèle de
Freundlich)
Figure 56 : Isotherme d'adsorption
linéarisée du BM sur le MA à pH 5,00 (modèle de
Freundlich)
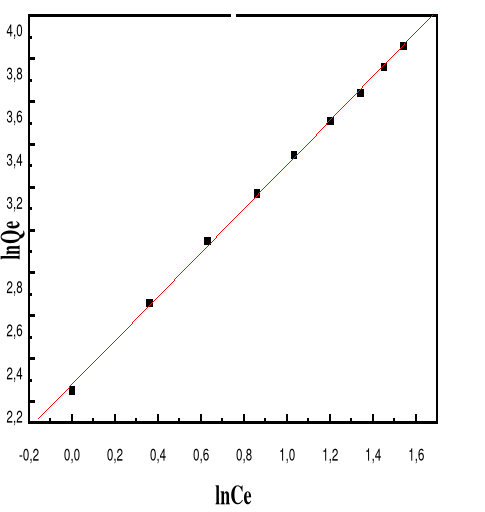
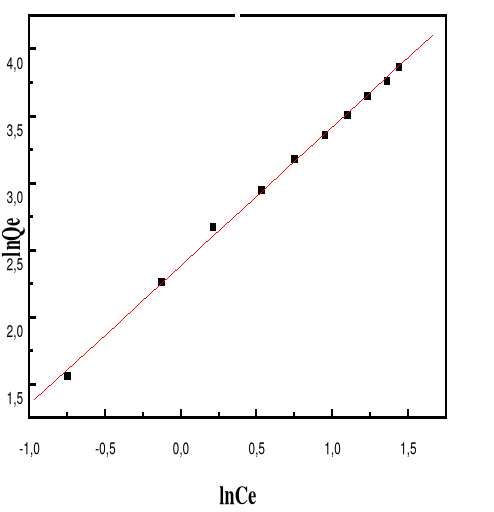
Figure 59 : Isotherme d'adsorption
linéarisée du BM sur le MA à pH 10,00 (modèle de
Freundlich)
Figure 58 : Isotherme d'adsorption
linéarisée du BM sur le MA à pH 8,00 (modèle de
Freundlich)
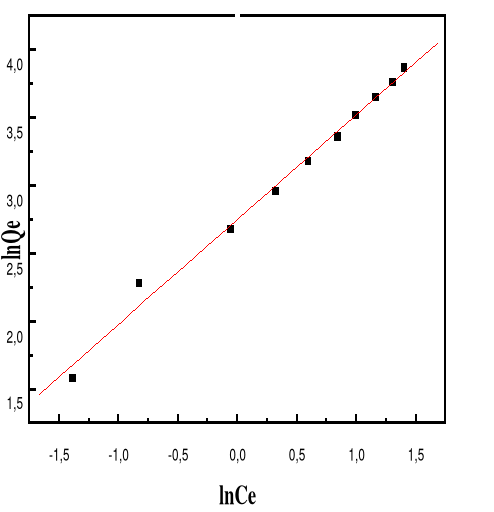
Figure 60 : Isotherme d'adsorption
linéarisée du BM sur le MA à pH 12,00 (modèle de
Freundlich)
Le tableau 11 donne les paramètres de Langmuir et de
Freundlich déterminés pour l'adsorption de bleu de
méthylène sur le bioadsorbant MA.
Tableau 11 : Paramètres de Langmuir et de
Freundlich pour l'adsorption du BM sur le bioadsorbant MA
|
pH
|
Paramètres de Langmuir
|
Paramètres de Freundlich
|
|
Qmax (mg g-1)
|
KL *
|
R2
|
Kf *
|
1/n
|
R2
|
|
3
|
47
|
0,22694
|
0,87705
|
2 ,07207
|
0,03037
|
0,99925
|
|
4
|
48
|
0,27932
|
0,76403
|
2,37096
|
0,02358
|
0,99954
|
|
5
|
48
|
0,1922
|
0,93925
|
2,19963
|
0,02885
|
0,99932
|
|
6
|
47
|
0,16152
|
0,95998
|
2,02898
|
0,02048
|
0,99965
|
|
8
|
48
|
0,18841
|
0,9179
|
2,27796
|
0,01721
|
0,99955
|
|
10
|
48
|
0,12957
|
0,97435
|
2,386
|
0,03364
|
0,99907
|
|
12
|
48
|
0,08778
|
0,75254
|
2,70822
|
0,01895
|
0,99909
|
· Unité de Kf : (mg
g-1) cmg L-1) -1/n
· Unité de KL (L
mg-1)
4.1.14.5. Discussion
Les résultats consignés dans le tableau 11
montre que :
- Les coefficients de corrélation sont
supérieurs à 0,75, ce qui indique que l'adsorption du BM sur le
bioadorbant M.A peut être décrite par le modèle de Langmuir
et le modèle de Freundlich. Toutefois, le modèle de Freundlich
est le mieux approprié pour décrire l'adsorption de BM sur le
bioadsorbant MA, car les coefficients de corrélation du modèle de
Freundlich sont plus élevés comparés à ceux obtenus
avec le modèle de Langmuir, pour tous les pH ;
- Les valeurs du paramètre de Freundlich 1/n sont
inférieurs à 1 pour tous les pH étudiés montrent
l'adsorption est favorable.
CONCLUSION
L'objectif principal de ce travail est de valoriser un
résidu naturel ligno-cellulosique en vue d'évaluer son
efficacité dans l'élimination par adsorption du bleu de
méthylène en solution aqueuse. Les essais ont été
réalisés en mode cuvé dans un adsorbeur LACOPE. La
première étape a consisté à la préparation
et à la caractérisation du biodadsorbant (épluchures de
Musa acuminata). Elle a été suivie des essais
d'adsorption du bleu de méthylène sur le bioadsorbant M.A en
évaluant l'influence des paramètres ci-après : temps
d'adsorption, masse du bioadsorbant, pH de la solution du bleu de
méthylène, concentration de la solution de BM sur l'adsorption.
Cette étude a révélé que
l'adsorption de BM en fonction de différents paramètres montre
trois phases de cinétique de sorption :
§ Une vitesse d'élimination rapide due à
une sorption rapide par la surface externe du solide et à la
différence entre la concentration du soluté dans la solution et
à la surface du solide : la force motrice.
§ Un ralentissement de la vitesse de sorption au fur et
à mesure que le soluté est adsorbé, du fait de la
diminution du nombre de sites de sorption et de la force motrice.
§ Un stade d'équilibre, où il n'y a plus
des sites de sorption libres ou accessibles. Le début de cette phase est
indiqué par un temps appelé temps d'équilibre.
Les résultats obtenus au cours de cette étude
nous conduisent aux conclusions générales suivantes :
- Le bioadsobant M.A présente une teneur
d'humidité de 9,49%, un taux de cendre de 8,10% et une teneur en
matière sèche de 90, 11% ;
- La capacité d'adsorption augmente en fonction du
temps de contact et du pH de la solution. Elle diminue avec
l'accroissement de la masse du bioadsorbant Musa acuminata;
- Le pourcentage d'adsorption augmente en fonction de la masse
du bioadsorbant de Musa acuminata, du temps de contact et du pH de
la solution de bleu de méthylène ;
- La masse optimale pour l'élimination de bleu de
méthylène par bioadsorbant Musa acuminata a
été estimée à 200 mg, le temps d'équilibre
optimum est de 300 minutes et le pH optimum est de 10 ;
- L'adsorption de BM sur l bioadsorbant M.A est meilleure en
milieu basique comparé au milieu acide à cause de la charge de
surface négative de ce bioadsorbant en milieu basique ;
- Les isothermes d'adsorption de BM sur le bioadsorbant M.A
sont de types C et S ;
- Le modèle de Freundlich décrit mieux
l'adsorption du bleu de méthylène sur le bioadsorbant Musa
acuminata ;
- Le bioadsorbant préparé à base du
résidu ligno-cellulosique de l'épluchure de Musa acuminata
constitue un bio adsorbant potentiel pour l'adsorption de bleu de
méthylène en solution aqueuse. Le bioadsorbant Musa
acuminata est un bioadsorbant potentiel pour l'élimination du bleu
de méthylène et peut donc servir pour le traitement
d'épuration des eaux usées.
A partir des résultats de cette étude, quelques
recommandations et perspectives peuvent être
suggérés :
- Etendre l'étude à d'autres types de colorants
ainsi qu'à leurs mélanges
- Effectuer des essais d'adsorption supplémentaires sur
les effluents résiduaires industriels variés afin d'envisager
quelques applications
REFERENCES BIBLIOGRAPHIQUES
1. Alain. Aarfane, A. Salhi , M. El Krati, S. Tahiri , M.
Monkade, E.K. Lhadi, M. Bensitel, Etude cinétique et thermodynamique de
l'adsorption des colorants Red195 et Bleu de méthylène en milieu
aqueux sur les cendres volantes et les mâchefers, J. Mater. Environ.
Sci. 2014, 5, 6 1927-1939.
2. A. Annadurai, R.S. Juang, D.J. Lee, Adsorption of heavy
metals from water using banana and orange peels, Water Sci. Technol.
2002, 47, 185-190.
3. Abibsi Nadjet, Réutilisation des eaux usées
épurées par filtres des plantes (phytoepuration) pour
l'irrigation des espaces verts Application à un quartier de la Ville de
Biskra, Mémoire de magister, Université Mohamed Khider - Biskra,
Alger, 2011.
4. Aboussaoud Wael. M, Etude du Rôle d'adsorbants
Alumino-Silicates dans un procède d'ozonation d'eaux usées
pétrochimiques, Thèse de doctorat, Université de Toulouse,
Toulouse, 2014.
5. Amrouche Sonia et Arouri Tassadit, Adsorption des colorants
textiles sur le minerai du phosphate noir de Kef Es Sennoun (Tébessa,
Algérie), Mémoire de Master, Université Abderrahmane
Mira-Bejaia, Alger 2013, 169 p.
6. Anatole KIFUANI KIA MAYEKO et al, Adsorption de la quinine
bi chlorhydrate sur un charbon actif peu coûteux à base de la
Bagasse de canne à sucre imprégnée de l'acide
phosphorique, International Journal of Biological and Chemical
Sciences., 2012, 3, 1337-1359 .
7. Anatole Kifuani Kia Mayeko, Adsorption des composés
organiques aromatiques en solution aqueuse sur charbon actif à base de
déchets agro-industriels, Thèse de doctorat, Université de
Kinshasa, Kinshasa, 2013.
8. Asmaa Bennani Karim, Badia Mounir, Mohsine Hachkar, Mina
Bakasse et Abdelghani Yaacoubi, Élimination du colorant basique «
Bleu de Méthylène » en solution aqueuse par l'argile de
Safi, Revue des sciences de l'eau, 2010, 23, 4, 375-388
9. Bahia Meroufel, Adsorption des polluants organiques et
inorganiques sur des substances naturelles : Kaolin, racines de Calotropis
procera et Noyaux de dattes, Mémoire de Thèse, Université
de Lorraine, Lorraine, 191 p, 2015.
10. Belaid, K. et Kacha, S. Étude cinétique et
thermodynamique de l'adsorption d'un colorant basique sur la sciure de bois.
Revue des sciences de l'eau, 2011, 24, 2, 131-144.
11. Ben Haoued Zahrat el Oula, Biosorption d'un colorant en
milieu aqueux sur différents déchet organiques, Mémoire de
Master, Université Kasdi Marbah Ouargl, Alger, 51p
12. Benaissa Asma, Etude de la faisabilité
d'élimination de certains colorants textiles par certains
matériaux déchets d'origine naturelle, Mémoire de Master,
Université Abou Bakr Balkaid, Tlemcen, Alger, 2012, 65 p.
13. Benamraoui Faouzia, Elimination des colorants cationiques
par des charbons actifs synthétisés à partir des
résidus de l'agriculture, Mémoire de Master, Université
Ferhat Abbas Setif-1, Alger, 2014, 103 p
14. Benaouda Lemya et Bentaiba Ghaniyya, Optimisation des
conditions opératoires pour l'élimination des colorants par la
biosorption : Application de la méthode des plans d'expériences,
Mémoire de Master, Université Djilali Bounaama Khemis Miliana,
Alger, 2016, 89 p
15. Benmakhlouf Tayeb et Bouiche Mouhoub, Elimination d'un
colorant textile basique (Rouge azucryl) par des rejets de phosphates de
Djebel-Onk (Tébessa, Algérie), Mémoire de master,
Université Abderrahmane Mira-Bejaia, Alger, 2015, 99 p.
16. Benosman née Bengrine Asma, Dépollution des
eaux usées sur un support naturel Chitosane-Bentonite, Mémoire de
Master, Université Abou Bekr Belkaid - Tlemcen, Alger, 2011.
17. Bouafia S, Dégradation des colorants textiles par
procédés d'oxydation avancée basée sur la
réaction de fenton application à la dépollution des rejets
industriels, Thèse de Doctorat, Université de Saâd Dahlab,
Blida, 2010, 89p.
18. Bouchemal Fattoum et Achour Samia, Elimination de la
Tyrosine par Adsorption sur différents Matériaux et Effet de la
Minéralisation des Eaux, Séminaire International sur
L'Hydrogéologie et l'Environnement, 5 - 7 Novembre 2013, Ouargla
(Algérie)
19. Chaheb Naima, L'adsorption du bleu de
méthylène sur l'argile brute de Touggourt, Mémoire de
Master, Université Mohamed Khider de Biskra, Alger 2016, 59 p.
20. Chawki Djelloul, Expérimentation,
Modélisation et Optimisation de l'adsorption des effluents textiles,
Mémoire de doctorant, Université Mohamed Khider de Biskra, Alger
2014, 116 p.
21. Daoud. M et Benturki. O, Activation d'un charbon à
base de noyaux de jujubes et application à l'environnement. Adsorption
d'un colorant de textile, Revue des Energies Renouvelables SIEN
Ghardaï, 2014, 155 - 162.
22. Dbik. A, El Messaoudi. N et Lacherai. A, Valorisation of
wood dates stones of a variety of palm tree of Tinghir region (Morocco):
Application to eliminate methylene blue, JMES, Sci, 2014, 5, 2510-2514
.
23. Derbal Khalfoui Amel Épouse, Etude
expérimentale de l'élimination de polluants organiques et
inorganiques par adsorption sur des matériaux naturels :
Application sur des peaux d'orange et banane, Thèse de doctorat,
Université Mentouri de Constantine, Alger, 2012.
24. F. Sakr, A. Sennaoui, M. Elouardi, M. Tamimi, A.
Assabbane, Adsorption study of Methylene Blue on biomaterial using cactus,
J. Mater. Environ. Sci. 2015, 6, 2, 397-406.
25. François Ramade, Dictionnaire encyclopédique
de l'écologie et des sciences de l'environnement. Dunod
2eme édition, 930 p.
26. Gouarir Borhane, Elimination d'un colorant par adsorption
sur support solide et par procédés photochimiques, en milieu
aqueux, Mémoire de Master, Université Constantine 1, Alger 2013,
118 p.
27. Guergour Saida, Elimination des polluants organiques
contenus dans les eaux usées par Electro-Fenton, Mémoire de
Master, Université Ferhat Abbas-Setif-1, Alger 2014, 117 p.
28. H. Sadki, K. Ziat et M. Saidi, Adsorption of dyes on
activated local clay in aqueous solution, Mater. Environ. Sci, 2014,
5, 2060-2065.
29. Hui Deng .,Jianjiang Lu., Guoxue Li., Genlin Zhang., Xugen
Wang., Adsorption of methylene blue on adsorbent materials produced from cotton
stalk, Chemical Engineering Journal, 2011, 172, p326- 334.
30. Jean Rodier, l'analyse de l'eau : eaux naturelles,
eaux résiduaires et eaux de mer
31. Kang K. C., Kim S. S., Choi J. W., Kwon S. H., Sorption of
Cu2+ and Cd2+ onto acid and base pretreated granular
activated carbon fiber samples, Journal of Industrial and Engineering
Chemistry,.2007, 14, p. 131-135.
32. Karim, A., Mounir, B., Hachkar, M., Bakasse, M. &
Yaacoubi, A. (2010). Élimination du colorant basique « Bleu de
Méthylène » en solution aqueuse par l'argile de Safi.
Revue des sciences de l'eau, 2010, 23, 4, 375-388.
33. Khaldi .K, Hadjel .M, Cherrak .R, Benyoucef .A Et
Zehhaf.A, Etude de l'adsorption du Bleu de Méthylène par
matériaux aluminosilicates d'origine algérien étude
cinétique et thermodynamique, Université Ferhat Abbas-Setif-1,
Alger 2015, 123 p
34. Kharfallah Narimen et Fratsa Latifa, Adsorption de bleu de
méthylène sur Arundo donax activé Thermiquement,
Mémoire de Master, Université M'hamed Bougara Boumerdes, Alger
2017, 57Pp
35. Kifline Milebudi Kifuani, Anatole Kifuani Kia Mayeko,
Philippe Noki Vesituluta, Bernard Ilinga Lopaka, Gracien Ekoko Bakambo, Blaise
Mbala Mavinga et Jeremie Muswema Lunguya, Adsorption d'un colorant basique,
Bleu de Méthylène, en solution aqueuse, sur un bioadsorbant issu
de déchets agricoles de Cucumeropsis mannii Naudin
i, Int. J. Biol. Chem. Sci, 2018, 12, 1, 558-575.
36. Kumar Djamel Belaid et Smaïl Kacha, Étude
cinétique et thermodynamique de l'adsorption d'un colorant basique sur
la sciure de bois, Revue des sciences de l'eau / Journal of Water
Science, 2011, 24, 2, 131-144
37. Laetitia Majoli. Elaboration, caractérisation et
étude des performances de nouveaux adsorbants hydrophobes : application
aux atmosphères odorantes et/ou chargées en composés
organiques volatils. Sciences de l'environnement. Ecole Nationale
Supérieure des Mines de Saint-Etienne, 2005, 232 p.
38. Mane Vs., Mall Id., Shrivastava Vc., Use of bagasse fly
ash as an adsorbent for the removal of brilliant green dye from aqueous
solution, Dyes Pigments ,2007, 73-269.
39. Mira Abdallah, Akram Hijazi, Mostafa Hamieh, Mohamad
Alameh, Joumana Toufaily, Hassan Rammal, Treatment of Industrial Wastewater
Using A Natural And Biodegradable adsorbent based on eucalyptus, J. Mater.
Environ. Sci. 2016, 7, 11, 4036-4048.
40. Mounir Ziati, Sabir Hazourli, Sana Nouacer, Fatma Zohra
Khelaifia, Nesrine Nait Merzoug, Adsorption de l'arsenic sur un résidu
naturel ligno-cellulosique valorisé en charbon actif - Exemple des
Noyaux de Dattes, Lebanese Science Journal, 2013, 14, 1,
2013,73-85.
41. Nait-Merzoug A, Benjaballah A, Guellati O,
Préparation et Caractérisation d'un charbon actif à base
d'un déchet agricole, 2016, 36-41 p
42. Raven PH, Berg L.R et Hassenzan D.M, Environnement
Editions de Boeck supérieur 2eme édition
Bruxelles 2011.
43. Rejsek Franck, Analyse de l'eau : Aspects et
réglementaire et technique, Ed CRDP d'Aquitaine, France, 2002, 358 p.
44. Renmin Gonga, Mei Li, Chao Yang, Yingzhi Suna, Jian Chenb,
«Removel of cationic dyes from aqueous solution by adsorption on peanut
hull», Journal of Hazardous Materials, 2005, 247-250.
45. S. Boumchita, A. Lahrichi, Y. Benjelloun, S. Lairini, V.
Nenov,F. Zerrouq, Removal of cationic dye from aqueous solution by a food
waste: Potato peel, J. Mater. Environ, 2016, 7 , 1, p 73-84.
46. Sana Nouacer, Application des tiges de dattes dans
l'adsorption de métaux toxiques de l'eau, thèse de doctorat,
Université Badji Mokhtar - Annaba, Alger, 134 p.
47. Saoudi Samiha et Hamouma Ouezna, Adsorption d'un colorant
basique bleu de méthylène sur une argile acidifié,
Mémoire de Master, Université A. MIRA - Bejaïa, Alger, 2013,
73 p.
48. Tangou Tabou Thierry, Chimie de l'environnement Pollutions
et Nuisances Volume 1. Editions presses Universitaires de Kinshasa, 2016. 139
p.
49. Tangou Tabou Thierry, Technologie de l'eau, Editions
Presses de l'Université de Kinshasa, Kinshasa, 2016, 138 p.
50. Yeddou Mezenner, Bensaadi Z., Lagha H. Bensmaili A. Yeddou
Mezenner N., Bensaadi Z., Lagha H. Bensmaili A, Etude de l'adsorption d'une
mixture de Composes biorecalcitrants en milieu aqueux, Larhyss
Journal, 2012, 11, p. 7-16.
51. Zied Marzougui, Elaboration de latex magnétique
fonctionnalisée pour le traitement des eaux usées par adsorption,
Thèse de doctorat, Université de Lyon, Lyon, 2016
52. Zoubida Smahi, Essais de valorisation d'un déchet
cellulosique : tiges de chardons dans l'élimination d'un colorant
basique à partir de solutions aqueuses synthétiques, Thèse
de doctorat, Université Abou-Bekr Belkaïd - Tlemcen, Alger , 2017,
274 p
Annexes
Annexe 1 : Résultats de l'adsorption du BM
sur le Musa acuminataen fonction du temps et de la
masse
Tableau 12 : Capacité d'adsorption du
bioadsorbant MA vis-à-vis de BM en fonction du temps ;
ë max : 664 ; Ci : 50 mg/L ; T :
28#177;01 °C ; V : 100 mL ; mBA : 10mg
|
Temps (min)
|
A
|
Cr (mg/L)
|
Q Ads (mg/g)
|
% Ads
|
|
1
|
0,73
|
45,63
|
43,75
|
8,75
|
|
3
|
0,725
|
45,31
|
46,88
|
9,38
|
|
5
|
0,712
|
44,50
|
55,00
|
11,00
|
|
10
|
0,71
|
44,38
|
56,25
|
11,25
|
|
20
|
0,701
|
43,81
|
61,88
|
12,38
|
|
30
|
0,696
|
43,50
|
65,00
|
13,00
|
|
60
|
0,687
|
42,94
|
70,63
|
14,13
|
|
90
|
0,675
|
42,19
|
78,13
|
15,63
|
|
120
|
0,666
|
41,63
|
83,75
|
16,75
|
|
150
|
0,652
|
40,75
|
92,50
|
18,50
|
|
180
|
0,654
|
40,88
|
91,25
|
18,25
|
|
210
|
0,652
|
40,75
|
92,50
|
18,50
|
|
240
|
0,652
|
40,75
|
92,50
|
18,50
|
|
270
|
0,639
|
39,94
|
100,63
|
20,13
|
|
300
|
0,632
|
39,50
|
105,00
|
21,00
|
|
330
|
0,632
|
39,50
|
105,00
|
21,00
|
|
360
|
0,632
|
39,50
|
105,00
|
21,00
|
|
390
|
0,632
|
39,50
|
105,00
|
21,00
|
|
420
|
0,632
|
39,50
|
105,00
|
21,00
|
|
450
|
0,632
|
39,50
|
105,00
|
21,00
|
Tableau 13 : Capacité d'adsorption du
bioadsorbant MA vis-à-vis de BM en fonction du temp ;
ë max : 664 ; Ci : 50 mg/L ; T :
28#177;01 °C; V : 100 mL ; mBA : 50mg
|
Temps(min)
|
A
|
Cr (mg/L)
|
QAds(mg/g)
|
%Ads
|
|
1
|
0,483
|
30,19
|
39,63
|
39,63
|
|
3
|
0,359
|
22,44
|
55,13
|
55,13
|
|
5
|
0,237
|
14,81
|
70,38
|
70,38
|
|
10
|
0,235
|
14,69
|
70,63
|
70,63
|
|
20
|
0,234
|
14,63
|
70,75
|
70,75
|
|
30
|
0,227
|
14,19
|
71,63
|
71,63
|
|
60
|
0,189
|
11,81
|
76,38
|
76,38
|
|
90
|
0,154
|
9,63
|
80,75
|
80,75
|
|
120
|
0,105
|
6,56
|
86,88
|
86,88
|
|
150
|
0,1
|
6,25
|
87,50
|
87,50
|
|
180
|
0,1
|
6,25
|
87,50
|
87,50
|
|
210
|
0,098
|
6,13
|
87,75
|
87,75
|
|
240
|
0,092
|
5,75
|
88,50
|
88,50
|
|
270
|
0,091
|
5,69
|
88,63
|
88,63
|
|
300
|
0,079
|
4,94
|
90,13
|
90,13
|
|
330
|
0,076
|
4,75
|
90,50
|
90,50
|
|
360
|
0,07
|
4,38
|
91,25
|
91,25
|
|
390
|
0,07
|
4,38
|
91,25
|
91,25
|
|
420
|
0,07
|
4,38
|
91,25
|
91,25
|
|
450
|
0,07
|
4,38
|
91,25
|
91,25
|
Tableau 14 : Capacité d'adsorption du
bioadsorbant MA vis-à-vis de BM en fonction du temps ;
ë max : 664 ; Ci : 50 mg/L ; T :
28#177;01 °C ; V : 100 mL ; mBA : 100 mg
|
Temps (min)
|
A
|
Cr (mg/L)
|
Q Ads (mg/g)
|
%Ads
|
|
1
|
0,238
|
14,88
|
35,13
|
70,25
|
|
3
|
0,198
|
12,38
|
37,63
|
75,25
|
|
5
|
0,157
|
9,81
|
40,19
|
80,38
|
|
10
|
0,142
|
8,88
|
41,13
|
82,25
|
|
20
|
0,127
|
7,94
|
42,06
|
84,13
|
|
30
|
0,087
|
5,44
|
44,56
|
89,13
|
|
60
|
0,087
|
5,44
|
44,56
|
89,13
|
|
90
|
0,081
|
5,06
|
44,94
|
89,88
|
|
120
|
0,077
|
4,81
|
45,19
|
90,38
|
|
150
|
0,068
|
4,25
|
45,75
|
91,50
|
|
180
|
0,063
|
3,94
|
46,06
|
92,13
|
|
210
|
0,063
|
3,94
|
46,06
|
92,13
|
|
240
|
0,062
|
3,88
|
46,13
|
92,25
|
|
270
|
0,062
|
3,88
|
46,13
|
92,25
|
|
300
|
0,06
|
3,75
|
46,25
|
92,50
|
|
330
|
0,056
|
3,50
|
46,50
|
93,00
|
|
360
|
0,054
|
3,38
|
46,63
|
93,25
|
|
390
|
0,054
|
3,38
|
46,63
|
93,25
|
|
420
|
0,054
|
3,38
|
46,63
|
93,25
|
|
450
|
0,054
|
3,38
|
46,63
|
93,25
|
Tableau 15 : Capacité d'adsorption du
bioadsorbant MA vis-à-vis de BM en fonction du temps ;
ë max : 664 ; Ci : 50 mg/L ; T :
28#177;01 °C; V : 100 mL ; mBA : 200 mg
|
Temps(min)
|
A
|
Cr (mg/L)
|
QAds(mg/g)
|
%Ads
|
|
1
|
0,197
|
12,31
|
18,84
|
75,38
|
|
3
|
0,184
|
11,50
|
19,25
|
77,00
|
|
5
|
0,175
|
10,94
|
19,53
|
78,13
|
|
10
|
0,166
|
10,38
|
19,81
|
79,25
|
|
20
|
0,131
|
8,19
|
20,91
|
83,63
|
|
30
|
0,082
|
5,13
|
22,44
|
89,75
|
|
60
|
0,071
|
4,44
|
22,78
|
91,13
|
|
90
|
0,069
|
4,31
|
22,84
|
91,38
|
|
120
|
0,066
|
4,13
|
22,94
|
91,75
|
|
150
|
0,064
|
4,00
|
23,00
|
92,00
|
|
180
|
0,059
|
3,69
|
23,16
|
92,63
|
|
210
|
0,058
|
3,63
|
23,19
|
92,75
|
|
240
|
0,058
|
3,63
|
23,19
|
92,75
|
|
270
|
0,064
|
4,00
|
23,00
|
92,00
|
|
300
|
0,053
|
3,31
|
23,34
|
93,38
|
|
330
|
0,053
|
3,31
|
23,34
|
93,38
|
|
360
|
0,053
|
3,31
|
23,34
|
93,38
|
|
390
|
0,053
|
3,31
|
23,34
|
93,38
|
|
420
|
0,053
|
3,31
|
23,34
|
93,38
|
|
450
|
0,053
|
3,31
|
23,34
|
93,38
|
|
Temps(min)
|
A
|
Cr (mg/L)
|
QAds(mg/g)
|
%Ads
|
|
1
|
0,14
|
8,75
|
10,31
|
82,50
|
|
3
|
0,118
|
7,38
|
10,66
|
85,25
|
|
5
|
0,106
|
6,63
|
10,84
|
86,75
|
|
10
|
0,106
|
6,63
|
10,84
|
86,75
|
|
20
|
0,1
|
6,25
|
10,94
|
87,50
|
|
30
|
0,084
|
5,25
|
11,19
|
89,50
|
|
60
|
0,078
|
4,88
|
11,28
|
90,25
|
|
90
|
0,072
|
4,50
|
11,38
|
91,00
|
|
120
|
0,07
|
4,38
|
11,41
|
91,25
|
|
150
|
0,069
|
4,31
|
11,42
|
91,38
|
|
180
|
0,069
|
4,31
|
11,42
|
91,38
|
|
210
|
0,065
|
4,06
|
11,48
|
91,88
|
|
240
|
0,062
|
3,88
|
11,53
|
92,25
|
|
270
|
0,062
|
3,88
|
11,53
|
92,25
|
|
300
|
0,061
|
3,81
|
11,55
|
92,38
|
|
330
|
0,06
|
3,75
|
11,56
|
92,50
|
|
360
|
0,058
|
3,63
|
11,59
|
92,75
|
|
390
|
0,053
|
3,31
|
11,67
|
93,38
|
|
420
|
0,053
|
3,31
|
11,67
|
93,38
|
|
450
|
0,053
|
3,31
|
11,67
|
93,38
|
Tableau 16 : Capacité d'adsorption du
bioadsorbant MA vis-à-vis de BM en fonction du temps ;
ë max : 664 ; Ci : 50 mg/L ; T :
28#177;01 °C; V : 100 mL ; mBA : 400 mg
Tableau 17 : Capacité d'adsorption du
bioadsorbant MA vis-à-vis de BM en fonction du temps ;
ë max : 664 ; Ci : 50 mg/L ; T :
28#177;01 °C ; V : 100 mL ; mBA : 800 mg
|
Temps(min)
|
A
|
Cr (mg/L)
|
QAds(mg/g)
|
%Ads
|
|
1
|
0,14
|
8,75
|
5,16
|
82,50
|
|
3
|
0,126
|
7,88
|
5,27
|
84,25
|
|
5
|
0,114
|
7,13
|
5,36
|
85,75
|
|
10
|
0,106
|
6,63
|
5,42
|
86,75
|
|
20
|
0,084
|
5,25
|
5,59
|
89,50
|
|
30
|
0,084
|
5,25
|
5,59
|
89,50
|
|
60
|
0,076
|
4,75
|
5,66
|
90,50
|
|
90
|
0,071
|
4,44
|
5,70
|
91,13
|
|
120
|
0,071
|
4,44
|
5,70
|
91,13
|
|
150
|
0,066
|
4,13
|
5,73
|
91,75
|
|
180
|
0,064
|
4,00
|
5,75
|
92,00
|
|
210
|
0,064
|
4,00
|
5,75
|
92,00
|
|
240
|
0,061
|
3,81
|
5,77
|
92,38
|
|
270
|
0,061
|
3,81
|
5,77
|
92,38
|
|
300
|
0,053
|
3,31
|
5,84
|
93,38
|
|
330
|
0,053
|
3,31
|
5,84
|
93,38
|
|
360
|
0,053
|
3,31
|
5,84
|
93,38
|
|
390
|
0,053
|
3,31
|
5,84
|
93,38
|
|
420
|
0,053
|
3,31
|
5,84
|
93,38
|
|
450
|
0,053
|
3,31
|
5,84
|
93,38
|
|
Temps(min)
|
A
|
Cr (mg/L)
|
QAds(mg/g)
|
%Ads
|
|
1
|
0,12
|
7,50
|
4,25
|
85,00
|
|
3
|
0,116
|
7,25
|
4,28
|
85,50
|
|
5
|
0,098
|
6,13
|
4,39
|
87,75
|
|
10
|
0,091
|
5,69
|
4,43
|
88,63
|
|
20
|
0,083
|
5,19
|
4,48
|
89,63
|
|
30
|
0,079
|
4,94
|
4,51
|
90,13
|
|
60
|
0,066
|
4,13
|
4,59
|
91,75
|
|
90
|
0,064
|
4,00
|
4,60
|
92,00
|
|
120
|
0,061
|
3,81
|
4,62
|
92,38
|
|
150
|
0,059
|
3,69
|
4,63
|
92,63
|
|
180
|
0,062
|
3,88
|
4,61
|
92,25
|
|
210
|
0,056
|
3,50
|
4,65
|
93,00
|
|
240
|
0,056
|
3,50
|
4,65
|
93,00
|
|
270
|
0,056
|
3,50
|
4,65
|
93,00
|
|
300
|
0,053
|
3,31
|
4,67
|
93,38
|
|
330
|
0,053
|
3,31
|
4,67
|
93,38
|
|
360
|
0,053
|
3,31
|
4,67
|
93,38
|
|
390
|
0,053
|
3,31
|
4,67
|
93,38
|
|
420
|
0,053
|
3,31
|
4,67
|
93,38
|
|
450
|
0,053
|
3,31
|
4,67
|
93,38
|
Tableau 18 : Capacité d'adsorption du
bioadsorbant MA vis-à-vis de BM en fonction du temps ;
ë max : 664 ; Ci : 50 mg/L ; T :
28#177;01 °C; V : 100 mL ; mBA : 1000 mg
Tableau 19 : Capacité d'adsorption du
bioadsorbant MA vis-à-vis de BM en fonction du pH ;
ë max : 664 ; Ci : 50 mg/L ; T :
28#177;01 °C; pH : 3 ; V : 100 mL ; mBA : 200
mg
Annexe 2 : Résultats de l'adsorption du BM
sur le bioadsorbant en fonction du pH
|
Temps(min)
|
A
|
Cr (mg/L)
|
QAds(mg/g)
|
%Ads
|
|
1
|
0,23
|
14,38
|
17,81
|
71,25
|
|
3
|
0,179
|
11,19
|
19,41
|
77,63
|
|
5
|
0,145
|
9,06
|
20,47
|
81,88
|
|
10
|
0,111
|
6,94
|
21,53
|
86,13
|
|
20
|
0,102
|
6,38
|
21,81
|
87,25
|
|
30
|
0,092
|
5,75
|
22,13
|
88,50
|
|
60
|
0,085
|
5,31
|
22,34
|
89,38
|
|
90
|
0,083
|
5,19
|
22,41
|
89,63
|
|
120
|
0,079
|
4,94
|
22,53
|
90,13
|
|
150
|
0,073
|
4,56
|
22,72
|
90,88
|
|
180
|
0,067
|
4,19
|
22,91
|
91,63
|
|
210
|
0,063
|
3,94
|
23,03
|
92,13
|
|
240
|
0,06
|
3,75
|
23,13
|
92,50
|
|
270
|
0,06
|
3,75
|
23,13
|
92,50
|
|
300
|
0,06
|
3,75
|
23,13
|
92,50
|
|
330
|
0,06
|
3,75
|
23,13
|
92,50
|
|
360
|
0,06
|
3,75
|
23,13
|
92,50
|
|
390
|
0,06
|
3,75
|
23,13
|
92,50
|
|
420
|
0,06
|
3,75
|
23,13
|
92,50
|
|
450
|
0,06
|
3,75
|
23,13
|
92,50
|
Tableau 20 : Capacité d'adsorption du
bioadsorbant MA vis-à-vis de BM en fonction du pH ;
ë max : 662 ; Ci : 50 mg/L ; T :
28#177;01°C ; pH : 4 ; V : 100 mL ; mBA : 200
mg
|
Temps(min)
|
A
|
Cr (mg/L)
|
QAds(mg/g)
|
%Ads
|
|
1
|
0,272
|
17,00
|
16,50
|
66,00
|
|
3
|
0,199
|
12,44
|
18,78
|
75,13
|
|
5
|
0,163
|
10,19
|
19,91
|
79,63
|
|
10
|
0,127
|
7,94
|
21,03
|
84,13
|
|
20
|
0,105
|
6,56
|
21,72
|
86,88
|
|
30
|
0,082
|
5,13
|
22,44
|
89,75
|
|
60
|
0,077
|
4,81
|
22,59
|
90,38
|
|
90
|
0,074
|
4,63
|
22,69
|
90,75
|
|
120
|
0,069
|
4,31
|
22,84
|
91,38
|
|
150
|
0,066
|
4,13
|
22,94
|
91,75
|
|
180
|
0,065
|
4,06
|
22,97
|
91,88
|
|
210
|
0,063
|
3,94
|
23,03
|
92,13
|
|
240
|
0,06
|
3,75
|
23,13
|
92,50
|
|
270
|
0,06
|
3,75
|
23,13
|
92,50
|
|
300
|
0,047
|
2,94
|
23,53
|
94,13
|
|
330
|
0,047
|
2,94
|
23,53
|
94,13
|
|
360
|
0,047
|
2,94
|
23,53
|
94,13
|
|
390
|
0,047
|
2,94
|
23,53
|
94,13
|
|
420
|
0,047
|
2,94
|
23,53
|
94,13
|
|
450
|
0,047
|
2,94
|
23,53
|
94,13
|
Tableau 21 : Capacité d'adsorption du
bioadsorbant MA vis-à-vis de BM en fonction du pH ;
ë max : 664 ; Ci : 50 mg/L ; T :
28#177;01 °C ; pH : 5 ; V : 100 mL ; mBA : 200
mg
|
Temps(min)
|
A
|
Cr (mg/L)
|
QAds(mg/g)
|
%Ads
|
|
1
|
0,263
|
16,44
|
16,78
|
67,13
|
|
3
|
0,228
|
14,25
|
17,88
|
71,50
|
|
5
|
0,161
|
10,06
|
19,97
|
79,88
|
|
10
|
0,117
|
7,31
|
21,34
|
85,38
|
|
20
|
0,099
|
6,19
|
21,91
|
87,63
|
|
30
|
0,077
|
4,81
|
22,59
|
90,38
|
|
60
|
0,07
|
4,38
|
22,81
|
91,25
|
|
90
|
0,089
|
5,56
|
22,22
|
88,88
|
|
120
|
0,065
|
4,06
|
22,97
|
91,88
|
|
150
|
0,057
|
3,56
|
23,22
|
92,88
|
|
180
|
0,051
|
3,19
|
23,41
|
93,63
|
|
210
|
0,045
|
2,81
|
23,59
|
94,38
|
|
240
|
0,045
|
2,81
|
23,59
|
94,38
|
|
270
|
0,032
|
2,00
|
24,00
|
96,00
|
|
300
|
0,033
|
2,06
|
23,97
|
95,88
|
|
330
|
0,033
|
2,06
|
23,97
|
95,88
|
|
360
|
0,033
|
2,06
|
23,97
|
95,88
|
|
390
|
0,033
|
2,06
|
23,97
|
95,88
|
|
420
|
0,033
|
2,06
|
23,97
|
95,88
|
|
|
|
|
|
|
450
|
0,033
|
2,06
|
23,97
|
95,88
|
Tableau 22 : Capacité d'adsorption du
bioadsorbant MA vis-à-vis de BM en fonction du pH ;
ë max : 664 ; Ci : 50 mg/L ; T :
28#177;01 °C; pH : 8 ; V : 100 mL ; mBA : 200
mg
|
Temps(min)
|
A
|
Cr (mg/L)
|
QAds(mg/g)
|
%Ads
|
|
1
|
0,197
|
12,31
|
18,84
|
75,38
|
|
3
|
0,178
|
11,13
|
19,44
|
77,75
|
|
5
|
0,159
|
9,94
|
20,03
|
80,13
|
|
10
|
0,124
|
7,75
|
21,13
|
84,50
|
|
20
|
0,109
|
6,81
|
21,59
|
86,38
|
|
30
|
0,076
|
4,75
|
22,63
|
90,50
|
|
60
|
0,055
|
3,44
|
23,28
|
93,13
|
|
90
|
0,054
|
3,38
|
23,31
|
93,25
|
|
120
|
0,054
|
3,38
|
23,31
|
93,25
|
|
150
|
0,054
|
3,38
|
23,31
|
93,25
|
|
180
|
0,046
|
2,88
|
23,56
|
94,25
|
|
210
|
0,046
|
2,88
|
23,56
|
94,25
|
|
240
|
0,045
|
2,81
|
23,59
|
94,38
|
|
270
|
0,033
|
2,06
|
23,97
|
95,88
|
|
300
|
0,025
|
1,56
|
24,22
|
96,88
|
|
330
|
0,025
|
1,56
|
24,22
|
96,88
|
|
360
|
0,025
|
1,56
|
24,22
|
96,88
|
|
390
|
0,025
|
1,56
|
24,22
|
96,88
|
|
420
|
0,025
|
1,56
|
24,22
|
96,88
|
|
450
|
0,025
|
1,56
|
24,22
|
96,88
|
Tableau 23 : Capacité d'adsorption du
bioadsorbant MA vis-à-vis de BM en fonction du pH,
ë max : 662 ; Ci : 50 mg/L ; T :
28#177;01 ; pH : 10 ; V : 100 mL ; mBA : 200
mg
|
Temps(min)
|
A
|
Cr (mg/L)
|
QAds(mg/g)
|
%Ads
|
|
1
|
0,15
|
9,38
|
20,31
|
81,25
|
|
3
|
0,136
|
8,50
|
20,75
|
83,00
|
|
5
|
0,095
|
5,94
|
22,03
|
88,13
|
|
10
|
0,093
|
5,81
|
22,09
|
88,38
|
|
20
|
0,082
|
5,13
|
22,44
|
89,75
|
|
30
|
0,058
|
3,63
|
23,19
|
92,75
|
|
60
|
0,057
|
3,56
|
23,22
|
92,88
|
|
90
|
0,057
|
3,56
|
23,22
|
92,88
|
|
120
|
0,055
|
3,44
|
23,28
|
93,13
|
|
150
|
0,055
|
3,44
|
23,28
|
93,13
|
|
180
|
0,055
|
3,44
|
23,28
|
93,13
|
|
210
|
0,05
|
3,13
|
23,44
|
93,75
|
|
240
|
0,048
|
3,00
|
23,50
|
94,00
|
|
270
|
0,047
|
2,94
|
23,53
|
94,13
|
|
300
|
0,023
|
1,44
|
24,28
|
97,13
|
|
330
|
0,023
|
1,44
|
24,28
|
97,13
|
|
360
|
0,023
|
1,44
|
24,28
|
97,13
|
|
390
|
0,023
|
1,44
|
24,28
|
97,13
|
|
420
|
0,023
|
1,44
|
24,28
|
97,13
|
|
450
|
0,023
|
1,44
|
24,28
|
97,13
|
Tableau 24 : Capacité d'adsorption du
bioadsorbant MA vis-à-vis de BM en fonction du pH,
ë max : 662 ; Ci : 50 mg/L ; T :
28#177;01 ; pH : 12 ; V : 100 mL ; mBA : 200
mg
|
Temps(min)
|
A
|
Cr (mg/L)
|
QAds(mg/g)
|
%Ads
|
|
1
|
0,111
|
6,94
|
21,53
|
86,13
|
|
3
|
0,085
|
5,31
|
22,34
|
89,38
|
|
5
|
0,078
|
4,88
|
22,56
|
90,25
|
|
10
|
0,078
|
4,88
|
22,56
|
90,25
|
|
20
|
0,068
|
4,25
|
22,88
|
91,50
|
|
30
|
0,062
|
3,88
|
23,06
|
92,25
|
|
60
|
0,052
|
3,25
|
23,38
|
93,50
|
|
90
|
0,052
|
3,25
|
23,38
|
93,50
|
|
120
|
0,052
|
3,25
|
23,38
|
93,50
|
|
150
|
0,048
|
3,00
|
23,50
|
94,00
|
|
180
|
0,037
|
2,31
|
23,84
|
95,38
|
|
210
|
0,033
|
2,06
|
23,97
|
95,88
|
|
240
|
0,029
|
1,81
|
24,09
|
96,38
|
|
270
|
0,025
|
1,56
|
24,22
|
96,88
|
|
300
|
0,019
|
1,19
|
24,41
|
97,63
|
|
330
|
0,019
|
1,19
|
24,41
|
97,63
|
|
360
|
0,019
|
1,19
|
24,41
|
97,63
|
|
390
|
0,019
|
1,19
|
24,41
|
97,63
|
|
420
|
0,019
|
1,19
|
24,41
|
97,63
|
|
450
|
0,019
|
1,19
|
24,41
|
97,63
|
j
Tableau 25 : Capacité d'adsorption du
bioadsorbant MA vis-à-vis de BM en fonction de la Concentration
initiale ; ë max : 664 ; Ci : 10
mg/L ; T : 28#177;01 °C; pH : 6,69 ; V : 100 mL ;
mBA : 200 mg
Annexe 3 : Résultats de l'adsorption du BM
sur le bioadsorbant en fonction de la Concentration
|
Temps(min)
|
A
|
Cr (mg/L)
|
QAds(mg/g)
|
%Ads
|
|
1
|
0,075
|
4,69
|
22,66
|
90,63
|
|
3
|
0,073
|
4,56
|
22,72
|
90,88
|
|
5
|
0,039
|
2,44
|
23,78
|
95,13
|
|
10
|
0,037
|
2,31
|
23,84
|
95,38
|
|
20
|
0,036
|
2,25
|
23,88
|
95,50
|
|
30
|
0,034
|
2,13
|
23,94
|
95,75
|
|
60
|
0,033
|
2,06
|
23,97
|
95,88
|
|
90
|
0,029
|
1,81
|
24,09
|
96,38
|
|
120
|
0,028
|
1,75
|
24,13
|
96,50
|
|
150
|
0,025
|
1,56
|
24,22
|
96,88
|
|
180
|
0,025
|
1,56
|
24,22
|
96,88
|
|
210
|
0,023
|
1,44
|
24,28
|
97,13
|
|
240
|
0,021
|
1,31
|
24,34
|
97,38
|
|
270
|
0,019
|
1,19
|
24,41
|
97,63
|
|
300
|
0,016
|
1,00
|
24,50
|
98,00
|
|
330
|
0,016
|
1,00
|
24,50
|
98,00
|
|
360
|
0,016
|
1,00
|
24,50
|
98,00
|
|
390
|
0,016
|
1,00
|
24,50
|
98,00
|
|
420
|
0,016
|
1,00
|
24,50
|
98,00
|
|
450
|
0,016
|
1,00
|
24,50
|
98,00
|
Tableau 26 : Capacité d'adsorption du
bioadsorbant MA vis-à-vis de BM en fonction de la Concentration
initiale ; ë max : 664 ; Ci : 20
mg/L ; T : 28#177;01 °C ; pH : 6,69 ; V : 100 mL
; mBA : 200 mg
|
Temps(min)
|
A
|
Cr (mg/L)
|
QAds(mg/g)
|
%Ads
|
|
1
|
0,064
|
4,00
|
23,00
|
92,00
|
|
3
|
0,063
|
3,94
|
23,03
|
92,13
|
|
5
|
0,063
|
3,94
|
23,03
|
92,13
|
|
10
|
0,062
|
3,88
|
23,06
|
92,25
|
|
20
|
0,06
|
3,75
|
23,13
|
92,50
|
|
30
|
0,045
|
2,81
|
23,59
|
94,38
|
|
60
|
0,038
|
2,38
|
23,81
|
95,25
|
|
90
|
0,036
|
2,25
|
23,88
|
95,50
|
|
120
|
0,035
|
2,19
|
23,91
|
95,63
|
|
150
|
0,027
|
1,69
|
24,16
|
96,63
|
|
180
|
0,026
|
1,63
|
24,19
|
96,75
|
|
210
|
0,023
|
1,44
|
24,28
|
97,13
|
|
240
|
0,021
|
1,31
|
24,34
|
97,38
|
|
270
|
0,02
|
1,25
|
24,38
|
97,50
|
|
300
|
0,019
|
1,19
|
24,41
|
97,63
|
|
330
|
0,019
|
1,19
|
24,41
|
97,63
|
|
360
|
0,019
|
1,19
|
24,41
|
97,63
|
|
390
|
0,019
|
1,19
|
24,41
|
97,63
|
|
420
|
0,019
|
1,19
|
24,41
|
97,63
|
|
450
|
0,019
|
1,19
|
24,41
|
97,63
|
Tableau 27 : Capacité d'adsorption du
bioadsorbant MA vis-à-vis de BM en fonction de la Concentration
initiale ; ë max : 664 ; Ci : 40
mg/L ; T : 28#177;01 °C ; pH : 6,69 ; V : 100 mL
; mBA : 200 mg
|
Temps(min)
|
A
|
Cr (mg/L)
|
QAds(mg/g)
|
%Ads
|
|
1
|
0,26
|
16,25
|
16,88
|
67,50
|
|
3
|
0,174
|
10,88
|
19,56
|
78,25
|
|
5
|
0,158
|
9,88
|
20,06
|
80,25
|
|
10
|
0,153
|
9,56
|
20,22
|
80,88
|
|
20
|
0,106
|
6,63
|
21,69
|
86,75
|
|
30
|
0,088
|
5,50
|
22,25
|
89,00
|
|
60
|
0,079
|
4,94
|
22,53
|
90,13
|
|
90
|
0,079
|
4,94
|
22,53
|
90,13
|
|
120
|
0,075
|
4,69
|
22,66
|
90,63
|
|
150
|
0,071
|
4,44
|
22,78
|
91,13
|
|
180
|
0,07
|
4,38
|
22,81
|
91,25
|
|
210
|
0,069
|
4,31
|
22,84
|
91,38
|
|
240
|
0,065
|
4,06
|
22,97
|
91,88
|
|
270
|
0,064
|
4,00
|
23,00
|
92,00
|
|
300
|
0,065
|
4,06
|
22,97
|
91,88
|
|
330
|
0,065
|
4,06
|
22,97
|
91,88
|
|
360
|
0,048
|
3,00
|
23,50
|
94,00
|
|
390
|
0,048
|
3,00
|
23,50
|
94,00
|
|
420
|
0,048
|
3,00
|
23,50
|
94,00
|
|
450
|
0,048
|
3,00
|
23,50
|
94,00
|
Tableau 28 : Capacité d'adsorption du
bioadsorbant MA vis-à-vis de BM en fonction de la Concentration
initiale ; ë max : 664 ; Ci : 60
mg/L ; T : 28#177;01 °C ; pH : 6,69 ; V : 100 mL
; mBA : 200 mg
|
Temps(min)
|
A
|
Cr (mg/L)
|
QAds(mg/g)
|
%Ads
|
|
1
|
0,302
|
18,88
|
15,56
|
62,25
|
|
3
|
0,301
|
18,81
|
15,59
|
62,38
|
|
5
|
0,27
|
16,88
|
16,56
|
66,25
|
|
10
|
0,215
|
13,44
|
18,28
|
73,13
|
|
20
|
0,181
|
11,31
|
19,34
|
77,38
|
|
30
|
0,132
|
8,25
|
20,88
|
83,50
|
|
60
|
0,111
|
6,94
|
21,53
|
86,13
|
|
90
|
0,11
|
6,88
|
21,56
|
86,25
|
|
120
|
0,108
|
6,75
|
21,63
|
86,50
|
|
150
|
0,105
|
6,56
|
21,72
|
86,88
|
|
180
|
0,098
|
6,13
|
21,94
|
87,75
|
|
210
|
0,087
|
5,44
|
22,28
|
89,13
|
|
240
|
0,08
|
5,00
|
22,50
|
90,00
|
|
270
|
0,075
|
4,69
|
22,66
|
90,63
|
|
300
|
0,063
|
3,94
|
23,03
|
92,13
|
|
330
|
0,061
|
3,81
|
23,09
|
92,38
|
|
360
|
0,059
|
3,69
|
23,16
|
92,63
|
|
390
|
0,059
|
3,69
|
23,16
|
92,63
|
|
420
|
0,059
|
3,69
|
23,16
|
92,63
|
|
450
|
0,059
|
3,69
|
23,16
|
92,63
|
Tableau 29 : Capacité d'adsorption du
bioadsorbant MA vis-à-vis de BM en fonction de la Concentration
initiale ; ë max : 664 ; Ci : 80
mg/L ; T : 28#177;01 °C; pH : 6,69 ; V : 100 mL ;
mBA : 200 mg
|
Temps(min)
|
A
|
Cr (mg/L)
|
QAds(mg/g)
|
%Ads
|
|
1
|
0,436
|
27,25
|
11,38
|
45,50
|
|
3
|
0,414
|
25,88
|
12,06
|
48,25
|
|
5
|
0,374
|
23,38
|
13,31
|
53,25
|
|
10
|
0,298
|
18,63
|
15,69
|
62,75
|
|
20
|
0,246
|
15,38
|
17,31
|
69,25
|
|
30
|
0,175
|
10,94
|
19,53
|
78,13
|
|
60
|
0,146
|
9,13
|
20,44
|
81,75
|
|
90
|
0,146
|
9,13
|
20,44
|
81,75
|
|
120
|
0,134
|
8,38
|
20,81
|
83,25
|
|
150
|
0,132
|
8,25
|
20,88
|
83,50
|
|
180
|
0,132
|
8,25
|
20,88
|
83,50
|
|
210
|
0,122
|
7,63
|
21,19
|
84,75
|
|
240
|
0,122
|
7,63
|
21,19
|
84,75
|
|
270
|
0,119
|
7,44
|
21,28
|
85,13
|
|
300
|
0,117
|
7,31
|
21,34
|
85,38
|
|
330
|
0,117
|
7,31
|
21,34
|
85,38
|
|
360
|
0,117
|
7,31
|
21,34
|
85,38
|
|
390
|
0,117
|
7,31
|
21,34
|
85,38
|
|
420
|
0,117
|
7,31
|
21,34
|
85,38
|
|
450
|
0,117
|
7,31
|
21,34
|
85,38
|
Tableau 30 : Capacité d'adsorption du
bioadsorbant MA vis-à-vis de BM en fonction de la Concentration
initiale ; ë max : 664 ; Ci : 100
mg/L ; T : 28#177;01 °C ; pH : 6,69 ; V : 100 mL
; mBA : 200 mg
|
Temps(min)
|
A
|
Cr (mg/L)
|
QAds(mg/g)
|
%Ads
|
|
1
|
0,593
|
37,06
|
6,47
|
25,88
|
|
3
|
0,441
|
27,56
|
11,22
|
44,88
|
|
5
|
0,41
|
25,63
|
12,19
|
48,75
|
|
10
|
0,378
|
23,63
|
13,19
|
52,75
|
|
20
|
0,248
|
15,50
|
17,25
|
69,00
|
|
30
|
0,247
|
15,44
|
17,28
|
69,13
|
|
60
|
0,244
|
15,25
|
17,38
|
69,50
|
|
90
|
0,199
|
12,44
|
18,78
|
75,13
|
|
120
|
0,181
|
11,31
|
19,34
|
77,38
|
|
150
|
0,148
|
9,25
|
20,38
|
81,50
|
|
180
|
0,143
|
8,94
|
20,53
|
82,13
|
|
210
|
0,144
|
9,00
|
20,50
|
82,00
|
|
240
|
0,139
|
8,69
|
20,66
|
82,63
|
|
270
|
0,134
|
8,38
|
20,81
|
83,25
|
|
300
|
0,132
|
8,25
|
20,88
|
83,50
|
|
330
|
0,132
|
8,25
|
20,88
|
83,50
|
|
360
|
0,132
|
8,25
|
20,88
|
83,50
|
|
390
|
0,132
|
8,25
|
20,88
|
83,50
|
|
420
|
0,132
|
8,25
|
20,88
|
83,50
|
|
450
|
0,132
|
8,25
|
20,88
|
83,50
|
Annexe 4 : Résultats de la
Modélisation de l'adsorption du BM sur les bioadsorbants MA
Tableau 31 : Capacité d'adsorption du
bioadsorbant MA vis-à-vis de BM en fonction de la Concentration
initiale ; ë max : 664 ; Ci : 50
mg/L ; T : 28#177;01 °C; pH : 3 ; V : 100 mL ;
mBA : 200 mg
|
Ci
|
A
|
Cr (mg/L)
|
QAds(mg/g)
|
1/Cr
|
1/Q
|
lnCe
|
lnQe
|
|
1
|
0,004
|
0,25
|
0,38
|
4,00
|
2,67
|
-1,39
|
-0,98
|
|
5
|
0,006
|
0,38
|
2,31
|
2,67
|
0,43
|
-0,98
|
0,84
|
|
10
|
0,01
|
0,63
|
4,69
|
1,60
|
0,21
|
-0,47
|
1,54
|
|
20
|
0,019
|
1,19
|
9,41
|
0,84
|
0,11
|
0,17
|
2,24
|
|
30
|
0,027
|
1,69
|
14,16
|
0,59
|
0,07
|
0,52
|
2,65
|
|
40
|
0,035
|
2,19
|
18,91
|
0,46
|
0,05
|
0,78
|
2,94
|
|
50
|
0,042
|
2,63
|
23,69
|
0,38
|
0,04
|
0,97
|
3,16
|
|
60
|
0,051
|
3,19
|
28,41
|
0,31
|
0,04
|
1,16
|
3,35
|
|
70
|
0,061
|
3,81
|
33,09
|
0,26
|
0,03
|
1,34
|
3,50
|
|
80
|
0,071
|
4,44
|
37,78
|
0,23
|
0,03
|
1,49
|
3,63
|
|
90
|
0,077
|
4,81
|
42,59
|
0,21
|
0,02
|
1,57
|
3,75
|
|
100
|
0,085
|
5,31
|
47,34
|
0,19
|
0,02
|
1,67
|
3,86
|
Tableau 32 : Capacité d'adsorption du
bioadsorbant MA vis-à-vis de BM en fonction de la Concentration
initiale, ë max : 662 ; Ci : 50 mg/L ;
T : 28#177;01 ; pH : 4 ; V : 100 mL ; mBA : 200
mg
|
Ci
|
A
|
Cr (mg/L)
|
QAds(mg/g)
|
1/Cr
|
1/Q
|
lnCe
|
lnQe
|
|
1
|
0,005
|
0,31
|
0,34
|
3,20
|
2,91
|
-1,16
|
-1,07
|
|
5
|
0,006
|
0,38
|
2,31
|
2,67
|
0,43
|
-0,98
|
0,84
|
|
10
|
0,008
|
0,50
|
4,75
|
2,00
|
0,21
|
-0,69
|
1,56
|
|
20
|
0,015
|
0,94
|
9,53
|
1,07
|
0,10
|
-0,06
|
2,25
|
|
30
|
0,022
|
1,38
|
14,31
|
0,73
|
0,07
|
0,32
|
2,66
|
|
40
|
0,029
|
1,81
|
19,09
|
0,55
|
0,05
|
0,59
|
2,95
|
|
50
|
0,037
|
2,31
|
23,84
|
0,43
|
0,04
|
0,84
|
3,17
|
|
60
|
0,045
|
2,81
|
28,59
|
0,36
|
0,03
|
1,03
|
3,35
|
|
70
|
0,051
|
3,19
|
33,41
|
0,31
|
0,03
|
1,16
|
3,51
|
|
80
|
0,059
|
3,69
|
38,16
|
0,27
|
0,03
|
1,30
|
3,64
|
|
90
|
0,067
|
4,19
|
42,91
|
0,24
|
0,02
|
1,43
|
3,76
|
|
100
|
0,074
|
4,63
|
47,69
|
0,22
|
0,02
|
1,53
|
3,86
|
Tableau 33 : Capacité d'adsorption du
bioadsorbant MA vis-à-vis de BM en fonction de la Concentration
initiale, ë max : 664 ; Ci : 50 mg/L ;
T : 28#177;01 ; pH : 5 ; V : 100 mL ; mBA : 200
mg
|
Ci
|
A
|
Cr (mg/L)
|
QAds(mg/g)
|
1/Cr
|
1/Q
|
lnCe
|
lnQe
|
|
1
|
0,003
|
0,19
|
0,41
|
5,33
|
2,46
|
-1,67
|
-0,90
|
|
5
|
0,006
|
0,38
|
2,31
|
2,67
|
0,43
|
-0,98
|
0,84
|
|
10
|
0,009
|
0,56
|
4,72
|
1,78
|
0,21
|
-0,58
|
1,55
|
|
20
|
0,016
|
1,00
|
9,50
|
1,00
|
0,11
|
0,00
|
2,25
|
|
30
|
0,024
|
1,50
|
14,25
|
0,67
|
0,07
|
0,41
|
2,66
|
|
40
|
0,033
|
2,06
|
18,97
|
0,48
|
0,05
|
0,72
|
2,94
|
|
50
|
0,041
|
2,56
|
23,72
|
0,39
|
0,04
|
0,94
|
3,17
|
|
60
|
0,049
|
3,06
|
28,47
|
0,33
|
0,04
|
1,12
|
3,35
|
|
70
|
0,057
|
3,56
|
33,22
|
0,28
|
0,03
|
1,27
|
3,50
|
|
80
|
0,064
|
4,00
|
38,00
|
0,25
|
0,03
|
1,39
|
3,64
|
|
90
|
0,072
|
4,50
|
42,75
|
0,22
|
0,02
|
1,50
|
3,76
|
|
100
|
0,08
|
5,00
|
47,50
|
0,20
|
0,02
|
1,61
|
3,86
|
Tableau 34 : Capacité d'adsorption du
bioadsorbant MA vis-à-vis de BM en fonction de la Concentration
initiale, ë max : 664 ; Ci : 50 mg/L ;
T : 28#177;01 ; pH : 6 ; V : 100 mL ; mBA : 200
mg
|
Ci
|
A
|
Cr(mg/L)
|
QAds(mg/g)
|
1/Cr
|
1/Q
|
lnCe
|
lnQe
|
|
1
|
0,003
|
0,19
|
0,41
|
5,33
|
2,46
|
-1,67
|
-0,90
|
|
5
|
0,007
|
0,44
|
2,28
|
2,29
|
0,44
|
-0,83
|
0,82
|
|
10
|
0,01
|
0,63
|
4,69
|
1,60
|
0,21
|
-0,47
|
1,54
|
|
20
|
0,019
|
1,19
|
9,41
|
0,84
|
0,11
|
0,17
|
2,24
|
|
30
|
0,03
|
1,88
|
14,06
|
0,53
|
0,07
|
0,63
|
2,64
|
|
40
|
0,04
|
2,50
|
18,75
|
0,40
|
0,05
|
0,92
|
2,93
|
|
50
|
0,049
|
3,06
|
23,47
|
0,33
|
0,04
|
1,12
|
3,16
|
|
60
|
0,059
|
3,69
|
28,16
|
0,27
|
0,04
|
1,30
|
3,34
|
|
70
|
0,069
|
4,31
|
32,84
|
0,23
|
0,03
|
1,46
|
3,49
|
|
80
|
0,079
|
4,94
|
37,53
|
0,20
|
0,03
|
1,60
|
3,63
|
|
90
|
0,09
|
5,63
|
42,19
|
0,18
|
0,02
|
1,73
|
3,74
|
|
100
|
0,099
|
6,19
|
46,91
|
0,16
|
0,02
|
1,82
|
3,85
|
Tableau 35 : Capacité d'adsorption du
bioadsorbant MA vis-à-vis de BM en fonction de la Concentration
initiale, ë max : 664 ; Ci : 50 mg/L ;
T : 28#177;01 ; pH : 8 ; V : 100 mL ; mBA : 200
mg
|
Ci
|
A
|
Cr (mg/L)
|
QAds(mg/g)
|
1/Cr
|
1/Q
|
lnCe
|
lnQe
|
|
1
|
0,003
|
0,19
|
0,41
|
5,33
|
2,46
|
-1,67
|
-0,90
|
|
5
|
0,005
|
0,31
|
2,34
|
3,20
|
0,43
|
-1,16
|
0,85
|
|
10
|
0,01
|
0,63
|
4,69
|
1,60
|
0,21
|
-0,47
|
1,54
|
|
20
|
0,016
|
1,00
|
9,50
|
1,00
|
0,11
|
0,00
|
2,25
|
|
30
|
0,023
|
1,44
|
14,28
|
0,70
|
0,07
|
0,36
|
2,66
|
|
40
|
0,03
|
1,88
|
19,06
|
0,53
|
0,05
|
0,63
|
2,95
|
|
50
|
0,038
|
2,38
|
23,81
|
0,42
|
0,04
|
0,86
|
3,17
|
|
60
|
0,045
|
2,81
|
28,59
|
0,36
|
0,03
|
1,03
|
3,35
|
|
70
|
0,053
|
3,31
|
33,34
|
0,30
|
0,03
|
1,20
|
3,51
|
|
80
|
0,061
|
3,81
|
38,09
|
0,26
|
0,03
|
1,34
|
3,64
|
|
90
|
0,068
|
4,25
|
42,88
|
0,24
|
0,02
|
1,45
|
3,76
|
|
100
|
0,075
|
4,69
|
47,66
|
0,21
|
0,02
|
1,54
|
3,86
|
Tableau 36 : Capacité d'adsorption du
bioadsorbant MA vis-à-vis de BM en fonction de la Concentration
initiale, ë max : 662 ; Ci : 50 mg/L ;
T : 28#177;01 ; pH : 10 ; V : 100 mL ; mBA : 200
mg
|
Ci
|
A
|
Cr (mg/L)
|
QAds(mg/g)
|
1/Cr
|
1/Q
|
lnCe
|
lnQe
|
|
1
|
0,002
|
0,13
|
0,44
|
8,00
|
2,29
|
-2,08
|
-0,83
|
|
5
|
0,005
|
0,31
|
2,34
|
3,20
|
0,43
|
-1,16
|
0,85
|
|
10
|
0,008
|
0,50
|
4,75
|
2,00
|
0,21
|
-0,69
|
1,56
|
|
20
|
0,015
|
0,94
|
9,53
|
1,07
|
0,10
|
-0,06
|
2,25
|
|
30
|
0,021
|
1,31
|
14,34
|
0,76
|
0,07
|
0,27
|
2,66
|
|
40
|
0,029
|
1,81
|
19,09
|
0,55
|
0,05
|
0,59
|
2,95
|
|
50
|
0,036
|
2,25
|
23,88
|
0,44
|
0,04
|
0,81
|
3,17
|
|
60
|
0,044
|
2,75
|
28,63
|
0,36
|
0,03
|
1,01
|
3,35
|
|
70
|
0,051
|
3,19
|
33,41
|
0,31
|
0,03
|
1,16
|
3,51
|
|
80
|
0,058
|
3,63
|
38,19
|
0,28
|
0,03
|
1,29
|
3,64
|
|
90
|
0,066
|
4,13
|
42,94
|
0,24
|
0,02
|
1,42
|
3,76
|
|
100
|
0,072
|
4,50
|
47,75
|
0,22
|
0,02
|
1,50
|
3,87
|
Tableau 37 : Capacité d'adsorption du
bioadsorbant MA vis-à-vis de BM en fonction de la Concentration
initiale, ë max : 662 ; Ci : 50 mg/L ;
T : 28#177;01 ; pH : 12 ; V : 100 mL ; mBA : 200
mg
|
Ci
|
A
|
Cr(mg/L)
|
QAds(mg/g)
|
1/Cr
|
1/Q
|
lnCe
|
lnQe
|
|
1
|
0,002
|
0,13
|
0,44
|
8,00
|
2,29
|
-2,08
|
-0,83
|
|
5
|
0,002
|
0,13
|
2,44
|
8,00
|
0,41
|
-2,08
|
0,89
|
|
10
|
0,004
|
0,25
|
4,88
|
4,00
|
0,21
|
-1,39
|
1,58
|
|
20
|
0,007
|
0,44
|
9,78
|
2,29
|
0,10
|
-0,83
|
2,28
|
|
30
|
0,015
|
0,94
|
14,53
|
1,07
|
0,07
|
-0,06
|
2,68
|
|
40
|
0,022
|
1,38
|
19,31
|
0,73
|
0,05
|
0,32
|
2,96
|
|
50
|
0,029
|
1,81
|
24,09
|
0,55
|
0,04
|
0,59
|
3,18
|
|
60
|
0,037
|
2,31
|
28,84
|
0,43
|
0,03
|
0,84
|
3,36
|
|
70
|
0,043
|
2,69
|
33,66
|
0,37
|
0,03
|
0,99
|
3,52
|
|
80
|
0,051
|
3,19
|
38,41
|
0,31
|
0,03
|
1,16
|
3,65
|
|
90
|
0,059
|
3,69
|
43,16
|
0,27
|
0,02
|
1,30
|
3,76
|
|
100
|
0,065
|
4,06
|
47,97
|
0,25
|
0,02
|
1,40
|
3,87
|
|
|



