|

N° d'ordre : 07
UNIVERSITE CHEIKH ANTA DIOP DE DAKAR
INSTITUT UNIVERSITAIRE DE PECHE ET
d'AQUACULTURE
(IUPA)
MEMOIRE DE MASTER II
ECOLOGIE ET GESTION DES ECOSYSTEMES
AQUATIQUES
Présenté par
Oumar SADIO
Soutenu le 30 mai 2012 devant la commission d'examen :
Président : Mr. Omar Thiom THIAW
Professeur Titulaire (U.C.A.D)
Membres : MM. Youssouph DIATTA Chercheur
(IFAN/U.C.A.D)
Malick DIOUF Maître-assistant (IUPA/U.C.A.D)
Jean-Marc
ECOUTIN Chercheur (LEMAR/IRD)
Alassane SARR Assistant (IUPA/U.C.A.D)
i
DEDICACE
Je dédie ce travail à :
> Mes très chers parents ;
> Ma femme Ndèye Rose Mané et mes enfants
Mamadou, Siré et Ibrahima ;
> Mes frères Malang, Omar, Assane, Ousseynou et
Souleymane
> Mes soeurs Khady, Ouly, Mariama, Gnima, Bintou, Astou et
Moussou
> Mes cousins Yancouba Diatta, Ibrahima Sadio et Ainsa
Diatta
> Mes collègues de l'IRD au Sénégal
ii
REMERCIEMENTS
Je remercie très sincèrement Monsieur Jean-Marc
ECOUTIN, chercheur à l'IRD, co-encadrant de ce travail, pour
l'opportunité qu'il m'a offerte de suivre ce Master et de traiter ce
sujet, pour sa disponibilité et pour les corrections qu'il a bien voulu
apporter à ce travail.
Un grand merci à Monsieur Malick DIOUF, directeur des
études à l'IUPA, pour avoir accepté de co-encadrer ce
travail.
Je remercie profondément Monsieur Omar Thiom THIAW,
directeur de l'IUPA, pour avoir accepté mon inscription à ce
Master II, Monsieur Alassane SARR, professeur à l'IUPA et responsable de
ce MASTER II, et Monsieur Youssou Diatta, chercheur à l'IFAN.
Je tiens aussi à remercier l'ensemble des chercheurs de
l'unité de recherches RAP de l'IRD (2001-2010) à savoir Raymond
LAE (son ex-directeur), Jean-Jacques ALBARET, Luis Tito de Morais, Monique
SIMIER, Jacques PANFILI, Guy VIDY et Jean-Dominique DURAND. Ce sont les membres
de l'équipe scientifique de l'IRD avec qui j'ai débuté mon
apprentissage de la recherche.
Mes remerciements vont à l'endroit de Mme Ndombour
Gning CISSE, Monsieur Jean Pierre Yvon FALL et tous les autres professeurs de
l'IUPA pour les enseignements riches qu'ils nous ont dispensés, pour
leurs encouragements et leurs conseils.
Je remercie aussi Monsieur Jean RAFFRAY, technicien
français de l'UMR LEMAR, Monsieur Ibrahima SOW, ingénieur
acousticien, pour ses conseils et ses encouragements, Gaspard BERTRAND,
volontaire international, Timothée BROCHIER, post-doctorant et les
techniciens et pêcheurs du LEMAR de Dakar.
Enfin, je remercie Mme KEBE secrétaire à l'IUPA
pour sa disponibilité, sa compréhension et son sens de
l'écoute, sans oublier l'ensemble du personnel administratif de
l'IUPA.
iii
Avant-propos
Ce travail entre dans le cadre des programmes
développés par l'équipe de l'Institut de Recherche pour le
Développement (IRD) appartenant à l'UMR 195 LEMAR
(CNRS/IRD/UBO/Ifremer). Cette étude s'inscrit dans le cadre du programme
de recherche sur les Aires Marines Protégées (AMP) au
Sénégal et, en particulier, celle de Bamboung dans le
Sine-Saloum.
Il s'inscrit dans le cadre du projet AMPhore (AMP et gestion
Halieutique par Optimisation des Ressources et des Ecosystèmes)
financé par l'ANR (Agence Nationale de Recherche) et achevé en
2011.
iv
Sommaire
DEDICACE i
REMERCIEMENTS ii
Avant-propos iii
Sommaire iv
Liste des figures v
Liste des tableaux vi
Liste des Sigles et Acronymes vii
1. INTRODUCTION 1
1.1. L'origine des Aires Marines Protégées (AMP)
1
1.2. La notion d'effet réserve 2
1.3. Les objectifs de l'étude 3
2. MATERIEL ET METHODES 4
2.1. Présentation de l'estuaire du Sine-Saloum 4
2.2. AMP de Bamboung 6
2.3. Le bolon de Sangako 6
2.4. Stratégie d'échantillonnage 7
2.5. Méthodes d'analyse des données 9
3. RESULTATS 16
3.1. Etude comparative des paramètres physico-chimiques
16
3.2. Etude comparative des indicateurs bioécologiques
22
3.3. Etude comparative des peuplements de poissons des deux
sites 25
4. DISCUSSION 42
4.1. Environnement aquatique 42
4.2. Les indicateurs bioécologiques 43
4.3. Répartition spatiale des peuplements de poissons
48
5. CONCLUSION ET PERSPECTIVES 51
REFERENCE BIBLIOGRAPHIQUE 53
ANNEXE 58
v
Liste des figures
Figure 1 : Situation géographique et
carte du delta du Sine-Saloum (Sénégal). Localisation
des deux sites d'étude et position des stations
.5
Figure 2 : Les grandes catégories
écologiques dans les peuplements de poissons estuariens
d'Afrique de l'Ouest (d'après Albaret, 1999)
14
Figure 3 : Variabilité spatiale des
paramètres physico-chimiques pour l'ensemble des relevés
hydrologiques réalisés dans les deux sites .19
Figure 4 : Variabilité des
paramètres physico-chimiques dans les deux sites d'étude 20
Figure 5 : Analyse en composantes principales
des paramètres physico-chimiques pour
l'ensemble des relevés hydrologiques
réalisés dans chaque site 21
Figure 6 :
Analyse en composante principales des paramètres physico-chimiques
pour
l'ensemble des 66 relevés hydrologiques
réalisés dans les deux sites 23
Figure 7:
Variabilité spatiale des indicateurs biologiques (abondance, biomasse,
richesse,
niveau trophique moyen, taille moyenne et taille maximale)
..25
Figure 8 : Analyse factorielle des correspondances
simples des tableaux relevés - espèces et
relevés - stations de chaque site d'étude
30
Figure 9 : AFC de l'ensemble des peuplements de poissons
de l'AMP de Bamboung (B) et
du bolon de Sangako (S) .31
Figure 10 : AFC - AMP de Bamboung et Bolon de
Sangako 32
Figure 11: Répartition en
catégories écologiques et par site du nombre d'espèces (en
%) dans
les deux sites d'étude .33
Figure 12 :
Analyse factorielle des correspondances simples des catégories
écologiques (en
abondance) de chaque site d'étude 35
Figure 13
: Analyse factorielle des correspondances simples des
catégories écologiques de
l'ensemble des deux sites d'étude 36
Figure 14
: Répartition en groupes trophiques et par site des biomasses
(en %) dans l'AMP de
Bamboung (BBG) et le bolon de Sangako (SAN) 37
Figure
15 : Analyse factorielle des correspondances simples des
catégories trophiques de
chaque site d'étude 38
Figure 16 :
Analyse factorielle des correspondances simples des catégories
trophiques de
l'ensemble des deux sites d'étude 39
Figure 17
: Distribution des fréquences de taille par site. (Tm = taille
moyenne observée et
TMO = taille maximale observée) 40
Figure 18 : Ajustement par moindre carré
du modèle linéaire au spectre de taille ....41
Liste des tableaux
Tableau I : Caractéristiques des stations
d'échantillonnage dans l'AMP de Bamboung (5) et
dans le bolon de Sangako (6) .7
Tableau II : Les six campagnes
d'échantillonnage réalisées pour la période
2008-2009 8
Tableau III : Caractéristiques des
paramètres physico-chimiques dans l'AMP de
Bamboung ..17
Tableau IV :
Caractéristiques des paramètres physico-chimiques dans le bolon
de
Sangako .17
Tableau V : Pourcentage
d'abondance et de biomasse pour chaque espèce par site, avec la famille,
l'espèce, le code espèce, la catégorie écologique
et la catégorie
trophique ..28
Tableau VI : Richesse,
abondance (en nombre ha-') et biomasse (en kg ha-')
par
|
catégorie écologique pour les deux sites 34
Tableau VII : Richesse, abondance (en nombre
ha-') et biomasse (en kg ha-') par catégorie
|
|
trophique pour les deux sites d'étude
|
37
|
|
Tableau VIII : Résultats de l'ajustement
par moindres-carrés des modèles linéaires aux
spectres de taille
|
.41
|
|
Tableau IX : Synthèse et pertinence des
paramètres physico-chimiques
|
..42
|
|
Tableau X : Synthèse et pertinence des
indicateurs bioécologiques
|
44
|
|
vi
|
vii
Liste des Sigles et Acronymes
ACP : Analyse en Composantes Principales
ACPn : Analyse en Composantes Principales normées
AFC : Analyse Factorielle des Correspondances simples
AMPc : Aire Marine Protégée communautaire
ANR : Agence Nationale de la Recherche
CNRS : Centre national de Recherche Scientifique
CRODT: Centre de Recherche Océanographique de Dakar
Thiaroye
IFREMER : Institut français de recherche pour
l'exploitation de la Mer
IRD : Institut de Recherche pour le Développement
ISRA : Institut Sénégalais de Recherche
Agricole
IUPA : Institut Universitaire des Pêches et
d'Aquaculture
LEMAR : Laboratoire des Sciences de l'Environnement Marin
UBO : Université de Bretagne Occidentale
UICN : Union Internationale pour la Conservation de la
Nature
UMR : Unité Mixte de Recherche
1
1. INTRODUCTION
1.1. L'origine des Aires Marines Protégées
(AMP)
Dès la fin du 19ème siècle,
certains Etats décidèrent, à travers la création
des premiers Parcs Nationaux, d'appliquer une protection intégrale de la
faune et de la flore sur des espaces remarquables de leur territoire (Cazalet,
2004).
L'augmentation globale de la pression de pêche
combinée à l'effondrement récent de nombreuses
pêcheries ont amené les écologistes marins et gestionnaires
de l'environnement à réévaluer les méthodes
traditionnelles de gestion des ressources. C'est ainsi que les réserves
marines sont devenues des zones d'interdiction de tout type d'extraction
d'organismes. Elles sont rapidement considérées comme une
alternative aux options de gestion traditionnelle (Halpern et al., 2002). Dans
un premier temps, les réserves marines ont été
créées comme des outils de conservation de l'environnement. Elles
étaient souvent liées soit à l'existence d'un biotope
spécifique, soit à la conservation d'une espèce
emblématique tant animale que végétale. Face à la
généralisation de la surexploitation halieutique, des zones
marines de plus en plus grandes, interdites partiellement ou
complètement à l'exploitation, ont été mises en
place avec l'espoir de reconstituer les stocks halieutiques. Les AMP sont
nées des grands engagements internationaux de protection de
l'environnement à savoir la conférence des nations unies sur
l'environnement et le développement tenue en juin 1992 à Rio de
Janeiro (Brésil) et le sommet de la terre de Johannesburg (Afrique du
Sud) en 2002. Elles font partie des nouvelles stratégies de gestion
durable des milieux marins et de leur biodiversité. L'union
Internationale pour la Conservation de la Nature (UICN) a défini en
2005, une AMP comme « Tout espace intertidal ou infra tidal ainsi que ses
eaux sus-jacentes, sa flore, sa faune et ses ressources historiques et
culturelles que la loi ou d'autres moyens efficaces ont mis en réserve
pour protéger en tout ou en partie le milieu ainsi
délimité» (Kelleher, 1999). L'UICN a recensé 6
catégories d'aires protégées avec un niveau de
conservation qui varie des réserves intégrales (zones de petite
ou de grande taille dans lesquelles les activités d'extraction humaines
ou leur impact significatif ne sont pas autorisés) aux AMP à
usages multiples (dans lesquelles les activités humaines sont
autorisées et réglementées) (Kelleher, 1999). L'AMP de
Bamboung est créée par décret présidentiel en 2004
et toute activité d'extraction d'organismes de tout type y est interdite
sauf les pêches expérimentales saisonnières pour des
besoins de suivi scientifique. C'est un site «à vocation
démonstrative» retenu en concertation avec les pêcheurs
artisans. Le choix du site de Bamboung est particulièrement pertinent,
d'un
2
point de vue bioécologique. Il concerne, en effet, une
zone d'estuaire à mangrove réputée pour sa
productivité mais aussi pour certaines fonctions essentielles au
maintien des populations et des peuplements de poissons, estuariens mais aussi
côtiers, dont l'importance économique et sociale est
considérable (Albaret, 2004).
1.2. La notion d'effet réserve
L'étude des effets attendus des AMP sur les
écosystèmes et sur les stocks (regroupés sous la notion
d'effets biologiques des AMP) nécessite de faire la distinction entre
deux grands types de zone de protection en fonction principalement des
objectifs, de la taille et du degré de protection : les réserves
intégrales et les aires multi-usages (Kelleher, 1999). La
création d'une AMP n'est pas sans effet sur les peuplements de poissons
et sur leurs habitats. Bell (1983) a défini l'effet réserve comme
étant l'ensemble des conséquences positives des mesures de
protection sur les peuplements benthiques. Sur le plan écologique,
l'effet réserve englobe plusieurs modifications des
caractéristiques structurelles et fonctionnelles du milieu, qui peuvent
être regroupées en trois catégories : les
bénéfices provoqués dans l'AMP, les effets
bénéfiques provoqués à l'extérieur de l'AMP
et les effets négatifs de l'AMP. En ce qui concerne les réserves
intégrales, les effets peuvent se produire à l'intérieur
de leurs frontières (McClanahan et al., 1999 ; Mosquera et al., 2000 ;
Gell et Roberts, 2003 ; Westera et al., 2003 ; Evans et Russ, 2004 ; Stobart et
al., 2009) comme à l'extérieur de leurs frontières
(Schroeder et Love, 2002 ; Graham et al., 2003 ; Halpern, 2003 ; Stobart et
al., 2009). D'après Gell et Roberts (2003), les meilleurs
résultats sont obtenus lorsque la zone protégée est de
l'ordre de 10 à 35% des zones exploitées. L'effet réserve
possède une composante spatiale (effet refuge) et une composante
temporelle (effet tampon). La composante spatiale représente les
différences qui peuvent exister entre secteurs protégés et
non protégés (Francour, 2000). L'effet refuge consiste à
une variation de l'abondance, une augmentation de la biodiversité, de la
taille moyenne des organismes et de la richesse spécifique. La variation
de l'abondance des organismes est surtout étudiée sur les
peuplements de poissons et se traduit par une augmentation ou une diminution
significative de l'abondance relative globale (nombre total d'individus
appartenant à toutes les espèces) de poissons dans l'AMP (Stobart
et al., 2009 ; Edgar et Barett, 1999 ; Evans et Russ, 2004 ; McClanahan et al.,
1999 ; Halpern, 2003 ; Harmelin-Vivien et al., 2008 ; Garcia-Charton et al.,
2004 ; Westera et al., 2003). L'augmentation de la biodiversité se
traduit par le retour de certaines espèces qui avaient disparu de la
zone sous les diverses pressions anthropiques (Francour, 2000 ;
Côté et al., 2001 ; Halpern, 2003 ; Lester et al., 2009). La
création d'une
3
AMP peut entrainer une réhabilitation de structure de
taille (Edgar et Barret, 1999 ; Rowe, 2002 ; Jouvenel et Pollard, 2001 ; Willis
et al., 2003 ; Halpern, 2003 ; Gell et Roberts, 2003 ; Floeter et al., 2006).
En effet, la pêche entraine la disparition des individus de grande
taille. Il reste alors dans le milieu des individus de plus en plus petits. La
mise en place d'une AMP, qui entraîne la réduction de la pression
de pêche, autorise donc une espérance de vie plus
élevée des espèces cibles. Ce qui se traduit globalement
par une augmentation des tailles moyennes et maximales (Mosquera et al., 2000).
Le troisième effet est l'effet cascade qui se traduit par une diminution
de l'abondance de certaines espèces suite à un
phénomène de prédation accrue (Pinnergar et al., 2000 ;
Westera et al., 2003). Le quatrième effet réserve est l'effet
« modification des comportements ». La mise en AMP d'une zone
maritime permet de préserver les zones de nurseries, les habitats des
espèces et ainsi sauvegarder les lieux d'implantation des larves, le
recrutement, l'alimentation et la reproduction des espèces. Elle permet
aussi à la faune marine de se réinstaller dans son habitat
originel, sans risque de prédation humaine (Château et Wantiez,
2005 ; Chiapone et Sealey, 2000 ; Gell et Roberts, 2003 ; Jones et al., 2007 ;
Yemane et al., 2008).
Les effets bénéfiques provoqués à
l'extérieur de l'AMP sont communément appelés effet de
débordement ou effet « spillover » (Russ et al, 2003 ; Stobart
et al., 2009). Il s'agit de l'émigration d'adultes et de
juvéniles de poissons. Pour le premier effet, la création d'une
AMP entraîne une augmentation de l'abondance des individus au sein des
réserves qui se retrouvent assez rapidement confrontés à
des compétitions inter et intra-spécifique sévères
(Russ et al., 2003). Ce phénomène favorise l'émigration
des adultes et des juvéniles vers les zones non protégées
(Alcala et Russ, 1990). Les effets négatifs d'une AMP sont
l'augmentation de la pression de pêche sur les zones voisines de l'AMP et
les effets nuisibles dus aux usages de non exploitation (Kellner et al.,
2007).
1.3. Les objectifs de l'étude
L'objectif principal de la présente étude est de
comparer le peuplement de poisson de l'AMP de Bamboung soumis à une
protection et celui du bolon de Sangako non protégé. Le but
visé est d'identifier le rôle de l'AMP de Bamboung dans
l'écosystème du Sine-Saloum. Dans un premier temps, nous allons
comparer les caractéristiques physico-chimiques des deux sites
d'étude. La deuxième partie sera consacrée à la
comparaison d'indicateurs bioécologiques entre les deux sites. Enfin,
dans la troisième partie, nous comparerons la distribution,
l'organisation, la structuration des peuplements de poissons entre l'AMP de
Bamboung et le bolon de Sangako.
4
2. MATERIEL ET METHODES
Cette étude concerne deux sites situés dans
l'estuaire du Sine-Saloum : le bolon de Bamboung qui correspond à l'AMP
et le bolon de Sangako qui est un site ouvert à la pêche. Ces deux
bolons sont des affluents du Diomboss, un des trois principaux bras du
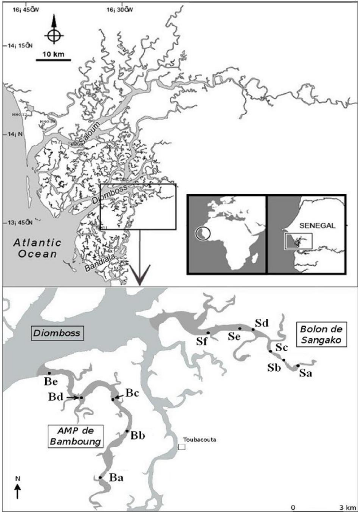
Sine-Saloum (Fig. 1).
2.1. Présentation de l'estuaire du
Sine-Saloum
L'estuaire du Sine-Saloum draine un bassin versant de 29 720
km2 dont le relief est en général plat et la pente
très faible. La superficie en eau est de 90 000 ha. La marée
monte deux fois par jour jusqu'en amont de Kaolack situé à 112 km
de l'embouchure (Bousso, 1996).
La situation environnementale du Sine-Saloum est très
particulière : il s'agit d'un estuaire sursalé dont le gradient
halin est inversé en permanence (croissant de l'embouchure vers
l'amont). Les parties situées en extrême amont du fleuve Saloum
atteignent des salinités de plus de 70 au delà de Foundiougne. La
salinité peut atteindre des valeurs de 130 en amont de Kaolack, soit
près de 4 fois la salinité moyenne de l'eau de mer. Cette
situation environnementale est susceptible d'évoluer plus ou moins
rapidement en fonction des tendances climatiques à moyen terme. Le
complexe du Sine-Saloum est constitué de trois bras principaux : le
Saloum au nord et nord-est, le Bandiala au sud-ouest et le Diomboss entre les
deux (Fig. 1). Il est caractérisé par un système complexe
et diffus de canaux appelés bolons et de mangroves
caractéristiques des zones humides saumâtres intertropicales
(Albaret, 2004).
5
Figure 1 : Situation géographique et
carte du delta du Sine-Saloum (Sénégal). Localisation des deux
sites d'étude et position des stations.
6
2.2. AMP de Bamboung
Le bolon de Bamboung (13°50 N - 16°33 W) est un
affluent du Diomboss situé dans l'estuaire du Sine-Saloum, à 130
km au sud-est de Dakar (Fig. 1). Les eaux sont peu profondes et la
biodiversité y est réputée importante, notamment pour les
oiseaux, les poissons et les mammifères marins (dauphins et lamantins)
(Albaret et al., 2005).
L'AMP de Bamboung, située au coeur de la réserve
de Biosphère du delta du Saloum, a une superficie de 6 800 ha. Elle est
divisée en 3 zones. La première est une zone terrestre, qui se
décompose en une zone de mangrove et une zone continentale. La mangrove
est localisée en bordure des rives de toute la zone de l'AMP de
Bamboung. Elle couvre plus de la moitié de la surface totale de l'AMP.
La végétation y est abondante et composée de
différentes espèces de palétuviers. Rhyzophora
racemosa et Rhyzophora harrisonii sont trouvés en bordure
des chenaux. À l'arrière, Rhizophora mangle est beaucoup
plus abondant et occupe les terres élevées susceptibles
d'être immergées lors des hautes marées. Cette
espèce forme le peuplement le plus important du bolon, tandis
qu'Avicennia africana se développe dans la partie
supérieure des vasières. Les palétuviers étant
à la fois source de matière organique et support d'une forte
production de périphyton, constituent un vivier pour la faune
estuarienne, les juvéniles principalement. La zone continentale est
représentée par l'île Coco. Cette zone de savane
arborée occupe 15 à 20 % de la surface de l'AMP. La
deuxième zone est une zone tampon localisée à l'embouchure
du bolon, au niveau de la rencontre des eaux du Diomboss et du Bamboung. C'est
une zone de transition. La troisième zone qui est l'aire marine
centrale, constituée par le bolon de Bamboung et ses ramifications, a
une longueur de 15 km à partir du confluent avec le Diomboss jusqu'aux
vasières de la forêt de Kolé. Sa superficie est d'environ
300 ha. La largeur maximale est d'environ 500 mètres alors que la
profondeur fluctue entre 0 et 15 m (Albaret et al., 2005) (Fig. 1). La zone
centrale est à 17 km de l'embouchure du Diomboss.
2.3. Le bolon de Sangako
Le bolon de Sangako est situé dans l'estuaire du
Sine-Saloum. C'est un affluent du Diomboss situé en amont de celui-ci.
Son embouchure est large d'environ 270 m (Fig. 1). Les profondeurs varient de 0
et 14 m. D'une superficie d'environ 378 ha, le bolon de Sangako s'étend
sur environ 11 km de son embouchure (jonction avec le Diomboss) jusqu'à
la vasière de la forêt de Sandikoli. On note la présence de
mangrove dense sur les deux rives, avec de petites ramifications et des
îlots de mangrove très dense. Cette végétation de
mangrove est
7
composée d'espèces de palétuviers comme dans
l'AMP de Bamboung. L'espèce dominante reste toujours Rhizophora
mangle. L'accès à ce bolon est libre et des activités
humaines comme la pêche et la récolte des fruits de mer y sont
pratiquées régulièrement.
2.4. Stratégie d'échantillonnage
Les méthodes, les techniques, les protocoles et la nature
des informations biologiques utilisés dans cette étude sont les
mêmes pour l'AMP de Bamboung et le bolon de Sangako.
2.4.1. Plan d'échantillonnage spatial
Cinq stations sont échantillonnées dans l'AMP de
Bamboung contre 6 stations dans le bolon de Sangakao (Tab. I).
Tableau I : Les 11 stations
d'échantillonnage sélectionnées dans l'AMP de Bamboung (5)
et le bolon de Sangako (6).
|
Site
|
Station
|
Latitude
|
Longitude
|
Profondeur
(m)
|
|
AMP
de Bamboung
|
Ba
|
13°46'30' N
|
16°31'27' W
|
4.5#177;0.8
|
|
Bb
|
13°47'87' N
|
16°30'29' W
|
4.8#177;0.8
|
|
Bc
|
13°48'95' N
|
16°30'79' W
|
6.8#177;1.1
|
|
Bd
|
13°49'12' N
|
16°31'70' W
|
7.0#177;1.6
|
|
Be
|
13°49'94' N
|
16°32'95' W
|
4.8#177;1.0
|
|
Bolon
de Sangako
|
Sa
|
13°50'06' N
|
16°24'48' W
|
2.8#177;0.9
|
|
Sb
|
13°50'25' N
|
16°25'07' W
|
2.9#177;1.1
|
|
Sc
|
13°50'55' N
|
16°25'20' W
|
3.2#177;1.1
|
|
Sd
|
13°51'18' N
|
16°26'20' W
|
4.2#177;2.9
|
|
Se
|
13°51'20' N
|
16°26'54' W
|
4.0#177;1.0
|
|
Sf
|
13°51'10' N
|
16°27'59' W
|
5.4#177;0.6
|
2.4.1.1. L'AMP de Bamboung
Une zonation écologique a été
préalablement établie lors d'une mission préliminaire
effectuée en décembre 2002 (Albaret et al., 2005). Sur la base de
cette étude préliminaire, 12 stations d'échantillonnage
représentant divers types de biotopes rencontrés dans le bolon de
Bamboung ont été sélectionnés pour un suivi
biologique dans la période allant de 2003 à 2007 (Albaret et al.,
2005 ; Tito de Morais et al., 2007). A partir de 2008, un nouveau protocole
d'échantillonnage a été mis en place pour comparer les
peuplements de l'AMP de Bamboung à ceux de l'extérieur de l'AMP.
Pour optimiser le temps d'échantillonnage compte tenu des nouvelles
stations du site de Sangako, la stratification spatiale dans l'AMP a
évolué de 12
8
stations à 5. Le choix des 5 stations
d'échantillonnage a été effectué suivant les
critères de proximité, de richesse, d'abondance et de biomasse.
Les stations AMP01, AMP03, AMP05, AMP08, AMP10 ont ainsi été
retenues. Dans le souci de faire de bonnes représentations graphiques,
les stations de l'AMP de Bamboung sont codées de l'amont vers l'aval
comme suit : AMP01=Ba, AMP03=Bb, AMP05=Bc, AMP08=Bd, AMP10=Be. La distance
moyenne entre station est de 3 km. (Tab. 1 et Fig. 1).
2.4.1.2. Le bolon de Sangako
Une zonation écologique a été
établie lors d'une mission préliminaire effectuée en
octobre 2007. Cette zonation ainsi que l'accessibilité des lieux et la
possibilité d'y effectuer des pêches à la senne tournante
dans de bonnes conditions ont permis de choisir six stations le long du bolon
de Sangako (Fig. 1 et Tab. 1). Comme pour l'AMP de Bamboung, les stations du
bolon de Sangako sont codées de l'amont vers l'aval comme suit :
SAN06=Sa, SAN05=Sb, SAN04=Sc, SAN03=Sd, SAN02=Se et SAN01=Sf. La distance
moyenne entre les stations est de 1.7 km.
2.4.2. Plan d'échantillonnage temporel
Le plan d'échantillonnage temporel a respecté la
stratégie temporelle de l'étude de 2003-2007 (Albaret et al.,
2005 ; Tito de Morais et al., 2007) à savoir des campagnes de
pêche réalisées aux trois grandes saisons hydroclimatiques
de la région : mars (fin de saison sèche fraiche), juin (fin de
saison sèche chaude) et octobre (fin de saison humide). Le calendrier
des campagnes est présenté au tableau II.
Tableau II : Les six campagnes
d'échantillonnage réalisées dans l'AMP de Bamboung et
dans le bolon de Sangako pour la période 2008-2009.
|
Campagne
|
Date
|
Début
|
Fin
|
|
16
|
mars-08
|
31/03/2008
|
02/04/2008
|
|
17
|
juin-08
|
10/06/2008
|
12/06/2008
|
|
18
|
oct-08
|
13/10/2008
|
15/10/2008
|
|
19
|
avr-09
|
07/04/2009
|
09/04/2008
|
|
20
|
juin-09
|
09/06/2009
|
11/06/2009
|
|
21
|
oct-09
|
06/10/2009
|
08/10/2009
|
2.4.3. Technique d'échantillonnage
Les pêches d'échantillonnage sont
réalisées à la senne tournante coulissante (longueur 250
m, hauteur 20 m, maille de côté 14 mm). La pêche
scientifique à la senne tournante est une méthode qui permet
d'avoir une bonne reproductibilité de l'échantillonnage dans
des
9
milieux très variés et une récolte de
matériel biologique en bon état. Utilisée sans recherche
de bancs de poissons, et avec, à chaque fois, la même
équipe de pêcheurs et le même mode opératoire, la
senne tournante coulissante permet de considérer un coup de pêche
comme une unité d'effort stable, autorisant la comparaison directe entre
les coups dans un même site ou dans deux sites différents.
L'équipe de pêche est composée de 8 à 9
pêcheurs formés à l'échantillonnage scientifique.
L'équipe scientifique est composée de 1 chercheur, 3 techniciens
supérieurs (ISRA et IRD) et un stagiaire. Les moyens navigants
consistent en un catamaran de recherche, le Diassanga, à la fois
laboratoire flottant et base de vie, d'une coque en résine de 7 m
propulsée par un moteur hors-bord de 40 chevaux (à partir de
laquelle la senne est manoeuvrée) et d'une annexe (15 CV) pour les
déplacements rapides.
2.4.4. Les paramètres physico-chimiques
Les relevés effectués sont : la profondeur
(mesurée au moyen d'un sondeur à main et du sondeur du bord), la
force du courant (estimée puis contrôlée au moyen d'un
fluxmètre), la salinité (mesurée au
réfractomètre de précision 1 unité de
salinité), la teneur en oxygène dissous et la température
(mesurée à la sonde multiparamètre) et la transparence (ou
turbidité) mesurée par la profondeur de disparition du disque de
Secchi (diamètre 30 cm). Salinité, teneur en oxygène,
conductivité et température sont mesurées en surface et au
fond. Les études environnementales effectuées dans l'estuaire du
Sine-Saloum ont toujours montré une très forte corrélation
et une faible différence entre les valeurs des paramètres
mesurés en surface et au fond (Simier et al., 2004 ; Albaret et al.,
2005). Par conséquent, on peut considérer qu'il n'y a pas de
stratification verticale pour la salinité, la température et la
teneur en oxygène dissous. Seules les valeurs de surface seront
utilisées dans les analyses.
2.5. Méthodes d'analyse des données
L'ensemble des données traitées dans ce travail
proviennent de deux sites proches, à savoir l'AMP de Bamboung et le
bolon de Sangako. Le coup de pêche est l'unité d'effort de
pêche. Un coup de pêche représente 0,005 km2,
soit 0,5 ha. Le taux d'échappement de la senne tournante est de 50%
(Charles-Dominique, 1989). Les indicateurs biologiques (abondance, biomasse,
taille moyenne et taille maximale) et les indicateurs dont le calcul en
dérive (indices synthétiques, le niveau trophique) ont
été calculés en tenant compte du taux d'échappement
et sont ramenés à l'hectare. La taille des séries de
données obtenues est égale à 30 observations pour l'AMP de
Bamboung et 36 observations pour le bolon de Sangako.
Ceci correspondant au nombre de stations par site (5 ou 6
stations) multiplié par le nombre de campagnes par années (3
campagnes) et multiplié par le nombre d'années d'étude (2
années).
2.5.1. Les paramètres physico-chimiques
Les données de l'environnement ont fait l'objet d'une
étude descriptive et d'une analyse multivariée (l'Analyse en
Composante principale Normée (ACPn)). L'analyse en composante principale
normée a été réalisée sur les variables
environnementales pour chaque site d'étude puis pour l'ensemble des deux
sites. Les variables prises en compte sont la transparence, la salinité,
la température, la teneur en oxygène dissous et la profondeur.
L'ACPn permet de déterminer les ressemblances entre les
individus statistiques (les relevés environnementaux) à partir
des liaisons entre les variables (paramètres physico-chimiques). Les
données ont été centrées et réduites en
raison de la différence d'unité de mesure des variables
étudiées.
Le pourcentage de saturation en oxygène n'a pas
été mesuré lors de la campagne d'octobre 2008 faute de
matériel (la sonde multiparamètre n'était pas disponible).
Les valeurs de l'oxygène de surface et de fond sont des valeurs
manquantes pour cette période dans toutes les stations. Ces
données manquantes ont été remplacées par la
moyenne annuelle du pourcentage de saturation en oxygène de 2008 dans
chaque site dans les analyses statistiques.
2.5.2. Les indicateurs bioécologiques
La différence entre les deux sites est
étudiée à l'échelle de leur peuplement de poissons.
Un indicateur biologique ou marqueur biologique est un paramètre
mesurable présent dans un système biologique.
? Les indices globaux
L'abondance (ou effectif) est par définition le nombre
d'individus. La densité (abondance à l'hectare) est
calculée en sommant d'abord les abondances des 30 coups de pêche
dans l'AMP de Bamboung et des 36 coups de pêche dans le bolon de Sangako.
Cette somme est divisée par le nombre de coups de pêche pour avoir
une abondance moyenne. L'abondance moyenne est multipliée par le facteur
4 pour avoir la densité à l'hectare. Le facteur multiplicatif 4
s'explique par le fait que le coefficient d'échappement de la senne
tournante est de 50% et que la superficie de la senne tournante est de 0.5
ha.
10
où A est la densité, Ai est l'abondance par coup de
pêche et x, le nombre de coups de pêche.
La biomasse est l'ensemble de la matière organique.
C'est la masse des organismes vivants présents dans un milieu
donné. La biomasse à l'hectare est calculée selon la
même procédure que la densité.
11
où B est la biomasse, Bi est la biomasse par coup de
pêche et x, le nombre de coups de pêche.
La richesse spécifique (S) désigne le nombre
d'espèces présentes dans l'espace considéré. Une
richesse spécifique peut s'exprimer en richesse totale ou en richesse
moyenne. La richesse totale correspond au nombre total d'espèces
présentes dans un biotope ou une station donnée. La richesse
moyenne correspond au nombre moyen d'espèces présentes dans les
échantillons d'un peuplement étudié.
Le niveau trophique moyen (NTm) dans chaque site
est calculé par la formule suivante (McClanahan and Mangi, 2004):

où NTmk est le niveau trophique moyen du
site k, bik la biomasse de l'espèce i du site k, NTi le
niveau trophique de l'espèce i et bik, la biomasse totale du site k.
La taille maximale est obtenue par tri des tailles de poissons
débarqués à chaque coup de pêche.
TMO = Max (Ti Ti+1, Ti+2, Ti+3, Ti+4, Tn)
où Ti est la
taille de l'individu i et n, le nombre total d'individus pesés. La
taille moyenne est calculée selon la formule suivante :
Tm = ?ti / n,
où ti est la taille de chaque individu i
et n, le nombre total d'individus mesurés.
? Les indices synthétiques
Le calcul d'indices synthétiques permet de mesurer le
degré d'organisation des communautés et la qualité de
cette organisation (Legendre et Legendre, 1984). La diversité peut
être mesurée par différents indices comme l'indice de
Shannon, l'indice de Simpson et l'équitabilité. L'indice de
Shannon est le plus utilisé et avait déjà
été choisi pour d'autres études sur les peuplements de
l'estuaire du Sine-Saloum (Diouf, 1996) ou sur ceux spécifiques à
Bamboung (Albaret et al., 2005).
12
L'indice de diversité de Shannon (H') est un indice qui
permet de décrire la structure d'une communauté. Par
définition, il n'a pas de sens lorsque le nombre d'espèce est de
1. Une espèce très peu abondante n'aura pas un impact majeur sur
la diversité de l'écosystème ; inversement, une
espèce très abondante et représentant presque 100% du
peuplement aura un impact en diminuant l'indice de diversité de
Shannon.
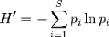
où H' est l'indice de diversité de Shannon, i
une espèce et pi, la proportion de l'espèce i
par rapport au nombre total d'espèces (S) dans le milieu
d'étude (ou richesse spécifique du milieu), qui se calcule de la
façon suivante : p(i) = ni /
N
où ni est le nombre d'individus pour
l'espèce i et N, l'effectif total (les individus de toutes les
espèces).
L'indice de diversité de Shannon varie de 0 (une seule
espèce) à ln(S) (toutes les espèces ont la même
abondance). L'utilisation de l'indice de Shannon présente un
inconvénient : les valeurs prises par H' dépendent à la
fois de la richesse et de la répartition des effectifs entre les
différentes espèces.
Indice de diversité de Simpson 1-D : il correspond
à la probabilité que deux individus prélevés
aléatoirement dans la communauté appartiennent à des
espèces différentes. Il s'agit d'un indice
hétérogène qui prend en compte
l'équitabilité de la répartition des espèces ainsi
que la richesse spécifique et se calcule par la formule suivante :

où Pi est la proportion de l'espèce
i et s, le nombre total d'espèces.
Equitabilité de Simpson E1-D : Cette mesure
résulte de la décomposition de l'indice de diversité de
Simpson, en divisant l'indice de Simpson par (1-1/S), S étant la
richesse spécifique. Cet indice permet de s'affranchir de la richesse
spécifique, et ainsi n'étudier que la distribution des
différentes espèces les unes par rapport aux autres. L'indice
d'équitabilité permet de mesurer la répartition des
individus au sein des espèces, indépendamment de la richesse
spécifique. Il mesure la régularité avec laquelle les
individus sont répartis entre les taxons présents.
L'équitabilité est comprise entre 0 et 1 : elle est proche de 0
quand la quasi-totalité des effectifs est concentrée sur une
seule espèce (dominance d'une des espèces); elle est proche de 1
lorsque toutes les espèces ont la même abondance
(équirépartition des
13
individus dans les espèces). On parle de
régularité complète lorsque l'indice
d'équitabilité est égal à 1.
Tous les indicateurs ont fait l'objet d'une analyse
descriptive suivie d'une analyse de comparaison en utilisant le test non
paramétrique de Wilcoxon. Les traitements statistiques et les graphiques
ont été réalisés avec le logiciel R disponible en
accès libre sur le web à l'adresse suivante :
http://cran.r-project.org/ et la librairie ade4 pour les analyses
multivariées (Thioulouse et al, 1997). Certains graphiques sont
tracés à l'aide du logiciel Excel.
2.5.3. Composition et répartition spatiale des
peuplements de poissons
Les peuplements de poissons des deux sites ont fait l'objet
d'une analyse descriptive. L'étude de leur organisation spatiale a
été réalisée par une Analyse Factorielle des
Correspondances (AFC) qui est une méthode couramment utilisée en
écologie pour le traitement de tableaux espèces-relevés.
Elle a pour but de décrire de manière globale les peuplements et
leur organisation. Elle permet d'établir des associations ou des
oppositions entre lignes (les stations) et colonnes (les espèces) d'un
tableau d'abondances faunistiques et de définir ainsi des groupes
d'espèces caractéristiques de certaines zones. Les données
ont été transformées en log(x+1) afin de stabiliser les
variances qui peuvent être importantes pour des espèces
pêchées en bancs de nombreux individus. Une première
Analyse Factorielle des Correspondances sur l'ensemble des 51 espèces de
l'AMP de Bamboung a mis en évidence la particularité de la
station Bc caractérisée par un peuplement dominé par la
seule espèce Alectis alexandrinus. Cette espèce a
été supprimée du fichier pour réaliser une nouvelle
AFC. En écologie numérique, les espèces rares sont souvent
supprimées des peuplements dans les analyses multivariées (Field
et al., 1982). Une troisième analyse factorielle des correspondances
simples a été réalisée sur l'ensemble des
espèces communes aux deux sites.
2.5.4. Structure écologique
Les espèces observées au niveau des deux sites
d'étude appartiennent à 6 des 9 catégories
écologiques définies par Albaret (1999) à savoir les
estuariennes d'origine continentale (Ec), les estuariennes
strictes (Es), les estuariennes d'origine marine
(Em), les marines-estuariennes (ME), les
marines accessoires (Ma) et les marines occasionnelles
(Mo) (Fig. 2).
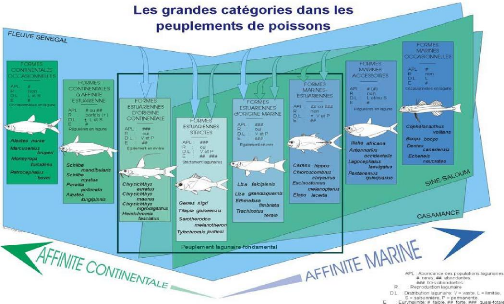
14
Figure 2 : Les grandes catégories
écologiques dans les peuplements de poissons estuariens d'Afrique de
l'Ouest (d'après Albaret, 1999).
Les estuariennes d'origine continentale : ce groupe est
composé d'espèces d'origine continentale (eau douce) parfaitement
adaptées aux milieux saumâtres où elles sont
représentées par des populations abondantes et permanentes. La
reproduction a lieu en estuaire ou en lagune mais est également possible
dans les eaux douces des fleuves et des lacs où elles sont aussi
présentes (Diouf, 1996).
Les estuariennes strictes : ce sont des espèces
présentes exclusivement en milieu lagunaire ou estuarien où se
déroule la totalité de leur cycle biologique.
Les estuariennes d'origine marine : ce sont des espèces
caractéristiques des milieux saumâtres où elles constituent
un groupe très important tant par leur abondance que par leur biomasse
(Diouf, 1996). Il s'agit d'espèces d'origine marine parfaitement
adaptées aux conditions estuariennes. Elles se reproduisent en estuaire
mais également en mer pour certaines espèces.
Les marines estuariennes : ce sont des espèces marines
ayant une large répartition spatio-temporelle dans les milieux
estuariens et lagunaires. Elles sont représentées par des
populations permanentes et abondantes où les écophases
juvéniles sont souvent dominantes voir exclusives (Diouf, 1996).
15
Les marines accessoires : les espèces de cette
catégorie sont régulièrement capturées dans les
milieux estuariens et lagunaires mais elles sont rarement très
abondantes. Leur présence est limitée dans l'espace (à la
zone sous influence directe de l'océan).
Les marines occasionnelles : c'est un groupe d'espèces
rares, voire exceptionnelles, et uniquement localisées à
proximité immédiate de l'embouchure (Diouf, 1996).
2.5.5. Structure trophique
En fonction de leur régime alimentaire, les
espèces sont groupées en catégories trophiques. Sept
catégories trophiques sont identifiées au cours des 6 campagnes
de pêches expérimentales : les herbivores détritivores ou
brouteurs (he-de), les herbivores à prédominance
phytoplanctonophage ou microphytophage (he-ph), les
prédateurs de premier niveau à prédominance benthophage :
mollusques, vers (p1-bt), les prédateurs de premier
niveau généralistes : crustacés, insectes
(p1-mc), les zooplanctonophagies dominantes (p1-zo),
les prédateurs de deuxième niveau
généraliste : poisson et autres proies (p2-ge)
et les prédateurs de deuxième niveau à
prédominance piscivore (p2-pi). Une seule espèce
(Remora remora) n'est pas encore classée.
2.5.6. Structure de taille
Il s'agit de la distribution des fréquences de taille,
de la longueur moyenne et de la longueur maximale. Les mesures
réalisées sur les individus pêchés ont permis de
tracer des structures de taille permettant d'observer l'évolution de la
taille des peuplements sur la durée de l'étude dans les deux
sites et ainsi observer les différences entre les deux sites.
Les individus sont groupés en classes de taille de 1
cm. Le nombre d'individus capturés par classe de taille est obtenu en
multipliant le nombre d'individus mesurés de chaque espèce par le
coefficient d'extrapolation. Le coefficient d'extrapolation est le rapport
entre le nombre d'individus mesurés et le nombre d'individus
capturés par espèce. Il est égal à 1 si tous les
individus capturés ont été mesurés. Il est
inférieur à 1 si le nombre d'individus mesurés est
inférieur au nombre d'individus capturés.
Les structures de taille sont rapportées au coup de
pêche, et l'engin de pêche est le même à savoir la
senne tournante coulissante. Les courbes des deux sites sont alors comparables.
Il en est de même pour la droite d'ajustement issue de leur spectre de
taille. Les profils de composition en tailles ont été
linéarisés afin de comparer leur pente et leur ordonnée
à l'origine.
16
3. RESULTATS
3.1. Etude comparative des paramètres
physico-chimiques
Dans ce paragraphe nous avons étudié
l'homogénéité des stations à l'intérieur de
chaque site et celle de l'ensemble des stations des deux sites. L'ACP a permis
de caractériser les stations dans chaque site puis les sites en fonction
des paramètres physico-chimiques.
3.1.1. Description et comparaison des paramètres
physico-chimiques
Les résultats de la description des paramètres
physico-chimiques réalisée dans chaque station au niveau de
chaque site sont consignés dans les tableaux III et IV pour les 6
campagnes de pêche expérimentale. Les paramètres
mesurés sont : la profondeur de pêche (m), la transparence (m), la
salinité, la température (°C), la teneur en oxygène
dissous (en %). Les tableaux III et IV présentent les
caractéristiques d'ensemble des paramètres physico-chimiques :
moyenne, écart type, coefficient de variation, minimum, maximum et
médiane.
Tableau III : Caractéristiques des
paramètres physico-chimiques sur l'ensemble des 30 relevés dans
l'AMP de Bamboung.
|
Site
|
AMP de Bamboung
|
|
Paramètre
|
Salinité
|
Transparence
|
Température
|
Oxygène
|
Profondeur
|
|
Moyenne #177; Ecart-type
|
37.9#177;7.0
|
2.1#177;0.6
|
28.8#177;2.0
|
75.5#177;8.6
|
5.6#177;1.5
|
|
Coefficient de variation
|
18.4
|
27.3
|
6.9
|
9.9
|
27.3
|
|
Minimum
|
25.0
|
1.1
|
24.7
|
56.4
|
3.2
|
|
Maximum
|
47.0
|
3.1
|
31.6
|
88.6
|
8.6
|
|
Médiane
|
40.5
|
2.0
|
29.0
|
76.2
|
5.4
|
Tableau IV : Caractéristiques des
paramètres physico-chimiques sur l'ensemble des 36 relevés dans
le bolon de Sangako.
|
Site
|
Bolon de Sangako
|
|
Paramètre
|
Salinité
|
Transparence
|
Température
|
Oxygène
|
Profondeur
|
|
Moyenne #177; Ecart-type
|
38.6#177;9.3
|
1.9#177;0.4
|
29.2#177;2.3
|
70.4#177;9.4
|
3.8#177;1.7
|
|
Coefficient de variation
|
24.1
|
20.5
|
7.8
|
13.0
|
43.7
|
|
Minimum
|
22.0
|
1.2
|
24.9
|
48.3
|
1.8
|
|
Maximum
|
50.0
|
2.7
|
33.2
|
88.7
|
10.0
|
|
Médiane
|
43.0
|
2.0
|
29.3
|
74.7
|
3.4
|
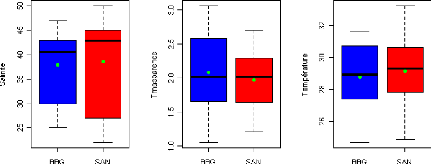
La salinité varie entre 25 et 47 dans l'AMP de Bamboung
avec une moyenne de 37.9#177;7.0 alors dans le bolon de Sangako le minimum est
égal à 22 et le maximum à 50 avec une moyenne de
38.6#177;9.3 (tableau III et IV). On constate une diminution de la
salinité de
17
l'amont vers l'aval dans les deux sites (Fig. 3). Les
résultats du test de comparaison non paramétrique de Wilcoxon
montrent une différence non significative entre l'AMP de Bamboung et le
bolon de Sangako (W = 464.5, p-value = 0.333).
La transparence est peu stable d'une station à l'autre
dans les deux sites (Fig. 3). La différence entre la valeur maximale et
minimale est de 2 m avec une moyenne de 2.1#177;0.6 m dans l'AMP de Bamboung.
Dans le bolon de Sangako, la transparence moyenne est de 1.9#177;0.4 m avec un
écart de 1.5 m entre le maximum (2.7 m) et le minimum (1.2). La
transparence ne varie pas en fonction des sites (W = 595, p-value = 0.483).
La température oscille entre 24.7°C et 31.6°C
dans l'AMP de Bamboung et entre 24.9°C et 33.2°C dans le bolon de
Sangako. La température baisse légèrement d'amont en aval
avec une moyenne de 28.8#177;2.0°C dans l'AMP de Bamboung. Dans le bolon
de Sangako la tendance est à la stabilité d'amont en aval avec
une moyenne de 29.2#177;2.3°C. La variabilité spatiale de la
température est plus importante au niveau des stations extrêmes
dans l'AMP de Bamboung alors que dans le bolon de Sangako la variabilité
est plus importante dans les stations aval (Fig. 3). Suivant le test Wilcoxon,
la température est la même dans les deux sites (W = 488, p-value =
0.507).
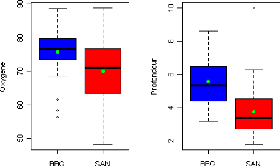
Le pourcentage de saturation en oxygène dissous varie
entre 56.4% et 88.6% dans l'AMP de Bamboung et entre 48.3% et 88.7% dans le
bolon de Sangako. Les variations sont plus importantes au niveau les stations
extrêmes dans l'AMP de Bamboung et au niveau des stations les plus en
amont dans le bolon de Sangako (Fig. 3). La teneur moyenne en oxygène
dissous est égale à 75.5#177;8.6% dans l'AMP de Bamboung et
à 70.4#177;9.4% dans le bolon de Sangako. Aux vues des résultats
du test de Wilcoxon (W = 681, p-value = 0.069), la teneur en oxygène
dissous est la même dans les deux sites.
Dans l'AMP de Bamboung, les stations situées vers le
centre sont les plus profondes. Les faibles profondeurs sont notées dans
la partie amont. La profondeur diminue d'aval en amont dans le bolon de
Sangako. La profondeur moyenne de l'AMP Bamboung (5.6#177;1.5 m) est
différente de celle du bolon de Sangako (3.4#177;1.7 m). Les
résultats du test de comparaison de Wilcoxon montrent une
différence significative de la profondeur en faveur de l'AMP Bamboung
(W=713, p-value=0.000).
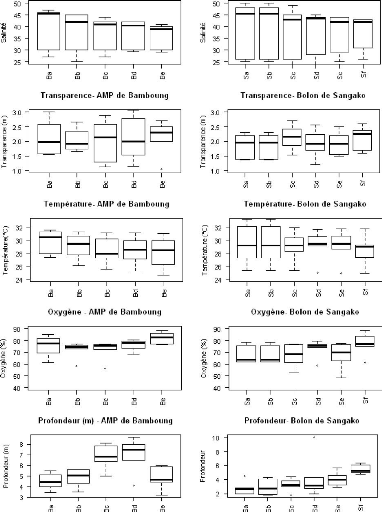
18
Figure 3 : Variabilité spatiale des
paramètres physico-chimiques pour l'ensemble des relevés
hydrologiques réalisés dans les deux sites.
19
Figure 4 : Variabilité des
paramètres physico-chimiques (salinité, transparence,
température, teneur en oxygène dissous et profondeur). Les points
verts représentent les moyennes.
3.1.2. Variabilité intra-site des paramètres
physico-chimiques
L'histogramme des valeurs propres (Fig. 5a et 5d)
suggère de retenir les deux premiers axes qui expliquent respectivement
45.0% et 22.2% de l'inertie totale du nuage des points pour l'AMP de Bamboung
et 47.8% et 24.0% de l'inertie totale du nuage des points pour le bolon de
Sangako.
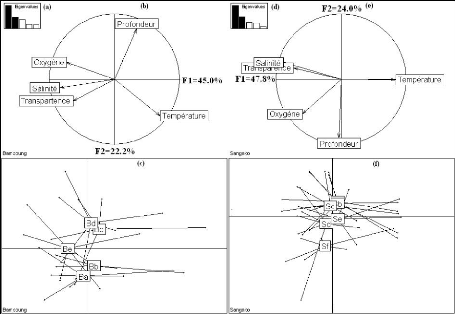
20
Figure 5 : Analyse en composantes principales
des paramètres physico-chimiques pour l'ensemble des relevés
hydrologiques réalisés dans l'AMP de Bamboung et le bolon de
Sangako. (a) et (d) : diagramme des valeurs propres ; (b) et (e) : cercle de
corrélation ; (c) et (f) : plan factoriel 1-2.
L'AMP de Bamboung
Trois groupes de variables, caractéristiques de trois
types de masses d'eau, sont ainsi mis en évidence : la
température qui s'oppose à l'oxygène, à la
salinité et à la transparence sur l'axe 1 et l'oxygène qui
s'oppose à la fois à la salinité et à la
transparence sur l'axe 2. La profondeur, située dans la partie positive
de l'axe 2 est fortement corrélée à celui-ci (Fig. 5b). La
représentation des points moyens par station (Fig. 5c) met en
évidence une faible variabilité intra-site permettant
néanmoins de distinguer trois groupes de stations dans l'AMP de
Bamboung. Le premier groupe est composé des deux stations les plus en
amont (Ba et Bb) qui sont les moins profondes et les plus chaudes. Le
deuxième groupe est formé par les deux stations centrales (Bc et
Bd) qui sont plus profondes. La station aval (Be) qui est la plus
oxygénée, la plus salée et la plus transparente,
s'individualise (Fig. 5c).
Le bolon de Sangako
Le bolon de Sangako est aussi caractérisé par
trois groupes de variables caractéristiques de trois types de masses
d'eau : salinité et transparence qui s'opposent à la
température sur l'axe 1, oxygène situé à la partie
inférieure de l'axe 2 s'oppose à la salinité et
21
à la transparence. La profondeur est très
fortement corrélée à l'axe 2 et se situe à son
extrémité négative (Fig. 5e). La variabilité
intra-site est faible avec un gradient amont aval moins marqué sur l'axe
2 montrant trois groupes de stations dans le bolon de Sangako. Les stations
amont (Sa, Sb et Sc) sont les plus chaudes, les plus salées et les plus
transparentes (premier groupe). Les stations centrales (Sd et Se) sont les plus
oxygénées (deuxième groupe). La station aval (Sf) qui est
la plus profonde s'individualise (Fig. 5f).
3.1.3. Variabilité intersites des paramètres
physico-chimiques
L'histogramme des valeurs propres (Fig. 6a) de l'analyse
intersites suggère de retenir les deux premiers axes qui expliquent
respectivement 45.1% et 24.1% de l'inertie totale du nuage des points.
Le cercle de corrélation permet de voir trois types de
masses d'eaux : salinité et transparence qui s'opposent à la
température sur l'axe 1 et à l'oxygène sur l'axe 2.
L'oxygène qui s'oppose à la température sur l'axe 1.
La projection des points moyens par station (Fig. 6c) a permis
de constater une variabilité interstation faible. On distingue trois
groupes de stations suivant l'axe 2. Le premier groupe est formé des
deux stations centrales de l'AMP de Bamboung, plus les deux stations les plus
en aval dans les deux sites (Bc, Bd, Be et Sf). Elles sont plus profondes. Le
deuxième groupe est composé des trois stations les plus en amont
du bolon de Sangako (Sa, Sb et Sc). Elles sont les moins profondes, les plus
chaudes, les plus salées et les moins oxygénées. Le
troisième groupe est formé des deux stations centrales du bolon
de Sangako et des deux stations amont de l'AMP de Bamboung (Sd, Se, Ba et Bb).
Elles ont des caractéristiques environnementales
intermédiaires.

22
Figure 6 : Analyse en composantes principales
des paramètres physico-chimiques pour l'ensemble des 66 relevés
hydrologiques réalisés dans les deux sites (AMP de Bamboung et
bolon de Sangako). (a) : diagramme des valeurs propres ; (b) : cercle de
corrélation ; (c) : plan factoriel 1-2.
3.2. Etude comparative des indicateurs
bioécologiques
3.2.1. Description et comparaison des indicateurs
biologiques
Dans l'AMP de Bamboung, la variabilité de l'abondance
est plus importante vers l'amont. Par contre, dans le bolon de Sangako, la
variabilité de l'abondance est plus importante dans les stations aval.
Dans les deux sites, le peuplement est plus abondant au niveau des stations
centrales (Fig. 7). L'abondance moyenne dans le bolon de Sangako
(1743#177;3396) est supérieure à celle de l'AMP de Bamboung
(1029#177;2830). Les résultats du test de Wilcoxon montrent une
abondance plus importante dans le bolon de Sangako que dans l'AMP de Bamboung
(w=274, p=0.000).
23
Pour ce qui est de la biomasse, sa variabilité suit la
même logique que cette de l'abondance. La biomasse fluctue d'une station
à l'autre dans l'AMP de Bamboung comme dans le bolon de Sangako. La
biomasse est plus importante dans la partie centrale des deux sites (Fig. 7).
La biomasse moyenne calculée dans l'AMP de Bamboung (84 #177;265) est
supérieure à celle calculée dans le bolon de Sangako
(40#177;59). Cette différence est significative (w=741, p=0.009)
d'après les résultats du test de Wilcoxon.
Dans l'AMP de Bamboung, la variabilité de la richesse
spécifique est plus importante dans les stations extrêmes. La
richesse spécifique est plus importante dans la station centre Bb. Dans
le bolon de Sangako, la tendance est à la baisse de l'amont vers l'aval
(Fig. 7). La richesse spécifique moyenne trouvée dans l'AMP de
Bamboung (7#177;5) est inférieure à celle trouvée dans le
bolon de Sangako (9#177;3). Cette différence est significative (w=360,
p=0.020).
La variabilité du niveau trophique moyen est plus
importante en amont de l'AMP de Bamboung et plus faible en aval. Elle est plus
importante dans les deux stations extrêmes dans le bolon de Sangako. Dans
l'AMP de Bamboung, le niveau trophique moyen est plus élevé au
niveau de la station Bd (station la plus profonde) alors que dans le bolon de
Sangako c'est la station la plus en aval (station la plus profonde) qui a le
niveau trophique moyen le pus élevé (Fig. 7). Le niveau trophique
moyen est égal à 3.2#177;0.3 dans l'AMP de Bamboung et
2.8#177;0.2 dans le bolon de Sangako. D'après les résultats du
test de Wilcoxon, cette différence est significative (w=915,
p=0.000).
La variabilité de la taille moyenne est plus faible au
niveau de la station avale (Be) et plus importante au niveau de la station la
plus profonde (Bd) dans l'AMP de Bamboung. Dans le bolon de Sangako, elle est
plus forte au niveau de la station avale (Sf) et plus faible au niveau de la
station Sc. La moyenne des tailles moyennes est de 299.5#177;105.8 mm dans
l'AMP Bamboung et de 131.5#177;29.6 mm dans le bolon de Sangako. Les
résultats du test de Wilcoxon montrent une différence
significative en faveur de l'AMP Bamboung (W = 9053, p-value = 0.020).
Dans l'AMP de Bamboung, la taille maximale varie faiblement
d'une station à l'autre mais elle est en moyenne plus importante au
niveau de la station Bb (station la plus profonde). Elle est plus variable dans
le bolon de Sangako surtout au niveau de la station amont (Sa). La moyenne des
tailles maximales dans l'AMP Bamboung (418.6#177;229.1 mm) est
supérieure à celle obtenue dans le bolon de Sangako
(181.9#177;84.1 mm). Les résultats du test de comparaison de Wilcoxon
montrent que cette différence est significative (W = 3151, p-value =
0.000).

24
Figure 7: Variabilité spatiale des
indicateurs biologiques (abondance et biomasse(en logarithme), richesse, niveau
trophique moyen, taille moyenne et taille maximale).
25
3.2.2. Description et comparaison des indicateurs
synthétiques
Dans l'AMP de Bamboung, l'indice de Shannon est plus variable
dans les stations amont et aval que dans les stations centrales. Il est plus
faible dans la station aval. Dans le bolon de Sangako, la variabilité de
l'indice de Shannon est plus importante en aval qu'en amont (Annexe 1). La
valeur moyenne de l'indice de Shannon est égale à 1.7#177;0.7
pour l'AMP de Bamboung et 1.9#177;0.4 pour le bolon de Sangako. Cette
différence n'est pas significative (w=423, p=0.134).
La variabilité de l'indice de Simpson évolue de
la même façon que celle de l'indice de Shannon dans les deux sites
(Annexe 1). L'indice de Simpson est en moyenne égal à 0.7#177;0.2
dans l'AMP de Bamboung et à 0.8#177;0.1 dans le bolon de Sangako. Les
résultats du test de Wilcoxon montrent que cet indice est le même
dans les deux sites (w=475, p=0.408).
L'équitabilité augmente de l'amont vers l'aval
dans l'AMP de Bamboung avec une variabilité plus importante au niveau
des stations amont. L'équitabilité varie peu d'une station
à l'autre dans le bolon de Sangako (Annexe 1).
L'équitabilité moyenne est égale à 0.90#177;0.01 et
0.90#177;0.05 respectivement dans l'AMP de Bamboung et le bolon de Sangako. Les
résultats du test de Wilcoxon confirment l'égalité de
l'équitabilité dans les deux sites (w=484, p=0.605).
3.3. Etude comparative des peuplements de poissons des
deux sites
L'étude de la composition des peuplements de poissons a
permis de dégager des tendances permettant de faire une distinction
entre les communautés de poissons de chaque site d'étude.
L'étude de la variabilité et de la comparaison intra-site des
indicateurs bioécologiques a fourni des différences entre les
peuplements des deux sites. L'organisation spatiale des peuplements de poissons
est étudiée à partir d'une analyse factorielle sur les
espèces, les catégories écologiques et les
catégories trophiques. Elle a permis de caractériser le
peuplement de poissons à l'intérieur de chaque site mais aussi
entre les deux sites. L'analyse de la structure en taille des peuplements de
poissons de chaque site d'étude constitue la dernière partie du
chapitre sur les résultats. Elle a permis de comparer le spectre de
taille des peuplements dans les deux sites.
3.3.1. Composition des peuplements de poissons des deux
sites
Au total, 51 espèces réparties dans 28 familles
sont recensées dans l'AMP de Bamboung au cours de la période
d'étude 2008-2009. Dans la bolon de Sangako, 41 espèces
réparties dans 21 familles ont été identifiées.
Parmi les 51 espèces de l'AMP de Bamboung,
26
17 espèces sont absentes des captures effectuées
dans le bolon de Sangako. Par contre, 7 espèces capturées dans le
bolon de Sangako n'ont pas été observées dans l'AMP de
Bamboung. Durant les 6 campagnes de pêches, le nombre total de poissons
capturés est de 7 721 individus pour une biomasse de 626 345 g dans
l'AMP de Bamboung et de 15 684 individus pour une biomasse de 360 686 g dans le
bolon de Sangako. Ramenée à l'hectare, la densité est
égale à 1029 individus pour une biomasse de 84 kg dans l'AMP de
Bamboung et de 1743 individus pour une biomasse de 40 kg dans le bolon de
Sangako. Le poids moyen d'un poisson est estimé à 82 g dans l'AMP
de Bamboung et à 23 g dans le bolon de Sangako. Dans l'AMP de Bamboung,
l'espèce la plus abondante est Ethmalosa fimbriata avec 67.7%
de l'effectif total et seulement 4.4% de la biomasse totale. Arius
latiscutatus occupe le rang 1 de la biomasse avec 48.7% de la biomasse
totale. Dans le bolon de Sangako deux espèces représentent 77% de
l'effectif total (Ethmalosa fimbriata 44% et Sardinella maderensis
33%). Ces deux espèces y représentent aussi 59% de la
biomasse totale avec 35% pour E. fimbriata et 24% pour S.
maderensis. Elles sont suivies par Liza dumerili (12% de la
biomasse totale).
Tableau V : Pourcentage d'abondance et de
biomasse avec la famille, l'espèce, le code espèce, la
catégorie écologique et la catégorie trophique.
|
Famille
|
Espèce
|
Code
espèce
|
Catégorie
écologique
|
Catégorie trophique
|
% Abondance
|
% Biomasse
|
|
BBG
|
SAN
|
BBG
|
SAN
|
|
Ariidae
|
Arius heudelotii
|
AHE
|
ME
|
p2-ge
|
0.0
|
|
0.1
|
|
|
Arius latiscutatus
|
AGA
|
ME
|
p2-ge
|
3.2
|
0.1
|
48.7
|
1.0
|
|
Arius parkii
|
ARP
|
ME
|
p2-ge
|
0.8
|
|
3.9
|
|
|
Batrachoididae
|
Batrachoides liberiensis
|
BLI
|
Ma
|
p2-ge
|
0.0
|
0.1
|
0.1
|
0.7
|
|
Belonidae
|
Tylosurus crocodilus
|
TCR
|
Mo
|
p2-pi
|
0.0
|
|
0.0
|
|
|
Carangidae
|
Alectis alexandrinus
|
SAL
|
Mo
|
p1-mc
|
0.0
|
|
0.1
|
|
|
Caranx hippos
|
CHI
|
ME
|
p2-ge
|
0.0
|
0.0
|
0.7
|
0.0
|
|
Chloroscombrus chrysurus
|
CHL
|
ME
|
p1-mc
|
4.4
|
7.8
|
0.4
|
2.3
|
|
Hemicaranx bicolor
|
AAM
|
Mo
|
p2-ge
|
0.0
|
0.0
|
0.0
|
0.0
|
|
Lichia amia
|
LIA
|
Ma
|
p2-ge
|
0.0
|
|
0.0
|
|
|
Trachinotus teraia
|
TFA
|
Em
|
p1-bt
|
0.2
|
0.0
|
5.2
|
1.4
|
|
Cichlidae
|
Hemichromis fasciatus
|
HFA
|
Ec
|
p2-ge
|
|
0.0
|
|
0.2
|
|
Sarotherodon melanotheron
|
THE
|
Es
|
he-ph
|
|
0.9
|
|
0.9
|
|
Tilapia guineensis
|
TGU
|
Es
|
he-de
|
0.0
|
0.1
|
0.0
|
1.3
|
|
Clupeidae
|
Ethmalosa fimbriata
|
EFI
|
Em
|
he-ph
|
67.7
|
43.8
|
4.4
|
34.6
|
|
Sardinella aurita
|
SAU
|
Ma
|
p1-zo
|
|
0.0
|
|
0.0
|
|
Sardinella maderensis
|
SEB
|
ME
|
p1-zo
|
5.4
|
32.7
|
1.1
|
23.9
|
|
Cynoglossidae
|
Cynoglossus senegalensis
|
CYS
|
Em
|
p1-bt
|
0.2
|
0.1
|
0.2
|
0.6
|
|
Dasyatidae
|
Dasyatis margaritella
|
DAM
|
Em
|
p1-bt
|
0.1
|
0.1
|
0.6
|
0.7
|
|
Drepaneidae
|
Drepane africana
|
DAF
|
ME
|
p1-mc
|
0.0
|
|
0.0
|
|
|
Echeneidae
|
Remora remora
|
RRE
|
Mo
|
|
0.0
|
|
0.0
|
|
27
Elopidae
|
Elops lacerta
|
ELA
|
ME
|
p2-pi
|
0.1
|
0.2
|
0.3
|
1.4
|
|
Elops senegalensis
|
ELS
|
Ma
|
p2-pi
|
0.0
|
0.0
|
0.1
|
0.1
|
|
Ephippidae
|
Chaetodipterus lippei
|
CLI
|
Ma
|
p1-mc
|
0.1
|
0.0
|
0.4
|
0.0
|
|
Gerreidae
|
Eucinostomus melanopterus
|
GME
|
ME
|
p1-mc
|
2.3
|
4.3
|
0.4
|
3.0
|
|
Gerres nigri
|
GNI
|
Es
|
p1-mc
|
2.7
|
4.4
|
1.5
|
3.8
|
|
Haemulidae
|
Brachydeuterus auritus
|
BAU
|
ME
|
p1-mc
|
0.0
|
0.0
|
0.0
|
0.0
|
|
Plectorhinchus macrolepis
|
PLM
|
Em
|
p2-ge
|
0.2
|
0.0
|
1.6
|
0.8
|
|
Pomadasys incisus
|
PIN
|
Ma
|
p1-bt
|
0.0
|
0.0
|
0.0
|
0.0
|
|
Pomadasys jubelini
|
PJU
|
Em
|
p1-bt
|
0.1
|
|
0.2
|
|
|
Pomadasys perotoei
|
PPE
|
Em
|
p1-bt
|
1.1
|
0.1
|
1.6
|
0.5
|
|
Hemiramphidae
|
Hemiramphus brasiliensis
|
HBR
|
Em
|
p2-ge
|
0.0
|
0.0
|
0.0
|
0.0
|
|
Lutjanidae
|
Lutjanus goreensis
|
LGO
|
Ma
|
p2-pi
|
0.2
|
|
3.8
|
|
|
Monodactylidae
|
Monodactylus sebae
|
PSB
|
Es
|
p2-ge
|
0.5
|
0.5
|
0.5
|
1.2
|
|
Moronidae
|
Dicentrarchus punctatus
|
DPU
|
Mo
|
p2-ge
|
|
0.0
|
|
0.0
|
|
Mugilidae
|
Liza dumerili
|
LDU
|
Em
|
he-de
|
0.2
|
2.6
|
0.4
|
11.9
|
|
Liza falcipinnis
|
LFA
|
Em
|
he-de
|
3.1
|
1.2
|
5.1
|
4.6
|
|
Liza grandisquamis
|
LGR
|
Em
|
he-de
|
0.1
|
0.1
|
0.2
|
0.5
|
|
Mugil bananensis
|
MBA
|
ME
|
he-de
|
0.2
|
0.2
|
0.3
|
0.7
|
|
Mugil cephalus
|
MCE
|
ME
|
he-de
|
|
0.0
|
|
0.0
|
|
Mugilidae
|
Mugil curema
|
MCU
|
Em
|
he-de
|
0.5
|
0.1
|
1.0
|
0.7
|
|
Paralichthyidae
|
Citharichthys stampflii
|
CST
|
Em
|
p2-ge
|
0.0
|
0.0
|
0.0
|
0.0
|
|
Polynemidae
|
Galeoides decadactylus
|
GDE
|
ME
|
p2-ge
|
0.3
|
0.1
|
0.1
|
0.1
|
|
Polydactylus quadrifilis
|
POQ
|
ME
|
p2-pi
|
0.1
|
|
0.9
|
|
|
Pristigasteridae
|
Ilisha africana
|
IAF
|
Em
|
p1-zo
|
4.2
|
|
4.4
|
|
|
Sciaenidae
|
Argyrosomus regius
|
ARE
|
Mo
|
p2-pi
|
0.0
|
|
0.0
|
|
|
Pseudotolithus elongatus
|
PEL
|
Em
|
p2-ge
|
1.0
|
|
2.4
|
|
|
Pseudotolithus senegallus
|
PBR
|
ME
|
p2-ge
|
0.4
|
|
4.7
|
|
|
Pseudotolithus typus
|
PTY
|
ME
|
p2-ge
|
0.1
|
|
0.0
|
|
|
Serranidae
|
Epinephelus aeneus
|
EAE
|
ME
|
p2-pi
|
0.0
|
0.0
|
0.0
|
0.2
|
|
Soleidae
|
Pegusa triophthalma
|
PTR
|
Ma
|
p1-bt
|
|
0.0
|
|
0.0
|
|
Synaptura cadenati
|
SCA
|
Mo
|
p1-bt
|
|
0.0
|
|
0.0
|
|
Synaptura lusitanica
|
SLU
|
Ma
|
p1-bt
|
0.0
|
0.0
|
0.0
|
0.0
|
|
Sphyraenidae
|
Sphyraena afra
|
SPI
|
ME
|
p2-pi
|
0.1
|
0.0
|
1.6
|
0.1
|
|
Tetraodontidae
|
Ephippion guttifer
|
EGU
|
ME
|
p1-bt
|
0.1
|
0.0
|
2.4
|
2.5
|
|
Sphoeroides spengleri
|
SSP
|
Mo
|
p1-bt
|
0.0
|
0.0
|
0.0
|
0.0
|
|
Torpedinidae
|
Torpedo sp
|
TOR
|
Mo
|
p2-ge
|
0.0
|
|
0.0
|
|
|
Trichiuridae
|
Trichiurus lepturus
|
TLE
|
ME
|
p2-pi
|
0.1
|
|
0.4
|
|
3.3.2. Analyse intra-site des peuplements de poissons
Les histogrammes des valeurs propres (Fig. 8a et 8d)
suggèrent de retenir les deux
premiers axes de l'AFC qui expliquent 22.1% de l'inertie
totale pour l'AMP de Bamboung et 24.1% de l'inertie totale pour le bolon de
Sangako. Le pourcentage d'inertie expliqué par les
28
deux premiers axes paraît faible pour les deux sites,
mais s'explique par la taille importante des tableaux de données.
L'AMP Bamboung
La projection des points moyens par station sur l'axe 2 met en
évidence deux groupes de stations caractéristiques de deux
peuplements différents. Un premier groupe de stations projetées
à gauche de l'axe 1 et sur la partie positive de l'axe 2 (Ba, Bb, Bc et
Be) et un second groupe formé par la station Bd (Fig. 8c). Les stations
du premier groupe sont caractérisées par un peuplement
dominé par des espèces de la famille des Mugilidae (L.
falcipinnis, L. dumerili, L. grandisquamis, M. bananensis
et M. curema), les Gerreidae (G. nigri et E.
melanopterus), des Haemulidae (P. jubelini et P.
incisus), E. fimbriata et H. brasiliensis. Les
espèces caractéristiques de la station Bd sont : M. sebae, T.
teraia, A. latiscutatus, L. goreensis, S. afra, B. auritus et P.
macrolepis (Fig. 8b).
Le bolon de Sangako
Un gradient amont-aval est visible sur l'axe 1. Les stations
les plus en amont se trouvent en bas de l'axe 2. Les stations les plus en aval
sont en haut de l'axe 2 (Fig. 8f).
Les espèces les plus présentes en amont sont les
Mugilidae (L. falcipinnis, L dumerili, L.
grandisquamis, M. bananensis et M. curema), les
Gerreidae (G. nigri et E. melanopterus), deux Cichlidae
(S. melanotheron et H. fasciatus), E. senegalensis,
S. afra, C. hippos et Arius latiscutatus. Dans la partie
aval, domine un peuplement composé de deux Clupeidae (E. fimbriata
et S. maderensis), T. teraia, C. chrysurus,
P.incisus et G. decadactylus (Fig. 8e).

29
Figure 8 : AFC des tableaux relevés -
espèces et relevés - stations des deux sites. AMP de Bamboung :
30 relevés - 51 espèces. Bolon de Sangako 36 relevés - 41
espèces Représentation des points moyens par station sur le plan
factoriel 1-2. (a) et (d) : diagramme des valeurs propres ; (b) et (e) : plan
factoriel 1-2 - espèces ; (c) et (f) : plan factoriel 1-2 - stations.
3.3.3. Analyse comparée des peuplements de poissons
des deux sites
Le graphique des valeurs propres (Fig. 9a) suggère de
retenir les deux premiers axes qui expliquent 21.9% de l'inertie totale. Cela
paraît faible, mais s'explique par la taille importante du tableau de
données (66 relevés, 54 espèces).
La projection des points moyens par site (Fig. 9c) montre une
distinction des deux sites. Il y a une opposition bien visible entre les deux
sites. Le point moyen des stations de l'AMP de Bamboung est projeté vers
la droite de l'axe 1 alors que le point moyen des stations du bolon de Sangako
est situé à gauche de l'axe 1. Cette opposition se retrouve sur
la
30
projection des points espèces (Fig. 9b). La
variabilité de l'abondance est beaucoup plus forte dans l'AMP de
Bamboung que dans le bolon de Sangako.
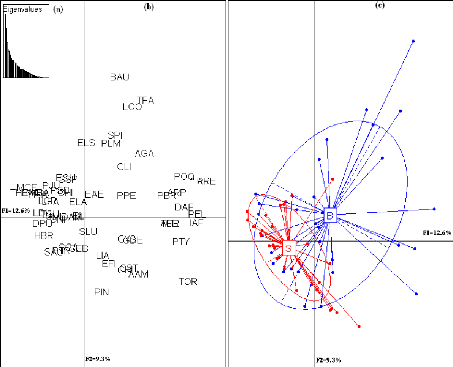
Figure 9 : AFC des peuplements de poissons de
l'AMP de Bamboung (B) et du bolon de Sangako (S) ; (66 relevés - 54
espèces). (a) : diagramme des valeurs propres ; (b) : plan factoriel 1-2
- espèces ; (c) : plan factoriel 1-2 - site.
Les espèces caractéristiques de l'AMP de
Bamboung sont : les deux Ariidae (A. latiscutatus et A.
parkii), trois Haemulidae (B. auritus, P. perotoei et
P. macrolepis), deux Sciaenidae (P. typus et P.
elongatus), deux Polynemidae (P. quadrifilis et G.
decadactylus), I. africana, T. teraia, L.
goreensis, S. afra, M. sebae et P.
brachygnatus.
Par opposition, les espèces projetées à
gauche de l'axe 1 sont majoritairement capturées dans le bolon de
Sangako. C'est un peuplement caractérisé par des Mugilidae
(L. falcipinnis, L. dumerili, M. bananensis et
M. curema), les Gerreidae (G. nigri et E.
melanopterus), des Clupeidae (E. fimbriata et S.
maderensis), S. melanotheron et C. chrysurus.
31

3.3.4. Analyse comparée des peuplements identiques
aux deux sites
Cette analyse est réalisée sur un peuplement
composé d'espèces capturées à la fois dans les deux
sites d'étude. Autrement dit, les espèces capturées
uniquement dans un seul site ne sont pas intégrées dans
l'analyse.
Le graphique des valeurs propres (Fig. 10a) suggère de
retenir les deux premiers axes. Les deux premiers axes expliquent 26.9% de
l'inertie totale, valeur faible qui s'explique par la taille importante du
tableau de données.
La projection des points moyens par site montre une opposition
des deux sites sur l'axe 2. Les structures des peuplements exploités des
deux sites sont différentes du point de vue abondance. Le peuplement
présente une variabilité plus faible dans le bolon de Sangako.
Par contre, le peuplement de l'AMP de Bamboung est plus variable (Fig. 10c).
Les espèces caractéristiques de l'AMP de Bamboung sont : E.
fimbriata, C. chrysurus, A. latiscutatus, G. decadactylus, T. teraia,
P. macrolepis, S. afra, B. auritus et P. perotoei. Les
espèces caractéristiques du bolon de Sangako sont des Mugilidae
(L. falcipinnis, L. dumerili, M. bananensis et
M. curema), les Gerreidae (G. nigri et E.
melanopterus), M. sebae et S. maderensis (Fig. 10b).
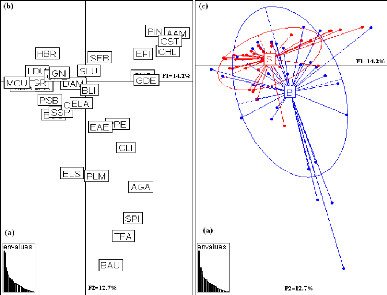
Figure 10 : AFC - AMP de Bamboung et Bolon de
Sangako : 66 relevés - 34 espèces Représentation des
points moyens par site sur le plan factoriel 1-2. B = points moyens des
stations de l'AMP de Bamboung et S = points moyens des stations du bolon de
Sangako. (a) : diagramme des valeurs propres ; (b) : plan factoriel 1-2 -
espèces ; (c) : plan factoriel 1-2 - site.
32
3.3.5. Structure écologique
La répartition des catégories écologiques
(Fig. 11) et leur description en fonction de la richesse, de l'abondance et de
la biomasse permettent une comparaison entre les deux sites. Une analyse
factorielle des correspondances simples intra-site et une intersites vont
permettre de caractériser les catégories écologiques
respectivement en fonction des stations et en fonction des sites.
3.3.5.1. Répartition des espèces par
catégories écologique et par site
Le peuplement de l'AMP de Bamboung est dominé par les
Marines estuariennes (ME) avec 45% de la richesse totale. Suivent les
estuariennes d'origine marine (Em) avec 32% de la richesse totale. Les
estuariennes strictes (Es) viennent en troisième position (11%). Les
marines accessoires (Ma) et les marines occasionnelles (Mo) regroupent
respectivement 8% et 3% de la richesse totale. La même situation se
retrouve dans le bolon de Sangako. La majeur partie des espèces sont de
la catégorie des ME (37% de la richesse totale). Suivent les Em (33%),
les Es (21%), les Ma (6%) et les Mo (2%). La catégorie estuarienne
d'origine continentale (Ec), représentée par l'espèce
Hemichromis fasciatus dans le bolon de Sangako, n'a pas
été observée dans l'AMP de Bamboung. Les ME, les Ma et les
Mo sont mieux représentées dans l'AMP de Bamboung que dans le
bolon de Sangako. Les deux catégories écologiques restantes (Em,
Es) sont mieux représentées dans le bolon de Sangako que dans
l'AMP de Bamboung (Fig. 11).
Figure 11: Répartition en
catégories écologiques et par site du nombre d'espèces (en
%) dans l'AMP de Bamboung (BBG) et le bolon de Sangako (SAN).
33
3.3.5.2. Richesse, abondance et biomasse par
catégorie écologique
En termes de richesse, les catégories Em, ME et Mo sont
mieux représentées dans l'AMP de Bamboung que dans le bolon de
Sangako. Pour ce qui est de l'abondance, les Ec, les Es, les Em et les ME sont
plus nombreuses dans le bolon de Sangako que dans l'AMP de Bamboung. En ce qui
concerne les autres catégories écologiques (Ma et Mo),
l'abondance est la même dans les deux sites. Du point de vue biomasse,
les ME et les Ma dominent dans l'AMP de Bamboung alors que les Es et Ec
dominent dans le bolon de Sangako (Tab. VI).
Tableau VI : Richesse, abondance (en nombre
ha-1) et biomasse (en kg ha-1) par catégorie
écologique pour les deux sites d'étude.
|
Catégorie
écologique
|
AMP de Bamboung
|
Bolon de Sangako
|
|
Richesse
|
Abondance
|
Biomasse
|
Richesse
|
Abondance
|
Biomasse
|
|
Ec
|
|
|
|
1
|
1
|
0
|
|
Es
|
3
|
33
|
2
|
4
|
103
|
3
|
|
Em
|
15
|
809
|
23
|
12
|
840
|
23
|
|
ME
|
19
|
181
|
55
|
13
|
794
|
14
|
|
Ma
|
7
|
4
|
4
|
7
|
4
|
0
|
|
Mo
|
7
|
1
|
0
|
4
|
1
|
0
|
|
Total
|
51
|
1029
|
84
|
41
|
1743
|
40
|
3.3.5.3. Répartition spatiale des
catégories écologiques
Les histogrammes des valeurs propres sont
représentés par les figures 12a et 12d. AMP de Bamboung : 5
catégories écologiques (Axe 1 horizontal - 12.5%, Axe 2 vertical
- 9.6%). Bolon de Sangako - 6 catégories écologiques (Axe 1
horizontal - 15.9%, Axe 2 vertical - 8.2%).
L'AMP de Bamboung
Le premier plan factoriel explique au total 22.1% de la
variance (Fig. 12a). La projection des points moyens par station a donné
les mêmes résultats que l'analyse intra-site des peuplements (Fig.
8). La station centrale (Bd) est caractérisée par la
catégorie ME. Les stations les plus en amont sont dominées par
les catégories écologiques Em, Es et Ma alors que la station aval
(Be) est dominée par la catégorie Mo. La catégorie Es
occupe une position centrale du fait de sa large répartition dans l'AMP
de Bamboung (Fig. 12b et 12c). Le bolon de Sangako
Les deux premières composantes expliquent au total
24.1% de la variance totale (Fig. 12d). La projection des points moyens par
station met en évidence un gradient amont aval sur l'axe 2. Comme pour
l'analyse intra-site (Fig. 8f), on constate deux grands groupes
34
35
de stations : les stations amont (Sa, Sb, Sc) et les stations
aval (Sd, Se, Sf). Les stations amont sont caractérisées par les
catégories Ec, ME et Mo alors que les stations aval sont dominées
par Es, Em et Ma (Fig. 12e et 12f).

Figure 12 : Analyse factorielle des
correspondances simples des catégories écologiques (en abondance)
de chaque site d'étude. Projection des points moyens des
catégories écologiques et des stations dans le plan factoriel
1-2. (a) et (d) : diagramme des valeurs propres ; (b) et (e) : plan factoriel
1-2 - espèces ; (c) et (f) : plan factoriel 1-2 - station.
3.3.5.4. Analyse comparée de la
répartition des catégories écologiques
Les deux axes expliquent au total 21.9% de l'inertie totale.
Deux groupes de catégories écologiques sont formées sur
l'axe 1 : un groupe composé de ME, Ma et Mo qui caractérisent
l'AMP de Bamboung et un groupe composé de Em et Ec qui
caractérisent le bolon de Sangako (Fig. 13b et 13c). La position
intermédiaire de la catégorie Es sur le graphique (Fig. 13b)
explique sa large distribution dans les deux sites d'étude.

Figure 13 : Analyse factorielle des
correspondances des catégories écologiques (en abondance) des
deux sites d'étude. Projection des catégories écologiques
et des points moyens par site dans le plan factoriel 1-2. (a) : diagramme des
valeurs propres ; (b) : plan factoriel 1-2 - catégorie écologique
; (c) : plan factoriel 1-2 - site.
3.3.6. Structure trophique
Les catégories trophiques ont fait l'objet d'une
analyse descriptive pour chaque site d'étude (Fig. 14). Ces
catégories trophiques ont été décrites en fonction
de la richesse, de l'abondance et de la biomasse permettant une comparaison
entre les deux sites. Une analyse factorielle des correspondances simples
intra-site et une intersites vont permettre de caractériser les
catégories trophiques en fonction des stations et en fonction des
sites.
3.3.6.1. Répartition des espèces par
catégories trophiques et par site
Dans l'AMP de Bamboung, le peuplement est dominé par
les p2-ge qui représentent plus de la moitié de la biomasse
totale (63%). Suivent les p1-bt (10%), les p2-pi (7%) et les he-de (7%). Les
he-ph (4%) et les p1-mc (3%) sont faiblement présents (Fig. 14). Dans le
bolon de Sangako, la proportion des he-ph (36%) est la plus importante. Les
p1-zo viennent en deuxième position avec 24%. Les he-de (20%) occupent
la troisième place. Les p1-mc (9%), les p1-bt (6%), les p2-ge (4%) et
p2-pi (2%) sont faiblement représentées en termes de biomasse
(Fig. 14).

36
Figure 14 : Répartition en groupes
trophiques et par site des biomasses (en %) dans l'AMP de Bamboung (BBG) et le
bolon de Sangako (SAN).
3.3.6.2. Richesse, abondance et biomasse par
catégorie trophique
Les espèces appartenant aux catégories
trophiques he-de, he-ph et p1-bt sont plus nombreuses dans le bolon de Sangako
alors que celles appartenant aux catégories trophiques p1-mc, p1-zo,
p2-ge et p2-pi sont plus représentées dans l'AMP de Bamboung. Les
catégories trophiques he-de, he-ph, p1-mc et p1-zo sont plus abondantes
dans le bolon de Sangako. Par contre, les catégories trophiques p1-bt,
p2-ge et p2-pi sont plus abondantes dans l'AMP de Bamboung. Du point de vue
biomasse, les catégories he-de, he-ph, p1-mc et p1-zo sont plus
importantes dans le bolon de Sangako alors que les p1-bt, p2-ge et p2-pi sont
plus importantes dans l'AMP de Bamboung (Tab. VII).
Tableau VII : Richesse, abondance (en nombre
ha-1) et biomasse (en kg ha-1) par catégorie
trophique pour les deux sites d'étude.
|
Catégorie
trophique
|
AMP de Bamboung
|
Bolon de Sangako
|
|
Richesse
|
Abondance
|
Biomasse
|
Richesse
|
Abondance
|
Biomasse
|
|
he-de
|
6
|
42
|
6
|
7
|
76
|
8
|
|
he-ph
|
1
|
697
|
4
|
2
|
780
|
14
|
|
p1-bt
|
9
|
18
|
9
|
10
|
7
|
2
|
|
p1-mc
|
7
|
98
|
2
|
5
|
288
|
4
|
|
p1-zo
|
3
|
99
|
5
|
2
|
571
|
10
|
|
p2-ge
|
16
|
69
|
52
|
11
|
16
|
2
|
|
p2-pi
|
9
|
7
|
6
|
4
|
5
|
1
|
|
Total
|
51
|
1029
|
84
|
41
|
1743
|
40
|
37
3.3.6.3. Répartition spatiale des
catégories trophiques
Les figures 15a et 15b sont respectivement les histogrammes
des valeurs propres pour l'AMP de Bamboung et le bolon de Sangako. AMP de
Bamboung : 7 catégories trophiques (Axe 1 horizontal - 12.5%, Axe 2
vertical - 9.6%). Bolon de Sangako - 7 catégories trophiques (Axe 1
horizontal - 15.9%, Axe 2 vertical - 8.2%).
L'AMP de Bamboung
La projection des points moyens des stations permet de
distinguer trois groupes de stations comme pour l'analyse intra-site des
peuplements de poissons (Fig. 8c). Les stations les plus en amont (Ba, Bb et
Bc) sont dominées par les he-de et les p1-bt, la station centrale (Bd)
est caractérisée par les p2-pi et les p1-mc. La station aval (Be)
est caractérisée par les catégories he-ph, p1-zo et p2-ge
(Fig. 15c).
Le bolon de Sangako
Deux groupes de stations caractéristiques de trois
peuplements différents sont ainsi mis en évidence (Fig. 15f). Les
stations amont (Sa, Sb et Sc) caractérisées par les
catégories trophiques p2-pi, p2-ge et he-de. Les stations aval
caractérisées par les catégories trophiques he-ph, p1-zo,
p1-mc et p1-bt. La station Sf située à l'extrême aval du
bolon de Sangako a un peuplement dominé par p1-bt (Fig. 15e).
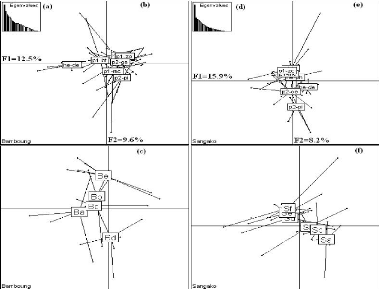
Figure 15 : Analyse factorielle des
correspondances simples des catégories trophiques (en biomasse) de
chaque site d'étude. Projection des catégories trophiques et des
points moyens par stations dans le plan factoriel 1-2. (a) et (d) : diagramme
des valeurs propres ; (b) et (e) : plan factoriel 1-2 - catégorie
trophique ; (c) et (f) : plan factoriel 1-2 - station.
38
3.3.6.4. Analyse comparée de la
répartition des catégories trophiques
Projection des catégories trophiques et des points
moyens par site dans le plan factoriel 1-2 (Axe 1 horizontal - 12.6%, Axe 2
vertical - 9.3%). B = points moyens des stations de l'AMP de Bamboung et S =
points moyens des stations du bolon de Sangako (Fig. 16).
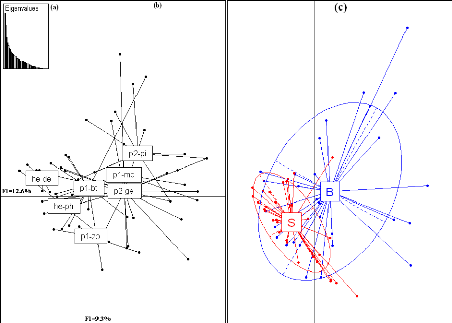
Figure 16 : Analyse factorielle des
correspondances des catégories trophiques (en abondance) des deux sites
d'étude. (a) : diagramme des valeurs propres ; (b) : plan factoriel 1-2
- catégorie trophique ; (c) : plan factoriel 1-2 - site.
La projection des points moyens par site permet de distinguer
l'AMP de Bamboung au bolon de Sangako (Fig. 16c). Deux groupes de
catégories trophiques se distinguent. Le premier groupe formé par
les p2-pi, p2-ge et p1-mc est caractéristique de l'AMP de Bamboung. Le
deuxième groupe formé des catégories trophiques he-de,
he-ph et p1-zo caractérise le bolon de Sangako. La catégorie
trophique p1-bt est largement distribuées dans les deux sites
d'où sa position centrale sur le graphique (Fig. 16b).
39
3.3.7. Structure de taille
Les tailles minimales observées (Tm) sont de 50 mm
(C. chrysurus) dans l'AMP de Bamboung et 44 mm (H. bicolor)
dans le bolon de Sangako. La taille maximale (TMO) capturée est de 1055
mm (P. brachygnatus) dans l'AMP de Bamboung et de 575 mm (T.
teraia) dans le bolon de Sangako. Le nombre de poissons capturés
est de 7 721 dans l'AMP de Bamboung et de 15 684 dans le bolon de Sangako.
3.3.7.1. Description des structures en taille
Les distributions des fréquences de taille fourni une
image de la structure des peuplements de poisson dans les deux sites
d'étude (Fig. 17). Elle est bimodale dans les deux sites avec deux
grandes phases. La première phase correspond à une augmentation
de la fréquence des individus de petite taille. C'est la phase de
sélectivité de la senne tournante. La seconde phase correspond
à une baisse du spectre de taille. C'est la phase de capture qui varie
entre 11 cm et 16 cm. Le pic de sélectivité le plus fort
correspond à la taille de première capture ou de recrutement.
Elle est égale à 8 cm dans l'AMP de Bamboung et à 10 cm
dans le bolon de Sangako. La phase de sélectivité de la senne
tournante varie entre 4 cm et 10 cm. Entre 4 et 22 cm, le spectre de taille du
bolon de Sangako est au dessus de celui de l'AMP de Bamboung. Pour cette gamme
de taille, la fréquence de capture est plus faible dans l'AMP de
Bamboung que dans le bolon de Sangako. Les deux courbes se recoupent à
la taille de 22 cm. Au-delà de 22 cm, le spectre de taille de l'AMP de
Bamboung est au dessus de celui du bolon de Sangako. Le spectre de taille
baisse à partir de 22 cm et atteint la valeur nulle à 57 cm (TMO)
dans le bolon de Sangako et à 105 cm (TMO) dans l'AMP de Bamboung.
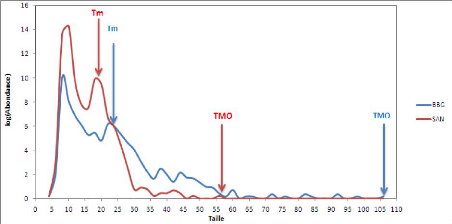
40
Figure 17 : Distribution des fréquences
de taille par site. Tm= taille moyenne observée et TMO = taille maximale
observée.
3.3.7.2. Ajustement par moindre carré du
modèle linéaire au spectre de taille
L'ajustement du modèle linéaire au spectre de
taille dans les deux sites d'étude montre une baisse de l'abondance par
classe de taille des poissons des plus petites aux plus grandes classes de
taille (Fig. 18).
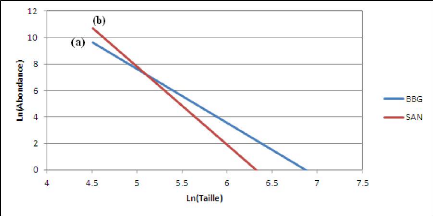
Figure 18 : Spectre de taille des peuplements
de poissons de l'AMP de Bamboung (a) et du bolon de Sangako (b).
Les résultats de la régression portant sur une
fonction linéaire sont reportés au tableau VIII. Dans les deux
sites, l'ajustement est de bonne qualité, le coefficient de
détermination (R2) est en effet très
élevé et significatif. Il est égal à 0.85 pour
l'AMP de Bamboung et à 0.88
41
pour le bolon de Sangako. Il y a une très forte
corrélation entre l'abondance et la classe de taille dans les deux
sites. La distribution des fréquences de taille reflète
exactement la distribution des abondances en fonction de la taille dans les
deux sites (Fig. 18). Le résultat de l'analyse du spectre de taille
montre que la pente est plus faible pour le peuplement de poissons de l'AMP de
Bamboung (-0.27) que pour celui du bolon de Sangako (-0.15). On constate le
contraire pour ce qui est de l'ordonnée à l'origine (Tableau
VIII).
Tableau VIII : Résultats de
l'ajustement par moindres-carrés des modèles linéaires aux
spectres de taille. R2 = coefficient de
régression, a= ordonnée à l'origine et b= pente.
|
Site
|
Modèle : yi = a + bxi + åi
|
Ordonnée à
l'origine
|
Pente
|
|
R2
|
a
|
b
|
|
BBG
|
0.85
|
7.1
|
-0.27
|
|
SAN
|
0.88
|
6.2
|
-0.15
|
42
4. DISCUSSION
Beaucoup de facteurs physico-chimiques et biologiques
influencent la distribution, l'abondance et la diversité des poissons
des estuaires tropicaux (Albaret, 2004). L'étude descriptive des
paramètres physico-chimiques des deux sites s'est avérée
nécessaire afin de mieux comprendre la biologie et l'écologie de
leur peuplement de poissons. Parmi les facteurs physico-chimiques, la
salinité de l'eau, la température, la transparence, la
profondeur, l'oxygène dissous et leurs fluctuations
régulières ou irrégulières à
différentes échelles de temps et d'espace, sont identifiés
comme variables déterminants dans l'écologie des poissons
estuariens et lagunaires (Albaret, 1999).
4.1. Environnement aquatique
L'étude des paramètres physico-chimiques avait
pour objectif de décrire l'environnement aquatique de l'AMP et celui du
bolon de Sangako, puis de les comparer. Les résultats de cette
étude vont permettre de conclure sur l'homogénéité
des deux sites étudiés.
Tableau IX : Synthèse et pertinence
des paramètres physico-chimiques. W = statistique de Wilcoxon et p =
probabilité.
|
Paramètre
|
Site
|
Test de Wilcoxon
|
|
Moyenne
|
W
|
P
|
|
BBG
|
37.9#177;7.0
|
|
|
|
Salinité
|
464.8
|
0.333
|
|
SAN
|
38.6#177;9.3
|
|
|
|
|
BBG
|
2.1#177;0.6
|
|
|
|
Transparence
|
595
|
0.483
|
|
SAN
|
1.9#177;0.4
|
|
|
|
|
BBG
|
28.8#177;2.0
|
|
|
|
Température
|
488
|
0.507
|
|
SAN
|
29.2#177;2.3
|
|
|
|
|
BBG
|
75.5#177;8.6
|
|
|
|
Oxygène
|
681
|
0.069
|
|
SAN
|
70.4#177;9.4
|
|
|
|
|
BBG
|
5.6#177;1.5
|
|
|
|
Profondeur
|
713
|
0.000
|
|
SAN
|
3.4#177;1.7
|
|
|
|
L'étude comparative a montré que les deux
milieux ont la même salinité. L'amplitude des variations spatiales
de la salinité n'a pas dépassé 28 dans l'AMP de Bamboung
et 22 dans le bolon de Sangako. La salinité dans l'estuaire du
Sine-Saloum dépend essentiellement de la pluviométrie (Diouf,
1996).
Les résultats du test de comparaison ont montré
une transparence qui ne varie pas en fonction des sites. Sa variabilité
n'est pas homogène dans les deux sites.
La température ne varie pas en fonction des sites. Sa
variabilité spatiale est très différente d'une station
à l'autre dans l'AMP de Bamboung. Dans le bolon de Sangako, la
43
température est plus variable dans les stations aval.
Les stations amont moins profondes sont les plus chaudes.
Le pourcentage de saturation en oxygène est la
même dans l'AMP de Bamboung et le bolon de Sangako. Il est toujours
élevé et très variable dans les stations extrêmes de
l'AMP de Bamboung. La variabilité spatiale n'est pas homogène
dans les deux sites d'étude.
La profondeur moyenne de pêche est plus importante dans
l'AMP de Bamboung que dans le bolon de Sangako. La profondeur ne dépasse
pas les 15m dans les deux sites. La senne tournante coulissante utilisée
touche le fond lors des opérations de pêches expérimentales
dans les deux sites (Tab. IX).
L'ACPn a permis de voir des variabilités intra-sites et
intersites faibles. Il n'y a pas de distinction nette liée aux
paramètres physico-chimiques entre les stations dans l'AMP de Bamboung
comme dans le bolon de Sangako. La profondeur, incluse dans l'ACPn est le
facteur qui explique le mieux cette faible variabilité spatiale. Il y a
trois groupes de stations dans l'AMP de Bamboung comme dans le bolon de
Sangako. Une distance de 8 km sépare les deux sites d'étude. Ils
sont proches et reçoivent des masses d'eau similaires. Les conditions
environnementales externes (pluviométrie, vent, ensoleillement,
marée, courant marin, humidité de l'air, etc...) sont
supposées être les mêmes pour les deux sites. Les
résultats du test de comparaison des paramètres physico-chimiques
combinés avec ceux de la comparaison de la variabilité intersites
montrent que les deux sites sont homogènes. Seule la profondeur de
pêche diffère en faveur de l'AMP de Bamboung. D'Onghia et al.
(1998) ont montré que la profondeur est un facteur très influant
sur la distribution, l'organisation, l'abondance, la biomasse et la structure
en taille des peuplements de poissons. La profondeur joue le rôle de
refuge pour les poissons d'après D'Onghia et al. (2009).
4.2. Les indicateurs bioécologiques
La deuxième partie de cette étude avait pour
objectif la comparaison des indicateurs bioécologiques comme
l'abondance, la biomasse, la richesse spécifique, le niveau trophique,
la taille moyenne observée, la taille maximale observée, l'indice
de Shannon, l'indice de Simpson et l'équitabilité de Simpson
entre l'AMP de Bamboung et le bolon de Sangako.
Sur l'ensemble des 58 espèces identifiées dans
les deux sites d'étude, 34 sont capturées à la fois dans
l'AMP de Bamboung et le bolon de Sangako. Cela traduit une bonne
répartition du peuplement de poissons entre les deux sites
étudiés.
44
La diversité de l'AMP de Bamboung (51 espèces)
est supérieure à celle du bolon de Sangako (41 espèces).
Les 11 espèces apparues entre 2008 et 2009 dans l'AMP de Bamboung sont
toutes des espèces prédatrices et d'affinité marine
(Annexe 2).
Tableau X : Synthèse et pertinence des
indicateurs bioécologiques.
|
Paramètre
|
Site
|
Test de Wilcoxon
|
|
Moyenne
|
W
|
P
|
|
Abondance
|
BBG
|
1029#177;2830
|
274
|
0.001
|
|
SAN
|
1743#177;3396
|
|
Biomasse
|
BBG
|
84#177;265
|
741
|
0.009
|
|
SAN
|
40#177;59
|
|
Richesse
spécifique
|
BBG
|
7#177;5
|
360
|
0.02
|
|
SAN
|
9#177;3
|
|
Niveau
trophique
|
BBG
|
3.2#177;0.3
|
915
|
0.000
|
|
SAN
|
2.8#177;0.2
|
|
Taille
moyenne
|
BBG
|
299.5#177;105.8
|
9053
|
0.020
|
|
SAN
|
131.5#177;29.6
|
|
Taille
maximale
|
BBG
|
418.6#177;229.1
|
3151
|
0.000
|
|
SAN
|
181.9#177;84.1
|
|
Indice de
Shannon
|
BBG
|
1.7#177;0.7
|
423
|
0.134
|
|
SAN
|
1.9#177;0.4
|
|
Indice de
Simpson
|
BBG
|
0.7#177;0.2
|
475
|
0.408
|
|
SAN
|
0.8#177;0.1
|
|
Equitabilité de Simpson
|
BBG
|
0.9#177;0.01
|
484
|
0.605
|
|
SAN
|
0.9#177;0.05
|
Tous les indicateurs biologiques sont statistiquement
différents entre les deux sites d'étude. Les différences
sont en faveur de l'AMP de Bamboung sauf pour l'abondance et la richesse
spécifique dont les valeurs sont en moyenne plus fortes dans le bolon de
Sangako que dans l'AMP de Bamboung. Les indicateurs synthétiques ne
varient pas en fonction des sites.
Le peuplement de poissons est beaucoup plus abondant dans le
bolon de Sangako (1743 individus ha-1) que dans l'AMP de Bamboung
(1029 individus ha-1). Dans l'AMP de Bamboung, le peuplement est
moins stable en amont alors que dans le bolon de Sangako l'instabilité
s'observe en aval. Le peuplement de l'AMP de Bamboung est fortement
concentré à la station centrale (Bd) qui est la plus profonde.
L'augmentation de la densité au sein d'un peuplement non
protégé pourrait être due à des interactions
significatives entre un site protégée et un site non
protégée. Ce résultat peut aussi s'expliquer par la forte
prédation qui existerait dans l'AMP de Bamboung. L'augmentation des
espèces d'affinité marine, très souvent
prédatrices, à l'intérieur de l'AMP de Bamboung aurait
conduit à une plus forte prédation et donc à une
diminution de l'abondance des proies. Un autre facteur susceptible
45
d'expliquer cette différence d'abondance en faveur du
bolon de Sangako est l'effet « spillover » ou effet de
débordement. Un peuplement plus abondant dans le bolon de Sangako que
dans l'AMP de Bamboung confirme les résultats de Graham et al. (2003) et
Schroeder et Love (2002). Dans le parc marin de la grande barrière des
coraux en Australie, Graham et al. (2003) ont montré que la
densité du peuplement de poissons est deux fois plus importante dans la
zone non protégée que dans la zone protégée. Selon
ces auteurs, ce résultat est attribué à la forte
présence de prédateurs dans la réserve. Schroeder et Love
(2002) ont montré une population de Sébastes plus abondante dans
la zone non protégée que dans les zones moins
protégée et la zone strictement protégée de la
réserve marine de Gail de Facto aux Etats Unies.
La biomasse de l'AMP de Bamboung (84 kg ha-1) est
deux fois supérieure à celle du bolon de Sangako (40 kg
ha-1). La forte variabilité spatiale de la biomasse
s'explique par un peuplement instable dans l'AMP de Bamboung comme dans le
bolon de Sangako. La biomasse est plus stable au niveau de la station centrale
de l'AMP de Bamboung (Bd) et au niveau de la station amont du bolon de Sangako
(Sa). La différence de biomasse en faveur de l'AMP de Bamboung
s'explique par une forte proportion d'espèces prédatrices.
Stobart et al. (2009) ont montré une biomasse du peuplement de poissons
plus importante à l'intérieur qu'à l'extérieur de
la réserve des iles Columbretes en Espagne. Edgar et Barett (1999) ont
aussi montré une biomasse plus importante à l'intérieur
qu'à l'extérieur de la réserve de Tinderbox en Australie.
Ils ont expliqué ce résultat par la forte présence de
langoustes à l'intérieur de la réserve entrainant une
énorme augmentation de la biomasse. Les résultats des
études menées par Evans et Russ (2004) ont montré une
biomasse plus importante dans les zones protégées que dans les
zones pêchées de trois îles (Palm, Whitsunday et Keppel) en
Australie. Ils ont expliqué ce résultat par une importante
biomasse de deux populations de poissons (Plectropomus
spp. et Lutjanus carponotatus)
à l'intérieur des zones protégées. McClanahan
et al. (1999) ont trouvé une biomasse 3.5 fois plus importante dans des
sites protégés que dans les sites non protégées au
niveau des récifs des îles du sud kényan et du nord de la
Tanzanie. Halpern (2003) a trouvé un résultat similaire à
partir d'une synthèse de 89 études sur l'effet des
réserves marines sur la biomasse des organismes. Les études
menées par Harmelin-Vivien et al. (2008) en France et en Espagne dans la
mer méditerranéenne ont montré une biomasse 4.7 fois plus
importante à l'intérieur qu'à l'extérieur de six
aires marines protégées (Carry-le-Rouet et Banyuls en France ;
Medes, Cabrera, Tabarca et Cabo de Palos en Espagne). Une biomasse plus
importante dans la zone protégée que dans la zone non
protégée est confirmée par l'étude menée par
Garcia-Charton et al. (2004) dans la réserve marine de Cabo de Palos en
Espagne. Dans le Parc marin de Ningaloo à l'Ouest de l'Australie,
Westera et al. (2003)
46
ont trouvé une biomasse plus importante dans la
réserve marine que dans la zone de pêche
récréative.
La richesse spécifique moyenne est plus importante dans
le bolon de Sangako que dans l'AMP de Bamboung. Ce résultat peut
s'expliquer par un flux migratoire d'espèces plus important dans l'AMP
de Bamboung que dans le bolon de Sangako. Ce résultat confirme celui de
Stobart et al. (2009) obtenu dans l'AMP des Îles Columbretes en Espagne.
La variabilité spatiale de la richesse spécifique est faible
d'une station à l'autre dans l'AMP de Bamboung affichant une
stabilité de l'amont vers l'aval. Il en est de même dans le bolon
de Sangako mais avec une tendance à la baisse de l'amont vers l'aval.
Les 17 espèces capturées dans l'AMP de Bamboung et non
recensées dans le bolon de Sangako sont d'origine marine. Ceci peut
justifier l'important flux migratoire des poissons vers l'AMP de Bamboung. Le
peuplement de poissons est plus stable dans le bolon de Sangako. Ce qui
suggère que l'AMP de Bamboung présente des
caractéristiques plus favorables parmi lesquelles on peut noter le
statut de protection.
La différence significative de niveau trophique moyen
en faveur de l'AMP de Bamboung se justifie par l'importante proportion de
prédateurs de haut niveau trophique. En effet, les prédateurs
représentent 88% de la biomasse totale dans l'AMP de Bamboung contre 45%
dans le bolon de Sangako. Il augmente d'amont en aval dans l'AMP de Bamboung
comme dans le bolon de Sangako. Cela traduit la présence d'espèce
de haut niveau trophique vers l'aval (zone profonde) et d'espèce de bas
niveau trophique vers l'amont (zone peu profonde). La variabilité du
niveau trophique moyen est plus importante en amont de l'AMP de Bamboung. Ce
résultat s'expliquerait par une importante interaction trophique au
niveau des stations amont. Dans le bolon de Sangako, on note une
variabilité importante du niveau trophique moyen en aval.
La taille moyenne du peuplement de poissons de l'AMP de
Bamboung est supérieure à celle du peuplement de poissons du
bolon de Sangako. Ce résultat peut s'expliquer par le fait que
l'exploitation des ressources s'accompagne d'une diminution de la taille
moyenne des poissons liée à la disparition d'individus de grande
taille. Stobart et al. (2009) ont obtenu un résultat similaire dans
l'AMP des Îles Columbretes en Espagne. Les résultats des travaux
d'Edgar et Barrett (1999) ont montré une taille moyenne des organismes
plus importante à l'intérieur qu'à l'extérieur des
quatre réserves marines de Tasmania en Australie. Dans la réserve
des îles Duck au Canada, les résultats des études
menées par Rowe (2002) sur la population de homards ont montré
une taille moyenne plus importante à l'intérieur qu'à
l'extérieure de la réserve. Jouvenel et Pollard (2001) ont
trouvé le même résultat après une
47
étude menée sur la population de sparidé
(Sparus aurata) de la réserve marine de Cerbère-Banyuls
en France. Ils ont expliqué cette différence par une
mortalité due en grande partie par la forte pression de pêche. Un
résultat similaire est obtenu par Willis et al. (2003) qui ont
montré une taille moyenne de la population de vivaneaux (Lutjanidae)
plus importante à l'intérieur qu'à l'extérieur de
trois réserves marines au nord de la Nouvelle Zélande. Halpern
(2003) a passé en revue plusieurs travaux sur l'impact des
réserves marines sur la taille moyenne des organismes. Il a
trouvé à partir de la synthèse des 89 études
distinctes, à l'exception de la taille des invertébrés,
une taille moyenne plus importante dans la réserve qu'en dehors de la
réserve. Dans l'île de la Réserve faunique nationale de
Merritt à Cap Canaveral, en Floride aux Etats-Unis, Gell et Roberts
(2003) ont trouvé la taille moyenne d'un peuplement de poissons plus
importante dans la réserve que dans les zones ouvertes à la
pêche.
La taille maximale du peuplement de poissons de l'AMP de
Bamboung est supérieure à celle du peuplement de poissons du
bolon de Sangako. Mosquera et al. (2000) ont synthétisé des
résultats d'études empiriques de réserves marines pour
évaluer les avantages potentiels de la protection des populations de
poissons et ont montré une taille maximale plus importante dans une zone
protégée que dans une zone non protégée. Ils ont
expliqué ce résultat par une importante présence
d'espèces ciblées par la pêche à l'intérieure
de la zone protégée. Ce résultat confirme ceux des
études menées par Floeter et al. (2006) dans la réserve
marine d'Arquipelago au Brésil. Ils ont trouvé un peuplement de
poissons de grande taille dans les sites présentant un degré
élevé de protection et ont expliqué ce résultat par
la forte présence de prédateurs et d'herbivores de grande taille
dans la réserve.
En ce qui concerne l'indice de Shannon, il n'y a pas de
différence significative entre l'AMP de Bamboung et le bolon de Sangako.
Le résultat de la comparaison de l'indice de Shannon est similaire
à celui obtenu par Garcia-Rubies et Zabala (1990) qui ont montré
un indice de Shannon égal entre l'intérieur et l'extérieur
de l'aire protégée des iles Mèdes en Espagne. Selon ces
auteurs, ce résultat s'explique par la forte occurrence de certaines
espèces. L'indice de Shannon varie entre 0 et 3.9 dans l'AMP de Bamboung
et entre 0 et 3.7 dans le bolon de Sangako. Les valeurs moyennes
observées dans l'AMP de Bamboung (1.7#177;0.2) et dans le bolon de
Sangako (1.9#177;0.4) traduisent un peuplement dominé par une seule
espèce dans chaque site. La structure des peuplements de poissons est
identique dans les deux sites d'étude. L'indice de Shannon est plus
variable en amont et plus élevé au niveau de la station la plus
profonde (Bd) dans l'AMP de Bamboung. Il affiche une tendance à la
baisse de l'amont vers l'aval dans le bolon de Sangako et sa variabilité
y est plus forte vers l'aval. La
48
quasi-totalité des effectifs est concentrée sur
E. fimbriata (68% de l'effectif total) dans l'AMP de Bamboung et sur
E. fimbriata (45% de l'effectif total) et S. maderensis (33%
de l'effectif total) dans le bolon de Sangako.
Les valeurs de l'équitabilité de Simpson sont en
moyenne proches de 1 dans l'AMP de Bamboung comme dans le bolon de Sangako
(Tab. 10). Elles traduisent un peuplement de poissons composé en
majorité d'espèces ayant la même abondance dans les deux
sites. En effet, mis à part E. fimbriata et S. maderensis,
le reste du peuplement est composé d'espèces ayant une
abondance faiblement différente dans les deux.
Pour ce qui est de l'indice de Simpson, il n'y a pas de
différence significative entre l'AMP de Bamboung et le bolon de Sangako.
L'indice de Simpson varie de la même façon que l'indice de
Shannon. Les valeurs moyennes sont de 0.7#177;0.2 dans l'AMP de Bamboung et de
0.8#177;0.1 dans le bolon de Sangako et traduisent une plus grande
diversité biologique dans le bolon de Sangako que dans l'AMP de
Bamboung. Sa variabilité en amont et en aval de l'AMP traduit un
peuplement hétérogène en amont et en aval. Dans le bolon
de Sangako, le peuplement est plus hétérogène en aval.
4.3. Répartition spatiale des peuplements de
poissons
Les résultats de l'analyse factorielle ont
montré un gradient amont aval beaucoup plus net dans le bolon de Sangako
que dans l'AMP de Bamboung. Dans l'AMP de Bamboung, le gradient amont aval est
faussé par la position de la station Bd situé au centre de l'AMP
de Bamboung. Cette position extrême de la station Bd s'expliquerait par
sa profondeur qui est plus importante que celle des autres stations. Dans l'AMP
de Bamboung, le peuplement est très différent entre l'amont et
l'aval. De même, dans le bolon de Sangako on distingue un peuplement
amont et un peuplement aval. Ces différences de peuplement entre l'amont
et l'aval de chaque site sont attribuables à la profondeur mais surtout
à l'abondance des espèces. L'analyse de la répartition
spatiale des peuplements montre que les deux sites ont un peuplement
différent lié surtout à la différence de
diversité et à la variabilité de l'abondance. Pour mieux
cerner la différence de peuplement de poissons entre les deux sites, une
analyse factorielle des correspondances simples basée uniquement sur les
espèces communes aux deux sites a été effectuée.
Les résultats de cette analyse ont montré que les principales
espèces responsables de cette différence de répartition
spatiale sont : A. latiscutatus, P. perotoei, P. macrolepus et L.
falcipinnis (plus abondantes dans l'AMP de Bamboung) et S. maderensis
E. melanopterus, G. nigri, L. dumerili (plus abondantes dans le
bolon de Sangako). Le peuplement de l'AMP de Bamboung est beaucoup plus
variable que celui du bolon de
49
Sangako. La forte variabilité observée dans
l'AMP de Bamboung est liée à la variation d'abondance de son
peuplement qui est beaucoup plus importante que celle du peuplement du bolon de
Sangako.
Du point de vue écologique, le peuplement de l'AMP de
Bamboung est un peuplement à affinité marine dominé par
les ME et les Em alors que le peuplement du bolon de Sangako dominé par
les ME, les Em et les Es est caractérisé par la présence
de la forme continentale (Ec). Les catégories estuariennes d'origine
marine (Em), les marines estuariennes (ME) et estuariennes strictes (Es) sont
largement réparties dans l'AMP de Bamboung comme dans le bolon de
Sangako. Les marines accessoires sont caractéristiques des zones aval
dans les deux sites. L'analyse comparée des catégories
écologiques a mis en évidence une différence entre les
deux sites qui s'explique par la différence d'abondance. En effet, le
peuplement amont de l'AMP de Bamboung est identique au peuplement aval du bolon
de Sangako. Par contre le peuplement aval de l'AMP de Bamboung est
différent du peuplement amont du bolon de Sangako exception faite de la
catégorie Mo.
L'étude de la structure trophique a permis de constater
une prédominance des prédateurs dans l'AMP de Bamboung et une
prédominance des microphages dans le bolon de Sangako. Un
résultat similaire est obtenu par Roberts et Hawkins (1997) qui ont
montré une biomasse plus importante dans la réserve qu'en dehors
de la réserve d'Anse Chastanet aux Caraïbes. Ils ont
expliqué ce résultat par la forte présence de
prédateurs de grande taille venus des zones de pêche.
L'étude de la répartition spatiale montre que
l'aval de l'AMP de Bamboung est dominé par les prédateurs
piscivores (p2-pi) alors que l'amont est dominé par les herbivores
détritivores (he-ph). La partie centrale est caractérisée
par les prédateurs de premier niveau à prédominance
benthophage (p1-bt) et les prédateurs de deuxième niveau
généralistes (p2-ge). Dans le bolon de Sangako, l'aval est
dominé par les he-ph suivis des prédateurs de premier niveau
à prédominance benthophage alors que l'amont est
caractérisé par les p2-pi. D'où une répartition
spatiale des catégories trophiques différente entre les deux
sites. L'analyse comparée de la répartition des catégories
trophiques a mis en évidence une différence entre les deux sites.
L'AMP de Bamboung est caractérisée par une importante abondance
de prédateurs alors que le bolon de Sangako est
caractérisé par une importante abondance de microphages.
L'étude des structures en taille a montré un
peuplement divisé en deux groupes d'individus : des individus de 4
à 21 cm plus abondants dans le bolon de Sangako et des individus de plus
de 22 cm plus abondants dans l'AMP de Bamboung. Les poissons les plus
50
gros étant bien souvent pêchés, une des
caractéristiques des zones exploitées est une modification
profonde de la structure de taille de la communauté. Ce qui justifie la
prédominance des individus de grande taille dans l'AMP de Bamboung.
Gracia-Rubies et Zabala (1990) ont étudié la structure des
peuplements de poissons d'un site protégé et de deux sites non
protégés dans les îles Medes en Espagne. Ils ont
trouvé un peuplement de poisson composé d'individus de grande
taille et moins abondants dans la zone protégée et un peuplement
composé d'individus de petite taille et plus abondants dans les zones
non protégées. Dans le Parc marin de Ningaloo à l'Ouest de
l'Australie, la taille du peuplement de poissons est plus importante dans la
réserve marine que dans la zone de pêche récréative
d'après Westera et al. (2003).
La droite d'ajustement du spectre de taille est plus raide
pour le bolon de Sangako que pour l'AMP de Bamboung. Les pentes des deux
spectres sont différentes. La valeur absolue de la pente du spectre de
taille de l'AMP Bamboung est supérieure à celle du spectre de
taille du bolon de Sangako. Cela s'explique par un régime d'exploitation
différente (Pope et al., 2006). Dans l'AMP de Bamboung, le peuplement de
poisson bénéficie d'une protection alors que dans le bolon de
Sangako le peuplement est soumis à une exploitation. Ce résultat
traduit aussi le fait que la pêche a ciblé les gros individus dans
le bolon de Sangako et a permis un relâchement de la prédation sur
les individus de petite taille. Ce qui permet d'expliquer une composition du
peuplement de poissons avec plus d'individus de taille supérieure
à 22 cm dans l'AMP de Bamboung. Dans la réserve des îles
Mèdes en Espagnes, Garcia-Rubies et Zabala (1990) ont trouvé une
structure de taille des peuplements de poissons vulnérables très
différente entre les réserves et les zones non
protégée. Ils ont expliqué cette différence de
structure de taille par l'effet réserve. L'effet de l'environnement
étant le même dans les deux sites, la différence des
profils de composition en taille explique bien la prédominance des
espèces de grande taille dans l'AMP de Bamboung. Bianchi et al. (2000)
ont observé une tendance à la décroissance de la pente du
spectre de taille, en particulier dans les écosystèmes de haute
latitude. Cette décroissance serait liée à un niveau
d'exploitation croissant, provoquant des changements dans la composition en
taille des communautés (augmentation relative de l'abondance dans les
classes de petite taille). Ils rajoutent que la pente et l'intercepte
permettent de répondre constamment au changement du niveau
d'exploitation d'un écosystème. Une pente plus raide signifie une
activité de pêche intense alors qu'une pente plus plate signifie
une faible activité de pêche. La pente du spectre de taille est
liée au niveau d'exploitation par la pêche. Selon Gislason et Rice
(1998), la pente du spectre de taille est proportionnelle à la
mortalité par pêche.
51
5. CONCLUSION ET PERSPECTIVES
Les deux sites étudiés ont un environnement
aquatique homogène du fait de leur proximité et de leur ouverture
sur le Diomboss. Leur choix pour répondre à la question
posé dans cette étude est pertinent. Les peuplements de poissons
des deux sites sont différents du point de vue abondance, biomasse,
richesse spécifique, niveau trophique moyen, taille moyenne
observée et taille maximale observée. Par contre, les indicateurs
synthétiques (indice de Shannon, indice de Simpson et
équitabilité de Simpson) ne différent pas entre les deux
sites. Le peuplement de poissons est plus abondant dans le bolon de Sangako que
dans l'AMP de Bamboung. Les poissons sont plus abondants au niveau des stations
centrales de l'AMP de Bamboung. L'instabilité du peuplement de poissons
de l'AMP de Bamboung serait à l'origine de la différence
significative de la richesse spécifique en faveur du bolon de Sangako.
L'importante biomasse observée dans l'AMP de Bamboung,
corrélée avec sa faible abondance par rapport au bolon de
Sangako, s'explique par le retour de gros prédateurs qui occasionne un
phénomène de prédation accrue. On assiste alors à
une situation semblable à l'effet cascade. La comparaison du niveau
trophique moyen, de la taille moyenne et de la taille maximale des peuplements
en faveur de l'AMP de Bamboung confirme la prédominance d'un peuplement
composé en majorité de prédateurs ichtyophages de haut
niveau trophique. L'étude comparative de la répartition spatiale
des peuplements de poissons des deux sites d'étude a montré des
modifications et des différences attribuables à l'effet
réserve. L'aval de l'AMP de Bamboung (zone plus profonde) est
dominé par des espèces prédatrices alors que l'amont
(moins profond) est caractérisé par des espèces proies.
Cette répartition spatiale du peuplement peut s'expliquer par le statut
de protection de l'AMP de Bamboung. La répartition des espèces
prédatrices est plus large dans le site non protégé que
dans le site protégé.
Du point de vue écologique et trophique, il y a une
différence sur la composition et la distribution spatiale des
peuplements de poissons entre les deux sites. L'étude de la structure en
taille montre des peuplements différents entre l'AMP de Bamboung et le
bolon de Sangako.
Aux vues de tous ces résultats, l'AMP de Bamboung
apparait comme étant un conserve écologique dans ce vaste
écosystème estuarien du Sine-Saloum. Sa création peut
être considérée comme un moyen de gestion des ressources
halieutiques. Pour mieux démontrer le rôle de l'AMP de Bamboung,
il serait intéressant d'étudier son impact sur
l'amélioration de la reproduction. Dans la zone d'aménagement
marine de Soufrière, Valles et al. (2001) ont démontré un
approvisionnement en larves de la zone de pêche de Grand Caille
52
par la réserve marine d'Anse Chastanet.
L'émigration des poissons vers l'extérieur et l'augmentation du
recrutement larvaire sont aussi des aspects à démontrer pour
comprendre encore plus le rôle de l'AMP de Bamboung. Aux Bahamas,
Chiappone et Sealey (2000) ont montré que la réserve d'Exuma Cays
Land and Sea Park est une importante source de larves pour les zones adjacentes
de l'écosystème d'Exuma Sound. Ils ont aussi montré une
émigration d'adultes de poissons de la réserve vers les zones de
pêche. Telles sont autant de pistes qui permettront de cerner d'avantage
la place de l'AMP de Bamboung dans l'écosystème du
Sine-Saloum.
53
REFERENCES BIBLIOGRAPHIQUES
Albaret J.J., 1999. Les peuplements des
estuaires et des lagunes. In: Les Poissons des Eaux continentales
africaines. Diversité, Écologie, Utilisation par l'Homme
(Lévêque C. & D. Paugy, eds), pp. 325-344. Paris : IRD.
Albaret J.J., 2004. Suivi biologique des
peuplements de poissons d'une aire protégée en zone de mangrove :
le bolon de Bamboung (Sine-Saloum, Sénégal). Rapport
d'étape. Rapport de convention Narou Heuleuk/ AFD/ IRD, Dakar,
juillet 2004. 18 pp.
Albaret J.J., Simier M. et Sadio O., 2005.
Suivi biologique des peuplements de poissons d'une aire
protégée en zone de mangrove : le bolon de Bamboung (Sine-Saloum,
Sénégal). Rapport final. Rapport de convention Narou
Heuleuk/ AFD/ IRD, Dakar, juillet 2005. 80 pp. Alcala A.C. et Russ
G.R., 1990. A direct test of the effects of protective management
on abundance and yield of tropical marine resources. ICES Journal of
Marine Science 46, 40-47. Bell J.D., 1983.
Effects of depth and marine reserve fishing restrictions on the structure
of a rocky reef fish assemblage in the north-western Mediterranean sea.
Journal of Applied Ecology 20, 357-369.
Bianchi G., Gislason H., Graham K., Hill L., Jin X.,
Koranteng K., Manickchand-Heileman S., Paya'I., Sainsbury K., Sanchez F. et K.
Zwanenburg Z., 2000. Impact of Fishing on Size Composition and
Diversity of Demersal Fish Communities. ICES Journal of Marine Science
57, 558-571.
Bousso T., 1996. La pêche
artisanale dans l'estuaire du Sine-Saloum (Sénégal) : Approches
typologiques des écosystèmes d'exploitation. Thèse de
Doctorat en Science, Université. Montpellier II, France, 293 p.
Cazalet B. 2004. Les aires marines
protégées à l'épreuve du sous développement
en Afrique de l'Ouest. VertigO. La revue électronique en science de
l'environnement 5, 3, 15 p. Charles-Dominique E.,
1989. Catch Efficiencies of Purse and Beach Seines in Ivory Coast
Lagoons. Fishery Bulletin, U.S. 87, 911-921.
Château O. et Wantiez L., 2005.
Comparaison de la structure des communautés de poissons
coralliens d'intérêt commercial entre une réserve marine et
deux zones non protégées dans le Parc du lagon sud de
Nouvelle-Calédonie. Cybium 29, 159-174.
Chiappone M. et Sealey K.M.S., 2000.
Marine reserve design criteria and measures of success: lessons learned
from the Exyma Cays Land and Sea Park, Bahamas. Bulletin of Marine
Sciences 66, 691-705.
54
Côté I.M., Mosquera I. et Reynolds J.D.,
2001. Effects of marine reserve characteristics on the
protection of fish populations: a meta-analysis. Journal of Fish Biology
59, 178-189. D'Onghia G., Tursi A., Maiorano P.,
Matarrese A. et Panza P., 1998. Demersal fish assemblages from the
bathyal grounds of the Ionian Sea (middle-eastern Mediterranean). Italian
Journal of Zoology, 65:S1, 287-292.
D'Onghia, G., Maiorano P., Capezzuto F., Carlucci R.,
Battista D., Giove A., Sion L. et Tursi A., 2009. Further
evidences of deep-sea recruitment of Aristeus antennatus (Crustacea, Decapoda)
and its role in the population renewal on the exploited bottoms of the
Mediterranean. Fisheries Research 95, 236-245.
Diouf P.S., 1996. Les peuplements en
poissons des milieux estuariens de l'Afrique de l'Ouest : l'exemple de
l'estuaire hyperhalin du Sine-Saloum. Thèse de Doctorat
Université Montpellier II, France, 267 p.
Edgar G.J. et Barrett N.S., 1999. Effects
of the declaration of marine reserves on Tasmanian reef fishes, invertebrates
and plants. Journal of Experimental Marine Biology and Ecology
242, 107-144.
Evans R.D. et Russ G.R., 2004. Larger
biomass of targeted reef fish in no-take marine reserves on the Great Barrier
Reef. Aquatic Conservation: Marine and Freshwater Ecosystems
14, 505-519.
Field J.G., Clarke K.R. et Warwick R.M.,
1982. A practical strategy for analyzing multispecies distribution
patterns. Marine Ecology-Progress Series 8, 37-52.
Floeter S., Halpern B.S. et Ferreira C.,
2006. Effects of fishing and protection on Brazilian reef
fishes. Biological Conservation 128, 391-402.
Francour P., 2000. Evolution
spatio-temporelle à long terme des peuplements de poissons des herbiers
à Posidonia oceanica de la réserve naturelle de Scandola (Corse,
Méditerranée nord-occidentale), Cybium 24,
85-95.
Garcia-Charton J.A., Pérez-Ruzafa A.,
Sanchez-Jerez P., Bayle-Sempere J.T., Renones O. et Moreno D., 2004.
Multi-scale spatial heterogeneity, habitat structure, and the
effect of marine reserves on Western Mediterranean rocky reef fish
assemblages. Marine Biology 144, 161-182.
Garcia-Rubiés A. et Zabala M., 1990.
Effects of total fishing prohibition on the rocky fish assemblages of Medes
Islands marine reserve (NW Mediterranean). Scientia Marina
54, 317328.
Gell F.R. et Roberts C.M., 2003. Benefits
beyond boundaries: the fishery effects of marine reserves. Trends in
Ecology and Evolution 18, 448-445.
55
Gislason H. et Rice J. 1998. Modelling the
response of size and diversity spectra of fish assemblages to changes in
exploitation. ICES Journal of Marine Science 55, 362-370.
Graham N.A.J., Evans R.D. et Russ G.R., 2003. The effects
of marine reserve protection on the trophic relationships of reef fishes on the
Great Barrier Reef. Environmental Conservation 30,
200-208.
Halpern B.S., 2003. The impact of marine
reserves: Do reserves work and does reserve size matter? Ecological
Applications 13, S117-S137.
Halpern B.S. et Warmer R.R., 2002. Marine
reserves have rapid and lasting effects. Ecology Letters
5: 361-366.
Harmelin-Vivien M., Le Direach L., Bayle-Sempere J.,
Charbonnel E., Garcia-Charton J.A., Odyf D., Pérez-Ruzafa A., Renones
O., Sanchez-Jerez P. et Valle C., 2008. Gradients of abundance and
biomass across reserve boundaries in six Mediterranean marine protected areas:
evidence of fish spillover? Biological Conservation 141,
1829-1839.
Jones J.P., Srinivasan M. et Almany G.R.,
2007. Population Connectivity and Conservation of Marine
Biodiversity. Oceanography 20, 100-110.
Jouvenel J.Y. et Pollard D.A., 2001. Some
effects of marine reserve protection on the population structure of two
spearfishing target fish species, Dicentrarchus labrax (Moronidae) and Sparus
aurata (Sparidae), in shallow inshore waters, along a rocky coast in the
northwestern Mediterranean Sea. Aquatic Conservation: Marine and
Freshwater Ecosystems 11, 1-9.
Kelleher G., 1999. Guidelines for marine
protected areas. World Conservation Union, Gland, Switzerland, 107 p.
Kellner J.B., Tetreault I., Gaines S.D. et Nisbet R.M.,
2007. Fishing the line near marine reserves in single and
multispecies fisheries. Ecological Applications 17,
1039-1054. Legendre L. et Legendre P., 1984. Ecologie
numérique, Tome 1. Le traitement multiple des données
écologiques. Masson, Paris : 260 pp.
Lester S.E., Halpern B.S., Grorud-Colvert K.,
Lubchenco J., Ruttenberg B.I., Gaines S.D., Airame S. et Warner R.R., 2009.
Biological effects within no-take marine reserves: a global
synthesis. Marine Ecology Progress Series 384, 33-46.
McClanahan T.R., Muthiga N.A., Kamakuru A.T., Machano
H. et Kiambo R.W., 1999. The effects of marine parks and fishing
on coral reefs of northern Tanzania. Biological Conservation
89, 161-182.
56
McClanahan T.R. et Mangi S.C., 2004.
Gear-based management of a tropical artisanal fishery based on
species selectivity and capture size. Fisheries Management and Ecology
11, 51-60.
Mosquera I., Côté I.M., Jennings S. et
Reynolds J.D., 2000. Conservation benefits of marine reserves for
fish populations. Animal Conservation 4, 321-332.
Pinnergar J.K., Polunin N.V.C., Francour P.,
Badalamenti F., Chamello R., Harmelin-Vivien M.L., Hereu B., Milazzo M., Zabala
M., D'Anna G. et Pipitone C., 2000. Trophic cascades in benthic
marine ecosystems: lessons for fisheries and protected-area management.
Environmental Conservation 27, 179-200.
Pope J.G., Rice J.C., Daan N., Jennings S. et Gislason
H., 2006. Modelling an exploited marine fish community with 15
parameters e results from a simple size-based model. ICES Journal of
Marine Science 63, 1029-1044.
Roberts C.M. et Hawkins J.P., 1997. How
small can a marine reserve be and still be effective? Coral Reefs
16, 150.
Rowe S., 2002. Population parameters of
American lobster inside and outside no-take reserves in Bonavista Bay,
Newfoundland. Fisheries Research 56, 167-175.
Russ G.R., Alcala A.C. et Maypa A.P., 2003.
Spillover from marine reserves: the case of Naso vlamingii at Apo
Island, the Philippines. Marine Ecology-Progress Series
264, 15-20. Schroeder D.M. et Love M.S.,
2002. Recreational fishing and marine fish populations in
California. California Cooperative Oceanic Fisheries Investigations
Reports 43, 182-190. Simier M., Blanc L., Aliaume C.,
Diouf P.S. et Albaret J.J., 2004. Spatial and temporal structure
of fish assemblages in an «inverse estuary'Ç the Sine-Saloum system
(Senegal). Estuarine, Coastal and Shelf Science 59,
69-86.
Stobart B., Warwick R., Gonzalez C., Mallol S., Diaz
D., Renones O. et Goñi R., 2009. Long-term and spillover
effects of a marine protected area on an exploited fish community. Marine
Ecology-Progress Series 384, 47-60.
Thioulouse J., Chessel D., Doleadec S. et Olivier
J.M., 1997. ADE-4: a multivariate analysis and graphical
display software. Statistic and computing 7, 75-83.
Tito de Morais L., Simier M., Raffray J. et Sadio O.,
2007. Suivi biologique des peuplements de poissons d'une aire
protégée en zone de mangrove : le bolon de Bamboung (Sine-Saloum,
Sénégal). Rapport final. Rapport de convention
Narou Heuleuk/ AFD/ IRD, Dakar, juillet 2005. 23 pp.
57
Valles H., Sponaugle S. et Oxenford H.A.,
2001. Larval supply to a marine reserve and adjacent fished area
in the Soufrière Marine Management Area, St Lucia, West Indies.
Journal of Fish Biology 59, 152-177.
Westera M., Lavery P. et Hyndes G., 2003.
Differences in recreationally targeted fishes between protected and fished
areas of a coral reef marine park. Journal of Experimental Marine Biology
and Ecology 294, 145-168.
Willis T.J., Millar R.B. et Babcock R.C.,
2003. Protection of exploited fishes in temperate regions: high
density and biomass of snapper Pagrus auratus (Sparidae) in northern New
Zealand marine reserves. Journal of Applied Ecology 40,
214-227.
Yemane D., Shin
Y-J. et Field G.J.,
2008. Exploring the effect of Marine Protected Areas on the
dynamics of fish communities in the southern Benguela: an individual-based
modeling approach. ICES Journal of Marine Science 66,
378-387.

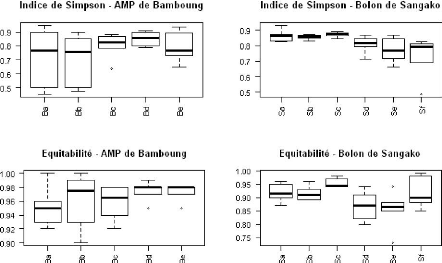
58
ANNEXE
Annexe1: Variabilité spatiale des
indices synthétiques : indice de Shannon, indice de Simpson et
équitabilité dans les deux sites d'étude.
59
Annexe 2 : Liste générale des
espèces capturées dans l'AMP de Bamboung et le bolon de Sangako
en 2008-2009.
|
Espèce
|
Code espèce
|
Catégorie écologique
|
Catégorie trophique
|
|
Alectis alexandrinus
|
SAL
|
Marine occasionnelle
|
Prédateur de premier niveau généraliste
(crustacés, insectes)
|
|
Argyrosomus regius
|
ARE
|
Marine occasionnelle
|
Prédateur de deuxième niveau à
prédominance piscivore
|
|
Arius heudelotii
|
AHE
|
Marine-estuarienne
|
Prédateur de deuxième niveau
généraliste (poisson et autres proies)
|
|
Arius latiscutatus
|
AGA
|
Marine-estuarienne
|
Prédateur de deuxième niveau
généraliste (poisson et autres proies)
|
|
Arius parkii
|
ARP
|
Marine-estuarienne
|
Prédateur de deuxième niveau
généraliste (poisson et autres proies)
|
|
Batrachoides liberiensis
|
BLI
|
Marine accessoire
|
Prédateur de deuxième niveau
généraliste (poisson et autres proies)
|
|
Brachydeuterus auritus
|
BAU
|
Marine-estuarienne
|
Prédateur de premier niveau généraliste
(crustacés, insectes)
|
|
Caranx hippos
|
CHI
|
Marine-estuarienne
|
Prédateur de deuxième niveau
généraliste (poisson et autres proies)
|
|
Chaetodipterus lippei
|
CLI
|
Marine accessoire
|
Prédateur de premier niveau généraliste
(crustacés, insectes)
|
|
Chloroscombrus chrysurus
|
CHL
|
Marine-estuarienne
|
Prédateur de premier niveau généraliste
(crustacés, insectes)
|
|
Citharichthys stampflii
|
CST
|
Estuarienne d'origine marine
|
Prédateur de deuxième niveau
généraliste (poisson et autres proies)
|
|
Cynoglossus senegalensis
|
CYS
|
Estuarienne d'origine marine
|
Prédateur de premier niveau à prédominance
benthophage (mollusques, vers)
|
|
Dasyatis margaritella
|
DAM
|
Estuarienne d'origine marine
|
Prédateur de premier niveau à prédominance
benthophage (mollusques, vers)
|
|
Dicentrarchus punctatus
|
DPU
|
Marine occasionnelle
|
Prédateur de deuxième niveau
généraliste (poisson et autres proies)
|
|
Drepane africana
|
DAF
|
Marine-estuarienne
|
Prédateur de premier niveau généraliste
(crustacés, insectes)
|
|
Elops lacerta
|
ELA
|
Marine-estuarienne
|
Prédateur de deuxième niveau à
prédominance piscivore
|
|
Elops senegalensis
|
ELS
|
Marine accessoire
|
Prédateur de deuxième niveau à
prédominance piscivore
|
|
Ephippion guttifer
|
EGU
|
Marine-estuarienne
|
Prédateur de premier niveau à prédominance
benthophage (mollusques, vers)
|
|
Epinephelus aeneus
|
EAE
|
Marine-estuarienne
|
Prédateur de deuxième niveau à
prédominance piscivore
|
|
Ethmalosa fimbriata
|
EFI
|
Estuarienne d'origine marine
|
Herbivore à prédominance phytoplanctonophage ou
microphytophage
|
|
Eucinostomus melanopterus
|
GME
|
Marine-estuarienne
|
Prédateur de premier niveau généraliste
(crustacés, insectes)
|
60
Galeoides decadactylus
|
GDE
|
Marine-estuarienne
|
Prédateur de deuxième niveau
généraliste (poisson et autres proies)
|
|
Gerres nigri
|
GNI
|
Estuarienne stricte
|
Prédateur de premier niveau généraliste
(crustacés, insectes)
|
|
Hemicaranx bicolor
|
AAM
|
Marine occasionnelle
|
Prédateur de deuxième niveau
généraliste (poisson et autres proies)
|
|
Hemichromis fasciatus
|
HFA
|
Estuarienne d'origine continentale
|
Prédateur de deuxième niveau
généraliste (poisson et autres proies)
|
|
Hemiramphus brasiliensis
|
HBR
|
Estuarienne d'origine marine
|
Prédateur de deuxième niveau
généraliste (poisson et autres proies)
|
|
Ilisha africana
|
IAF
|
Estuarienne d'origine marine
|
Zooplanctonophagie dominante
|
|
Lichia amia
|
LIA
|
Marine accessoire
|
Prédateur de deuxième niveau
généraliste (poisson et autres proies)
|
|
Liza dumerili
|
LDU
|
Estuarienne d'origine marine
|
Herbivore détritivore ou brouteur
|
|
Liza falcipinnis
|
LFA
|
Estuarienne d'origine marine
|
Herbivore détritivore ou brouteur
|
|
Liza grandisquamis
|
LGR
|
Estuarienne d'origine marine
|
Herbivore détritivore ou brouteur
|
|
Lutjanus goreensis
|
LGO
|
Marine accessoire
|
Prédateur de deuxième niveau à
prédominance piscivore
|
|
Monodactylus sebae
|
PSB
|
Estuarienne stricte
|
Prédateur de deuxième niveau
généraliste (poisson et autres proies)
|
|
Mugil bananensis
|
MBA
|
Marine-estuarienne
|
Herbivore détritivore ou brouteur
|
|
Mugil cephalus
|
MCE
|
Marine-estuarienne
|
Herbivore détritivore ou brouteur
|
|
Mugil curema
|
MCU
|
Estuarienne d'origine marine
|
Herbivore détritivore ou brouteur
|
|
Pegusa triophthalma
|
PTR
|
Marine accessoire
|
Prédateur de premier niveau à prédominance
benthophage (mollusques, vers)
|
|
Plectorhinchus macrolepis
|
PLM
|
Estuarienne d'origine marine
|
Prédateur de deuxième niveau
généraliste (poisson et autres proies)
|
|
Polydactylus quadrifilis
|
POQ
|
Marine-estuarienne
|
Prédateur de deuxième niveau à
prédominance piscivore
|
|
Pomadasys incisus
|
PIN
|
Marine accessoire
|
Prédateur de premier niveau à prédominance
benthophage (mollusques, vers)
|
|
Pomadasys jubelini
|
PJU
|
Estuarienne d'origine marine
|
Prédateur de premier niveau à prédominance
benthophage (mollusques, vers)
|
|
Pomadasys perotoei
|
PPE
|
Estuarienne d'origine marine
|
Prédateur de premier niveau à prédominance
benthophage (mollusques, vers)
|
|
Pseudotolithus elongatus
|
PEL
|
Estuarienne d'origine marine
|
Prédateur de deuxième niveau
généraliste (poisson et autres proies)
|
|
Pseudotolithus senegallus
|
PBR
|
Marine-estuarienne
|
Prédateur de deuxième niveau
généraliste (poisson et autres proies)
|
61
Pseudotolithus typus
|
PTY
|
Marine-estuarienne
|
Prédateur de deuxième niveau
généraliste (poisson et autres proies)
|
|
Remora remora
|
RRE
|
Marine occasionnelle
|
|
|
Sardinella aurita
|
SAU
|
Marine accessoire
|
Zooplanctonophagie dominante
|
|
Sardinella maderensis
|
SEB
|
Marine-estuarienne
|
Zooplanctonophagie dominante
|
|
Sarotherodon melanotheron
|
THE
|
Estuarienne stricte
|
Herbivore à prédominance phytoplanctonophage ou
microphytophage
|
|
Sphoeroides spengleri
|
SSP
|
Marine occasionnelle
|
Prédateur de premier niveau à prédominance
benthophage (mollusques, vers)
|
|
Sphyraena afra
|
SPI
|
Marine-estuarienne
|
Prédateur de deuxième niveau à
prédominance piscivore
|
|
Synaptura cadenati
|
SCA
|
Marine occasionnelle
|
Prédateur de premier niveau à prédominance
benthophage (mollusques, vers)
|
|
Synaptura lusitanica
|
SLU
|
Marine accessoire
|
Prédateur de premier niveau à prédominance
benthophage (mollusques, vers)
|
|
Tilapia guineensis
|
TGU
|
Estuarienne stricte
|
Herbivore détritivore ou brouteur
|
|
Torpedo sp
|
TOR
|
Marine occasionnelle
|
Prédateur de deuxième niveau
généraliste (poisson et autres proies)
|
|
Trachinotus teraia
|
TFA
|
Estuarienne d'origine marine
|
Prédateur de premier niveau à prédominance
benthophage (mollusques, vers)
|
|
Trichiurus lepturus
|
TLE
|
Marine-estuarienne
|
Prédateur de deuxième niveau à
prédominance piscivore
|
|
Tylosurus crocodilus
|
TCR
|
Marine occasionnelle
|
Prédateur de deuxième niveau à
prédominance piscivore
|
62
Annexe 3 : Liste des 11 nouvelles espèces
recensées dans l'AMP de Bamboung en 2008-2009.
|
Famille
|
Espèce
|
code
|
Catégorie
écologique
|
Catégorie
trophique
|
|
Carangidae
|
Hemicaranx bicolor
|
AAM
|
Mo
|
p2-ge
|
|
Ariidae
|
Arius heudelotii
|
AHE
|
ME
|
p2-ge
|
|
Sciaenidae
|
Argyrosomus regius
|
ARE
|
Mo
|
p2-pi
|
|
Paralichthyidae
|
Citharichthys stampflii
|
CST
|
Em
|
p2-ge
|
|
Drepaneidae
|
Drepane africana
|
DAF
|
ME
|
p1-mc
|
|
Hemiramphidae
|
Hemiramphus brasiliensis
|
HBR
|
Em
|
p2-ge
|
|
Sciaenidae
|
Pseudotolithus senegallus
|
PBR
|
ME
|
p2-ge
|
|
Pseudotolithus typus
|
PTY
|
ME
|
p2-ge
|
|
Echeneidae
|
Remora remora
|
RRE
|
M
|
|
|
Soleidae
|
Synaptura lusitanica
|
SLU
|
Ma
|
p1-bt
|
|
Trichiuridae
|
Trichiurus lepturus
|
TLE
|
ME
|
p2-pi
|
|
Torpedinidae
|
Torpedo sp
|
TOR
|
M
|
p2-ge
|
69
Sujet : Comparaison des peuplements de
poissons entre une aire marine protégée (le bolon de Bamboung) et
un site non protégé (le bolon de Sangako) dans l'estuaire du
Sine-Saloum (Sénégal).
Nom : Oumar SADIO
Nature du document : Mémoire de Master
II, soutenu le 30 mai 2012
Président : Mr. Omar Thiom THIAW
Professeur Titulaire (U.C.A.D)
Membres : MM. Youssouph DIATTA Chercheur
(IFAN/U.C.A.D)
Malick DIOUF Maître-assistant (IUPA/U.C.A.D)
Jean-Marc
ECOUTIN Chercheur (LEMAR/IRD)
Alassane SARR Assistant (IUPA/U.C.A.D)
Résumé
Le peuplement de poissons de l'Aire Marine
Protégée de Bamboung a été comparé à
celui du bolon de Sangako. Les données traitées dans la cadre de
cette étude sont récoltées au cours de 6 campagnes de
pêche expérimentale effectuées dans 5 stations de l'AMP de
Bamboung et 6 stations du bolon de Sangako entre 2008 et 2009.
Cette étude est menée suivant trois approches :
une étude descriptive univarié et multivariée , une
étude comparative des paramètres abiotiques et des indicateurs
bioécologiques d'une part et d'autre part une étude comparative
de l'organisation spatiale des peuplements de poissons des deux sites
d'étude.
Les paramètres abiotiques observés et
comparés sont la salinité, la transparence, la
température, le pourcentage de saturation en oxygène dissous et
la profondeur. Les résultats ont montré deux sites
homogènes du point de vue physico-chimique. Les résultats de la
comparaison des indicateurs biologiques ont montré une différence
significative de l'abondance et de la richesse spécifique en faveur du
bolon de Sangako. Par contre, la biomasse, le niveau trophique moyen, la taille
moyenne observée et la taille maximale observée sont plus
importantes dans l'AMP de Bamboung. Les indices synthétiques (indice de
Shannon, indice de Simpson et équitabilité) ne différent
pas significativement en fonction des sites d'étude.
Le peuplement de poissons de l'AMP de Bamboung est instable,
hétérogène, dominé en abondance par E.
fimbriata (67,7%) et en biomasse par A. latiscutatus (48.7%).
C'est un peuplement à affinité marine (ME - 45% et Em - 32%),
caractérisé par des prédateurs (83%) et des individus de
taille supérieure à 22 cm. Le peuplement du bolon de Sangako est
plus stable, moins hétérogène, dominé en abondance
comme en biomasse par E. fimbriata (43.8% de l'abondance totale et
34.6% de la biomasse totale) et par S. maderensis (32.7% de
l'abondance totale et 23.9% de la biomasse totale). C'est un peuplement
à tendance estuarienne, caractérisé par la présence
de forme continentale (Hemichromus fasciatus), réparti suivant
un gradient amont aval, caractérisé par des microphages et des
individus de taille inférieure à 22 cm.
Les différences observées tant du point de vue
des indicateurs biologiques que du point de vue de l'organisation spatiale du
peuplement de poissons peuvent s'expliquer par le statut de protection de l'AMP
de Bamboung. Cette dernière apparaît comme étant une
réserve écologique dans le vaste écosystème
estuarien du Sine-Saloum. Pour mieux connaître la place de l'AMP de
Bamboung dans le vaste écosystème de l'estuaire du Sine-Saloum,
il serait intéressant de mener des études sur le rôle que
jouerait l'AMP de Bamboung dans l'amélioration de la reproduction,
l'émigration des poissons vers l'extérieur et l'augmentation du
recrutement.
Mots clés : Aire Marine
Protégée, Indicateur bioécologique, Peuplement de
poissons, Sine-Saloum.
| 


