|
UNIVERSITE DE MONTPELLIER
FACULTE DE MEDECINE
MONTPELLIER-NIMES
MEMOIRE
Pour obtenir validation du
Diplôme Universitaire Plaies et
Cicatrisations
Promotion 2017-2018
Réalisé par
le Docteur Simon ABANADES
né le 08/05/1990
TITRE
Perfusions intraveineuses d'Iloprost : indications
retenues chez les patients
pris en charge en HAD dans les
départements de l'Hérault et du Gard
Sous la supervision du Pr DEREUR Olivier
2
TABLE DES MATIÈRES
GLOSSAIRE 4
INTRODUCTION 5
I - Problématisation 5
A - L'hôpital « à la maison » 5
B - Les plaies en HAD : un mode de prise en charge incontournable
5
C - L'Iloprost à domicile, c'est possible ! 5
D - L'Iloprost dans l'AOMI : une utilisation pratique sans preuve
formelle d'efficacité 6
II - Bases théoriques 7
A - Iloprost : données pharmacologiques issues de la
monographie Vidal® (7) 7
1 - Pharmacodynamie 7
2 - Pharmacocinétique 7
3 - Posologie et mode d'administration 8
a - Traitement de l'ischémie chronique
sévère des membres inférieurs 9
b - Traitement des phénomènes de Raynaud
sévère 10
4 - Indications 10
5 - Contre-indications 10
6 - Effets secondaires 11
B - Les données de la littérature sur
l'efficacité de l'Iloprost dans l'AOMI 11
1 - Stade de la claudication intermittente 11
2 - Stade des douleurs de repos et/ou des troubles trophiques
12
C - Les recommandations par les sociétés savantes
de l'utilisation de l'Iloprost dans
l'AOMI 12
1 - Recommandations nationales 12
a - HAS 2019 12
b - SFMV et SCVE 2020 (pre-print) 13
2 - Recommandations internationales 13
a - ACC/AHA 2011 13
b - ESC/ESVS 2017 13
c - ESVM 2019 13
III - Objectifs de l'étude 15
MATERIELS ET METHODES 16
I - Type d'étude 16
II - Population de l'étude 16
III - Analyse des données 16
RESULTATS 18
I - Les indications thérapeutiques à l'utilisation
des perfusions intraveineuses d'Iloprost 18
II - Autres données analysées 19
DISCUSSION 21
I - Discussion des résultats et comparaison à la
littérature 21
A - En ce qui concerne les indications retenues 21
B - En ce qui concerne les médecins prescripteurs 21
C - En ce qui concerne les durée d'utilisation 22
D - En ce qui concerne les débits de perfusion
utilisés 22
E - En ce qui concerne les effets indésirables 23
II - Forces et limites de l'étude 24
3
A - Limites 24
B - Forces 24
CONCLUSION 25
BIBLIOGRAPHIE 26
ANNEXES 29
ANNEXE I : Débits de perfusion de l'Iloprost 29
ANNEXE II : Effets indésirables selon la monographie du
VIDAL® 30
4
GLOSSAIRE
AOMI Artériopathie oblitérante
des membres inférieurs
ACC American College of Cardiology
AHA American Heart Association
EI Effets indésirables
ESC European Society of Cardiology
ESVM European Society of Vascular Medicine
ESVS European Society of Vascular Surgery
HAD Hospitalisation à domicile
MP Mode de prise en charge
NYHA New York Heart Association
SARS-CoV-2 Coronavirus 2 du syndrome
respiratoire aigu sévère
SCVE Société de Chirurgie
Vasculaire et Endovasculaire de Langue Française
SFMV Société Française
de Médecine Vasculaire
5
INTRODUCTION
I - Problématisation
A - L'hôpital « à la maison »
La prise en charge des patients en hospitalisation à
domicile (HAD) constitue une avancée majeure en terme d'offre de
santé. En effet, la saturation actuelle du système de
santé français que nous connaissons avec la pandémie
à SARS-CoV-2 a vu fleurir les demandes de prises en charge en HAD pour
désengorger les structures d'hospitalisation conventionnelle.
Depuis le début des années 2000, le recours
à l'HAD ne fait que progresser, passant de 35000 patients pris en charge
en 2006 à 116000 en 2017. (1)
B - Les plaies en HAD : un mode de prise en charge
incontournable
Le mode de prise en charge le plus fréquent en HAD est
le MP 09 « Pansements complexes et soins spécifiques (stomies
compliquées) », représentant 28% des prises en charge
durant l'année 2017. La durée moyenne des séjours pour ce
mode de prise en charge est de 46 jours, avec un coût moyen journalier de
200€. (1)
C - L'Iloprost à domicile, c'est possible !
Le MP 03 « Traitement intraveineux » est
également un mode de prise en charge régulièrement
rencontré en HAD, permettant l'administration de traitements issus de la
réserve hospitalière.
Les perfusions intraveineuses d'Iloprost sont largement
utilisées, à visée curative et de prévention de
l'apparition de nouveaux ulcères. (2)
Ainsi, dans un contexte de plaie chronique, les HAD sont
régulièrement sollicités pour réaliser des cures
d'Iloprost à domicile en plus de la prise en charge et du suivi des
plaies.
6
D - L'Iloprost dans l'AOMI : une utilisation pratique
sans preuve formelle d'efficacité
L'artériopathie oblitérante des membres
inférieurs (AOMI) est une grande pourvoyeuse de troubles trophiques,
touchant 800000 personnes en France (tous stades confondus) et responsable de
5000 amputations par an. Il s'agit donc d'une pathologie
régulièrement constatée chez les patients pris en charge
en HAD pour « pansements complexes ».
(3)
Bien que l'AMM précise « le traitement de
l'ischémie chronique sévère des membres inférieurs
chez les patients ayant un risque d'amputation et chez lesquels la
revascularisation par chirurgie ou angioplastie a échoué ou n'est
pas indiquée après confrontation médico-radio-chirurgicale
» comme indication thérapeutique aux perfusions intraveineuses
d'Iloprost, nombreuses sont les sociétés savantes nationales et
internationales ayant émis un avis défavorable à son
utilisation dans cette indication. (4-6)
Nous avons donc émis la question de recherche suivante
: Quels sont les indications retenues d'injections intraveineuses d'Iloprost
par les médecins prescripteurs d'HAD dans le cadre de troubles
trophiques cutanés dans les départements de l'Hérault et
du Gard ?
7
II - Bases théoriques
A - Iloprost : données pharmacologiques issues
de la monographie Vidal® (7)
1 - Pharmacodynamie
L'iloprost est un analogue de la prostacycline. Les effets
pharmacologiques suivants ont été observés :
· inhibition de l'agrégation plaquettaire, de
l'adhésion et de la sécrétion plaquettaires ;
· dilatation des artérioles et des veinules ;
· augmentation de la perfusion du réseau
capillaire nutritif et diminution de l'hyperperméabilité
vasculaire au niveau de la microcirculation ;
· activation de la fibrinolyse ;
· inhibition de l'adhésion et de la migration des
leucocytes après une lésion endothéliale ;
· diminution de la libération de radicaux libres
d'oxygène. Le mécanisme d'action exact n'est pas connu.
2 - Pharmacocinétique
L'état d'équilibre plasmatique de l'iloprost
est atteint dès 10 à 20 minutes après le début de
la perfusion IV. La concentration plasmatique atteinte lors de l'état
d'équilibre est proportionnelle au débit de perfusion : pour un
débit de perfusion de 3 ng/kg/min, elle se situe autour de 135 #177; 24
pg/ml. Les concentrations plasmatiques chutent très rapidement
après la fin de la perfusion, en raison d'une métabolisation
intense.
La clairance plasmatique est d'environ 20 #177; 5 ml/kg/min.
La demi-vie d'élimination plasmatique terminale est de 30 minutes ;
ainsi 2 heures après la fin de la perfusion, la concentration
plasmatique retombe à un niveau inférieur à 10 % de
l'état d'équilibre.
La pharmacocinétique de l'iloprost est
indépendante de l'âge ou du sexe des malades.
8
En revanche, en cas d'insuffisance hépatique
sévère ou d'insuffisance rénale chronique
nécessitant une épuration extrarénale, la clairance de
l'iloprost diminue de 2 à 4 fois.
L'interaction pharmacocinétique à type de
déplacement à partir des sites de liaison aux protéines
plasmatiques est improbable parce que le taux de liaison aux protéines,
en majeure partie à l'albumine, est relativement faible (60 %).
Un effet de l'iloprost sur la biotransformation d'autres
médicaments est aussi improbable en raison des voies métaboliques
du produit et de la faible dose administrée.
L'iloprost est complètement métabolisé,
essentiellement par ß-oxydation de la chaîne latérale
carboxylique. Le principal métabolite est le tétranor-iloprost
que l'on trouve dans l'urine sous forme de 4
diastéréo-isomères libres et conjugués. Le
tétranor-iloprost est pharmacologiquement inactif. L'excrétion
des métabolites se fait pour 80 % par voie urinaire et pour 20 % par
voie biliaire. Les métabolites sont éliminés du plasma et
de l'urine en deux phases, dont les demi-vies sont respectivement d'environ 2
et 5 heures (plasma) et 2 et 18 heures (urine).
L'Iloprost étant administré par voie IV, donc
directement dans le flux sanguin, est évidemment biodisponible à
100 %.
Bien qu'aucune étude clinique n'ait été
réalisée, les études in vitro du potentiel
inhibiteur de l'iloprost sur l'activité des enzymes du cytochrome P450
ont montré qu'aucune inhibition du métabolisme du
médicament par l'intermédiaire de ces enzymes n'est à
prévoir.
3 - Posologie et mode d'administration
L'iloprost doit être utilisé en milieu
hospitalier dans un service disposant du personnel et de l'équipement
permettant une surveillance étroite au cours du traitement.
L'iloprost est administré après dilution en
perfusion IV. Il est recommandé d'utiliser une pompe ou une seringue
automatique, la voie d'administration étant périphérique
ou centrale.
La solution à perfuser doit être
préparée quotidiennement pour maintenir la
stérilité.
Le contenu d'une ampoule d'Iloprost est dilué, soit
dans du soluté physiologique soit dans du soluté glucosé
(à 5%). Il faut assurer un mélange homogène par
agitation.
Le contrôle de la pression artérielle et de la
fréquence cardiaque doit être réalisé avant la mise
en route de la perfusion, et à chaque palier d'augmentation de dose.
9
Pendant les deux à trois premiers jours de traitement,
on recherche la dose maximum bien tolérée par le patient.
Durant cette phase de recherche de dose, on commence la
perfusion à une dose de 0,5 ng/kg/min pendant 30 minutes. Ensuite, on
augmente la dose toutes les 30 minutes, par paliers de 0,5 ng/kg/min
jusqu'à un maximum de 2,0 ng/kg/min.
Le débit de perfusion doit être calculé
d'après le poids du patient de façon à obtenir une valeur
comprise entre 0,5 et 2,0 ng/kg/min. Les différents débits de
perfusion sont présentés dans l'annexes
I
Si des effets indésirables tels que
céphalées, nausées, baisse de la pression
artérielle surviennent, réduire le débit de perfusion
jusqu'à trouver la dose maximale bien tolérée. Si les
effets indésirables sont sévères, interrompre la
perfusion.
En fonction de la technique de perfusion utilisée, il
existe deux dilutions différentes de chaque ampoule. L'une est 10 fois
moins concentrée que l'autre (0,2 ug/ml contre 2 ug/ml) et peut
être employée uniquement avec une pompe automatique. À
l'inverse, la solution la plus concentrée peut être
administrée à l'aide d'une seringue automatique.
a - Traitement de l'ischémie chronique
sévère des membres inférieurs
La posologie est adaptée individuellement en fonction
de la tolérance et se situe entre 0,5 et 2 ng d'iloprost par kg de poids
corporel et par minute pour une perfusion de 6 heures par jour.
Poursuivre le traitement en général pendant
quatre semaines, en utilisant la dose tolérée
déterminée pendant les deux ou trois premiers jours de
traitement.
La durée du traitement est de 28 jours en
général. Elle peut être moindre en cas d'efficacité
précoce.
L'efficacité et la tolérance d'Ilomédine
n'ont pas été étudiées pour des durées de
traitement supérieures à quatre semaines ou en cas de cures
répétées dans cette indication.
La perfusion en continu pendant plusieurs jours n'est pas
conseillée.
En effet, bien qu'il n'y ait pas eu de conséquences
cliniques, une tachyphylaxie des effets sur les plaquettes ainsi qu'une
hyperagrégabilité à l'arrêt du traitement peuvent se
produire.
10
b - Traitement des phénomènes de
Raynaud sévère
La posologie recommandée varie entre 1,5 et 2 ng/kg/min
selon la tolérance du patient.
Cependant, le traitement devra être débuté
à 0,5 ng/kg/min (soit 10 ml/h) et augmenté progressivement toutes
les 30 minutes, selon le schéma proposé ci-dessus, pour atteindre
la dose maximale tolérée par le patient.
La durée de la perfusion sera de 6 heures par jour
pendant 5 jours consécutifs, en utilisant la dose maximale
tolérée déterminée pendant les premiers jours de
traitement.
La répétition des cures devra se faire de
préférence à intervalles de 6 à 12 semaines (et
jamais inférieurs à 4 semaines).
4 - Indications
Les indications « classiques » inscrites à
l'AMM de l'Iloprost en perfusion intraveineuse sont représentées
par :
- Les situations d'ischémie chronique
sévère a risque d'amputation chez des patients pour lesquels une
revascularisation chirurgicale a échoué ou n'est pas
envisagée
- Les syndromes de Raynaud sévères avec troubles
trophiques en évolution.
Cela concerne en majeure partie des patients porteurs d'AOMI,
de maladie de Buerger, et de sclérodermie.
Il existe également dans la littérature
d'autres indications plus anecdotiques, non validées et non
consensuelles, que nous ne décrirons pas dans cette étude.
(8-15)
5 - Contre-indications
Ce médicament ne doit jamais être utilisé
dans les situations suivantes :
· Grossesse, allaitement.
· Hypersensibilité à la substance active
ou à l'un des excipients mentionnés à la rubrique
Composition.
·
11
Affections où le risque hémorragique peut
être accru à cause des effets de l'iloprost sur les plaquettes
(par exemple ulcère gastrique ou duodénal en évolution,
traumatisme, hémorragie intracrânienne).
· Troubles coronariens sévères ou angor
instable.
· Infarctus du myocarde dans les six mois
précédents.
· Insuffisance cardiaque aiguë ou chronique
(classification NYHA II à IV).
· Troubles du rythme sévères.
· OEdème pulmonaire.
6 - Effets secondaires
Les effets indésirables résultent de l'effet
local lié à l'administration par inhalation de l'iloprost, tels
qu'une toux, et de l'activité liée aux propriétés
pharmacologiques des prostacyclines.
Les effets indésirables observés le plus
fréquemment (= 20 %) dans les essais cliniques étaient :
vasodilatation (dont hypotension), céphalées et toux. Les effets
indésirables les plus graves ont été : hypotension,
saignements et bronchospasme.
Pour le détail exhaustif des effets indésirables de
l'Iloprost, se référer à l'annexe
II
B - Les données de la littérature sur
l'efficacité de l'Iloprost dans l'AOMI
Plusieurs méta-analyses ont étudié
l'efficacité de l'Iloprost dans l'AOMI.
1 - Stade de la claudication intermittente
L'étude de la Cochrane de 2013 a
analysé 18 études, dont 4 études randomisées contre
placebo, soit 2773 patients. Cette méta-analyse conclue à
l'absence de preuves de bonne qualité pour suggérer une
efficacité de l'Iloprost dans cette indication. (16)
12
2 - Stade des douleurs de repos et/ou des troubles
trophiques
La méta-analyse de Vitale et al. de 2016 ayant
étudié 18 études, soit 3077 patients, conclue
également à l'absence de preuves de bonne qualité pour
suggérer une efficacité de l'Iloprost dans cette indication.
(17)
En 2018, une nouvelle méta-analyse de la Cochrane
a analysé 33 études soit 4477 patients, dont 21
études randomisées contre placebo. Cette méta-analyse a pu
montrer l'absence de d'efficacité de l'Iloprost sur l'incidence des
amputations et la mortalité cardio-vasculaire par rapport au placebo,
avec un bon niveau de preuve pour les amputations mais un faible niveau de
preuve pour la mortalité cardio-vasculaire. Un petit effet positif sur
l'amélioration des douleurs et du pronostic cicatriciel a
été constaté, avec un niveau de preuve
modéré. En revanche, une plus grande incidence d'effets
indésirables sous prostanoïdes par rapport au placebo a
été montrée, avec un niveau de preuve
modéré. Les auteurs appellent à la prudence et que par
conséquent, une évaluation minutieuse des alternatives
thérapeutiques doit être envisagée. (2)
C - Les recommandations par les sociétés
savantes de l'utilisation de l'Iloprost dans l'AOMI
Pour guider la prise en charge des praticiens, plusieurs
recommandations de bonne pratique existent sur le sujet.
Pour résumé, il semble que les perfusions
intraveineuses d'Iloprost représentent une niche pour la prise en charge
de certains patients bien sélectionnés, mais que cette
dernière ne présente actuellement pas une balance
bénéfice/risque favorable pour être recommandée plus
largement dans cette indication.
1 - Recommandations nationales
a - HAS 2019
La commission de la transparence s'est exprimée en 2019
sur le maintien de l'AMM dans cette indication. Voici ses conclusions :
« ILOMEDINE n'a pas de place dans la stratégie
thérapeutique de l'ischémie chronique sévère des
membres inférieurs lorsque la revascularisation a échoué
ou n'est pas indiquée. »
13
« Avis défavorable au remboursement dans le
traitement de l'ischémie chronique sévère des membres
inférieurs chez les patients pour lesquels la revascularisation a
échoué ou n'est pas indiquée. »
(6)
b - SFMV et SCVE 2020 (pre-print)
« Nous suggérons l'utilisation de
prostanoïdes IV chez les patients au stade d'ischémie de repos chez
qui les tentatives de revascularisation ont échoué ou ne sont pas
réalisables (patients sans option de revascularisation), si l'amputation
n'est pas indispensable à court terme et si l'état
général du patient permet un tel traitement (Niveau 2+). »
(18)
2 - Recommandations internationales
a - ACC/AHA 2011
Contrairement aux recommandations de 2005, les perfusions
intraveineuses d'Iloprost n'apparaissent plus dans la liste des traitements
envisageable chez les patients au stade des douleurs de repos.
(4)
b - ESC/ESVS 2017
Les perfusions intraveineuses d'Iloprost n'apparaissent pas
dans la liste des traitements envisageables chez les patients au stade des
douleurs de repos. (5)
c - ESVM 2019
« Les prostanoïdes (...) ne sont pas
recommandés à visée symptomatique au stade de claudication
des membres inférieurs, car il n'existe pas de preuve solide de
l'amélioration des distances de marche, de la morbidité, de la
mortalité et de la qualité de vie (grade III B) »
« Les prostanoïdes peuvent être
considérés comme apportant un bénéfice modeste chez
les patients au stade des douleurs de repos (grade IIb B) »
« Les prostanoïdes peuvent être
considérés comme un traitement médical pour les patients
au stade des douleurs de repos qui ne sont pas éligibles à la
revascularisation ou dont la revascularisation a échoué (grade
IIb B) »
14
« Ce traitement n'est pas recommandé comme une
alternative à la revascularisation (grade III B) »
(19)
15
III - Objectifs de l'étude
L'objectif principal de notre étude est de
répertorier les différentes indications retenues d'injections
intraveineuses d'Iloprost par les médecins prescripteurs d'HAD dans le
cadre de troubles trophiques cutanés pour analyser leur
adéquation avec les recommandations nationales et internationales sur le
sujet.
L'objectif secondaire de notre étude est d'analyser la
tolérance et le pronostic cicatriciel et/ou général des
patients ayant reçu des injections intraveineuses d'Iloprost.
16
MATERIELS ET METHODES
I - Type d'étude
Il s'agit d'une étude de dossiers, observationnelle,
descriptive, longitudinale, rétrospective, réalisée chez
26 patients pris en charge en HAD dans l'entreprise associative à but
non lucratif groupe Adène, en Occitanie, sur 3 centres
(Alès, Nîmes et Montpellier), portant sur un période allant
de janvier 2019 à avril 2021.
II - Population de l'étude
Les dossiers ont pu être identifiées en
interrogeant la base de données du logiciel AntHADine® de
l'HAD, puis la recherche a été affinée dossier par dossier
grâce aux comptes-rendus de consultation et d'hospitalisation disponibles
sur la base de données informatique de l'HAD.
Dans notre étude, nous avons défini une cure
intraveineuse d'Iloprost comme l'administration non interrompue d'au moins une
perfusion intraveineuse d'Iloprost.
Nous avons inclus les patients ayant reçu au moins une
cure d'Iloprost en HAD sur la période analysée. Nous avons exclus
les patients pour qui la thérapeutique était utilisée
à visée prophylactique.
Nous nous sommes assurés au préalable de
l'absence d'opposition des patients à l'utilisation de leurs
données biomédicales à des fins de recherche. Nous avons
assuré l'anonymat des données de chaque dossier patient en les
désignant par un numéro de classement chronologique.
III - Analyse des données
Les données brutes ont été analysées
avec le logiciel Microsoft Excel®.
Nous avons analysé les données suivantes :
- L'indication des perfusions d'Iloprost.
- Les caractéristiques cliniques des patients : âge,
sexe, antécédents notables, facteurs de
risque cardio-vasculaires, traitements médicamenteux.
- La vitesse de perfusion maximale théorique pour chaque
cure.
17
- La vitesse de perfusion maximale réelle pour chaque
cure. - La durée de chaque cure.
- La tolérance : effets indésirables, motifs
d'arrêt non prévus. - L'évolution à la suite de
chaque cure.
Nous avons ensuite réalisé une étude
statistique de ces valeurs brutes pour les organiser et leur donner du sens
:
- Mesure de la distribution de fréquence pour
les valeurs catégoriques (nominales ou ordinales) comme l'indication de
perfusion d'Iloprost, le sexe, la tolérance...
- Mesure des tendances centrales et de la
dispersion (moyenne et écart-type) pour les valeurs
quantitatives comme l'âge, le poids, la durée de la cure...
Les données ont par la suite été
présentées sous forme de diagrammes et tableaux à des fins
de clarté.
18
RESULTATS
I - Les indications thérapeutiques à
l'utilisation des perfusions intraveineuses d'Iloprost
Nous avons retenu 26 patients ayant reçus au moins une
cure d'Iloprost sur la période analysée.
Les indications thérapeutiques retenues pas les
médecins prescripteurs d'HAD étaient par ordre de
fréquence : les troubles trophiques dans un contexte de
sclérodermie ou CREST syndrome (31%), ceux dans un contexte d'AOMI
revascularisée ou non (31%) et ceux dans un contexte de Maladie de
Buerger (23%).
Le reste des indications étaient à part
égale : l'ischémie mésentérique, la maladie des
emboles de cholestérol, iatrogène (injection sous-cutanée
de Chlorhexidine) et un diagnostic incertain (4% chacune).
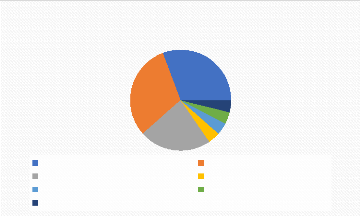
AOMI/polyathéromateux Sclérodermie/CREST/
Raynaud
Maladie de Buerger NC ou incertain
Ischémie mésentérique Injection SC
chlorhexidine
Maladie des emboles de cholestérol
Indications thérapeutiques
31%
23%
31%
4%
4%4%
4%
Diagramme 1 : Indications
thérapeutiques
19
II - Autres données analysées
Tableau 1 : Caractéristiques
des patients, médecins prescripteurs et modalités des cures en
fonction de l'indication retenue à la cure d'Iloprost
|
AOMI
|
Sclérodermie
CREST/Raynaud
|
Maladie de Buerger
|
Autres
|
Total/Moyenne
|
|
Nombre de patients
|
8 (31%)
|
8 (31%)
|
6 (23%)
|
4 (16%)
|
26 (100%)
|
|
Sexe-ratio
|
111/1F
|
111/3F
|
111/1F
|
311/1F
|
111/1F
|
|
Âge (année)
|
70 [44-92]
|
64 [51-70]
|
44 [28-62]
|
54 [30-83]
|
60 (ó = 14,67)
|
|
Poids (kg)
|
74 [56-109]
|
63 [55-74]
|
64 [51-95]
|
69 [55-84]
|
68 (ó = 16,17)
|
|
Médecin prescripteur
|
|
|
- CHU
Médecine interne Chir. vasculaire
|
3
2
|
7
0
|
5
0
|
2
0
|
17
2
|
|
- Clinique privée Médecine interne
Chir. vasculaire
|
3
0
|
1
0
|
1
0
|
2
0
|
7
0
|
|
Durée prescription (jours)
|
23 [4-42]
|
23 [7-42]
|
28 [21-42]
|
28 [5-63]
|
25 (ó = 12,85)
|
|
Débit max
théorique en ml/h (moyenne)
|
2,86
|
3,15
|
3,24
|
NC
|
3,06 (ó = 1,30)
|
|
Débit max réel en ml/h
(moyenne)
|
3,61
|
2,47
|
2,17
|
2,38
|
2,74 (ó = 1,10)
|
20
Tableau 2 : Effets indésirables
et évolution cicatriciel en fonction de l'indication retenue à la
cure d'Iloprost
|
AOMI
|
Sclérodermie
CREST/Raynaud
|
Maladie de
Buerger
|
Autres
|
Total
|
|
Effets indésirables
|
|
|
Mineurs
|
|
Céphalées
|
2
|
4
|
1
|
2
|
8
|
|
Nausées
|
2
|
2
|
1
|
1
|
6
|
|
Flush
|
1
|
0
|
0
|
0
|
1
|
|
Diffusion sous-
cutanée
|
0
|
1
|
0
|
0
|
1
|
|
Diarrhée
|
1
|
0
|
0
|
0
|
1
|
|
Nombre de patients
|
2
|
4
|
1
|
2
|
9 (35%)
|
|
Majeurs
|
|
|
Vomissements
|
0
|
1
|
1
|
0
|
2
|
|
HTA
|
0
|
1
|
0
|
0
|
1
|
|
Hypotension
|
0
|
0
|
1
|
0
|
1
|
|
Tachycardie
|
0
|
1
|
0
|
0
|
1
|
|
Arythmie
|
0
|
0
|
0
|
0
|
|
|
Douleur thoracique
|
0
|
1
|
0
|
0
|
1
|
|
Décès
|
1
|
0
|
0
|
0
|
1
|
|
Infection loco- régionale
|
1
|
0
|
2
|
0
|
3
|
|
Nombre de patients
|
1
|
2
|
3
|
0
|
6 (23%)
|
|
Évolution cicatriciel
|
|
|
- Amélioration
|
4 (50%)
|
3 (37,5%)
|
1 (25%)
|
3 (100%)
|
11 (42%)
|
|
- Stabilité
|
1 (12,5%)
|
1 (12,5%)
|
1 (17%)
|
0
|
3 (11,5%)
|
|
- Aggravation
Amputation
Décès
|
3 (37,5%)
1
1
|
2 (25%)
NC
0
|
2 (33%)
1
0
|
0
0
0
|
7 (27%)
2
1
|
|
- NC
|
0
|
2 (25%)
|
2 (33%)
|
1 (25%)
|
5 (19%)
|
21
DISCUSSION
I - Discussion des résultats et comparaison à
la littérature
A - En ce qui concerne les indications retenues
Les 2 principales indications sont, à part
égale, l'AOMI grade = 3 et le groupe sclérodermie/CREST
syndrome/Raynaud sévère, suivies de très près par
la maladie de Buerger. Ces données sont comparables à celles de
la littérature.
Cette part importante de l'utilisation de l'Iloprost dans
l'AOMI semble discutable au vue de la littérature et des recommandations
sus-citées.
En ce qui concerne la répartition des patients en
fonction des indications, notre étude présente quelques
différences par rapport à la littérature.
Dans la série de Catros en 2013,
réalisée sur 39 patients suivis en CHU, l'AOMI
représentait 46,1% des dossiers, la maladie de Buerger 23%, la
sclérodermie 15,3% et les autres indications 15,3%.
(20)
Dans la série de Benhamou de 2010, on
retrouvait la répartition suivante : maladie de Buerger (40 %),
sclerodermie (27%) et autres maladies vasculaires périphériques
(33%). (21) Ces différences de recrutement peuvent
s'expliquer par la nature intrinsèque des centres recruteurs, la maladie
de Buerger et la sclérodermie étant toutes deux des maladies
rares, essentiellement prises en charge dans des centres de
références.
Nous pouvons supposer que la part plus importante dans notre
étude des patients sclérodermiques peut s'expliquer par le
caractère récurrent des cures chez ses patients, pour qui la cure
d'Iloprost à domicile semble faciliter l'adhésion aux soins et la
qualité de vie.
B - En ce qui concerne les médecins prescripteurs
Les prescripteurs principaux de cure d'Iloprost sont en
majeure partie des médecins internistes, bien que nous ayons
retrouvé deux chirurgiens vasculaires parmi les prescripteurs.
22
Ces derniers ne prescrivent l'Iloprost dans des situations
d'AOMI grade = 3, contrairement aux médecins internistes qui utilisent
cette thérapeutique dans des situations plus diversifiées.
En proportion, les médecins des cliniques
privées prescrivent plus souvent les cures d'Iloprost dans des
situations « non consensuelles » (71%) que ceux exerçant en
CHU (29%), ce qui peut s'expliquer par le caractère universitaire de ces
derniers.
On remarque également que la proportion de patients
appartenant au groupe sclérodermie/CREST syndrome/Raynaud
sévère est également plus basse en cliniques
privées (14%) qu'au CHU (29%), ce qui peut-être expliqué
par la présence de centre de référence en CHU pour le
suivi de ces pathologies.
Nous n'avons pas trouvés de données issues de la
littérature permettant une comparaison avec nos résultats.
C - En ce qui concerne les durée d'utilisation
La durée moyenne, toutes indications confondues, est de
25 jours avec des extrêmes allant de 4 à 63 jours, et avec un
écart-type de 13 jours ce qui démontre une réelle
variabilité des durées d'utilisation.
De façon étonnante, compte-tenu des
modalités d'utilisation spécifiques à chaque indication
(cf supra), les groupe AOMI et sclérodermie/CREST syndrome/Raynaud
sévère présentent une durée d'utilisation identique
de 23 jours, avec là aussi, une variabilité inter-patient
importante.
Cette disparité de résultats était
également retrouvée dans l'étude de Catros de
2013 déjà citée.
D - En ce qui concerne les débits de perfusion
utilisés
Nous avons pu voir que les débits maximums
utilisés chez nos patients étaient en moyenne plus faible que les
objectifs recommandés dans la monographie du VIDAL®.
Le facteur limitant principal à l'augmentation des
débits était l'apparition d'effets secondaires mineurs
malgré une prémédication ou l'utilisation per-cure de
traitements symptomatiques.
Ces résultats sont similaires à plusieurs
études réalisées sur le sujet. (20,
22-24)
23
E - En ce qui concerne les effets indésirables
Dans notre série les effets indésirables
étaient relativement fréquent avec des ET mineurs chez 35% des
patients et des ET majeurs chez 23% des patients.
Les ET mineurs et les vomissements n'ont pas été
responsables d'arrêt de cure, à l'inverse des ET majeurs
responsables de trois arrêts de cure.
Tl a été noté un décès qui
ne semblait pas en lien direct avec la cure d'Tloprost (septicémie sur
infection de matériel prothétique).
Nos données sont relativement meilleurs que dans
l'étude de Catros de 2013 qui retrouvait 51,8 % d'ET mineurs
(céphalées (43,9%), flushs (19,6%), nausées (14,3%)), et
des ET majeurs dans 37,3 % des cas. Ces chiffres sont également
similaires dans la série de Benhamou de 2010.
(2021)
Ces différences peuvent être expliquées
par les caractéristiques des patients pris en charge en HAD qui
pourraient être significativement moins fragiles que les patients pris en
charge en CHU. Tl existe certainement de nombreuses données manquantes
dans le suivi des patients en HAD ce qui peut donner l'illusion d'une incidence
moins importante des effets secondaires dans cette population. Un des exemples
de ce manque de données est la proportion quasi inexistante de flushs
rapportés lors des cures.
24
II - Forces et limites de l'étude
A - Limites
Notre étude présente plusieurs limites.
Malgré l'analyse minutieuse des dossiers, force est de constater que
beaucoup de données restent manquantes et complexifient l'analyse des
résultats.
D'ailleurs, une des conséquences directes de ce manque
de données et la mauvaise connaissance des thérapeutiques
associées à l'Iloprost et susceptibles d'être des facteurs
de confusion majeurs.
Une autre limite est la période de suivi qui est
objectivement courte, dans la plupart des cas se limitant uniquement à
la période d'hospitalisation pour cure d'Iloprost.
Enfin, compte tenu de l'absence de calcul du nombre de sujet
nécessaire et donc a priori d'un défaut de puissance, nous
n'avons pas réalisé de test statistique pour connaître la
significativité de nos résultats.
B - Forces
La force principale de notre étude réside dans
son originalité car, à notre connaissance, il n'existe pas
d'étude publiée répertoriant l'utilisation de l'Iloprost
en HAD.
Elle a également le mérite de montrer la
faisabilité des cures intraveineuses d'Iloprost à domicile,
parfois sur de très longues périodes (jusqu'à 63 jours) et
conforte donc l'intérêt du recours à l'HAD pour
améliorer l'adhésion aux soins des patients et favoriser le
désengorgement des structures hospitalières conventionnelles.
25
CONCLUSION
Les indications retenues par les médecins prescripteurs
d'HAD d'injections intraveineuses d'Iloprost dans le cadre de troubles
trophiques cutanés sont majoritairement l'AOMI, le syndrome de Raynaud
sévère (isolé ou en lien avec une sclérodermie) et
la maladie de Buerger.
Cette part importante de l'utilisation de l'Iloprost dans
l'AOMI semble discutable au vue de la littérature et des recommandations
sus-citées.
Une meilleur analyse de la pertinence d'une telle
thérapeutique chez les patients pris en charge en HAD semble
nécessaire, à la fois par le médecin prescripteur mais
également par le médecin coordonnateur en HAD.
Notre travail, à l'instar des autres études
similaires, montre une présence importante de données manquantes,
ce qui pourrait être amélioré par une sensibilisation des
équipes soignantes d'HAD à une meilleure tenue de dossiers
patients.
26
BIBLIOGRAPHIE
1. Rapport d'activité 2017-2018 de la FNEHAD
[Internet]. FNEHAD. 2018 [cité 21 avr 2021]. Disponible sur:
https://www.fnehad.fr/2018/11/21/le-rapport-dactivite-2017-2018-de-la-fnehad-est-disponible/
2. Prostanoids for critical limb ischaemia - Vietto, V - 2018
| Cochrane Library [Internet]. [cité 21 avr 2021]. Disponible sur:
https://www-cochranelibrary-com.ezpum.biu-montpellier.fr/cdsr/doi/10.1002/14651858.CD006544.pub3/full
3. FEDECARDIO | L'artériopathie oblitérante des
membres inférieurs [Internet].
https://www.fedecardio.org.
2016 [cité 21 avr 2021]. Disponible sur:
https://www.fedecardio.org/Les-maladies-cardio-vasculaires/Les-pathologies-cardio-vasculaires/larteriopathie-obliterante-des-membres-inferieurs
4. Rooke Thom W., Hirsch Alan T., Misra Sanjay, Sidawy Anton
N., Beckman Joshua A., Findeiss Laura K., et al. 2011 ACCF/AHA Focused Update
of the Guideline for the Management of Patients With Peripheral Artery Disease
(Updating the 2005 Guideline). Circulation. 1 nov 2011;124(18):2020-45.
5. 2017 ESC Guidelines on the Diagnosis and Treatment of
Peripheral Arterial Diseases, in collaboration with the European Society for
Vascular Surgery (ESVS) | European Heart Journal | Oxford Academic [Internet].
[cité 21 avr 2021]. Disponible sur:
https://academic.oup.com/eurheartj/article/39/9/763/4095038
6. Avis de la commission de la transparence, ILOMEDINE
(iloprost) [Internet]. Haute Autorité de Santé. [cité 21
avr 2021]. Disponible sur:
https://www.has-sante.fr/jcms/p_3135580/fr/ilomedine-iloprost
7. ILOMEDINE 0,1 mg/1 ml sol inj p perf - VIDAL eVIDAL
[Internet]. [cité 21 avr 2021].
Disponible sur:
https://evidal-vidal-fr.ezpum.biu-
montpellier.fr/medicament/ilomedine
0 1 mg 1 ml sol inj p perf-8527-pharmacodynamie.html
8. Benhamou Y, Vandecandelaere V, Varin R, Le Besnerais M,
Cailleux N, Levesque H. Administration d'iloprost au sein d'une cohorte de 30
patients atteints d'ischemie digitale : determination de criteres de bonne
tolerance clinique. Rev Medecine Interne. Juin 2010;31:S78.
9. Kuhar CG, Mesti T, Zakotnik B. Digital ischemic events
related to gemcitabine: Report of two cases and a systematic review. Radiol
Oncol. Dec 2010;44(4):257-261.
10. Gouny P, Gaitz JP, Vayssairat M. Acute hand ischemia
secondary to intraarterial buprenorphine injection: treatment with iloprost and
dextran-40--a case report. Angiology. Juill 1999;50(7):605-606.
11. Assie C, Marie I. Atteintes arterielles des membres
superieurs et inferieurs au cours de la maladie de Horton. Presse Medicale.
Fevr 2011;40(2):151-161.
12.
27
Lo Gullo R, De Filippis L, Caliri A, Bagnato G. Successful
treatment of necrotizing vasculitic lesions after infusion of iloprost in a
patient with cryoglobulinemia and chronic HCV infection. Clin Exp Rheumatol.
Dec 2005;23(6):912-913.
13. Teixeira L, Servettaz A, Mehrenberger M, Noel L-H,
Guillevin L, Mouthon L. Crise renale sclerodermique. Presse Medicale.
2006;35(12):1966-74.
14. Metz D, N'Guyen P, Chapoutot L, Graciet J, Taupin JM,
Grentzinger A, et al. [Massive pulmonary embolism disclosing thrombocytopenia
induced by low molecular weight heparin. Therapeutic success of prostacyclin].
Ann Cardiol Angeiologie. Dec 1991;40(10):619-621.
15. Palatianos GM, Foroulis CN, Vassili MI, Matsouka P,
Astras GM, Kantidakis GH, et al. Preoperative detection and management of
immune heparin-induced thrombocytopenia in patients undergoing heart surgery
with iloprost. J Thorac Cardiovasc Surg. Fevr 2004;127(2):548-554.
16. Robertson L, Andras A. Prostanoids for intermittent
claudication. Cochrane Database of Systematic Reviews [Internet]. 2013
[cité 18 avr 2021];(4). Disponible sur:
http://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD000986.pub3/full
17. Vitale V, Monami M, Mannucci E. Prostanoids in patients
with peripheral arterial disease: A meta-analysis of placebo-controlled
randomized clinical trials. Journal of Diabetes and its Complications. 1 janv
2016;30(1):161-6.
18. Mahé G, Boge G, Bura-Rivière A,
Chakfé N, Constans J, Goueffic Y, et al. Disparities Between
International Guidelines (AHA/ESC/ESVS/ESVM/SVS) Concerning Lower Extremity
Arterial Disease: Consensus of the French Society of Vascular Medicine (SFMV)
and the French Society for Vascular and Endovascular Surgery (SCVE). Annals of
Vascular Surgery. avr 2021;72:1-56.
19. Frank U, Nikol S, Belch J, Boc V, Brodmann M, Carpentier
PH, et al. ESVM Guideline on peripheral arterial disease. Vasa. sept
2019;48(Suppl 102):1-79.
20. Catros F. Perfusions intraveineuses d'Iloprost: profil
des patients et tolérance [Thèse d'exercice]. [France]:
Université de Bretagne occidentale; 2013.
21. Benhamou Y, Vandecandelaere V, Varin R, Le Besnerais M,
Cailleux N, Levesque H. Administration d'iloprost au sein d'une cohorte de 30
patients atteints d'ischemie digitale : determination de criteres de bonne
tolerance clinique. Rev Medecine Interne. Juin 2010;31:S78.
22. Torley HI, Madhok R, Capell HA, Brouwer RM, Maddison PJ,
Black CM, et al. A double blind, randomised, multicentre comparison of two
doses of intravenous iloprost in the treatment of Raynaud's phenomenon
secondary to connective tissue diseases. Ann Rheum Dis. Nov
1991;50(11):800-804.
23. Kawald A, Burmester GR, Huscher D, Sunderkotter C,
Riemekasten G. Low versus high-dose iloprost therapy over 21 days in patients
with secondary Raynaud's phenomenon and systemic sclerosis: a randomized, open,
single-center study. J Rheumatol. Sept 2008;35(9):1830-1837.
28
24. Beischer W, Dembski JC, Gruss JD, Hofgartner F, Horsch A,
Horsch S, et al. Low-dose iloprost infusions compared to the standard dose in
patients with peripheral arterial occlusive disease Fontaine stage IV. DAWID
Study Group. VASA Z Fur Gefasskrankheiten. Fevr 1998;27(1):15-19.
ANNEXES
ANNEXE I : Débits de perfusion de l'Iloprost
Débits de perfusion (ml/h) à utiliser pour
les différentes doses avec une pompe automatique
29
Débits de perfusion (ml/h) à utiliser
pour les différentes doses avec une seringue
automatique

30
ANNEXE II : Effets indésirables selon la
monographie du VIDAL®
|
Classes
de systèmes
d'organes
|
Très fréquent :
=1/10
|
Fréquent :
= 1/100 a < 1/10
|
Peu fréquent :
= 1/1000
a < 1/100
|
Rare : =
1/10 000
a < 1/1000
|
|
Troubles du métabolisme et de la nutrition
|
|
Anorexie
|
|
|
|
Affections psychiatriques
|
|
Apathie
|
Anxiété, dépression, hallucinations
|
|
|
Affections du système nerveux
|
Céphalées
|
Sensation de vertige/vertige, paresthésie, sensation
pulsatile, hyperesthésie, nervosité, agitation, somnolence
|
Tremblements, migraine, syncope
|
|
|
Affections oculaires
|
|
|
Anomalie de la vision
|
|
|
Affections cardiaques
|
|
Bradycardie
|
Troubles du rythme, infarctus du myocarde
|
|
|
Affections vasculaires
|
Bouffées vasomotrices
|
Hypotension
|
Accident cérébro-vasculaire, thrombose veineuse
profonde, embolie pulmonaire
|
|
|
Affections respiratoires, thoraciques et médiastinales
|
|
|
Asthme
|
Toux
|
|
Affections gastro- intestinales
|
Nausées,
vomissements
|
Diarrhées, douleur abdominale
|
Dyspepsie, ténesme, constipation, dysphagie,
diarrhée hémorragique, sécheresse buccale, dysgueusie
|
Rectite
|
|
Affections hepato-biliaires
|
|
|
Atteinte hépatique
|
|
31
Affections de la peau et du tissu sous-cutane
|
Sudation
|
|
Prurit
|
|
|
Affections musculo- squelettiques et systémiques
|
|
Douleur des mâchoires, myalgie, arthralgie
|
Crampes musculaires
|
|
|
Affections du
rein
et des voies urinaires
|
|
|
Dysurie
|
|
|
Troubles généraux et anomalies au site
d'administration
|
|
Douleur localisée/générale, sensation de
chaleur généralisée, malaise, asthénie, soif ;
réaction au site d'injection : érythème, douleur,
phlébite
|
|
|
| 


