|

Mémoire de recherche présenté en vue de
l'obtention du Master Sciences et
Techniques des Activités Physiques
et Sportives (STAPS)
Spécialité Sciences du Mouvement Humain
(SMH) - Recherche
Parcours : Physiologie
Laboratoire d'accueil : INSERM C3M U1065
Effets de l'activation de la voie du Peroxisome
Proliferator-
Activated Receptor Beta (PPARâ) dans le
processus de
régénération musculaire
Présenté par
Jessica PIQUET
Sous la direction et co-direction de Anne-Sophie ROUSSEAU
(MCU) et Isabelle SATNEY (CR1/ HDR)
Juin 2016

Table des matières
1. Introduction 1
1.1 La régénération musculaire 1
1.1.1 Les différentes phases de la
régénération 1
1.1.2 Rôle des cellules immunitaires 2
1.1.3 Mécanismes moléculaires impliqués dans
la régénération musculaire 3
1.2 Rôle du facteur de transcription PPARâ 4
1.2.1 Rôle de PPARâ dans le muscle squelettique 4
1.2.2 Implication de PPARâ dans la myogenèse et la
régénération musculaire 5
1.2.3 Rôle de PPARâ dans l'inflammation 6
1.3 Problématique 7
2. Matériels et méthodes 8
2.1 Protocole 8
2.1.1 Animaux 8
2.1.2 Traitement au GW0742 par l'alimentation 8
2.1.3 Blessure musculaire 9
2.1.4 Evaluation des capacités fonctionnelles 9
2.1.5 Sacrifice et prélèvement des tissus 9
2.2 Techniques et dosages 10
2.2.1 Dissociation du muscle squelettique et cytométrie
en flux 10
2.2.2 Extraction d'ARN, Reverse transcription (RT) et PCR
quantitative (qPCR) 10
2.3 Analyses statistiques 11
3. Résultats 12
3.1 Effet de la blessure sur la cinétique de
régénération musculaire 14
3.1.1 Expression des gènes impliqués dans les
étapes de la régénération musculaire 14
3.1.2 Effet de la blessure sur l'expression des gènes
Myostatine et PPARâ 15
3.1.2 Effet de la blessure sur la réponse immunitaire
(macrophages, lymphocyte T) 16
3.2 Effet du traitement GW0742 sur la cinétique de
régénération du muscle 19
3.2.1 Effet du traitement GW0742 sur la
cinétique des quantités d'ARNm des gènes
impliqués dans la régénération
musculaire 19
3.2.2 Effet du traitement GW0742 sur la réponse
immunitaire (macrophages et
lymphocytes T) induite par la blessure dans le muscle TLA 20
4. Discussion 20
5. Conclusion 24
Bibliographie 26
1
1. Introduction
L'altération du processus de
régénération musculaire est la cause ou la
conséquence de nombreuses pathologies : des myopathies (Wilschut et al.,
2012) aux pathologies du mode de vie telles que le diabète de type 2
(Souza et al., 2013), l'obésité (Akhmedov et al., 2013) ou la
sarcopénie liée au vieillissement (Stephen EA et al., 2014).
Indépendamment des facteurs liés à la pathologie ou au
mode de vie, l'optimisation de la régénération musculaire
est d'intérêt dans le cadre de la prise en charge de la blessure
musculaire qui peut être favorisée par la pratique physique
à tout âge et quel que soit le niveau d'expertise (Rapport
d'expertise collective ANSES, 2016). L'optimisation du processus de
régénération dépend de nombreux facteurs, non
seulement de l'entrainement et probablement du niveau de
sédentarité, mais aussi des apports nutritionnels. Toutefois, les
mécanismes moléculaires impliqués dans la
régénération musculaire ne sont pas encore totalement
élucidés car complexes, ce qui rend encore floues les
stratégies thérapeutiques (médicamenteuses ou non)
à adopter dans les différents cas où le processus normal
de régénération est altéré ou dans le cas
plus général de la blessure musculaire. Ce mémoire vise
à mieux comprendre l'implication de l'activation de la voie
moléculaire impliquant le facteur de transcription Peroxisome
Proliferator-Activated Receptors Beta (PPARâ), fortement impliquée
dans la physiologie musculaire (Neels and Grimaldi., 2014), dans le processus
de régénération musculaire.
1.1 La régénération musculaire
1.1.1 Les différentes phases de la
régénération
Le processus de régénération suit trois
phases : Une phase de destruction, une phase de réparation, puis une
phase de remodelage (Järvinen, 2014). La première phase se
caractérise par une destruction de l'ensemble des fibres musculaires.
Durant cette étape, les macrophages positionnés dans le muscle,
vont émettre des signaux chimio-attractifs (facteurs de croissance,
cytokines) pour activer et recruter des cellules immunitaires circulantes
(Rappolee et al., 1992).
La phase de réparation est caractérisée
par la régénération, la revascularisation du muscle, et la
production d'un tissu conjonctif cicatriciel. Durant cette étape, les
cellules satellites vont avoir un rôle important. Celles-ci sont à
la périphérie des myofibres, entre la membrane plasmique de la
fibre et sa lame basale (Mauro A. 1961), dans un état
2
quiescent et vont exprimer Pax7, un facteur de transcription
impliqué dans la prévention de la différenciation
précoce. Les cytokines et les facteurs de croissances (tels que HGF,
IGF-1, TGFâ, etc) libérés par les cellules inflammatoires
vont conduire à l'activation des cellules satellites. Celles-ci vont
ensuite proliférer, puis certaines des cellules satellites vont revenir
à leur état quiescent pour permettre un auto-renouvèlement
au sein du muscle (Kuang et al., 2007) pendant que d'autres vont se
différencier en myocytes. Ces myocytes peuvent alors fusionner et former
des myotubes de faibles calibres possédant des noyaux localisés
dans la partie centrale de la fibre, soit intégrer des fibres
partiellement lésées (Jory et al., 2007).
Enfin, la phase de remodelage permet une
récupération progressive de la masse musculaire et des
propriétés contractiles et métaboliques des fibres, ainsi
que la migration des noyaux centraux vers la périphérie de la
fibre (Järvinen TA, 2005).
1.1.2 Rôle des cellules immunitaires
Les cellules immunitaires (macrophages et lymphocytes T)
jouent un rôle central dans le processus de réparation du muscle.
Les macrophages pro-inflammatoires (de type M1) dont le rôle est de
phagocyter les débris cellulaires, sont recrutés dans les heures
qui suivent la lésion musculaire. Ils jouent un rôle important
dans la phase inflammatoire et vont stimuler la prolifération des
cellules satellites (Chazaud B et al., 2009). Les macrophages
anti-inflammatoires (de type M2) vont contribuer à la résolution
de l'inflammation et à la réparation du muscle, notamment en
permettant aux cellules satellites de se différencier et de fusionner
entre elles (Chazaud B et al., 2009). A la fois les macrophages de type M1 et
de type M2 sont nécessaires au processus normal de
régénération musculaire (Wang et al., 2014). A la fin de
ces étapes, les macrophages vont alors mourir par apoptose (Saclier et
al., 2013). Même si les macrophages sont les cellules inflammatoires
prédominantes dans le muscle squelettique lors de la
régénération musculaire, d'autres types de cellules
immunitaires vont présenter un rôle central (Kharraz et al.,
2013). En effet, les cellules T de type régulatrices sont
impliquées dans le changement phénotypique des macrophages
pro-inflammatoires en macrophages anti-inflammatoires (Burzyn et al., 2013).
Aussi, en blessant des souris déficientes en lymphocytes T, avec un
venin de serpent (cardiotoxine), Castiglioni A et al. (2015) ont montré
que ces souris avaient un défaut de prolifération des cellules
satellites.
3
L'utilisation de souris sauvages leur a permis d'identifier
que les cellules T régulatrices étaient la seule population de
cellules majoritairement infiltrées dans le cas d'une lésion
musculaire. Les cellules T régulatrices pourraient donc jouer un
rôle déterminant dans la prolifération des cellules
satellites.
1.1.3 Mécanismes moléculaires
impliqués dans la régénération musculaire
La signalisation moléculaire impliquée dans le
processus de régénération musculaire est complexe. Nous
allons évoquer quelques-uns des signaux et des voies moléculaires
dans cette partie. L'Oxyde nitrique (NO) est une molécule-signal dont la
synthèse est favorisée lors de la blessure musculaire. Il est
connu pour permettre l'activité de facteurs de croissance qui vont
ensuite permettre aux cellules satellites de s'activer et d'entrer dans un
cycle de prolifération. Les facteurs de croissances ont des rôles
bien distincts : par exemple, l'HGF est le premier facteur à induire
l'activation des cellules satellites. Il va ensuite stimuler la
prolifération tout en inhibant la différenciation, pour
l'obtention d'un nombre suffisant de myoblastes (Miller et al., 2000). Les IGFs
vont permettre d'activer la prolifération des cellules satellites par le
biais de l'activation de la voie Mitogen-Activated Protein Kinases (MAPK) ainsi
que leur différenciation (Allen et al., 1989) par les voies
Phosphatidylinositol 3-OH kinase/ Protéine kinase B (PI3k/AKT) et
Calcineurin/ Nuclear factor of activated T-cells (NFAT) (Sakuma et al., 2012).
D'autres signaux sont impliqués dans la régulation de la
prolifération et de la différenciation des cellules satellites.
Par exemple, le TNFá, une cytokine sécrétée par les
macrophages pro-inflammatoires, est impliqué dans la diminution de
l'expression de MyoD (un facteur de transcription) (Warren et al., 2002). En
activant la voie c-Jun N-terminal Kinase (JNK), le TNF-á va conduire
à un blocage du signal d'IGF-1, pour favoriser la prolifération
des cellules satellites et inhiber leur différenciation (Warren et al.,
2002 ; Strle et al., 2006). Aussi, IL-4, une autre cytokine
sécrétée par les myotubes, agit via un récepteur
exprimé sur les myoblastes (IL-4Rá), et promeut la fusion de ces
derniers avec les myotubes (Horsley et al., 2003). Enfin, la myostatine (un
facteur de croissance) est particulièrement intéressante car
c'est un régulateur négatif de l'activation, de la
prolifération, de la différenciation (Langley et al., 2002 ;
Joulia et al., 2003) et de l'autorenouvèlement des cellules satellites
(McCroskery et al., 2003).
4
1.2 Rôle du facteur de transcription
PPARâ
Le Peroxisome Proliferator-Activated Receptors Beta (PPARf3),
est un facteur de transcription appartenant à la superfamille des
récepteurs nucléaires. Il existe trois isoformes des PPARs :
á, f3, et ã. PPARf3 est impliqué dans la régulation
du métabolisme, de l'inflammation, de la prolifération, et de la
différenciation dans plusieurs types cellulaires (Neels et Grimaldi.,
2014). En absence de ligands, PPARf3 forme un hétérodimère
avec RXR (Retinoic X Receptor) lié avec l'ADN sur un PPRE (Peroxisome
Proliferator Responsive Element) et en interaction avec le
co-répresseur. Dès qu'un ligand vient se fixer, il y a un
changement du complexe co-transcriptionnel qui permet la venue du
co-activateur, et ainsi la transcription des gènes cibles de PPARf3.
PPARf3 peut être activé par des ligands endogènes tels que
des dérivés d'acides gras ou bien des ligands synthétiques
comme le GW0742. PPARf3 est exprimé de façon ubiquitaire mais il
est très exprimé dans le muscle squelettique.
1.2.1 Rôle de PPARâ dans le muscle
squelettique
Comme nous venons de le voir précédemment, le
niveau d'expression de PPARf3 dans le muscle squelettique est plus
élevé que dans certains tissus. Cependant, son expression peut
varier dans certaines conditions. Par exemple, il a été
montré que le vieillissement entraîne une diminution de son
expression, et à l'inverse, un entrainement aigu ou chronique de type
aérobie l'augmente d'un facteur deux (Rousseau et al., 2016). PPARf3
joue un rôle important dans la réponse angiogénique, dans
l'hyperplasie, et dans le changement métabolique du muscle squelettique,
par un remodelage de la composition des fibres musculaires. En effet, une
surexpression de la protéine PPARf3 muscle-spécifique, ou une
activation pharmacologique de la voie PPARf3 par le GW0742, induit dans le
Tibialis anterior (TLA) (dont le métabolisme est principalement
glycolytique), un remodelage qui est caractérisé par une
augmentation de la capacité oxydative des fibres musculaires. Le
potentiel oxydo-lipidique est favorisé par une diminution du potentiel
d'oxydation du glucose et une augmentation du potentiel à cataboliser
les acides gras. L'activation pharmacologique de la voie PPARf3 conduit aussi
à une augmentation du nombre de capillaires ainsi qu'à une
augmentation de l'expression de certains marqueurs myogéniques
impliqués dans la prolifération et la différenciation des
cellules satellites tels que Myf5 et MyoD (Gaudel et al., 2008).
5
1.2.2 Implication de PPARâ dans la
myogenèse et la régénération musculaire 1.2.2.1
Implication de PPARâ dans la myogenèse
Giordano et al. (2009) ont traité des souris avec un
agoniste de PPARâ, le GW0742, par injection sous cutanée.
L'activation de la voie PPARâ dans le muscle TLA a conduit à une
augmentation du nombre de noyaux par millimètre de fibre, de 14%
comparé aux souris non traitées. Si ceci témoigne d'une
activation des cellules satellites ainsi que d'une fusion favorisée par
le traitement, la technique d'immunohistologie, n'a pas permis de montrer une
augmentation de la prolifération des cellules satellites.
D'autres auteurs ont à l'inverse montré une
prolifération diminuée de moitié et une
différenciation des cellules satellites doublée chez des souris
n'exprimant pas PPARâ dans les cellules satellites, par rapport aux
souris sauvages (Angione et al., 2011). L'expression de la myogénine
(marqueur de différenciation) est plus élevée chez les
souris mutantes n'exprimant pas PPARâ. Toutefois, ces auteurs n'ont pas
montré de différences du nombre de cellules satellites
quiescentes ou en autorenouvèlement.
Enfin, deux autres études (Bonala et al., 2012 ;
Chandrashekar et al., 2015) ont montré que la régulation par la
myostatine est altérée chez les souris qui n'expriment pas
PPARâ dans le muscle. Cela conduit à un défaut de
prolifération et de différenciation des myoblastes. Cet effet
passerait par le biais d'un antagoniste de la myostatine (Gasp-1).
1.2.2.2 Implication de PPARâ dans la
régénération musculaire
Le pourcentage de fibres de petit calibre est augmenté
de 30% et celui de gros calibre diminué de 20 % lorsque les souris
n'exprimant pas PPARâ dans les cellules satellites sont blessés
dans les TLA avec du venin de serpent (Cardiotoxine) (Angione et al., 2011).
Néanmoins, après 30 jours, les TLA des souris mutantes ont
complètement régénéré. Les résultats
de cette étude suggèrent que la régénération
musculaire chez des souris n'exprimant pas PPARâ dans les cellules
satellites est retardée.
Enfin, Chandrashekar P et al. (2015) ont blessé les TLA
de souris qui n'expriment pas PPARâ dans les cellules musculaires, avec
un venin de serpent (la notexine) et montrent que la réponse
inflammatoire est augmentée et la prolifération des cellules
satellites est altérée lors du processus de
régénération. A la fin de la
régénération musculaire, les fibres présentent une
atrophie et une diminution du nombre de noyaux
6
centraux, ce qui suggère qu'il y a eu un défaut
de régénération musculaire. Toutefois, l'administration
chez ces souris d'un inhibiteur de l'activité de la myostatine, au
contraire augmente le nombre de noyaux centraux, et l'hypertrophie dans les
fibres régénérées. Ceci suggère que
PPARâ a un impact sur le processus de régénération
musculaire, probablement en partie, par le biais de la régulation de
l'activité de la myostatine.
1.2.3 Rôle de PPARâ dans l'inflammation
L'inflammation est un processus normal de protection de
l'organisme contre les traumatismes et les infections. Dans des conditions
normales, la réponse inflammatoire est contrôlée pour
prévenir des dommages excessifs à l'organisme. Lorsque celle-ci
n'est pas bien contrôlée, il va y avoir une production accrue de
cytokines inflammatoires (TNF, IL-1, IL-6). Dans le tissus adipeux obèse
enflammé, les effets anti-inflammatoires de PPARâ peuvent affecter
le phénotype des macrophages favorisant ainsi le phénotype
anti-inflammatoire (M2) au détriment du phénotype
pro-inflammatoire (M1) (Kang et al., 2008). PPARâ apparait donc jouer un
rôle central dans la polarisation des monocytes en macrophages de type M2
(Kang et al., 2008). Dans les cellules endothéliales, l'activation
pharmacologique de PPARâ diminue la réponse inflammatoire induite
par le TNF-á, en réduisant le recrutement des leucocytes
(Piqueras et al., 2009). Aussi, dans le cadre des maladies inflammatoires
chroniques de l'intestin, il a été rapporté une
activité anti-inflammatoire de PPARâ (Bassaganya-Riera et al.,
2004). Les effets anti-inflammatoires de PPARâ passent également
par l'interaction physique de la protéine PPARâ avec la
sous-unité p65 de NFêB, empêchant par ce biais
l'activité de la voie NFêB et donc la production de cytokines
pro-inflammatoires (Rodriguez-Calvo et al., 2008). Toutefois, à notre
connaissance, il n'a pas été encore mis en évidence
d'effets de l'activation de la voie PPARâ dans le cas de l'inflammation
du muscle squelettique.
Le rôle de PPARâ dans les lymphocytes T n'a
été que très peu exploré. Néanmoins, il en
ressort dans des études menées dans un contexte de
sclérose en plaque induite chez la souris, un effet de l'activation de
la voie PPARâ dans la différenciation des cellules T. Plus en
détail, il existe différentes sortes de lymphocytes T dont les
lymphocytes considérés comme pro-inflammatoires, tels que les
lymphocytes T helper 1 (Th1) et T helper 17 (Th17) et les lymphocytes
considérés comme anti-inflammatoires tels que les lymphocytes T
helper 2 (Th2) et les T régulatrices (Treg). Or, des cellules T CD4+
de
7
souris déficientes en PPARâ produisent plus de
cytokines spécifiques des polarisations de Th1 et de Th17 (Kanakasabai
et al., 2011). A l'inverse, des souris traitées avec un agoniste de
PPARâ ont une augmentation de Th2 et de Treg (Kanakasabai et al., 2010).
Il en ressort dans ces conditions, lors de l'activation de la voie PPARâ,
une régulation de la balance pro-anti-inflammatoire en faveur d'une
production de cytokines ayant davantage un rôle anti-inflammatoire.
1.3 Problématique
Le processus de régénération musculaire
peut être découpé en trois grandes étapes (phase
inflammatoire, de réparation et de remodelage). C'est un processus
complexe qui mobilise différents types cellulaires durant ces
étapes. D'après la littérature actuelle, PPARâ, un
facteur de transcription, joue un rôle majeur sur la résolution de
l'inflammation. PPARâ est aussi impliqué dans la
prolifération et la différenciation des cellules satellites,
à travers la régulation de différentes voies
moléculaires (Giordano et al. (2009), Angione et al. (2011), Bonala et
al. (2012), Chandrashekar et al. (2015)). Sachant que l'inhibition de la voie
PPARâ conduit à une altération du processus de
régénération, nous nous posons la question si à
l'inverse, une activation pharmacologique de la voie PPARâ peut conduire
à une accélération du processus de
régénération. Le but de notre étude va donc
être de comprendre davantage l'impact de la voie PPARâ aux
différents stades du processus de régénération
musculaire. En effet, nous pensons que la voie PPARâ est impliquée
dans la phase inflammatoire ainsi que dans la phase de réparation du
muscle. Nous mènerons un protocole de dommages musculaires induits par
l'injection de cardiotoxine dans le tibialis anterior (TLA) de souris afin de
vérifier les hypothèses selon lesquelles l'activation de la voie
PPARâ: (1) durant la phase inflammatoire, favorise un profil
anti-inflammatoire des macrophages (de type M2) et le recrutement des
lymphocytes T; (2) durant la phase de réparation, favorise la
prolifération et la différenciation des cellules satellites.
Enfin, si nos hypothèses sont validées, nous pensons et
vérifierons que ces effets s'accompagnent d'une amélioration des
capacités fonctionnelles des souris.
8
2. Matériels et méthodes
Au total, 48 souris sont utilisées dans ce protocole.
La moitié des souris reçoit une alimentation spécifique et
l'autre moitié une alimentation avec un véhicule. Après 15
jours de traitement, toutes les souris sont blessées à la patte
gauche, et une injection de solution saline est administrée à la
patte droite (patte contrôle). 12 souris sont sacrifiées aux jours
4, 7, 9 et 14 post-blessure. 2 jours avant la blessure et la veille du
sacrifice des jours 7 et 14, certaines souris sont soumises à des tests
physiques. Pour des raisons méthodologiques (mode de sacrifice
différent des autres souris) nous n'avons pas considéré
les analyses par qPCR des souris sacrifiées au jour 9 post-blessure.
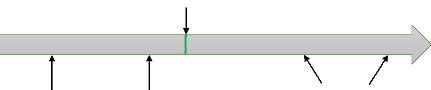
Sacrifice J4
Sacrifice J7
Sacrifice J9
Sacrifice J14
J0 : Injection Cardiotoxine
Nourriture enrichie GW0742 vs DMSO
J-15 : Début nourriture J-2 : Pré-tests physiques
J6, 13 : Tests physiques
GW0742/ DMSO
Figure 1 : Résumé du protocole 2.1
Protocole
2.1.1 Animaux
48 souris mâles sauvages de type C57Bl/6J,
âgées de 10 semaines à J0 (Charles Rivers, France) sont
hébergées à l'animalerie dans des cages de 2 ou 4 souris,
à une température ambiante (20°). La moitié des
souris (n=24) est traitée avec du GW0742 par voie orale (dans
l'alimentation). L'autre moitié des souris est
supplémentée avec le véhicule (DMSO). Les animaux sont
blessés au TLA 15 jours après le début du traitement, sont
sacrifiés à différents temps par dislocation cervicale et
les muscles TLA sont récupérés immédiatement
après le sacrifice.
2.1.2 Traitement au GW0742 par l'alimentation
La moitié des souris reçoit de la nourriture
standard (AO4) supplémentée en GW0742 (3 mg/kg/jour). Pour cela,
2g de bicarbonate est dissout dans 1L d'eau miliQ, puis 28mg de GW0742 sont
rajoutés ou non suivant la nourriture produite. Ensuite, 1kg de
croquettes est mélangée dans la solution. L'autre moitié
des souris, qui sont les souris
9
« contrôle » ne reçoivent que de la
nourriture supplémentée en DMSO (véhicule). Tous les 3 ou
4 jours, la nourriture restante et les souris sont pesées, puis la
nourriture est renouvelée.
2.1.3 Blessure musculaire
Après 15 jours de traitement, les souris sont
blessées, sous anesthésie gazeuse (Vetflurane) à la patte
gauche avec une injection de 50 ul de cardiotoxine (0,03 mg/ml, purifiée
à partir du venin de serpent Naja pallida) et reçoivent une
injection de 50ìl de sérum physiologique à la patte droite
(patte contrôle). Pour des raisons éthiques, un anti-douleur
(Buprenorphine) est administré en sous-cutané (Buprecare :
30ìg/ml) 20 minutes avant l'anesthésie.
2.1.4 Evaluation des capacités
fonctionnelles
Une partie des souris (celles sacrifiées aux jours 7 et
14 post-blessure), est évaluée physiquement la veille de
l'injection de cardiotoxine et la veille du sacrifice. Les souris sont
habituées à faire les tests une semaine avant l'évaluation
des tests physiques.
- Grip test :
Le grip test permet d'évaluer la force maximale des
membres supérieurs des souris. Les souris sont tenues pas la queue,
s'agrippent à l'appareil et l'opérateur essaie d'éloigner
la souris de la barre. Le test est répété plusieurs fois
(au minimum deux fois) et la meilleure valeur est retenue. La force maximale
est mesurée en Newton par gramme (N/g).
- Tapis roulant :
L'exercice consiste à courir en un temps limite sur un
tapis roulant incliné à 5° (1 heure maximum) au moins
à 30 cm/s (35cm/s les 15 dernières minutes) après une
augmentation progressive de l'intensité de l'effort (30 secondes
à 15 cm/s, 30 secondes à 20 cm/s, 30 s à 25 cm/s). Les
souris reçoivent des stimulations électriques (0,2 mA a une
fréquence de 0,25 Hz) pour stimuler la course (maximum 50 stimulations).
L'exercice est arrêté lorsque les souris ont reçu plus de
50 stimulations.
2.1.5 Sacrifice et prélèvement des
tissus
6 souris traitées au GW0742 et 6 souris traitées
au DMSO sont sacrifiées aux différents temps par dislocation
cervicale. Elles sont ensuite pesées puis les TLA gauches
10
et droits sont récupérés et pesés.
Sur 4 souris traitées au GW0742 et 4 souris traitées au DMSO, les
2/3 de chaque TLA sont récupérés pour la technique de
dissociation des cellules musculaires et de cytométrie en flux et le
tiers restant (haut du TLA) est mis à congeler à -80° pour
la technique de RT qPCR. Sur les 4 autres souris, chaque TLA est
prélevé et mis dans un tube avec de l'Optimal Cutting Temperature
compound (OCT) puis congelé à -80° pour la technique
d'histologie et d'immunohistochimie.
2.2 Techniques et dosages
2.2.1 Dissociation du muscle squelettique et
cytométrie en flux
Après la dissection du TLA, celui-ci est nettoyé
dans du Phostphate Buffer Saline (PBS) puis mis dans un tube contenant 3mg de
collagénase de type A et 1.5 ml de DMEM 10% de sérum foetal de
veau (SVF). Le TLA est ensuite dissocié grâce à la
collagénase et aux différents temps d'incubations à
37° (une fois 60 minutes puis 15 minutes). Une fois la dissociation
terminée, les culots sont repris dans 1 ml de DMEM 20% SVF. Les cellules
sont ensuite marquées avec des anticorps spécifiques des
protéines d'intérêt (listés ci-dessous)
couplés à différents fluorochromes. Puis elles sont
passées devant un faisceau laser pour mesurer leur taille, leur
granulosité et la longueur d'onde émise par le fluorochrome
après excitation. Les cellules sont donc reconnues en fonction de la
fluorescence qu'elles émettent. Les cellules reprises dans un volume de
300ul de DPBS 0,5% SVF, passent dans le cytomètre. Après
différents contrôles (morphologie, viabilité, compensation
des fluorochromes), les cellules sont analysées individuellement. Trois
types de cellules sont étudiées : Les lymphocytes T, les
macrophages et les cellules satellites à différents temps post
blessure (J4, J7, J9 et J14).
Tableau 1 : Types cellulaires et anticorps
|
Types cellulaires
|
Anticorps et fluorochromes
|
|
Cellules satellites
|
CD34- FITC/ Iá7-APC
|
|
Macrophages
|
F4/80-APC/ CD11b-PEcy7/ CD11c-PE
|
|
Lymphocytes T totaux
|
CD3-PE/ CD4-APC/ CD8-PERCP
|
2.2.2 Extraction d'ARN, Reverse transcription (RT) et PCR
quantitative (qPCR) Les ARN totaux sont extraits à partir de 1/3
des muscles TLA lysés dans 1mL de trizol auquel est ensuite
ajouté du chloroforme. Ils sont ensuite précipités sur la
nuit avec
11
de l'isopropanol. Après lavage avec de l'éthanol
70%, les ARN sont repris dans de l'eau ne contenant pas de RNase et
dosés avec la technique de spectrophotométrie (Nanodrop).
Ensuite, les ARN sont rétro-transcrits grâce au kit QuantiTech
reverse transcription (Qiagen) afin d'obtenir de l'ADN complémentaire
(ADNc). Après l'élimination de l'ADN génomique par ajout
du gDNA « wipeout » buffer, 1 ug d'ARN est rétro-transcrit
pendant 30 minutes à 42°C avant l'inactivation de l'enzyme par la
chaleur (95°C) pendant 3 min. Enfin, l'ADNc est
récupéré puis dilué au 1/50 en présence de
0.3uM de primer listés ci-dessous, et de SYBRGreen (Takara). Toutes les
réactions de qPCR sont réalisées en triplicats. La
quantité relative des ARNm est calculée selon la méthode
de CT comparatif et le gène 36B4 est utilisé comme gène de
référence.
Tableau 2 : Séquences des primers
|
Nom
|
Séquence
|
|
PPARâ
|
F-AGATGGTGGCAGAGCTATGACC/R-TCCTCCTGTGGCTGTTCC
|
|
PDK4
|
F-GGGTCTCAATAGTGTCACC/R-GTGGGCCTGGGCATTTAGCA
|
|
CD34
|
F-GGAGTTCTGCTGGCCATCTT/R-TAAGGGTCTTCACCCAGCCTT
|
|
Pax7
|
F-CGATTAGCCGAGTGCTCAGA/R-GGAGGTCGGGTTCTGATTCC
|
|
MyoD
|
F-AGCACRACAGTGGCGACTCA/R-GCTCCACTATGCTGGACAGG
|
|
Myf5
|
F-TGAGGGAACAGGTGGAGAAC/R-AGCTGGACACGGAGCTTTT
|
|
MRF4
|
F-AGAGGGCTCTCCTTTGTATCC/R-CTGCTTTCCGACGATCTGTGG
|
|
Myogénine
|
F-AACTACCTTCCTGTCCACCTTCA/R-GTCCCCAGTCCCTTTTCTTCCA
|
|
Myostatine
|
F-CAGCCATGGTAGTAGACCGC/R-TACAGCCTGTGGTGCTTGAA
|
|
36B4
|
F-TCCAGGCTTTGGGCATCA/R-CTTTATCAGCTGCACATCACTCAGA
|
2.3 Analyses statistiques
Les comparaisons appariées entre les pattes
contrôles et les pattes blessées ont été
testées par le test de rang de Wilcoxon et quand le nombre de souris
était inférieur à 4, nous avons utilisé le test
exact de permutation. L'effet du traitement (GW0742 vs DMSO) a
été évalué en utilisant le test de Mann et Whitney.
La cinétique de régénération a été
testée grâce au test de Kruskal Wallis en considérant les 3
groupes (J4, J7 et J14). Les différences sont considérées
comme significatives pour une valeur de p < 0.05. Les résultats sont
présentés sous forme de moyenne #177; écart type. Les
données sont analysées
12
avec le logiciel Statview (version 4.57) et le logiciel
StatXact (version 8) pour le test exact de permutation.
3. Résultats
Dans un premier temps, nous avons vérifié que
l'agoniste de PPARâ (le GW0742) administré dans la nourriture des
souris conduisait bien à une activation de la voie PPARâ. La
quantité d'ARNm du gène PDK4 (gène cible de PPARâ
dans le muscle), est significativement plus élevée (2,5 fois)
dans le TLA des souris traitées au GW0742 pendant 15 jours, que dans le
TLA des souris contrôles (Figure 2), confirmant que la voie PPARâ
est plus active dans le TLA de souris traitées au GW0742. En revanche,
nous n'avons pas observé de variation significative de masse corporelle
des souris en réponse au traitement.
ARNm PDK4
|
4
|
|
|
|
|
|
|
|
U.A expression de PDK4
|
|
|
|
|
|
|
|
3
2
|
|
|
|
|
*
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1
0
|
|
|
|
|
|
|
|
|
|
|
|
|
|
DMSO GW
Figure 2 : Quantité
d'ARNm de PDK4 dans les TLA de souris traitées ou non au GW0742. * :
p< 0.05 Différent de DMSO.
Indépendamment de la blessure, et afin d'établir
une valeur basale de référence, nous avons évalué
si l'apport de GW0742 impactait sur l'expression des gènes
utilisés dans la caractérisation des différentes
étapes du processus de régénération. La
quantité d'ARNm de Pax7 est significativement plus basse dans le TLA des
souris traitées avec du GW0742. Aucune différence significative
n'est montrée pour les autres gènes (Tableau 3).
Tableau 3 : Rôle des gènes
impliqués dans la régénération musculaire et
quantité d'ARNm dans les TLA de souris non blessées,
traitées au GW0742 ou avec un véhicule (DMSO). Les valeurs
présentées sont des moyennes +/- écart-type.
|
[ARNm]
|
Marqueurs des
|
Traitement
DMSO. n=6
|
Traitement
GW0742. n=6
|
|
Pax7
|
Cellules satellites quiescentes, actives
|
0,77
|
#177; 0,21
|
0,47
|
#177; 0,23
|
*
|
|
Myf5
|
Cellules satellites activées, destinées à
proliférer
|
1,00
|
#177; 0,43
|
0,54
|
#177; 0,32
|
|
|
MyoD
|
Myoblastes proliférés destinées à se
différencier
|
1,19
|
#177; 0,42
|
0,77
|
#177; 0,56
|
|
|
CD34
|
Cellules souches hématopoïétiques
|
1,36
|
#177; 1,06
|
0,38
|
#177; 0,08
|
|
|
Myogénine
|
Myocytes en train de se différencier
|
1,07
|
#177; 0,67
|
0,91
|
#177; 0,77
|
|
|
MRF4
|
Myocytes en train de fusionner
|
0,93
|
#177; 0,11
|
0,92
|
#177; 0,13
|
|
13
|
Myostatine
|
Maintient cellules satellites quiescentes
|
0,29 #177; 0,12
|
0,20 #177; 0,04
|
|
CD68
|
Monocytes
|
1,41 #177; 0,47
|
1,06 #177; 0,17
|
|
PPARâ
|
Facteur de transcription impliqué dans l'inflammation, le
métabolisme et la prolifération
|
0,84 #177; 0,29
|
0,91 #177; 0,77
|
* : p < 0.05 versus DMSO
La blessure induite par la CTX dans le TLA des souris a
conduit à une différence de masse corporelle plus
élevée chez les souris traitées au GW0742 qui tend
à être négativement plus élevée que celle des
souris contrôles (p= 0.06) (Tableau 4), ceci à tous les temps. De
même, nous observons une tendance (p=0.06) à ce que la variation
de masse des TLA (comparativement à la masse des TLA non blessés)
soit plus élevée, quel que soit le temps de sacrifice
post-blessure, chez les souris traitées au GW0742, comparativement aux
souris contrôles (Tableau 4). Néanmoins, toutes les souris ont
récupéré leur masse de TLA initial au jour 14
post-blessure.
Tableau 4 : Effet du GW0742 sur la variation de masse
des TLA blessés versus contrôles et sur la variation de masse
corporelle des souris, entre le jour de la blessure et les temps de
sacrifice.
|
Variation poids souris (g)
|
Variation masse TLA blessés versus contrôles (mg)
|
|
DMSO
|
GW0742
|
DMSO
|
GW0742
|
|
Jour blessure à J4 post blessure
|
0,05 #177; 0,30
|
-1,08 #177; 2,05
|
-8,61 #177; 1,38 *
|
-13,2 #177; 2,01 *
|
|
Jour blessure à J7 post blessure
|
0,06 #177; 2,43
|
-0,62 #177; 2,36
|
-6,9 #177; -2,59 *
|
-6,36 #177; 3,58 *
|
|
Jour blessure à J14 post blessure
|
1,36 #177; 0,68
|
-0,28 #177; 1,65
|
7,14 #177; 2,63
|
1,31 #177; 5,27
|
* : p< 0.0005 versus 0. Test univarié non
paramétrique.
Il y a une diminution significative des performances
d'endurance chez les souris traitées au GW0742, après la
blessure. En revanche, le traitement au GW0742 n'a pas conduit à de
différence significative sur les performances de force (Tableau 5). Il
est à noter que le traitement n'a pas conduit à de diminution
significative des capacités physiques avant la blessure.
Tableau 5 : Variation des performances d'endurance et
de force des souris DMSO et GW0742.
|
Temps limite sur tapis (min)
|
Grip test (N/g)
|
|
Jours sacrifice
|
DMSO
|
GW0742
|
DMSO
|
GW0742
|
|
J7
|
-13,94 #177; 14,69
|
-7,5 #177; 8,54 *
|
-0,005 #177; 0,007
|
0,00 #177; 0,006
|
|
J14
|
-18,04 #177; 22,15
|
-20,35 #177; 13,92 *
|
-0,004 #177; 0,003
|
0,00 #177; 0,006
|
* : p=0.0005 versus 0. Test univarié non
paramétrique.
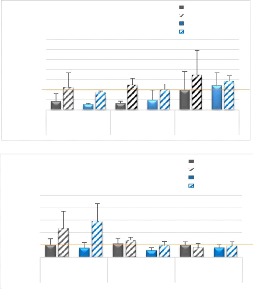
D
U.A expression de MyoD
U.A expression de Pax7
Contrôle DMSO
C) ARNm MyoD Blessée DMSO
Contrôle GW Blessée GW
Contrôle DMSO
A) ARNm Pax7 Blessée DMSO
Contrôle GW Blessée GW
2,5
2,0
3,5
3,0
0,5
0,0
4
2
1,5
1,0
5
3
0
1
DMSO GW DMSO GW DMSO GW
DMSO GW DMSO GW DMSO GW
J4 J7 J14
J4 J7 J14
#
#
#
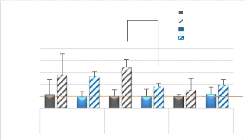
Contrôle DMSO
B) ARNm Myf5 * Blessée DMSO
Contrôle GW Blessée GW
5
U.A expression de Myf5
4
2
5
3
0
1
DMSO GW DMSO GW DMSO GW
J4 J7 J14
#
#
Figure 3 : Quantités
d'ARNm dans les TLA des marqueurs exprimés dans les cellules satellites
lors de l'état quiescent, activé et de prolifération,
selon les conditions de
14
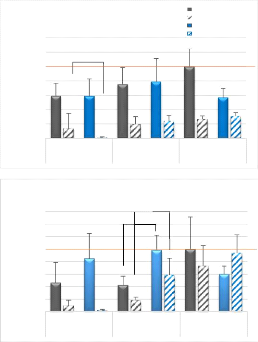
3.1 Effet de la blessure sur la cinétique de
régénération musculaire
3.1.1 Expression des gènes impliqués dans les
étapes de la régénération musculaire
Avec la technique de RT-qPCR, nous avons pu comparer les
quantités d'ARN messagers des gènes impliqués aux
différentes étapes du processus de
régénération. La blessure du TLA a conduit dans le TLA
blessé (comparativement au TLA contrôle) à une augmentation
des quantités d'ARNm de Myf5, MyoD et Myogénine (Figure 3-B, C ;
Figure 4-B) et à une diminution des quantités d'ARNm de MRF4
(Figure 4-C) au jour 4. Cette différence entre patte blessée et
contrôle est significative dans les 2 groupes (DMSO et GW0742) au jour 4
pour Myogénine et MRF4. Pour Pax7, Myf5 et MyoD, la différence
entre patte blessée et contrôle au jour 4 n'est significative que
pour le groupe traité au GW0742 (Figure 3-A, B, C). Les quantités
d'ARNm de MyoD et de MRF4 reviennent à des valeurs non
différentes des pattes contrôles au jour 7 (Figure 3-C ; Figure
4-C), alors que les quantités de Pax7, Myf5 et Myogénine restent
significativement plus élevées dans les pattes blessées au
jour 7 pour revenir à des valeurs non différentes des valeurs
observées dans les pattes contrôles au jour 14 (Figures 3-A et B ;
Figure 4-B).
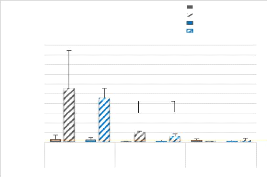
15
blessure et de traitement aux différents temps
post-blessure. Les valeurs présentées sont des moyennes +/-
écart-type. * : p < 0.05 Différence significative entre les
pattes blessées DMSO et GW0742 (Test de Mann et Whitney) ; # : p <
0.05 Différence significative entre pattes blessées et pattes
contrôles (Test exact de permutation) ; Trait orange : Niveau
d'expression de base chez des souris non blessées traitées au
DMSO.
Dans les deux groupes, les quantités d'ARNm de CD34
dans les TLA blessés ne sont pas significativement différentes au
jour 4 post-blessure des pattes contrôles, mais le sont au jour 7
post-blessure et le restent au jour 14 dans le groupe DMSO (Figure 4-A).
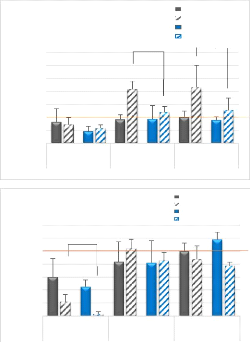
U.A expression de MRF4
U.A expression de CD34
Contrôle DMSO
C) ARNm MRF4 Blessée DMSO
Contrôle GW Blessée GW
Contrôle DMSO
A) ARNm CD34 Blessée DMSO
Contrôle GW Blessée GW
0,8
0,6
0,4
0,2
0,0
1,4
1,2
1,0
2,5
2,0
3,5
3,0
0,5
0,0
1,5
1,0
DMSO GW DMSO GW DMSO GW
DMSO GW DMSO GW DMSO GW
#
§
§ §
J4 J7 J14
J4 J7 J14
*
#
§
#
* P=0,15
#
#
U.A expression de Myogénine
B) ARNm Myogénine
45
40
25
20
50
35
30
15
10
5
0
DMSO GW DMSO GW DMSO GW
#
§
J4 J7 J14
#
§
# #
*
Contrôle DMSO Blessée DMSO Contrôle GW
Blessée GW
Figure 4 : Quantités
d'ARNm dans les TLA des marqueurs de la différenciation et de la fusion
des cellules musculaires selon les conditions de blessure et de traitement aux
différents temps post-blessure. Les valeurs présentées
sont des moyennes +/- écart-type. * : p < 0.05 Différence
significative entre les pattes blessées DMSO et GW0742 ; # : p < 0.05
Différence significative entre pattes blessées et pattes
contrôles ; § : p < 0.05 Différence significative entre le
jour 4 et les autres jours (Test de Kruskal Wallis); Trait orange : Niveau
d'expression de base chez des souris non blessées traitées au
DMSO
3.1.2 Effet de la blessure sur l'expression des
gènes Myostatine et PPARâ
Quel que soit le traitement administré, la
quantité de Myostatine (Figure 5-A) est plus faible dans les pattes
blessées que dans les pattes contrôles, ceci à tous les
temps
16
post-blessure. Dans les pattes blessées, son expression
est toutefois significativement plus faible 4 jours post-blessure
comparativement aux autres jours. Les quantités d'ARNm de PPARâ
(Figure 5-B) et de PDK4 (un gène cible-de PPARâ) (Figure 5-C) sont
plus basses au jour 4 dans les pattes blessées comparativement aux
pattes contrôles. Cette différence n'est pas observée aux
jours 7 et 14. La quantité de PPARâ et de PDK4 revient à
des valeurs non différentes des pattes contrôles au jour 7.
U.A expression de Myostatine
U.A expression de PDK4
Contrôle DMSO
A) ARNm Myostatine Blessée DMSO
Contrôle GW Blessée GW
C) ARNm PDK4
0,8
0,6
0,4
0,2
0,0
0,8
0,6
0,4
0,2
0,0
1,6
1,4
1,2
1,0
1,4
1,2
1,0
DMSO GW DMSO GW DMSO GW
DMSO GW DMSO GW DMSO GW
#
#
§
J4 J7 J14
J4 J7 J14
*
#
§
#
#
*
*
#
# #
U.A expression de PPARâ
B) ARNm PPARâ
0,8
0,6
0,4
0,2
0,0
1,8
1,6
1,4
1,2
1,0
DMSO GW DMSO GW DMSO GW
# #
§ §
J4 J7 J14
*
Contrôle DMSO Blessée DMSO Contrôle GW
Blessée GW
Figure 5 : Quantité
d'ARNm (A) de Myostatine, (B) de PPARâ et (C) de PDK4 selon les
conditions de blessure et de traitement aux différents temps
post-blessure. Les valeurs présentées sont des moyennes +/-
écart-type. * : p < 0.05 Différence significative entre les
pattes blessées DMSO et GW0742 ; # : p < 0.05 Différence
significative entre pattes blessées et pattes contrôles ; § :
p < 0.05 Différence significative entre le jour 4 et les autres jours
; Trait orange : Niveau d'expression de base chez des souris non
blessées traitées au DMSO.
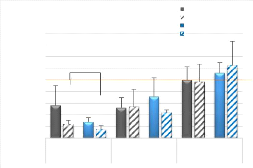
3.1.2 Effet de la blessure sur la réponse
immunitaire (macrophages, lymphocyte T)
La blessure conduit à une augmentation significative du
nombre de macrophages
totaux dans les pattes blessées, à tous les temps.
Le nombre de macrophages M1
17
(macrophages pro-inflammatoires) est significativement plus
élevé dans les pattes blessées par rapport aux pattes
contrôles (à tous les temps) alors que le nombre de M2
(macrophages anti-inflammatoires) n'est significativement plus
élevé comparativement aux pattes contrôles qu'au jour 4
post-blessure (Figure 6-A) et au jour 7 pour les souris DMSO. L'expression de
CD68, un marqueur de surface des macrophages (totaux) dans le TLA des souris
est significativement (50 fois) plus élevé au jour 4 dans les
pattes blessées, confortant la réponse immunitaire induite par la
blessure observée par l'analyse par cytométrie de flux (Figure
6-B).
*
§
350
#
300
J14 GW
250
*
##
*
§
200
#
#
#
#
#
150
#
#
#
#
#
§
100
#
50
§
0
Cont Blessée
Cont Blessée
Cont Blessée
Macrophages totaux
A) Nombre de macrophages pour 10mg de TLA J4
DMSO
J4 GW
J7 DMSO J7 GW
J14 DMSO
Macrophages Pro-inflammatoires (M1) Macrophages
Anti-inflammatoires (M2)
P=0,08
Contrôle GW Blessée GW
§
#
Contrôle DMSO
A) ARNm CD68 Blessée DMSO
§
U.A expression de CD68
120
#
100
80
60
40
20
0
#
#
#
DMSO GW
J4
DMSO GW
J7
DMSO GW
J14
Figure 6 : Nombre de macrophages
totaux et sous populations M1 et M2 pour 10mg de TLA et quantité d'ARNm
de CD68, un marqueur des macrophages, selon les conditions de blessure et de
traitement aux différents temps post-blessure. Les valeurs
présentées sont des moyennes +/- écart-moyen (macrophages)
ou écart-type (CD68). * : p < 0.05
18
Différence significative entre les pattes
blessées DMSO et GW0742 ; # : p < 0.05 Différence
significative entre pattes blessées et pattes contrôles ; § :
p < 0.05 Différence significative entre le jour 4 et les autres jours
; Trait orange : Niveau d'expression de base chez des souris non
blessées traitées au DMSO
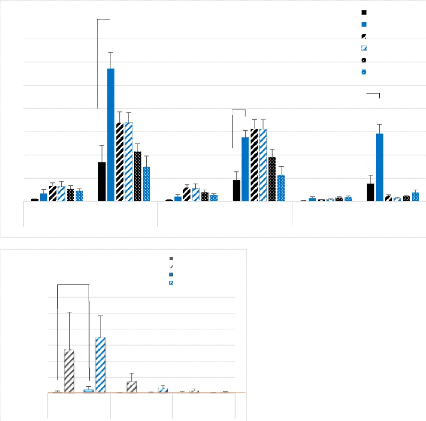
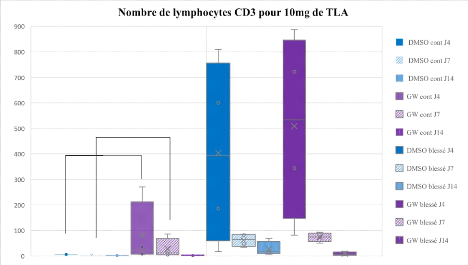
Le nombre de lymphocytes T (Figure 7) est significativement
plus élevé 4 jours post-blessure, dans les pattes blessées
des souris DMSO par rapport aux pattes contrôles. A partir du
7ème jour, le nombre de lymphocytes est fortement
diminué. A 4 jours post-blesure, les pattes blessées des souris
DMSO sont infiltrées de CD4+ et de CD8+, puis ces populations ne sont
plus représentées à partir du 7ème jour
(Tableau 6).
P=0,08
P=0,08
#
# #
§
#
Figure 7 : Nombre de lymphocytes
CD3, pour 10mg de TLA selon les conditions de blessure et de traitement aux
différents temps post-blessure. Boites à moustaches
résumant le maximum, les quartiles Q1, Q2 (médiane) et Q3 et le
minimum. # : p < 0.05 Différence significative entre pattes
blessées et pattes contrôles ; § : p < 0.05
Différence significative entre le jour 4 et les autres jours ; Trait
orange : Niveau d'expression de base chez des souris non blessées
traitées au DMSO
19
Tableau 6 : Nombre de lymphocytes T CD4+ et CD8+ pour 10mg
de TLA
|
Nombre CD4 pour 10mg TLA
|
|
Nombre CD8 pour 10mg TLA
|
|
|
Jours
|
Traitement
|
Contrôle
|
|
Blessée
|
|
Contrôle
|
Blessée
|
|
|
J4
|
DMSO
|
2,94 #177; 1,81 §
|
|
147,27 #177; 135,84
|
§ #
|
0,98 #177; 0,63
|
82,05 #177; 72,49
|
#
|
|
GW
|
25,24 #177; 42,24
|
§
|
122,52 #177; 114,29
|
§ #
|
22,35 #177; 39,84
|
102,4 #177; 73,73
|
#
|
|
J7
|
DMSO
|
2,25 #177; 0,80
|
|
26,81 #177; 17,65 #
|
|
0,86 #177; 0,64
|
6,5 #177; 4
|
|
|
GW
|
6,12 #177; 6,42
|
|
36,45 #177; 8,26 #
|
|
1,13 #177; 1,31
|
10,59 #177; 5,54
|
|
|
J14
|
DMSO
|
0,45 #177; 0,40
|
|
3,37 #177; 2,04
|
|
0,98 #177; 0,87
|
14,88 #177; 19,72
|
|
|
GW
|
0,55 #177; 0,61
|
|
0,89 #177; 0,34
|
|
1,22 #177; 1,56
|
4,28 #177; 4,46
|
|
# : p < 0.05 Différence significative entre
pattes blessées et pattes contrôles ; § : p < 0.05
Différence significative entre le jour 4 et les autres jours.
3.2 Effet du traitement GW0742 sur la
cinétique de régénération du
muscle
3.2.1 Effet du traitement GW0742 sur la
cinétique des quantités d'ARNm des
gènes impliqués dans la
régénération musculaire
La réponse musculaire à la blessure varie en
fonction du traitement administré. Le
traitement GW0742 conduit à une
récupération plus rapide du niveau d'expression basal observable
de Myf5, CD34 et de Myogénine. En effet, les quantités d'ARNm de
Myf5 (Figure 3-B), CD34 (Figure 4-A) et Myogénine (Figure 4-B) sont
significativement plus basses dans les TLA blessés des souris GW0742
comparativement à celles des souris DMSO. La différence n'est
plus significative après le jour 7 pour Myf5 (Figure 3-B),
Myogénine (Figure 4-B) et CD34 (Figure 4- A). Les quantités
d'ARNm de MRF4 sont significativement plus basses dans les TLA blessés
des souris traitées au GW0742 comparativement aux TLA des souris DMSO
(Figure 4-C). Cette différence n'est plus significative au jour 7. Le
traitement au GW0742 a également conduit à des diminutions plus
marquées, significatives au jour 4, des quantités d'ARNm de
myostatine et de PPARâ en réponse à la blessure,
comparativement à celles des souris traitées au DMSO (Figure 5-A,
B). La quantité d'ARNm de PDK4 est, quant à elle,
significativement plus élevée au jour 7 post-blessure chez les
souris traitées au GW0742, dans les pattes blessées ainsi que
dans les pattes contrôles comparées au souris DMSO (Figure 5-C).
Nous n'avons pas observé d'effet significatif du traitement sur le
nombre de cellules satellites (évalué au jour 9), que ce soit
dans les pattes blessées ou dans les pattes contrôles (DMSO : 211
#177; 153 et GW : 129 #177; 57 cellules pour 10mg de TLA).
20
3.2.2 Effet du traitement GW0742 sur la réponse
immunitaire
(macrophages et lymphocytes T) induite par la blessure
dans le muscle TLA.
Au jour 4 post-blessure, les macrophages totaux, de type M1 et
de type M2 sont en nombres plus élevés dans les pattes
blessées GW0742 comparées aux pattes blessées DMSO (Figure
6-A). Il n'y a pas de différence significative de quantité d'ARNm
de CD68 (Figure 6-B) au jour 4 post-blessure. Au regard du nombre de
lymphocytes T totaux (CD3), une tendance (p=0,08) à une
sur-représentation de cette population est observée au jour 4 et
7 chez les souris GW0742 comparativement au souris DMSO, dans les pattes
contrôles, sans différence significative au jour 14 post-blessure
(Figure 7). L'ensemble de ces effets apparait montrer une réponse
immunitaire globale plus marquée en réponse au traitement par le
GW0742.
4. Discussion
Dans ce mémoire, nous nous sommes demandé si une
activation pharmacologique de la voie PPARâ peut conduire à une
accélération du processus de régénération
impliquant des effets sur les phases inflammatoires et de réparation.
L'activité de la voie PPARâ peut être augmentée de
deux façons : par une augmentation de l'expression de la protéine
PPARâ et/ou par une augmentation de son activation en augmentant la
quantité de ligand (Neels et Grimaldi., 2014). Dans notre étude,
nous avons traité des souris avec du GW0742, un agoniste puissant et
spécifique de PPARâ, dans l'objectif d'augmenter l'activation de
PPARâ dans le TLA. L'augmentation observée, dans le TLA, de
l'expression de PDK4, un gène-cible de PPARâ, après 15
jours de traitement au GW0742 administré dans l'alimentation des souris,
témoigne que le l'agoniste a bien induit l'activation de PPARâ.
Cet effet est d'une amplitude comparable à celui induit en
réponse à 48h de traitement GW0742 administré par voie
sous-cutanée (Giordano et al., 2008).
Nous montrons que les effets du GW0742 observés dans
les TLA des souris non blessées, ne sont pas totalement similaires
à ceux observés dans les TLA non blessés des souris qui
ont subi une blessure sur l'autre patte. En effet, la blessure dans le TLA a
conduit à une diminution de l'expression de PPARâ lui-même,
significative au jour 4 post-blessure et davantage marquée chez les
souris traitées avec du GW0742. L'augmentation de l'activité de
la voie JNK (voie du stress impliquée dans la réponse
inflammatoire) en réponse à la blessure (Alter et al., 2008)
pourrait expliquer cet effet.
21
En effet, cette voie apparait jouer un rôle dans la
régulation du niveau d'expression de PPARâ (Rousseau et al.,
2016). PPARâ est par ailleurs connu, dans d'autres modèles
cellulaires, pour être impliqué dans la régulation de
l'inflammation par son interaction physique avec la sous-unité p65 de
NF-êB, inhibant par ce biais son activité transcriptionnelle
(Neels et Grimaldi., 2014). Cet effet pourrait-être dépendant du
niveau d'expression protéique de PPARâ (Neels et Grimaldi., 2014).
Il est donc possible que la baisse de l'expression de PPARâ en
réponse à la blessure, soit une réponse adaptative pour
permettre une moindre interaction inhibitrice de PPARâ sur la voie
NF-êB et ainsi permettre l'activité transcriptionnelle de ce
dernier. NF-êB est en effet un facteur de transcription impliqué
dans l'expression de plusieurs cytokines pro-inflammatoires dont le
TNF-á qui est connu comme nécessaire au bon déroulement du
processus de régénération (Chen et al., 2005). Nous avons
également montré une plus forte augmentation du nombre de
macrophages et de lymphocytes T CD3 infiltrés au jour 4 post-blessure
chez les souris traitées au GW0742, dans les pattes contrôles et
dans les pattes blessées. L'ensemble de ces effets nous laisse penser
que le traitement au GW0742 augmente le stress inflammatoire induit par la
blessure. En parallèle, la quantité de myostatine est plus faible
chez les souris traitées au GW0742 par rapport aux souris DMSO au jour
4. Il a été montré qu'une inhibition de l'expression de la
myostatine favorise l'infiltration des macrophages durant les premiers jours de
la régénération musculaire (McCroskery et al., 2005) et
favorise l'activation et la prolifération des cellules satellites. Le
mécanisme est encore peu étudié mais l'infiltration des
macrophages serait due à une augmentation de la quantité de
chémoattractants dans l'environnement de la blessure (Siriettet al.,
2006). Nous pouvons donc suggérer que l'augmentation du nombre de
macrophages observable au jour 4 post-blessure plus marquée en
réponse au traitement GW0742 est, au moins en partie, la
conséquence de la baisse de l'expression de la myostatine et donc
possiblement de son activité. Toutefois, il est connu que l'activation
de PPARâ favorise l'angiogenèse (Gaudel et al., 2008 ; Wagner et
al., 2009). L'augmentation de la capillarisation du muscle, induite par le
traitement, pourrait également expliquer un nombre de cellules
immunitaires (macrophages et lymphocytes) infiltrées, également
observable dans les pattes contrôles, plus élevé dans le
TLA des souris traitées.
22
Pour rappel, les macrophages jouent un rôle crucial lors
de la phase de régénération du muscle. Il a
été montré qu'en l'absence de macrophages, le délai
de prolifération et de différenciation des cellules satellites
est augmenté (Segawa et al., 2008). En effet, les macrophages
pro-inflammatoires (de type M1) vont permettre aux cellules satellites
d'entamer leur prolifération (Chazaud B et al., 2009) et sont
prédominants dans le muscle après la blessure avant que
n'augmente le nombre de macrophages anti-inflammatoires (de type M2) qui eux
vont permettre aux myoblastes de se différencier et de fusionner
(Chazaud B et al., 2009). Dans notre étude, les macrophages sont en
nombre plus élevé dans le muscle jusqu'au septième jour
puis leur nombre diminue, ce qui est en accord avec d'autres études sur
la régénération musculaire (Novak et al., 2014 ; Wang et
al., 2014). De plus, le traitement au GW0742 conduit à la fois à
un nombre de macrophages de type M1 mais aussi de type M2 plus
élevé dans le muscle, observable 4 jours post-blessure, que le
traitement avec du DMSO, sans différence au jour 7. Le rôle des
macrophages dans le processus de régénération est
dépendant non seulement de leur nombre et de leur profil mais aussi de
la chronicité de leur présence (Mann et al., 2011), ce qui laisse
penser que leur présence en plus grand nombre chez les souris
traitées avec du GW0742 puisse être favorable à une
réponse adaptative plus marquée à la blessure. En effet,
nous observons sur plusieurs marqueurs de la régénération
un retour plus rapide (7 jours versus 14 jours) vers des valeurs de base, chez
les souris traitées avec du GW0742 comparativement aux souris
contrôles. De manière intéressante, et même si nous
ne l'avons pas quantifié dans le cadre de ce travail, l'augmentation du
nombre de macrophages devrait s'accompagner d'une modification des
sécrétions de cytokines. Sachant que les cytokines telles que le
TNF-á, l'IL-1â et l'IL-6 sont sécrétées par
les macrophages pro-inflammatoires et favorisent la prolifération des
cellules satellites (Strle et al., 2006; Otis et al., 2014; Cantini et al.,
1995), et que l'IL-10, et l'IL-4 sont sécrétées par les
macrophages anti-inflammatoires et favorisent la différenciation des
myoblastes (Villalta et al., 2011; Horsley et al., 2003), nous pensons qu'une
augmentation aigue des macrophages à la fois de type M1 et de type M2
dans les premiers jours suivant la blessure peut favoriser la
prolifération et la différenciation des cellules satellites et
donc être "bénéfique" au processus de
régénération. Toutefois, nous n'avons pas montré de
différence significative, liée au traitement, sur la
quantité de Myf5, de MyoD et de Myogénine (marqueurs de
prolifération et de différenciation des cellules satellites)
au
23
jour 4 post-blessure. En accord avec l'étude de Lee et
al (2013) les gènes Myf5, MyoD, myogénine et myostatine varient
de la même façon, dans notre étude, en réponse
à une blessure musculaire induite. En revanche, au regard des effets du
traitement GW0742, nos résultats diffèrent de ceux de Gaudel et
al (2008) qui, chez la souris qui n'était pas sujette à une
blessure musculaire et dont le traitement était administré par
voie sous-cutanée pendant une durée de 96h maximum, montraient
une augmentation de l'expression de Myf5 et de MyoD. De manière
intéressante, les effets montrés étaient rapides et
transitoires. En effet, l'expression de Myf5 est élevée
dès 2h post-injection puis diminue significativement après 48h de
traitement. De même, l'expression de MyoD est élevée
dès 5h de traitement, reste élevée jusqu'à 48h de
traitement, mais retourne à des valeurs de base après 96h (Gaudel
et al., 2008). Une autre étude (Lee et al., 2016) a montré qu'en
traitant des C12 en culture avec du GW0742 pendant 2 jours, la quantité
d'ARNm de MyoD et de Myogénine était significativement
augmentée. Ces études diffèrent méthodologiquement
de la notre au regard du modèle utilisé (C12, TLA de souris non
blessées) et du traitement (durée, mode d'administration). Dans
notre étude, au jour 7 post-blessure, le traitement au GW0742 semble
avoir l'effet inverse des effets du GW0742 préalablement montrés
sur les gènes de Myf5 et de Myogénine (Gaudel et al., 2008 ; Lee
et al., 2016). En effet, la quantité d'ARNm de Myf5 et de
Myogénine revient à un niveau basal dès le
7ème jour de blessure, chez les souris traitées au
GW0742 comparées aux souris DMSO pour qui les quantités d'ARNm
reviennent à leur niveau de base au jour 14 post-blessure. Il est tout
à fait possible de penser que le retour à des valeurs basales
d'expression soit plus rapide mais nous pouvons également penser que la
cinétique d'expression de ces marqueurs entre le jour de la blessure et
le jour 4 soit décalée vers une réponse plus
précoce chez les souris traitées au GW0742. Dans ce dernier cas,
cette réponse pourrait-être déjà terminée 48h
après la blessure. Il serait donc intéressant, dans une prochaine
étude, de regarder ces marqueurs dans les heures qui suivent la
blessure. En parallèle aux effets observés sur les marqueurs de
prolifération et de différenciation et probablement en
cohérence avec ces effets, l'expression du facteur MRF4, un marqueur de
fusion des myocytes et présent dans les fibres matures (Chargé et
al., 2004), est plus basse au jour 4 post-blessure chez les souris
traitées au GW0742 comparée aux souris DMSO. Cet effet laisse
suggérer que sa moindre expression favorise la prolifération et
la différenciation des cellules satellites.
24
Enfin, il est observable dans notre étude que la
Myostatine reste exprimée de manière plus faible dans les pattes
blessées comparées aux pattes contrôles jusqu'au jour 14
post-blessure quel que soit le traitement administré. Il est connu que
la diminution de l'expression de la Myostatine favorise l'activité de la
voie Akt/mTOR (voie de synthèse protéique) impliquée dans
la différenciation et la fusion des myocytes ainsi que dans la
maturation des fibres musculaires (Park et al., 2005 ; Amirouche et al., 2009 ;
Miyabara et al., 2010). Il est donc possible que l'expression de la Myostatine
ne soit pas revenue à un niveau de base car la voie Akt/ mTOR doit
être active pour terminer le processus de maturation des fibres. De plus,
les capacités physiques d'endurance des souris, ne sont pas revenues au
niveau de leur performance initiale, malgré le fait que la masse
musculaire de la patte blessée ne soit pas différente de la patte
contrôle au jour 14 post-blessure, et que les souris ne présentent
pas de problème biomécanique, visible, lors de la marche et de la
course. L'absence de retour à un niveau d'expression de base de la
myostatine ou identique au niveau d'expression dans le TLA de la patte non
blessée au jour 14 post-blessure, suggère que la patte
blessée n'a pas complétement régénéré
au jour 14 quel que soit le traitement administré.
5. Conclusion
Le but de cette étude était de comprendre
davantage l'impact de la voie PPARâ aux différents stades du
processus de régénération musculaire. Pour ce faire, nous
avons vérifié les hypothèses selon lesquelles l'activation
de la voie PPARâ favorise un profil anti-inflammatoire des macrophages
(de type M2) et le recrutement des lymphocytes T pendant la phase inflammatoire
puis favorise la prolifération et la différenciation des cellules
satellites pendant la phase de régénération. En effet, il
est connu que l'activation de la voie PPARâ favorise le remodelage des
fibres musculaires et pourrait par ce biais impacter les dernières
phases du processus de régénération musculaire. Dans cette
étude, nous avons apporté quelques éléments de
preuve montrant que la voie PPARâ est aussi impliquée dans les
phases précoces du processus de régénération. Nous
pouvons conclure que l'activation pharmacologique de la voie PPARâ
favorise les étapes de prolifération et de différenciation
des cellules satellites en affectant positivement la réponse
inflammatoire induite par la blessure. La prolifération et la
différenciation pourraient être plus précoces après
la blessure mais contrairement à l'hypothèse initiale, ces
effets
25
n'apparaissent pas liés à une
amélioration du profil anti-inflammatoire mais au contraire à une
amplitude de la réponse inflammatoire plus élevée.
Toutefois, d'autres analyses par des techniques de RT-qPCR
mais aussi immunohistochimie, doivent être menées pour renforcer
notre argumentation : notamment, le dosage des cytokines
secrétées par les différents types de macrophages et le
dosage de marqueurs de l'angiogenèse dans le TLA.
Dans notre étude, nous n'avons regardé que les
étapes précoces du processus de
régénération, et donc n'avons pas pu déterminer si
l'impact positif de l'activation de la voie PPARâ menait à une
augmentation de la vitesse du processus global de
régénération. En effet, au jour 14 post-blessure, le
processus n'est pas terminé. Dans une prochaine étude il serait
intéressant de sacrifier des souris dans les premières heures et
les premiers jours de la blessure, ainsi que dans les derniers jours où
la régénération musculaire se termine.
S'il s'avère que l'activation de la voie PPARâ a
un impact bénéfique sur la prolifération et la
différenciation des cellules satellites, la compréhension des
mécanismes impliqués dans ces effets pourrait permettre
d'envisager l'activation de PPARâ dans le muscle comme une cible
thérapeutique dans le cadre des maladies musculaires affectant le
processus normal de prolifération et de différenciation.
Toutefois, d'autres modèles que la blessure qui est une contrainte
aigue, nécessiteraient d'être utilisés. Enfin d'autres
études sont nécessaires pour justifier l'intérêt
potentiel d'une activation de la voie PPARâ dans le cadre de la
récupération fonctionnelle post-blessure chez l'athlètes
qui n'a pu être montré ici chez la souris durant la phase
précoce de régénération.
26
Bibliographie
Akhmedov D, Berdeaux R. The effects of obesity on skeletal
muscle regeneration. Front Physiol. 2013 ; 17;4:371.
Allen RE and LK Boxhorn. Regulation of skeletal muscle
satellite cell proliferation and differentiation by transforming growth
factor-beta, insulin-like growth factor I, and fibroblast growth factor.
J.Cell Physiol. 1989 ; 138:311-315.
Alter J, Rozentzweig D, Bengal E. Inhibition of myoblast
differentiation by tumor necrosis factor alpha is mediated by c-Jun N-terminal
kinase 1 and leukemia inhibitory factor. J Biol Chem. 2008 ;
22;283(34):23224-34.
Amirouche A, Durieux AC, Banzet S, Koulmann N, Bonnefoy R,
Mouret C, Bigard X, Peinnequin A, Freyssenet D. Down-regulation of
Akt/mammalian target of rapamycin signaling pathway in response to myostatin
overexpression in skeletal muscle. Endocrinology. 2009 ; 150(1):286-94.
Angione AR, Jiang C, Pan D, Wang YX, Kuang S. PPARö
regulates satellite cell proliferation and skeletal muscle regeneration.
Skelet Muscle. 2011 ; 1(1):33.
Bassaganya-Riera J, Reynolds K, Martino-Catt S, Cui Y,
Hennighausen L, Gonzalez F, Rohrer J, Benninghoff AU, Hontecillas R. Activation
of PPAR gamma and delta by conjugated linoleic acid mediates protection from
experimental inflammatory bowel disease. Gastroenterology. 2004 ;
127(3):777-91.
Bonala S, Lokireddy S, Arigela H, Teng S, Wahli W, Sharma M,
McFarlane C, Kambadur R. Peroxisome proliferator-activated receptor
â/ö induces myogenesis by modulating myostatin activity. J Biol
Chem. 2012 ; 287(16):12935-51.
Burzyn D, Kuswanto W, Kolodin D, L. Shadrach J, Cerletti M,
Jang Y, Sefik E, Guan Tan T, J. Wagers A, Benoist C and Mathis D. A Special
Population of Regulatory T Cells Potentiates Muscle Repair.
Cell. 2013; 155(6): 1282-1295.
Cantini M, Massimino ML, Rapizzi E, Rossini K, Catani C, Dalla
Libera L, Carraro U. Human satellite cell proliferation in vitro is regulated
by autocrine secretion of IL-6 stimulated by a soluble factor(s) released by
activated monocytes. Biochem Biophys Res Commun. 1995
;216(1):49-53.
Castiglioni A, Corna G, Rigamonti E, Basso V, Vezzoli M, Monno
A, Almada A, Mondino A, Wagers AJ, Manfredi A, Rovere-Querini P.
FOXP3+ T Cells Recruited to Sites of Sterile Skeletal Muscle Injury
Regulate the Fate of Satellite Cells and Guide Effective Tissue
Regeneration. PLoS One. 2015; 10(6): e0128094.
Chandrashekar P, Manickam R, Ge X, Bonala S ,McFarlane C,
Sharma M, Wahli W, Kambadur R. Inactivation of PPARâ/ö adversely
affects satellite cells and reduces postnatal myogenesis. Am J Physiol
Endocrinol Metab. 2015;309(2):E122-31.
Chargé SB, Rudnicki MA. Cellular and molecular
regulation of muscle regeneration. Physiol Rev. 2004; 84(1):209-38.
Chazaud B, Brigitte M, Yacoub-Youssef H, Arnold L, Gherardi R,
Sonnet C, Lafuste P, Chretien F. Dual and beneficial roles of macrophages
during skeletal muscle regeneration. Exerc Sport Sci Rev. 2009 ;37(1):18-22.
27
Chen SE, Gerken E, Zhang Y, Zhan M, Mohan RK, Li AS, Reid MB,
Li YP. Role of TNF-{alpha} signaling in regeneration of cardiotoxin-injured
muscle. Am J Physiol Cell Physiol. 2005; 289(5):C1179-87.
D'Souza DM, Al-Sajee D, Hawke TJ. Diabetic myopathy: impact of
diabetes mellitus on skeletal muscle progenitor cells. Front Physiol.
2013 ; 20;4:379.
Gaudel C, Schwartz C, Giordano C, Abumrad NA and Grimaldi PA.
Pharmacological activation of PPARâ promotes rapid and
calcineurin-dependent fiber remodeling and angiogenesis in mouse skeletal
muscle. Am J Physiol Endocrinol Metab. 2008; 295(2): E297-E304.
Horsley V, Jansen KM, Mills ST, Pavlath GK. IL-4 acts as a
myoblast recruitment factor during mammalian muscle growth. Cell 2003
; 113 : 483-94.
Järvinen TA, Järvinen TL, Kääriäinen
M, Kalimo H, Järvinen M. Muscle injuries: biology and treatment. Am J
Sports Med. 2005; 33(5):745-64.
Joulia D, Bernardi H, Garandel V, Rabenoelina F, Vernus B,
Cabello G. Mechanisms involved in the inhibition of myoblast proliferation and
differentiation by myostatin. Exp Cell Res. 2003; 286(2):263-75.
Jory A, Cousin Xavier, Tajbakhsh S. Muscle formation, strain
cells and muscular regeneration. Biofutur. 2007 ; Vol26 (281) :
37-40.
Kanakasabai S, Chearwae W, Walline CC, Iams W, Adams SM,
Bright JJ. Peroxisome proliferator-activated receptor delta agonists inhibit T
helper type 1 (Th1) and Th17 responses in experimental allergic
encephalomyelitis. Immunology 2010; 130: 572-588.
Kanakasabai S, Walline CC, Chakraborty S, Bright JJ. PPARdelta
deficient mice develop elevated Th1/Th17 responses and prolonged experimental
autoimmune encephalomyelitis. Brain Res 2011; 1376: 101-112.
Kang K, Reilly SM, Karabacak V, Gangl MR, Fitzgerald K, Hatano
B, Lee CH. Adipocyte-derived Th2 cytokines and myeloid PPARdelta regulate
macrophage polarization and insulin sensitivity. Cell Metab. 2008;
7(6):485-95.
Karlijn J. Wilschut, Vivian B. Ling and Harold S. Bernstein.
Concise Review: Stem Cell Therapy for Muscular Dystrophies. Stem Cells
Transl Med. 2012; 1(11): 833-842.
Kharraz Y, Guerra J, J. Mann C, L. Serrano A and
Muñoz-Cánoves P. Macrophage Plasticity and the Role of
Inflammation in Skeletal Muscle Repair. Mediators
of Inflammation 2013 ; (10):491497.
Kuang S, Kuroda K, Le Grand F, Rudnicki MA. Asymmetric
self-renewal and commitment of satellite stem cells in muscle. Cell.
2007;129(5):999-1010.
Langley B, Thomas M, Bishop A, Sharma M, Gilmour S, Kambadur
R. Myostatin inhibits myoblast differentiation by down-regulating MyoD
expression. J. Biol. Chem. 2002 ; 277: 4983149840.
Lee YS, Lee SJ. Regulation of GDF-11 and myostatin activity by
GASP-1 and GASP-2.Proc Natl Acad Sci U S A. 2013; 110(39):E3713-22.
Lee SJ, Go GY, Yoo M, Kim YK, Seo DW, Kang JS, Bae GU.
Peroxisome proliferator-activated receptor â/ö (PPARâ/ö)
activates promyogenic signaling pathways, thereby promoting myoblast
differentiation. Biochem Biophys Res Commun. 2016; 470(1):157-62.
28
Luquet S, Lopez-Soriano J, Holst D, Fredenrich A, Melki J,
Rassoulzadegan M, Grimaldi PA. Peroxisome proliferator-activated receptor
ä controls muscle development and oxidative capability FASEB J.
2003; 17(15):2299-301.
Mann CJ, Perdiguero E, Kharraz Y, Aguilar S, Pessina P,
Serrano AL, Muñoz-Cánoves. Aberrant repair and fibrosis
development in skeletal muscle. Skelet Muscle. 2011 ; 4;1(1):21.
Mauro A. Satellite cell of skeletal muscle fibers. J Biophys
Biochem Cytol. 1961; 9:493-5.
McCroskery S, Thomas M, Maxwell L, Sharma M, and Kambadur R.
Myostatin negatively regulates satellite cell activation and self-renewal.
J Cell Biol. 2003; 162(6): 1135-1147.
McCroskery S, Thomas M, Platt L, Hennebry A, Nishimura T,
McLeay L, Sharma M, Kambadur R. Improved muscle healing
through enhanced regeneration and reduced fibrosis in myostatin-null mice.
J Cell Sci. 2005; 118(Pt 15):3531-41.
Miller, KJ, D. Thaloor S. Matteson, and GK Pavlath. Hepatocyte
growth factor affects satellite cell activation and differentiation in
regenerating skeletal muscle. Am.J.Physiol Cell Physiol 2000 ;
278.C174-C181.
Miyabara EH, Conte TC, Silva MT, Baptista IL, Bueno C Jr,
Fiamoncini J, Lambertucci RH, Serra CS, Brum PC, Pithon-Curi T, Curi R, Aoki
MS, Oliveira AC,Moriscot AS. Mammalian target of rapamycin complex 1 is
involved in differentiation of regenerating myofib ers in vivo.Muscle
Nerve. 2010; 42(5):778-87.
Neels JG, Grimaldi PA. Physiological Functions of Peroxisome
Proliferator-Activated Receptor I. Physiological Reviews. 1 July 2014
Vol. 94 no. 3, 795-858.
Novak ML, Weinheimer-Haus EM, Koh TJ. Macrophage activation
and skeletal muscle healing following traumatic injury.J Pathol. 2014;
232(3):344-55
Otis JS, Niccoli S, Hawdon N, Sarvas JL, Frye MA, Chicco AJ
,Lees SJ. Pro-inflammatory mediation of myoblast proliferation. PLoS
One. 2014; 9(3):e92363.
Palomer X, Alvarez-Guardia D, Rodríguez-Calvo R, Coll
T, Laguna JC, Davidson MM, Chan TO, Feldman AM, Vázquez-Carrera M.
TNF-alpha reduces PGC-1alpha expression through NF-kappaB and p38 MAPK leading
to increased glucose oxidation in a human cardiac cell model. Cardiovasc
Res. 2009; 81(4):703-12.
Park IH, Chen J. Mammalian target of rapamycin (mTOR)
signaling is required for a late-stage fusion process during skeletal myotube
maturation. J Biol Chem. 2005; 280(36):32009-17.
Piqueras L, Sanz MJ, Perretti M, Morcillo E, Norling L,
Mitchell JA, Li Y, Bishop-Bailey D. Activation of PPARbeta/delta inhibits
leukocyte recruitment, cell adhesion molecule expression, and chemokine
release. J Leukoc Biol. 2009; 86(1):115-22.
Rapport d'expertise collective ANSES. Caractérisation
des risques liés à la pratique d'activité physique. In :
Actualisation des repères du PNNS- Révisions des
repères relatifs à l'activité physique et à la
sédentarité. (Ed) Scientifique, 2016 ; 339- 342.
Rappolee DA, Werb Z. Macrophage-derived growth factors.
Curr Top Microbiol Immunol. 1992 ; 181: 87-140.
Rousseau AS, Sibille B, Murdaca J, Mothe-Satney I, Grimaldi
PA, Neels JG. á-Lipoic acid up-regulates expression of peroxisome
proliferator-activated receptor I in skeletal muscle: involvement of the JNK
signaling pathway. FASEB J. 2016; 30(3):1287-99.
29
Saclier M, Cuvellier S, Magnan M, Mounier R, Chazaud B.
Monocyte/macrophage interactions with myogenic precursor cells during skeletal
muscle regeneration. FEBS J. 2013; 280(17):411830.
Sakuma K and Yamaguchi A. Molecular and Cellular Mechanism of
Muscle Regeneration. In Cseri, J. (ed). Skeletal Muscle- From Myogenenis to
Clinical Relations. 2012 ; 3-30.
Segawa M, Fukada S, Yamamoto Y, Yahagi H, Kanematsu M, Sato M,
Ito T, Uezumi
A, Hayashi S, Miyagoe-Suzuki Y, Takeda S, Tsujikawa K, Yamamoto
H.
Suppression of macrophage functions impairs skeletal muscle regeneration
with severe fibrosis. Exp Cell Res. 2008; 314(17):3232-44.
Shuen-Ei Chen, Eric Gerken, Yingmin Zhang, Mei Zhan, Raja K.
Mohan, Andrew S. Li, Michael B. Reid, Yi-Ping Li. Role of TNF-á
signaling in regeneration of cardiotoxin-injured muscle. American Journal
of Physiology - Cell Physiology. 2005; Vol. 289 no. 5, C1179-C1187.
Siriett V, Salerno MS, Berry C, Nicholas G, Bower R, Kambadur
R, Sharma M Antagonism of myostatin enhances muscle regeneration during
sarcopenia. Mol Ther. 2007; 15(8):1463-70.
Strle K, Broussard SR, McCusker RH, Shen WH, LeCleir JM,
Johnson RW, Freund GG, Dantzer R, Kelley KW. C-jun N-terminal kinase mediates
tumor necrosis factor-alpha suppression of differentiation in myoblasts.
Endocrinology. 2006; 147(9):4363-73.
Villalta SA, Rinaldi C, Deng B, Liu G, Fedor B, Tidball
JG. Interleukin-10 reduces the pathology of mdx muscular
dystrophy by deactivating M1 macrophages and modulating macrophage phenotype.
Hum Mol Genet. 2011; 20(4):790-805.
Wagner N, Jehl-Piétri C, Lopez P, Murdaca J, Giordano
C, Schwartz C, Gounon P, Hatem SN, Grimaldi P, Wagner KD.
Peroxisome proliferator-activated receptor beta stimulation induces
rapid cardiac growth and angiogenesis via direct activation of calcineurin.
Cardiovasc Res. 2009; 83(1):61-71.
Wang H, Melton DW, Porter L, Sarwar ZU, McManus LM, Shireman
PK. Altered macrophage phenotype transition impairs skeletal
muscle regeneration. Am J Pathol. 2014; 184(4):1167-84.
Warren GL, Hulderman T, Jensen N, McKinstry M, Mishra M,
Luster MI, Simeonova PP. Physiological role of tumor necrosis factor alpha in
traumatic muscle injury. FASEB J. 2002; 16(12):1630-2.
Abstract :
The Peroxisome Proliferator-Activated Receptors Beta
(PPARâ), is a transcription factor playing an important role in muscle
physiology and immunometabolism. We hypothesized that its activation with an
agonist treatment (GW0742) of mice could alter the early-phase of the muscle
regeneration process when immune cells infiltrate in injured muscle. To
investigate this, tibialis anterior of mice treated or not with GW0742
were injured with cardiotoxin, and muscle regeneration was monitored on days 4,
7, 9 and 14 post-injury. The injury induced a decrease in PPARâ and
Myostatin expression, the latter response was more pronounced in GW0742 treated
mice. We found that treatment of mice with GW0742 increases the recruitment of
macrophages (both M1 and M2) and CD3+ lymphocytes at day 4 post-damage. This
effect is accompanied by a more pronounced response of markers of proliferation
and differentiation of satellite cells and of Myostatin. Moreover, we observed
an earlier return to basal level (7 days versus 14 days). Taken together, our
results suggest that activating PPARâ pathway in skeletal muscle could be
a therapeutic strategy in the case of certain skeletal muscle diseases or
injuries.
Key-words: Muscle, injury, regeneration, PPARâ
Résumé :
Le Peroxisome Proliferator-Activated Receptors Beta
(PPARâ), un facteur de transcription, joue un rôle important dans
la physiologie du muscle et l'immuno-métabolisme. Nous avons émis
l'hypothèse que l'activation de PPARâ par un agoniste (le GW0742)
affecte les phases précoces du processus de
régénération musculaire. Pour la vérifier, les
tibialis anterior de souris traitées ou non au GW0742 sont
blessées avec de la cardiotoxine et la régénération
musculaire est évaluée aux jours 4, 7, 9 et 14 post-blessure. Nos
résultats montrent que la blessure induit une diminution de l'expression
de PPARâ et de la Myostatine, plus marquée chez les souris
traitées au GW0742. Le traitement induit une augmentation du nombre de
macrophages (de types M1 et M2) et de lymphocytes CD3+ au jour 4 post-blessure.
Ces effets sont accompagnés d'une réponse plus prononcée
de l'expression des marqueurs de prolifération et de
différenciation des cellules satellites et de la Myostatine. De plus,
nous observons un retour plus précoce à des valeurs de base (7
jours versus 14 jours). L'ensemble de nos résultats suggère que
d'activer la voie PPARâ dans le muscle squelettique pourrait être
une stratégie thérapeutique dans le cas de certaines maladies ou
blessures musculaires.
Mots clés : Muscle, blessure,
régénération, PPARâ
|
|



