|
|
|
|
|
RÉPUBLIQUE DU BENIN
UNIVERSITÉ D'ABOMEY CALAVI (UAC)
FACULTÉ DES SCIENCES AGRONOMIQUES (FSA)
|
|
|
ÉCOLE D'AMÉNAGEMENT ET GESTION DE L'ENVIRONNEMENT
(EAGE)
Mémoire pour l'obtention du diplôme
de:
Master Régional Professionnel en Monitoring des
Ressources aquatiques
et Aménagement des Pêches continentales
(MoRAP)
|
|
Analyse de la biodiversité ichtyologique et de
la
productivité des pêcheries de Say au
Niger
|
|
Soutenu le 15 Novembre 2019 par:
|
|
Hamadou YACOUBA
Superviseur:
|
|
Pr Dr Ir Philippe A. LALÈYÈ
Professeur Titulaire en Hydrobiologie et Aquaculture
(CAMES)
Université d'Abomey-Calavi (Bénin).
Co-Superviseur:
|
|
Dr Issiaka YOUSSOUFA
Maître de Conférences en Sciences de
l'Environnement et Ecologie des Ecosystèmes Aquatiques
(CAMES)
Université de Diffa (Niger).
Jury:
|
|
Président
Examinateur
Examinateur
: Pr Antoine CHIKOU, Professeur Titulaire en
Hydrobiologie et Aquaculture (CAMES),
Université d'Abomey-Calavi (Bénin).
Rapporteur : Pr Philippe A. LALÈYÈ,
Professeur Titulaire en Hydrobiologie et Aquaculture (CAMES),
Université d'Abomey-Calavi (Bénin).
1: Dr Djiman LEDEROUN, Maître de
Conférences en Hydrobiologie et Aquaculture (CAMES), Université
d'Abomey-Calavi (Bénin).
2: Dr Delphine ADANDÉDJAN, Maître
de Conférences en Hydrobiologie et Aquaculture CAMES), Université
d'Abomey-Calavi (Bénin).
|
|
Année académique: 2018 - 2019
CINQUIÈME PROMOTION ARES-CCD
|
|
|

Présentation de la page de Garde
Les photos figurant sur la page de garde ont été
prises sur le terrain à Say en 2019, par l'auteur de ce mémoire.
Leur présence a pour objectif de permettre à tout lecteur de
mieux cerner le sujet abordé dans ce document. De gauche à
droite, nous avons :
? Palangres chez le président de l'association des
pêcheurs de Say
Date : 28/08/2019
Dimensions : 5152 x 3864 pixels ; Marque de l'appareil
Photographique : IXUS 177
? Prise d'un pêcheur à Tounga Mini composé de
Glarias angullaris (Linnaeus, 1758)
Labeo senegalensis Valenciennes, 1842 Distichodus
rostratus Günther, 1864
Date : 27/08/2019
Dimensions : 5152 x 3864 pixels ; Marque de l'appareil
Photographique : IXUS 177
? Deux pêcheurs dans une pirogue entrain d'enlever des
poissons attrapés par le filet maillant au bord du fleuve Niger à
la station de Tounga Mini
Date : 28/08/2019
Dimensions : 5152 x 3864 pixels ; Marque de l'appareil
Photographique : IXUS 177
CERTIFICATION
Je soussigné, Pr Philippe A.
LALÈYÈ certifie que ce travail a été
entièrement réalisé par YACOUBA Hamadou
pour l'obtention de son diplôme de Master Régional
Professionnel en Monitoring des Ressources Aquatiques et Aménagement des
Pêches Continentales à la Faculté des Sciences Agronomiques
de l'Université d'Abomey-Calavi (UAC) du Benin.
II
Superviseur
Pr Philippe A. LALÈYÈ
Professeur Titulaire des Universités (CAMES)
III
Dédicace
A la mémoire de mon Père Yacouba Moumouni
décédé au moment où nous rentrons au Niger pour la
sortie intégrée. Paix à son âme.
iv
REMERCIEMENTS
Je remercie vivement tous ceux qui d'une façon ou d'une
autre ont contribué à la réalisation de ce travail. Mes
remerciements vont particulièrement :
- à L'ARES-CCD, principal partenaire financier du MoRAP
qui nous a accordé une bourse d'étude en vue de suivre cette
formation ;
- au Professeur Philippe A. LALEYE, Doyen de la Faculté
des Sciences agronomiques de l'Université d'Abomey Calavi du
Bénin, Coordonnateur Régional du Master MoRAP pour son
efficacité dans la gestion des Masters, son encadrement, ses sages
conseils, sa disponibilité, sa patience et surtout son pragmatisme
à toute éventualité pendant toute la période de ma
formation à la FSA/UAC du Bénin ;
- à mon Superviseur de mémoire Dr. Djiman
LEDEROUN, Maître-Assistant des Universités, Enseignant-chercheur
à la FSA/UAC du Bénin, pour avoir accepté superviser mon
mémoire de master malgré ses nombreuses occupations. Il a su
guider avec efficacité et sagesse ce travail pendant toute la
période du stage ;
- à mon Co-superviseur de mémoire Monsieur
Youssoufa ISSIAKA, Maître de Conférences des Universités,
Enseignant-Chercheur à la Faculté d'Agronomie de
l'Université de Diffa pour l'encadrement assuré malgré son
éloignement de la zone d'étude et de celle du travail au
laboratoire qu'il trouve ici notre entière satisfaction ;
- à mon Encadreur de terrain, Monsieur Alhou BASSIROU,
Maître de Conférences des Universités, Enseignant-Chercheur
à l'Ecole Normale Supérieure de l'Université Abdou
Moumouni de Niamey, pour le suivi sur le terrain et au laboratoire de l'ENS et
sans lequel ce travail n'aurait jamais été réalisé
;
- à mon Co-Encadreur de terrain, Colonel ABDOU Ibrahim,
Ingénieur des Eaux et Forêts, Directeur national de la Pêche
et de l'Aquaculture (DPA), pour son encadrement, ses conseils, sa
disponibilité, et sa patience durant mon séjour à la DPA
;
- à Madame Delphine ADANDEDJAN, Maître de
Conférences des Universités, Enseignant-Chercheur à la
Faculté des Sciences Agronomiques de l'UAC, qu'elle trouve notre
entière satisfaction ;
- à Monsieur Hyppolite AGADJIHOUEDE Maître de
Conférences des Universités Enseignant-Chercheur à l'Ecole
d'Aquaculture de l'Université Nationale d'Agriculture (UNA) ;
- à Monsieur GOUGBEDJI Armel Doctorant au Laboratoire
d'Hydrobiologie et d'Aquaculture pour sa contribution à
l'amélioration de ce travail ;
V
- à tous les étudiants de la 5e promotion MoRAP
pour le séjour plein des souvenirs qu'on a passé ensemble au
Bénin et surtout lors de la sortie intégrée;
- au Colonel major Ali HAROUNA Ingénieur des Eaux et
Forêts, Secrétaire Général Adjoint du ME/SU/DD, pour
ses conseils et la démarche administrative qu'il nous a
facilité;
- à Monsieur Amadou, technicien du laboratoire de l'ENS
pour son assistance sans faille ;
- aux Lieutenant-Colonel Issa YACOUBA et Commandant Seyni
MOUMOUNI, tous Ingénieurs Halieutes pour leur encadrement et leur
soutien moral et matériel ;
- aux Commandants Ado Moussa IBRAHIM et Amadou OUMAROU tous de
la 4eme promotion MoRAP pour leur contribution au traitement des
données;
- au Lieutenant-colonel Hama HASSANE, Directeur
départemental de l'environnement et du développement du durable
de Say et toute son équipe qui nous ont hébergé pendant la
durée du stage;
- à Monsieur Mahamane BOUBACAR, président de
l'association des pêcheurs de Say, mon piroguier du site de Tounga
Mini;
- à Monsieur Issoufou SIDI mon piroguier du site de
Bolongué ;
- à Monsieur Boubacar IBRAHIM mon piroguier du site de
Koba
- à Monsieur Omar SALEY, mon guide de terrain, pour avoir
accepté de me tenir compagnie et de jouer le rôle de facilitateur
lors des échanges avec les pêcheurs et les mareyeuses ; - à
toute la communauté des pêcheurs de de Say pour l'amitié et
l'intérêt accordé à ce travail ; - à
l'ensemble du personnel de la DPA et de la Direction Générale des
Eaux et Forêts ;
- Au président du jury Pr. Antoine CHIKOU ainsi qu'aux
membres de mon jury : Professeur Philippe A. LALEYE, Madame Delphine ADANDEDJAN
et Dr. Djiman LEDEROUN grâce aux observations pertinentes et à la
qualité des questions qui ont permis la finalisation de ce document ;
qu'ils trouvent ainsi ma profonde reconnaissance ;
- Mes vifs remerciements vont, en général, à
l'endroit de tous les enseignants et chercheurs intervenant dans le programme
de formation MoRAP ;
- à tous ceux qui nous ont apporté une
quelconque aide et qui n'ont pu être cités ici, nous leur
exprimons nos sincères remerciements.
vi
Sigles et abréviations
ABN : Autorité du Bassin du Niger
DAP: Division d'Aménagement des
pêcheries
DDA : Division du Développement de
l'Aquaculture
DPA : Direction de la Pêche et de
l'Aquaculture
DN : Division Nutrition
DSRH/VTTP : Division de Suivi des Ressources
Halieutiques et de la Vulgarisation
des Techniques et Technologies de Pêche
ENS : Ecole Normale Supérieure
GPS : Global Position System
INS : Institut National de la Statistique
ME/LCD : Ministère de l'Environnement de
la Lutte Contre la Désertification
MESU/DD : Ministère de l'Environnement de
la Salubrité Urbaine et du
Développement Durable
MHE/LCD : Ministère de l'Hydraulique, de
l'Environnement et de la Lutte Contre la
Désertification
MoRAP : Monitoring des Ressources aquatiques et
Aménagement des Pêches
Continentales
MPAT/DC : Ministère du Plan de
l'Aménagement du Territoire et du
Développement
Communautaire
PDC : Plan du Développement Communal
PGIPAP : Projet de Gestion
Intégrée des Plantes Aquatiques Proliférantes
RGP/H : Recensement General de la Population et
de l'Habitat
SD : Secrétariat de Direction
SM : Secrétaire Municipal
SDR : Stratégie de Développement
Rural
UAM : Université Abdou Moumouni
UEMOA : Union Economique Monétaire Ouest
Africain
UAC : Université d'Abomey Calavi
VII
Liste des tableaux
Tableau 1 : Synthèse des paramètres
physico-chimiques de l'eau au cours de l'étude 19
Tableau 2 : Variations spatio-temporelles des
paramètres physico-chimiques 21
Tableau 3 : Liste des espèces de poissons
inventoriés dans le fleuve à Say 22
Tableau 4 : Indices de diversité de Shannon et de son
équitabilité en fonction des stations 29
Tableau 5 : Indices de diversité de Shannon et de son
équitabilité en fonction des mois 29
Tableau 6 : Indice de similarité de Jaccard 30
Tableau 7 : Richesse spécifique des engins de
pêche et leur indice de diversité de Shannon-
Wiener 32
Tableau 8 : Paramètres morphometriques des
espèces totalisant plus de 10 individus. 37
Tableau 9 : Paramètres de la relation poids-longueur et
du facteur de condition de Labeo
senegalensis 38
viii
Liste des figures
Figure 1 : Zonage agro-écologique du Niger (Source :
SDR, 2004) 5
Figure 2 : Zones humides et agro-écologiques 6
Figure 3 : Cumul annuel des pluies (PDC 2017-2021, Say) 8
Figure 4 : Localisation des sites d'échantillonnage
12
Figure 5 : Materiel de collectes des données 14
Figure 6 : Abondance numérique (A) et pondérale
(B) toutes stations confondues 25
Figure 7 : Abondance numérique spatiale 27
Figure 8 : Abondance pondérale spatiale 28
Figure 9 : Filet maillant de différentes mailles 30
Figure 10 : Quelques palangres d'hameçons
différents 31
Figure 11 : Nasses de différentes mailles 32
Figure 12 : Sélectivité des engins liée
à l'abondance numérique toutes espèces confondues: 34
Figure 13 : Sélectivité des engins liée
à l'abondance pondérale toutes espèces confondues 34
Figure 14 : Capture de pêche par unité d'effort
par engin 35
Figure 15 : Structure générale par taille des
captures toutes stations confondues 35
Figure 16 : Structure par taille des individus capturés
selon le type d'engin utilisé 36
Figure 17 : Relation poids-longueur et structure de taille du
Labeo senegalensis 38
Résumé
Dans le but d'analyser la biodiversité ichtyologique et
la productivité des pêcheries de Say sur le fleuve Niger au Niger,
une étude a été faite de juillet à septembre 2019.
L'objectif global est de caractériser la faune ichtyologique de la
commune de Say à travers sa diversité et sa production.
L'inventaire de la faune ichtyologique a été
réalisé auprès des pêcheurs artisanaux utilisant
divers type d'engins. Des pêches expérimentales ont
été effectuées chaque 15 jours à l'aide d'une
batterie de cinq (5) filets expérimentaux de 50 m de longueur et 1,5 m
de profondeur et de maillage respectives: 10 mm, 20 mm, 25 mm, 40 mm et 50 mm
afin de capturer toutes les gammes de tailles de poisson. Les paramètres
physico-chimiques relevés à la fin de chaque offraient des
conditions optimales à la vie aquatique. La température mensuelle
de l'air varie de 27,6°C à 33,7°C avec une moyenne de 29,45
#177;0,17; celle de l'eau varie de 26,8 à 30,7°C avec une moyenne
de 28,25 #177; 0,38. La profondeur et la transparence varient respectivement de
1,6 à 7,6 m et de 2 à 5 cm. L'oxygène dissous quant
à lui varie de 4,68 à 5,64 mg/L ; le pH varie de 6,5 à
8,3. La richesse spécifique varie d'une station à une autre et
d'un mois à un autre. Ainsi 41 espèces ont été
inventoriés à Tounga Mini, 35 espèces à
Bolongué et Koba, 34 espèces en juillet, 40 espèces en
Août et 38 espèces en Septembre. L'inventaire de l'ichtyofaune a
révélé l'existence de 48 espèces de poisson
reparties en 31 genres et 16 familles. Trois types d'engins de pêche sont
utilisés pour l'exploitation des poissons: Le filet maillant, les nasses
et les palangres. L'espèce la plus abondante est Labeo senegalensis
avec 419 individus soit 19,47% du nombre totale et (19,19%) de la biomasse
totale des captures. Cette étude reste cependant limitée car ne
concerne qu'une petite portion du fleuve et pendant un temps très court
(3 mois), il serait donc nécessaire de l'approfondir sur une
période d'au moins un an et sur un long secteur.
ix
Mots clés: Ichtyofaune, biodiversité, Fleuve Niger,
Say.
Summary
In order to analyze the ichthyological biodiversity and
productivity of the Say fisheries on the Niger River in Niger, a study was
conducted from July to September 2019. The overall objective is to characterize
the ichthyological fauna of the commune of Say in through its diversity and
production. The inventory of fish fauna was carried out among artisanal
fishermen using various types of gear. Experimental fisheries were carried out
every 15 days using a battery of five (5) experimental nets of 50 m length and
1.5 m depth and mesh respectively: 10 mm, 20 mm, 25 mm, 40 mm and 50 mm to
capture all sizes of fish. The physicochemical parameters recorded at the end
of each offered optimal conditions for aquatic life. The monthly air
temperature varies from 27.6 O C to 33.7 O C with an average of 29.45 #177;
0.17; that of water varies from 26.8 to 30.7 O C with an average of 28.25 #177;
0.38. The depth and transparency vary from 1.6 to 7.6 m and from 2 to 5 cm
respectively. Dissolved oxygen varies from 4.68 to 5.64 mg / L; the pH varies
from 6.5 to 8.3. Species richness varies from one station to another and from
one month to another. Thus 41 species were inventoried in Tounga Mini, 35
species in Bolongué and Koba, 34 species in July, 40 species in August
and 38 species in September. The fish fauna inventory revealed the existence of
48 species of fish divided into 31 genera and 16 families. Three types of
fishing gear are used for fish exploitation: gillnets, traps and longlines. The
most abundant species is Labeo senegalensis with 419 individuals or 19.47% of
the total number and (19.19%) of the total biomass of the catches. However,
this study remains limited because it concerns only a small portion of the
river and for a very short time (3 months), it would therefore be necessary to
deepen it over a period of at least one year and over a long area.
X
Key words: Fish fauna, biodiversity, Niger River, Say.
xi
Table des matières
CERTIFICATION ii
Dédicace iii
REMERCIEMENTS iv
Sigles et abréviations vi
Liste des tableaux vii
Liste des figures viii
Résumé ix
Summary x
Table des matières xi
Introduction 1
CHAPITRE I : GENERALITES 4
1.1 Généralités sur la République
du Niger 4
1.1.1 Situation géographique 4
1.1.3 Ecosystèmes aquatiques 5
1.1.4 Plantes aquatiques 6
1.2 Cadre institutionnel, législatif et
règlementaire de la pêche 7
1.2.1 Cadre institutionnel 7
1.2.2 Cadre législatif et réglementaire de la
pêche 7
2. Présentation du milieu d'étude 7
2.1. Commune urbaine de Say 7
2.2. Aspect biophysique : 8
2.2.1. Climat 8
2.2.2 Relief 9
2.2.3 Sols 9
2.2.5 Flore 10
2.2.6 Faune 10
2.3 Aspect humain 11
2.3.1 Population 11
2.3.2 Activités socioéconomiques 11
2.3.3 Organisation administrative et sociale 11
CHAPITRE II : MATERIEL ET METHODES 12
2.1 Présentation du site d'étude 12
2.1.2 Localisation de Say 12
2.1.3 Choix des stations d'études 12
2.2 Matériel 13
2.2.1 Structures logistiques 13
xii
2.2.2 Matériel de collecte des données
13
2.3 Méthodes 14
2.3.1 Collectes des données 14
2.3.1.1 Paramètres physico-chimiques des stations
d'échantillonnage 14
2.3.1.2 Inventaire de l'ichtyofaune 15
2.3.1.3 Suivi des captures et des techniques de pêche
15
2.3.1.4 Mensurations morphométriques et
pondérales 15
2.3.2 Analyse et traitement des données
16
2.3.2.1 Analyse des données 16
2.3.2.1.1 Paramètres physico-chimiques
16
2.3.2.1.2 Inventaire de l'ichtyofaune 16
2.3.2.1.2.1 Indice de diversité de Shannon et de Wiener
16
2.3.2.1.2.2 Régularité ou
l'équitabilité de Piélou 16
2.3.2.1.2.3 Richesse spécifique effective (S) 17
2.3.2.1.2.4 Indice de similitude de Jaccard 17
2.3.2.1.2.5 Capture Par Unité d'Effort (CPUE) 17
2.3.2.1.2.6 Histogramme des fréquences de taille 17
2.3.2.1.3 Biologie de l'espèce abondante dans les
captures 17
2.3.2.1.3.1 Relations poids-longueurs 17
2.3.2.1.3.2 Facteur de condition 18
CHAPITRE III : RESULTATS ET DISCUSSION 19
3.1 Résultats 19
3.1.1 Paramètres physico-chimiques
19
3.1.1.1 Caractéristiques physico-chimiques des trois
stations 19
3.1.1.2 Variations spatio-temporelles des paramètres
physico-chimiques 20
3.1.2 Inventaire de la faune ichtyologique 22
3.1.2.2 Communauté ichtyologique 23
3.1.2.3 Abondances numérique et pondérale des
espèces capturées 24
3.1.2.3.1 Abondances numérique et pondérale
générales 24
3.1.2.3.2 Abondance numérique spatiale 26
3.1.2.3.4 Variations spatiales des indices de diversité
29
3.1.2.3.5 Variation temporelle des indices de diversité
29
3.1.2.3.6 Indice de similarité de Jaccard 30
3.1.3 Typologie des engins de pêche et leurs
sélectivités 30
3.1.3.1 Sélectivité des engins liée
à la diversité spécifique des captures 32
3.1.3.2 Sélectivité des engins liée
à l'abondance numérique 33
3.1.3.3 Sélectivité des engins liée
à l'abondance pondérale 34
XIII
3.1.3.4 Capture Par Unité d'Effort (CPUE) de chaque
engin 34
3.1.4. Structure des captures 35
3.1.4.1 Structure générale des fréquences
de distribution de la longueur totale 35
3.1.4.2 Distribution des fréquences de longueurs
totales des poissons en fonction des engins 36
3.1.5. Eléments de Biologie des espèces 37
3.1.5.1. Variables morphométriques des captures 37
3.1.5.2 Relation poids-longueur et structure par taille de
l'espèce dominante 38
3.2 Discussion 39
3.2.1 Paramètres physico-chimiques du fleuve dans le
secteur de Say 39
3.2.2 Inventaire de l'ichtyofaune 40
3.2.2.1 Variations spatio-temporelle de la richesse
spécifique 41
3.2.2.2 Abondance spatio-temporelle numérique et
pondérale des captures : 42
3.2.3 Typologie des engins de pêche et leurs
sélectivités 42
3.2.3.1 Structure morphométriques des spécimens
43
3.2.3.2 Relations poids-longueurs 43
CONCLUSION ET PERSPECTIVES 45
Références bibliographiques 47
Annexes : Quelques spécimens de poissons
échantillonnés 50
1
Introduction
La pêche est l'une des activités de production
les plus vieilles de l'humanité et les études anthropologiques
contemporaines sur les sociétés primitives ont confirmé
l'importance de cette activité comme moyen de subsistance (Arnason,
1997). Mais très tôt, l'activité a connu des
décadences dans plusieurs pays en raison de la démographie
galopante avec des pêcheurs trop nombreux, pourchassant des ressources
devenus de plus en plus rares (Lévêque, 1992 ; Chikou, 2006 ;
Kiossa, 2011).
Aujourd'hui, les pêcheurs des pays en voie de
développement ne parlent plus de rentabilité de leurs
activités, mais plutôt d'un simple moyen de survie
(Lévêque, 1992;Ahouansou Montcho, 2011). Ainsi, la gestion des
ressources halieutiques est devenue un enjeu crucial tant sur le plan
biologique (conservation des espèces) que sur le plan économique
(préservation de l'activité de pêche).
L'Afrique de l'Ouest, à travers la
variété de ses écosystèmes, renferme une
diversité biologique unique en son genre, et est
considérée comme l'une des zones prioritaires de conservation de
la biodiversité au niveau mondial. Son patrimoine biologique fait
l'objet d'une exploitation non durable et est menacé d'une disparition
imminente (Sinsin & Kampermann, 2010).La nécessité de prendre
des mesures de conservation devient dès lors une préoccupation
majeure. Ces mesures, pour être efficaces, nécessitent une bonne
connaissance des espèces et des relations qui les lient à leur
milieu.
Les travaux de Coenen (1987) sur le fleuve Niger partie
nigérienne font état de 83 espèces réparties dans
20 familles. Au Niger, la faune ichtyologique renferme 112 espèces
réparties dans 22 familles (PGIPAP, 2012). La
pêche contribue à hauteur de 2,65% au PIB et fournit un emploi
direct à près de 50 000 personnes pour une production moyenne de
35 000 tonnes par an (UEMOA 2012). Elle génère en moyenne plus de
40 milliards F.CFA de chiffres d'affaires par an (UEMOA 2012). Les ressources
halieutiques sont concentrées dans le fleuve Niger et ses affluents, la
Komadougou yobé, le Lac Tchad, 970 mares naturelles et 69 retenues d'eau
artificielles.
La production de poisson, a connu une évolution en
dents de scies caractérisée par une tendance à la baisse
très marquée pendant ces dernières années due au
problème d'insécurité sur le Lac Tchad. La production du
poisson frais est ainsi passée à 40473 tonnes en 2011 à
31041 tonnes en 2018 (DPA, 2018).
2
Le Niger a adopté et mis en oeuvre la stratégie
de développement de la pêche et de l'aquaculture qui a pour
objectif global une pêche responsable en vue d'assurer la conservation,
la gestion et le développement des ressources (MPAT/DC, 2013).
En effet, l'un des facteurs qui conduit à la
dégradation des stocks de poissons est le mode d'exploitation de ces
ressources (Montchowui et al., 2008). C'est en ce sens que l'Etat du
Niger a adopté et mis en oeuvre la stratégie de
développement de la pêche et de l'aquaculture qui a pour objectif
global une pêche responsable en vue d'assurer la conservation, la gestion
et le développement des ressources halieutiques dans le respect des
écosystèmes et de la biodiversité, afin de mieux lutter
contre l'insécurité alimentaire et la pauvreté (ME/LCD
2007).
Cette étude contribuera à l'atteinte d'un
objectif spécifique de l'axe stratégique N°1 de la
stratégie de développement de la pêche et de l'aquaculture
qui se rapporte à : « la promotion de la recherche appliquée
dans les domaines de la pêche et de l'aquaculture et des
écosystèmes aquatiques en vue d'une meilleure valorisation
socioéconomique et écologique des ressources halieutiques».
Les pêcheries de Say font partie des points d'approvisionnement de la
ville de Niamey en poisson.
D'où l'intérêt d'étudier la
diversité ichtyologique et la productivité des pêcheries
dans la commune urbaine de Say.
La présente étude se propose ainsi de
caractériser la faune ichtyologique de la commune de Say à
travers sa diversité et sa production en vue d'une gestion durable des
ressources.
De manière spécifique, il s'agit de:
? suivre la qualité physico-chimique de l'eau du fleuve
Niger dans le secteur de la zone d'étude ;
? inventorier les espèces de poisson du fleuve et
d'évaluer leur abondance spécifique dans le secteur
d'étude
? inventorier les différents engins de pêche
déployés dans le secteur de l'étude
? déterminer les paramètres morphometriques des
espèces abondantes dans les captures.
En abordant ce thème, il s'agira de répondre aux
questions recherche suivantes:
? les caractéristiques physico-chimiques de l'eau du
fleuve Niger dans le secteur de la zone d'étude sont-elles favorables
à la survie de la faune ichtyologique ?
3
> les espèces de poissons et leur abondance
spécifique sont-elles connues dans le fleuve Niger au niveau de la
commune de Say ?
> les paramètres morphometriques des principales
espèces de poissons du fleuve Niger dans le secteur de Say sont-elles
connues ?
> les caractéristiques des engins et techniques de
pêches utilisées dans le fleuve Niger partie de la commune de Say
sont-ils connus?
Quatre hypothèses sous-tendent la présente
étude:
> Plusieurs espèces de poissons vivent dans le
fleuve Niger dans la partie de la commune de Say
> Le manque de connaissance des espèces de poisson
ne permet pas leur utilisation durable;
> La pêche ne suit pas la règlementation
> la pêche a une influence sur le peuplement des
poissons dans la commune de say
Le présent document, en plus de l'introduction et de la
conclusion comporte trois chapitres. Le premier chapitre a
présenté les généralités, le deuxième
chapitre le matériel et les méthodes et le troisième
chapitre les résultats et les discussions.
4
CHAPITRE I : GENERALITES
1.1 Généralités sur la
République du Niger
1.1.1 Situation géographique
Pays continental au trois quart (3/4) désertique, le
Niger se situe entre 0°16' et 16° de longitude Est, et 11°1' et
23°17' de latitude Nord. Il est limité au Nord par l'Algérie
et la Libye, à l'Ouest par le Mali et le Burkina Faso, au Sud par le
Nigeria et le Benin, à l'Est par le Tchad (Figure 1). Une telle
situation géographique place le Niger dans une zone
écologiquement aride. Il couvre une superficie de 1 267 000
km2 et présente une population d'environ 19 124 884 habitants
(INS, 2016).
1.1.2 Zones agro écologiques
Du Sud au Nord, on distingue cinq zones agro climatiques
(Figure 1). Ce sont :
La zone soudanienne: Elle couvre
l'extrême sud-ouest du pays et représente environ1% de la
superficie totale, reçoit 600 à 800 mm de pluie par an. Elle est
le domaine des savanes arborées et arbustives et de forêts
galeries. La végétation de savanes est caractérisée
par une strate herbacée continue où dominent les graminées
de grande taille. Région à vocation agricole et très
peuplée, elle renferme la réserve totale de faune de Tamou et le
Parc National du W.
Les zones Soudano -Sahélienne et
sahélienne: Elles couvrent environ 10% du pays, reçoit
de 350 à 600 mm de pluie. Caractérisée par une steppe qui
passe des formations contractées ou arbustives dans la partie
septentrionale à des types plus diffus et arborés dans le sud
avec une végétation de steppes arborées et arbustives et
« brousse tigrée ». C'est une zone à vocation agricole
avec une grande composante pastorale soumise à une intense exploitation
et pression démographique.
La zone sahélo-saharienne : Elle
représente environ 12% de la superficie du pays.
Elle reçoit 150 mm à 350 mm de pluie. Elle est
caractérisée par une végétation de steppes
herbacées et arbustives dominées par les graminées, qui
lui confère une vocation essentiellement pastorale.
La zone saharienne: Elle couvre 77% du pays,
reçoit moins de 100-150 mm par an. Toutefois, l'Aïr en
général, et plus particulièrement son secteur sud-ouest,
se distingue de l'ensemble comme un îlot plus humide qui recueille
annuellement environ 200mm. La végétation se concentre dans les
vallées de l'Aïr et dans les oasis situées aux pieds des
falaises du Kawar. Elle apparaît sous la forme de reliques d'une
végétation de steppe discontinue fortement anthropique.
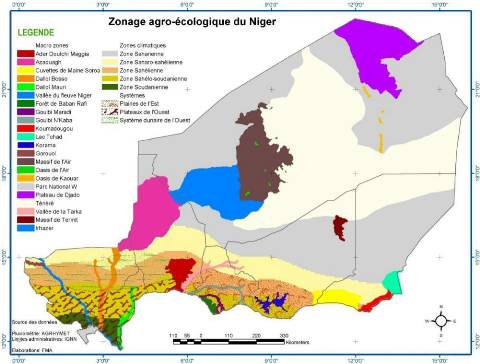
5
Figure 1 : Zonage agro-écologique du Niger (Source :
SDR, 2004) 1.1.3 Ecosystèmes aquatiques
Les ressources en eau de surface sont concentrées dans
les quatre premières zones et sont constituées par le fleuve
Niger et ses affluents, la Komadougou Yobé, le lac Tchad et 970 mares
naturelles (Figure 2) et 69 retenues d'eau artificielles (MHE/LCD, 1999). Les
ressources forment trois (03) types d'écosystèmes aquatiques: les
cours d'eau (pêcheries fluviales, affluents, rivières et
ruisseaux), les mares naturelles et retenues d'eau artificielles et le lac
Tchad (écosystème lacustre). Leur principale
caractéristique commune est leur régime hydrologique fortement
dépendant des précipitations très contrastées. En
effet, les zones sahéliennes, soudano-sahéliennes et soudaniennes
au Niger se caractérisent par une succession de longue saison
sèche et rigoureuse et de saison des pluies assez courte (3 à 4
mois) au cours de laquelle l'eau tombe en général sous forme
d'averses ou d'orages. Il en résulte une variation saisonnière
très marquée du volume et de la superficie des
écosystèmes aquatiques qui conditionne la biologie et la
dynamique des espèces aquatiques et semi-aquatiques. Les cours d'eau
sont constitués par :
6
- le fleuve Niger qui traverse le territoire du Niger sur une
longueur de 550 Km et ses sept
affluents (Goroual, Dargol, Sirba, Goroubi, Diamangou, Tapoa
et Mékrou) ;
- la Komadougou Yobé ;
- des cours d'eau fossiles (Dallols Bosso, Maouri) ;
- et des rivières (ruisseaux) à
écoulement épisodique (Goulbis N'Kaba, N'Maradi et Korama).

Figure 2 : Zones humides et agro-écologiques
1.1.4 Plantes aquatiques
Les principales espèces de plantes aquatiques
envahissantes rencontrées au Niger sont : Typha
australis, Pistia stratiotes, Polygonum
senegalensus, Nymphaea lotus, Cyperus papyrus et
Eichhornia crassipes ou jacinthe d'eau. Les cinq (5) premières
espèces sont locales tandis que la dernière est exotique. Dans la
zone d'intervention du projet de gestion intégrée des plantes
aquatiques envahissantes, les principales espèces de plantes
recensées sur les berges et mares sont : Cyperus sp,Typha
australis, Oryza breviligulata, Brachiaria mutica,
Nymphaea spp
7
Pistia stratiotes. La principale plante à
caractère proliférant qui menace les cours et plans d'eau est
Typha australis.
1.2 Cadre institutionnel, législatif et
règlementaire de la pêche
1.2.1 Cadre institutionnel
La gestion administrative et technique du secteur pêche et
aquaculture est assurée par la
Direction de la Pêche et de l'Aquaculture (DPA) qui
relève du Ministère de l'Environnement de la Salubrité
Urbaine et du Développement Durable (MESU/DD) créé par le
décret N°2018-475/PRN/ME/SU/DD du 9 juillet 2018. Ainsi pour
exécuter son cahier de charge, la Direction de la Pêche et de
l'Aquaculture (DPA) est organisée comme suit : une direction, un
Secrétariat de Direction (SD), une Division d'Aménagement des
Pêcheries (DA), une Division de Développement de l'Aquaculture
(DDA) une Division de Suivi des Ressources Halieutiques, Vulgarisation de
Techniques et Technologies de Pêche (DSRHVTTP) et une Division Nutrition
(DN). Au niveau de chaque région, il y a un divisionnaire de la
pêche et de l'aquaculture. Les départements sont coiffés
par des chefs de service pêche et aquaculture.
1.2.2 Cadre législatif et réglementaire de la
pêche
La pêche est régie par la loi n° 98-042 du 07
décembre 1998 portant régime de la pêche. Cette
loi garantit la responsabilisation et l'implication effectives
des communautés de pêche dans les processus de
développement à tous les niveaux. Cependant, cette loi souffre
d'une longue absence de son décret d'application. L'aquaculture, quant
à elle, n'est régie, ni par un texte spécifique, ni par la
loi susmentionnée.
2. Présentation du milieu d'étude
2.1. Commune urbaine de Say
Selon son Plan du Développement Communal (PDC 2017-2021),
la Commune Urbaine Say
fait partie des trois (3) communes du département du
même nom appartenant à la région de Tillabéry. Elle
est située entre les longitudes 5°50' et 6°00'Est et les
latitudes 14°40' et 14°50' Nord. Elle est limitée :
V' A l'Est par le fleuve Niger et la commune rurale de Kirtachi
;
V' A l'Ouest par la commune rurale de Guéladio et la
commune rurale de Tamou ;
V' Au Nord par la commune rurale de Youri ;
V' Et au Sud par la commune rurale de Tamou.
8
Cette commune couvre une superficie de 673 km2
représentant 10,35% de la superficie totale du département de
Say. La commune urbaine de Say est constituée de quarante (41) villages
administratifs et 9 quartiers de la ville de Say auxquels s'ajoutent une
quarantaine de hameaux rattachés chacun à un village
administratif.
2.2. Aspect biophysique :
2.2.1. Climat
La commune urbaine de Say est caractérisée par
un climat Sahélo soudanien avec principalement deux saisons :
? Une courte saison de pluies de juin à septembre qui
se caractérise par un vent humide (la mousson) soufflant de l'Ouest vers
l'Est ;
? Une longue saison sèche d'octobre à mai
repartie en période froide de novembre à janvier et
période chaude de février à mai. La saison sèche
est caractérisée par l'harmattan qui est un vent chaud et sec qui
souffle de l'Est vers l'Ouest.
Les températures les plus élevées sont
enregistrées en avril et en mai et sont encore relativement hautes
à la fin de l'hivernage. Décembre et janvier sont les mois les
plus froids.
A l'instar des autres communes du Niger, la commune urbaine de
Say n'échappe pas aux phénomènes de changements
climatiques dus aux faibles précipitations, à la hausse de
températures , aux vents violents et à une fréquence
très rapprochée d'inondations. Tous ces phénomènes
ont eu pour conséquences la dégradation poussée des
terres, la disparition de certaines espèces végétales,
fauniques et halieutiques et l'ensablement du fleuve et des mares.
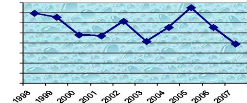
La commune urbaine de Say est caractérisée par
des hauteurs pluviométriques qui évoluent en dents de scie selon
les années
Hauteurs Pluviométriques
800
700
600
500
400
300
200
100
0
Année
Figure 3 : Cumul annuel des pluies (PDC 2017-2021, Say)
9
2.2.2 Relief
Située dans un climat Sahélo soudanien où
les précipitations sont de l'ordre de 450 à 600 mm, la commune
urbaine de Say est caractérisée par un relief constitué de
deux zones bien distinctes :
y' La zone de vallée du fleuve taillée dans le
socle granito magmatique relativement encaissée au sud. La largeur varie
entre 300 m et 500 m, son altitude la plus basse est de 170 m (au Sud) et la
plus élevée est de 180 m au Nord ;
y' La zone de plateau formé par la bordure du
continental terminal. C'est cette zone qui constitue le domaine
privilégié de la brousse tigrée et une source de revenus
considérable pour la population.
2.2.3 Sols
On observe trois grands types de sols :
Les sols ferrugineux tropicaux non ou peu lessivés,
communément appelés sols dunaires à faible
fertilité ;
Les sols ferrugineux lessivés ne présentant pas un
grand intérêt agricole ;
Les sols hydro morphes communément appelés sols
de bas-fonds et de cuvettes relativement fertiles et localisés le long
du fleuve Niger. La commune de Say dispose de terres agricoles relativement
importantes (25 600 ha) dont seulement 38% sont cultivées (9.768 ha).
La culture de contre saison est très pratiquée
dans la commune. Elle concerne plusieurs sites (environs une trentaine) qui
totalisent plus de 561,5 ha.
Le capital de production est caractérisé par une
dégradation poussée dues à l'érosion hydrique et
éolienne et les inondations cycliques.
La commune dispose aussi de 4 aménagements hydro
agricoles qui totalisent 843 ha dont 27,46 ha de pépinière.
2.2.4 Ressources en eau
En matière de ressources en eau, il faut distinguer les
eaux de surface et les eaux souterraines. Pour les eaux de surface, la commune
urbaine de Say dispose du fleuve Niger sur près de 25 Km de long. Le
fleuve a un seul affluent dans la commune: le Goroubi. En plus, il faut noter
la présence de 4 mares dont une permanente (Tokèye).
10
Ces ressources en eau de surface sont utilisées
tantôt pour les cultures maraîchères, tantôt pour
l'abreuvement des animaux et quelque fois pour la consommation humaine.
La commune de Say appartient à la formation du
Liptako-Gourma, socle cristallin qui ne renferme que de couches
aquifères dans ses parties altérées ; de ce fait elle est
fortement défavorisée en eaux souterraines.
2.2.5 Flore
Les principaux éléments qui composent cette
végétation sont généralement :
Une strate arborée et arbustive
discontinue et dominée par les espèces suivantes :
Acacia Sp, Balanites aegyptiaca, Bossia
senegalensis, Acacia senegal, Guiera senegalensis,
Piliostigma reticulatum, Bauhinia rufescens, Combretum
micranthum, Combretum glutinosum, Acacia albida, Hyphaena
thebeica. Ces espèces subissent une dégradation très
souvent irréversible.
Un tapis herbacé
surpâturé et dominé par des espèces
annuelles telles que : Cenchrus biflorus, Pollida pennisetum,
Eragrostis tremula, Schoenefeldia gracilis, Alysicarpus
ovolifolius, Zornia glochidiata, Cyperus rotusidus, Cacia
mimosoïdes , Ceratotheca sesamoïches, etc. ce tapis subit une
forte colonisation du Sida cordopholia.
La commune urbaine de Say n'est pas assez riche en
pâturage. Dans la majorité des cas, les aires de pâturage
sont des espaces situés sur les plateaux ou en altitude. Ces terres, de
mauvaise structure (sols compacts ou sols battants), sont très pauvres
en végétation arborée, arbustive et herbacée. Ces
terres ont été dégradées par les érosions
hydriques et éoliennes et une utilisation abusive par les
communautés à travers une destruction intensive des arbres et
arbustes. Par conséquent ils ne permettent pas aux animaux un
pâturage satisfaisant, surtout en saison sèche. Ainsi les
espèces les plus appétées sont composées
généralement des herbacées (Echinochloa stagnima
(Bourgou) et Eichlornia crassipes) auxquelles s'ajoutent les
feuilles des arbres et arbustes et les sous-produits agricoles dont la paille
de riz.
2.2.6 Faune
La faune n'est pas assez riche, elle est
caractérisée seulement par la présence de singes, pintades
sauvages, gazelles, lapins, hyènes, etc. La faune aquatique est
constituée des crocodiles, hippopotames, lamantins et de multiples
oiseaux.
11
2.3 Aspect humain
2.3.1 Population
Au dernier recensement général de la population et
de l'habitat (RGP/H) survenu en 2012 au
Niger, l'ensemble des 50 villages administratifs et hameaux de
la commune Urbaine de Say comptaient 58290 habitants. Cette population est
composée principalement de : Peulhs, Djerma-Songhaï, Haoussa et
Touareg.
2.3.2 Activités socioéconomiques
Sur le plan socio-économique, l'agriculture,
l'élevage et le commerce constituent
incontestablement les principales activités de la
commune. L'exode rural est un phénomène qui émane de
l'insuffisance de revenu annuel d'un individu pour couvrir tous ces besoins. Il
permet de combler le déficit céréalier des ménages.
Dans la Commune urbaine de Say, l'exode à l'intérieur du pays
notamment vers la capitale Niamey est le plus important. En plus, cet exode
rural touche également l'extérieur du pays à savoir : le
Nigéria, le Benin, le Burkina Faso, la Cote d'Ivoire, le Mali, le
Ghana.
La présence du fleuve et de certaines mares
empoissonnées font que la pêche devienne une activité
présente sur l'échiquier des activités économiques
de la Commune de Say. C'est une activité qui intéresse
particulièrement les hommes dans la capture et les femmes dans
l'écoulement des poissons ; ce qui leur permet d'améliorer leurs
revenus. La production peut atteindre au moins 10 tonnes de poissons par an. Ce
poisson est destiné aussi bien à la consommation locale
qu'à la vente dans les marchés locaux et dans la ville de Niamey.
En dépit de son apport relativement considérable dans
l'économie des ménages, la pêche est pratiquée de
façon traditionnelle.
2.3.3 Organisation administrative et sociale
Cette organisation fait apparaître deux (2) types de
pouvoir bien distincts dans cette
commune:
? le pouvoir moderne exercé par le conseil municipal
avec à sa tête un maire assisté par un personnel de soutien
(Secrétaire Général, SM, receveur municipal, agents
d'état civil, planton, manoeuvre, gardien) ;
? le pouvoir traditionnel est exercé par le chef du
canton. Il le fait à travers ses représentants qui sont les chefs
des villages et quartiers assistés par les autorités
religieuses.
12
CHAPITRE II : MATERIEL ET METHODES
2.1 Présentation du site d'étude
2.1.2 Localisation de Say
Say (Figure 4) est située entre les longitudes 5°50'
et 6°00'Est et les latitudes 14°40'et 14°50'
Nord. C'est une ville riveraine du fleuve Niger dans la
région de Tillabéry à 55 km de Niamey.
2.1.3 Choix des stations d'études
A l'issue de la phase de prospection et de l'entretien avec la
communauté des pêcheurs dans
l'ensemble de la zone d'étude (début juillet
2019), trois stations d'échantillonnage ont été choisies
compte tenu de leurs accessibilités et du débarquement des
pêcheurs. Le premier à l'amont du secteur parcouru par le fleuve
Niger de la ville: Tounga Mini, la deuxième à
mi-parcours: Bolongué et enfin la troisième,
à l'aval: Koba (Figure 4).
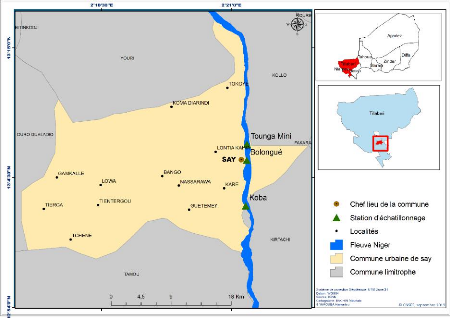
Figure 4 : Localisation des sites d'échantillonnage
13
2.2 Matériel
2.2.1 Structures logistiques
Les structures logistiques qui ont servi de cadre pour la
réalisation de la présente étude sont le
laboratoire de l'Ecole Normale Supérieure (ENS) de
l'Université Abdou Moumouni (UAM)
de Niamey et de la Direction de la Pêche et de
l'Aquaculture. En plus de ces structures du
matériel de collectes a été
utilisé.
2.2.2 Matériel de collecte des données
- un double décimètre est utilisé pour
mesurer les mailles (noeud à noeud) des filets;
- un appareil photo numérique de marque Canon IXUS 20
mégapixels pour la prise des
images;
- un GPS (Global Positioning System) de marque GARMIN pour la
prise des coordonnées
géographiques des différentes stations
d'étude ;
- un Oxymètre EcoSense ODO200 pour la mesure de
l'oxygène dissous de l'eau et du taux de
saturation en oxygène ;
- un multiparamètre HANNA HI9813-6 pour la mesure de la
température, du pH, de la
conductivité et du TDS ;
- un disque de Secchi muni d'une corde graduée en cm
pour mesurer la transparence et la
profondeur de l'eau ;
- un peson pour peser les captures ;
- une trousse à dissection pour certaines dissections
dans les identifications des poissons ;
- des sachets en plastique pour l'emballage des poissons
échantillonnés ;
- des étiquettes pour identifier les
échantillons ;
- une glacière contenant de la glace pour la
conservation au frais des poissons échantillonnés
pendant leur transport des stations d'étude vers le
laboratoire ;
- du formol dilué à 10% pour la conservation des
poissons ;
- la clé d'identification des poissons de Paugy et
al. (2003) ;
- un ichtyomètre de 1,5 m de long, gradué en
millimètre pour mesurer la taille des poissons ;
- une balance de précision 0,01 g pour peser les
poissons échantillonnés ;
14
- un lot de cinq (5) filets maillants à différent
maillage (10, 20, 25, 40 et 50 mm) pour la pêche expérimentale
;
- une table de tri ;
- une fiche pour les mesures morphométriques ;

Oxymètre
Balance de précision PH-mètre
GPS
Multiparamètre
|
Filet maillant Ichtyomètre
expérimentaux
|
Figure 5 : Materiel de collectes des données
2.3 Méthodes
2.3.1 Collectes des données
2.3.1.1 Paramètres physico-chimiques des
stations d'échantillonnage
Les mesures sont prises une fois par mois au niveau de chacune
des trois stations de fin juillet
à fin septembre. Les coordonnées
géographiques de ces stations étant enregistrées lors de
la prospection, pour toute mesure nous naviguons à l'aide du GPS pour
aller aux mêmes points. Ces mesures sont faites les matins entre 07
heures et 09 heures. Au cours de la prise de ces mesures nous précisons
chaque fois le temps qu'il fait (état du ciel nuageux ou non, temps
pluvieux, ensoleillé, venteux, etc.). Les paramètres
mesurés sont: la température ambiante et
15
celle de l'eau (°C), le pH, le taux de solides dissout ou
TDS (mg/L) et la conductivité (ìS/cm); la profondeur de l'eau
(cm) et la transparence de l'eau (cm); le taux de saturation en oxygène
(%) et l'oxygène dissous (mg/l).
2.3.1.2 Inventaire de l'ichtyofaune
Chaque station est visitée chaque 15 jours entre 7 heures
et 11 heures dans le but de
rencontrer beaucoup de pêcheurs avec leurs captures. A
chaque station les captures issues de la pêche artisanale sont
échantillonnées afin de pouvoir caractériser le peuplement
de poissons des pêcheries de la commune de Say. Les données
d'inventaire de la pêche artisanale sont complétées par
celles des pêches expérimentales réalisées chaque 15
jours à l'aide d'une batterie de cinq (5) filets expérimentaux de
50 m de longueur et 1,5 m de profondeur et de différents maillages (10
mm, 20 mm, 25 mm, 40 mm et 50 mm). Les filets maillants expérimentaux
ont été utilisés dans le but d'échantillonner une
taille variable des espèces qui auraient échappé à
la pêche artisanale. Les filets ont été disposés
obliquement au sens du courant d'eau de l'amont à l'aval dans chaque
station et suivant l'ordre décroissant des mailles. Ils ont
été posés entre 17 et 18 heures et relevés le
lendemain entre 7 et 8 heures. Les captures des filets ont été
collectées et étiquetées par maille.
2.3.1.3 Suivi des captures et des techniques de
pêche
A chaque sortie les captures des pêcheurs rencontrés
sont régulièrement échantillonnées. Ceci
permet de recueillir pour chaque station des informations
comme: le type d'engin, le village de provenance, la quantité de
poissons pêchés, les espèces de poissons capturées
et leur abondance relative est calculée par station.
2.3.1.4 Mensurations morphométriques et
pondérales
Après l'identification à l'aide la clé de
Paugy et al. (2003), les caractéristiques
morphométriques des espèces sont prises. Il s'agit
de:
- la longueur totale (LT) qui représente la longueur du
poisson depuis l'extrémité de la bouche jusqu'à
l'extrémité de la nageoire caudale ;
- la longueur standard (LS). C'est la longueur du poisson
depuis l'extrémité de sa bouche jusqu'à la base de sa
nageoire caudale ;
- le poids total de chaque individu.
16
2.3.2 Analyse et traitement des
données
2.3.2.1 Analyse des données
2.3.2.1.1 Paramètres physico-chimiques
Le traitement des données collectées au niveau des
paramètres physico-chimiques a consisté
au calcul des moyennes, écart-types. Les
résultats obtenus ont été présentés sous
forme de tableaux. Nous avons testé la normalité des
données par le test statistique de Ryan-Joiner. Ensuite, des
comparaisons de moyennes ont été faites par station et par mois
grâce au test de Kruskal wallis. Ainsi, au cas où, une
différence significative a été mise en évidence,
nous avons procède à une comparaison statistique des moyennes
grâce au test de Mann Whitney.
2.3.2.1.2 Inventaire de l'ichtyofaune
Pour une présentation synthétique des informations
et une meilleure compréhension de
l'organisation des peuplements des poissons, nous avons
présenté sous forme de tableaux regroupant les différentes
familles, genres, espèces et leur présence par station et par
mois.
2.3.2.1.2.1 Indice de diversité de Shannon et de
Wiener
L'indice de diversité de Shannon et de Wiener noté
H' donne une idée de la distribution
spécifique au sein de la population
étudiée.
H' = -Ó (Pi log2 (Pi)) ;
H' est exprimé en bits, avec
Pi = ni / N ; ni est le nombre d'individus
représentant l'espèce i et N=
nombre total d'individus.
Les indices de diversité de Shannon, quel que soit le
groupe physiologique, sont compris généralement entre 1
bit et 4,5 bits environ ou exceptionnellement plus dans le cas des
échantillons de grande taille de communautés complexes.
2.3.2.1.2.2 Régularité ou
l'équitabilité de Piélou
La régularité ou l'équitabilité de
Piélou notée Eq permet de voir si les individus sont
équitablement répartis au sein des espèces
du milieu.
Eq = H'/ log2 S ;
S = nombre total des espèces.
Elle est comprise entre 0 et 1. Elle tend vers 0 quand la
quasi-totalité des effectifs est
concentrée sur une espèce et vers 1 lorsque toutes
les espèces ont le même nombre d'individu.
Si: Eq ? [0; 0,6]: équitabilité de Pielou
faible. Il y a un phénomène de dominance dans la
communauté. Si Eq ? [0,7 ; 0,8]: équitabilité de Pielou
moyenne ;
17
Si Eq ? [0,8; 1]: équitabilité de Pielou est
élevée. Il y a absence de dominance et les ressources sont
régulièrement réparties entre les individus de la
communauté.
2.3.2.1.2.3 Richesse spécifique effective
(S)
La richesse spécifique effective (S)
indique le nombre d'espèces responsables de la diversité
observée. Elle est donnée par la formule :
N= 2H;
2 désigne la base du logarithme utilisé pour
calculer l'indice de diversité de Shannon H.
2.3.2.1.2.4 Indice de similitude de Jaccard
Pour comprendre les relations entre les différentes
stations, l'indice de similitude de Jaccard (IJ) est calculé par la
formule :
IJ= 100 c
a+b-c
Où a et b désignent respectivement le nombre
d'espèces des milieux A et B et c le nombre d'espèces communes
aux deux milieux.
Si IJ > 50%, il s'agit d'une même communauté et
si IJ < 50%, A et B sont des communautés différentes.
2.3.2.1.2.5 Capture Par Unité d'Effort
(CPUE)
La Capture Par Unité d'Effort est selon Anato (2001) le
rapport des prises sur la durée de
pêche. Sa détermination permet d'apprécier
l'efficacité et le rendement de chacun des engins. La CPUE est
calculée par engin.
2.3.2.1.2.6 Histogramme des fréquences de
taille
Des histogrammes de fréquence de taille sont tracés
pour exprimer la structure de taille des
poissons échantillonnés.
2.3.2.1.3 Biologie de l'espèce abondante dans les
captures
Dans le cadre de la présente étude, seules les
mensurations telles que la longueur totale (Lt),
la longueur standard (Ls) et le poids total (Pt) ont
été prises en compte pour déterminer la relation existante
entre le poids et la longueur, le coefficient de condition K et la taille de
première capture.
2.3.2.1.3.1 Relations poids-longueurs
La relation poids-longueur est un paramètre qui permet de
vérifier la croissance de la
population de poissons. Elle est établie au moyen de la
formule suivante :
18
Pt = aLtb (Le Cren 1951)
Où Pt et Lt représentent respectivement le poids
total et la longueur totale du poisson. Les constantes a et b sont
respectivement des facteurs caractéristiques du milieu et de
l'espèce. Le coefficient b varie entre 2 et 3 (Lalèyè,
1995), mais il est souvent proche de 3. Lorsqu'il est statistiquement
égal à 3, la croissance est dite isométrique. Lorsqu'il
est différent de 3, la croissance est dite allométrique. Un
coefficient b supérieur à 3 indique une meilleure croissance en
poids qu'en longueur et inversement lorsque b est inférieur à
3.
2.3.2.1.3.2 Facteur de condition
Le facteur de condition k est calculé pour l'espèce
abondante dans les captures, sur la base de
la formule selon Koné et Teugels (1999).
K=100(Pt/Ltb )
Pt est le poids corporel, Lt est la longueur totale du poisson
et b le coefficient d'allométrie de la relation poids-longueur.
Ce facteur permet d'apprécier la corpulence du poisson,
son embonpoint. Une valeur élevée de K signifie que les poissons
ont de l'embonpoint et sont dans un milieu où les conditions de vie leur
sont favorables.
19
CHAPITRE III : RESULTATS ET DISCUSSION
3.1 Résultats
3.1.1 Paramètres physico-chimiques
3.1.1.1 Caractéristiques physico-chimiques des
trois stations
Le tableau1 présente la synthèse des valeurs des
paramètres physico-chimiques de l'eau
durant les trois mois d'échantillonnage.
Tableau 1 : Synthèse des paramètres
physico-chimiques de l'eau au cours de l'étude
|
Paramètres
|
|
Tounga Mini
|
Bolongué
|
Koba
|
|
Température ambiante
(°C)
|
Moyenne Ecart-type
Min
Max
|
29,70
3,47
27,60
33,70
|
29,37
2,01
27,70
31,60
|
29,30
0,53
28,70
29,70
|
|
Moyenne
|
27,93
|
28,53
|
28,30
|
|
Température eau (°C)
|
Ecart-type Min
|
1,79
26,80
|
1,88
27,40
|
0,85
27,50
|
|
Max
|
30
|
30,70
|
29,20
|
|
Moyenne
|
5,06
|
5,19
|
5,22
|
|
Oxygène dissous
|
Ecart-type
|
0,34
|
0,39
|
0,20
|
|
(mg/L)
|
Min
|
4,68
|
4,96
|
4,99
|
|
Max
|
5,31
|
5,64
|
5,34
|
|
Moyenne
|
7,50
|
7,63
|
7,60
|
|
Ecart-type
|
0,75
|
0,99
|
0,35
|
|
pH
|
Min
|
6,70
|
6,50
|
7,20
|
|
Max
|
8,20
|
8,30
|
7,80
|
|
Moyenne
|
2,67
|
2,67
|
3,33
|
|
Transparence (cm)
|
Ecart-type Min
|
0,58
2,00
|
1,15
2,00
|
1,53
2,00
|
|
Max
|
3,00
|
4,00
|
5,00
|
|
Moyenne
|
2,06
|
4,40
|
5,80
|
|
Ecart-type
|
0,43
|
0,87
|
2,45
|
|
Profondeur (m)
|
Min
|
1,60
|
3,40
|
3,00
|
|
Max
|
2,47
|
5,00
|
7,60
|
|
Moyenne
|
32
|
37,67
|
36,67
|
|
Conductivité (ìS/cm)
|
Ecart-type Min
|
2
30
|
2,52
35
|
3,06
34
|
|
Max
|
34
|
40
|
40
|
|
Moyenne
|
0,40
|
0,03
|
0,28
|
|
Ecart-type
|
0,17
|
0,01
|
0,21
|
|
TDS (ppm)
|
Min
|
0,30
|
0,03
|
0,03
|
|
Max
|
0,60
|
0,04
|
0,40
|
|
Moyenne
|
0,35
|
0,37
|
0,38
|
|
Vitesse (m/s)
|
Ecart-type Min
|
0,10
0,25
|
0,08
0,30
|
0,10
0,30
|
|
Max
|
0,44
|
0,46
|
0,49
|
20
3.1.1.2 Variations spatio-temporelles des
paramètres physico-chimiques
Le tableau 2 présente variations spatio-temporelles des
paramètres physico-chimiques du fleuve durant notre étude.
La plus forte température (30,7 °C) a
été relevée à la station de Bolongué en
septembre et la plus faible (26,8 °C) à Tounga Mini en août.
Les moyennes des températures sont presque constantes entre les
stations. L'analyse statistique (Kruskal Wallis) n'a montré aucune
différence significative de la température de l'eau d'une station
à une autre (p=0,58) et d'un mois à un autre (p =0,066)
La plus grande valeur de pH (8,3) a été
relevée à la station de Bolongué en août et la plus
faible (6,5) à Bolongué en septembre. L'analyse statistique
(Kruskal Wallis) n'a montré aucune différence significative entre
les mois (p=0,045) et entre les stations (p=0,84).
La plus grande valeur de l'oxygène dissous (5,64 mg/L)
a été obtenue à la station de Koba en juillet et la plus
petite (4,68 mg/L) à Tounga Mini en septembre. De manière
générale, les teneurs en oxygène dissous du mois de
septembre sont faibles par rapport aux autres mois et ceci pour toutes les
stations. L'analyse statistique (Kruskal Wallis) n'a montré aucune
différence significative de l'oxygène dissous d'un mois à
un autre (p=0,082) et d'une station à une autre (p=0,56).
La transparence est restée très faible au cours
de la période d'échantillonnage pour toutes les stations. La plus
grande valeur a été enregistrée à la station de
Bolongué en juillet et faible au niveau de toutes les stations et mois.
L'analyse statistique (Kruskal Wallis) n'a montré aucune
différence significative entre les mois (p=0,11) et entre les stations
(p=0,89)
La plus forte profondeur (7,6 m) a été
relevée en septembre à la station de Koba et la plus faible (1,6
m) en juillet à la station de Tounga Mini. La profondeur augmente de
juillet à septembre dans toutes les stations. On constate que la moyenne
de la profondeur, toutes stations confondues a presque doublé de juillet
à septembre. L'analyse statistique (Kruskal Wallis) n'a montré
aucune différence significative entre les mois (p=0,39) et entre les
stations (p=0,060) Le Taux des Solides Dissous est trop faible sur le fleuve
Niger, la moyenne obtenu au cours de notre étude est de 0,23 #177; 0,09
ppm ce qui entraîne une conductivité trop faible la moyenne est de
35,44 #177; 3,33 ìS/cm
La plus faible vitesse de l'eau du fleuve est obtenue en
juillet (0,25m/s) à la station de Tounga Mini et la plus grande en
août (0,49m/s) à Koba. Globalement les vitesses moyennes sont
faibles sans différence significative entre les stations
mais avec une différence significative entre les mois.
Tableau 2 : Variations spatio-temporelles des paramètres
physico-chimiques
|
Paramètres
|
Juillet
|
Août
|
Septembre
|
Moyennes
|
|
Température
ambiante (°C)
|
Tounga Mini
Bolongué
Koba
Moyennes
|
27,8
27,7
28,7
28,06 #177; 0,44
|
27,6
28,8
29,7
28,7 #177; 0,86
|
33,7
31,6
29,5
31,6 #177; 1,71
|
29,7 #177; 2,82 29,36 #177;1,64 29,3 #177; 0,43 29,45 #177;
0,17
|
|
Tounga Mini
|
27
|
26,8
|
30
|
27,93 #177; 1,79
|
|
Température eau (°C)
|
Bolongué
|
28,2
|
27,5
|
30,7
|
28,8 #177; 1,68
|
|
Koba
|
27,4
|
27,5
|
29,2
|
28,03 #177; 1,01
|
|
Moyennes
|
27,53 #177; 0,49
|
27,26 #177; 0,33
|
29,96 #177; 0,61
|
28,25 #177; 0,38
|
|
Tounga Mini
|
5,31
|
5,2
|
4,68
|
5,06 #177; 0,33
|
|
Oxygène dissous
|
Bolongué
|
5,34
|
4,96
|
4,96
|
5,08 #177; 0,21
|
|
(mg/L)
|
Koba
|
5,64
|
5,34
|
4,99
|
5,32 #177; 0,32
|
|
Moyennes
|
5,43 #177; 0,14
|
5,16 #177; 0,15
|
4,87 #177; 0,13
|
5,15 #177; 0,28
|
|
Tounga Mini
|
7,6
|
8,2
|
6,7
|
7,5 #177; 0,75
|
|
pH
|
Bolongué
|
7,8
|
8,3
|
6,5
|
7,53 #177; 0,92
|
|
Koba
|
8,1
|
7,8
|
7,2
|
7,7 #177; 0,45
|
|
Moyennes
|
7,83 #177; 0,25
|
8,1 #177; 0,26
|
6,8 #177; 0,36
|
7,57 #177; 0,56
|
|
Tounga Mini
|
3
|
2
|
3
|
2,66 #177; 0,57
|
|
Transparence (cm)
|
Bolongué
|
5
|
2
|
2
|
3 #177; 1,173
|
|
Koba
|
4
|
3
|
2
|
3 #177; 1
|
|
Moyennes
|
4 #177; 1
|
2,33 #177; 0,57
|
2,33 #177; 0,57
|
2,88 #177; 0,19
|
|
Tounga Mini
|
1,6
|
2,13
|
2,47
|
2,06 #177; 0,43
|
|
Bolongué
|
3
|
4,8
|
5
|
4,26 #177; 0,89
|
|
Profondeur (m)
|
Koba
|
3,4
|
6,8
|
7,6
|
5,93 #177; 2,23
|
|
Moyennes
|
2,66 #177; 0,94
|
4,57 #177; 2,34
|
5,02 #177; 2,56
|
3,97 #177; 1,93
|
|
Tounga Mini
|
30
|
32
|
34
|
32 #177; 2
|
|
Conductivité (ìS/cm)
|
Bolongué Koba
|
34
40
|
38
40
|
35
36
|
35,66 #177; 2,08
38,66 #177; 2,30
|
|
Moyennes
|
34,66 #177;5 ,03
|
36,66 #177; 4,16
|
35 #177; 1
|
35,44 #177; 3,33
|
|
Tounga Mini
|
0,3
|
0,6
|
0,3
|
0,4#177; 0,14
|
|
Bolongué
|
0,4
|
0,04
|
0,03
|
0,15 #177; 0,17
|
|
TDS (ppm)
|
Koba
|
0,03
|
0,4
|
0,03
|
0,15 #177; 0,17
|
|
Moyennes
|
0,24 #177; 0,15
|
0,34 #177; 0,23
|
0,12 #177; 0,12
|
0,23 #177; 0,09
|
|
Tounga Mini
|
0,25
|
0,44
|
0,37
|
0,35 #177; 0,096
|
|
Bolongué
|
0,3
|
0,46
|
0,34
|
0,36 #177; 0,083
|
|
Vitesse (m/s)
|
Koba
|
0,3
|
0,49
|
0,36
|
0,38 #177; 0,097
|
|
Moyennes
|
0,28 #177; 0,028
|
0,46 #177; 0,025
|
0,35 #177; 0,0152
|
0,36 #177;0 ,0152
|
|
|
|
|
|
21
|
22
3.1.2 Inventaire de la faune ichtyologique
Il a été échantillonné 2152 poissons
dont 1213 individus proviennent de la pêche artisanale et
939 individus sont issus de la pêche
expérimentale. Au total 41 espèces ont été
échantillonnées à Tounga mini, 35 espèces
Bolongué et Koba. La richesse spécifique mensuelle obtenu au
cours de cette étude est de: 34 espèces en juillet, 40
espèces en août et 38 espèces en septembre .Le tableau 3
présente la liste des espèces de poissons inventoriés dans
le fleuve à Say.
Tableau 3 : Liste des espèces de poissons
inventoriés dans le fleuve à Say
|
|
|
Mois
|
|
|
Stations
|
|
|
Familles
|
Espèces
|
Juillet
|
Août
|
Septembre
|
Tounga Mini
|
Bolongué
|
Koba
|
|
Alestidae
|
Alestes dentex ( Linnaeus,1758) Alestes
macrophthalmus Günther, 1867 Hydrocynus forskali
(Cuvier,1819) Brycinus nurse (Rüppell,1832) Brycinus
leuciscus ( Günther, 1867)
|
X X X X
|
X
X X X
|
X
X X
|
X X X X X
|
X
X
X
|
X X X X X
|
|
Bagridae
|
Bagrus bajad (Forskål, 1775) Bagrus docmak
(Forskål,1775)
|
X
|
X
X
|
X X
|
X
|
X
X
|
X
X
|
|
Cichlidae
|
Hemichromis bimaculatus, Gill 1862 Oreochromis
niloticus (Linnaeus, 1758) Sarotherodon galilaeus (Linnaeus,
1758) Coptodon zillii (Gervais, 1848)
|
X
X
|
X X X X
|
X
X
|
X
X
X
|
X
X
X
|
X
|
|
Citharinidae
|
Citharinus citharus (Geoffroy Saint-Hilaire, 1809)
|
X
|
X
|
X
|
X
|
X
|
|
|
Clariidae
|
Clarias angularis (Linnaeus,1758) Heterobranchus
bidorsalis Geoffroy Saint-Hilaire, 1809
|
X
|
X
X
|
X X
|
X X
|
X
X
|
X
X
|
|
Claroteidae
|
Auchenoglanus occidentalis(Valenciennes, 1840)
Auchenoglanus biscutatus (Geoffroy Saint-Hilaire,
1808)
Chrysichthys auratus(Geoffroy
Saint-Hilaire,1808)
Chrysichthys nigrodigitatus (Lacepède,1803)
Clarotes laticeps (Rüppell,1829)
|
X
X
X
X
X
|
X
X
X
X
|
X
X
X X
|
X
X X
|
X X X X
|
X
X
X
X
|
|
Cyprinidae
|
Labeo coubie Rüppell, 1832
Labeo senegalensis,Valenciennes, 1842 Labeo barbus
(Forskål, 1775)
|
X
X
X
|
X
X
|
X X
|
X X
|
X
X
|
X
X
X
|
|
Distichodontidae
|
Distichodus rostratus Günther, 1864 Distichodus
brevipinnis Günther, 1864
|
X
X
|
X
|
X
|
X X
|
X
|
X
|
|
Latidae
|
Lates niloticus (Linnaeus,1758)
|
X
|
X
|
X
|
X
|
X
|
X
|
|
Malapteruridae
|
Malapterurus electricus (Gmelin, 1789)
|
X
|
|
X
|
X
|
X
|
|
|
Mochokidae
|
Synodontis batensoda Rüppell, 1832 Synodontis
schall (Bloch et Schneider, 1801)
|
X
X
|
X
X
|
X X
|
X X
|
X
X
|
X
X
|
23
X X X X
Synodontis sorex Günther,1864
X X X X X
Synodontis courteti Pelligrin,1906
X X X X X
Synodntis gobroni Daget ,1954
X X X X X X
Synodontis occellifer Boulenger,1900
X X
Synodontis violaceus Pellegrin ,1919
X
Mormyridae Campylomormyrus tamandua (Günther,
1864) X X X X X
Marcusenius cyprinoides (Linnaeus, 1758) X X X X X X
X X X
Marcusenius abadii (Boulenger,1901)
X X X X X X
Mormyrus rume Valenciennes,1846
X X X X X
Mormyrus macrophtalmus Günther,1866
X X X X X
Mormyrops oudoti Daget,1954
X X X X X X
Pollimyrus isidori (Valenciennes, 1846)
X X X X
Pollimyrus petricolus(Daget, 1954)
X X X X X X
Hyperopisus bebe (Lacepède,1803)
X X X
Hypopotamyrus pictus( Marcusen,1864)
X X X
Petrocephalus bovei(Valenciennes,1847)
X
Polypteridae Polypterus senegalus senegalus Cuvier,
1829 X
X X X
Protopteridae Protopterus annectens (Owen, 1839)
X X X X X X
Schilbeidae Schilbe mystus (Linnaeus,1758)
X X
Tetraodontidae Tetraodon lineatus Linneaus ,1758
34 40 38 41 35 35
Total
X : présence de l'espèce
3.1.2.2 Communauté ichtyologique
Il a été inventorié 48 espèces dont 3
provenant que de la pêche experimentale ( Hemichromis
bimaculatus, Brycinus leuciscus et Polypterus
senegalus senegalus) réparties dans 31 genres et 16 familles dans
les pêcheries de Say. La figure 6 présente la répartition
des familles en fonction du nombre d'espèces.
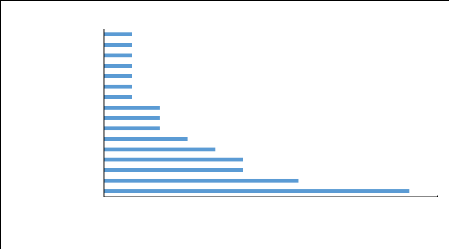
0 1 2 3 4 5 6 7 8 9 10 11 12
Nombre d'espèces
Schilbeidae
Polypteridae
Latidae
Clariidae
Bagridae
Cichlidae
Claroteidae
Mormyridae
Familles
24
Figure 6 : Répartition des familles en fonction de nombre
d'espèces
Les Mormyridae constituent la famille la plus
représentée avec 11 espèces et 8 genres soit 22,91%, de la
faune ichtyologique, suivies par le Mochokidae avecn7espèces (14,58%),
les Claroteidae et les Alestidae avec 5 espèces chacune soit 10,41%, les
Cichlidae avec 4 espèces soit 8,33%, les Cyprinidae avec 3
espèces soit 6,25%, les Bagridae, les Clariidae et les Distichodontidae
ont chacune 2 espèces. Les autres familles ont
représentées chacune par une seule espèce. Le nombre
d'espèces probable estimé sur la base de l'estimateur de
Jack-Knife (S) est de 51 espèces.
3.1.2.3 Abondances numérique et pondérale
des espèces capturées 3.1.2.3.1 Abondances numérique et
pondérale générales
La figure7 présente l'abondance numérique (A) et
pondérale (B) en pourcentage de toutes les stations confondues durant
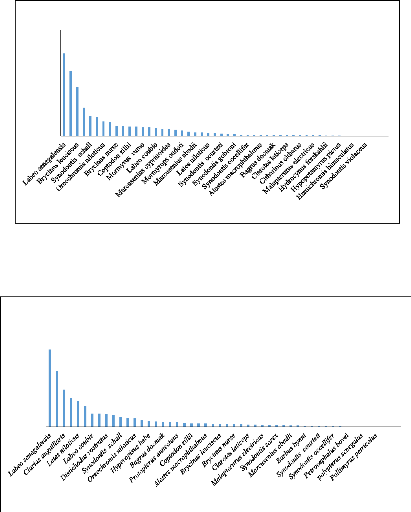
les trois mois d'échantillonnage. Les espèces les plus abondantes
en nombre sont: Labeo senegalensis avec 19,47%; Pollimyrus isidori
avec 15,42%; Brycinus leuciscus avec 11,47%; Schilbe mystus
avec 6,64%. Les autres espèces, chacune prise individuellement a
moins de 5%. Quant à la biomasse c'est Labeo senegalensis
(19,19%) qui domine suivi de Bagrus bajad avec 13,89% puis
Glarias anguillarus (9,22%) et Heterobranchus bidorsalis
(7,05%). La plus faible biomasse a été
enregistrée chez Hemichromis bimaculatus avec 0,001% de la
biomasse totale.
25
20
Abondance(%)
15
10
5
0
A
Espèces
25
20
Abondance(%)
15
10
5
0
B
Espèces
25
Figure 6 : Abondance numérique (A) et pondérale (B)
toutes stations confondues
26
3.1.2.3.2 Abondance numérique spatiale
La figure 8 présente l'abondance spatiale numérique
des différentes espèces capturées. On
|
Abondance numerique(%)
|
16
14 12 10 8 6
4
2
0
|
Tounga Mini
|
|
|
|
|
Pollimyrus isidori Labeo senegalensis Schilbe mystus
Brycinus leuciscus Synodontis schall Clarias anguillaris Oreochromis niloticus
Tilapia zilii Chrysichthys auratus Marcusenius cyprinoides Brycinus nurse
Distichodus rostratus Labeo coubie Synodontis batensoda
Auchenoglanus...
Marcusenius abadii Mormyrus rume
Campylomormyrus...
Alestes dentex Bagrus bajad Protopterus annectans Synodontis
courteti Hyperopisus bebe
Chrysichthys...
Synodontis gobroni Mormyrops oudoti
Mormyrus...
Sarotherodon gallileus Synodontis occellifer Alestes
macrophthalmus Distichodus brevipinnis Malapterurus electricus Petrocephalus
bovei Synodontis sorex Citharinus citharus Lates niloticus Pollimyrus
petricolus
Heterobranchus...
Hydrocynus forskahlii Hypopotamyrus pictus polypterus
senegalus
|
|
|
Espèces
Koba
30
25
20
15
10
5
0
Abondance numerique(%)
Espèces
Brycinus leuciscus Clarias anguillaris Labeo senegalensis
Pollimyrus isidori Synodontis schall Bagrus bajad Schilbe mystus Oreochromis
niloticus Mormyrops oudoti
Auchenoglanus...
Chrysichthys auratus
Chrysichthys...
Hyperopisus bebe Synodontis batensoda Mormyrus rume
Distichodus rostratus Brycinus nurse Lates niloticus Bagrus docmak Clarotes
laticeps Labeo coubie
Marcusenius...
Synodontis gobroni Synodontis sorex Alestes dentex
Alestes...
Heterobranchus...
Hydrocynus forskahlii Barbus bynni
Campylomormyrus... Mormyrus...
Petrocephalus bovei Pollimyrus petricolus Synodontis
occellifer Tetraodon lineatus
constate qu'à Tounga Mini une dominance des Pollimyrus
isidori (14,88%) et Labeo senegalensis (9,96%), à
Bolongué Labeo senegalensis qui domine fortement avec 37,29%,
alors qu'à Koba c'est les Brycinus leuciscus qui dominent avec
25,19% de la capture.
0
Labeo senegalensis Pollimyrus isidori Brycinus leuciscus
Schilbe mystus Chrysichthys auratus Synodontis schall Oreochromis niloticus
Mormyrus rume Tilapia zilii Brycinus nurse Bagrus bajad Clarias anguillaris
Labeo coubie Chrysichthys nigrodigitatus Synodontis batensoda Distichodus
rostratus Auchenoglanus biscutatus Alestes dentex Lates niloticus Mormyrops
oudoti Synodontis courteti Heterobranchus bidorsalis Marcusenius cyprinoides
Citharinus citharus Marcusenius abadii Auchenoglanus occidentalis Bagrus docmak
Campylomormyrus tamandua Hemichromis bimaculatus Hyperopisus bebe Hypopotamyrus
pictus Malapterurus electricus Mormyrus macrophthalmus Synodontis occellifer
Synodontis violaceus
Espèces
40
35
30
25
20
15
10
5
Abondance numérique(%)
Bolongué
27
Figure 7 : Abondance numérique spatiale
3.1.2.3.3 Abondance pondérale
La figure 9 présente la répartition spatiale de
la biomasse des captures. On constate qu'à Tounga Mini Labeo
senegalensis domine avec 18,82% suivi de Glarias angullaris
(9,85%), à Bolongué Labeo senegalensis domine
largement avec 32,93% et à Koba Bagrus bajad domine avec 19,76%
de la capture total
Tounga Mini
|
20
18
16 14 12 10 8
6 4 2 0
|
|
|
|
Abondance ponderale(%)
|
|
|
|
Labeo senegalensis Clarias anguillaris
Auchenoglanus...
Lates niloticus Synodontis batensoda Labeo coubie Synodontis
schall Oreochromis niloticus Protopterus annectans Distichodus rostratus
Mormyrus rume Marcusenius cyprinoides
Chrysichthys...
Schilbe mystus Chrysichthys auratus Bagrus bajad
Malapterurus electricus
Campylomormyrus...
Alestes dentex Pollimyrus isidori Mormyrops oudoti Brycinus
nurse Synodontis gobroni Alestes macrophthalmus Hyperopisus bebe Tilapia zilii
Marcusenius abadii Brycinus leuciscus Citharinus citharus
Mormyrus...
Synodontis sorex Distichodus brevipinnis Sarotherodon
gallileus Synodontis courteti Synodontis occellifer Hydrocynus forskahlii
Petrocephalus bovei
Heterobranchus...
Hypopotamyrus pictus polypterus senegalus Pollimyrus
petricolus
|
|
|
Espèces
Bolongué
35
30
25
20
15
10
5
0
Aoondance ponderale(%)
Labeo senegalensis Bagrus bajad Heterobranchus bidorsalis
Distichodus rostratus Clarias anguillaris Lates niloticus Chrysichthys
nigrodigitatus Auchenoglanus biscutatus Synodontis batensoda Mormyrus rume
Oreochromis niloticus Tilapia zilii Synodontis schall Pollimyrus isidori
Chrysichthys auratus Labeo coubie Brycinus nurse Schilbe mystus Alestes dentex
Auchenoglanus occidentalis Mormyrops oudoti Citharinus citharus Brycinus
leuciscus Marcusenius cyprinoides Marcusenius abadii Synodontis courteti
Malapterurus electricus Bagrus docmak Campylomormyrus tamandua Hypopotamyrus
pictus Mormyrus macrophthalmus Synodontis occellifer Hyperopisus bebe
Synodontis violaceus Hemichromis bimaculatus
Espèces
Koba
Espèces
25
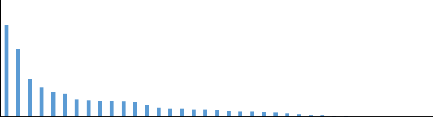
Abondance ponderale(%)
20
15
10
5
0
Bagrus bajad Clarias anguillaris Lates niloticus
Auchenoglanus occidentalis Labeo senegalensis Labeo coubie Chrysichthys
nigrodigitatus Bagrus docmak Mormyrops oudoti Heterobranchus bidorsalis
Hyperopisus bebe Synodontis batensoda Mormyrus rume Distichodus rostratus
Synodontis schall Synodontis gobroni Clarotes laticeps Alestes macrophthalmus
Tetraodon lineatus Brycinus leuciscus Chrysichthys auratus Hydrocynus
forskahlii Oreochromis niloticus Synodontis sorex Schilbe mystus Barbus bynni
Brycinus nurse Pollimyrus isidori Marcusenius cyprinoides Alestes dentex
Synodontis occellifer Mormyrus macrophthalmus Campylomormyrus tamandua
Petrocephalus bovei Pollimyrus petricolus
28
Figure 8 : Abondance pondérale spatiale
29
3.1.2.3.4 Variations spatiales des indices de
diversité
La variation spatiale de la diversité de l'ichtyofaune par
l'indice de diversité de Shannon
suivant les trois (3) stations donne un résultat
consigné dans le tableau4. L'analyse du
tableau4 montre que la station de Bolongué a un indice
de diversité de Shannon moyen (2,6 = H'=3,9).
Les stations de Tounga mini et Koba ont enregistré des
indices de Shannon élevés (4= H'? 6).
L'équitabilité de Piélou élevée (0,8= Eq=1)
a été observée dans les stations de Tounga mini et Koba.
Ces résultats (équitabilité de Pielou moyenne) traduisent
une absence de dominance dans la communauté de ces deux stations. La
station Bolongué présente une valeur d'équitabilité
faible (0= Eq = 0,6) alors il y'a un phénomène de dominance dans
la communauté.
Tableau 4 : Indices de diversité de Shannon et de son
équitabilité en fonction des stations
H' Eq Nombre d'espèce Nombre d'espèce
Stations effective
|
Tounga mini
|
4,43 #177; 0,10
|
0,82
|
21,55
|
41
|
|
Bolongué
|
3,27 #177; 0,11
|
0,63
|
9,64
|
35
|
|
Koba
|
4,11 #177; 0,10
|
0,80
|
17,26
|
35
|
3.1.2.3.5 Variation temporelle des indices de
diversité
La variation temporelle de la diversité de l'ichtyofaune
par l'indice de diversité de Shannon
suivant les trois (3) mois de collecte donne un
résultat consigné dans le tableau5. L'analyse du tableau5 montre
que l'indice de diversité de Shannon varie en fonction des mois. Cette
analyse fait ressortir un indice forte (diversité élevée)
au mois de septembre (4= H'? 6) et l'équitabilité de
Piélou (0,85) est moyenne ce qui traduit un phénomène de
dominance moyenne. Les mois de juillet et août ont enregistrés des
indices de diversités moyens (2,6 = H'= 3,9) de même que des
équitabilités de Piélou (0,74 et 0,72). Ce qui traduit une
diversité et une dominance moyennes.
Tableau 5 : Indices de diversité de Shannon et de son
équitabilité en fonction des mois
H' Eq Nombre d'espèce Nombre d'espèce
Stations effective
|
Juillet
|
3,77 #177; 0,11
|
0,74
|
13,64
|
34
|
|
Août
|
3,88 #177; 0,11
|
0,72
|
14,72
|
40
|
|
Septembre
|
4,48 #177; 0,09
|
0,85
|
22,31
|
38
|
30
3.1.2.3.6 Indice de similarité de
Jaccard
Le tableau 6 présente les valeurs de l'indice de
similarité permettant de comparer les
populations entre les trois stations. L'analyse de ce tableau
montre que toutes les statons sont similaires mais la similarité est
plus forte entre les stations Tounga Mini et Koba.
Tableau 6 : Indice de similarité de Jaccard
Stations Tounga Mini Bolongué Koba
Tounga Mini 1
Bolongué 65% 1
Koba 68% 59% 1
3.1.3 Typologie des engins de pêche et leurs
sélectivités
Les pêcheurs de Say utilisent beaucoup du matériel
traditionnel et des techniques qui sont les
mêmes rencontrées dans les pêcheries
artisanales de la sous-région ouest africaine. Les engins les plus
nombreux et surtout utilisés pendant cette période sont : les
filets maillants, les palangres et les nasses.
? Filets maillants: les mailles des filets
rencontrées au cours de cette étude varient de 10mm; 20 mm; 25
mm; 30 mm; 40 mm; 50 mm noeud à noeud. Certains sont fixés alors
que d'autres dérivent. Ils ont une forme rectangulaire avec une longueur
moyenne de 20 à 50 m et une chute de 1,5 à 2 m. Le choix d'une
catégorie de maille dépend de l'espèce (taille) que le
pêcheur désire capturer car c'est un engin sélectif.
Ils sont posés dans la colonne d'eau le soir à
17 h et relevés le lendemain matin aux environs
de 6 h.

Figure 9 : Filet maillant de différentes mailles
31
? Palangres: Elles sont constituées
d'une ligne principale horizontale (de longueur variable) à laquelle
sont attachés des avançons très rapprochés munis
chacun d'un hameçon, suspendue dans l'eau et portant un appât.
L'appât utilisé au cours de l'étude est soit un ver soit un
petit morceau de savon parfumé. Cet engin est généralement
toujours signalé à cause du danger qu'il constitue pour les
usagers. Il est posé le soir entre 17 et 18 heures et relevé le
lendemain matin à 6h (au même moment que les filets maillants).

Figure 10 : Quelques palangres d'hameçons
différents
? Nasses: ce sont des cages en forme conique
faites d'une charpente constituée de tiges verticales montées
autour de cercles de diamètre décroissant vers le sommet. Cette
charpente est entourée de filet de différentes mailles (5 mm,10mm
et 20mm noeud à noeud) sur lequel deux ouvertures opposées
diamétralement sont pratiquées de manière à ne
permettre que l'entrée des poissons. La nasse, appâtée avec
de la patte du son, est déposée avec un support dans la
végétation généralement au niveau des berges.

32
Figure 11 : Nasses de différentes mailles
3.1.3.1 Sélectivité des engins
liée à la diversité spécifique des captures
La sélectivité spécifique des engins de
pêche utilisés sur les pêcheries de Say, varie d'un
engin à l'autre (Tableau 7). L'engin ayant
capturé plusieurs espèces de poisson est le filet maillant (41
espèces) suivi de la nasse (31 espèces) et enfin la palangre
(20espèces). Les indices de diversité de Shannon sont compris
entre 2,6 et 3,9 ce qui signifie une diversité moyenne pour tous les
trois engins avec respectivement 3,84 pour le filet maillant, 3,65 pour la
palangre et 3,26 pour la nasse.
Tableau 7 : Richesse spécifique des engins de pêche
et leur indice de diversité de Shannon-
|
Wiener
|
|
|
|
|
Espèces
|
Filet maillant
|
Nasse
|
Palangre
|
|
Alestes dentex
|
18
|
0
|
0
|
|
Alestes macrophthalmus
|
6
|
0
|
0
|
|
Auchenoglanus biscutatus
|
0
|
6
|
0
|
|
Auchenoglanus occidentalis
|
15
|
9
|
12
|
|
Bagrus bajad
|
13
|
4
|
33
|
|
Bagrus docmak
|
0
|
0
|
6
|
|
Labeo barbus
|
0
|
0
|
1
|
|
Brycinus leuciscus
|
247
|
0
|
0
|
|
Brycinus nurse
|
23
|
28
|
1
|
|
Campylomormyrus tamandua
|
12
|
2
|
0
|
|
Chrysichthys auratus
|
9
|
47
|
16
|
|
Chrysichthys nigrodigitatus
|
8
|
17
|
7
|
|
Citharinus citharus
|
2
|
2
|
0
|
|
Clarias anguillaris
|
49
|
30
|
18
|
33
|
Espèces
|
Filet maillant
|
Nasse
|
Palangre
|
|
Clarotes laticeps
|
2
|
0
|
3
|
|
Distichodus brevipinnis
|
0
|
4
|
0
|
|
Distichodus rostratus
|
31
|
13
|
0
|
|
Hemichromis bimaculatus
|
1
|
0
|
0
|
|
Heterobranchus bidorsalis
|
2
|
1
|
3
|
|
Hydrocynus forskahlii
|
3
|
0
|
0
|
|
Hyperopisus bebe
|
21
|
1
|
0
|
|
Hypopotamyrus pictus
|
2
|
0
|
0
|
|
Labeo coubie
|
33
|
8
|
0
|
|
Labeo senegalensis
|
115
|
304
|
0
|
|
Lates niloticus
|
2
|
12
|
1
|
|
Malapterurus electricus
|
0
|
3
|
1
|
|
Marcusenius abadii
|
17
|
2
|
0
|
|
Marcusenius cyprinoides
|
36
|
0
|
0
|
|
Mormyrops oudoti
|
3
|
11
|
15
|
|
Mormyrus rume
|
25
|
20
|
0
|
|
Mormyrus macrophthalmus
|
7
|
0
|
0
|
|
Oreochromis niloticus
|
39
|
36
|
0
|
|
Petrocephalus bovei
|
4
|
0
|
0
|
|
Pollimyrus isidori
|
321
|
11
|
0
|
|
Pollimyrus petricolus
|
3
|
0
|
0
|
|
polypterus senegalus
|
1
|
0
|
0
|
|
Protopterus annectans
|
3
|
7
|
0
|
|
Sarotherodon gallileus
|
4
|
1
|
0
|
|
Schilbe mystus
|
118
|
2
|
23
|
|
Synodontis courteti
|
4
|
9
|
0
|
|
Synodontis schall
|
46
|
24
|
30
|
|
Synodontis batensoda
|
22
|
17
|
9
|
|
Synodontis gobroni
|
1
|
0
|
9
|
|
Synodontis occellifer
|
1
|
2
|
4
|
|
Synodontis sorex
|
5
|
0
|
2
|
|
Synodontis violaceus
|
0
|
1
|
0
|
|
Tetraodon lineatus
|
0
|
0
|
1
|
|
Coptodon zillii
|
33
|
16
|
0
|
|
Nombre d'individus
|
1307
|
650
|
195
|
|
Richesse spécifique (S)
|
41
|
31
|
20
|
|
Indice de diversité de Shannon (H')
|
3,84
|
3,26
|
3,65
|
3.1.3.2 Sélectivité des engins
liée à l'abondance numérique
La figure 13 présente la sélectivité des
engins liée à l'abondance numérique des captures.
L'analyse de cette figure montre que c'est le filet maillant qui
est l'engin le plus sélectif avec 60,73% des captures suivie de la nasse
avec 30,20% et la palangre avec seulement 9,06%.
Filet Nasse Palangre
maillant
Engins de pêche
70
60
50
40
30
20
10
0
Abndance numerique(%)
34
Figure 12 : Sélectivité des engins liée
à l'abondance numérique toutes espèces
confondues:
3.1.3.3 Sélectivité des engins
liée à l'abondance pondérale
La figure 14 présente la sélectivité des
engins liée à l'abondance pondérale des captures.
L'analyse de cette figure montre que c'est la nasse qui est
l'engin le plus sélectif avec 49,60%de la biomasse des capture suivie du
filet maillant (27,41%) et la nasse avec 22,97%).
60
50
40
30
20
Abondance(%)
10
0
Nasse Palangre Engins de pêche
Filet
maillant
Figure 13 : Sélectivité des engins liée
à l'abondance pondérale toutes espèces confondues
3.1.3.4 Capture Par Unité d'Effort (CPUE) de
chaque engin
Les captures par unité d'effort des engins sont
représentées à la figure 15. L'analyse de cette
figure montre que le filet maillant a enregistré la CPUE
la plus élevée (0,65 kg/h/engins) suivi de la nasse (0,57
kg/h/engins) et enfin la palangre (0,33 kg/h/engins).
0.7
CPUE (kg/h/engins)
0.6
0.5
0.4
0.3
0.2
0.1
0
Nasse Palangre Filet maillant
Engins de pêche
35
Figure 14 : Capture de pêche par unité d'effort par
engin
3.1.4. Structure des captures
3.1.4.1 Structure générale des
fréquences de distribution de la longueur totale
La représentation graphique des fréquences de
distribution de la longueur totale de tous les
poissons et de tous les engins confondus a été
réalisée et présentée sur la figure 16 .l'analyse
de cette figure montre que la distribution est unimodale avec un intervalle de
classe modale compris entre 5 et 9. La taille moyenne des poissons
échantillonnés lors de cette étude est de 16,74 #177; 9,19
cm et près de 60,21% des poissons capturés ont une taille
inférieure à cette moyenne. Ce qui traduit globalement que la
capture est dominée par des individus de petite taille.
N=2152
|
25 20 15 10
5
0
|
|
|
0 10 20 30 40 50 60 70 80
Lt(cm)
|
Figure 15 : Structure générale par taille
des captures toutes stations confondues
3.1.4.2 Distribution des fréquences de longueurs
totales des poissons en fonction des
engins
La figure 17 présente la structure par taille des
individus capturés toutes stations et tout mois
confondus selon le type d'engin utilisé. Seuls les
individus capturés par la palangre ont une distribution bimodale. Le
filet maillant a capturé des poissons de tailles variant de 7cm à
47,5cm avec une moyenne de 13,35 #177;7,33cm et 68,69% ont une taille
inférieure à cette moyenne. Les nasses et les palangres ont
capturé les individus d'une gamme de taille (de 7 à 71 cm pour
les nasses et 10,2 à 80 cm pour les palangres) avec des moyennes
respectives de 20,85 #177; 8,08 et 25,80 #177; 11,87cm.
Nasse
Filet maillant

N=650
N=1307
25
20
15
10
5
0
30
0 10 20 30 40 50 60
Lt(cm)
%)
%
0 10 20 30 40 50 60 70 80
Lt(cm)
36
Figure 16 : Structure par taille des individus capturés
selon le type d'engin utilisé
37
3.1.5. Eléments de Biologie des espèces
3.1.5.1. Variables morphométriques des
captures
Au total, 2152 spécimens de poissons appartenant à
48 espèces ont été mesurés. Le nombre de
spécimens par espèce, les valeurs minimales,
moyennes et maximales de la longueur totale, de la longueur standard et du
poids corporel total sont présentés dans le tableau 8. Le nombre
de spécimens par espèce a varié de 1 à 419. Le plus
grand nombre de spécimens est observé chez Labeo
senegalensis. La longueur totale est comprise entre 5 cm (Coptodon
zilii) et 80 cm (Lates niloticus) et la longueur standard est
comprise entre 3,9 cm (Coptodon zillii) et 70 cm (Lates
niloticus). Le poids a varié de 3 g (Brycinus leuciscus,
Pollimyrus isidori, Hemichromis bimaculatus, schilbe mystus, Coptodon zillii,
Oreochromis niloticus, Marcusenius abadii, Labeo senegalensis) à
8920g (Heterobranchus bidorsalis).
Tableau 8 : Paramètres morphometriques des espèces
totalisant plus de 10 individus.
|
Espèces
|
N
|
Ltmax
|
Ltmoy
|
Ltmin
|
Ls max
|
Lsmoy
|
Lsmin
|
Ptmax
|
Ptmoy
|
Ptmin
|
|
Alestes dentex
|
18
|
30,5
|
21,89
|
12
|
23,5
|
17,15
|
9
|
123
|
65,5
|
8
|
|
Auchenoglanus occidentalis
|
36
|
39,2
|
29,16
|
22
|
32
|
23,99
|
18
|
413
|
246,91
|
27
|
|
Bagrus bajad
|
50
|
71
|
34,44
|
11,4
|
58,5
|
27,54
|
9,3
|
8600
|
479,38
|
7
|
|
Brycinus leuciscus
|
247
|
14,9
|
8,54
|
6,4
|
12,1
|
6,97
|
5,3
|
26
|
5,23
|
3
|
|
Brycinus nurse
|
52
|
22,2
|
13,57
|
8
|
18
|
11,12
|
6,8
|
80
|
24,01
|
4
|
|
Campylomormyrus tamandua
|
14
|
27,5
|
20,35
|
16,3
|
24,3
|
18,01
|
13,4
|
92
|
51,28
|
25
|
|
Chrysichthys auratus
|
72
|
23
|
15,29
|
9,7
|
16,4
|
12,24
|
7,8
|
71
|
32,77
|
9
|
|
Chrysichthys nigrodigitatus
|
32
|
38,5
|
27,11
|
10,2
|
29,5
|
20,06
|
8
|
476
|
157,4
|
6
|
|
Clarias anguillaris
|
97
|
42
|
28,67
|
8,5
|
38,5
|
25,18
|
7,9
|
450
|
164,02
|
5
|
|
Distichodus rostratus
|
44
|
37
|
21,35
|
9
|
30,5
|
17,31
|
7,4
|
472
|
124,68
|
11
|
|
Hyperopisus bebe
|
22
|
32
|
27,16
|
19
|
29
|
24,58
|
17,8
|
163
|
113
|
21
|
|
Labeo coubie
|
41
|
66,4
|
16,28
|
8,3
|
53,7
|
12,92
|
7
|
3000
|
137,97
|
5
|
|
Labeo senegalensis
|
419
|
38,5
|
18,77
|
6,7
|
31
|
14,9
|
5
|
436
|
78,99
|
3
|
|
Lates niloticus
|
15
|
80
|
37,01
|
22
|
70
|
31,04
|
18,5
|
3820
|
736,53
|
157
|
|
Marcusenius abadii
|
19
|
20,2
|
15,64
|
6,8
|
17,6
|
13,73
|
5,7
|
58
|
28,84
|
3
|
|
Marcusenius cyprinoides
|
36
|
22,5
|
17,65
|
12,5
|
19,5
|
15,64
|
11,5
|
81
|
40,02
|
25
|
|
Mormyrops oudoti
|
29
|
47,5
|
27,07
|
13,5
|
45,3
|
24,85
|
10
|
346
|
99,72
|
14
|
|
Mormyrus rume
|
45
|
30,5
|
24,67
|
11
|
27,3
|
22,04
|
10,4
|
150
|
86,13
|
12
|
|
Oreochromis niloticus
|
75
|
24,5
|
14,04
|
6,5
|
18
|
11,26
|
5,3
|
149
|
48,78
|
3
|
|
Pollimyrus isidori
|
332
|
13,5
|
8,23
|
6,5
|
12,4
|
7,06
|
5
|
18
|
4,09
|
3
|
|
Protopterus annectans
|
10
|
44
|
36,1
|
30
|
40
|
32,55
|
28
|
340
|
191,6
|
93
|
|
Schilbe mystus
|
143
|
24,5
|
12,34
|
8,9
|
21,5
|
10,29
|
7,1
|
132
|
14,14
|
3
|
|
Synodontis courteti
|
13
|
14,5
|
11,36
|
7
|
11,5
|
8,88
|
6
|
33
|
18,53
|
6
|
|
Synodontis schall
|
100
|
24,5
|
16,77
|
8,4
|
18,5
|
12,54
|
7,4
|
134
|
40,98
|
5
|
|
Synodontis batensoda
|
48
|
36,5
|
22,55
|
9
|
26,5
|
16,44
|
7,9
|
455
|
117,37
|
5
|
|
Synodontis gobroni
|
10
|
38
|
23,07
|
14,5
|
28
|
17,81
|
11,6
|
490
|
158,7
|
29
|
|
Coptodon zillii
|
49
|
20,3
|
11,28
|
5
|
16,8
|
8,98
|
3,9
|
151
|
31,16
|
3
|
3.1.5.2 Relation poids-longueur et structure par taille
de l'espèce dominante
La relation poids-longueur et la structure par taille de
Labeo senegalensis sont représentées à
la figure 18. Les équations de régression entre la
longueur totale et le poids total ainsi que le coefficient de
détermination (R2) sont présentés sur cette
même figure.
Labeo senegalensis
Pt= 0.0058Lt3.105 R2 = 0.9736 N=419

0 20 40 60
Lt(cm)
|
Pt(g)
|
600 500 400 300 200 100
0
|
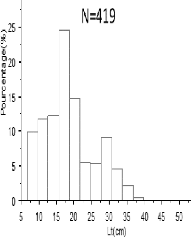
38
Figure 17 : Relation poids-longueur et structure de taille du
Labeo senegalensis
La relation poids-longueur du Labeo senegalensis a
été très significative (p < 0,001). Cette relation est
utilisée notamment pour l'étude de la croissance où l'on
infère des résultats de croissance en poids à partir de la
croissance en longueur. Elle permet également d'apprécier le type
de croissance présenté par une population ou une partie de la
population de poisson. Le tableau 9 présente les paramètres de
cette relation.
Tableau 9 : Paramètres de la relation poids-longueur et du
facteur de condition de Labeo
senegalensis
|
Espèces
|
N
|
a
|
b
|
R2
|
K
|
IC (95%)
|
Type de
croissance
|
|
Labeo senegalensis
|
419
|
0,005
|
3,105
|
0,973
|
0,58#177;0,13
|
[3,056 ; 3,154]
|
Allometrie+
|
L'analyse de ce tableau montre que la valeur de b est comprise
dans l'intervalle de confiance et b>3 ce qui traduit une allométrie
positive (A+)
39
La structure par taille du Labeo senegalensis montre une
distribution bimodale. La longueur totale moyenne est de 18,77 cm, plus de
58,22% ont une taille inférieure à cette moyenne. Ce qui que les
captures sont dominées par des individus de petites. La longueur totale
a varié de 6,7 à 38,5 cm.
3.2 Discussion
3.2.1 Paramètres physico-chimiques du fleuve dans le
secteur de Say
Les températures de l'eau ont varié de 26,8
°C à 30,7 °C avec une moyenne de 28,25 #177; 1,39°C qui
est légèrement supérieure à la température
moyenne annuelle de l'eau du fleuve Niger (26°C) observée par
Coenen, 1987. Cette moyenne est comprise entre 23 et 31 °C, gamme de
températures tolérée par la plupart des espèces
tropicales (Lalèyé et al., 2005). Nos résultats
sont légèrement inférieurs à ceux obtenu par
Hassane (2017) qui a rapporté une moyenne de 28,48 #177; 0,5 °C
à Niamey, et Amadou (2018) avec une moyenne de 30,81 #177; 0,98 °C
à Namaro sur le fleuve Niger. Les variations de la température de
l'eau suivent celle de la température de l'air (Etienne et al.,
1994; Ahouansou Montcho, 2003; Lederoun, 2006; Abdou 2015; Ali Abdou,
2016,).
Les valeurs de pH ont varié de 6,5 à 8,3 avec
une moyenne générale de 7,57 #177; 0,64 au cours de notre
étude. Ce résultat est nettement supérieur à ceux
obtenu par Hassane (2017) qui a rapporté une moyenne de 7,45 #177; 0,1
à Niamey et par Ado (2018) qui a obtenu un PH moyen de 7,21 #177; 0,26
à Boubon sur le fleuve Niger. Les valeurs obtenues au cours de notre
étude sont comprises entre 6,5 et 8,5, fourchette qui caractérise
des eaux où la vie se développe de manière optimale (IBGE
2005).
Les valeurs de l'oxygène dissous ont varié de
4,68 à 5,64 mg/L avec une moyenne générale de 5,15 #177;
0,28 mg/L. La moyenne de la concentration en oxygène au cours de cette
étude est au-dessus de 5 mg/L, teneure requise pour la survie des
êtres vivants aquatiques (Odokuma et Okpokwasili, 1993). Alhou (2007) a
rapporté une moyenne de 7,2 mg/L et un taux de saturation maximum de
99,6% pendant l'étiage du fleuve. Ce même auteur rapporte que le
taux d'oxygène dissous ainsi que le taux de saturation en oxygène
baisse en saison de pluie (une moyenne de 5,4 mg/L obtenue à Niamey
entre juillet et août). Ado(2018) a rapporté une moyenne de 6,92
#177; 1,63 mg/L à Boubon et Amadou (2018) une moyenne de 5,72 #177; 0,47
mg/L à Namaro sur le même fleuve pendant la même
période.
Le Taux des Solides Dissous est trop faible sur le fleuve
Niger, ce qui entraîne une conductivité trop faible la moyenne est
de 35,44 ìS/cm ce qui est conforme aux résultats
40
observés par Coenen, 1987. En effet, cet auteur a
obtenu une conductivité de 30 à 40 ìS/cm, pendant les
hautes eaux, indiquant que les eaux du fleuve Niger sont très pauvres au
point de vue chimique ce qui est probablement dû à la faible
solubilité des granites et schistes précambriens dans le Niger
supérieur. Ado (2018) a obtenu une moyenne de TDS de 0,23 #177; 0,09 ppm
et une conductivité de 40 ìS/cm.
La transparence a été très faible au
cours de notre étude. Les valeurs ont variés entre 2 et 5cm avec
une moyenne générale de 2,88#177;0,19cm. Cette moyenne est
inférieure à celle d'Amadou (2018) qui obtenue 5,67cm. Selon
Daget (1957) la transparence de l'eau du fleuve Niger dans le delta central du
Niger ne dépasse pas 1 m en étiage et 0,5 m en période de
crue. Les faibles valeurs observées au cours de cette étude sont
probablement due au phénomène de ruissellement des affluents qui
charrient des matières en suspension et les jette dans ce fleuve. Les
fortes concentrations des matières en suspension jouent sur la
transparence de l'eau en saison de pluie qui devient faible (Akpan, 2004).
L'augmentation progressive de la profondeur du fleuve de
juillet à Septembre est liée à l'abondance de pluies
pendant cette période.
De façon générale, les paramètres
physico-chimiques des eaux du fleuve Niger enregistrés dans les
pêcheries de Say sont favorables à la survie de l'ichtyofaune.
3.2.2 Inventaire de l'ichtyofaune
La faune ichtyologique des pêcheries de Say sur le
fleuve Niger est constituée de 48 espèces sur les 139
annoncé par Fishbase pour le Niger. Elles sont regroupées en 31
genres et 16 familles. Ce résultat est nettement supérieur
à ceux d'Ado (2018) qui a eu 40 espèces 30 genres et 14 familles
pour une même période de trois mois sur le fleuve Niger à
Boubon. Cette différence pourrait être expliqué par la
proximité de nos stations du parc national du W possédant des
affluents (ou la pêche est interdite) en connexion avec le fleuve. Par
contre notre résultat ne reflète qu'un peu plus de la
moitié de celui trouvé par Coenen (1987) sur le fleuve Niger. En
effet les travaux menés par cet auteur sur le fleuve Niger en 21 mois a
révélé un nombre total de 83 espèces reparties en
20 familles. Cet écart observé, pourrait s'expliquer par la
durée de l'étude. En effet, dans notre cas, l'étude a eu
lieu de juillet à septembre soit 3 mois, ce qui est susceptible de
biaiser le nombre réel d'espèce et/ou leur abondance. Le biais
dans la collecte de données peut être lié à la
richesse spécifique ou à l'abondance des espèces. En
effet, Ahouansou Montcho (2011), estime qu'il n'est pas rare de constater des
biais dans l'appréciation de la diversité spécifique d'une
communauté animale.
41
Dans cette étude, du fait de la présence de
singletons (espèce unique) dans les échantillons des campagnes
(juillet à septembre) cumulés, l'inventaire demeure incomplet.
Aussi longtemps que les singletons (au nombre de 5 dans notre cas) et doublons
(au nombre de 1) persistent dans les échantillons, les
possibilités d'obtention de la richesse spécifique plus
élevée existent. Le nombre total d'espèces d'un milieu est
atteint dès que les singletons n'apparaissent plus dans les captures
malgré la poursuite des campagnes d'échantillonnage (Walther et
Morand 1998, Novotny et Basset 2000, Mao et Colwell 2005). Selon Walther et
Moore (2005), pour déterminer la richesse spécifique dans une
communauté biologique à partir des bases des données
réelles, l'échantillonnage doit être exhaustif quelles que
soient les difficultés de le réaliser. La richesse
spécifique estimée serait égale alors au nombre
d'espèce réellement inventorier. Dans cette étude,
l'estimation a prédit une richesse spécifique de 51
espèces contre 48 réellement récoltées.
La richesse spécifique du fleuve Niger dans le secteur
d'étude est dominée par la famille des mormyridae composée
de 11 espèces et 8 genres. Ce résultat est supérieur
à ceux obtenus par Ado (2018) qui a rapporté 7 espèces et
7 genres à Boubon sur le Niger mais proche des résultats d'Amadou
(2018) qui a eu 14 espèces et 9 genres à Namaro sur le fleuve
Niger. Le PGIPAP (2012) rapporte que la famille de Mormyridae est la plus
représentée de toutes les familles de poisson du Niger avec 9
espèces. Plusieurs auteurs ont rapportés que la famille de
Mormyridae est la plus représentée dans leur milieu
d'étude dont Lalèyé et al. (2004) avec 12
espèces sur le fleuve Ouémé, Chikou (2006) avec 10
espèces sur le fleuve Ouémé, Sirima et al. (2009)
qui a eu 7 espèces sur le bassin de la Coemé au Burkina Faso,
Ahouanssou Montcho (2011) avec 21 espèces sur la rivière
Pendjari, Sanogo et al. (2012) avec 13 espèces sur la
rivière Baoulé dans le bassin du fleuve Niger au Mali et Bamogo
(2016) avec 7 espèces sur le Barrage de Ziga au Burkina Faso.
3.2.2.1 Variations spatio-temporelle de la richesse
spécifique
L'étude réalisée de juillet à
septembre 2019 sur les pêcheries de Say a révélé 41
espèces à Tounga Mini, 35 espèces
à Bolongué et Koba. Les indices de similarité de Jaccard
montrent que les trois sont similaires mais la similarité est plus forte
entre les stations de Tounga Mini et Koba. Cela serait probablement dû
à la proximité de ces deux stations et aux conditions
environnementales apparaissant plus stables ce qui favorise la cohabitation de
nombreuses espèces (Wootton 1992).
La variation temporelle de la richesse spécifique
révèle qu'en juillet et Août il y a une diversité
(2,6 = H' = 3,9) moyenne et une dominance (0,7 = Eq = 0,8) moyenne de la
42
richesse spécifique. En septembre, on observe une
diversité élevée et une dominance moyenne. Cela
s'expliquerait par le cycle hydrologique du fleuve et surtout du calendrier de
la pêche. En effet, le mois de juillet et août correspondent
à la période de début des crues les poissons commence leur
déplacement longitudinale. Le mois de septembre correspond à la
fin de la crue avec l'arrivée d'autres espèces de poissons
d'où la diversité élevée observée. Il est
à noter que 14 espèces au mois de juillet, 15 espèces au
mois d'août et 22 espèces au mois de septembre ont
contribué très fortement à la diversité
spécifique mensuelle durant cette étude. Alors que 22
espèces à Tounga Mini, 10 espèces à Bolongué
et 17 espèces à Koba ont contribué très fortement
à la diversité spécifique de ces stations.
3.2.2.2 Abondance spatio-temporelle numérique et
pondérale des captures :
La répartition spatiale de la biomasse montre que c'est
Labeo senegalensis qui domine au niveau des stations de Tounga mini et
Bolongué, alors que Bagrus bajad domine à Koba .La
répartition mensuelle de la biomasse montre que c'est Labeo
senegalensis qui domine. En Juillet et Août, en Septembre c'est
Bagrus bajad qui domine. D'après Chikou (2006) les abondances
numérique et pondérale varient en fonction des mois, des habitats
et des techniques de pêche.
3.2.3 Typologie des engins de pêche et leurs
sélectivités
Il ressort de cette étude que le filets maillant, la
nasse et la palangre sont des engins de pêche qui capturent toutes les
classes de tailles avec une proportion élevée (?50%) des
individus de petite taille (5 à 16,74 cm). Ceci est dû aux petites
mailles des filets utilisés. Selon Chikou (2006), les techniques et
engins de pêche très peu sélectifs des tailles engendrent
de grands déséquilibres dans la structure de taille de plusieurs
espèces de poissons, surtout celles qui sont exploitées par la
pêche. Le Filet maillant a été l'engin le plus
sélectif, avec plus de 68.69% des individus capturés ont une
taille inférieure à la taille moyenne.
Lêvèque et Paugy (2006) ont rapporté que
parmi les engins fixes, les plus fréquemment utilisés par les
scientifiques ainsi que par les pêcheurs sont les filets maillants car
ils ont l'avantage d'être faciles d'emploi. Ces engins sont aussi
annoncés dans les résultats de l'enquête cadre 2012 (ME/DD,
2012) avec une dominance du filet maillant (35%) suivi de la palangre (28%).
D'autres types d'engins non rencontrés au cours de cette étude
ont été rapportés par les résultats de cette
même enquête mais utilisés en de très faibles
proportions: il s'agit de la senne, du filet conique et la ligne et de
l'épervier. Ahouanssou Montcho (2011) a observé sur la
rivière Pendjari que sur les six engins utilisés, les filets
maillants prédominent (54,1%) suivis des lignes (21,9%). Ce même
auteur rapporte que les dimensions des mailles
43
des filets ont varié de 2,5 à 17 cm et la gamme
de maille située entre 5 et 11 cm a été couramment
utilisée sur le même cours d'eau. Richard et al. (2007)
ont utilisé les mêmes types d'engins (à l'exception de
l'épervier) pour leur capture dans la réserve de Yoko au Congo.
Aussi les mailles des filets utilisés par ces auteurs ont varié
de 1,5 à 3 cm.
Au Niger, les filets maillants dont les mailles noeud à
noeud sont inférieures à 60 mm sont interdits par la loi
N°98-042 du 07 décembre 1998 portant régime de pêche
au Niger à son article 16, titre3.
La Capture Par Unité d'Effort (CPUE) a
été trop faible chez tous les engins. Néanmoins, elle a
permis de classer les engins du point de vue rendement. Ainsi, le filet
maillant a été l'engin le plus efficace suivi respectivement de:
la nasse et la palangre. Ces résultats obtenus sont différent
dans un ordre d'engins (filet maillant, palangre, nasse et épervier)
obtenus par Montchowui et al, 2008 dans la basse vallée du
fleuve Ouémé au Bénin et d'Ado, 2018 sur le fleuve
Niger.
3.2.3.1 Structure morphométriques des
spécimens
La longueur totale est comprise entre 5 cm et 80 cm. Le poids
a varié de 3 g à 8920 g. Ces résultats sont proches de
ceux obtenus par Ado (2018) qui a eu 6,5cm et 74,66cm respectivement pour la
longueur totale minimale et maximale, avec 2g et 3156g pour le poids minimale
et maximale. En terme des valeurs minimales de la longueur totale et du poids
total nos résultats sont également rapproche de ceux obtenus par
Coenen, 1987 (6cm et 3g) mais diffèrent de loin en terme des valeurs
maximales (166 cm et 50.000g). Cette situation peut être imputée
à la lumière des travaux de Ahouansou Montcho (2011) par la
durée de l'échantillonnage qui est de 3 mois.
En effet, cet auteur rapporte que « l'augmentation de
l'effort de pêche par la multiplication du nombre de campagnes
d'échantillonnage dans le temps et/ou dans l'espace accroît la
probabilité de capture des espèces. Ceci démontre
également l'importance de réaliser un inventaire sur une
période relativement longue afin d'obtenir une image plus
réaliste des peuplements de poissons présents dans un milieu
donné ».
3.2.3.2 Relations poids-longueurs
La relation poids-longueurs de l'espèce
étudiée (L. senegalensis) montre que la relation
morphométriques est très significatives (p < 0,001) et la
valeur du coefficient de corrélation est positive. Le poisson
croît aussi bien en longueur qu'en poids. La valeur de b > 3
: Ce qui montre que c'est espèce à croissance allométrique
positive. Le facteur de condition k du
44
Labeo senegalensis (k = 0,58 #177; 0,13) montre que
les conditions sont défavorables pour cette espèce.
Le facteur de condition est un indicateur non seulement de
l'évolution de l'état de l'embonpoint du poisson mais aussi un
bon instrument pour comparer l'état physiologique global de populations
entre bassins présentant des conditions écologiques
différentes (Lévêque, 2006). Cette condition
écologique défavorable chez Labeo senegalensis, serait
due à l'utilisation excessive de certains engins et techniques de
pêche qui y créent un stress permanent. Zerbo (2004), a
rapporté que les eaux de ruissèlement peuvent affecter les
paramètres physico-chimiques du plan d'eau, ce qui peut avoir des
impacts sur les conditions physiologiques du poisson.
45
CONCLUSION ET PERSPECTIVES
La gestion des ressources naturelles notamment halieutiques,
exige un suivi périodique de plusieurs paramètres permettant de
garantir la durabilité de l'activité de pêche et la
sauvegarde de la diversité biologique.
La présente étude qui s'est
déroulée en trois mois de juillet à septembre sur le
secteur de Say a permis de faire un état des lieux de la
biodiversité ichtyologique du fleuve Niger au Niger. D'une
manière générale les paramètres physico-chimiques
du fleuve Niger à Say sont favorables au développement de
l'ichtyofaune. L'inventaire des poissons fait ressortir une liste de
quarante-huit (48) espèces réparties dans 31 genres et 16
familles. La typologie des engins de pêche permet de regrouper ces
derniers en trois catégories : les filets maillants, les nasses et les
palangres.
L'étude a aussi révélé qu'une
bonne proportion des filets maillants utilisés est interdite par la loi
régissant le régime de pêche au Niger; ce qui n'est pas
favorable à une gestion durable de la ressource qui est
déjà fragilisée par des phénomènes
d'ensablement du fleuve et des changements climatiques. Cette étude
contribuera à une meilleure connaissance des poissons du fleuve Niger
car depuis les travaux de Coenen (1987), aucune étude n'a
prospecté de manière approfondie l'ichtyofaune du Fleuve Niger au
Niger. Cette étude reste cependant limitée car ne concernant
qu'une petite portion du fleuve et pendant un temps très court. Il est
donc nécessaire d'entreprendre des études approfondies de cette
faune ichtyologique en vue d'assoir des bases de données pour sa gestion
durable. Il convient alors de faire recours à l'application stricte de
l'article 16 de la loi N° 98-042 portant régime de la pêche
au Niger afin de sauvegarder les ressources halieutiques du fleuve Niger.
Au-delà, la mise en application des articles 2, 12 et 33 de la charte de
l'eau du bassin du Niger par tous les pays membres de l'ABN.
Au vu de tout ce qui précède, les suggestions
suivantes ont été formulées pour une gestion durable et
concertée des pêcheries de Say:
? Poursuivre cette étude sur une période d'au
moins un an et sur un long secteur afin d'asseoir une base des données
fiables de la richesse ichtyologique du fleuve Niger;
? Elaborer un plan d'aménagement et de gestion
rationnelle et sa mise en application par le renforcement des capacités,
la dotation en pirogue et engins des pêcheurs.
? Réviser la loi N°98-042 du 17 Décembre
1998 portant régime de pêche au Niger et son accompagnement d'un
décret d'application afin de revoir à la baisse l'interdiction
46
de maillage inférieure à 60 mm pour 25 mm car
plus de 50% des engins rencontrés ne respectent pas cette
réglementation.
? Sensibiliser les pêcheurs sur les risques de
disparution des espèces qu'ils courent en utilisant certains engins et
techniques de pêche destructifs (filets à mailles inferieures
à 20 mm).
47
Références bibliographiques
Ado I.M, 2018.Influence de la pêche sur la
structure des stocks de poisson dans les pêcheries de Boubon au (Niger)
mémoire de master, Faculté des Sciences
Agronomiques/Université d'Abomey Calavi (Bénin) ,99P
Ahouansou, M.S., 2011. Diversité et
Exploitation des poissons de la rivière Pendjari (Bénin, Afrique
de l'Ouest). Thèse du grade de docteur. Faculté des Sciences
Agronomiques / Université d'Abomey-Calavi. Bénin. 234P.
Akpan A. W., 2004. The water quality of some
tropical freshwater bodies in Uyo (Nigeria) receiving municipal effluents,
slaughter-house washings and agricultural land drainage. The
Environmentalist, 24 :49-55.
Alhou B., 2007. Impact des rejets de la ville
de Niamey (Niger) sur la qualité des eaux du fleuve Niger, thèse
de doctorat unique, Facultés Universitaires Notre Dame de la Paix Namur
(Belgique), 229 p.
Ali Abdou. O, 2016. Caractéristiques
hydrobiologiques et gestion de la mare de Rouafi dans le département de
Konni (Niger), mémoire de master, Faculté des Sciences
Agronomiques/Université d'Abomey Calavi (Bénin), 61p.
Amadou .O, 2018. Diversité et
exploitation des populations de Mormyridae dans le secteur du fleuve Niger sous
influence du Programme de Lutte Contre l'Ensablement (PLCE), mémoire de
master, Faculté des Sciences Agronomiques/Université d'Abomey
Calavi (Bénin),73P
Bamogo L.L., 2016. Diversité des
poissons et gestion des pêcheries du lac de barrage de ziga (burkina
faso), mémoire de master, Faculté des Sciences
Agronomiques/Université d'Abomy Calavi (Bénin), 60p.
Cakpo Kiossa C., 2012. Biodiversité et
exploitation de quelques espèces de poissons de la rivière
sô au Benin, mémoire de master, Université polytechnique de
Bobo Dioulasso, (Burkina Faso), 113p.
Chikou, A., 2006. Etude de la
démographie et de l'exploitation halieutique de six espèces de
poisson-chats (Teleostei, Siluriformes) dans le delta de l'Ouémé
au Bénin. Thèse de doctorat. Université de Liège
(Belgique), 459P.
48
Coenen, E. 1987- République du Niger :
Résultats des études ichtyo-biologique sur le Niger, rapport
préparé pour le projet de développement des pêches.
FAO, Rome, FI : DP/NER/79/018.
Daget, J. 1962- Rapport au gouvernement du
Niger sur la situation et l'évolution de la pêche au Niger. FAO,
Rome, PEAT Rapport No 1525
DESSOUASSI. R., 2002. Le climat en 2002 :
conséquences du climat 2002 sur l'hydrologie (cas du bassin du Niger).
Autorité du Bassin du Niger : CIP-HYDRONIGERCRP/ AOC-HYCOS, 7 P.
Hamani, H., 2015. Etude de l'exploitation de
la faune ichtyologique de la rivière Sô au Bénin (Afrique
de l'Ouest). Mémoire de master, Faculté des Sciences
Agronomiques/Université d'Abomey-Calavi (Bénin) 189p.
Hassane Younoussi. H., 2017. Performances
immunitaires du poisson-chat Clarias gariepinus (Burchell, 1822)
exposé aux métaux lourds issus des rejets industriels et
hospitaliers dans le Fleuve Niger à Niamey, mémoire de master,
Faculté des Sciences Agronomiques/Université d'Abomey Calavi
(Bénin), 76p + annexes.
IBGE 2005 : Institut Bruxellois pour la Gestion de
l'Environnement, 2005. Qualité physiologique et chimique des
eaux de surface : cadre général 16P.
Institut Nationale de la Statistique 2016. Le
Niger en chiffres.
Kiossa, C. C., 2011. Diversité et
exploitation de quelques espèces de poisson de la rivière
sô au Bénin. Mémoire de master Université
Polytechnique de Bobo Dioulasso, Institut du Développement
Rural.113p.
Lalèyè P., 1995. Ecologie
comparée de deux espèces de Chrysichthys, poissons
siluriformes claroteidae) du complexe lac Nokoué-lagune de Porto/Novo au
Bénin. Université de liège Faculté des Sciences
Agronomiques. Thèse de Doctorat Université de Liège
(Belgique). 199p.
Lalèyè P., Chikou A., Philippart J.-C.,
Teugels G. & Vandewalle P., 2004. Étude de la
diversité ichtyologique du bassin du fleuve Ouémé au
Bénin (Afrique de l'Ouest), Cybium, 28(4): 329-339.
Lederoun, D., 2006. Etude et exploitation des
ressources halieutiques de la lagune de Porto Novo, au Benin. Mémoire de
fin de cycle pour l'obtention du diplôme d'ingénieur des travaux
(DIT).69p+ annexes
49
Ministère de l'Hydraulique et de
l'Environnement, MHE, 2012. Répertoire de la faune aquatique de
la zone d'intervention du projet de gestion intégrée des plantes
aquatiques profilerantes, ( PGIPAP).36p.
OCAR, 2003. Rapport d'évaluation du
programme de lutte contre l'ensablement dans le bassin du fleuve Niger.
Autorités du Bassin du Niger (ABN), 68 p.
Odukuma L.O et Okpokwasili G.C, 1993.
Seasonal influences on inorganic anion monitoring of the New Calabar river,
Nigeria. Environmental Management : 491-496.
Paugy D, Lévêque C, Teugels GG.
2003. Poissons d'Eaux Douces et Saumâtres de l'Afrique de
l'Ouest (Tome I et II). IRD, MNHN et MRAC: Paris
Paugy D., Lévêque C., 2006. Les
poissons des eaux continentales africaines : Diversité, écologie
et utilisation par l'homme, 573p.
Plan du Développement Communal Say
(PDC 2017-2021),
Programme de Gestion Intégrées des
Plantes Aquatiques Proliferantes., 2012. Répertoire de la faune
aquatique de la zone d'intervention du projet 36p.
Programme de Lutte Contre l'Ensablement du Bassin du
Niger, 2006. Etude pour la mise en place d'un réseau de
recherche et développement à l'échelle du Bassin du Niger
; rapport final provisoire, 109p.
Sanogo Y., D. Traoré, F. Samaké A.
Koné 2012. Les communautés ichtyologiques de la
rivière Baoulé dans le bassin du fleuve Niger au Mali.
30, 2, 65-71.
Sinsin, B. ; Kampermann, D., (eds)., 2010.
Atlas de la Biodiversité de l'Afrique de L'Ouest, Tome I : Bénin.
Cotonou & Frankfurt/Main.
Youssoufa, I. 2004. Importance des zones
humides du parc national du w du Niger pour les oiseaux d'eau migrateurs
d'afrique-eurasi. 2pp.
Zerbo, P., 2004. Contribution à
l'étude de la diversité du phytoplancton d'eau douce: Cas du
réservoir de Loumbila, Burkina Faso. Mémoire de DEA,
Université de Ouagadougou, 51 p.

50
Citharinus citharus (Geoffroy Saint-Hilaire, 1809)
Schilbe mystus (Linnaeus,1758)
Lates niloticus (Linnaeus,1758)
Annexes : Quelques spécimens de poissons
échantillonnés

Labeo coubie Rüppell, 1832
Mormyrus macrophtalmus Günther,1866
Labeo senegalensis,Valenciennes, 1842
Campylomormyrus tamandua (Günther,
1864)
51
| 


