MISE AU POINT DU DOSAGE DE L'ACTIVITE DE LA
CATALASE
DANS LES TISSUS.
Guy NYA NJOMEN1, Salim BENSAID2 et
Christophe SOULAGE2
1- GEMS, Animal Physiology Laboratory, Faculty of Sciences,
University of Yaounde I, P.O. Box 8127, Cameroon
2- INSERM, U870, F-69008 ; INRA, U1235, F-69008 ; INSA-Lyon,
RMND, F-69621 ; Univ Lyon 1, F-69003 ; Hospices Civils de Lyon, F-69003, Lyon,
France.
I- PRINCIPE

La catalase dégrade le peroxyde d'hydrogine
(H2O2) en eau et dioxygène suivant la réaction :
H2O2 2H2O + O2
La disparition du peroxyde d'hydrogène peut etre
mesurée en spectrophotométrie.

II- DOSAGE SPECTROPHOTOMETRIQUE DE H2O2
DO
3,4
|
2,9 2,4 1,9 1,4 0,9 0,4 -0,1 -0,6
|
|
190 240 290
X,, nm
Figure 1: Spectre d'absorption du
H2O2 mesuré à l'aide d'un spectrophotom~tre KONTRON
UVIKON 932.
H2O2 absorbe dans l'ultraviolet. La longueur d'onde
traditionnellement utilisée pour doser H2O2 en spectrophotométrie
est 240 nm (Beer & Sizer, 1959, Aebi et al, 1984). En
conséquence, toutes les mesures seron,t réalisées dans
des cuves en quartz.
II-1 Méthode de mesure.
L'absorbance est mesurée à 240 nm à
l'aide d'un spectrophotomètre KONTRON UVIKON 932. Avant la mesure, deux
cuves remplies chacune de 1250 mL de milieu réactionnel (MR) permettent
de faire le blanc; l'une des deux sera conservée et servira à la
mesure de l'absorbance des cuves échantillons. Le tableau de remplissage
des cuves échantillon contenant du H2O2 dilué à
1/200 est le suivant :
1
|
Volume de H2O2
(DL)
|
MR (DL)
|
Volume final
(DL)
|
|
50
|
1200
|
1250
|
|
100
|
1150
|
1250
|
|
150
|
1100
|
1250
|
|
200
|
1050
|
1250
|

II-2 Résultats
y = 0,0523x - 0,0129 R2= 0,9965
A 240 nm
0,6
0,5
0,4
0,3
0,2
0,1
0
0 2 4 6 8 10 12
H2O2, mM
Figure 2 Gamme étalon en
H2O2
II-3 Conclusion :
L'absorbance à 240 nm est bien proportionnelle à la
concentration en H2O2 , donc la disparition d'H2O2 peut être
suivie à 240nm.
III- METHODE DE DOSAGE DE L'ACTIVITE DE LA CATALASE
III-1 TEST DE REPRODUCTIBILITE
III-1-1 Méthode (1) adaptée d'après
Tanguy , 1999.
III-1-1-1 Solutions :
KH2PO4 50mM
NaH2PO4 50mM
Tampon de broyage : : KH2PO4 100mM , DTT 1mM, EDTA-Na2 2mM, pH7.4
H2O2 30mM
TRITON X 100 à 1% dans H2Obd
Ethanol 95%.
III-1-1-2 Homogénéisation des tissus pour
dosages
* Peser 20-30mg de tissus (muscle gastrocnémien) * Broyer
dans 1mL de tampon de broyage à 4°C.
* Aliquoter 200 uL d'homogénat pour le dosage des
protéines totales. * Centrifuger 5 min à 5500 rpm , 4°C.
* Prélever et aliquoter le surnageant en fraction de
200uL.
* Congeler les aliquots à - 20°C jusqu'à
utilisation
III-1-1-3 Préparation des surnageants.
*Ajouter 2 uL d'éthanol 95% à 200uL de
surnageant
*Incuber 30 min à 4°C.
*Ajouter 2uL de triton x 100 à 1%
*Incuber 10 min à 4°C
III-1-1-4 Dosage spectrophotométrique de
l'activité de la catalase.
La mesure de l'absorbance est réalisée à 240
nm. Deux blancs sont préparés dans 2 cuves pour faire
l'autozéro du spectrophotomètre. L'échantillon est
mesuré contre le blanc.
|
Solution
|
Blanc
|
Echantillon
|
|
MR (uL)
|
900
|
600
|
|
Surnageant (uL)
|
50
|
50
|
|
H2O2 à 1/200 (uL)
|
0
|
300
|
La réaction est déclenchée par l'ajout du
surnageant.
La catalase étant une enzyme à cinétique
non Michaélienne, donc non saturable, l'activité catalase sera
estimée en calculant la constance de vitesse de premier ordre de
disparition de H2O2 (Aebi H, 1982). La constance de vitesse
de disparition de H2O2 (K) est définie telle que :
K= 2,3/?t x log 10 ( DOo/DOt) en
sec-1
Avec :
?t : Durée de la mesure (sec)
DO0 : Densité optique à l'instant
0 DOt : Densité optique à l'instant t
III-1-1-5 Résultats.
|
Mesure
|
K ( sec -1)
|
|
1
|
1,68 x 10
|
-3
|
|
3
|
1,84 x 10
|
-3
|
|
4
|
1,85 x 10
|
-2
|
|
5
|
6,58 x 10
|
-3
|
|
6
|
7,44 x 10
|
-3
|
|
7
|
1,17 x 10
|
-2
|
|
8
|
1,20 x 10
|
-2
|
|
9
|
4,56 x 10
|
-3
|
|
10
|
7,96 x 10
|
-3
|
|
11
|
1,15 x 10
|
-2
|
Le traitement statistique des résultats nous donne une
moyenne de (8,65 #177;2,07) x 10 -3 sec -1 avec un
coefficient de variation de 23.9%.
III -1-1-6 Conclusion :
Le dosage spectrophotométrique de la catalase fonctionne,
mais la variabilité des résultats dans cette séquence de
mesure est importante.
III-1-2 METHODE(2) : SERVAIS et al, 2003.
III-1-2-1 Matériel et méthode
Seule la concentration de H2O2 change par rapport
à la méthode précédente (180mM) et donc le volume
ajouté (50uL).
III-1-2-2 Mesure de la DO
|
Solution
|
Blanc
|
Echantillon
|
|
MR (uL)
|
850
|
800
|
|
Surnageant (uL)
|
50
|
50
|
|
H2O2(uL)
|
0
|
50
|
III-1-2-3 Résultats
K (en sec -1)
Mesure
|
|
|
1
|
5,89 x 10
|
-3
|
|
2
|
4,51 x 10
|
-3
|
|
3
|
2,47 x 10
|
-3
|
|
4
|
4,22 x 10
|
-3
|
La moyenne est K = (4,29 #177; 0,99) x 10 -3
sec -1, avec un coefficient de variation de
23%.
Remarque : Les échantillons 5 ; 6 et 7 sont
conservés sur glace de 11h à 14h, suite à un
problème de spectrophotomètre et les mesures sont reprises
à 14h. Les résultats suivants sont obtenus :
|
Mesure
|
K (sec -1)
|
|
5
|
4,21 x 10
|
-4
|
|
6
|
1,95 x 10
|
-3
|
|
7
|
1,54 x 10
|
-2
|
La moyenne est K = ( 8,24 #177; 4,76) x 10 -3
sec -1 , avec un coefficient de variabilité de
50%. III-1-2-4 Conclusion
Le dosage spectrophotométrique de la catalase fonctionne,
mais la variabilité des résultats dans cette séquence de
mesure est importante.
III-2 ADAPTATION DE LA METHODE.
Nous avons modifié les deux méthodes
précédentes en nous basant sur les connaissances
bibliographiques.
III-2-1 :Mesure de la DO à 240 nm
La réaction sera déclenchée en ajoutant
H2O2 dans la cuve et non le
surnageant comme dans les cas précédents. Le plus grand
volume ajouté (300 uL au lieu de 50 uL) devrait favoriser un
mélange rapide des réactifs dans la cuve de mesure et le
déclenchement instantané de la réaction. Les cuves de
mesure ayant une contenance de 1500 uL, le volume réactionnel plus grand
(1250 uL au lieu de 950 uL) assurera un mailleur passage du
faisceau de mesure dans la solution.
0
Solution
|
Blanc
|
Echantillon
|
|
MR (uL)
|
1200
|
900
|
|
Surnageant (uL)
|
50
|
50
|
|
H2O2(uL)
|
|
300
|
Résultats :
|
Mesure
|
K ( sec -1)
|
|
1
|
2,98 x 10
|
-3
|
|
3
|
2,57 x 10
|
-3
|
|
4
|
2,36 x 10
|
-3
|
|
5
|
3,24 x 10
|
-3
|
|
6
|
1,74 x 10
|
-3
|
|
7
|
2,92 x 10
|
-3
|
|
8
|
1,75 x 10
|
-3
|
|
9
|
1,81 x 10
|
-3
|
|
10
|
1,31 x 10
|
-3
|
|
11
|
2,69 x 10
|
-3
|
La moyenne est K = ( 2,64 #177; 0,2) x 10 -3
sec -1 , avec un coefficient de variabilité de
8,3%. Conclusion : Bonne reproductibilité de
cette méthode
III-2 TEST DE PROPORTIONNALITE.
La constante K étant directement
proportionnelle à la quantité de catalase
présente dans la cuve de mesure, l'ajout de volumes croissants de
surnageant devrait résulter en une augmentation des valeurs de K
mesurées.
0,00E+00
1,00E-03
|
Cuve
|
Surnageant
(DL)
|
MR (DL)
|
H2O2 à 1/200
(DL)
|
Volume final
(DL)
|
|
Blanc 1
|
50
|
1200
|
0
|
1250
|
|
Test 1
|
50
|
900
|
300
|
1250
|
|
Blanc 2
|
100
|
1150
|
0
|
1250
|
|
Test 2
|
100
|
850
|
300
|
1250
|
|
Blanc 3
|
200
|
1050
|
0
|
1250
|
|
Test 3
|
200
|
750
|
300
|
1250
|
III-2-2 Résultats
N = 1
4,00E-03
5,00E-03
K , sec-1
2,00E-03
6,00E-03
3,00E-03
N = 5

N = 5
50 1iL 100 1iL 200 1iL
Volume de surnageant
Figure 3 : Mesure de la constante
de vitesse de disparition de H2O2 en présence de volumes
croissants de surnageant tissulaire.
III-2-3 Conclusion
Bonne proportionalité et bonne reproductibilité.
III-3 TEST DE LA SPECIFICITE DE LA MESURE
III-3-1 Matériel et méthode
Le matériel utilisé est le même , mais les
modifications suivantes ont étés faites :
- Tissu : 55 mg de muscle gastrocnémien sont broyés
dans 1 mL de Tp de broyage, pH 7,4.
- 900 1iL de surnageant + 81iL éthanol 95% ( incubation
30mn à 4°C) + 81iL TRITON X 100 à 1% ( incubation 10 mn
à 4°C).
- 450 1iL de surnageant sont dénaturés
par chauffage au bain marie, à 90°C pendant 15mn et le
reste, soit 4501iL( surnageant natif) sont utilisés pour la mesure de la
DO à 240 nm.
III-3-2 Mesure de la DO à 240 nm.
Au départ 2 cuves sont remplies chacune de 900uL de MR
et de 50uL de surnageant. Ces 2 cuves permettent de faire l'autozero du
spectrophotomètre. Un tube servira de blanc et 300 uL de MR seront
ajoutés à ce tube .
|
Solution
|
Blanc
|
Echantillon
|
|
MR (uL)
|
1200
|
900
|
|
Surnageant (uL)
|
50
|
50
|
|
H2O2 à 1/200(uL)
|
0
|
300
|
III-3-3 Résultats :
N = 10

ADO/min
0,04
0,03
0,03
0,02
0,02
0,01
0,01
0,00
N = 5
Contrôle 15min, 90°C
Figure 4 : Mesure
spectrophotométrique de la dégradation de H2O2 par un
surnageant natif ou un surnageant inactivé par incubation 15 min
à 90°C.
III-4 Conclusion
- Bonne reproductibilité des résultats dans chacune
des séquences .
- En comparant les activités des deux surnageants, il
ressort que la disparition de H2O2 dans la cuve en présence du
surnageant natif et donc la variation de DO sont bien dûs à
l'activité de la catalase, puisque aucune variation significative n'est
observée dans les mêmes conditions en présence du
surnageant traité.

III-5 TEST DE STABILITE DE H2O2 DANS LES CONDITIONS DE
MESURE.
III-5-1 MESURE DE LA DO A 240nm.
Le tableau de remplissage des cuves de mesure est le suivant :
|
Volume de
|
MR
|
Volume final
|
|
H2O2 (DL)
|
(DL)
|
(DL)
|
|
50
|
1200
|
1250
|
|
100
|
1150
|
1250
|
|
150
|
1100
|
1250
|
|
200
|
1050
|
1250
|
III-5-2 RESULTATS
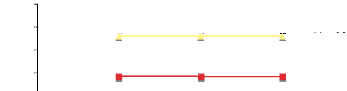
11 mM
7,3 mM
A 240 nm
0,7
0,6
0,5
0,4





0,3
0,2
0,1
3,7 mM
1,8 mM
0
0 1 2 3
Temps d'incubation, min
Figure 5 : Stabilité de
l'absorbance à 240nm de solutions de concentrations croissantes
en H2O2
III-5-3 CONCLUSION
La stabilité de l'absorbance pour chaque concentration
en H2O2, nous permet de confirmer que la disparition du
H2O2 en présence du substrat est bien due à
l'activité de la catalase et non à une dismutation
spontanée d' H2O2 en O2 et H2O.
PROTOCOLE DE MESURE DE L'ACTIVITE DE LA CATALASE
I - Solutions : KH2PO4 50mM ,
NaH2PO4 50mM, H2O2 1/200, Triton x 100 Bb dilué dans H2Obd,
Ethanol 95%.
II - Homogénéisation des tissus pour
dosages
- Tampon de broyage : : KH2PO4 100mM , DTT 1mM, EDTA-Na2
2mM, pH7.4 - Préparation des homogénats tissulaires:
* Peser 20-30mg de tissus
* Broyer dans 1mL de tampon de broyage à 4°C.
* Aliquoter 200 uL d'homogénat pour le dosage des
protéines totaux. * Congeler.
* Centrifuger 5 min à 5500 rpm , 4°C.
* Prélever et aliquoter le surnageant en fraction de
200uL.
* Congeler les aliquots à - 20°C
III - Préparation des surnageants.
*Ajouter 2 uL d'éthanol 95% à 200uL de surnageant
*Incuber 30 min à 4°C.
* Ajouter 2uL de triton x 100 à 1%
* Incuber 10 min à 4°C
IV - Dosage spectrophotométrique de
l'activité de la catalase.
La mesure de l'absorbance est faite à 240 nm
Deux blancs sont préparés dans 2 cuves pour faire
l'autozéro du spectrophotomètre. L'échantillon est
mesuré contre le blanc.
|
Solution
|
Blanc
|
Echantillon
|
|
MR (uL)
|
1200
|
900
|
|
Surnageant (uL)
|
50
|
50
|
|
H2O2 à 1/200 uL)
|
0
|
300
|
La réaction est déclenchée par l'ajout du
surnageant.
La constance de vitesse de disparition de H2O2 est
définie telle que : K= 2,3/?t x log 10 ( DOo/DOt) sec-1 (Aebi H,
1982),



