|

ÉíÈÚÔáÇ
ÉíØÇÑÞãíÏáÇ
ÉíÑÆÇÒÌáÇ
ÉíÑæåãÌáÇ
REPUBLIQUE ALGERIENNE DEMOCRATIQUE ET
POPULAIRE
íãáÚáÇ
ËÍÈáÇ æ
íáÇÚáÇ
ãíÜáÚÊáÇ
ÉÑÇÒæ
Ministère de l'Enseignement Supérieur et de la
Recherche Scientifique
Centre Universitaire Salhi Ahmed
-Naâma-
Institut des Sciences et
Technologies
Département des Sciences de la Nature et de la
Vie
Mémoire de fin
d'études
En vue de l'obtention du Diplôme de
Master
Académique en science biologique
Spécialité : Microbiologie
Appliquée
Thème
Etude de l'activité antifongique des huiles
essentielles de
Pulicaria mauritanica et Micromeria debilis
contre quelques
champignons phytopatogènes du genre Alternaria
sp
Présenté par :
Mme BENATTA Fatima Zahra Mme DJELILATE Yosra
Soutenu le : 01 Juillet 2018
Jury :
Président : M. MERIOUA SIDI MOHAMMED
M.C.B
Encadreur : M. GHERIB MOHAMMED M.C.A
Examinateurs : M. AMROUCHE ABDELILEH M.C.A
Mme YAKOUBI MERYEM M.A.B
Année Universitaire 2018/2019
Remercîement
Ce mémoire n'aurait pas
pu être ce qu'il est, sans l'aide d'ALLAH Miséricordieux le tout
puissant qui nous a donné la force afin de l'accomplir.
Tous d'abord nous tenons
à exprimer nos profonds remerciements et notre vive reconnaissance
à notre promoteur,
Mr GHERIB Mohammed. Maitre de
conférences Au département de SNV, Faculté des sciences et
technologie, Centre Universitaire Salhi Ahmed de Naama, pour nous avoir fait
l'honneur de diriger ce travail. Nous voudrons qu'il trouve ici toute notre
reconnaissance pour ses encouragements, ses conseils, ses recommandations, le
temps qu'il nous a consacré et sa bienveillance.
Nous adressons nos
sincère remercîments à Mr MERIOUA Sidi
Mohammed Maitre de conférence B au C.U. Naama d'avoir
accepté de présider le jury de ce mémoire .Les remarques
et suggestions seront d'une grande valeur pour l'enrichissement de ce
travail.
Nous remercions
profondément Mr AMROUCHE AbdelIllah Maitre
de Conférences A au C.U.Naama pour sa disponibilité et ses
encouragements pour l'accomplissement de ce travail. Qu'il trouve ici notre
profonde reconnaissance. Nous le remercions aussi d'avoir accepté de
juger ce travail.
Nous voudrons remercier très sincèrement notre
Co-promoteur et notre examinatrice Mme YAKO7JBI
Meryem maitre assistante B au C.7J.Naama .Nous la remercions,
du fond du coeur pour l' esprit scientifique et humain de
grande qualité.
Nous exprimons aussi notre reconnaissance à
Mr Maarouf Abderezzak professeur au C.7J.Naama pour
son aide pour l'identification des plantes médicinales
étudiées.
A Mme
BENHAMZA Messaouda, pour le soutien
moral, les encouragements, les conseils et la disponibilité ;
qu'elle trouve ici notre profonde reconnaissance.
Nos remercîments vont également à
l'ensemble du personnel technique des laboratoires dans lesquels ce
travail a été réalisé, pour la sympathie
qu'ils nous ont témoignée ainsi qu'à toute, les
personnes qui, de prés ou de loin, nous ont aidé pour
achever ce travail.

Dédicace
Je dédie ce travail
A mon père pour ses encouragements et son
soutien
tout au long de mes études et aussi pour ses
innombrables
sacrifices.
A ma mère que Dieu le tout-puissant la protège
et lui
donne la force pour qu'elle continue à couronner notre
vie.
A mes soeurs : Amina et khadidja.
A mes frères : Boubeker, Omar et Othman.
A mes nièces et mes neveux.
A toute ma famille.
A mes amis :Siham, Yakout et Farouk

Fatima Zahra
Dédicace
Je dédie ce travail
A ma mère qui m'a donné la vie
A mon père qui s'est sacrifié pour mon bonheur
et ma
réussite.
A mes frères, mes soeurs et ma petite
Chaimaa
A tous les membres de ma famille, petite et grande
A ceux, qui me sont chers.

Yosra
ÕÎáã
äíÊíÑØÚ
äíÊÊÈä äã
ÉÕáÎÊÓãáÇ
ÉÑÇíØáÇ
ÊæíÒáÇ ìÏá
ÊÇíÑØáá
ÏÇÖãáÇ
áæÚãáá
íÑÈÎãáÇ
ãííÞÊáÇÈ
ÉÓÇÑÏáÇ åÐå
ãÊåÊ
|
Úæä äã
ÉíÑØ
ÊáÇáÇÓ ÉÑÔÚ
ØíÈËÊ ÏåÈ
ßáÐæ
|
"
|
ÓíáÈÏ ÇíÑ
íãÑßíã
|
"
|
æ
"ÇßíäÇÊíÑæã
ÇíÑÇßíáæÈ" :
Çãåæ
ÉãÇÚäáÇ
ÉÞØäã äã
|
ãØÇãØáÇ
ÉÊÈäá
ÉíÑØáÇ
ÖÇÑãáá
ÉÈÈÓãáÇ "
ÇíÑÇäÑÇÊáÇ
"
ÇíÑÇäÑÇÊáÇ
"ìáÅ íãÊäÊ
ÇåÏíÏÍÊ ãÊ
íÊáÇ
ÊáÇáÇÓáÇ .
ÉíÌæáæÑæãáÇ
ÊÇÕáÇ ìáÚ
ÉíÑØáÇ ÊáÇ
ÒÚáÇ ÉÑÚã í
ÇäÏäÊÓÇ
. "
áÇíæØÇãæØ
ÇíÑÇäÑÇÊáÇ "
æ "íäáÇæÓ
ÇíÑÇäÑÇÊáÇ
""ÇãíÓæäÊ
ÇíÑÇäÑÇÊáÇ"
"ÇÊÇäÑÊáÇ
ÇíÑÇßíáæÈ"
:á % 0.045 æ % 0.30 ÊäÇß
ÑÇÎÈáÇÈ
ÑíØÞÊáÇ
ÉØÓÇæÈ
ÕáÇÎÊÓáÇ Ç
äÚ ÌÊÇäáÇ
íÑØÚáÇ
ÊíÒáÇ
ÉíÏæÏÑã
|
.íáÇæÊáÇ
ìáÚ
|
"
|
ÓíáÈÏ ÇíÑ
íãÑßíã
|
"
|
æ
"ÇßíäÇÊíÑæã
|
ÊáÇáÇÓáÇ
åÇÌÊ ãåã
ØÇÔä äÚ
ÑÔÇÈãáÇ
ÓãáÇÊáÇ
ÉÞíÑØ
ÉØÓÇæÈ
ÊæíÒáÇ åÐåá
ÊÇíÑØáá
ÏÇÖãáÇ
ØÇÔäáÇ
ÉÓÇÑÏ ÊÔß
ÇÐßæ
ÉíÑØáÇ
ÊáÇáÇÓáÇ
æãäá
ÉØÈËãáÇ
ÒíßÇÑÊáÇ
ãíÞ ÏíÏÍÊ
ááÇÎ äã ãÊ
ÊæíÒáÇ åÐå
ÉíáÇÚ äÅ
íáÇÊáÇÈæ
.ÇåÑÇÈÊÎÇ ãÊ
íÊáÇ
. áã /
ÑÊáæÑßíã 1.1
ìáÅ 0.95 äíÈ Çã
ØÈËã
ÖÎäã
ÒíßÑÊáÇ ãíÞ
ÊÇíÑØáÇ
ãÙÚã
ØíÈËÊ ÇäÇØÚ
äí ÛÇæÈáÇÇ
áíßÔÊ
|
.ÉíÆÇíãíßáÇ
|
ÊÇíÑØáÇ
ÊÇÏíÈãá
áÇÇÚ æ áÇíÏÈ
áÇÍ
|
ÊæíÒáÇ
åÐå ÑÇÈÊÚÇ
äßãí
|
ãÇÊÎáÇ
|
í
|
ÏÇÖã ØÇÔä
ÑÇíØ ÊíÒ
ÑÇÎÈáÇÈ
ÑíØÞÊáÇ
ÇíÑÇäÑÇÊáÇ
ÓíáÈÏ
ÇíÑíãÑßíã
ÇßíäÇÊíÑæã
ÇíÑÇßíáæÈ:
ÉíÍÇÊãáÇ
ÊÇãáßáÇ
ÊÇíÑØáá
Abstract
This stady aimed to evaluate in vitro the antifungal
activity of the essential oils of two aromatic plants growing in Naama:
Pulicaria mauritanica and Micromeria debilis against ten
fungal strains belonging Alternaria sp responsible of the fungal
diseases that infect tomatoes..
The identification of fungal isolates was based on cultural
traits and morphological characters. The results showed that the identified
strains belong to the following species: Alternaria alternata, Alternaria
tenuissima, Alternaria solani and Alternaria tomatophila.
While, the yield of essential oil resulting from a
hydrodistillation extraction was of the order of 0.30% and 0.045% for
P.mauritanica and M.debilis respectively. The study of the
antifungal activity of these oils by the direct contact method revealed an
important activity to some strains tested.
The effectiveness of each EO is estimated by determining the
inhibition rate of mycelial growth and the rate of inhibition of sporulation,
where the total inhibition of the majority of strains gave us MIC mean value
ranging between 0.95 to 1.1ìl / ml.
Finally, these oils can be considered as a potential
alternative to synthetic fungicides.
Key words: Pulicaria mauritanica,
Micromeria debilis, Alternaria sp, Hydrodistillation, Essential oil,
Antifungal activity.
Résumé
Le but de ce travail était d'évaluer
l'activité antifongique in vitro des huiles essentielles de
deux plantes aromatiques de la région de Naama : Pulicaria
mauritanica et Micromeria debilis vis-à-vis de dix souches
fongiques du genre Alternaria sp responsables de l'alternariose de la
plante de tomate.
L'identification des isolats fongiques a été
basée sur les caractères culturaux et les caractères
morphologiques. Les souches identifiées appartiennent aux espèces
Alternaria alternata, Alternaria tenuissima, Alternaria solani et
Alternaria tomatophila.
Le rendement en huile essentielle issu d'une extraction par
hydrodistillation était de l'ordre de 0.30% et 0.045% pour
P.mauritanica et M.debilis respectivement. L'étude de
l'activité antifongique de ces huiles par la méthode de contact
direct a révélé une importante activité
vis-à-vis des souches testées.
L'efficacité de chaque HE est estimée par la
détermination du taux d'inhibition de la croissance mycélienne et
le taux d'inhibition de la sporulation, d'où l'inhibition total de la
majorité des souches nous a donné des valeurs de CMI comprises
entre 0.95 à 1.1ul/ml.
En conclusion, ces huiles peuvent être
considérées comme une alternative potentielle aux fongicides
synthétiques.
Mots clés : Pulicaria mauritanica
,Micromeria debilis ,Alternaria sp, Hydrodistillation ,Huile essentielle,
Activité antifongique.
Glossaire
Chlamydospore : une spore à grande
paroi épaisse, une spore de repos, de plusieurs types
de champignons
Conidies: Spore issue de la multiplication
asexuée formée à l'extrémité d'un
conidiophore.
Conidiophore: Hyphe aérien
spécialisé qui produit à son extrémité
plusieurs conidies.
Dictyospore : une spore multicellulaire de
certains champignons qui a des cloisons
transversales et longitudinales
Floraison : Phase du cycle vital des
phanérogames qui marque le début de la période
reproductive
Fragrance : odeur agréablement
parfumé émise par les plantes
Hyphe : Filament dépourvu de
chlorophylle constituant le thalle des champignons.
Isolat: Matériel biologique
prélevé sur un organisme vivant, en vue de son étude ou de
sa
culture in vitro.
Mycélium: Appareil
végétatif d'un champignon constitué d'un ensemble
d'hyphes.
Pathogène : organisme susceptible de
causer une maladie.
Phytopathogène : Qui cause une maladie
chez les plantes.
Piriforme : en forme de poire
Plante hôte: Espèce de plante
dont dépend le développement d'un organisme (source
nutritive).
Pubescent : qui est couvert d'un duvet de
poils fins et courts
Rampant : en botanique, qualifie certains
organes d'une plante croissant parallèlement au sol
Rendement : la grandeur qui exprime la
production généralement en poids.
Sédatif : une substance qui a une
action dépressive sur le système nerveux.
Spore : Spore issue de la multiplication
sexué et asexuée.
Sporulation ; aptitude d'un champignon
à produire des spores.
Liste des figures
Figure 1 Différents organes de la tomate
a: Les feuilles b : la fleur
c: Le fruit P5
Figure 2 Chaine des conidies
P9
P10
Figure 3 A. alternata, (a) colonie sur
gélose pomme de terre carotte (PCA)
après 6 jours, (b) modèle de sporulation
à long chaînes, (c) conidies dans une chaîne avec septa
longitudinaux et transversaux
Figure 4 A.tenuissima, (a)colonie sur
PCA après 6 jours, (b) sporulation à
courte chaine, (c) chaînes conidiales et conidies
P11
P11
Figure 5 A. arborescens, (a) colonie
sur PCA après 6 jours, (b) modèle de
sporulation à long conidiophore primaire, (c) conidies
avec des décorations de surface.
Figure 6 A.solani , colonie sur PCA
après 6 jours et les conidies P12
Figure 7 Conidies et conidiophores de la souche
A. tomatophila représentative P12
Figure 8 Symptômes de l'aternariose sur la
foliole P13
Figure 9 Symptômes de l'aternariose sur
fruit P13
Figure 10 Lésions provoquées par
Alternaria tomatophila et A.alternata; A sur
tige, B sur collet
P14
Figure 11 Développement et
symptômes de maladies causées par Alternaria spp
P16
Figure 12 Formule chimique de l'isoprène
méthyl-2-buta-1,3-diène P18
Figure 13 Méthodes d'extraction des HE
P20
Figure 14 Appareillage utilisé pour
l'hydrodistillation P20
Figure 15 Photo de Pulicaria mauritanica
P23
Figure 16 Photo de Micromeria debilis
P25
Figure 17 Photos représentant les
étapes de l'induction de la sporulation P29
Figure 18 Photos représentant la methode
de microculture P30
Figure 19 Situation géographique des
lieux des prélèvements P31
Figure 20 Montage de type Clevenger
P32
Figure 21 Protocole expérimental de
l'activité antifongique P34
Figure 22 Photo représente la
détermination du taux d'inhibition de la sporulation
P35
P38
Figure 23 Aspect macroscopique des colonies
(revers et avers) des espèces d'Alternaria à petite
spores sur milieu PDA
P38
Figure 24 Aspect macroscopique des colonies
(revers et avers) des espèces d'Alternaria à grosses
spores sur milieu PDA
P39
Figure 25 Aspect macroscopique des colonies des
espèces d'Alternaria à petites
spores sur milieu PCA après induction de la sporulation
Figure 26 Aspect macroscopique des colonies des
espèces d'Alternaria à grosse
spores sur milieu PCA après induction de la sporulation
P39
Figure 27 Aspect microscopique des
espèces d'Alternaria à petites spores .
P40
Figure 28 Aspect microscopique des
espèces d'Alternaria à grosses spores
P41
Figure 29 Huile essentielle de P.
mauritanica P40
Figure 30 Huile essentielle de M. debilis
P40
P43
Figure 31 Cinétique de croissance des
souches d'Alternaria (A01 et A10) en fonction de temps (jours) et
concentration de l'huile essentielles de P. mauritanica
Figure 32 Cinétique de croissance des
souches d'Alternaria( A18 et A37 et A42) en fonction de temps (jours)
et concentration de l'huile essentielles de P. mauritanica
P44
P45
Figure 33 Cinétique de croissance des
souches d'Alternaria (A45, A51 et A57) en fonction de temps (jours) et
concentration de l'huile essentielles de P. mauritanica
Figure 34 Cinétique de croissance des
souches d'Alternaria (AT01 et AT04) en fonction de temps (jours) et
concentration de l'huile essentielles de P.mauritanica
P46
P47
Figure 35 Cinétique de croissance des
souches d'Alternaria (A01 et A10) en fonction de temps (jours) et
concentration de l'huile essentielles de M.debilis
Figure 36 Cinétique de croissance des
souches d'Alternaria (A18, A37et A42) en fonction de temps (jours) et
concentration de l'huile essentielles de M.debilis.
P48
P49
Figure 37 Cinétique de croissance des
souches d'Alternaria (A45, A51et A57) en fonction de temps (jours) et
concentration de l'huile essentielles de M.debilis.
P50
Figure 38 Cinétique de croissance des
souches d'Alternaria (AT01 et AT04) en fonction de temps et
concentration de l'huile essentielles de M.debilis
Figure 39 Taux d'inhibition de la croissance
mycélienne de l'HE P.mauritanica. P51
Figure 40 Taux d'inhibition de la croissance
mycélienne de l'HE M.debilis. P51
Figure 41 Taux d'inhibition de la sporulation de
l'HE de P.mauritanica P53
Figure 42 Taux d'inhibition de la sporulation de
l'HE de P.mauritanica P53
P54
Figure 43 Aspect macroscopique des colonies
testées par differentes concentrations d'
HE.de P.mauritanica aprés 10
jours d'incubation.
Figure 44 Aspect macroscopique des colonies
testées par differentes concentrations d'
HE.de P.mauritanica aprés 10
jours d'incubation.
P55
P56
Figure 45 Aspect macroscopique des colonies
testées par differentes concentrations d'
HE.de M.debilis aprés 10
jours d'incubation.
Figure 46 Aspect macroscopique des colonies
testées par differentes concentrationsd'
HE.de M.debilis après 10
jours d'incubation
P57
P58
Figure 47 Vitesse de la croissance
mycélienne sous l'effet de différentes concentrations en HE de
P.mauritanica
P59
Figure 48 Vitesse de la croissance
mycélienne sous l'effet de différente concentration en HE de
M.debilis
Liste des tableaux
Tableau 1 Principaux pays producteur de la
tomate P6
Tableau 2 Origine des isolats d'Alternaria
sp. P28
Tableau3 Caractères culturaux des isolats
d'Alternaria sp sur milieu PDA P37
Tableau 4 Caractéristiques des huiles
essentielles P41
Tableau 5 Rendement calculé en (%) pour
les deux espèces étudiées P42
Table des matières
Remerciment Dédicace
ÕÎáã
Abstract Résumé
Glossaire
Liste des figures Liste des tableaux Table des matières
Introduction générale 1
Partie bibliographique 2
Chapitre I : La plante hôte 4
I.1 Généralité sur la tomate 4
I.2 Historique 4
I.3 Nomenclature et classification 4
I.4 Description botanique 5
I.5 Production de la tomate 5
I.5.1 Dans le monde 5
I.5.2 En Algérie 6
I.6 Importance nutritionnelle 6
Chapitre II: Le pathogène 7
II .1 Généralités sur Alternaria
7
II.2 Historique 7
II.3 Classification 8
II.4 Caractéristiques du genre 8
Table des matières
II .4.1 Caractères culturaux 8
II .4.2 Caractères morphologiques 9
II .5 Alternaria pathogène des tomates 9
II .5 .1 Alternaria à petite spore 9
II .5 .1.1 Alternaria Alternata 9
II .5 .1.2 Alternaria Tenuissima 10
II .5 .1.3 Alternaria arborecsence 11
II .5 .2 Alternaria à grosse spore 11
II .5 .2.1 Alternaria solani 11
II .5 .2.2 Alternaria tomatophila 12
II .6.Alternariose 12
II.6.1 Symptômes 13
II.6.1.1 Sur feuiles 13
II.6.1.2 Sur fruits 13
II .6.1.3 Sur tiges et collets 14
II .7 Cycle infectieux 14
II .7. 1 Conservation, source d'inoculum 14
II .7. 2 Pénétration et invasion 14
II .7. 3 Sporulation et dissémination 15
Chapitre III les huiles essentielles 17
III.1.Aromathérapie 17
III.2.Généralités sur les huiles
essentielles 17
III.3 Chimie des huiles essentielles 18
III.3.1 Terpènes et Terpénoides 18
III.3.2 Composés aromatiques 19
III.4 Caractéristiques et propriétés
physiques 19
III.5.Méthodes d'extraction 19
Table des matières
III.5.1 Méthodes conventionnelles 20
III.5.1.1 Hydrodistillation 20
III.5.1.2 Extraction par entraînement à la vapeur
d'eau 21
III.5.1.3 Pressage à froid 21
III.5.1.4 Enfleurage 21
III.5.1.5 Extraction par solvant organique 21
III.5.2 Méthodes innovantes 21
III.5.2.1 Extraction par micro-onde 21
III.5.2.2 Extraction par les ultrasons 21
III.6 Analyses des huiles essentielles 22
III.7.Rendement 22
III.8 Conservation des huiles essentielles 22
III.9 Action des huiles essentielles contre les champignons 22
III.10 Plantes étudiées 23
III.10.1 Pulicaria mauritanica 23
III.10.1.1 Description botanique 24
III.10.1.2 composition chimique 24
III.10.1.3 Propriétés thérapeutiques 24
III.10.2 Micromeria debilis 25
III.10.2.1 Description botanique 25
III.10.2.2 composition chimique 26
III.10.2.3 Propriétés thérapeutiques 26
Partie éxpérimentale 27
Chapitre I : Matériels et méthodes
28
I.1 Matériel fongique 28
I.1.1 Choix des souches 28
I.1.2 Origine des souches 28
Table des matières
I.1.3 Repiquage des souches 28
I.1.4 Induction de la sporulation 29
I.1.5 Conservation des isolats 29
I.1.6 Identification des isolats 29
I.1.6.1 Etude macroscopique 29
I.1.6.2 Etude microscopiques 30
I.2 Matériel végétal 31
I.2.1 Récolte de matériel végétal
31
I.2.2 Identification botanique 31
I.2.3 Préparation des échantillons 31
I.2.4 Extraction de l'huile essentielle 32
I.2.5 Calcul du rendement en huile essentielle 32
I .3 Activité antifongique 30
I .3.1 Effet des huiles essentielles sur la croissance
mycélienne 30
I .3.2 Évaluation de l'indice antifongique 34
I .3.3 Effet des huiles essentielle sur la sporulation 35
I .3.4. Détermination de la vitesse de la croissance
mycélienne 35
Chapitre II : Résultats et
Interprétations 36
II .1 Matériel fongique 36
II .1.1 Identification des isolats 36
II .1.1.1 Etude macroscopique 36
II .1.1.2 Etude microscopique 40
II .2 Caractéristiques des huiles essentielles 41
II .3 Rendement des huiles essentielles 42
II .4 Activité antifongique 42
II .4.1 Cinétique de la croissance mycélienne 42
II .4.1.1Cas de l'HE de P. mauritanica 42
Table des matières
II .4.1.2 Cas de l'HE de M.debilis 47
II .3 .3 Taux d'inhibition de la croissance mycélienne
50
II .3 .4 Taux d'inhibition de la sporulation 52
II .3 .4 Détermination de la vitesse de la croissance
mycélienne 58
Conclusion générale 62
Références bibliographiques 65
Annexes
« Le don d'une pLante utiLe
me parait
pLus précieux que La découverte d'une
mine
d'or et d'un monument pLus durabLe qu'une
pyramide »
Bernardin de Saint-Pierre.

INTRODUCTION
Page 1
Introduction
Les champignons sont les principaux agents infectieux des
plantes, responsables des altérations au cours des stades de
développement, et sont les principaux microorganismes responsables de
pertes en agriculture (kacemi et al, 2017).
Les espèces du genre Alternaria sont
répandues à grande échelle. Une partie considérable
des espèces sont cosmopolites .Selon le style de vie saprophytes ils se
développent sur les parties mortes des plantes. Une partie d'entre eux
jouent un mode de vie parasite necrotrophes et une qui cause des graves
maladies, ces espèces sont considérées comme un
véritable organisme nuisible spécifique de l'hôte.
Les symptômes causés par ces pathogènes se
présentent généralement sous forme des taches brunes
à noirâtre sur les solanacées. Les dégâts
causés par les principaux agents de l'alternariose se traduisent par des
brulures au niveau des feuilles, des tiges, des collets et des fruits
(Ranc, 2010).
Cette maladie est contrôlée souvent par des
fongicides. Or, ces derniers constituent un véritable danger pour la
santé humaine et l'environnement (kacemi et al.,
2017).
Le traitement des mycoses reste difficile d'une part du fait
du nombre limité de principes réellement efficaces et de leur
coût très élevé et d'autre part lié à
l'émergence de souches résistantes à certains
antimycosiques usuels (El Mansouri, 2013).
Ces différentes difficultés ont suscité
l'intérêt de plusieurs chercheurs à trouver d'autres
substances fongitoxiques inoffensives et non polluantes, pouvant être une
solution alternative aux médicaments actuels.
Les plantes aromatiques et médicinales de part leur
utilisation ancestrale nous offrent un terrain important d'investigation
(El Haci, 2015).
Différentes espèces de végétaux
sont connues depuis longtemps par leurs effets antimicrobiens. Les plantes
aromatiques et médicinales (PAM) constituent une richesse naturelle
très importante dont la valorisation demande une parfaite connaissance
des propriétés à mettre en valeur. Les
propriétés médicales des plantes médicinales
dépendent de la présence d'agents bioactifs variés et
appartenant à différentes classes chimiques. Ces
propriétés, dues souvent à la fraction d'huile essentielle
(HE), peuvent être mises à profit pour traiter les infections
mycosiques (El Mansouri, 2013) .
les huiles essentielles représentent des
molécules de fortes valeurs, utilisées dans la pharmacologie car
elles ont un effet spécifique sur d'autres organismes (Remmal et
al., 1993), elles ont un spectre d'activité
très large due principalement à leur grande affinité
Introduction
grâce a leur natures, pour cela, les activités
antibactériennes de ces produits ont été rapportées
dans de très nombreux travaux (Bouzouita et al.,
2008).
La région Sud-Ouest de notre pays même si elle
est dotée d'un climat sec renferme des régions qui
possèdent des variétés de plantes surprenantes par leur
aspect et par leur capacité d'adaptation.
Le présent travail constitue l'ébauche d'un
projet de recherche dans le but de valoriser la flore locale visant à
étudier l'activité antifongique in vitro des huiles essentielles
de deux plantes aromatiques Pulicaria mauritanica et Micromeria
debilis de la wilaya de Naama sur dix (10) souches de champignons du genre
Alternaria responsables des taches brunes de la tomate.
Nous avons organisé notre travail en trois grandes
parties:
? La 1ere partie consiste une étude
bibliographique sur la plante hôte, le pathogène et la lutte
biologique par les huiles essentielles de deux plantes aromatiques :
Pulicaria mauritanica et Micromeria debilis.
? La 2eme partie représente la partie
expérimentale qui consiste à l'identification des espèces
d'Alternaria , l'extraction des huiles essentielles de Pulicaria
mauritanica et Micromeria debilis et l'étude du pouvoir
antifongique de ces deux plantes sur les espèces d'Alternaria
sp.
? La 3eme partie est consacrée à la
présentation des résultats obtenus et leurs discussions.
? Enfin, notre travail est clôturé par une
conclusion générale pour restituer les principaux
résultats obtenus, les limites de notre travail et les perspectives
voulues pour pouvoir compléter et améliorer cette
étude.
Page 2
PARTIE
BIBlIoGRAPHIQUE

Page 4
Partie bibliographique
Chapitre I : La plante hôte
I.1 Généralité sur la tomate
La tomate (Solanum lycopersicum), est l'un des plus
populaires légumes dans le monde entier et le deuxième produit le
plus précieux après la pomme de terre, fraîches ou
après transformation (Kumar et al., 2008) avec
une production de 170,8 millions de tonnes en 2013 (FAO,
2013).
I.2 Historique
La tomate est originaire de l'Amérique de Sud, dans la
région montagneuse des Andes (Equateur, Pérou, Chili), la tomate
fut domestiquée au Mexique, avant d'être importé en Europe
au XVI siècle par les conquistadores (Peratla et al.,
2006).
En Algérie, la tomate a été introduite
par les cultivateurs du Sud de l'Espagne. Sa culture a commencé dans la
région d'Oran en 1905 puis, elle s'étendit vers le centre,
notamment au littoral Algérois (Latigui, 1984).
I.3 Nomenclature et classification
En 1753, le botaniste suédois Linnaeus l'a
nommée Solanum lycopersicum, mais 15 ans plus tard Philipe
Miller a remplacé ce nom par Lycopersicom esculentum. Bien que
les taxonomistes aient récemment réintroduits son nom original
Solanum lycopersicum (Milet, 2017).
La tomate fait partie de la famille des Solanaceae et du genre
Solanum. La famille des Solanaceae comprend 94 genres et environ 2950
espèces cosmopolites. Le genre Solanum est très
important dans le monde (environ 1700 espèces recensées) et
comporte des plantes alimentaires comme la pomme de terre (Solanum
tuberosum), et bien sûr la tomate (Ranc, 2010).
La classification scientifique de la tomate proposée en
2007 par Benton est la suivante :
· Règne : Plantae
· Embranchement : Tracheophyta
· Classe : Mangoliopsida
· Ordre : Solanales
· Famille : Solanaceae
· Genre : Solanum
· Espèce : Solanum
lycopersicum
Page 5
Partie bibliographique
I.4 Description botanique
La tomate est une plante herbacée vivace, ce qui
signifie qu'elle peut vivre plusieurs années, elle est cultivé
dans les régions à climat chaud, mais peut également
être planté dans une serre en hiver (Possada,
2016), c'est une plante aux tiges ramifiées et port rampant. La
tige est pubescente, épaisse aux entre-noeuds. Les feuilles sont
composées (5à7 folioles), alternées et persistantes. Les
fruits sont des baies formées de 2 à 3 loges, à graines
très nombreuses, et dont la taille, la forme et la couleur varient avec
les différentes variétés. Elle a une température
optimale de croissance de l'ordre de 25°C et un thermopériodisme
journalier de 10°C, conditions qu'elle a retenues de son origine
montagnarde (Bessadat, 2014).

a
b
c
Figure 1: Différents organes de la
tomate a: Les feuilles b : la fleur
c: Le fruit
(Oukala, 2014).
I.5 Production de la tomate
I.5.1 Dans le monde
Les principaux pays producteurs sont la Chine, les USA,
l'Inde, la Turquie, l'Egypte, l'Italie, l'Iran, le Brésil et
l'Espagne.
La tomate représente 8,2% de la surface totale
assignée pour l'agriculture et les récoltes industrielles
(MADR, 2013)
La production de la tomate a progressé
régulièrement, elle est passée de 48 millions de tonnes en
1978 à 159 millions de tonnes en 2011 (Blancard et al.,
2009 )
Le tableau 1 montre les principaux pays producteur de la tomate
en 2013.
Page 6
Partie bibliographique
Tableau 1: Principaux pays producteur de la
tomate (FAOSTAT, 2013)
Classement
|
Pays
|
Production*
|
01
|
Chine
|
52.6
|
02
|
Inde
|
18.8
|
03
|
Etats-Unis
|
14.5
|
04
|
Turquie
|
11.9
|
05
|
Egypte
|
8.3
|
06
|
Iran
|
6.0
|
07
|
Italie
|
5.6
|
08
|
Espagne
|
4.9
|
|
* : Millions de tonnes
I.5.2 En Algérie
La tomate occupe une place privilégiée dans le
secteur maraicher en Algérie. Elle est considérée comme
une espèce prioritaire et classée en troisième lieu
après la pomme de terre et l'oignon. La production moyenne en 2011 est
de 790 mille tonnes avec un rendement moyen de 336 Qx / ha (Snoussi,
2010).
I.6 Importance nutritionnelle
La tomate est très prisée pour son
intérêt alimentaire et sa valeur nutritive. Le fruit de tomate est
très riche en vitamine A, C et K, sa composition en vitamine, en acide
organique, potassium et en lycopène le rend un légume
anticancéreux. (Possada, 2016)
Sa richesse en nutriment, leur peau fine et leurs tissus mous
rend les tomates facilement infectées et susceptibles à une
pénétration et une croissance rapides des différents types
d'espèces d'Alternaria. (Vaquera et al.,
2014)
Page 7
Partie Bibliographique
Chapitre II: Le pathogène
II .1Généralités sur
Alternaria
Alternaria est un genre fongique omniprésent
qui comprend prés de 275 espèces (Simmons, 2007)
mésophile, leurs activités prédominantes
disparaissent lorsque la température s'élève
(Botton et al., 1990) , avec des modes de vies
saprophytes endophytes et phytopathogènes (Saharan et
al., 2016), qui peuvent affecter les cultures sur champ ou
les produits végétaux pendant la récolte et
post-récolte (Logrieco et al., 2009).
En général, les espèces du genre
Alternaria provoquent une destruction relativement lente des tissus
hôtes par la réduction du potentiel photosynthétique. Les
tissus affaiblis par le stress, la sénescence ou les blessures sont plus
susceptibles à l'infection par Alternaria sp. (Vaquera
et al., 2014) . Ce genre peut pousser sur plusieurs substrats
y compris les graines, les feuilles et les fruits des plantes, cultures, sol et
air (Kokaeva et al., 2015).
Les spores sont de couleur brune foncée et naissent en
chaînes simples ou ramifiées à l'extrémité de
conidiophores simples et sombres ; elles sont divisées en plusieurs
cellules par des parois transversales et verticales. Les nouvelles spores sont
produites par extrusion à l'extrémité de la spore
précédente, par le biais d'un pore de la paroi. Elles sont
communément isolées à partir de la décomposition
des matières végétales, mais causent aussi des maladies
des plantes. Les spores des Alternaria sont dispersées par les
courants d'air et sont généralement une composante majeure de
l'air extérieur (Siciliano, 2017). Certaines
espèces produisent des toxines spécifiques à l'hôte
(HST) qui contribuent à leur pouvoir pathogène et à leur
virulence (Virginia, 2016).
Les espèces d'Alternaria sont des agents
phytopathogènes responsables de la détérioration des
produits agricoles, capables de produire des métabolites secondaires
potentiellement affectant la santé humaine (Siciliano, 2017)
voire des pertes économiques, les aliments
végétaux infectés par Alternaria peuvent
introduire de grandes quantités de ces toxines dans l'alimentation
humaine. Des études supplémentaires sur le potentiel toxique de
ces toxines et leur danger pour la consommation humaine sont nécessaires
pour réaliser une évaluation fiable des risques liés
à une exposition alimentaire (Virginia, 2016)
II.2 Historique
En 1816, Nees décrit pour la première fois un
champignon qu'il a nommé Alternaria tenuis. Parmi les
caractéristiques de ce genre ; la production des chaines de
Page 8
Partie Bibliographique
conidies de couleur foncé avec des septa transversales
et longitudinales ; il a cité cette espèce comme un synonyme de
Torula alternata.
En 1832 Fries a établi un nouveau genre
Macrosporium, comprend des espèces ayant les mêmes
caractéristiques avec Alternaria et qui ont aujourd'hui
reconnus comme des espèces d'Alternaria. Pendant une bonne
période, de nombreuses espèces d'Alternaria ont
été décrites. Deux autre genres ont été
établi :Stemphylium et Ulocladium avec les mêmes
caractéristiques, ces genres compliquent la résolution
taxonomique. Kiessler (1912) a mis le synonyme à la fois A.tenuis
et Torula alternata avec A. alternata Kiessel. Wiltshire
(1933,1938) a proposé des critères pour les genres Alternaria
et Stemphylium, Ulocladium n'a pas été
officiellement reconnus. En 1964 Joly a proposé que ces espèces
atypiques classées comme Alternaria. Plusieurs descriptions et
critères morphologiques révisés de ces genres,
données lieu à un nombre croissant de nouvelles espèces
qui ont été résumés dans Simmons (2007), dans
lequel 275 espèces d'Alternaria ont été
reconnues.
II .3 Classification
Le genre Alternaria comprend plus de 250
espèces. Les méthodes traditionnelles d'identification des
espèces d'Alternaria sont basées sur les
caractéristiques morphologiques, des structures de reproduction et les
schémas de sporulation dans des conditions de culture
contrôlées. (Virginia, 2016)
Le genre Alternaria appartient à la
classification suivante :
· Phylum: Ascomycota
· Subdivision: Pezizomycotina
· Classe: Dothediomycetes,
· Ordre: Pleosporales
· Famille: Pleosporaceae.
· Genre : Alternaria
Alternaria appartient à la division
Deuteromycota avec plusieurs espèces. (Mamgain,
2013).
II .4 Caractéristiques du genre
II .4.1 Caractères culturaux
Les colonies sont de croissance rapide sur milieu Sabouraud
à 25-30°C. La
croissance est habituellement inhibée à
37°C, comme en présence de cycloheximide. La colonie, blanc-gris au
départ, devient rapidement foncée (vert foncé à
noire) au recto comme au verso. La texture est duveteuse à laineuse
(Pitt et Hocking, 1997).
Page 9
Partie Bibliographique
II .4.2 Caractères morphologique
Les hyphes, septés, sont ramifiés et
tardivement certains filaments sont pigmentés en brun. Les conidiophores
sont cloisonnés, bruns, septés, simples ou ramifiés, plus
ou moins droits ou flexueux (génicules) (Chabasse,
2002) .
Les conidies sont de couleur brune également,
très caractéristique du genre, organisées en chainette. Ce
sont des dictyospores : conidies piriformes, à la base élargie
avec des septa transversaux, obliques et longitudinaux en nombre variable. Leur
extrémité est constituée d'une partie
rétrécie plus ou moins longue appelée le « bec
». L'aspect global rappelle la forme d'une massue. Elles mesurent entre
50-100 um de long et 3-16 um de large (Calmes, 2011).

Figure 2 : Chaines des conidies
II .5 Alternaria pathogène des tomates
Alternaria est signalé depuis plusieurs
décennies comme pathogène des Solanacées surtout
l'espèce A.solani et a longtemps été
décrit comme affectant la tomate, l'aubergine, la pomme de terre, ainsi
que plusieurs membres de cette famille botanique (Blancard et al.,
2012). Ainsi, plusieurs espèces d'Alternaria
seraient inféodées à plus d'une soixantaine de
Solanacées (Bessadat, 2012).
II .5 .1 Alternaria à petite spore
II .5 .1.1 Alternaria Alternata
A. Alternata est un champignon filamenteux
cosmopolite ubiquiste. Communément isolé à partir de
plantes, de sols, de nourriture corrompue ainsi qu'à partir de l'air.
Elle présente des colonies veloutées parfois à centre
cotonné de couleur vert olivâtre à vert foncé.
Page 10
Partie Bibliographique
Les hyphes sont septées, les conidiophores sont bruns,
septés et elles ont souvent l'aspect de «zigzags».Ils portent
des conidies simples ou ramifiées. Les conidies présentent des
cloisonnements transversaux (1à8) et longitudinaux (0à3) avec une
taille de 6,559,8×4,2-16,5 ìm. (Bessadat et al.,
2014)
A alternata a été considéré
comme l'espèce principal productrice de mycotoxine, les autres membres
du genre tels que : A. solani, A.arborescence, A.
tenuissima capable aussi de produire ces contaminants toxiques dans leur
hôte.
A. alternata produit plusieurs toxines, dont la plus
importante est l'acide tenazonique (TA). (Logrieco et al.,
2003)

a
b
c
Figure 3: A. alternata, (a) colonie sur
gélose pomme de terre carotte (PCA) après 6 jours, (b)
modèle de sporulation à long chaînes, (c) conidies dans une
chaîne avec septa longitudinaux et transversaux (Ramezani et
al., 2019).
II .5 .1.2 Alternaria tenuissima
A. tenuissima, a des conidiophores solitaires ou
dans des groupes, simples, bruns, lisse et septés. Les conidies ont
été solitaires ou dans des chaînes courtes, la longueur des
conidies est habituellement plus courte avec une couleur brune à brune
doré, Les conidies présentent des cloisonnements transversaux
(4à9) et longitudinaux (0à4) avec une taille de 9,8-60,20 ×
8,6-15,5 ìm. (Bessadat et al ,2014)
Page 11
Partie Bibliographique
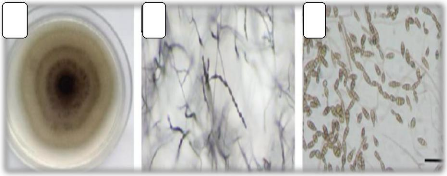
a
b
c
Figure 4: A.tenuissima, (a)colonie sur
PCA après 6 jours, (b) sporulation à courte chaine, (c)
chaînes conidiales et conidies (Ramezani et al.,
2019).
II .5 .1.3 Aletrnaria arborescens
A.arborescens appartient au groupe d'espèces
à petites spores au sein du genre Alternaria avec de couleur de
spore brune et de taille de 8,6-38,4 X 3,2-12,8 ìm ; les conidies
présentent des septa transversals varient de 1-6 et longitudinal ou
oblique varient de 0-3, la chaîne de conidies est apparue comme faible
touffes de branches bien ramifiées. (Bessadat et al
,2014)

a
b
c
Figure 5 : A. arborescens, (a) colonie
sur PCA après 6 jours, (b) modèle de sporulation à long
conidiophore primaire, (c) conidies avec des décorations de surface.
II .5 .2 Alternaria a grosse spore
II .5 .2.1 Alternaria solani
A. solani appartient au groupe d'espèces
à grosses spores au sein du genre Alternaria, les conidies
solitaires, supportées individuellement ou rarement en chaine de
Page 12
Partie Bibliographique
deux, sur des conidiophores simples et séptés
(Neergaard, 1945) elles mesurent entre 150 et 200 ìm de
long (de la base à l'extrémité du bec) (Simmons,
2007).

a
b
c
Figure 6: A.solani , (a) colonie sur
PCA après 6 jours, (b et c ) les conidies
(Zheng et al.
, 2015)
II .5 .2.2Alternaria tomatophila
A.tomatophila comme A. solani, appartient
aux espèces à grosse spores. Elle dispose d'un mycélium
cloisonné se mélanisant progressivement avec l'âge, elle
produite de courts conidiophores bruns sur lesquels ne se forme souvent qu'une
seule conidie (Simmons, 2000). Les conidies sont brunes,
pluricellulaires et très allongées. Elles possèdent un
long appendice hyalin (bec) (Figure 7), parfois
bifurqué et plus long que le corps de la spore, qui mesure entre 120 et
300 ìm de long.
A.tomatophila est le pathogène le plus commun
lié à la brûlure foliaire de la tomate.
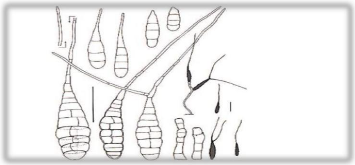
Figure 7: Conidies et conidiophores de la
souche A. tomatophila . (Simmons, 2007)
II .6.Alternariose
L'Alternariose de la tomate, causée par les
espèces d'Alternaria, est une des principales maladies de la
tomate pouvant affecter toutes les parties de la plantes et tous les stades de
développement.
Page 13
Partie Bibliographique
Elle est caractérisée par l'apparition des
tâches noires arrondies à la surface des feuilles, des tiges et
des fruits. Ces tâches sont caractérisées par une
croissance en anneaux concentriques, donnant aux lésions une forme de
cible. Le pathogène passe la mauvaise saison sur les débris de
culture. Les infections sont dues à la projection des spores sur la
plante par le vent, la pluie où directement par contact entre les
feuilles et le sol (Edouard, 2010).
II .6.1 Symptômes
II .6.1.1 Sur feuille
L'alternariose apparaît sous forme des taches
concentriques brunes foncés et bien délimitées de tailles
variables, la feuille commence à pourrir ; L'infection par la suite
s'étend à toute la feuille. La plante finit par perdre ses
feuilles (Michel, 1991).

Figure 8 : Symptômes de l'aternariose sur
la foliole
II .6.1.2 Sur fruit
Les taches sur le fruit se produisent d'abord à son
forme de zones creuses avec des anneaux concentriques (Figure 9). De cette
zone, le champignon se propage et éventuellement, la pourriture couvert
la moitié supérieure du fruit. (Glasscock, 1944; Jones et
al., 1997).

Figure 9 : Symptômes de l'aternariose sur
fruit
Page 14
Partie Bibliographique
II .6.1.3 Sur tiges et collets
Les tiges attaquées par l'Alternaria
présentent des plages superficiellement colorées en brun,
qui s'agrandissent avec le développement de la maladie, puis le
desséchement de la tige peut entraîner sa mort ou celle de toute
la plante .

a b
Figure 10 : Lésions provoquées par
A. tomatophila et A.alternata; a sur
tige, b sur collet
(Bessadat, 2014)
II .7 Cycle infectieux
L'alternariose est favorisé par un cycle infectieux
similaire pour toutes les espèces d'Alternaria, responsable de
cette maladie (Farrar et al., 2004). Ce cycle est
devisé en plusieurs stades : conservation, pénétration et
invasion, sporulation puis dissémination. (Figure 11)
II .7. 1 Conservation, source d'inoculum
L'Alternaria peut se conserver dans les
résidus de culture, les sols contaminés et les tubercules
infectés durant plusieurs années (Christine,
2000). Les chlamydospores peuvent également servir de structure
de survie (Basu, 1974). Elle serait aussi capable de se
maintenir d'une saison à l'autre sur d'autres solanacées comme la
tomate, l'aubergine, poivron (Neegaard, 1945 ; Ellis et Gibson, 1975 ;
Blancard et al., 2012).
II .7. 2 Pénétration et invasion
Une fois les spores d'Alternaria sont en contact
avec les cellules végétales, elles sont capables de germer et
produisent un ou plusieurs tubes germinatifs, la pénétration dans
les tissus végétaux se fait soit directement à travers les
stomates ou les blessures (Agrios, 2005) ou soit par
pénétration enzymatique, cette stratégie est la plus
évidente chez les Alternaria. La colonisation de l'hôte
est facilitée par des enzymes (cellulase,
Page 15
Partie Bibliographique
pectinase,....etc). La pénétration peut se
produire à des températures entre 10°C et 25°C
(Sherf et MacNab, 1986).
II .7. 3 Sporulation et dissémination
Sur des tissus colonisés, quand les conditions
climatiques sont favorable, Alternaria ne perde pas à produire
des conidiophores, Les spores sont disséminées par le vent, la
pluie et les insectes ; les conidies produites assurent des contaminations
secondaires et par la suite plusieurs cycles parasitaires peuvent avoir lieu
dans la culture (Messiaen, 1991)
Page 16
Partie Bibliographique
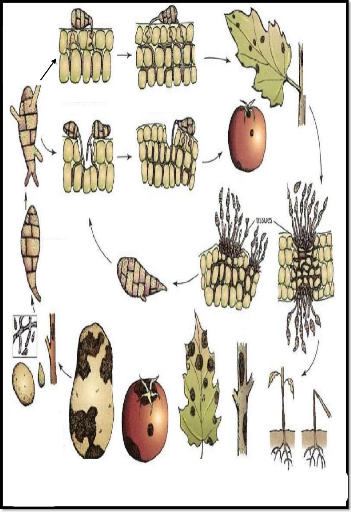
Germination
des conidies
les conidies et le mycélium passent
l'hiver dans une plante infectée, des débris sur
les graines, des tubercules,etc
Pénétration à travers la plaie
Pénétration directe
Conidie
Lésions sur tubercule de pomme
Les conidies réinfectent les plantes
Lésion sur fruit de tomate
Invasion de la feuille
Invasion de la tige ou du fruit
Lésions sur feuille de tomate
Lésions sur tige
Production des conidies sur les tissus infectés
Dépérissement du collet
Lésion précoce sur feuille, tige et fruit
Figure 11 : Développement et
symptômes de maladies causées par Alternaria sp.
(Agrios, 2005)
Page 17
Partie bibliographique
Chapitre III : les huiles essentielles
III.1.Aromathérapie
L'aromathérapie est l'utilisation médicale des
extraits aromatiques des plantes. Ce terme a été inventé
par René Maurice Gattefossé, pharmacien français dans les
années 1910. Ce mot vient du latin « aroma »
signifiant odeur et du grec « therapeia » signifiant
traitement. Il s'agit donc de soigner par les huiles
essentielles (Pierron, 2014).
Tous les êtres vivants ont un métabolisme
primaire qui fournit les molécules de base (acides nucléiques,
lipides, protéines, acides aminés et glucides). Les plantes
produisent, en plus, un grand nombre de composés qui ne sont pas issus
directement lors de la photosynthèse, mais résultent des
réactions chimiques ultérieures. Ces composés sont
appelés métabolites secondaires. De nos jours, un grand nombre de
ces composés sont utilisés en médecine moderne et une
majorité de ceux-ci le sont selon leur usage traditionnel
(Mohammedi, 2013).
Nous citerons ci-dessous un groupe important
considéré comme une source de molécules biologiquement
actives.
III.2.Généralités sur les huiles
essentielles
Les HE sont des substances volatiles non grasses
sécrétées par des plantes aromatiques. (Gherib,
2009). Le terme «huile» vient de leur caractère
hydrophobe et de leur propriété de se solubiliser dans les
graisses, alors que le terme «essentielle» fait
référence à l'odeur dégagée par la plante
productrice. (El Mansouri, 2013). Elles peuvent être
extraite de différentes parties d'un végétal : les
feuilles (ex : l'eucalyptus), les fleurs (ex : la camomille), l'écorce
(ex : la cannelle), le bois (ex : le cèdre), le zeste (ex : le citron)
et bien d'autres encore : les graines, les baies, les fruits, le bulbe...
(Pierron, 2014) obtenu par entrainement à la vapeur ou
par hydrodistillation. (El Haci, 2015)
Les huiles essentielles (HE) ont été
utilisées depuis des millénaires pour leurs vertus
thérapeutiques (antiseptique, antibactérienne, antivirale,
analgésique, sédative, anti inflammatoire ...) et ont
été largement utilisées en tant que fragrance et le sont
toujours. (El Haci, 2015)
Actuellement, le règne végétal nous
offre une grande diversité permettant d'obtenir plus de 3000 HE, parmi
lesquelles, environ 300 sont importantes d'un point de vue commercial,
spécialement dans l'industrie pharmaceutique, l'agroalimentaire, le
cosmétique et la parfumerie (Bakkali et al.,
2008).
Page 18
Partie bibliographique
Une HE est un Produit odorant, généralement de
composition complexe, obtenue à partir d'une matière
première végétale botaniquement définie, soit par
entraînement à la vapeur d'eau, soit par distillation
sèche, soit par un procédé mécanique
approprié sans chauffage. L'huile essentielle est le plus souvent
séparée de la phase aqueuse par un procédé physique
n'entraînant pas de changement significatif de sa composition.
(Filatre, 2011). La quantité d'huile essentielle
contenue dans les plantes est toujours faible, parfois très faible,
voire infime. (Pierron, 2014)
Dans la nature, les HE semblent jouer un rôle dans la
protection des végétaux contre les agressions extérieurs
causées par les microorganismes, contre les insectes et même les
animaux herbivores (Bakkali et al., 2008). Elles ont
aussi un rôle dans l'attraction des insectes pour la dispersion des
grains de pollen et des graines de certaines plantes (El Haci, 2015).
les huiles essentielles ou leurs composés actifs pourraient
également être employés comme agents de protection contre
les champignons phytopathogènes, et les microorganismes envahissant les
denrées alimentaires. (Mohammedi, 2013).
III.3 Chimie des huiles essentielles
Les HE sont des mélanges complexes et
éminemment variables de constituants qui appartiennent de façon
quasi exclusive à deux groupes caractérisés par des
origines biogénétiques distinctes : le groupe des terpènes
et des terpénoides représentant la classe la plus importante
d'une part et celui des composés aromatiques dérivés de
phenylpropane, beaucoup moins fréquent, d'autre part (Brunton,
2009).
III.3.1 Terpènes et Terpénoides
Les terpènes représentent un groupe d'un
intérêt chimique considérable, les terpènes ont un
caractère commun, ils sont tous formés par la réunion
d'unité isoprénique figure (12)

Figure 12: Formule chimique de
l'isoprène méthyl-2-buta-1,3-diène (Benayad, 2008)
On définit alors les monoterpènes (2 unités :
C10), les sesquiterpènes (3unités : C15), les diterpènes
(4 unités : 0) , les triterpènes (6 unités : C30),..etc,
Le terpène qui possède un oxygène est un
terpénoïde.
Page 19
Partie bibliographique
III.3.2 Composés aromatiques
Les composés aromatiques des HE sont principalement
des dérivés du phénylpropane C6-C3 ont une
biogenèse différente de celle des terpènes, On peut citer
l'acide et l'aldéhyde cinnamique (HE de cannelle), l'eugénol (HE
de girofle), le carvacrol (HE d'origan), qui sont les principaux membres de
cette famille.
Les acides organiques, les cétones de faible poids
moléculaire et les coumarines volatiles entrent également en
faible proportion dans la constitution des HE (El Mansouri,
2013).
III.4 Caractéristiques et
propriétés physiques
Les huiles essentielles sont constituées de
molécules aromatiques de très faible masse moléculaire.
Elles sont très inflammables et très odorantes, liquides à
température ambiante, les HE se volatilisent quand elles sont
exposées à l'air. Elles ne sont que très rarement
colorées. Leur densité est en général
inférieure à celle de l'eau sauf les huiles essentielles de
sassafras, de girofle et de cannelle. Elles ont un indice de réfraction
élevé et la plupart dévient la lumière
polarisée (optiquement active) (Bouguerra, 2012).
Elles ont parfois un toucher gras ou huileux mais ce ne sont
pas des corps gras. Par évaporation, peuvent retourner à
l'état de vapeur sans laisser des traces, ce qui n'est pas le cas des
huiles fixes (olive, tournesol ...) qui ne sont pas volatiles et laissent sur
le papier une trace grasse persistante. (Bouguerra, 2012)
Les huiles essentielles ne sont que très peu solubles
ou pas du tout dans l'eau. Entraînables à la vapeur d'eau, elles
se retrouvent dans le protoplasme sous forme d'émulsion plus ou moins
stable qui tende à se collecter en gouttelettes de grosse taille
(Benayad, 2008).
III.5.Méthodes d'extraction
L'obtention des HE se fait actuellement par plusieurs
méthodes d'extraction. Certains auteurs les classifient en deux groupes
: les méthodes conventionnelles, dites classiques ; hydrodistilation,
entrainement à la vapeur, expression, enfleurage ,et les méthodes
innovantes assisté par micro-onde ou par ultra sons (Ouis,
2015)
Partie bibliographique
Entrainement à la vapeur
Expression Hydrodistilation
Enfleurage
Solvant organique
Huile essentielle
Micro-onde Ultra-son
Figure 13 : Méthodes d'extraction des
HE
III.5.1 Méthodes conventionnelles III.5.1.1
Hydrodistillation
L'hydrodistillation est la méthode la plus simple et
la plus ancienne, utilisée depuis des siècles pour l'extraction
des HE. Historiquement, Avicenne (980-1037) a été le premier
à développer l'extraction à travers l'alambic. Il a
extrait la première HE pure de la rose (El Haci, 2015).
La plante est mise en contact avec de l'eau dans un ballon lors d'une
extraction au laboratoire ou dans un alambic industriel. Le tout est
porté à l' ébullition. Les vapeurs sont condensées
dans un réfrigérant et les huiles essentielles se séparent
de l'eau par différence de densité (Gherib,
2009).
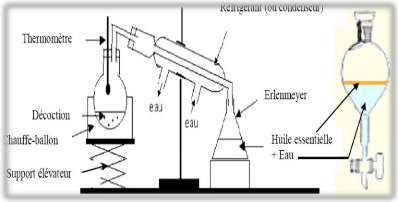
Figure 14: Appareillage utilisé pour
l'hydrodistillation (Lagunez, 2006).
Page 20
Page 21
Partie bibliographique
III.5.1.2 Extraction par entraînement à
la vapeur d'eau
Cette méthode est l'une des méthodes les plus
utilisées pour l'obtention des HE. Son Príncipe est le même
que celui de l'hydrodistillation sauf qu'il n'y a pas de contact direct entre
la matière végétale et l'eau (Masango,
2005).
III.5.1.3 Pressage à froid
Le pressage à froid est une méthode
traditionnelle, essentiellement, utilisée pour extraire les HE à
partir des agrumes. L'expression à froid consiste à rompre ou
dilacérer les parois des sacs oléifères contenus dans le
mésocarpe situé juste sous l'écorce de fruit. Les HE sont
obtenues mécaniquement par pression à froid qui donne une
émulsion aqueuse. L'HE est ensuite récupérée par
centrifugation (Ferhat et al., 2007).
III.5.1.4 Enfleurage
L'enfleurage est une ancienne méthode utilisée
pour l'extraction des plantes aromatiques destinées surtout à la
parfumerie. Le principe consiste à placer les fleurs odorantes dans la
graisse, afin de laisser les arômes y pénétrer. Une fois
saturée, celle-ci est ensuite lavée à l'alcool pour
extraire les composés odorants. L'alcool obtenu est ensuite
évaporé pour donner l'absolue. Cette méthode est peu
utilisée de nos jours à cause de l'utilisation de la graisse
animale et du coût de production élevé. Elle a
été remplacée par l'extraction aux solvants
(Mnayer, 2014)
III.5.1.5 Extraction par solvant organique
Certaines HE ont une densité voisine de l'eau et le
procédé par distillation à la vapeur d'eau ne peut
être utilisé dans ce cas. Le principe consiste à faire
macérer la plante dans le solvant afin de faire passer les substances
odorantes dans le solvant (Ouis, 2015).
III.5.2 Méthodes innovantes
III.5.2.1 Extraction par micro-onde
Extraction par micro-onde consiste à chauffer
l'extractant (eau ou solvant organique) mis en contact avec le matériel
végétal sous l'énergie micro-onde ce qui permet un
chauffage homogène. Ce nouveau procédé permet des gains
considérables de temps et d'énergie (Ericsson et al.,
2000).
III.5.2.2Extraction par les ultrasons
Le matériel végétal est mis en contacte
avec le solvant (eau ou solvant organique) et en même temps soumis
à l'action des ondes ultrasoniques, ces derniers induisent des
Page 22
Partie bibliographique
vibrations mécaniques au niveau des membranes des
poches sécrétrices induisant une libération rapide des
gouttelettes d'HE (Romanik et al., 2007) .
III.6 Analyses des huiles essentielles
Deux types d'analyse qui ont pour but d'identifier les
différents constituants d'une huile essentielle afin d'en
connaître la composition chimique: la chromatographie en phase gazeuse GC
et la chromatographie en phase gazeuse couplée à la spectroscopie
de masse GC/MS.
La chromatographie en phase gazeuse GC est utilisée
pour l'analyse quantitative et la chromatographie en phase gazeuse
couplée à la spectroscopie de masse GC/MS pour l'analyse
qualitative. La GC et la GC/MS permettent, en plus de connaître
très exactement la composition chimique, la recherche
d'éventuelles traces de produits indésirables tels des pesticides
ou des produits chimiques ajoutés (Renata et al., 2006
) .
III.7.Rendement
Le rendement de la distillation est donc limité: de
plusieurs kilogrammes à plusieurs tonnes d'organes producteurs sont
nécessaires pour obtenir un kilogramme d'HE. Le volume de
matériel à récolter est souvent important, ce qui explique
les coûts élevés de certaines HE, notamment la rose de
Damas ou le néroli bigaradier (Pierron, 2014).
III.8 Conservation des huiles essentielles
Les huiles essentielles sont des substances sensibles et
très délicates, ce qui rend leur conservation difficile et
obligatoire dans le but de limiter les risques de dégradation, ces
dégradations peuvent modifier leurs propriétés si elles ne
sont pas enfermées dans des flacons opaques à l'abri de la
chaleur (une température de 4°C) et de la lumière
(Valnet, 2000).
III.9 Action des huiles essentielles contre les
champignons
Plusieurs huiles essentielles offrent un espoir
illimité et grand potentiel à l'égard des problèmes
de la résistance des micro-organismes aux antibiotiques, connu de
façon empirique depuis des siècles, leurs efficacités
anti-infectieuses a été scientifiquement démontré
in vitro (Oussalah et al, 2007) et in
vivo (Chami et al, 2004).
L'étude de l'effet fongicide et fongistatique des HE
vis-à-vis des champignons pathogènes a fait l'objet de plusieurs
travaux. L'action antifongique des huiles essentielles est due à une
augmentation de la perméabilité de la membrane plasmique suivie
d'une rupture de celle-ci entraînant une fuite du contenu cytoplasmique
(Gherib, 2009). Les groupes moléculaires avec les plus
puissantes actions
Page 23
Partie bibliographique
antifongiques sont les groupes fonctionnels des composés
majoritaires (alcools, phénols, composés terpéniques et
cétoniques) et à leurs effets synergiques (Buert,
2004).
III.10 Plantes étudiées
III.10.1 Pulicaria mauritanica
P. mauritanica est une plante aromatique et
endémique qui pousse à l'état sauvage dans le sud-est du
Maroc et en Algérie.
Selon Hussein et al., 2017, le genre
Pulicaria comprend 100 espèces largement diffusées en
Europe, l'Afrique du nord et en Asie. Pulicaria est un genre qui
regroupe les plantes à fleurs de la famille des Asteraceae.
· Nom scientifique : Pulicaria
mauritanica
· Nom vernaculaire :
ÉíÑíÇÓ ÉJíJ.Q

Figure 16: Photo de Pulicaria mauritanica
(Gherib, 2014)
D'après Quezel et Santa (1963) et
Dupont (2004) la classification qu'occupe Pulicaria
mauritanica est la suivante :
· Embranchement: Phanérogames ou
Spermaphytes.
· Sous-embranchement: Angiospermes.
· Classe: Eudicots.
· Sous classe: Asteridées
· Ordre: Asterales.
· Famille: Astéracées.
· Genre:
Pulicaria.
· Espèce: Pulicaria
mauritanica.
Page 24
Partie bibliographique
III.10.1.1 Description botanique
Pulicaria mauritanica est une espèce
endémique au Maroc et en Algérie, c'est une espèce
très odorante à odeur camphrée, elle est velue ou laineuse
avec des feuilles radiales plus petites (5-6 cm) les tiges sont dressées
et rameuses, portant des feuilles à bord ondulé, les capitules
solitaires sont fixés par de longs pédoncules épaissis au
sommet. Les akènes sont oblongs, orangés, brillants et à
cotes blanches et marquées (Gherib, 2014).
III.10.1.2 Composition chimique
Les études phytochimiques du genre Pulicaria
ont fait l'objet de plusieurs travaux rapportés par Liu et
al.en 2010. Ces auteurs
révèlent que les espèces de Pulicaria contiennent
une grande variété de composés, tel que les
dérivés phénoliques, les monoterpènes, les
sesquitérpènes, les diterpènes, les triterpènes,
les stéroides et les flavonoïdes.
La caractérisation des huiles essentielles du genre
Pulicaria a fait l'objet de plusieurs travaux, permettant l'existence
d'une variabilité chimique de cette huile essentielle
(wayertahel et al., 1998, Hambali et al., 2005 ; El
Kamali et al., 2009 ;El Abed et al.,2010 ; Ravendach et
al., 2011 ; Gristofari et al., 2011)
En revanche la caractérisation de l'HE de P.
mauritanica a fait l'objet de très peu d'étude.
Gattefossé et Igolen en 1945 ont
rapporté que le carvotanacétone et le composé majoritaire
de l'HE de P.mauritanica avec un pourcentage de l'ordre de 81.0%, une
deuxième étude a été réalisé par
Gristofari et al. en 2011 sur
l'huile essentielle de cette plante récoltée dans quatre stations
différentes au Maroc, révèle également une grande
richesse en carvotanacétone (79.99%, 92.13%), suivi de linalol
(0.4%-2.1%) et de carvacrol (0.4%-1.2%). Ces auteurs ont étudié
aussi l'activité antifongique de ces huiles vis-à-vis trois
champignons phytopathogènes (Znini et al.,
2013).
III.10.1.3 Propriétés
thérapeutiques
Pulicaria mauritanica Coss. connue sous le
nom vernaculaire de « mariwa sfayrya», elle est
considérée comme une plante médicinale. Dans la
région de Naama, elle est utilisée dans le traitement des
troubles intestinaux, des maux de tète par fumigation aussi
donnée aux femmes après l'accouchement (Gherib,
2014).
Au Maroc cette plante porte plusieurs noms vernaculaires
"Bamghar" et "Ifenzi oudaden" la décoction et la macération de
ses feuilles et de ses fleurs est utilisée pour traiter les troubles
digestifs et circulatoires (Hamadouch et al.,
2018).
Page 25
Partie bibliographique
III.10.2 Micromeria debilis
C'est une plante endémique en Algerie et en Maroc,
appartient à la famille des Lamiaceae également connue comme
Satureja briquetii Maire.
· Nom scientifique : Micromeria
debilis
· Nom vernaculaire:
ÉÏÇíÕáÇ
ÚÇäÚä

Figure 17: Photo de Micromeria
debilis
D'après Quezel et Santa (1963) la
classification qu'occupe Micromeria debilis est la suivante:
· Règne : Plantae
· Division : Magnoliophyta
· Classe : Magnoliopsida
· Ordre : Lamiales
· Famille : Lamiaceae
· Genre : Micromeria
· Espèce : Micromeria debilis
III.10.2.1 Description botanique
Le genre Micromeria contient environ
soixante-dix(70) espèces avec trente-deux(32) sous-espèces.
M. debilis est un petit buisson avec des tiges très
étroites et des feuilles rhomboïdes généralement de
couleur pourpre et de revers rougeâtre. Le calice est
caractérisé par des très court dents triangulaires,
hérissées, de poils appressés identique à celle du
reste de la plante. (Quezel et Santa, 1963)
Page 26
Partie bibliographique
III.10.2.2 Composition chimique
La caractérisation de l'HE de M. debilis a fait
l'objet de très peu d'étude. Gherib et al.
en 2016 ont montrés que les
monoterpènes sont les composants prédominants de l'HE de M.
debilis avec un pourcentage de l'ordre de 54,6%, et sont principalement
représentés par les â-pinène (19,3%).
Géranial (8,7%), linalol (6,5%) et Neral (5.4%).
III.10.2.3 Propriétés
thérapeutiques
Les espèces de Micromeria ont
généralement de nombreuses activités pharmacologiques, y
compris anesthésique, antiseptique et antirhumatismal. Elles sont
utilisées contre les maux de tète, les douleurs abdominales, les
infections cutanées, et les problèmes de l'hypertension en raison
des principaux constituants de son huile essentielles (Gulluce et
al., 2004). L'HE et les extraits des espèces de
Micromeria ont une activité biologique antibactérienne
et antifongique (Marin et al., 2015 ; Bakkour et al.,
2012).
PARTIE
EXPERIMENTALE

Page 28
Partie expérimentale
Chapitre I : Matériels et méthodes
I.1 Matériel fongique
I.1.1 Choix des souches
Les souches fongiques ont été choisies parce
qu'elles ont été révélées fortement
virulentes par Mme Yakoubi sur deux variétés de plante de
tomate.
I.1.2 Origine des souches
Les isolats d'Alternaria sp. utilisées pour
cette étude proviennent de différentes wilaya d'Algérie
(Oran, Mostaganem, Relizane, et Ain Temouchent). Ces isolats ont
été isolés au sein de laboratoire de microbiologie
appliquée (université d'Oran 1 Ahmed Ben Bella) par Mme Yakoubi
M. à partir de différentes parties de la plante de tomate (tige,
feuille et fruit) présentant les symptômes d'alternariose. Ces
isolats sont représentés dans le tableau 2.
Tableau 2 : Origine des isolats
d'Alternaria sp.
Code d'isolats
|
Date de prélèvement
|
Lieu de prélèvement
|
Partie d'isolement
|
A1
|
18/03/2015
|
Mostaganem (Stidia)
|
Fruit
|
A10
|
18/03/2015
|
Mostaganem (Ouriah)
|
Fruit
|
A11
|
18/03/2015
|
Mostaganem(Stidia)
|
Fruit
|
A18
|
18/03/2015
|
Mostaganem (Ouriah)
|
Fruit
|
A37
|
25/03/2015
|
Oran (Sidi Maarouf)
|
Feuille
|
A42
|
25/03/2015
|
Oran (Sidi Maarouf)
|
Feuille
|
A45
|
24/04/2015
|
Oran (Bousfer)
|
Feuille
|
A51
|
10/04/2015
|
Ain Temouchent
|
Feuille
|
A57
|
24/04/2015
|
Oran (Bousfer)
|
Feuille
|
AT01
|
18/03/2015
|
Mostaganem (Stidia)
|
Tige
|
AT04
|
18/03/2015
|
Mostaganem(Ouriah)
|
Tige
|
|
I.1.3 Repiquage des souches
Afin d'obtenir des cultures fongiques jeunes ; des fragments
mycéliens de 5mm2 des isolats d'Alternaria sont
découpés à l'anse à partir de la marge des colonies
puis transférées sur une nouvelle boite contenant le milieu PDA
(Pomme Dextrose Agar),les boites sont ensuite incubées à 25#177;2
°C pendant 7 à 10 jours.
Page 29
Partie expérimentale
I.1.4 Induction de la sporulation
Dans le cas des espèces d'Alternaria qui
présentent une faible sporulation ; les conidies sont obtenues
après induction de la sporulation selon la méthode décrite
par (Lyudmila et al., 2005) avec quelque modification
: le mycélium des colonies (âgés de 10 à 14 jours)
cultivé sur milieu PCA est blessé à l'aide d'un scalpel
stérile, puis les boites de pétri sont placées au
réfrigérateur (+5°C) pendant 12 heures puis exposées
à la lumière du soleil pendant 120 min, elles sont ensuite
transférés à 25#177;2°C sous l'obscurité
continu pendant 48h.
Figure 17 : Photos représentant les
étapes de l'induction de la sporulation
I.1.5 Conservation des isolats
La conservation des isolats d'Alternaria se fait
dans des tubes à essai contenant le milieu PDA incliné, puis mis
à incuber à 25#177;2°C, âpres 7 jours les isolats sont
transférés à 4°C et ceci pour des utilisations
ultérieures.
I.1.6 Identification des isolats I.1.6.1 Etude
macroscopique
L'étude macroscopique des isolats d'Alternaria
se fait à l'oeil nu, elle est basée sur
la description morphologique des colonies cultivées sur
milieu PDA et incubées à 25#177;2°C
pendant 7 à 10 jours. Les critères morpho-culturaux
retenus pour la caractérisation des
colonies selon Botton et al., 1990
sont :
? L'aspect du mycélium
? La vitesse de la croissance mycélienne
? La couleur des colonies (avers et revers)
? Les marges (couleur et forme)
? La pigmentation de milieu.
Partie expérimentale
I.1.6.2 Etude microscopique
Cette étude se fait par l'observation des isolats au
microscope optique aux differents grossissement (Gx10 , Gx40, et par l'huile
à immersion à (Gx100). Ce type d'identification est fondé
essentiellement sur l'étude morphologique du mycelium (absence ou
presence de cloison, couleur ,...etc) et des spores ( forme, couleur, taille,
nombre de septa, formation des chaines de spores)
Les préparations microscopiques ont été
réalisées par deux méthodes :
A l'etat frais
La manipulation consiste à mettre un petit fragement
mycelien sur la lame propre placée entre deux becs bunsen en presence
d'une goutte de liquide de montage (lactopphenol, bleu de methylene), puis le
recouvrir délicatement d'une lamelle en évitant de créer
des bulles d'air des débordements.
Par microculture (culture sur lame ou méthode
de carré de gelose)
Cette technique consiste à ensemencer les spores des
moisissures sur des petits carrés de PDA (15mmx15mm) de 2 mm d'epaisseur
placés entre lames et lamelles. Les spores sont ensemencés sur
les limites périphériques du milieu pour fournir un potentiel
d'oxygène élevé afin qu'elles puissent germer. L'ensemble
est conditionné dans une chambre humidifiées, et après 3
jours d'incubation à 25#177;2°C, les lamelles aux quelles
s'adhèrent le mycélium sont transférées sur d'autre
lames stériles contenant quelques gouttes de lactophenol pour
l'observation microscopique aux grossissements x10, x40 et x100.
Les observations sont comparées aux clés
d'identification propre à chaque espèce (Simmons,
2007)

Page 30
Figure 18 : Photos représentant la
méthode de microculture
Page 31
Partie expérimentale
I.2 Matériel végétal
Nous avons utilisé la partie aérienne de
Pulicaria mauritanica et Micromeria debilis pour extraire
leurs huiles essentielles, et tester leurs activités antifongiques sur
Dix (10) souches du genre Alternaria.
I.2.1 Récolte de matériel
végétal
Le matériel végétal est
récolté dans la wilaya de Naama le mois de Novembre 2018.et le
mois de Février 2019 dans la région d'Ain Sefra : Djbel Mekter
pour Pulicaria mauritanica et Mograr pour Micromeria
debilis
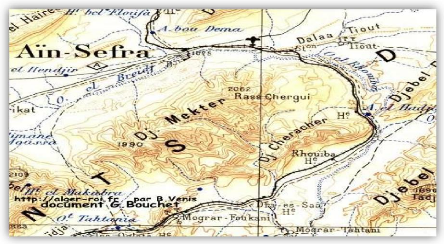
Figure 19 : Situation géographique des lieux des
prélèvements I.2.2 Identification botanique
Les deux espèces ont été
identifiées au sein du centre universitaire Salhi Ahmed de Naama
exactement dans le laboratoire de microbiologie N01 par Mr Maarouf
A. (professeur au C.U.Naama).
I.2.3 Préparation des échantillons
Le matériel végétal
récolté est ensuite séché à l'abri de la
température et la lumière de soleil afin de préserver au
maximum l'intégrité des molécules pendant huit (08) jours
en moyenne.
Après l'opération de séchage, les
parties destinées particulièrement tiges, feuilles et fleurs sont
ensuite conservées dans des sacs en papier.
Page 32
Partie expérimentale
I.2.4 Extraction de l'huile essentielle
La technique utilisée pour l'extraction de l'huile
essentielle est la technique conventionnelle par hydrodistillation (water
distillation), l'extraction a été faite par un montage de type
Clevenger. Le principe de cette méthode consiste à exploiter la
volatilité des constituants de l'HE. Le matériel
végétal est immergé directement dans l'eau
distillée 50 g de matériel végétal sec (partie
aérienne de la plante) est introduit dans un ballon de 01litres
imprégné d'eau distillée, l'ensemble est porté
à l'ébullition pendant 2 à 3 heures. Les composés
volatils entraînés par la vapeur d'eau dégagée sont
condensés au niveau d'un réfrigérant (Bettaieb R.
et al. ,2017) et puis sont récupérées.
Après décantation l'huile essentielle obtenue est conservé
à une température de 4°C dans des tubes ombrés et
bien scellés (Msaada et al., 2012)( Bettaieb R. et
al. ,2017) .

Figure 20 : Montage de type Clevenger
I.2.5 Calcul du rendement en huile essentielle
Le rendement est défini comme étant le rapport
entre la masse de l'huile essentielle obtenue et la masse du matériel
végétal utilisé, le rendement est exprimé en
pourcentage (%) et calculé par la formule suivante :
RHE% = (mh / mv) x100
RITE = rendement en huile essentielle en %.
mh =masse d'huiles essentielles
récupérées en gramme (g).
mv = masse d'essai du matériel
végétal en gramme (g) (Selvakumar et al.,
2012).
Page 33
Partie expérimentale
I .3 Activité antifongique
I .3.1 Effet des huiles essentielles sur la croissance
mycélienne
L'effet antifongique des huiles essentielles sur les isolats
d'Alternaria, est évalué selon la méthode de
contact directe sur gélose décrite par Fandoham
(2004). Différentes concentrations en huile essentielles 0.8
uL/mL, 0.95 uL/mL , 1.1 uL/mL sont obtenues par addition de 12, 14.25 et 16.5
uL d'huile essentielle à 15 mL de milieu PDA en surfusion à
450C contenant Tween 20 (Sigma 0,5%, v/v). Le mélange (huile
essentielle+PDA+ Tween 20) est ensuite homogénéisé au
vortex puis coulée dans des boites de pétri de 90 mm de
diamètre.
Deux concentrations ont été utilisées
pour l'HE de M.debilis (0.95 uL/mL, 1.1 uL/mL).
Des disques mycéliens de 6 mm de diamètre
prélevés à partir de la périphérie des
colonies fongiques âgées de 10 jours, sont déposés
aseptiquement au centre des boites de pétri contenant le milieu PDA
additionné à différentes concentrations d'huile
essentielle avec trois répétitions pour chaque isolat et chaque
concentration. Les boites de pétri témoins contiennent 15 ml de
milieu PDA additionné au Tween 20 (sans huile essentielle). Les souches
testées sont ensuite incubées à 250C pendant 10
jours.
La mesure de la croissance mycélienne est
effectuée chaque jour à partir du 3éme jusqu'au
10éme jour d'incubation par mesure des deux diamètres
perpendiculaires des colonies.
La CMI (concentration minimale inhibitrice) est
déterminée après 10 jours d'incubation et correspond
à la plus faible concentration pour laquelle nous n'observons pas de
croissance fongique à l'oeil nu (Remmal et al., 1993,
Kumar et al., 2008).
Page 34
Partie expérimentale

A1
A10
A18
A37
A42
A45
A51
A57
AT1
AT4
Témoin
Incubation à 25 °C pendant 10 jours
0.8 ul
Milieu de culture PDA+Tween 20
+ HE ul
0.95 ul
1.1ul
Figure 21 : Protocole expérimental de
l'activité antifongique
I .3.2 Évaluation de l'indice antifongique
L'indice antifongique (pourcentage d'inhibition) est
déterminé par la formule suivante (Kasmi et al.,
2018) :
IAF(%) = [(X- Xi) / X] ×100
Avec :
X : Estimation de la croissance
mycélienne ou de la sporulation chez le témoin - diamètre
de disque initial (en absence d'huile essentielle).
Xi : Estimation de la croissance
mycélienne ou de la sporulation chez l'essai - diamètre de disque
initial (en présence d'huile essentielle)
Page 35
Partie expérimentale
I .3.3 Effet des huiles essentielles sur la
sporulation
Les colonies fongiques âgées de 10 jours, ayant
servis pour l'estimation de la croissance mycélienne ont
été utilisées pour l'évaluation du taux de la
sporulation (Mebarki, 2015).
Les spores d'Alternaria.sp. sont
récupérées aseptiquement à la surface des colonies
à l'aide d'une pipette pasteur recourbée par addition de 5 ml
d'eau distillée stérile; après agitation au vortex / 30
seconde, la suspension sporale est filtrée à travers une double
mousline stérile puis récupérée dans des tubes
stériles. Le taux des spores est déterminé à l'aide
d'une cellule malassez.
Les résultats sont exprimés en nombre de spore/
ml de suspension sporale.

Figure 22: Photo représente la
détermination du taux d'inhibition de la sporulation
I.3.4 Détermination de la vitesse de la croissance
mycélienne
Selon (Cahagnier et Molard, 1998) la vitesse
de la croissance mycélienne de chaque concentration est
déterminée par la formule suivante :
VC= [D1/Te1]+[(D2-D1)/Te2]+ [(D3-D2)/Te3]+... +
[(Dn-Dn-1)/Ten]
D = Diamètre de la zone de croissance du
chaque jour (mm). Te = Temps d'incubation (heure).
Page 36
Partie expérimentale
Chapitre II : Résultats et discussions
II .1 Matériel fongique
II .1.1 Identification des isolats
L'Identification des espèces d'Alternaria a
été réalisé selon les clés de
détermination de (Simmons, 2007 ; Rodrigues et al.,
2010 et Mirkarimi et al ,2013) en se basant sur les
caractères macroscopiques des colonies (aspect, couleur, les marges,
....etc) et sur les caractères microscopiques du mycélium et des
spores (forme des spores, enchainement des spores, la couleur, la taille
....etc.)
II .1.1.1Etude macroscopique
L'étude macroscopique des 10 isolats d'Alternaria
sp sur milieu PDA après sept (7) jours d'incubation à
25°C, a révélé une variabilité
considérable entre les caractères morphologiques des isolats
(tableau 3). Les isolats présentent une couleur de colonie varie du
clair au foncé avec une teinte vert olive à grisâtre, la
majorité des colonies ont un aspect duveteux ou cotonneux avec des
bordures régulières ou irrégulières.
Ces observations sont en accord avec ceux obtenus par
(Mirkarimi et al., 2013) qui avaient reporté
que la couleur des colonies d'A.tenuissima est vert olive. De
même (Zheng et al., 2015) ont observé un
aspect cotonneux pour A.tenuissima avec une couleur vert
grisâtre a verdâtre, aussi (Kumari et al., 2009)
ont observé différents isolats d'A .alternata,
les colonies avaient une texture cotonneuse à compacte et dense
avec une couleur clair à noir foncé.
Parmi les isolats à petites spores, aucune
pigmentation n'a été observée dans le milieu PDA, tandis
que les isolats à grosses spores ont présenté une
pigmentation varie entre jaune et orange. (Virender et al.,
2008) ont reporté que la pigmentation d'A.solani dans
le milieu PDA varie entre jaune, marron, brunâtre à noir, les
mêmes observations ont été signalés par (
Kumar et al. 2008).
Page 37
Partie expérimentale
Tableau 3 : Caractères culturaux des
isolats d'Alternaria sp sur milieu PDA
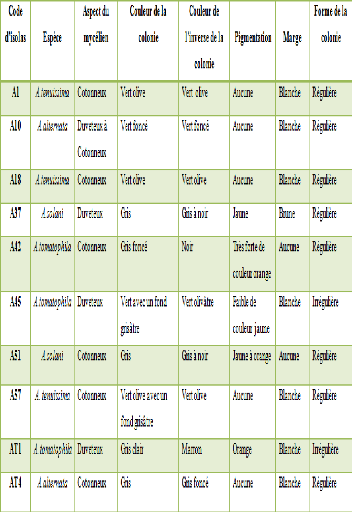
Partie expérimentale
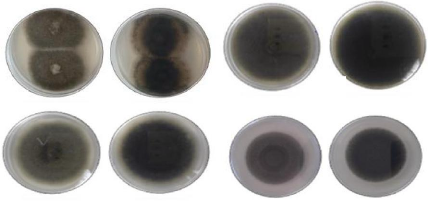
A01
A18
A57
A10

AT04
Figure 23 : Aspect macroscopique des colonies
(revers et avers) des espèces d'Alternaria à petite
spores sur milieu PDA
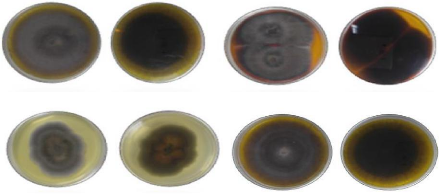
A37 A42
A45 A51

AT01
Page 38
Figure 24 : Aspect macroscopique des colonies
(revers et avers) des espèces d'Alternaria à grosses
spores sur milieu PDA
Page 39
Partie expérimentale
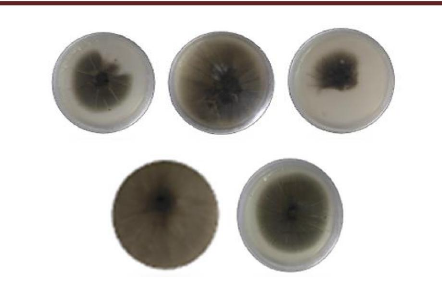
A57
AT04
A10
A01
A18
Figure 25 : Aspect macroscopique des colonies
des espèces d'Alternaria à petites spores
sur milieu
PCA après induction de la sporulation
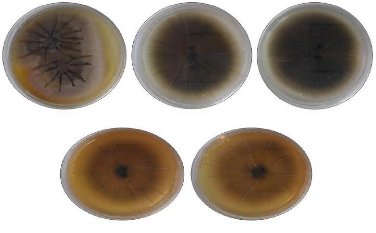
A51
AT01
A42
A37
A45
Figure 26 : Aspect macroscopique des colonies
des espèces d'Alternaria à grosses
spores sur milieu PCA après induction de la
sporulation
Page 40
Partie expérimentale
II .1.1.2 Etude microscopique
L'observation microscopique des dix (10) isolats
d'Alternaria sp a révélé deux types des conidies:
les petites spores et les grosses spores.
Les souches à petites spores sont
caractérisées par des spores de forme ellipsoïde et
ovoïde, et une couleur varie entre brun et jaune avec des cloisons
transversaux et longitudinaux.
En revanche les souches à grosses spores
présentent des conidies avec forme de massue, de couleur varie entre
brun et jaune. Les isolats d'A tomatophila différent
d'A.solani par la taille, la forme des conidies et le nombre des
cloisons et aussi les spores d'A.tomatophila
caractérisés par un long bec. Ces résultats sont
similaires à ceux cités par (Rodrigues et al.
2010) qui avaient reporté qu'A.tomatophila
présente un long bec par rapport à A.solani parfois
bifurqué et plus long que le corps de la spore.
Bien que les caractéristiques microscopiques des
conidies et conidiophores fournissent souvent les principaux critères
taxonomiques pour l'identification des espèces fongiques, une
identification moléculaire reste nécessaire afin de confirmer ces
espèces.
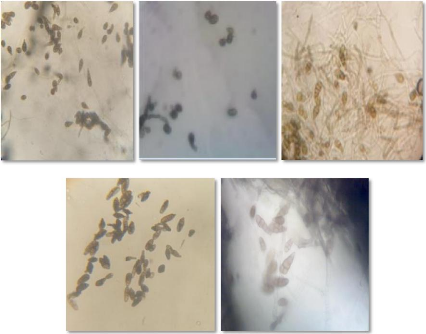
A01 A10
A57
AT04
A18
Figure 27 : Aspect microscopique des
espèces d'Alternaria à petites spores (Gx40) .
Page 41
Partie expérimentale
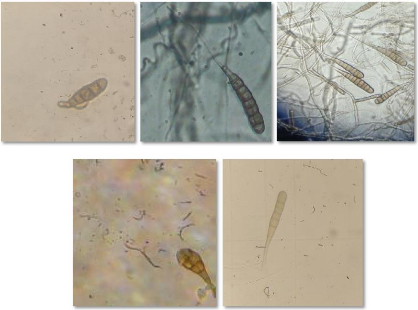
A37 A42 A45
A51 AT01
Figure 28: Aspect microscopique des
espèces d'Alternaria à grosses spores(Gx100)
II .2 Caractéristiques des huiles
essentielles
Les huiles essentielles des espèces
étudiées obtenues après une hydrodistillation,
présentent des caractéristiques regroupées dans le tableau
suivant :
Tableau 4 : Caractéristiques des huiles
essentielles
Espèce
|
Couleur
|
Odeur
|
Aspect
|
P.mauritanica
|
Jaune foncé
|
Forte odeur
|
Liquide
|
M. debilis
|
Vert clair
|
Forte odeur
|
Liquide
|
|
Ces caractéristiques différent dune plante
à une autre aussi de la partie soumise à l'extraction
(Gherib, 2014).
Partie expérimentale

Page 42
Figure 29: Huile essentielle de Figure
30: Huile essentielle de
P. mauritanica M. debilis
II .3 Rendement des huiles essentielles
Le rendement en huile essentielle des deux espèces est
exprimé en pourcentage massique par rapport à la matière
végétal sèche, représenté dans le tableau
5
Tableau 5 : Rendement calculé en (%)
pour les deux espèces étudiées
Espèce
|
Quantité de la biomasse(g)
|
Quantité d'huile (g)
|
Rendement (%)
|
P. mauritanica
|
50
|
0.15
|
(0.15/50) x 100=0.30
|
M.debilis
|
400
|
0.18
|
(0.18/400)x100=0.045
|
|
Le rendement d'extraction que nous avons obtenu de l'HE de
P.mauritanica est de l'ordre de 0.30%, cette valeur est inferieure a
celle obtenu par (Gherib, 2014) en période de floraison
(1.17 %) et à la fin de floraison (0.70 %). On parallèle, on a
obtenu un rendement de l'ordre de 0.045% de l'HE de M.debilis, et qui
est inferieur a ceux obtenu par (Gherib et al., 2016)
dans les deux périodes de floraison : Mai 0.07% et Novembre
0.12%.
Divers facteurs peuvent influencer le rendement en HE tels
que, la période de récolte de la plante, l'âge, la partie
soumise à la distillation, conditions de stockage de la plante et la
méthode d'extraction utilisée.
II .4 Activité antifongique
II .4.1 Cinétique de croissance mycélienne
II .4.1.1 Cas d'HE de P.mauritanica
Les figures 31,32, 33 et 34 représentent les
résultats enregistrés sur la cinétique de croissance des
souches d'Alternaria sp en fonction de temps (jours) et la
concentration de l'HE de P. mauritanica.
Page 43
Partie expérimentale
On a observé que la croissance mycélienne dans
la plupart des souches testées est lente par rapport au témoin et
l'augmentation de la concentration exerce un retard de croissance voire
inexistant à une concentration de 1.1ul/ml des souches A18, A37 , A57
,AT1 et AT4, ce qui explique que l'HE de P. mauritanica a un effet sur
la croissance des souches fongiques.
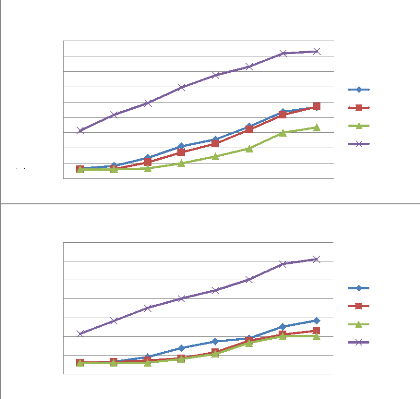
Diamétre de croissance mycélienne en
(mm)
Diamétre de croissance mycélienneen
(mm)
40
40
90
80
70
60
50
30
20
70
60
50
30
20
10
10
0
0
j3 j4 j5 j6 j7 j8 j9 j10
j3 j4 j5 j6 j7 j8 j9 j10
la souche A01
la souche A10
0,8 ul/ml 0,95ul/ml 1,1ul/ml temoin
0,8ul/ml 0,95ul/ml 1,1ul/ml temoin
Figure 31: Cinétique de croissance des
souches d'Alternaria (A01 et A10) en fonction de
temps (jours) et
concentration de l'huile essentielles de P. mauritanica
Page 44
Partie expérimentale
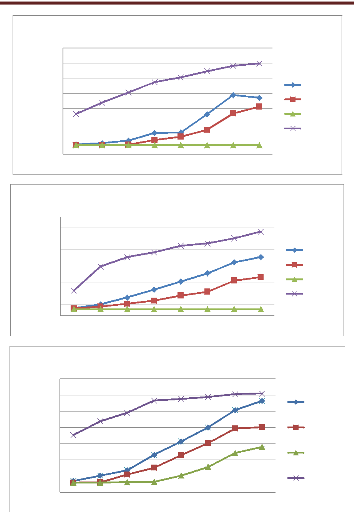
70
60
50
40
30
20
10
0
Diamètre de croissance mycélienneen
(mm)
j3 j4 j5 j6 j7 j8 j9 j10
La souche A42
0,8ul/ml 0,95ul/ml 1,1ul/ml temoin
70
60
50
40
Diamètre de croissance
30
20
10
0
90
80
70
60
50
40
30
20
10
0
Diamètre de croissance mycélienne en
(mm)
mycélienne en (mm)
j3 j4 j5 j6 j7 j8 j9 j10
j3 j4 j5 j6 j7 j8 j9 j10
la souche A37
la souche A18
0,8ul/ml 0,95ul/ml 1,1ul/ml temoin
0,8ul/ml 0,95ul/ml 1,1ul/ml Temoin
Figure 32: Cinétique de croissance des
souches d'Alternaria( A18 et A37 et A42) en
fonction de temps
(jours) et concentration de l'huile essentielles de P. mauritanica
Page 45
Partie expérimentale
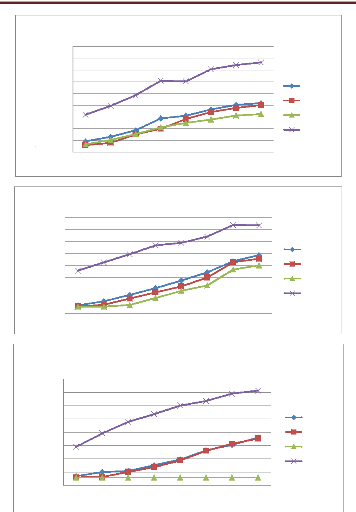
Diamètre de croissance mycélienne
en(mm)
80
70
60
50
40
30
20
10
0,8ul/ml 0,95ul/ml 1,1ul/ml Temoin
80
70
60
50
40
30
20
10
0
80
70
60
50
40
30
20
10
0
Diamètre de croissance mycélienne en
(mm)
Diamètre de croissance mycélienne en
(mm)
j3 j4 j5 j6 j7 j8 j9 j10
j3 j4 j5 j6 j7 j8 j9 j10
La souche A51
La souche A57
0,8ul/ml 0,95ul/ml 1,1ul/ml témoin
0,8ul/ml 0,95ul/ml 1,1ul/ml temoin
La souche A45
0
J3 J4 J5 J6 J7 J8 J9 J10
90
Figure 33: Cinétique de croissance des
souches d'Alternaria (A45, A51 et A57)en
fonction de temps (jours)
et concentration de l'huile essentielles de P. mauritanica
Partie expérimentale
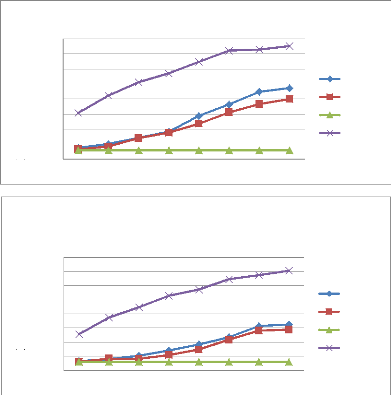
Diamètre de croissance mycélienne
en(mm)
Diamètre de en croissance
(mm) mycélienne
40
80
70
60
50
30
20
10
40
80
70
60
50
30
20
10
0
0
j3 j4 j5 j6 j7 j8 j9 j10
j3 j4 j5 j6 j7 j8 j9 j10
La souche AT04
La souche AT01
0,8ul/ml 0,95ul/ml 1,1ul/ml temoin
0,8ul/ml 0,95ul/ml 1,1ul/ml temoin
Figure 34 : Cinétique de croissance
des souches d'Alternaria (AT01 et AT04) en fonction de temps (jours)
et concentration de l'huile essentielles de P.mauritanica
Page 46
Page 47
Partie expérimentale
II .4.1.2 Cas d'HE de M. debilis
Les figures 35, 36 , 37 et 38 représentent les
résultats enregistrés sur la cinétique de la croissance
des souches d'Alternaria en fonction de temps (jours) et les
concentrations de l'HE M. debilis .
On a observé que la croissance mycélienne dans
la plupart des souches testées est moins important par rapport au
témoin et plus la concentration en HE augmente, plus la croissance
diminue , ce qui explique que l'HE de M. debilis a un effet inhibiteur
sur la croissance, mis appart la souche A42 ou elle a été
inhibé par une concentration de 1.1ul/ml, et la souche A57 qu'elle a
été inhibé par une concentration de 0.95ul/ml
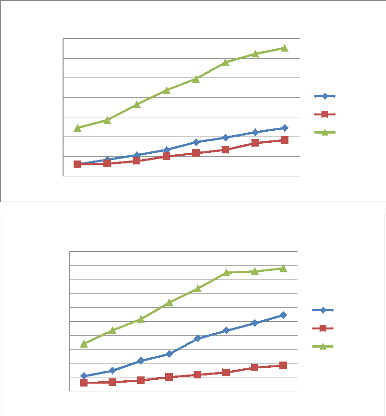
Diamètre de en croissance
(mm) mycélienne
60
50
40
30
20
10
0,95ul/ml 1,1ul/ml temoin
100
90
80
70
60
50
40
30
20
10
0
Diamètre de croissance mycélienne en
(mm)
j3 j4 j5 j6 j7 j8 j9 j10
La souche A10
0,95ul/ml 1,1ul/ml temoin
La souche A01
0
j3 j4 j5 j6 j7 j8 j9 j10
70
Figure 35 : Cinétique de croissance des
souches d'Alternaria (A01 et A10) en fonction de temps (jours) et
concentration de l'huile essentielles de M.debilis
Page 48
Partie expérimentale
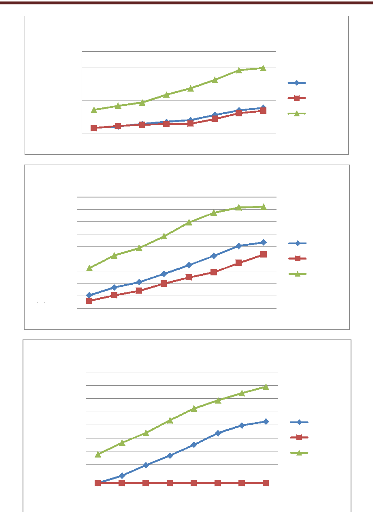
Diamètre de en croissance
(mm) mycélienne
80
60
40
20
0
0,95ul/ml 1,1ul/ml temoin
j3 j4 j5 j6 j7 j8 j9 j10
90
80
70
60
50
40
30
20
10
0
90
80
70
60
50
40
30
20
10
0
Diamètre de croissance mycélienne en
(mm)
Diamètre de croissance mycélienne
en(mm)
j3 j4 j5 j6 j7 j8 j9 j10
j3 j4 j5 j6 j7 j8 j9 j10
La souche A37
La souche A42
0,95ul/ml 1,1ul/ml témoin
0,95ul/ml 1,1ul/ml témoin
La souche A18
100
Figure 36 : Cinétique de croissance des
souches d'Alternaria (A18, A37et A42) en
fonction de temps (jours)
et concentration de l'huile essentielles de M.debilis.
Page 49
Partie expérimentale
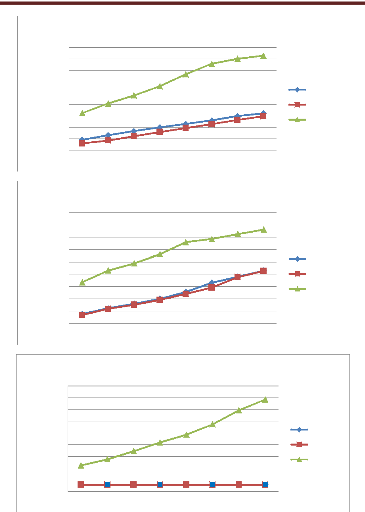
Diamètre de en croissance
(mm) mycélienne
80
70
60
50
40
30
20
10
0
0,95ul/ml 1,1ul/ml témoin
La souche A45
j3 j4 j5 j6 j7 j8 j9 j10
90
Diamètre de croissance mycélienne en
(mm)
80
70
60
50
40
30
20
10
0,95ul/ml 1,1ul/ml témoin
La souche A51
0
j3 j4 j5 j6 j7 j8 j9 j10
90
90
80
70
60
50
40
30
20
10
0
Diamètre de croissance mycelienne en
(mm)
j3 j4 j5 j6 j7 j8 j9 j10
La souche A57
0,95ul/ml 1,1ul/ml témoin
Figure 37: Cinétique de croissance des
souches d'Alternaria (A45, A51et A57) en
fonction de temps (jours)
et concentration de l'huile essentielles de M.debilis.
Page 50
Partie expérimentale
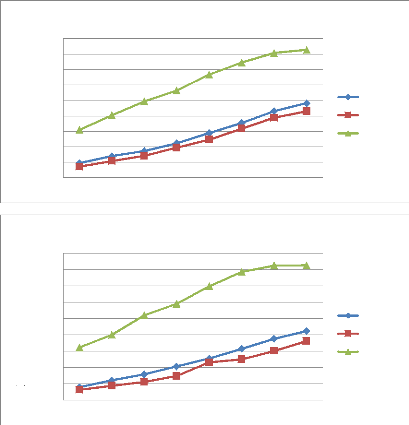
Diamètre de croissance mycélienneen
(mm)
Diamètre de croissance mycélienne
en(mm)
40
40
90
80
90
80
70
60
50
30
20
70
60
50
30
20
10
10
0
0
j3 j4 j5 j6 j7 j8 j9 j10
j3 j4 j5 j6 j7 j8 j9 j10
La souche AT01
La souche AT04
0,95ul/ml 1,1ul/ml témoin
0,95ul/ml 1,1ul/ml témoin
Figure 38 : Cinétique de croissance des
souches d'Alternaria (AT01 et AT04) en
fonction de temps (jours) et
concentration de l'huile essentielles de M.debilis
II .3 .3 Taux d'inhibition de la croissance
mycélienne
Les résultats illustrés dans la figure 39
montrent le taux d'inhibition de la croissance mycélienne de l'HE de
P.mauritanica.
On a observé que l'HE a des effets différents sur
les souches d'Alternaria sp. L'inhibition totale (100%) a
été remarquée à une concentration de 1.1ul/ml pour
les souches A18, A37, A57, AT1, AT4
Page 51
Partie expérimentale

Pourcentage d'inhibition %
100
40
90
80
70
60
50
30
20
10
0
0,8ul/ml 0,95ul/ml 1,1ul/ml
Concentrations ul/ml
A01 A10 A18 A37 A42 A45 A51 A57 AT1 AT4
Figure 39 : Taux d'inhibition de la croissance
mycélienne de l'HE de P.mauritanica.
Alors que la figure 40
démontre le taux d'inhibition de la croissance mycélienne de
l'HE
de M.debilis avec des effets différents sur
les souches d'Alternaria sp., un taux d'inhibition totale (100%) a
été remarqué a une concentration de1.1ul/ml pour la souche
A57 et la concentration 0.95 pour la souche A42.

pourcentage d'inhibition %
100
40
80
60
20
0
0,95ul/ml 1,1ul/ml
Concentrations ul/ml
A01
A10
A18
A37
A42
A45
A51
A57
AT1
AT4
Figure 40 : Taux d'inhibition de la croissance
mycélienne de l'HE M.debilis.
Page 52
Partie expérimentale
Les résultats que nous avons obtenus ont montré
une activité antifongique considérable. L'HE de P.mauritanica
renferme une intéressante activité sur les moisissures. En
effet cinq souches sont inhibées à des concentrations minimales
inhibitrices (CMI) entre 0.95ul/ml et 1.1ul/ml (A18, A37, A57, AT1, AT4) et la
souche A42 par une CMI entre 1.1ul/ml et 1.2ul/ml. Nos résultats de CMI
sont inférieurs par ceux obtenus par (Znini et al.
2013). Ces auteurs ont testé l'activité
antifongique de l'HE de P.mauritanica vis-à-vis de trois
souches fongiques phytopathogènes, à savoir : Alternaria
sp., Penicillium expansum et Rhizopus stolonifer par la
méthode de contacte direct. Ils ont obtenu des CMI de l'ordre de 2ul/ml
pour Alternaria
sp. et Penicillium
expansum.
On ce qui concerne l'HE de M. debilis qui a
présenté une activité antifongique inhibitrice, deux
souches ont été inhibées, l'une avec une CMI inferieure ou
égale à 0.95 ul/ml et la deuxième avec une CMI entre 0.95
ul/ml et 1.1ul/ml.
Selon Gherib et al. 2016, les
résultats ont montré que l'huile essentielle avait un large
spectre d'activité antimicrobienne. La méthode de diffusion
à la gélose a montré que l'huile était efficace
contre S. typhimurium, K. pneumoniae et C. albicans
avec une CMI de 2ul/ml.
En générale, la variabilité des
résultats est probablement due à l'influence de plusieurs
facteurs tels que la méthodologie, les microorganismes testés et
les huiles essentielles utilisées (Pattnaik et al .,
1996) .
II .3 .4 Taux d'inhibition de la sporulation
Le taux d'inhibition de la sporulation des souches fongiques
de l'HE de P.mauritanica en fonction de trois concentrations (figure
41) montre des effets très remarquable sur presque toutes les souches
d'Alternaria sp.
L'inhibition totale (100%) a été
remarqué a une concentration de 1.1ul/ml pour les souches A01, A18, A51
et A57 et pour les autre souches, on a remarqué qu'il ya une inhibition
importante supérieure à 60%.
Page 53
Partie expérimentale
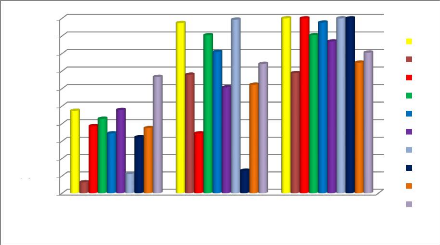
Pourcentage d'inhibition %
100
40
90
80
70
60
50
30
20
10
0
0,8ul/ml 0,95ul/ml 1,1ul/ml
Concentrations ul/ml
A01 A10 A18 A37 A42 A45 A51 A57 AT1 AT4
Figure 41 : Taux d'inhibition de la sporulation
de l'HE de P.mauritanica
Les résultats illustrés dans la figure 42
montrent le taux d'inhibition de la sporulation de l'HE de
M.debilis.
On a observé que l'HE a des effets différents
sur les souches d'Alternaria. L'inhibition totale (100%) a
été remarqué a une concentration de1.1ul/ml pour les
souches A01, A37, A42, A51, A57 et la souche AT4 et la concentration 0.95 ul/ml
pour la souche A42.
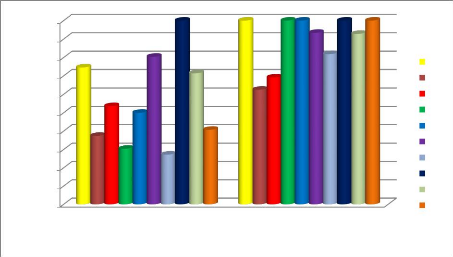
Pourcentage d'inhibition %
100
40
90
80
70
60
50
30
20
10
0
0,95ul/ml 1,1ul/ml
Concentrations ul/ml
A01 A10 A18 A37 A42 A45 A51 A57 AT1 AT4
Figure 42 : Taux d'inhibition de la
sporulation de l'HE de P.mauritanica
Page 54
Partie expérimentale
Les deux huiles sont des bons inhibiteurs de la croissance
mycélienne et de la sporulation. L'activité la plus remarquable
est constatée avec l'HE de P.mauritanica. Cette huile exerce
une très bonne activité antifongique. En effet cette
activité augmente par l'augmentation de la concentration
Témoin
|
0.8ul/ml 0.95ul/ml 1.1ul/ml
|
|
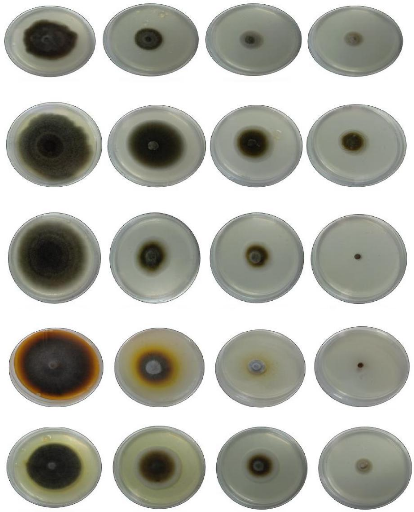
Témoin
A01 A01 A01 A01
Témoin
Témoin
A42
Témoin
A10
A37 A37 A37 A37
A18 A18 A18 A18
1.1ul/ml
0.8ul/ml 0.95ul/ml
0.8ul/ml 0.95ul/ml 1.1ul/ml
0.8ul/ml
0.8ul/ml
A10
A42
0.95ul/ml
0.95ul/ml
A10
A42
1.1ul/ml
A10
1.1ul/ml
A42
Figure 43 : Aspect macroscopique des colonies
testées par differentes concentrations
d'
HE.de P.mauritanica aprés 10
jours d'incubation.
Page 55
Partie expérimentale
Témoin
|
0.8u/ml
|
0.95ul/ml
|
1.1ul/ml
|
|
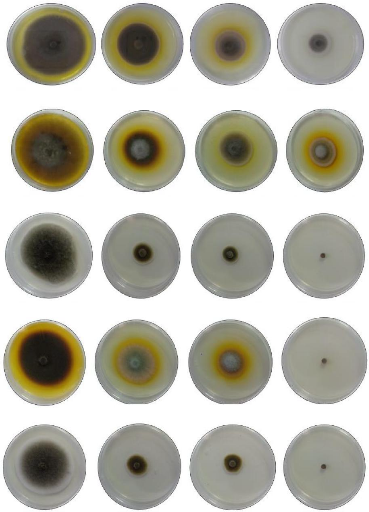
Témoin
AT4 AT4 AT4 AT4
Témoin
Témoin
AT1
Témoin
A45 A45 A45 A45
A51
A57
AT1
0.8u/ml 0.95ul/ml 1.1ul/ml
0.8u/ml
0.8u/ml 0.95ul/ml 1.1ul/ml
0.8u/ml 0.95ul/ml
A51
A57 A57 A57
0.95ul/ml 1.1ul/ml
AT1
A51
1.1ul/ml
A51
AT1
Figure 44: Aspect macroscopique des colonies
testées par differentes concentrations
d'
HE.de P.mauritanica aprés 10
jours d'incubation.
Page 56
Partie expérimentale
Témoin
|
0.95ul/ml 1.1ul/ml
|
|
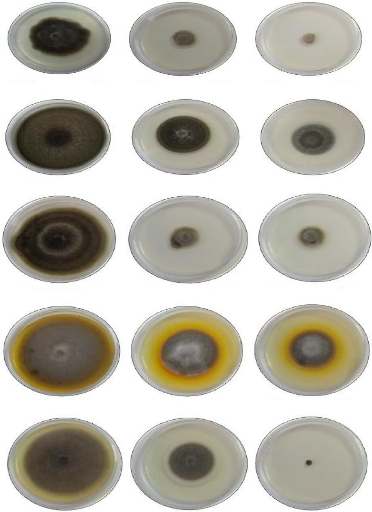
Témoin Cin
A10
A18
ca
Témoin
hui
A37 A37 A37
Témoin
Témoin n de
A01
A42
0.95ul/ml
0.95ul/ml
0.95ul/ml
0.95ul/ml 1.1ul/ml
A01 A01
A10
A18 A18
A42 A42
1.1ul/ml
1.1ul/ml
1.1ul/ml
A10
Figure 45: Aspect macroscopique des colonies
testées par differentes concentrations
d'
HE.de M.debilis aprés 10
jours d'incubation..
Page 57
Partie expérimentale
Témoin
|
0.95ul/ml 1.1ul/ml
|
|
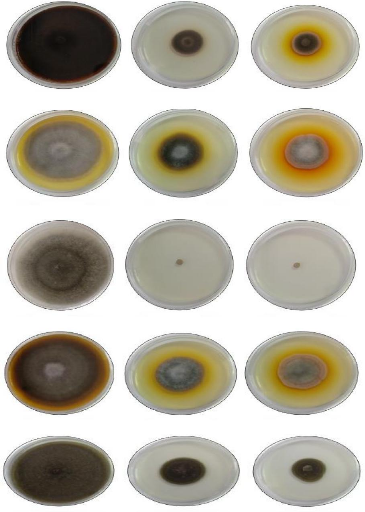
A45
Témo
Témoin
AT4 AT4 AT4
AT1 AT1 AT1
Témoin
Témoin
A51
A57
0.95ul/ml 1.1ul/ml
0.95ul/ml
0.95ul/ml 1.1ul/ml
0.95ul/ml
A57
A45
A51
1.1ul/ml
1.1ul/ml
A57
A45
A51
Figure 46: Aspect macroscopique des colonies
testées par differentes
concentrationsd'
HE.de M.debilis après 10
jours d'incubation
Page 58
Partie expérimentale
II .3 .4 Détermination de la vitesse de la
croissance mycélienne
La figure 47 représente la vitesse de la croissance
mycélienne en présence de différentes concentrations de
l'huile essentielle de P.mauritanica.
On a remarqué que la vitesse la plus haute est celle
du témoin dans les deux huiles, et qui se diffère d'une souche
à une autre, aussi plus la concentrations de l'HE augmente plus la
vitesse de la croissance mycélienne diminue, où elle a atteint la
valeur la plus basse de 0.08mm/h à une concentration de 1.1ul/ml par les
souches A18, A37, A57, AT01, AT4.
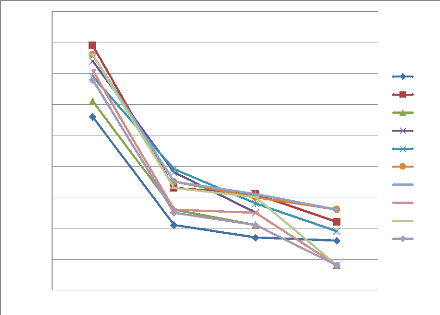
Vitesse de croissance (mm/h)
0.9
0.8
0.7
0.6
0.5
0.4
0.3
0.2
0.1
0
0ul/ml 0,8ul/ml 0,95ul/ml 1,1ul/ml
A01 A10 A18 A37 A42 A45 A51 A57 AT1 AT4
Figure 47 : Vitesse de la croissance
mycélienne sous l'effet de différentes concentrations
en HE de
P.mauritanica
La vitesse de la croissance mycélienne en
présence de différentes concentrations de l'HE de M.debilis
est illustrée dans la figure.48
La vitesse la plus haute est toujours du témoin, se
diffère d'une souche à une autre, aussi plus la concentration de
l' HE augmente plus la vitesse de la croissance mycélienne diminue,
où elle a atteint la valeur la plus basse de 0.08mm/h à une
concentration de
Page 59
Partie expérimentale
1.1ul/ml par la souche A42 qui a été
inhibé par cette concentration et la souche A57 qui a
présenté une vitesse stable dans les deux concentrations.
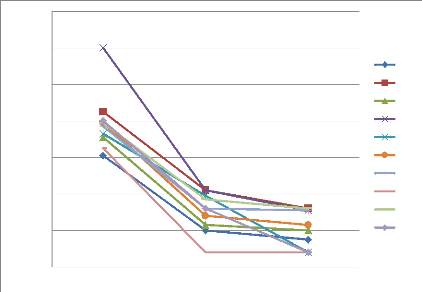
vitesse de croissance (mm/h)
0.8
0.6
0.4
0.2
1.4
1.2
0
1
0ul/ml 0,95ul/ml 1,1ul/ml
A01 A10 A18 A37 A42 A45 A51 A57 AT1 AT4
Figure 48 : Vitesse de la croissance
mycélienne sous l'effet de différente concentration
en HE de
M.debilis
La différence du pouvoir antifongique des huiles
essentielles des deux plantes peut être liée à leurs
compositions chimiques.
Selon ces observations, on peut spéculer que la forte
activité antifongique observée chez les huile essentielles
provient de l'efficacité de ses composants, comme elle peut être
le résultat de synergie entre les différents constituants des
huiles El Ajjouri et al ., 2008.
Gattefossé et Igolen en 1945 ont
raporté que le carvotanacétone et le composé majoritaire
de l'HE de P.mauritanica avec un pourcentage de l'ordre de 81.0%,une
deuxième étude a été réalisé par
Gristofari et al. (2011) sur l'huile essentielle de
cette plante récoltée dans quatre stations differentes au Maroc,
révèle également une grande richesse en
carvotanacétone (79.99%, 92.13%), suivi de linalol 0.4%-2.1% et de
carvacrol( 0.4%-1.2%).
Nasser et al.,2012 ont
raporté que l'HE de P.undulata prénte aussi un
porcentage elevé en carvotanacétone (91.4%)
Page 60
Partie expérimentale
Gherib et al. (2016) ont
rapporté que les monoterpènes sont les composants les
prédominants (54,6%) de l'HE de M. debilis et ont
été présenté principalement
représentée par â-pinène (19,3%). Géranial
(8,7%), linalol (6,5%).
CONCLUSION
GéNéRALE
Page 62
Conclusion générale
Nos cultures sont souvent soumises à des niveaux
variables de contamination microbienne, principalement dues à des
champignons phytopathogènes, qui infectent généralement
l'hôte.
L'application des huiles essentielles est récemment
devenue une méthode très attrayante de lutte contre les maladies
fongiques. On pense que la production d'huiles essentielles par les plantes est
principalement un mécanisme de défense contre les agents
pathogènes nuisibles, notamment parce qu'elles possèdent des
propriétés antimicrobiennes et antifongiques.
Dans le but de protéger notre culture de tomate contre
les prédateurs (infections fongiques) et afin de valoriser notre flore
locale, nous nous sommes intéressés d'étudier
l'activité biologique des huiles essentielles de la partie
aérienne de P.mauritanica et M.debilis, en
évaluant leurs pouvoir antifongique vis-à-vis les espèces
d'Alternaria sp qui attaquent notre culture.
Premièrement, les souches isolées de
différentes régions du Nord-Ouest d'Algérie, ont
été identifiée par l'utilisation des critères
culturaux (couleur, vitesse de croissance et aspect de mycélium) et des
critères morphologiques (forme des spores, couleur,..), l'étude
de ces caractéristiques révèle l'apparence de quatre
espèces du genre Alternaria à savoir les espèces
à petite spore représentés par A.alternata et
A.tenuissima, et les espèces à grosse spore
représenté par A.tomatophila et A.solani.
Les plantes utilisées possèdent des rendements
divers qui sont de l'ordre de 0.30% et 0,045% respectivement pour
P.mauritanica et M.debilis.
Dans un second temps, nous avons évalué in
vitro l'activité antifongique des HE sur les espèces
d'Alternaria sp par la méthode de contacte direct. A la
lumière des résultats parvenus par cette étude, on conclu
que les deux HE présentent une inhibition total de la croissance
mycélienne de cinq souches à une concentration de 1.1ul/ml de
l'HE de P. mauritanica et deux souches à des concentrations de
0.95ul/ml et 1.1ul/ml. Les deux huiles présentent aussi un taux
d'inhibition de la sporulation très élevé pour la
majorité des souches.
Point de vue comparatif, l'HE de P.mauritanica
présente un effet mieux que l'HE de M.debilis
vis-à-vis les CMI et les souches inhibées
En fin, et à l'essor de la présente
étude, les résultats obtenus ne constituent qu'une
première étape de recherche il serait
intéressant de Poursuivre la recherche
phytochimique, et mener une
étude plus approfondie sur les huile essentielles de
Page 63
Conclusion générale
P.mauritanica et M.debilis afin d'isoler et
d'identifier les composés ayant une activité antifongique et
même d'autre métabolites.
Les huiles essentielles des deux plantes
étudiées, ont manifesté un bon effet antifongique à
l'échelle du laboratoire »in vitro `', pour assurer leurs
utilisation comme alternative des produits chimiques pour la protection des
cultures de tomates, une deuxième étude in vivo doit
être réalisée pour mieux affiner l'effet des ces huiles.
RéféREnCES
BIBlIoGRAPHIQUES
Page 65
Références bibliographiques
Abdelkader F., 2012. Etude comparative de
l'infection des sols par quelques champignons pathogènes en conditions
de semis direct et de travail conventionnel. Thèse de magister.
Université Ferhat Abbas Setif.89p.
Agrios GN., 2005. Plant pathologie. 5th .Ed.
Elsivier, London. 922 :455.
Amrouche A., 2012. Etude in vitro de l'effet
antifongique des huiles extraites de plantes médicinales et leurs effets
chez des rats wistar contaminés par les mycotoxines. Thèse de
doctorat Es-sciences, Université Abou-Bekr Belkaiid -Tlemcen, 276p.
Bakkali F., Averbeck S., Averbeck D. et Idaomar M.,
2008.Biological effects of essential oils - a review. Food Chem
Toxicol 46: pp. 446-475.
Bakkour Y., Alwan S., Soufi H., El-Ashi N., Tabcheh M.
et El Omar F., 2012.Chemical composition of essential oil extracted
from Micromeria barbata growing in Lebanon and their antimicrobial and
antioxidant properties. J.Nat. Prod., 5: 116-120 .
Basu. PK., 1974. Measuring early blight, its
progress and influence on fruit losses in nine cultuvars. Can plant Dis Surv.
54 :45-51.
Benayad N., 2008. Les huiles essentielles
extraites des plantes médicinales marocaines: moyen efficace de lutte
contre les ravageurs des denrées alimentaires stockées,
laboratoire des substances naturelles et thermolyse éclair,
département de chimie, faculté des sciences de rabat.
Bessadat N., 2014. Isolement, identification
et caractérisation des Alternaria sp. Responsables de la
détérioration des plantes maraichères par des
systèmes enzymatiques et moléculaires. Thèse de doctorat.
Université d'Oran, 199p.
Bessadat N., Benichou S., Kihal M. et Henni D.,
2014.Aggressiveness and morphological variability of small spore
Alternaria species isolated from Algeria. Journal of Experimental
Biology and Agricultural Sciences, 2(2S) 2320 - 8694
Bettaieb R., Bourgou S., Saidani Tounsi M.,
Fauconnier M.L. et Ksouri R., 2017.Phytochemical composition and
antioxidant activity of Lavandula dentate extracts In journal
of new siences, Agriculture and Biotechnology, 39(2) 2096-2105 .
Blancard D., Laterrot H., Marchoux G.et Candresse T.
2009. Les maladies de la
tomate. INRA.
Page 66
Références bibliographiques
Blancard D., Laterrot H., Marchoux, G.et Candresse
T.2012. A colour handbook-Tomato Diseases : identification, biology
and control. Manson Publishing Ltd. 688 pp.
Botton B., Bertron A., Fevere M., Cauthier S.,
Guoh.D.,Larpent J.P, Reymond P.,Sanglier JJ, Vaysser Y.et Veau
S.,1990. Moisissures utiles et nuisibles importance industrielle.2eme
ED Masson collection biotechnologies : 5-10.
Bouguerra A., 2012. Etude des
activités biologiques de l'huile essentielle extraite des graines de
Foeniculum vulgare Mill. en vue de son utilisation comme conservateur
alimentaire. Thèse de Magister en Sciences Alimentaires.
Université Mentouri Constantine, 128p.
Bouzouita N., Kachouri F., Ben Halima M., et
Chaabouni M. 2008. Composition chimique et activité
antioxydante, antimicrobienne et insecticide de l'huile essentielle de
Juniperus phoenicea. Journal de la Société Chimique de
Tunisie. 10 : 119-125.
Brunton J., 2009. Pharmacognosie,
photochimie, plantes médicinales. 4 ème Ed. Paris
technique et Documentation,1289 p.
Burt S., 2004.Essential oils : their
antibacterial properties and potential application in foodes
a-review.Int.J.food microbial.94:223-253
Cahagnier B., Dragaci S., Frayssinet C., Frémy
J.M., Hennebert G.L., Lesage - meessenL., Multon J.L., Richard-Molard D.et
Roquebert M.F., 1998.Moisissures des aliments peu-hydratés. Tec
& Doc Lavoisier, France.
Calmes B., 2011. Réponses adaptatives
d'Alternaria brassicicola au stress oxydatif lors de l'interaction
avec les Brassicacées. Thèse de doctorat, Ecole Doctorale VENAM,
202p.
Chabasse D.,2002. Les moisissures
d'intérêt médical. Cahier N°25 de formation de
biologie médical. Ed bio forma.159p
Chami N. , hami F., Bennis S., Trouillas J. et Remmal
A., 2004. Antifungat treatment with carvacrol and eugenol of oral
candidiasis in immunosupressed rats. Brazilian J Infections Disease 8:
217-226
Christine J., 2000. Maladies, insectes
nuisibles et utiles de la pomme de terre. Edition IRDA sainte-foy
Québec. p16.
Dupont F., 2004. Botanique -
Systématique Moléculaire. Ed Masson. 110-125.
Page 67
Références bibliographiques
Edouard L., 2010. Alternariose de la Tomate
(Alternaria solani). Promété - Agro-Météo
et Outils,p1
El Abed N., Harzallah-Skhiri F. et Boughaleb N.,
2010. Chimical composition and antifungal activity of the essential
oil of Pulicaria arabica(L) Coss. From Tunisia. Agrucultural segment,
1(2) AGS/1530.
El Kamali HH.,youssif MO., Ahmed OI. Et Sabir SS.,
2009. Phytochimical analysis of the essentil oil from aerial parts of
Pulicaria undulata(L) Kostel from Sudan. Ethnobotanical
leaflets, 13 :467-471.
El AjjouriM., Satrani B., Ghanmi M., Aafi A.,Farah
A., Rahouti M., Amarti F.et Aberchane M., 2008. Activité
antifongique des huiles essentielles de Thymus bleicherianus Pomel et
Thymus capitatus (L.) Hoffm. Et link contre les champignons de
pourriture du bois d'oeuvre. biotechnol. agron. soc. environ. 12(4):
345-351.
El Haci I., 2015. Etude phytochimique et
activités biologiques de quelques plantes médicinales
endémiques de Sud d'Algerie : Ammodaucus leucotrichus Coss.
&Dur.,Anabasis aretioides Moq. & Coss. et Limoniastrum
feei (Girard) Batt. Thèse de doctorat en Biologie,
Université Abou-Bekr Belkaiid -Tlemcen, 188p.
EL Mansouri K., 2013.Recherche et
évaluation de l'activité antifongique des extraits de plantes
médicinales. Thèses de Doctorat en médecine,
Université Cadi Ayyad. 107p.
Ellis MB., Gibson IAS., 1975.Alternaria
solani no. 45 set 48. Common welth Mycologyca l institut, kew, Surrey,
UK.
Ericsson M. et Colmjo A., 2000 .Journal of
Microbiology.877.141.
Fandohan,P. Gbenou, JD. Gnonlonfin,B. Hell,K.
Marasas,WFO. Wingfield, MJ., 2004. Effect of essential oils on the
growth of fusarium verticillioides and fumonisin contamination in corn. Journal
of Agricultural and Food Chemistry. 52 : 6824-6829.
Ferhat, M.A., Meklati, B.Y.et Chemat, F.,
2007. Comparison of different isolation methods of essential oil from
citrus fruits: cold pressing: hydrodistillation and microwave dry distillation,
Flavour Fragr J, 22, 494-504.
Ferrar JJ., Pryor BM., Davis RM.,
2004.Alternaria diseases of carrot. Plant
disease.88: 776-784.
Page 68
Références bibliographiques
Fillatre Y., 2011. Produits phytosanitaires:
Développement d'une méthode d'analyse multirésidus dans
les huiles essentielles par couplage de la chromatographie liquide avec la
spectrométrie de masse en mode tandem. Thèse de doctorat.
Université d'Angers, p 267.
Gherib M., 2009. Etude des activités
antimicrobienne et antioxydante des huiles essentielle et des flavonoides
d'Artemisia herba alba Asso; Artemisia judaica .L.
ssp.sahariensis; Artemisiacampestris L; Herniaria mauritanica
Murb et Warionia saharae Benth. Et Coll. Thèse de magister
en biologie. Université Abou Bekr Belkaid -Tlemcen, 133p.
Gherib, M. 2014. Analyse des huiles
essentielles de Warionia saharae Benth. & Hook. et de
Pulicaria mauritanica Cos de l'Ouest Algérien (Nâama) par
CPG(Ir), CC, CPG/SM et RMN 13C et étude de leur pouvoir antimicrobien.
Thèse de Doctorat, Université de Tlemcen, p 127.
Gherib M., Bekhchi C., Paoli M., Atik Bekkara F.,
Bighelli A., Casanova J. et Tomi F., 2016. Chemical composition and
antimicrobial activity of the essential oil from aerial parts of Micromeria
debilis Pomel from Algeria.In Jornal of essential oil research,
5 : 383- 390
Gulluce M., Sokmen M., Sahin F., Sokmen A., Adiguzel
A. et Ozer H., 2004. Biological activities of the essential oil and
methanolic extract of Micromeria fruticosa (L) Druce ssp.
serpyllifolia (Bieb) PH Davis plants from the eastern Anatolia region of
Turkey. J. Sci. Food Agric. 84:735-741 .
Hambali FE., Aksira M., Ezoubeiri A., Gadhi CE.,
Melouki F., Benherraf A., Blazquez AM. Et Boira H., 2005.Chimical
composition and antibacterial activity of essential oil of Pulicaria odora
L.J.Ethnofarmacol, 99:399-401.
Hamdouch A., A. Asdadi F., Achemchem B., Chebli M.,
El Hadek L.M. et Idrissi Hassani, 2018. Phytochemical analysis,
Antifungal, antibacterial and antioxidant properties of Pulicaria
mauritanica from South-East of Morocco IN Journal of Materials and
Environmental Sciences, 9: 1762-1770
Hussein S. R., Marzouk M. M., Soltan M. M., Ahmed E.
K., Said M. M.et Hamed A. R. 2017. Phenolic constituents of
Pulicaria undulata (L.) C. A. Mey. Sub sp. Undulata (Asteraceae):
Antioxidant protective effets and chemosysthematic significances. Journal of
Food and Drug Analysis, 25: 333-339.
Page 69
Références bibliographiques
Joly P., 1964. Le genre Alternaria.
Encyclopedie mycologique, Ed.J.P.Lechebalier. Paris. 250p.
Kasmi M., Aourach M., El Boukari M., Barrijal S.et
Essalmani H., 2018. Efficacité des extraits aqueux des plantes
aromatiques et médicinales contre la pourriture grise de la tomate au
Maroc. Comptes rendus - Biologies. 340(8):386-393.
Kumar V, Haldar S, Pandey KK, Singh RP, Singh AK,
Singh PC, 2008. Cultural, morphological, pathogenic and molecular
variability amongst tomato isolates of Alternaria solani In India.
World J Microbiol Biotechnol 24:1003-1009
Kumar A., Shukla R., Singh P., Prasad C.S., Dubey
NK., 2008. Assessment of Thymus vulgaris L. essential oil as a safe
botanical preservative against post-harvest fungal infestation of food
commodities. Innovative Food Science and Emerging Technologies.
9: 575-580.
Lagunez R., 2006. Etude de l'extraction de
métabolites secondaires de différentes matières
végétales en réacteur chauffée par induction
thermomagnétique directe. Thèse de Doctorat, Institut national
polytechnique de Toulouse.
Latigui A., 1984. Effets des
différents niveaux de fertilisation potassique sur la fructification de
la tomate cultivée en hiver sous serre non chauffée. Thèse
de Doctorat en Science Agronomique. INA EL-Harrach. Alger, 162p.
Logrieco, A., Bottalico, A., Mule, G, Moretti, A. and
Perrone, G. 2003. Epidemiology of toxigenic fungi and their associated
mycotoxins for some Mediterranean crops. Eur. J. Plant Pathol.
109: 645-667.
MADR. 2010. Statistiques du Ministère de
l'Agriculture et du développement rural.
Mamgain A., Roychowdhury R.et Tah J., 2013.
Alternaria pathogenicity and its strategic controls. Research Journal
of Biology, 1: 01-09
Marin M.A., Novakoviæ M.M., Teeviæ V.V.,
Kolareviæ S.M. et Vukoviæ-Gaèiæ B.S., 2015.
Antimicrobial activity of the essential oil of wild-growing Micromeria
thymifolia (Scop.) Fritsch. J. BioSci Biotechnol., 4, 29-31.
Masango, P., 2005. Cleaner production of
essential oils by steam distillation, J Clean Prod, 13 : 833-839.
Page 70
Références bibliographiques
Mebarki L., 2015. Recherche
d'activité biologique de molécules, végétales pour
la lutte contre Fusarium oxysporum f. sp. albedinis. Thèse de
doctorat. Université des Sciences et de la Technologie d'Oran Mohamed
Boudiaf.191pp
Messiaen CM., Blancard D., Rouxel F. et Lafon R.
1991. Les plantes maraichères, INRA. Paris.552p.
Michel M., 1991. Maladies et ravageurs de la
pomme de terre. Edition TH. Mann. Gelsenkirchen-buer
ISBN3-7862-0090-4.Verlagth-mann-nordring 10 D 4650 gelsenkirchen-buer. Page :
21-22-23.
Millet A., 2017. Isolement de
microorganismes à partir du sol des régions arides et
sélection d'isolats à effet antagoniste sur l'agent de
l'Alternariose. Thèse de Doctorat. Université de Constantine1,
122p.
Mirkarimi HR., Abasi moghadam A., Mozafari J. et
Taheri Ardestani S., 2013. In vitro and green house
evaluation of phytopathogenic potential of fungal isolates alternaria
tenuissima in Iran .In Journal of Experimental Biology and
Agricultural Sciences, 2320 - 8694
Mnayer D., 2014. Eco-Extraction des huiles
essentielles et des arômes alimentaires en vue d'une application comme
agents antioxydants et antimicrobiens. Thèse de Doctorat en Sciences.
Université d'Avignon et des Pays de Vaucluse, 157p.
Mohammedi Z. , 2013. Etude Phytochimique et
Activités Biologiques de quelques Plantes médicinales de la
Région Nord et Sud-Ouest de l'Algérie. Thèse de doctorat
en Biologie, Université Abou-Bekr Belkaiid -Tlemcen, 170p.
Msaada K., Salem N., Tammar S., Hammami M., Jamal
Saharkhiz M., Debiche N., Limam, F.et Marzouk B. 2012. Essential oil
composition of Lavandula dentata, L. stoechas and L. multifida
cultivated in Tunisia. In Journal of Essential Oil Bearing Plants, 15(6),
1030-1039.
Nasser A., Awadh A., Farukh S., Sharopovb, M.,
Gabrielle M. H., Andrea P., Norbert A., William N., Setzerb J. S. , et Ludger
W.,2012. Chemical Composition and Biological Activity of Essential Oil
from Pulicaria undulata from Yemen. Natural Product Communications, 7
( 2) 257 - 260
Page 71
Références bibliographiques
Neergaard P., 1945. Danish species of
Alternaria and Stemphylium: taxonomy, parasitism, economic
significance. Oxford UniversityPress, London. 2-287.
Ouis N., 2014. Etude chimique et biologique
des huiles essentielles de coriandre, de fenouil et de persil. Thèse de
doctorat en sciences. Université d'Oran 1-239p
Oukala N., 2014. Etat sanitaire des cultures
de tomate sous serre et étude de l'impact des pratiques culturales sur
le développement de la pathologie dominante. Thèse de magister.
Université de Bejaia.114p
Oussalah M., Caillet S., Saucier L. et Lacroix
M.,2007. Inhibitory effects of selected plant essential oil on the
growth of four pathogenic bacteria : E. coli O157:H7, Salmonella
typhimirium, Staphylococcus aureus and Listeria
monocytogenes, Food Control, 18, 414420
Pattnaik ,Subramanyam S., V.R. et Kole C.
1996.Antibacterial and antifungal activity of the essential oils in
vitro. microbios .86 : 237-246.
Peratla IE., et Knapp Spooner DM.2006.
Nomenclature of wild and cultivated tomatos. Report of tomatogenetics
cooperative.56 :5-12.
Pierron C., 2014. Les huiles essentielles et
leurs expérimentations dans les services hospitaliers de France :
exemples d'applications en gériatrie gérontologie et soins
palliatifs. Thèse de doctorat en pharmacie, Université de
Lorraine. 256p.
Pitt J.I. et Hocking A.D., 1997. Fungi and
Food Spoilage, 2nd Ed. Blackie Academic and Professional, London.
Posada L., 2016. Solanum lycopersicum
a monograph. Agricultural Science. Colegio Bolivar 34p
Quezel P. et Santa S. 1963. Nouvelle flore
de l'Algérie et des régions désertiques
méridionale. Tome II Ed. CNRS. Paris.
Ramezani Y., Taheri P .et Mamarabadi M .,
2019. Identification of Alternaria spp. associated with
tomato early blight in Iran and investigating some of their virulence factors.
In Journal of Plant Pathology,
Ranc N., 2010. Analyse du polymorphisme
moléculaire de gènes de composantes de la qualité des
fruits dans les ressources génétiques sauvages et
cultivées de tomate ; recherche
Page 72
Références bibliographiques
d'associations gènes/QTL. Thèse de Doctorat en
Sciences, l'Ecole Nationale Supérieure Agronomique de Montpellier.
261p.
Ravandeh M., Valizadeh J., Noroozifar M.et
Khorasani-Motlagh M., 2011.Screening of chemical composition of
essential oil, mineral element and antioxidant activity in Pulicaria
undulate (L) C.A. Mey from Iran. J.of medicinal plants Research,
5: 2035-2040.
Remmal A., Bouchikhi T., Rhayour K., Ettayebi M. et
Tantaoui-Elaraki , A., 1993. Improved method for determination of
antimicrobial activity of essential oils in agar medium. Journal of Essential
Oil Research. 5: 179-184.
Rodrigues T., Berbee M., Simmons E.G., Cardoso C.R,
Reis A., Maffia L.A. et Mizubuti E.S.G., 2010. First report of
Alternaria tomatophila and A.grandis causing early blight on tomato
and potato in Brazil. In New Disease Reports,22, 28
Romanik G., Gilgenast E., Przyjazny A. et Kaminski
M., 2007.Techniques of preparing plant material for chromatographic
separation and analysis, J Biochem Biophys Methods, 70, 253-261.
Selvakumar P., Edhaya Naveena .B et Prakash D.S.,
2012. Studies on the antidandruff activity of the essential oil of
coleus amboinicus and eucalyptus globules, asian pacific journal of tropical
biomedicine. pp 715-719.
Sherf AF. et MacNab AS., 1986.Vegetable desease
and their control.Wiley, NewYork.
Siciliano I., Gilardi G., Giuseppe O., Ulrich G.,
Gullino, M. L. et Garibaldi A., 2017. Identification and
characterization of Alternaria species causing leaf spot on cabbage,
cauliflower, wild and cultivated rocket by using molecular and morphological
features and mycotoxin production. In European Journal of Plant Pathology.
2:401-413.
Simmons EG., 1992.Alternaria
taxonomy : curent status, viewpoint, change, in Alternaria
Biology, Plant desease and metabolites, J. Chelkewski and A. visconti, Ed.
Elsivier, Amesterdam. The Netherlands.1-35.
Simmons EG., 2007.Alternaria.An
identification Manual :CBS biodiversity series N6.CBS Fungal biodiversity
centre, Utrecht, the Netherlands.755p
Snoussi S., 2010. Rapport de mission : Etude
de base sur la tomate en Algérie. Ministère de l'Agriculture et
du Développement Rural, Direction des statistiques. (MADR).
Page 73
Références bibliographiques
Vaquera S., Patriarca A. et Fernández Pinto
A.,2014. Water activity and temperature effects on growth of
Alternaria arborescens on tomato medium. International Journal of Food
Microbiology, 136-139
Virginia E., Fernández P.et Andrea P., 2016.
Alternaria Species and Their Associated Mycotoxins In
Mycotoxigenic Fungi
Wayerstahl P., Marchal H., Weirach M., Thefeld K. et
Surburg H., 1998.Constituents of the commercial Labdanumn oil. Flavour
fragr. J.13:295-318
Zheng H. H., 2015. Characterization of
Alternaria species associated with potato foliar diseases in China. IN
Plant Pathology. 64:425-433
Znini M., Cristofari G., Majidi L., Mazouz H., Tomi
P., Paolini J., et Costa, J. 2011.420 Antifungal activity of essential
oil from Asteriscus graveolens against postharvest421 phytopathogenic
fungi in apples. Natural Product Communications, 6, 1763-1768.
ANNEXES
Annexes
Annexe1: Milieux de culture
PDA : Ptatos Dextrose Agar
· Pomme de terre 200 g
· Sucrose 10 g
· Agar 15 g
· Eau distillée 1000 ml
PCA : Pomme de terre Carotte Agar
· Pomme de terre 40 g
· Carotte 40 g
· Agar 20 g
· Eau distillée 1000ml
Lactophénol:
|
·
|
Glycérol
|
40g
|
|
·
|
Phénol
|
20g
|
|
·
|
Acide lactique
|
20g
|
Annexe2 : Cinétique de la croissance
? De la plante de Pulicaria maurintanica
Cinétique de la souche A01
|
A01
|
0,8 ul/ml
|
0,95ul/ml
|
1,1ul/ml
|
témoin
|
|
j3
|
6#177;0
|
6#177;0
|
6#177;0
|
21,4#177;0
|
|
j4
|
6,5#177;0,5
|
6,33#177;0,57
|
6#177;0
|
28,3#177;0
|
|
j5
|
9#177;1,5
|
7,16#177;2,02
|
6#177;0
|
35,16#177;0.1
|
|
j6
|
13,83#177;4,53
|
8,33#177;3,17
|
8#177;2,17
|
40,16#177;0.1
|
|
j7
|
17,33#177;1,75
|
11,5#177;2,64
|
10,66#177;2,75
|
44,5#177;0
|
|
j8
|
19#177;1,73
|
17,66#177;5,29
|
16,5#177;1,80
|
50,3#177;0.1
|
|
j9
|
25,16#177;3,54
|
21#177;2,29
|
20,16#177;2,51
|
58,6#177;0.2
|
|
j10
|
28,5#177;4,58
|
23,06#177;1,67
|
20,16#177;2,08
|
61,16#177;0.1
|
Annexes
Cinétique de la souche A10
|
A10
|
0,8ul/ml
|
0,95ul/ml
|
1,1ul/ml
|
témoin
|
|
j3
|
6,66#177;1,15
|
6#177;0
|
6#177;0
|
31,4#177;0.1
|
|
j4
|
8,33#177;2,84
|
6,16#177;0,28
|
6#177;0
|
41,6#177;0.2
|
|
j5
|
13,66#177;4,61
|
10,66#177;0,28
|
6,66#177;1,15
|
49,3#177;0.1
|
|
j6
|
21,16#177;4,64
|
17,16#177;0,28
|
10#177;3,6
|
59,5#177;0.1
|
|
j7
|
25,66#177;7,0
|
22,83#177;0,28
|
14,5#177;5,07
|
67,6#177;0.2
|
|
j8
|
34#177;7,93
|
32#177;1
|
19,66#177;7,23
|
73,1#177;0.6
|
|
j9
|
43,66#177;11,11
|
41,66#177;1,6
|
30#177;7,54
|
81,8#177;0.5
|
|
j10
|
46,66#177;12,90
|
47#177;1,73
|
33,5#177;8,18
|
83,1#177;0.6
|
Cinétique de la souche A18
|
A18
|
0,8ul/ml
|
0,95ul/ml
|
1,1ul/ml
|
Témoin
|
|
j3
|
6,5#177;0
|
6#177;0
|
6#177;0
|
26,5#177;0.1
|
|
j4
|
7,33#177;0,57
|
6,16#177;0,28
|
6#177;0
|
34#177;0.1
|
|
j5
|
9#177;3,46
|
6,33#177;0,57
|
6#177;0
|
40,6#177;0.1
|
|
j6
|
14,05#177;6,16
|
9,33#177;4,93
|
6#177;0
|
47,5#177;0.3
|
|
j7
|
14,33#177;6,21
|
11,5#177;6,24
|
6#177;0
|
50,6#177;0.8
|
|
j8
|
26,33#177;6,25
|
16#177;8,32
|
6#177;0
|
54,6#177;0.9
|
|
j9
|
39#177;15,17
|
26,83#177;6,02
|
6#177;0
|
58,3#177;1.3
|
|
j10
|
37,16#177;5,05
|
31,33#177;2,30
|
6#177;0
|
59,8#177;1.6
|
Cinétique de la souche A37
|
A37
|
0,8ul/ml
|
0,95ul/ml
|
1,1ul/ml
|
Témoin
|
|
j3
|
7#177;1,73
|
6,66#177;1,15
|
6#177;0
|
23#177;0.1
|
|
j4
|
10,5#177;3,12
|
8,5#177;2,17
|
6#177;0
|
45,1#177;0.1
|
|
j5
|
16,83#177;4,31
|
11#177;4,58
|
6#177;0
|
53,5#177;0.3
|
|
j6
|
23,83#177;5,61
|
13,83#177;7,75
|
6#177;0
|
57,8#177;0.9
|
|
j7
|
31,33#177;3,75
|
18,5#177;10,33
|
6#177;0
|
63,8#177;1.2
|
|
j8
|
38,83#177;5,39
|
22#177;11,13
|
6#177;0
|
66#177;1.5
|
|
j9
|
48,83#177;4,01
|
32,16#177;11,23
|
6#177;0
|
70,5#177;1.3
|
|
j10
|
53,66#177;3,68
|
35,33#177;11,026
|
6#177;0
|
76,8#177;1
|
Annexes
Cinétique de la souche A42
|
A42
|
0,8ul/ml
|
0,95ul/ml
|
1,1ul/ml
|
temoin
|
|
j3
|
7#177;0,86
|
6#177;
|
6#177;
|
35,3#177;0
|
|
j4
|
10,33#177;2,88
|
6,16#177;0,28
|
6#177;
|
43,8#177;0
|
|
j5
|
13,66#177;4,72
|
11#177;0
|
6,33#177;0,57
|
49,1#177;0.2
|
|
j6
|
23,16#177;5,79
|
15,16#177;2,46
|
6,5#177;0,5
|
56,6#177;0.4
|
|
j7
|
31,33#177;6,78
|
23#177;2,64
|
10,33#177;1,44
|
57,6#177;0.6
|
|
j8
|
40#177;6,53
|
30,33#177;3,25
|
15,66#177;2,36
|
58,8#177;0.6
|
|
j9
|
50,66#177;6,65
|
39,33#177;2,36
|
24,33#177;5,05
|
60,5#177;0.6
|
|
j10
|
56,36#177;9,48
|
40,16#177;2,51
|
28#177;6,94
|
61#177;0.7
|
Cinétique de la souche A45
|
A45
|
0,8ul/ml
|
0,95ul/ml
|
1,1ul/ml
|
Témoin
|
|
J3
|
9,33#177;3,51
|
6
|
6,66#177;0
|
32#177;0
|
|
J4
|
13,16#177;6,29
|
8,08#177;0,8
|
10,5#177;3,96
|
39,5#177;0
|
|
J5
|
18,66#177;4,53
|
15,16#177;1,25
|
15,5#177;4,92
|
48,5#177;0.1
|
|
J6
|
28,83#177;7,81
|
20#177;7
|
21,16#177;3,25
|
61#177;0.2
|
|
J7
|
31,16#177;6,21
|
28,33#177;1,44
|
25#177;4,33
|
60,3#177;0.1
|
|
J8
|
36,33#177;5,00
|
34,16#177;1,60
|
27,83#177;2,02
|
70,6#177;0.5
|
|
J9
|
40,33#177;7,97
|
37,66#177;3,61
|
31,33#177;2,51
|
74,3#177;0.5
|
|
J10
|
41,83#177;11,40
|
40,16#177;7,28
|
32,5#177;1,5
|
76,5#177;0.4
|
Cinétique de la souche A51
|
A51
|
0,8ul/ml
|
0,95ul/ml
|
1,1ul/ml
|
témoin
|
|
j3
|
7#177;0,86
|
6#177;0
|
6#177;0
|
36#177;0
|
|
j4
|
10,5#177;1,32
|
7,5#177;0,86
|
6#177;0
|
42,8#177;0.2
|
|
j5
|
15,66#177;1,44
|
12,66#177;1,52
|
7,33#177;0,57
|
49,6#177;0.3
|
|
j6
|
21,33#177;1,25
|
17,83#177;1,25
|
13,16#177;1,25
|
57#177;0.5
|
|
j7
|
27,66#177;2,02
|
22,83#177;1,52
|
19,16#177;1,25
|
59,1#177;0.8
|
|
j8
|
34,5#177;1,32
|
30,16#177;2,84
|
23,66#177;0,28
|
64,3#177;0.8
|
|
j9
|
43,66#177;2,51
|
43#177;2,17
|
36,83#177;2,56
|
74#177;1.5
|
|
j10
|
48,83#177;2,92
|
45,83#177;2,75
|
40,33#177;3,05
|
73,6#177;1.5
|
Annexes
Cinétique de la souche A57
|
A57
|
0,8ul/ml
|
0,95ul/ml
|
1,1ul/ml
|
Témoin
|
|
j3
|
7#177;0,86
|
6#177;0
|
6#177;0
|
29,1#177;0.4
|
|
j4
|
10#177;2,78
|
6,33#177;0,57
|
6#177;0
|
39,1#177;0.1
|
|
j5
|
10,83#177;2,02
|
10,16#177;1,25
|
6#177;0
|
47,8#177;0.1
|
|
j6
|
15,16#177;2,75
|
13,83#177;1,89
|
6#177;0
|
53,6#177;0.2
|
|
j7
|
19,5#177;3,04
|
18,73#177;2,13
|
6#177;0
|
60,1#177;0.5
|
|
j8
|
26,5#177;4,58
|
26#177;3,60
|
6#177;0
|
63,5#177;1
|
|
j9
|
30,5#177;3,96
|
31,33#177;3,17
|
6#177;0
|
69#177;1
|
|
j10
|
36#177;4,09
|
35,16#177;4,64
|
6#177;0
|
71,3#177;1
|
Cinétique de la souche AT1
|
AT1
|
0,8ul/ml
|
0,95ul/ml
|
1,1ul/ml
|
Témoin
|
|
j3
|
7,5#177;1,5
|
6,5#177;0,86
|
6#177;0
|
30,8#177;0.5
|
|
j4
|
10,16#177;2,25
|
8,33#177;0,76
|
6#177;0
|
42,3#177;0.4
|
|
j5
|
14,16#177;2,25
|
14#177;3,46
|
6#177;0
|
51,2#177;0.5
|
|
j6
|
18,33#177;2,51
|
17,6#177;2,02
|
6#177;0
|
57,1#177;0.4
|
|
j7
|
28,83#177;2,46
|
23,66#177;9,56
|
6#177;0
|
64,8#177;0.4
|
|
j8
|
36,5#177;2,56
|
31,16#177;11,82
|
6#177;0
|
72,3#177;0.7
|
|
j9
|
44,83333#177;3,51
|
36,66#177;13,25
|
6#177;0
|
73#177;0.2
|
|
j10
|
47,33#177;3,12
|
40#177;13,01
|
6#177;0
|
75,3#177;0.2
|
Cinétique de la souche AT4
|
AT4
|
0,8ul/ml
|
0,95ul/ml
|
1,1ul/ml
|
Témoin
|
|
j3
|
6,5#177;0,5
|
6#177;0
|
6#177;0
|
25,6#177;0
|
|
j4
|
8#177;1,5
|
8,33#177;0,57
|
6#177;0
|
37,3#177;0
|
|
j5
|
10,33#177;2,08
|
8,16#177;2,02
|
6#177;0
|
44,6#177;0
|
|
j6
|
14#177;0,5
|
10,83#177;0,57
|
6#177;0
|
52,8#177;0
|
|
j7
|
18,33#177;2,51
|
14,66#177;3,75
|
6#177;0
|
57,2#177;0.2
|
|
j8
|
23,5#177;4,09
|
21,66#177;2,88
|
6#177;0
|
64,5#177;0.6
|
|
j9
|
31,33#177;3,17
|
28,16#177;2,02
|
6#177;0
|
67,5#177;0.9
|
|
j10
|
32,5#177;0,5
|
28,83#177;7,50
|
6#177;0
|
70,6#177;0.7
|
Annexes
? De la plante de Micromeria debilis
Cinétique de la souche A01
|
A01
|
0,95ul/m
|
1,1ul/ml
|
témoin
|
|
j3
|
6#177;0
|
6#177;0
|
24,6#177;2.5
|
|
j4
|
8,33#177;0.5
|
6,33#177; 0.5
|
28,5#177;1.3
|
|
j5
|
10,66#177;0.5
|
7,66#177; 0.5
|
36,5#177;6.2
|
|
j6
|
13,33#177;0.5
|
10#177; 1
|
43,8#177;0.3
|
|
j7
|
17,33#177;0.5
|
11,66#177; 0.5
|
49,5#177;7.7
|
|
j8
|
19,66#177;0.5
|
13,3 #177; 0.5
|
58#177;3.5
|
|
j9
|
22,33#177;0.7
|
16,83 #177;1.5
|
62,3#177;2.2
|
|
j10
|
24,5#177;0.5
|
18,33#177; 1.5
|
65,3#177;2.5
|
Cinétique de la souche A10
|
A10
|
0,95ul/ml
|
1,1ul/ml
|
témoin
|
|
j3
|
10,66#177; 2
|
8#177;1
|
34#177;1
|
|
j4
|
14,6#177; 1.5
|
11.66#177;1.5
|
43,5#177;1.3
|
|
j5
|
21,66#177; 2
|
14.66#177;2
|
51,6#177;2.7
|
|
j6
|
26,66#177;1.5
|
19.83#177;4.6
|
63,5#177;1.3
|
|
j7
|
37,66#177;1.1
|
26#177;6.2
|
73,6#177;2.2
|
|
j8
|
43,33#177;1.5
|
31.5#177;8.2
|
85#177;0
|
|
j9
|
48,66#177;1.7
|
36.83#177;8.8
|
85,8#177;0.5
|
|
j10
|
54,5#177; 1.3
|
42.5#177;9.1
|
88#177;1
|
Cinétique de la souche A18
|
A18
|
0,95ul/ml
|
1,1ul/ml
|
témoin
|
|
j3
|
6,5#177;0.5
|
6,33#177;0.5
|
28,6#177;1.5
|
|
j4
|
8,33#177;0.7
|
8,83#177;1
|
33,5#177;1.5
|
|
j5
|
11,33#177;0.7
|
10,33#177;0.7
|
37,6#177;1.6
|
|
j6
|
14#177;1.3
|
11#177;1
|
47,1#177;4
|
|
j7
|
16#177;1.3
|
11,66#177;0.7
|
55#177;4.2
|
|
j8
|
22,33#177;1
|
17,33#177;3.7
|
65,3#177;2.5
|
|
j9
|
28#177;2.2
|
24,5#177;2.7
|
77,1#177;0.7
|
|
j10
|
31#177;2.2
|
27,33#177;.2
|
79,8#177;0.7
|
Annexes
Cinétique de la souche A37
|
A37
|
0,95ul/ml
|
1,1ul/ml
|
témoin
|
|
j3
|
10,5#177;0.5
|
6#177;0
|
32,6#177;3.4
|
|
j4
|
16,8#177;1
|
10,5#177;0.5
|
42,8#177;4
|
|
j5
|
21,1#177;0.2
|
14,16#177;0.7
|
48,8#177;3.8
|
|
j6
|
27,8#177;1.2
|
20#177;0.5
|
58,3#177;5.2
|
|
j7
|
35#177;1.3
|
25#177;1.7
|
69,6#177;6.6
|
|
j8
|
42,5#177;2.7
|
29,1#177;0.7
|
77,3#177;2.2
|
|
j9
|
50,5#177;3.2
|
36,6#177;0.7
|
81,6#177;1.6
|
|
j10
|
53,3#177;2
|
43,5#177;1.5
|
82,16#177;0.7
|
Cinétique de la souche A42
|
A42
|
0,95ul/ml
|
1,1ul/ml
|
témoin
|
|
j3
|
6#177;0
|
6#177;0
|
27,8#177;0.2
|
|
j4
|
11,66#177;0.5
|
6#177;0
|
36,6#177;1
|
|
j5
|
19,66#177;1.2
|
6#177;0
|
44,1#177;1.2
|
|
j6
|
26,8#177;1.2
|
6#177;0
|
53,5#177;2
|
|
j7
|
35#177;1.8
|
6#177;0
|
62,5#177;2.7
|
|
j8
|
43,8#177;2
|
6#177;0
|
68,6#177;5.96
|
|
j9
|
49,6#177;2
|
6#177;0
|
74,1#177;3.3
|
|
j10
|
52,66#177;1.2
|
6#177;0
|
79#177;1.5
|
Cinétique de la souche A45
|
A45
|
0,95ul/ml
|
1,1ul/ml
|
témoin
|
|
j3
|
9,16#177;0.7
|
6#177;0
|
32,5#177;1.6
|
|
j4
|
13,1#177;1.7
|
8,5#177;0.5
|
41#177;1.5
|
|
j5
|
16,8#177;1.6
|
12,3#177;1
|
48#177;2.5
|
|
j6
|
20,16#177;1.4
|
16#177;1.3
|
56,1#177;3.1
|
|
j7
|
23#177;1
|
19,5#177;0.8
|
66,6#177;2.7
|
|
j8
|
26,16#177;0.7
|
22,83#177;1.2
|
75,8#177;2.3
|
|
j9
|
30#177;0.5
|
26,5#177;0.8
|
80,3#177;0.2
|
|
j10
|
32,3#177;1.7
|
29,8#177;1.2
|
83#177;1.6
|
Annexes
Cinétique de la souche A51
|
A51
|
0,95ul/ml
|
1,1ul/ml
|
témoin
|
|
j3
|
7,66#177;0.7
|
6,8#177;0.2
|
33,5#177;2.7
|
|
j4
|
12,33#177;0.7
|
11,8#177;0.7
|
43#177;4.4
|
|
j5
|
16#177;1.8
|
15,1#177;1
|
48,8#177;3.6
|
|
j6
|
20#177;2.5
|
19,1#177;0.7
|
56,3#177;4.8
|
|
j7
|
25,66#177;2.7
|
24#177;1.3
|
66,1#177;9.3
|
|
j8
|
33,1#177;2
|
29,1#177;3.5
|
68,7#177;4.3
|
|
j9
|
38#177;1.8
|
37,66#177;4.4
|
72,6#177;2.9
|
|
j10
|
43#177;4.5
|
42,73#177;3.7
|
76,3#177;2.5
|
Cinétique de la souche A57
|
A57
|
0,95ul/ml
|
1,1ul/ml
|
témoin
|
|
j3
|
6#177;0
|
6#177;0
|
22,3#177;4.8
|
|
j4
|
6#177;0
|
6#177;0
|
27,5#177;4
|
|
j5
|
6#177;0
|
6#177;0
|
34,5#177;4.3
|
|
j6
|
6#177;0
|
6#177;0
|
41,8#177;3.8
|
|
j7
|
6#177;0
|
6#177;0
|
48,5#177;5.7
|
|
j8
|
6#177;0
|
6#177;0
|
57,3#177;8.3
|
|
j9
|
6#177;0
|
6#177;0
|
69,3#177;6.8
|
|
j10
|
6#177;0
|
6#177;0
|
78,5#177;5.5
|
Cinétique de la souche AT1
|
AT1
|
0,95ul/ml
|
1,1ul/ml
|
témoin
|
|
j3
|
9,5#177;0.5
|
7,1#177;0.2
|
31#177;0.5
|
|
j4
|
14#177;0.5
|
10,8#177;0.7
|
40,5#177;0.8
|
|
j5
|
17,3#177;1
|
14,1#177;1
|
49,5#177;1.3
|
|
j6
|
22,3#177;1.8
|
19,5#177;1.5
|
56,5#177;1.5
|
|
j7
|
29#177;3.6
|
24,6#177;2.3
|
66,8#177;2.4
|
|
j8
|
35,5#177;3.1
|
31,8#177;3.7
|
74,6#177;2.3
|
|
j9
|
43,1#177;2.9
|
38,8#177;5.2
|
80,8#177;1
|
|
j10
|
48,33#177;2.9
|
43#177;4
|
82,8#177;0.7
|
Annexes
Cinétique de la souche AT4
|
AT4
|
0,95ul/ml
|
1,1ul/ml
|
témoin
|
|
j3
|
8#177;1
|
6,33#177;0.5
|
32,3#177;0.7
|
|
j4
|
12,16#177;0.7
|
8,8#177;0.28
|
40,1#177;2.3
|
|
j5
|
15,83#177;0.2
|
11,16#177;0.7
|
52#177;3.4
|
|
j6
|
20,6#177;1
|
14,8#177;0.2
|
59#177;1.5
|
|
j7
|
25,5#177;1.8
|
23,1#177;2.7
|
69,8#177;1.2
|
|
j8
|
31,5#177;0.5
|
25#177;1
|
78,6#177;3
|
|
j9
|
37,66#177;0.76
|
30,1#177;1
|
82,5#177;3.2
|
|
j10
|
42,3#177;1.2
|
36,16#177;2.2
|
82,6#177;2
|
Annexe 3: Taux d'inhibition de la croissance
> De la plante de Pulicaria
mauritanica
P.maurintanica
|
A01
|
A10
|
A18
|
A37
|
A42
|
A45
|
A51
|
A57
|
AT1
|
AT4
|
0,8ul/ml
|
59,2
|
47,25
|
42,06
|
32,67
|
8,42
|
49,17
|
36,63
|
54,05
|
50,93
|
58,97
|
0,95ul/ml
|
69,05
|
46,82
|
52,91
|
58,56
|
37,87
|
51,53
|
41,07
|
55,33
|
40,35
|
64,65
|
1,1ul/ml
|
74,31
|
64,33
|
100
|
100
|
60
|
62,41
|
49,21
|
100
|
100
|
100
|
|
> De la plante de Micomeria
debilis
M.debilis
|
A01
|
A10
|
A18
|
A37
|
A42
|
A45
|
A51
|
A57
|
AT1
|
AT4
|
0,95ul/ml
|
68,8
|
40,8
|
66,1
|
37,8
|
36,
|
65,8
|
47,3
|
100
|
44,8
|
52,5
|
1,1ul/ml
|
79,2
|
55,4
|
71
|
50,7
|
100
|
69
|
47,7
|
100
|
51,8
|
60,6
|
|
Annexe 4 : Taux d'inhibition de la sporulation
> De la plante de Pulicaria
mauritanica
|
P.maurintanica
|
A01
|
A10
|
A18
|
A37
|
A42
|
A45
|
A51
|
A57
|
AT1
|
AT4
|
|
0,8ul/ml
|
47,3#177;0,6
|
6,3#177;3,7
|
38,6#177;1,6
|
42#177;1,3
|
34,5#177;0,7
|
47,8#177;0,3
|
11#177;0,5
|
47,2#177;3
|
37,5#177;0.1
|
66#177;3
|
|
0,95ul/ml
|
97,3#177;0,1
|
67,9#177;1,8
|
34,5#177;4,4
|
90#177;0,2
|
80,9#177;0,4
|
60,7#177;0,4
|
99#177;0,1
|
97,3#177;4
|
62,2#177;0.2
|
74#177;1,8
|
|
1,1ul/ml
|
100#177;0
|
68,8#177;3,8
|
100#177;0
|
90#177;0,2
|
97,6#177;0,1
|
86,9#177;0,3
|
100#177;0
|
100#177;0
|
74,8#177;0.1
|
80#177;1,2
|
Annexes
> De la plante de Micromeria
debilis
|
M.debilis
|
A01
|
A10
|
A18
|
A37
|
A42
|
A45
|
A51
|
A57
|
AT1
|
AT4
|
|
0,95ul/ml
|
74,6#177;0,3
|
37,4 #177;1
|
53,6#177;0,7
|
30,#177;0,5
|
50#177;0,2
|
80,4#177;0,4
|
27,#177;0,1
|
100#177;0
|
71,4#177;0,1
|
40#177;0,3
|
|
1,1ul/ml
|
100 #177;0
|
62,5#177;0,8
|
69,1#177;0,5
|
100 #177;0
|
100#177;0
|
93,4#177;0,2
|
81,8#177;0,1
|
100#177;0
|
92,8#177;0,1
|
100 #177;0
|
Annexe 5 : Vitesse de la croissance
> De la plante de Pulicaria
maurintanica
|
P.maurintanica
|
A01
|
A10
|
A18
|
A3
|
A42
|
A45
|
A51
|
A57
|
AT1
|
AT4
|
|
0ul/ml
|
0,56
|
0,79
|
0,61
|
0,74
|
0,69
|
0,76
|
0,76
|
0,71
|
0,76
|
0,68
|
|
0,8ul/ml
|
0,21
|
0,33
|
0,26
|
0,38
|
0,39
|
0,35
|
0,35
|
0,26
|
0,33
|
0,25
|
|
0,95ul/ml
|
0,17
|
0,31
|
0,21
|
0,25
|
0,28
|
0,3
|
0,31
|
0,25
|
0,3
|
0,21
|
|
1,1ul/ml
|
0,16
|
0,22
|
0,08
|
0,08
|
0,19
|
0,26
|
0,26
|
0,08
|
0,08
|
0,08
|
> De la plante de Micomeria
debilis
|
M.debilis
|
A01
|
A10
|
A18
|
A37
|
A42
|
A45
|
A51
|
A57
|
AT1
|
AT4
|
|
0ul/ml
|
0,61
|
0,85
|
0,71
|
1,2
|
0,73
|
0,79
|
0,77
|
0,65
|
0,79
|
0,8
|
|
0,95ul/ml
|
0,2
|
0,42
|
0,23
|
0,42
|
0,39
|
0,28
|
0,32
|
0,08
|
0,37
|
0,32
|
|
1,1ul/ml
|
0,15
|
0,32
|
0,2
|
0,31
|
0,08
|
0,23
|
0,31
|
0,08
|
0,32
|
0,08
|
Résumé
Le but de ce travail était d'évaluer
l'activité antifongique in vitro des huiles essentielles de
deux plantes aromatiques de la région de Naama :Pulicaria
mauritanica et Micromeria debilis vis-à-vis de dix souches
fongiques du genre Alternaria sp responsables de l'alternariose de la
plante de tomate.
L'identification des isolats fongiques a été
basée sur les caractères culturaux et les caractères
morphologiques. Les souches identifiées appartiennent aux espèces
Alternaria alternata, Alternaria tenuissima, Alternaria solani et
Alternaria tomatophila.
Le rendement en huile essentielle issu d'une extraction par
hydrodistillation était de l'ordre de 0.30% et 0.045% pour
P.mauritanica et M.debilis respectivement. L'étude de
l'activité antifongique de ces huiles par la méthode de contact
direct a révélé une importante activité
vis-à-vis des souches testées.
L'efficacité de chaque HE est estimée par la
détermination du taux d'inhibition de la croissance mycélienne et
le taux d'inhibition de la sporulation, d'où l'inhibition total de la
majorité des souches nous a donné des valeurs de CMI comprises
entre 0.95 à 1.1ul/ml.
En conclusion, ces huiles peuvent être
considérées comme une alternative potentielle aux fongicides
synthétiques.
Mots clés : Pulicaria mauritanica
;Micromeria debilis ,Alternaria sp, Hydrodistillation ,Huile essentielle,
Activité antifongique.

Úæä äã
ÉíÑØ
ÊáÇáÇÓ ÉÑÔÚ
ØíÈËÊ ÏåÈ
ßáÐæ "ÓíáÈÏ
ÇíÑíãæÑßíã
"æ
"ÇßíäÇÊíÑæã
ÇíÑÇßíáæÈ"
: Çãåæ
ÉãÇÚäáÇ
ÉÞØäã
. "
"ÇÊÇäÑÊáÇ
ÇíÑÇäÑÇÊáÇ
"ìáÅ íãÊäÊ
ÇåÏíÏÍÊ ãÊ
íÊáÇ
ÊáÇáÇÓáÇ .
ÉíÌæáæÑæãáÇ
ÊÇÕáÇ ìáÚ
ÉíÑØáÇ
ÊáÇÒÚáÇ
ÉÑÚã í
ÇäÏäÊÓÇ
áÇíæØÇãæØ
ÇíÑÇäÑÇÊáÇ "
æ "íäáÇæÓ
ÇíÑÇäÑÇÊáÇ
""ÇãíÓæäÊ
ÇíÑÇäÑÇÊáÇ"
0.30 ÊäÇß
ÑÇÎÈáÇÈ
ÑíØÞÊáÇ
ÉØÓÇæÈ
ÕáÇÎÊÓáÇÇ
äÚ ÌÊÇäáÇ
íÑØÚáÇ
ÊíÒáÇ
ÉíÏæÏÑã
ÇíÑÇßíáæÈ"
:á % 0.045 æ %
ÊáÇáÇÓáÇ
æãäá
ÉØÈËãáÇ
áíßÔÊ
ØíÈËÊ ÇÐßæ
ÉíÑØáÇ
ãíÞ ÏíÏÍÊ
ááÇÎ äã ãÊ
ÊæíÒáÇ åÐå
ÉíáÇÚ äÅ
íáÇÊáÇÈæ
.ÇåÑÇÈÊÎÇ
ÒíßÇÑÊáÇ
ãÙÚã
ìáÅ
1.1
0.95
ÊÇíÑØáÇ
.áã /
ÑÊáæÑßíã
ØíÈËÊ
ÇäÇØÚ äí
ÛÇæÈáÇÇ
äíÈ Çã
ØÈËã ÖÎäã
񒧄懂
ãíÞ
ÕÎáã
äã
äíÊíÑØÚ
äíÊÊÈä äã
ÉÕáÎÊÓãáÇ
ÉÑÇíØáÇ
ÊæíÒáÇ ìÏá
ÊÇíÑØáá
ÏÇÖãáÇ
áæÚãáá
íÑÈÎãáÇ
ãííÞÊáÇÈ
ÉÓÇÑÏáÇ åÐå
ãÊåÊ
ãØÇãØáÇ
ÉÊÈäá
ÉíÑØáÇ
ÖÇÑãá á
ÉÈÈÓãáÇ
"ÇíÑÇäÑÇÊáÇ"
.íáÇæÊáÇ
ìáÚ "ÓíáÈÏ
ÇíÑ íãÑßí ã"
æ
"ÇßíäÇÊíÑæã
ãÊ íÊáÇ
ÊáÇáÇÓáÇ
åÇÌÊ ãåã
ØÇÔä äÚ
ÑÔÇÈãáÇ
ÓãáÇÊáÇ
ÉÞíÑØ
ÉØÓÇæÈ
ÊæíÒáÇ åÐåá
ÊÇíÑØáá
ÏÇÖãáÇ
ØÇÔäáÇ
ÉÓÇÑÏ ÊÔß
ÊÇíÑØáá
ÏÇÖã ØÇÔä
ÑÇí Ø ÊíÒ
ÑÇÎÈáÇÈ
ÑíØÞÊáÇ
ÇíÑÇäÑÇÊáÇ
ÓíáÈÏ
ÇíÑíãÑßíã
ÇßíäÇÊíÑæã
ÇíÑÇßíáæÈ:
.ÉíÆÇíãíßáÇ
ÊÇíÑØáÇ
ÊÇÏíÈãá
áÇÇÚ æ áÇíÏÈ
áÇÍ ÊæíÒáÇ
åÐå ÑÇÈÊÚÇ
äßãí ãÇÊÎáÇ
í
ÉíÍÇÊãáÇ
ÊÇãáßáÇ
Abstract
This stady aimed to evaluate in vitro the antifungal
activity of the essential oils of two aromatic plants growing in Naama:
Pulicaria mauritanica and Micromeria debilis against ten
fungal strains belonging Alternaria sp responsible of the fungal
diseases that infect tomatoes..
The identification of fungal isolates was based on cultural
traits and morphological characters. The results showed that the identified
strains belong to the following species: Alternaria alternata, Alternaria
tenuissima, Alternaria solani and Alternaria tomatophila.
While, the yield of essential oil resulting from a
hydrodistillation extraction was of the order of 0.30% and 0.045% for
P.mauritanica and M.debilis respectively. The study of the
antifungal activity of these oils by the direct contact method revealed an
important activity to some strains tested.
The effectiveness of each EO is estimated by determining the
inhibition rate of mycelial growth and the rate of inhibition of sporulation,
where the total inhibition of the majority of strains gave us MIC mean value
ranging between 0.95 to 1.1ìl / ml.
Finally, these oils can be considered as a potential
alternative to synthetic fungicides. Key words: Pulicaria
mauritanica, Micromeria debilis, Alternaria sp, Hydrodistillation,
Essential oil, Antifungal activity.
|
|



