|

Laboratoire de Productivité
végétale et contraintes
envirenmentales
Département de Biologie
Faculté des Sciences de Tunis
Campus
Universitaire
Mémoire présenté en vue de l'obtention
de Diplôme de Mastère
En Biologie Physiologie Végétales Parcours:
Productivité Végétale Intitulé :
Effet de la pollution atmosphérique sur la
composition biochimique de Ricinus communis:
Cas des particules de ciment de la cimenterie de
Bir Mechergua
Présenté par :
Mlle Razgui
Eya
Soutenu le : 12/ 12/ 2018, devant le jury composé de
:
Mme Chiraz Chafei : Professeur Président
MrKarim Hosni : Maître de Conférence
Examinateur
Mme Hela Mahmoudi : Maître
assistante Encadreur
Année Universitaire : 2018 - 2019
Remerciements
Ce travail a été réalisé à
la Faculté des Sciences de Tunis dans le Laboratoire de
Productivité Végétale et Contraintes Environnementales, au
sein de l'équipe de Madame le Professeur Zeineb OUERGHI
ABIDI. Ses qualités humaines et sa disponibilité sont
remarquables. Je tiens à lui exprimer ma gratitude et ma reconnaissance
de m'accepter dans son laboratoire.
Je tiens à remercier tout particulièrement
madame Chiraz CHAFEI, Professeur à la Faculté
des Sciences de Tunis, pour avoir accepté de présider mon jury de
mastère. Je tiens à lui exprimer ma gratitude et ma
reconnaissance.
Une grande part de ma reconnaissance s'adresse à mon
encadreur, Dr. Hela MAHMOUDI, Maître Assistante à
l'Institut Supérieur de Biotechnologie de Béja. Elle a
consacré énormément de son temps pour l'analyse et
l'interprétation des résultats, la présentation et la
correction du mémoire. Qu'elle trouve ici un témoignage de ma
sincère reconnaissance, de mon plus profond respect et de ma plus haute
considération.
Mes remerciements s'adressent également à
Dr. Karim Hosni, Maître de Conférence à
l'Institut National de Recherche et d'Analyse Physico-Chimique pour avoir
accepté d'évaluer ce travail en tant que membre de jury. Qu'il
trouve ici l'expression de ma profonde reconnaissance pour
l'intérêt constant qu'il n'a cessé d'accorder à mon
travail et pour ses efforts considérables dans l'analyse et
l'interprétation de la partie biochimique et pour ses qualités
humaines.
Je tiens à remercier Mes dames Najoua BOURAOUI,
Imen BEN SALAH Héla BEN AHMED, Sabah M'RAH, Mouhiba BEN
NASRI AYACHI, pour leur soutien et leur gentillesse durant toutes ces
années d'étude.
Je tiens à exprimer mes sincères remerciements
à mes amis: Soumaya, Houssem, Mohamed, Wafa, Ameni, Monia
qui m'ont aidé d'une manière ou d'une autre à la
réalisation de ce travail.
Un merci collectif à tous les membres de Laboratoire de
Productivité Végétale et Contraintes Environnementales
à la faculté des sciences de tunis.
Que tous ceux qui m'a aidé d'une manière ou
d'une autre et qui n'ont pas été cités, qu'ils trouvent
ici l'expression de mes meilleurs sentiments.
Dédicace
Je dédie humblement ce manuscrit à :
Mes parents, pour leurs encouragements, leurs soutiens tout au
long de mon cursus, les
sacrifices qu'ils ont consentis pour mon
éducation et ma formation. L'amour et l'affection
qu'ils ont su
m'apporter afin de mener à bien ce travail. Qu'ils trouvent ici le
témoignage de
ma reconnaissance.
Mes frères, pour tous les moments de bonheur qu'on
s'est partagés et pour toutes leurs aides. Mes meilleures amies, pour
leur soutien moral.
Je vous aime.
Liste des abréviations
AG Acides gras
AGS Acides gras saturés
AGMI Acides gras monoinsaturés
AGPI Acides gras polyinsaturés
AAT Activité antioxydante totale
BSA Bovine sérum albumine
DTT Dithiothreitol
EDTA Acide éthylène diamine
tétra-acétique
H2O2 Peroxyde d'hydrogène
MDA Malondialdéhyde
MF Matière fraîche
MS Matière sèche
PM Poids moléculaire
GPX Gaïacol peroxydase
PT Polyphénols totaux
PVPP Polyvinyl polypyrrolidone
ROS Espèces réactives
d'oxygène
SOD Superoxyde dismutase
SST Sucres solubles totaux
TBA Acide thiobarbiturique
TCA Acide trichloroacétique
Liste des figures
Figure 1. Teneurs en MDA dans
les feuilles des plantes du ricin récoltées au niveau des trois
sites (Contrôle, S1 et S2). Moyennes de 3 répétitions et
intervalles de sécurité au seuil de 5%-
26
Figure 2. Effet de pollution
atmosphérique sur les teneurs en mélano dines dans les feuilles
des plantes du ricin récoltées au niveau des trois sites
(Contrôle, S1 et S2). Moyennes de 3
répétitions et intervalles de
sécurité au seuil de 5% 27
Figure 3. Effet de la pollution
atmosphérique sur le contenu en sucres solubles totaux (SST) dans les
feuilles des plantes du ricin récoltées dans les trois sites.
Moyennes de 3 répétitions
et intervalles de sécurité au seuil de 5%
28
Figure 4. Effet de la pollution
atmosphérique sur le contenu en proline dans les feuilles des plantes du
ricin récoltées dans les trois sites. Moyennes de 3
répétitions et intervalles de
sécurité au seuil de 5%
29
Figure 5. Effet de la pollution
atmosphérique sur la teneur en protéines, les activités de
la GPX, CAT et APX dans les feuilles des plantes du ricin
récoltées dans les trois sites.
Moyennes de 4 répétitions et intervalles de
sécurité au seuil de 5% 30
Figure 6. Effet de la pollution
atmosphérique sur la teneur en polyphénols totaux et en
flavonoïdes des extraits méthanoliques des feuilles des plantes du
ricin récoltées dans les
trois sites. Moyennes de 4 répétitions et
intervalles de sécurité au seuil de 5%
31
Figure 7. Effet de la pollution
atmosphérique sur l'activité antioxydante totale et
l'activité antiradicalaire des extraits méthanoliques des
feuilles des plantes du ricin récoltées dans les
trois sites. Moyennes de 4 répétitions et
intervalles de sécurité au seuil de 5%
32
Figure 8. Effet de la pollution
atmosphérique sur les rendements en lipides totaux des feuilles des
plantes du ricin récoltées dans les trois sites. Moyennes de 3
répétitions et intervalles de
sécurité au seuil de 5 %
33
Figure 9. Effet de la pollution atmosphérique sur
l'indice de double liaison (DBI) des feuilles des plantes du ricin
récoltées dans les trois sites. Moyennes de 3
répétitions et intervalles de
sécurité au seuil de 5 %
37
Liste des tableaux
Tableau 1. Effet de la pollution
atmosphérique sur les teneurs en Chl a, Chl b, Chl totale, en
caroténoïdes totaux et en lycopène dans les feuilles des
plantes du ricin récoltées au niveau des 3 sites: Contrôle,
site 1 (S1) et site 2 (S2). Moyennes de 5 répétitions et
intervalles de
sécurité au seuil de 5% 25
Tableau
2. Teneurs en chlorophylle (mg.kg-1huile) et en
beta-carotène (mg.kg-1huile) des huiles fixes extraites des
feuilles du ricin récoltées au niveau d'un site non pollué
(Contrôle),
site 1 et site 2 34
Tableau 3.
Composition en acides gras des feuilles du ricin
récoltées au niveau d'un site non
pollué (Contrôle), Site 1 et site 2.
36
Sommaire
Introduction générale 1
Chapitre 1 : Données bibliographiques
3
I.le ricin : Ricinus communis 3
I.1. Taxonomie de Ricinus communis
3
I.2. Description botanique 3
1.3. Exigences climatiques et édaphiques
4
1.4. Utilisation du ricin 4
a. Utilisation industrielle 4
b. Utilisation médicinale 5
c. Effet insecticide 6
1.5. Etude phytochimique du ricin 6
II. La pollution 7
II.1. Définition 7
II.2. Sources de pollution 7
II.3. Pollution atmosphérique et
activité industrielle 7
II.4. les émissions de cimenteries
8
III. Impact de la pollution 8
III.1. La pollution atmosphérique
8
III.2. Effet sur la physiologie des plantes
8
III.3. Effet des particules de cimenteries
10
IV. Le stress oxydatif chez les végétaux
11
IV.1. Le stress oxydatif 11
IV.2. Rôle des ROS et effets
délétères 12
IV.3. Formation des ROS 12
V. Réponses des plantes au stress oxydatif
12
V. 1. Systèmes de défense enzymatiques
12
V. 2. Système de défense non
enzymatique 13
Chapitre 2: matériel et méthodes
15
1. Matériel végétal
15
2. Extraction et dosage des chlorophylles et des
caroténoïdes 15
3. Extraction et dosage du lycopène
16
4. Dosage du malondialdéhyde (MDA)
16
5. Extraction et dosage des mélanoïdines
16
6. Activité antioxydante 16
6.1. Extraction des protéines solubles
16
6.2. Dosage des protéines solubles
17
6.3. Détermination des activités des
enzymes antioxydantes 17
7. Extraction et dosage des composés
phénoliques 18
7.1. Préparation des extraits 18
7.2. Dosages des polyphénols totaux
18
7.3. Dosage des flavonoïdes 19
7.4. Détermination de l'activité
antioxydante totale 19
7.5. Pouvoir antiradicalaire (test DPPH)
20
8. Extraction et dosage des sucres solubles totaux
20
9. Extraction et dosage de la proline 20
10. Extraction des lipides 21
10.1. Détermination du rendement en
matière grasse 22
10.2. Détermination de la teneur en
chlorophylle et en béta carotène 22
11. Analyse chromatographique des acides gras
23
12. Analyse statistique 24
I. Résultats 25
1. Effet de la pollution atmosphérique sur le
contenu en pigments 25
2. Effet de la pollution atmosphérique sur
l'accumulation en MDA 26
3. Effet de la pollution atmosphérique sur
l'accumulation en mélanoúdines 26
4.
27
Effet de la pollution atmosphérique sur
l'accumulation des sucres solubles totaux
4. Effet de la pollution atmosphérique sur
l'accumulation de la proline 28
5.
29
Effet de la pollution atmosphérique sur la teneur
en protéines et les activités
antioxydantes
5.
32
Effet de la pollution atmosphérique sur les
composés phénoliques 31
6. Effet de la pollution atmosphérique sur
l'activité antioxydante totale et l'activité
antiradicalaire
7. Effet de la pollution atmosphérique sur le
métabolisme lipidique 33
7.1. Effet de la pollution atmosphérique sur le
rendement en lipides totaux 33
|
7.2. Effet de la pollution atmosphérique sur les
teneurs en chlorophylle et en beta-
carotène
|
34
|
7.3. Effet de la pollution atmosphérique sur la
composition en acides gras 34
II. Discussion 37
Conclusions générales et perspectives
42
Références bibliographiques
44
Introduction générale

1
Introduction Générale
Un des problèmes actuels qui occupe
l'intérêt de l'homme est la pollution. Suite à la
révolution industrielle dans la deuxième moitié de XVIII
siècle, connue par l'utilisation de charbon comme source
d'énergie, on a noté un début de pollution, puis ça
était aggravé en découvrant le pétrole,
utilisé jusqu'à nos jours comme source majeure
d'énergie.
Ces révolutions industrielles sont accompagnées
par la production énorme de polluants induisant ainsi une accumulation
de produit chimiques toxiques dans l'environnement et même dans l'air.
L'émission des gaz par les industries tels que le dioxyde de carbone
(CO2), le méthane (CH4), le protoxyde d'azote (N2O), contribuent
directement à l'effet de serre.
La concentration des gaz à effet de serre s'est
considérablement accrue depuis l'ère industrielle. En effet, la
concentration de CO2 atmosphérique a augmenté de 30% partant de
280 parties par million de volume (ppm) en 1750 allant à environ 370 ppm
aujourd'hui.
La Tunisie comme tout pays connait une pollution
atmosphérique importante qui se concentre généralement
dans les villes ayant des zones industrielles à activité notable,
telles que Sfax et Gabes. Les sources de la pollution sont principalement le
trafic routier, les cimenteries et la décharge municipale
(Dahech et al., 2006). Les cimenteries, bien qu'elles
soient installées généralement loin des centres urbains,
contribuent massivement à la pollution atmosphérique
particulaire. En effet, ces unités industrielles émettent de
grandes quantités de poussières. Ces dernières sont
véhiculées et dispersées par le vent sur de grandes
étendues pouvant ainsi affecter les différentes composantes de
l'environnement (air, eau, sol et végétation) sur lesquelles
elles se déposent.
Les stress environnementaux, tels que la pollution
atmosphérique, est l'un des facteurs qui limitent la productivité
végétale et la survie des plantes (Woo et al.,
2007). Par ailleurs, ce type du stress peut affecter directement les
plantes via les feuilles ou indirectement via
l'alcalinisation du sol.
Lorsqu'elles sont exposées à des polluants
atmosphériques, la plupart des plantes subissent des changements
physiologiques avant de présenter des dommages visibles au niveau des
feuilles (Liu et Ding, 2008). Ces plantes fournissent une
énorme surface foliaire permettant la pénétration,
l'absorption et l'accumulation des polluants, afin de réduire leurs
niveaux dans l'environnement atmosphérique (Liu et Ding,
2008).
Le ricin se présente sous la forme d'une plante
herbacée ou arborescente, annuelle ou vivace suivant les conditions
climatiques de la région où elle pousse. Dans ce projet, on
s'est

2
Introduction Générale
intéressé à l'étude les effets
individuels et conjugués de plusieurs contraintes (CO2, gaz, COO3...)
sur la composition biochimique de cette plante au niveau de trois sites : Un
site Contrôle non pollué, un site (S1) loin de la source de la
pollution à peu près de 100 m et un troisième site S2 (le
plus pollué).
Chapitre I
Données
bibliographiques
Chapitre I Données bibliographiques

3
I. Le ricin: Ricinus communis
Le ricin est une plante spontanée du Nord-Afrique et de
Moyen-Orient. On le rencontre généralement en Tunisie sur les
terrains dégradés, les terres incultes et friches urbaines
(Neff, 2008).
I.1. Taxonomie
Ricinus communis L. est une plante du sous
règne des Phanérogames, de l'embranchement des Angiospermes, de
la classe des Magnoliopsidae, de la sous classe des Rosidae, de l'ordre des
Euphorbiales et de la famille des Euphorbiaceae qui compte entre 5000
et 8000 espèces réparties sur environ 300 genres. Les plantes de
cette famille sont d'aspect très variable. Elles se caractérisent
essentiellement par leur latex blanc avec une évolution de la
morphologie florale qui va des fleurs classiques (sous-famille des
Crotonoïdeae) aux fleurs simplifiées et réduites
(sous-famille des Euphorbioïdeae). Chez la majorité des
espèces, le fruit est à trois loges. Le genre Ricinus
est représenté par une seule espèce : Ricinus
communis L. (Polvèche, 1996).
I.2. Description botanique
Le ricin est un arbuste vivace robuste de 3 à 12 m de
haut (Wan, 2006). Les feuilles (Photo 1A) sont longuement
pétiolées, palmées, lobées (5 à 9 lobes),
caduques et de couleur vert foncé parfois tracées de rouge
pourpré (Wan, 2006).
Les fleurs (Photo1 B) sont regroupées en cyathes, les
fleurs femelles en haut, les fleurs mâles en bas. C'est donc une
espèce monoïque. La floraison a lieu en été.
Les fruits sont des capsules tricoques hérissées de
pointes (parfois absentes).
La graine (Photo 1C) est luisante, marbrée de rouge ou
de brun, elle présente une ligne saillante sur la face ventrale et est
surmontée par un élaiosome. Elle contient entre 40 et 60 %
d'huile riche en triglycérides, principalement la ricinoléine.
Chapitre I Données bibliographiques

A
B
C

4
Photo 1: Feuilles (A), Fleurs (B) et graines (C) du ricin
1.3. Exigences climatiques et édaphiques
Le ricin a pu s'acclimater spontanément dans les
régions tropicales et subtropicales mais il préfère des
pluviométries assez élevées (450 - 1000 mm) pour
compléter son cycle du développement (Déthiollaz,
2003). La répartition géographique du ricin dans le
monde indique qu'il tolère une grande variabilité des conditions
climatiques sauf pour les très basses températures. En effet, 24
heures à 2°C suffisent pour inhiber la germination. Cependant, un
bon démarrage de la germination à des températures
supérieures à 15°C est observé
(Polvèche, 1996). Concernant les conditions
édaphiques du sol (liées aux caractéristiques
physico-chimiques et biologiques), en général, la plante est
exigeante, elle préfère des pentes qui ne dépassent pas
12%, des sols argileux-siliceux profonds dont le pH ne dépasse pas 7
(Rousset et al., 2008).
1.4. Utilisation du ricin a. Utilisation industrielle
Le ricin et plus particulièrement son huile
présente un grand intérêt économique. L'huile du
ricin est largement utilisée comme lubrifiant pour ces
caractéristiques exceptionnelles: sa souplesse, sa bonne
résistance, sa bonne tenue dans une gamme étendue de
température (de -40 °C à +130°C) et sa grande
affinité pour les surfaces métalliques (qualités de
mouillage). En outre, on est arrivé à fabriquer une fibre nylon
qui s'avère un produit incontournable dans le monde entier,
caractérisé par sa forte résistance mécanique et sa
grande souplesse (Polvèche, 1996).
Polvèche (1996) puis Perret (2007)
rapportent l'utilisation de certaines composantes de l'huile du ricin
pour la fabrication des vernis, savons et des peintures. Au Brésil, dans
le domaine énergétique, l'huile du ricin est
Chapitre I Données bibliographiques

5
Chapitre I Données bibliographiques

6
utilisée pour la production de biodiesel. La production
du ricin dans ce pays est de 210 000 tonnes entre 2004 et 2005 (Rousset
et al., 2008).
b. Utilisation médicinale
Le ricin est une plante médicinale qui a
été traditionnellement utilisée dans le traitement de
nombreuses maladies. Ainsi, l'huile du ricin entre dans la composition de
nombreux traitements purgatifs ou laxatifs. En usage externe, elle est
exploitée en cosmétique comme crèmes solaires et
crème antirides. En dermatologie, elle est utilisée pour le soin
des durillons, des kystes et de certaines plaies ouvertes
(Polvèche, 1996). En Inde, les feuilles, les racines et
les graines sont utilisées pour la contraception et l'avortement.
Kirtikar et Basu (1991) ont aussi utilisé les
différentes parties de la plante pour traiter les inflammations et les
maladies du foie.
L'extrait des feuilles mélangé avec du lait et
du sucre est une préparation connue en Inde pour vider l'estomac.
Kota et Manthri (2011) indiquent que les
feuilles du ricin soulagent les maux de tête et le rhumatisme. Le ricin
est traditionnellement utilisé pour d'autres activités
hépato-protectrices (Visen et al., 1992),
diurétique (Nath, 2011) et antibactérienne .
Ainsi, il a été démontré que l'extrait
éthanolique des racines du ricin possèdent une activité
antidiabétique (Poonam et al., 2008). Alors
que l'extrait méthanolique montre une activité anti-inflammatoire
importante contre des inflammations aigues et chroniques chez les rats, cet
extrait a montré également une importante activité
antioxydante en tant que piégeurs et inhibiteur de la peroxydation
lipidique.
De plus, ces dernières années, la recherche a
montré que la ricine, toxine qui caractérise le ricin,
s'avère active contre certaines cellules cancéreuses. Cette
glycoprotéine, largement étudiée, est formée par
deux chaînes polypeptidiques A et B reliées par un pont disulfure.
La chaîne A forme la partie toxique quant à la chaîne B,
elle permet à la toxine de se fixer à la surface d'une cellule en
se liant à une molécule de sucre ou galactose. Ainsi, une fois la
chaîne A entre à l'intérieur de la cellule, elle bloque la
synthèse des protéines ce qui conduit à la mort
cellulaire. Il est à noter que la chaîne A sans la chaîne B
ne peut pas pénétrer à l'intérieur d'une cellule et
la chaîne B sans la chaîne A n'a aucune action toxique d'où
l'importance du pont disulfure (Olsnes et Kozlov, 2001).
Déthiollaz (2003) montre que le
ciblage des tumeurs par la ricine permet de détruire les cellules
cancéreuses sans endommager les cellules saines du patient. Donc il
s'agit d'une véritable " torpille " qui permettrait d'atteindre les
cellules cancéreuses métastasées ou de
pénétrer à l'intérieur des tumeurs solides
inopérables.
c. Effet insecticide
Sharma et al., (1990) ont
montré que le ricin peut être utilisé comme un insecticide
efficace, ainsi l'utilisation du ricin dans la lutte contre les termites
(fourmis blanches) qui endommagent le bois de Mangifera indica (le
manguier) et Pinus longifolia (pin) a été mise en
évidence dans des essais comparatifs
Ainsi les extraits aqueux des feuilles et des graines du ricin
(Ricinus communis) provenant de plusieurs provenances Tunisiennes
présentent des effets toxiques sur les larves de moustiques Culex
pipiens. Les tests de toxicité ont révélé au
bout de 24 heures d'exposition, des taux de mortalités de 100% et des
concentrations létales CL50 très faibles. Donc dans le cadre de
lutte contre les moustiques, ces extraits peuvent être utilisés
comme des biocides naturels (Ghnimi et al., 2014).
1.5. Etude phytochimique du ricin
Plusieurs études phytochimiques ont été
réalisées pour identifier les différents composés
chimiques chez le ricin. Ces analyses ont montré la présence des
flavonoïdes qui sont le kaempferol-3-O-3-D-rutinoside et le
kaempferol-3-O-3-D-xylopyranoside. Ces flavonoïdes ont été
isolés à partir des feuilles par Khafagy et al.,
(1979) puis Kang et al., (1985).
Plus récemment, les travaux de Ghosh et
al., (2013) ont montré que l'extrait méthanolique
des feuilles est riche en composés phénoliques (l'acide gallique,
l'acide gentisique, l'acide ellagique, la quercetine, la rutine et
l'epicatéchine) et qu'il possède un pouvoir antioxydant.
Khogali et al., (1992) ont montré la
présence de tanins au niveau des feuilles. En ce qui concerne les
graines, qui contiennent 45% d'huile fixe, elles sont riches en glycosides
d'acides ricinoléique, isoricinoléique, stéarique et
dihydroxystéarique. Ces graines contiennent également de la
lipase et un alcaloïde qui est la ricinine (Khogali et
al., 1992).
Chapitre I Données bibliographiques

7
II. La pollution
II.1. Définition
La pollution est définie comme étant la
dégradation de l'environnement par des substances (naturelles, chimiques
ou radioactives), des déchets ou des substances diverses. Cette
dégradation peut engendrer une perturbation dans le fonctionnement de
l'écosystème, qu'on peut définir par
déséquilibre écologique (Abbas et al.,
2015).
II.2. Sources de pollution
La pollution a des sources très variées, qui
sont généralement un résultat des phénomènes
physiques naturels ou des activités humaines. Or les activités
humaines se divisent en deux grands groupes induisant la pollution :
? Les activités urbaines: ce sont les rejets
domestiques, les eaux usées, les gaz d'échappement des
voitures...
? Les activités chimiques: proviennent des industries
de fabrication et transformation pour obtenir des produits chimiques, aussi les
cimenteries.
Ces activités dégagent des polluants dans
l'atmosphère, l'eau et le sol (Abbas et al.,
2015) .
II.3. Pollution atmosphérique et activité
industrielle
A l'échelle mondiale, on a connu les dernières
décennies une dégradation importante de la qualité de
l'air. Ce phénomène est lié au développement des
activités industrielles et au trafic routier qui sont les principales
sources de la pollution atmosphérique. Parmi ces activités
industrielles, on note les cimenteries ; elles sont installées
généralement loin des centres urbains mais contribuent
massivement à la pollution atmosphérique. En effet, ces
unités industrielles émettent de grandes quantités de
poussières. Ces dernières sont véhiculées et
dispersées par le vent sur des grandes étendues, ce qui affecte
les différentes composantes de l'environnement (air, eau, sol, la
végétation) sur lesquelles elles se déposent. En effet,
des quantités importantes de poussières sont émises dans
l'atmosphère (170 tonnes en moyenne par mois durant l'année 2001,
par exemple). Pour les cimenteries, les particules sont
générées à chaque procédé de
fabrication de ciment (Bengamra et al., 2006).
Chapitre I Données bibliographiques

8
II.4. les émissions de cimenteries
D'après Parekh (1989), les cimenteries
émettent dans l'air du ciment et de calcaire qui sont les deux sources
les plus communs de calcium (Ca), tandis que les argiles, les schistes et les
cendres sont les sources d aluminium (Al), silicium (Si) et fer (Fe).
En Suisse, la présence de fluorure atmosphérique
s'explique principalement par les activités humaines. Ainsi, la majeure
partie des composés fluorés que l'on trouve dans certaines
régions du pays proviennent notamment de la préparation
électrolytique de l'aluminium et dans une moindre mesure des usines
d'incinération d'ordures ménagères (UIOM), des fabriques
d'engrais phosphatés, des cimenteries et de l'industrie du verre.
III. Impact de la pollution
III.1. La pollution atmosphérique
On parle de polluant majeur de l'air surtout chez les pays
industrialisés: c'est l'ozone. L'émission des fortes
concentrations d'ozone constitue un facteur de modification non
négligeable de la biologie des plantes qui peuvent dépérir
et subir plus facilement d'autres stress. Il existe des plantes plus sensibles
à l'ozone, on cite les graminées (blé et riz) ayant un
rôle important dans l'alimentation de l'Homme, ainsi certains cultivars
de tabac et des arbres très vulnérables tels que des pins, du
hêtre (Fagus sylvatica), de l'érable (Acer
pseudoplatanus), du frêne (Fraxinus sp) ou du merisier
(Prunus avium) (Dalstein et al., 2005).
III.2. Effet sur la physiologie des plantes
Sur le plan macroscopique, les dégâts sont
visualisés par l'oeil nu. Les premiers dommages apparaissent sur la face
supérieure des feuilles exposées à la lumière. Les
symptômes se manifestent, pour certaines espèces par des chloroses
diffuses sur la partie supérieure du feuillage. Ainsi, des
altérations dégénératives, souvent plus
développées sur les contours des feuilles, se manifestaient par
de petites taches blanc-jaune avec des contours mal définis ou une
coloration brun-rouge sur des échantillons de pins, frênes,
robiniers, sureaux, cytises, symphorines. La phase finale se caractérise
par des ponctuations qui s'étalent formant des nécroses pour
toucher l'ensemble de la surface foliaire.
Chapitre I Données bibliographiques

9
Pour d'autres espèces telles que les viornes, ronces,
spirées, épilobes et mahonias, les dégâts d'ozone se
manifestent par des rougissements le long des nervures sur les parties du
feuillage exposé à la lumière. Cette coloration est due
à une accumulation, au niveau des vacuoles des cellules du
mésophylle palissadique, d'anthocyanes. Ces pigments apparaissant
souvent lors de phénomènes de dégénérescence
de la chlorophylle et/ou lors du processus de vieillissement du feuillage
(Dalstein et al., 2005).
Yunus et al., (1979) ont
étudié l'impact de la pollution atmosphérique sur le
ricin. Les études ont l'aspect microscopique et cellulaire, elles
montrent qu'il n y a pas des différences dans les
caractéristiques épidermiques des populations saines et
polluées du ricin. Cependant, les polluants environnementaux ont
légèrement affecté la forme et la sinuosité des
cellules épidermiques et des stries cuticulaires.
Chez les populations polluées, les cellules
épidermiques sont beaucoup plus petites que celles de la population
saines, les stomates sont devenues grandes et ouvertes et les stries
cuticulaires sont plus remarquables, alors que chez la population saine,
l'ouverture stomatique est étroite et les stries cuticulaires sont
discrètes.
En comparant le pourcentage des stomates anormaux sur
l'épiderme inférieur et supérieur, on remarque qu'il ne
dépasse pas 1% chez la population saine , alors que chez les populations
polluées, ils sont plus 8 fois et 3 fois plus importantes respectivement
sur l'épiderme inférieur et l'épiderme
supérieur.
La densité stomatique semble avoir une relation avec la
pollution de l'air, les populations des zones polluées ont plus de
stomates sur la surface foliaire que les populations de la zone saine. C'est
probablement une réponse des plantes à la perte des stomates les
plus anciens et sains à travers la dégénérescence
causée par la pollution de l'air.
Selon Dalstein (2005), les analyses faites
sur les feuilles des pins cembro de Mercantour, qui sont touchées par
des chloroses, phénomène constituant le premier symptôme
causé par l'ozone pour certaines espèces, ont montré des
altérations des cellules du mésophylle palissadique, avec une
lyse de la chlorophylle qui progressait vers le collapse des chloroplastes, en
l'absence d'altérations sur l'épiderme supérieur ou dans
le parenchyme lacuneux.
Chapitre I Données bibliographiques

10
Chez les espèces rougissantes, telles que les viornes
et les mahonias, l'accumulation des anthocyanes était nette dans les
chloroplastes et précédait le collapse des parois cellulaires.
Ils ont constaté que les modifications cellulaires ont touché
l'épiderme supérieur proche de la zone en contact étroit
avec le mésophylle palissadique atteint ou le parenchyme dans les cas de
nécroses (Dalstein et al., 2005).
La pollution atmosphérique affecte le
métabolisme cellulaire des végétaux, donnant plusieurs
aspects tels que chlorose, accumulation d'anthocyanes et elle peut affecter la
photosynthèse (Auclair, 1997). L'étude consiste
à effectuer des empoussièrements artificiels semblables aux
empoussièrements naturels que l'on rencontre autour de certaines usines.
Ils ont constaté que la photosynthèse nette est significativement
inhibée par les poussières aux éclairements faibles, mais
non aux éclairements plus élevé. Alors, les
poussières semblent avoir un rôle de capteur de lumière, ce
qui induit la diminution de l'énergie lumineuse utilisable par la
photosynthèse.
Donc, les résultats montrent que, s'ajoutant à
un effet chimique possible à long terme, les poussières ont un
effet notable sur la photosynthèse en diminuant l'énergie
lumineuse utilisable par la plante. Dans la majorité des cas, les
poussières affectent les plantes par leur composition chimique, pouvant
ainsi entraîner des nécroses, dessèchements et même
parfois la mort.
III.3. Effet des particules de cimenteries
Les cimenteries comme toute industrie chimique, produisent des
polluants spécifiquement atmosphériques tels que le calcaire et
le fluor. La sensibilité des plantes au fluor dépend de plusieurs
facteurs, dont les principaux sont la teneur de polluant dans l'air,
l'espèce, la variété, la morphologie de la plante
(stomates, pilosité, âge etc.), les facteurs climatiques et la
présence ou non d'autres polluants (SO2, NOx, O3). Il existe une
classification des plantes selon leurs sensibilités, les plantes dites
sensibles montrent une chlorose à partir de 0.15~g/m3 de
polluant dans l'air.
Dans les environnements industriels, les concentrations
moyennes des polluants est dans l'ordre de 0.5 à 20~g/m3
(selon l'activité industrielle) et atteignent parfois
100~g/m3 au voisinage de la source polluante. Cela peut induire des
conséquences plus graves que la chlorose, on parle des effets
cytogénétiques (mutation, aberration chromosomique). Dans
Chapitre I Données bibliographiques

11
certaines espèces végétales, le
développement végétatif a augmenté au
détriment de la reproduction générative. Les plantes
sensibles et fortement chlorosées disparaissent, modifiant ainsi la
composition botanique du couvert végétal (Grub et
al., 1997).
Le fluor est un polluant, il n'intervient pas dans le
métabolisme des végétaux, cet élément
pénètre dans la cellule du parenchyme foliaire, et il est alors
transféré et stocké aux extrémités ou sur
les bords du limbe.
L'effet de pollution se manifeste différemment chez les
différentes espèces ; des nécroses apparaissent :
? À la pointe des feuilles longues et étroites
(sapin, pin, glaïeul, iris ....)
? Sur les bords des feuilles larges et entières
(hêtre, noisetier....)
? À l'extrémité des lobes pour les feuilles
découpées (aubépine, érable à f.
d'obier..).
Ces brûlures présentent des teintes variées,
allant du brun clair (sapin) au noir (noyer). On parle donc d'une accumulation
du fluor, qui va être éliminé pendant la chute annuelle des
feuilles caduques (Bossavy, 1970).
IV. Le stress oxydatif chez les
végétaux
IV.1. Le stress oxydatif
Les plantes utilisent l'oxygène de l'air O2, via le
métabolisme aérobie pour fournir de l'énergie
nécessaire à leur croissance et à leur
développement. Or la réduction de l'oxygène est
accompagnée d'une production des radicaux oxygénés qui
sont soit :
? Des radicaux libres: tels que l'anion superoxyde (O2 .-) et le
radical hydroxyle (OH.) ? Des molécules : telles que le
peroxyde d'hydrogène (H2O2) et l'oxygène singulet
(1O2).
Ces formes réactives de l'oxygène (ROS) ont un
effet toxique direct ou indirect envers les substances bioorganiques
(Parent et al., 2008).
Donc le stress oxydatif correspond à un
déséquilibre entre la génération des formes
réactives de l'oxygène et les défenses antioxydantes de
l'organisme en faveur des premiers.
IV.2. Chapitre I Données bibliographiques

12
Rôle des ROS et effets
délétères
Le rôle des ROS est très complexe, car elles
peuvent avoir un rôle physiologique ou un effet toxique en fonction de
leur concentration. Le peroxyde d'hydrogène H2O2 est capable
de traverser les membranes biologiques et de modifier l'activité de
glutathion peroxydase (Haleng et al., 2007).
En plus, les ROS sont impliquées dans la cascade de
régulation de l'expression génique; la plante adapte ses
réponses selon un mécanisme de régulation génique
qui dépend de la concentration cellulaire des ROS.
IV.3. Formation des ROS
La majeure partie de l'oxygène cellulaire subit une
réduction tétravalente qui conduit à la production de
l'eau, une partie des électrons peut s'échapper et réduire
l'oxygène d'une manière monovalente donnant l'anion superoxyde
(Parent et al., 2008).
Les autres formes se forment dans: le chloroplaste,
mitochondrie, peroxysome, membrane cellulaire et l'apoplaste, ayant des
origines diverses : la photosynthèse, la respiration, ect...Dans les
conditions du stress, les ROS peuvent engendrer des dommages importants dans la
structure et le métabolisme cellulaire en dégradant les
protéines, les lipides et les acides nucléiques. Ainsi, les
radicaux libres OH. sont des oxydants capables d'arracher des
électrons et/ou de s'additionner aux macromolécules organiques
cellulaires, provoquant ainsi la peroxydation des lipides membranaires.
V. Réponses des plantes au stress oxydatif V. 1.
Systèmes de défense enzymatiques a. Les Superoxydes dismutases
(SOD)
Ce sont des métalloenzymes qui présentent les
premières lignes de défense contre le stress oxydant, elles
assurent l'élimination de l'anion superoxyde dismutase par une
réaction de dismutation en transformant le peroxyde d'hydrogène
en oxygène (Haleng et al., 2007).
Chapitre I Données bibliographiques

13
Il existe trois isoformes de SOD qui diffèrent par leurs
cofacteurs :Cu/Zn-SOD , Mn-SOD et Fe-SOD.
b. La glutathion peroxydase (GPX)
C'est une sélénoprotéine qui réduit
les peroxydes aux dépens de son substrat spécifique, le
glutathion réduit (GSH). Elle assure l'élimination des peroxydes
lipidiques résultant de l'oxydation des acides gras (Haleng
et al., 2007).
c. La catalase
C'est une enzyme d'origine peroxysomale, qui a le rôle
de dismuter le peroxyde d'hydrogène en eau et dioxygène
(Arora et al., 2002).
d. L'ascorbate péroxydase:
C'est une enzyme qui a une très forte
spécificité en tant que donneur d'électrons vis à
vis de l'ascorbate qu'elle transforme en déhydroascorbate. L'ascorbate
agit en convertissant l'eau oxygénée en eau (Haleng
et al., 2007).
V. 2. Système de défense non
enzymatique
Les plantes présentent un autre système de
défense, intégrant des différentes molécules de
métabolites primaires ainsi que les métabolites secondaires.
a. La vitamine C
C'est un excellent piégeur de radical hydroxyle et
l'anion superoxyde. Elle inhibe la peroxydation lipidique en
régénérant la vitamine E à partir de la forme
radicale issue de la réaction de sa réaction avec des radicaux
lipidiques (Haleng et al., 2007).
b. La vitamine E
Elle a un caractère hydrophobe qui lui permet de
s'insérer au sein des membranes riches en acides gras
polyinsaturés, ou elle joue un rôle protecteur en
réagissant avec les radicaux peroxyles (ROO.), formant ainsi un radical
tocophéryle, ce qui empêche la propagation de la peroxydation
lipidique (Haleng et al., 2007).
c. Chapitre I Données bibliographiques

14
Les caroténoïdes
Elles forment une famille de plus de 600 molécules.
Généralement, tous les caroténoïdes dérivent
d'une structure linéaire C40H56 (Haleng et
al., 2007). Ce sont des pigments qui assurent plus qu'un
rôle:
? Absorption de lumière de longueur d'onde entre 400 et
550 nm.
? Protection de l'appareil photosynthétique de triplet
Chl3 et l'oxygène singulet 1O2 .
? Stabilisation des complexes protéiques
photo-collecteurs et des membranes thylacoïdales.
d. Les polyphénols
Ce sont des métabolites secondaires qui constituent une
famille importante d'antioxydants. Ils sont présents sous
différentes formes :
? Sous forme d'anthocyanes dans les fruits rouges
? Sous forme de flavonoïdes dans les agrumes. Sous forme
de flavon-3-ols dans le thé, pomme et oignon.
Ce sont des excellents piégeurs de ROS et de bons
chélateurs de métaux de transition tels que le fer et le cuivre
(Haleng et al., 2007).
L'objectif de ce travail est d'étudier la
réponse biochimique de l'espèce Ricinus communis
à l'exposition aux particules de ciment auprès de la
cimenterie de Bir Mecherga.
Chapitre II
Matériel
et
Méthodes
1. Chapitre II Matériel et méthodes

15
Matériel végétal
Notre étude a été réalisée
sur une plante spontanée: le ricin (Ricinus communis). Les
échantillons sont collectés à partir de trois sites
nommés respectivement: Contrôle (C), le site 1 (S1: situé
à 100 m de l'origine de la pollution) et le site 2 (S2: situé
juste à côté de la source de la pollution : cimenterie de
Bir Mecherga).

Photo de la cimenterie à partir de Google
maps
2. Extraction et dosage des chlorophylles et des
caroténoïdes
Les teneurs en chlorophylles a, b et totales et en
caroténoïdes (mg.g-1 MF) ont été
déterminées selon la méthode de Lichtenthaler
(1988). Deux feuilles d'environ 100 mg de masse fraîche sont
pesées et mises dans 5 ml d'acétone (80 %). Après un
séjour de 72 heures à l'obscurité et à une
température de 4°C, la densité optique de l'extrait est
mesurée á 470 nm, 646 nm et 663 nm. Les teneurs en chlorophylles
a, b et totale et en caroténoïdes sont ensuite calculées
selon les équations suivantes:
Chlorophylle a = 12,25A663 - 2,79A646 Chlorophylle b =
21,50A646 - 5,10A663
Chlorophylle totale) = 7,15A663 + 18,71A646
Chapitre II Matériel et méthodes

16
Caroténoïdes = (1000A470 - 1,82Ca - 85,02Cb)
/198
3. Extraction et dosage du lycopène
Le lycopène est un pigment liposoluble, du fait de sa
grande disponibilité, il est beaucoup utilisé comme colorant
(E160d), c'est un tétra terpène de la famille des
carotènes. L'identification du lycopène se fait par
spectrophotomètre à 472 nm (Benakmoum et
al., 2008).
Une quantité de 100 mg de matière fraîche
est mise dans 10 ml d'un mélange formé de
hexane-acétone-éthanol (50/50/1). Le mélange est
agité pendant 10 min puis centrifugé à 5000 tours pendant
15 mn. Un volume de 1 ml de la phase organique est ensuite dilué dans 10
ml d'hexane. L'absorbance est mesurée à 472 nm.
4. Dosage du malondialdéhyde (MDA)
Le MDA est déterminé selon la méthode
décrite par Heath et Packer, (1968). Des
échantillons de 0,2 g sont broyés dans de l'azote liquide dans un
mortier en porcelaine. La poudre obtenue est homogénéisée
dans un mélange contenant 0.5% d'acide thiobarbiturique (TBA) et 20%
d'acide trichloroacétique (TCA). L'extrait est incubé à
95°C, pendant 30 min. Les tubes sont ensuite mis dans la glace puis
centrifugés à 4000 g, pendant 30 min à 4°C.
L'absorbance est mesurée à 532 et 600 nm. La concentration en MDA
(?mol g-1 MF) est calculée en utilisant le coefficient
d'extinction à 532 nm (155 mM cm-1).
5. Extraction et dosage des
mélanoïdines
Une quantité de 100 mg de tissu est extraite par
l'ajout de 1 ml d'eau distillée. La solution est placée dans un
rotateur, pendant 24h à 4°C puis centrifugée à 1300 g
pendant 15 min. Le surnageant est transféré dans de nouveaux
tubes. L'extrait est scanné avec un UV spectrophotomètre, selon
un spectre de 200 à 700 nm. Le pic est obtenu à 360 nm, comme a
été décrit par Shin et al.,
(2009).
6. Activité antioxydante
6.1. Extraction des protéines solubles
Après broyage des échantillons (1g) dans l'azote
liquide, la poudre est reprise dans un tampon d'extraction (1,5 ml) dont son
volume est proportionnel à la masse de matière fraîche et
dont la composition est la suivante:

17
|
Chapitre II
|
Matériel et méthodes
|
|
Phosphate de potassium
|
50 mM, pH 7.5
|
|
PVPP
|
5 %
|
|
Glycérol
|
.5 %
|
|
DTT
|
...1 mM
|
|
EDTA
|
100 mM
|
Une centrifugation est effectuée à 13000 g
à 4°C, pendant 20 min. Le surnageant obtenu contient les
protéines solubles. Il servira pour le dosage des protéines et
pour les tests des activités enzymatiques.
6.2. Dosage des protéines solubles
Le dosage des protéines est réalisé selon
la méthode de Bradford, (1976), utilisant le principe
de la liaison du bleu de Coomassie G250 avec les protéines. Ce
réactif coloré passe du violet au bleu lorsqu'il se lie à
la protéine et ainsi l'absorbance du complexe est lue. Ce complexe
colorant-protéine permet de déterminer la quantité en
protéines.
A un volume d'extrait protéique connu, 2 ml de bleu de
Coomassie sont ajoutés. Après 15 min, l'absorbance du
mélange est lue par spectrophotométrie à 595 nm. La
concentration protéique des échantillons est
déterminée à partir d'une gamme étalon de BSA
(Sigma) comprise entre 0 et 10ug.ml-1.
6.3. Détermination des activités des
enzymes antioxydantes
L'activité de la Catalase (CAT, EC 1.11.1.6) est
mesurée selon la méthode de Cakmak et Marschner,
(1992). Elle est testée par la mesure de la vitesse initiale de
disparition du peroxyde d'hydrogène, pendant 1 min à 240 nm, et
est calculée en utilisant le coefficient d'extinction de 39,4
mM-1 cm-1 pour le peroxyde d'hydrogène. Le tampon
réactionnel est composé de 50 mM de tampon phosphate (pH 7.0), 30
mM H2O2 et de l'extrait enzymatique.
La Gaïacol péroxydase (POD, GPX, EC 1.11.1.7) est
déterminée selon la méthode de Srinivas et
al., (1999), par suite de la formation de
tétra-gaïacol par la mesure de l'absorbance à 470 nm et en
utilisant le coefficient d'extinction de 26.6 mM-1 cm-1.
Le tampon réactionnel
Chapitre II Matériel et méthodes

18
(1 ml) contient 50 mM de tampon phosphate-gaïacol (pH
5,6), 30 mM H2O2 avec une aliquote de l'extrait de l'enzyme. La
réaction est effectuée pendant 2 min. Une unité de
péroxydase représente la quantité d'enzyme catalysant
l'oxydation de 1 ìmol de gaïacol.
L'activité de l'APX a été
déterminée selon la méthode de Cakmak et
Marschner, 1992, en mesurant la diminution de la densité de
l'ascorbate oxydé à 290 nm. Une unité de APX a
été définie comme la quantité d'enzyme
nécessaire pour consommer 1 ìmol ascorbate / min.
7. Extraction et dosage des composés
phénoliques
7.1. Préparation des extraits
L'extraction des composés phénoliques est
réalisée selon la méthode de Mau et al.,
(2001). Un gramme de matière sèche est
mélangé avec 10 mL méthanol. Le mélange est mis en
agitation pendant 60 min puis gardé au repos, pendant 24h à
4°C et à l'obscurité. Les extraits obtenus sont
filtrés avec des papiers filtres sans cendre puis conservés a
4°C pour servir par la suite aux dosages des polyphénols totaux,
des flavonoïdes et des activités antioxydante totale et
antiradicalaire.
7.2. Dosages des polyphénols totaux
Le dosage des polyphénols totaux est effectué
par un dosage colorimétrique selon la méthode de Folin Cicalteu
qui est un acide de couleur jaune constitué d'un mélange d'acide
phosphotungstique et d'acide phosphomolybdique (H3PMo12 O40). Ce mélange
se réduit lors de l'oxydation des polyphénols en un
mélange d'oxydes bleu de tungstène et de molybdène
(Ribereau-Gayon, 1968). L'intensité de cette coloration
bleue dont l'absorption maximale à 760nm renseigne sur la richesse de
l'extrait en polyphénols. Un volume de 125uL de l'extrait
méthanolique est mélangé avec 500 uL d'eau
distillée et 125 uL réactif de Folin Cicalteu. Après une
agitation vigoureuse du mélange suivie d'un repos de 3 min, on ajoute
1250uL d'une solution (Na)2CO3 à 7% et une prise de 1000uL d'eau
distillée est additionnée. Après un repos de 90 min
à l'obscurité et à la température ambiante; on
effectue une lecture de l'absorbance à 760 nm. Les teneurs des
polyphénols totaux sont déterminés à partir de la
courbe d'étalonnage linéaire réalisée par l'acide
gallique (0-200ug/mL), exprimées en milligrammes équivalents
d'acide gallique par gramme de matière sèche (mg EAG,
g-1MS) (Dewanto et al., 2002).
Chapitre II Matériel et méthodes

19
7.3. Dosage des flavonoïdes
a. Principe
Un dosage colorimétrique est basé sur la
formation d'un complexe, de couleur jaune, entre les flavonoïdes et le
trichlorure d'aluminium. La soude forme de son côté un autre
complexe qui rend la couleur rose dont l'intensité nous indique
l'importance du contenu de l'extrait en flavonoïdes (Zhishen et
al., 1999).
b. Mode opératoire
Un volume de 250 ul de l'extrait méthanolique est
mélangé avec 75 uL d'une solution de NaNO2 (5%). Après une
incubation à la température ambiante, on ajoute 150 uL d'une
solution de trichlorure d'aluminium à 10% (AlCl3,6H2O) fraîchement
préparé. Après cinq minutes de repos on ajoute 500 uL de
soude (NaOH, 1M) et on ajuste avec l'eau distillée jusqu'à 2.5 ml
(Dewanto et al., 2002). L'absorbance est
mesurée à 510 nm en se référant à un
témoin dépourvu de l'extrait. Les teneurs en flavonoïdes
sont calculées en utilisant une gamme étalon de catéchine
à des concentrations allant de 50 à 500 mg.l-1. Ces
teneurs en flavonoïdes sont exprimées en mg d'équivalent
catéchine par gramme de matière sèche (mg EC.
g-1MS).
7.4. Détermination de l'activité
antioxydante totale
a. Principe
Cette activité est mesurée par la
méthode qui consiste à réduire les ions Mo6+ en
Mo5+ par les extraits méthanoliques ainsi que la formation du
complexe (phosphate/ Mo5+) de couleur verte et à un pH acide
(Prieto et al., 1999).
b. Mode opératoire
Cette méthode consiste à ajouter 0.2 ml d'une
solution contenant de l'acide sulfurique (H2SO4; 0.6M), du phosphate de sodium
(NaH2PO4,H2O; 28mM) et de l'heptamolybdate d'ammonium ((NH4)6 MO7
O24, 4H2O; 4mM) à pH acide. Le mélange est ensuite
placé dans un bain - marie à 95°C, pendant 90 min.
Après refroidissement à la température ambiante,
l'absorbance est par la suite mesurée à 695 nm. L'activité
antioxydante totale est exprimée en mg d'équivalent acide
gallique par gramme de matière sèche (mg
EAG.g-1MS).
Chapitre II Matériel et méthodes

20
7.5. Pouvoir antiradicalaire (test DPPH)
a. Principe
C'est une méthode colorimétrique rapide, simple
et sensible, utilisée pour estimer l'activité antiradicalaire des
extraits. A une température ambiante, le radical synthétique le
2,2'-diphenyl-1-picrylhydrazyl (DPPHÿ) qui
présente en solution une coloration violette, disparaît au contact
d'une substance donneuse de protons.
DPPHÿ+Antioxydant-OH ? DPPH-H +
Aÿ
(Violette) (Incolore)
La cinétique de la dégradation de cette couleur
est détectable par le spectrophotomètre -UV à 517 nm par
rapport à un témoin. L'absorbance diminue en fonction de la
réduction du radical par les molécules antioxydantes
présentes dans l'extrait (Tadolini et al.,
2000).
b. Mode opératoire
Une solution mère de DPPH a été
préparée en mélangeant 15 mg DPPH dans 200 mL
méthanol pendant 2h a l'obscurité. Une prise d'essai de 0,75 mL
d'extrait dilué, du standard (0-0,1 mM ascorbate), ou blanc
(méthanol) est mise en présence de 1,5 mL de la solution de DPPH
à l'obscurité et pendant 30 min d'incubation. L'absorbance est
mesurée à 517 nm à l'aide d'un spectrophotomètre
UV-visible. Pour chaque échantillon, un blanc (méthanol) est
inclus a la place de DPPH.
8. Extraction et dosage des sucres solubles
totaux
La matière fraîche est extraite dans
l'éthanol 80% (v/v) à l'ébullition. Les sucres solubles
totaux sont dosés selon la méthode à l'anthrone
(Yemm et Willis, 1954) après incubation de l'extrait en
présence du réactif d'anthrone à 100°C pendant 10
minutes. La DO est mesurée à 640 nm contre une gamme croissante
de glucose.
9. Extraction et dosage de la proline
La proline est dosée selon la méthode de
Bates et al., (1973), mais dans la matière
végétale préalablement desséchée à
60°C. Elle est extraite par l'acide sulfosalicylique aqueux à 3%.
Le surnageant est récupéré après une centrifugation
effectuée à 14000 g, pendant 20 minutes à 4°C. La
proline est ensuite dosée dans le surnageant par une méthode
colorimétrique, qui est basée sur le complexe proline-ninhydrine,
obtenu après une heure à
Chapitre II Matériel et méthodes

21
Chapitre II Matériel et méthodes

22
100°C. Ce complexe coloré est ensuite extrait avec
du toluène et dosé à 520 nm par rapport à une gamme
étalon préalablement établie.
10. Extraction des lipides
a. Principe
Les lipides sont solubles à chaud ou à froid
dans les solvants organiques tels que l'éther de pétrole,
l'éther-di éthylique, l'hexane, l'acétone,
l'éthanol, le chloroforme, le méthanol, etc. En pratique l'hexane
et l'éther de pétrole à chaud sont les plus couramment
utilisés .On utilise pour cela un solvant à reflux dans un
extracteur de type SOXHLET. Les vapeurs chaudes du solvant traversent la
mouture (échantillon broyé) dans une cartouche, se condensent
plus haut dans un réfrigérant et retombent dans la cartouche
contenant la mouture. Lorsque le solvant remplit le corps de l'extracteur, il y
a siphonage et le solvant (chargé en huile fixe) retombe dans le ballon
d'ébullition. Le cycle continu jusqu'à l'extraction
complète de la matière grasse.
b. Mode opératoire
La détermination des matières grasses est faite
selon la méthode d'extraction par le SOXHLET, en utilisant l'hexane
comme solvant. On pèse 5g de feuilles du ricin bien broyées dans
une cartouche, on le recouvre avec coton et on la place dans le Soxhlet. Peser
le ballon qui servira à recouvrir le solvant et y introduire 50 ml
hexane.

Schéma de SOXHLET
Ensuite on va chasser par distillation la majeure partie du
solvant à l'aide de l'évaporateur rotatif (ROTAVAPOR) pour
éviter l'ébullition de l'huile qui à la longue pourrait
modifier les indices d'acidité.

Schéma de ROTAVAPOR
10.1. Détermination du rendement en matière
grasse
La teneur en huile ou teneur en matière grasse totale,
exprimée en pourcentage de la matière sèche, est
calculée selon la formule suivante :
Teneur en matières grasses (%) = ((P1 - P0)*100) /
PS
Avec :
P0 : poids en g du ballon à vide
P1 : poids en g du ballon contenant les lipides
PS : poids en g de la matière sèche
10.2. Détermination de la teneur en chlorophylle
et en béta carotène
On pèse 0,6g de l'échantillon dans une fiole de
25 ml et on complète avec le cyclohexane jusqu'à le trait de
jauge, puis on fait une agitation jusqu'à l'obtention d'une solution
limpide. Ensuite une lecture de DO à 670 nm pour la chlorophylle et
l'autre 470 pour le /3-carotène.
a. Teneur en chlorophylle
Teneur en chl:
absorbance670*106/E1*100*d
Avec :
E1 = 613 (l'extinction spécifique)
d = 1 cm (l'épaisseur de cuve)
b. Teneur en /3-carotène
Teneur en /3-carotène:
absorbance470*106/E2*100*d
Chapitre II Matériel et méthodes

23
Avec :
E2 = 2000 (l'extinction spécifique)
d = 1 cm (l'épaisseur de cuve)
11. Analyse chromatographique des acides gras
Les acides gras (AG) pour être analysés par
chromatographie en phase gazeuse doivent être transformés
chimiquement en des composés volatils, les esters méthyliques
d'acides gras (EMAGs). Cette réaction chimique s'appelle la
méthylation. La méthode utilisée est une
trans-méthylation alcaline directe (ISO 12966-2 : 2012),
illustrée par l'équation suivante :
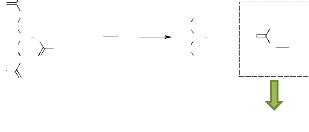
H2C
R
O
O
R
H2C
CH
O
O
OH
R
Glycérol
O
Triglycéride
OH
H2C
EMAGs
CH3
OH-
+ 3
O
Méthanol
CH
R
O
GC
O
La séparation des différents esters
méthyliques d'acides gras (EMAG) est effectuée par
chromatographie en phase gazeuse en utilisant un appareil de marque HP-6980
(Agilent Technologies, Palo Alto, CA, USA) série II muni d'un
détecteur à ionisation de flamme (FID), d'un auto-injecteur et
d'un échantillonneur automatique.
R: Chaîne carbonée de l'acide gras
La séparation des différents EMAG a
été réalisée sur une colonne capillaire polaire
TR-FAME (60 m de longueur, 0,32 mm de diamètre, 0,25 um
d'épaisseur du film). La température du four a été
programmée de la manière suivante: isotherme à 170°C
(2 min), augmentation de 3°C/min jusqu' à 240°C, de 170°C
à 240°C à raison de 3°C/mn pendant 15 mn, isotherme
à 240°C pendant 10mn. La température de l'injecteur et du
détecteur est maintenue à 225°C.
Les analyses ont été menées en mode split
(Rapport de split : 60/l, gaz vecteur: hélium, Débit total: 1.6
ml/min). Le système est piloté par un logiciel type Chemstation
qui assure l'intégration électronique des différents
pics.
Chapitre II Matériel et méthodes

24
L'identification des EMAG a été effectuée
en comparant leurs temps de rétention avec ceux des étalons de
référence acheté chez Fluka. Les compositions des EMAG (%)
se réfèrent au rapport de pourcentage de chaque composant au
total des acides gras. Le "double bond index" (DBI) a été
calculé comme suit (Gignon et al, 2004):
Avec, AM : acides monoénoïques ;
AD : acides diénoïques et AT :
acides triénoïques
ODR: Oleic desaturase ratio ([(C18:2+C18:3) /
(C18:1+C18:2+C18:3)]X100);
LDR: Linoleic desaturase ratio
([C18:3 / (C18:2+C18:3)] X100)
12. Analyse statistique
Toutes les expériences ont été
réalisées trois fois au cours de trois expériences
successives. Les résultats ont été exprimés par une
moyenne plus ou moins l'écart type.
Chapitre III
Résultats
et
Discussion
Chapitre III Résultats et discussions

25
I. Résultats
1. Effet de la pollution atmosphérique sur le
contenu en pigments
Le tableau 1 présente les teneurs en pigments dans les
feuilles des plantes du ricin récoltées au niveau des trois sites
(contrôle, S1 et S2). L'analyse de ce tableau montre une réduction
de la teneur en Chl a, accompagnée d'une augmentation de la teneur en
Chl b, ce qui induit une réduction du rapport Chl a / b, dans les
feuilles des plantes récoltées au niveau du site 2. De
même, les teneurs en caroténoïdes totaux sont
réduites. Ceci suggère une sensibilité de la Chl a et du
métabolisme des caroténoïdes à la pollution
atmosphérique. Au niveau du site 1, les teneurs en Chl a, en Chl b et en
caroténoïdes semblent être insensibles à cette
pollution.
Pour le lycopène, les teneurs en ce pigment augmentent
dans les feuilles des plantes récoltées au niveau des deux sites
1 et 2. Cette augmentation est de l'ordre de 286 et 302% respectivement, pour
S1 et S2.
La sensibilité de la chlorophylle dépend de la
distance à la source de pollution.
Tableau 1. Effet de la pollution
atmosphérique sur les teneurs en Chl a, Chl b, Chl totale, en
caroténoïdes totaux et en lycopène dans les feuilles des
plantes du ricin récoltées au niveau des 3 sites: Contrôle,
site 1 (S1) et site 2 (S2). Moyennes de 5 répétitions et
intervalles de sécurité au seuil de 5%.
|
Paramètres
|
Contrôle
|
Site 1
|
Site 2
|
|
Chl a
|
1,48#177;0,05a
|
1,61#177;0,09a
|
0,61#177;0,10b
|
|
Chl b
|
0,80#177;0,10b
|
1,12#177;0,24b
|
1,68#177;0,17a
|
|
Chl totale
|
2,29#177;0,12ab
|
2,73#177;0,26a
|
2,29#177;0,27a
|
|
Caroténoïdes
|
2,58#177;0,20a
|
2,47#177;0,24a
|
1,55#177;0,08b
|
|
Chl a/b
|
1,87#177;0,23a
|
1,48#177;0,34a
|
0,36#177;0,03b
|
|
Chl/car
|
0,89#177;0,07b
|
1,11#177;0,18b
|
1,47#177;0,12a
|
|
lycopène
|
0,19#177;0,03b
|
0,54#177;0,09a
|
0,53#177;0,09a
|
2. Chapitre III Résultats et discussions

26
Effet de la pollution atmosphérique sur
l'accumulation en MDA
Les acides gras poly-insaturés constituent la
principale composante lipidique de la membrane susceptible à la
péroxydation et à la dégradation dans les conditions des
contraintes environnementales.
La pollution peut entraîner la formation des radicaux
libres qui endommagent les membranes cellulaires. Les dommages membranaires ont
été détectés en mesurant le produit de peroxydation
des AGI et MDA, qui est un biomarqueur représentatif de ce type de
dommages.
L'effet de la pollution atmosphérique sur les teneurs
en MDA est représenté sur la figure 1. L'analyse de cette figure
montre que la pollution induit une peroxydation lipidique des feuilles des
plantes du ricin estimée par une augmentation de la teneur en MDA pour
les deux sites S1 et S2, par comparaison aux plantes témoins. Ce
résultat indique l'apparition d'un stress oxydatif induit par la
pollution atmosphérique.
Figure 1. Teneurs en MDA dans
les feuilles des plantes du ricin récoltées au niveau des trois
sites (Contrôle, S1 et S2). Moyennes de 3 répétitions et
intervalles de sécurité au seuil de 5%.
3. Effet de la pollution atmosphérique sur
l'accumulation en mélanoúdines
Il s'agit d'un pigment brun à haut poids
moléculaire résultant de la polycondensation des sucres
aldéhydiques et d'acides aminés qui se produit lorsque des
protéines et des sucres réducteurs sont mis en contact. Ils sont
accumulés dans les graines de mutants de riz
Chapitre III Résultats et discussions

27
déficients en aldéhyde
déhydrogénase 7 (Shin et al., 2009).
Cette enzyme est impliquée dans l'élimination des
aldéhydes, tels que le MDA.
Les résultats de la figure 2 montrent que
l'accumulation des mélanoidines est similaire dans les feuilles des
plantes du ricin pour les trois sites étudiés. Cela
suggère que les mélanoidines ne sont pas impliquées dans
le processus de tolérance ou résistance au stress.
|
600 500
400 300 200 100
0
|
|
|
C S1 S2
|
Figure 2. Effet de la pollution
atmosphérique sur les teneurs en mélanoïdines dans
les feuilles des plantes du ricin récoltées au niveau des trois
sites (Contrôle, S1 et S2). Moyennes de 3 répétitions et
intervalles de sécurité au seuil de 5%.
4. Effet de la pollution atmosphérique sur
l'accumulation des sucres solubles totaux
La figure 3 représente la variation des teneurs en
sucres solubles totaux dans les feuilles des plantes du ricin
récoltées au niveau de 3 sites.
Les résultats montrent qu'en réponse à
l'accumulation de MDA, les teneurs en SST augmentent, notamment dans les
feuilles des plantes du site 2. Cette augmentation est de l'ordre de 137% et
172%, respectivement pour S1 et S2.
Chapitre III Résultats et discussions

28
|
140 120
100 80 60 40
20
0
|
|
|
C S1 S2
|
Figure 3. Effet de la pollution
atmosphérique sur le contenu en sucres solubles totaux (SST) dans les
feuilles des plantes du ricin récoltées dans les trois sites
(Contrôle, S1 et S2). Moyennes de 3 répétitions et
intervalles de sécurité au seuil de 5%.
4. Effet de la pollution atmosphérique sur
l'accumulation de la proline
Outre son rôle dans l'ajustement osmotique, cet
aminoacide contribue aussi dans la protection des enzymes et dans
l'intégrité membranaire, chez les plantes soumises à des
conditions contraignantes.
La figure 4 représente la variation des teneurs en
proline dans les feuilles des plantes du ricin récoltées au
niveau de 3 sites: Contrôle, site 1 et site 2.
Les résultats de cette figure montrent que comme pour
les teneurs en sucres solubles, les teneurs en proline augmentent, notamment
dans les feuilles des plantes du site 2. Cette augmentation est de l'ordre de
220%.
Cette accumulation peut expliquer les rôles protectifs
des sucres solubles et de la proline contre les dommages induisent par le
stress oxydatif.
Chapitre III Résultats et discussions

29
|
1,2
1 0,8
0,6 0,4 0,2
0
|
|
|
C S1 S2
|
Figure 4. Effet de la pollution
atmosphérique sur le contenu en proline dans les feuilles des plantes du
ricin récoltées dans les trois sites. Moyennes de 3
répétitions et intervalles de sécurité au seuil de
5%.
5. Effet de la pollution atmosphérique sur la
teneur en protéines et les activités antioxydantes
Une analyse quantitative est effectuée sur cinq
systèmes antioxydants, tels que, la catalase, la gaïacol peroxydase
et l'ascorbate peroxydase (antioxydant enzymatique), les polyphénols
totaux et les flavonoïdes (antioxydant non enzymatique).
La figure 5 montre que la teneur en protéines des
feuilles des plantes récoltées au niveau des deux sites n'est pas
affectée par la pollution par comparaison à celle des feuilles
des plantes témoin (contrôle).
Ainsi, l'activité de la GPX augmente significativement
dans les feuilles des plantes récoltées au niveau des deux sites
S1 et S2. Cette augmentation est de l'ordre de 171 et 190%, respectivement pour
S1 et S2.
Contrairement à la GPX, l'activité de la CAT
diminue de 59 et de 17%, respectivement pour S1 et S2. Par ailleurs,
l'activité de l'APX reste insensible à la pollution au niveau des
deux sites S1 et S2.

Chapitre III Résultats et discussions
1000
800
600
400
200
0
C S1 S2
Figure 5. Effet de la pollution
atmosphérique sur la teneur en protéines solubles totaux, les
activités de la GPX, CAT et APX dans les feuilles des plantes du ricin
récoltées dans les trois sites. Moyennes de 4
répétitions et intervalles de sécurité au seuil de
5%.
30
1,2
1
0,8
0,6
0,4
0,2
0
500
400
300
200
100
0
40
35
30
25
20
15
10
5
0
Chapitre III Résultats et discussions

31
5. Effet de la pollution atmosphérique sur les
composés phénoliques
La figure 6 présente les teneurs en polyphénols
totaux et en flavonoïdes dans les feuilles des plantes du ricin au niveau
de trois sites. L'analyse de cette figure montre que les teneurs les plus
élevées sont enregistrées au niveau du site le plus
pollué S2. Ainsi, ces teneurs augmentent de 188 et 153%, respectivement
pour les polyphénols totaux et les flavonoïdes. Par contre, une
réduction de 45% est enregistrée dans les feuilles des plantes du
site 1, pour les PT.
|
70 60
50 40 30 20
10
0
|
|
|
18 16
14 12 10
8
6
4
2
0
|
|
|
C S1 S2
|
Figure 6. Effet de la pollution
atmosphérique sur la teneur en polyphénols totaux (PT) et en
flavonoïdes (Flav) des extraits méthanoliques des feuilles des
plantes du ricin récoltées dans les trois sites. Moyennes de 4
répétitions et intervalles de sécurité au seuil de
5%.
Chapitre III Résultats et discussions

32
6. Effet de la pollution atmosphérique sur
l'activité antioxydante totale et l'activité
antiradicalaire
L'activité antioxydante des extraits
méthanoliques est généralement attribuée à
ses composés phénoliques: polyphénols totaux,
flavonoïdes et tannins...etc.
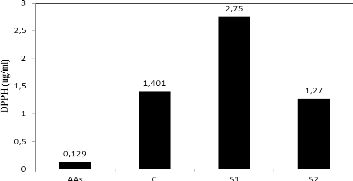
La figure 7. présente l'activité antioxydante
totale et celle antiradicalaire estimée par le test DPPH des extraits
méthanoliques des feuilles des plantes du ricin récoltées
au niveau des trois sites (contrôle, S1 et S2). L'analyse de cette figure
montre que l'activité antioxydante la plus élevée est
enregistrée au niveau des feuilles du site 2.
Cette activité et de l'ordre de 57,54
mgEAG.g-1MS. Par contre les valeurs les plus faibles sont
notées dans les feuilles du site 1 (25,52 mgEAG.g-1MS). Ces
résultats sont fortement corrélés avec la richesse des
extraits en composés phénoliques, polyphénols totaux et
flavonoïdes.
L'estimation de la capacité inhibitrice du radical DPPH
par les extraits des feuilles des plantes du ricin pour les trois sites,
a été faite par le suivi de la cinétique de cette
activité avec des concentrations variées. La courbe obtenue nous
a permis de déterminer la concentration d'inhibition à 50%
(CI50).
Les extraits méthanoliques des feuilles des plantes du
ricin récoltées à partir du site S1 montrent la valeur
IC50 la plus importante et donc possèdent l'activité antioxydante
la plus faible (DPPH: 2,75 ìg/ml).
Par contre, ceux des plantes du site S2 montrent la valeur
IC50 la plus faible (DPPH: 1,27 ìg/ml) et donc possèdent
l'activité antioxydante la plus importante. Ces résultats
confirment le dosage de l'activité antioxydante totale et
suggèrent l'existence des corrélations significatives entre le
pouvoir antiradicalaire et les teneurs en composés
phénoliques.

Chapitre III Résultats et discussions

33
Figure 7. Effet de la pollution
atmosphérique sur l'activité antioxydante totale et
l'activité antiradicalaire des extraits méthanoliques des
feuilles des plantes du ricin récoltées dans les trois sites.
Moyennes de 4 répétitions et intervalles de
sécurité au seuil de 5%. 7. Effet de la pollution
atmosphérique sur le métabolisme lipidique
7.1. Effet de la pollution atmosphérique sur
le rendement en lipides totaux
La figure 8 montre que le rendement en lipides totaux diminue
significativement avec l'augmentation de l'intensité de la pollution.
Cette réduction est de l'ordre de 38 et 60%, respectivement, pour S1 et
S2.
|
1 0,8
0,6 0,4 0,2
0
|
|
|
C S1 S2
|
Figure 8. Effet de la pollution
atmosphérique sur les rendements en lipides totaux (%) des feuilles des
plantes du ricin récoltées dans les trois sites. Moyennes de 3
répétitions et intervalles de sécurité au seuil de
5 %.
Chapitre III Résultats et discussions

34
7.2. Effet de la pollution atmosphérique
sur les teneurs en chlorophylle et en beta-carotène
Les teneurs en pigments (chlorophylle et beta-carotène)
de l'huile des feuilles du ricin, sont déterminés dans le tableau
2. L'analyse de ce tableau montre que la pollution atmosphérique
réduit la teneur en chlorophylle de l'huile fixe des deux sites, S1et
S2. Cette diminution est de l'ordre de 13 et 33%, respectivement pour S1 et
S2.
Par contre, la teneur en beta-carotène augmente de 117 et
115%, pour S1 et S2.
Tableau 2. Teneurs en
chlorophylle (mg.kg-1huile) et en beta-carotène
(mg.kg-1huile) des huiles fixes extraites des feuilles du ricin
récoltées au niveau d'un site non pollué (Contrôle),
site 1 et site 2
|
Contrôle
|
S1
|
S2
|
|
Chl
|
12,12#177;0,07
|
10,52#177;0,02
|
8,09#177;0,07
|
|
Béta-carotène
|
1,25#177;0,01
|
1,46#177;0,01
|
1,44#177;0,03
|
7.3. Effet de la pollution atmosphérique
sur la composition en acides gras
Le tableau 3 présente la composition en acides gras
dans les feuilles du ricin récoltées au niveau des trois sites,
Contrôle, S1 et S2.
L'analyse détaillée du profile en acides gras
(Tableau 3), a permis l'identification de 21 acides gras dont 11 sont des AGS
et 10 sont des AGI. L'huile des feuilles du ricin est plus riche en AGI dont
l'acide á- linolénique (C18:3) et linoléique (C18:2) sont
les composés prépondérants dans les feuilles du ricin des
trois sites analysées.
L'examen du tableau 3 révèle également
que la pollution atmosphérique induit une augmentation des pourcentages
des acides gras saturés (AGS) et ceux monoinsaturés (AGMI), alors
qu'il réduit considérablement les pourcentages des acides gras
polyinsaturés (AGPI), dans les feuilles du ricin des deux sites S1 et
S2, par comparaison au contrôle. Ce résultat pourrait expliquer la
réduction du rapport AGI/AGS.
Cette pollution a engendré une nette augmentation des
pourcentages de certains AGS notamment, l'acide myristique, margarique,
stéarique, béhénique et linogérique (Tableau 3).
Chapitre III Résultats et discussions

35
Dans l'ensemble, les résultats obtenus montrent que le
stress induit par la pollution a tendance à réduire le
degré d'insaturation des acides gras dans les feuilles du ricin via
une réduction des AGI, notamment l'acide
á-linolénique et l'acide linoléique.
L'indice d'iode (II) reflète le degré
d'insaturation d'une l'huile fixe. Les résultats de la valeur d'iode
(Tableau 3) montre que la pollution atmosphérique induit une
légère diminution de cet indice de l'ordre e 19 et 7%,
respectivement pour S1 et S2.
Les valeurs du taux de désaturation oléique
(ODR) et du taux de désaturation linoléique (LDR) indiquent,
l'efficacité des systèmes de désaturation de 18: 1
à 18: 2 et de 18: 2 à 18: 3, respectivement. Les résultats
du tableau 3 révèlent une diminution des valeurs du taux de
désaturation oléique (ODR) au niveau des deux sites S1 et S2 par
comparaison au contrôle. Ce qui révèle que la pollution a
induit une diminution de l'efficacité des systèmes de
désaturation de C18:1 à C18:2.
Ces résultats sont en concordance avec les valeurs de
DBI (Figure 9), qui montre que la pollution atmosphérique engendre une
réduction des niveaux d'insaturation.
Par contre, les résultats (Tableau 3) montrent que le
taux de désaturation linoléique (LDR) augmente au niveau des deux
sites S1 et S2 par comparaison au contrôle. Ces résultats
révèlent une augmentation de l'efficacité des
systèmes de désaturation de C18:2 à C18:3. Ceci pourrait
s'expliquer par l'activation des désaturasses en condition du stress.
Chapitre III Résultats et discussions

36
Tableau 3. Composition en acides
gras des feuilles des plantes du ricin récoltées au niveau de
trois sites (Contrôle, Site 1 et Site 2).
|
acide gras
|
Contrôle
|
Site 1
|
Site 2
|
|
acide caprylique
|
C8:0
|
5,83
|
5,39
|
2,07
|
|
acide décanoique
|
C10:0
|
4,33
|
4,13
|
2,93
|
|
acide laurique
|
C12:0
|
0,70
|
0,37
|
0,77
|
|
acide myristique
|
C14:0
|
0,62
|
0,09
|
2,20
|
|
acide myristoléique
|
C14:1
|
0,40
|
0,07
|
0,45
|
|
Acide penta-décanoïque
|
C15:0
|
0,35
|
0,06
|
0,26
|
|
Acide palmitique
|
C16:0
|
11,57
|
17,79
|
12,37
|
|
Acide palmitoléique
|
C16:1
|
0,89
|
0,09
|
0,70
|
|
Acide margarique
|
C17:0
|
0,31
|
2,04
|
1,02
|
|
Acide hepta-décenoïque
|
C17:1
|
0,58
|
0,10
|
0,13
|
|
Acide stéarique
|
C18:0
|
1,75
|
0,16
|
3,58
|
|
Acide élaïdique
|
C18:1 trans 9
|
0,99
|
0,14
|
0,55
|
|
Acide oléique
|
C18:1 Cis 9
|
0,45
|
6,14
|
1,63
|
|
Acide linoleaidique
|
C18:2 trans 9,12
|
0,21
|
0,13
|
0,30
|
|
Acide linoléique
|
C18:2 Cis 9, 12
|
21,89
|
16,29
|
18,20
|
|
Acide á- linolénique
|
C18:3
|
47,02
|
37,64
|
45,12
|
|
Acide arachidique
|
0:0
|
0,11
|
3,05
|
1,36
|
|
Acide gadoléique
|
0:1
|
0,07
|
0,01
|
0,11
|
|
Acide béhénique
|
2:0
|
1,17
|
4,03
|
4,81
|
|
Acide érucique
|
2:1
|
0,17
|
0,11
|
0,42
|
|
Acide lignocérique
|
4:0
|
0,60
|
2,18
|
1,00
|
|
AGS
|
|
28,528
|
39,546
|
33,241
|
|
AGMI
|
|
2,56
|
6,52
|
3,44
|
|
AGPI
|
|
68,91
|
53,93
|
62,56
|
|
AGI/AGS
|
|
2,505
|
1,528
|
2,008
|
|
Valeur d'iode
|
|
169,69
|
138,18
|
158,67
|
|
ODR
|
|
99,35
|
89,78
|
97,49
|
|
LDR
|
|
68,23
|
69,80
|
71,25
|
*AGS : Acides gras saturés
; AGMI : Acides gras monoinsaturés ; AGPI
: Acides gras polyinsaturés. ODR: Oleic
desaturase ratio ([(C18:2+C18:3)/(C18:1+C18:2+C18:3)]×100);
LDR: Linoleic desaturase ratio ([C18:3/(C18:2+C18:3)]
×100)
Chapitre III Résultats et discussions

37
|
210 180
150 120
90
60
30
0
|
|
|
C S1 S2
|
Figure 9. Effet de la pollution
atmosphérique sur l'indice de double liaison (DBI) des feuilles des
plantes du ricin récoltées dans les trois sites. Moyennes de 3
répétitions et intervalles de sécurité au seuil de
5 %.
II. Discussion
La pollution atmosphérique est un facteur du stress qui
peut exercer une pression sélective sur les populations
végétales. Les cimenteries émettent dans l'air des
particules de ciment, du calcaire, du gypse, de l'argile et du schiste, qui
sont riches en Fe, Al, Si et Ca. Ces éléments s'accumulent au
niveau du sol ainsi que sur la surface des feuilles des plantes exposées
à la pollution.
Dans cette étude, nous avons examiné l'effet de
la pollution par une cimenterie sur le métabolisme primaire (composition
en acides gras, rendement en huile fixe) et le métabolisme secondaire
(polyphénol, flavonoïdes, ...etc.), des feuilles des plantes du
ricin.
Le stress dû à la pollution atmosphérique
entraîne le colmatage des stomates, ce qui réduit la
disponibilité de CO2 dans les feuilles et inhibe la fixation du
carbone.
L'assimilation photosynthétique nette est un indicateur
couramment utilisé pour étudier l'impact des polluants
atmosphériques sur la croissance des plantes (Woo et
al., 2007). Ces dernières constamment exposées
aux polluants environnementaux absorbent, accumulent et intègrent ces
polluants dans leurs systèmes. Il est a signalé que, selon leur
degré de sensibilité, les plantes présentent des
modifications visibles, notamment une
Chapitre III Résultats et discussions

38
modification des processus biochimiques ou une accumulation de
certains métabolites (Agbaire et Esiefarienrhe, 2009).
Ces polluants, lorsqu'ils sont absorbés par les feuilles, ils peuvent
entraîner une réduction de la concentration des pigments
photosynthétiques, à savoir la chlorophylle et les
caroténoïdes, qui affectent directement la productivité de
la plante (Joshi et Swami, 2009). Par ailleurs, une exposition
élevée aux polluants atmosphériques force les
chloroplastes à un niveau d'énergie d'excitation excessif, ce qui
augmente la génération de ROS et induit un stress oxydatif
(Woo et al., 2007).
Les résultats du tableau 1 ont montré que la
pollution atmosphérique a induit une modification de la teneur en
pigments photosynthétiques des feuilles des plantes du ricin, par une
diminution de la teneur en chlorophylle a et en caroténoïdes, et
une augmentation de celle en chlorophylle b. Ces résultats sont en
accord avec ceux de Joshi et Swami (2009), qui ont
également montré une diminution de la teneur en
caroténoïdes dans les feuilles de six espèces
exposées à une émission véhiculaire. De même,
plusieurs chercheurs ont signalé une réduction de la teneur en
caroténoïdes en condition de la pollution atmosphérique
(Joshi et al., 2009; Tripathi et Gautam,
2007).
Il semble que l'effet principal des poussières est la
diminution du rendement de captage et d'utilisation de la lumière
incidente (Auclair, 1976), suite à une accumulation du
ciment sur les surfaces foliaires. Selon Auclair, les poussières ont pu
avoir un effet chimique, du aux éléments toxiques qu'elles
peuvent contenir (ciment). Ces éléments toxiques ont pu
pénétrer dans la feuille et détériorer les
éléments qui transforment l'énergie lumineuse en pouvoir
réducteur et en énergie utilisable par la plante. Donc
l'augmentation significative de la teneur en chlorophylle b chez les plantes du
ricin exposées aux émissions de cimenterie (Tableau 1), n'est
qu'une manière pour compenser le problème de la machinerie
photosynthétique: autrement dit, les poussières émises par
la cimenterie, s'accumulent sur les surfaces des feuilles et
pénètrent, ce qui entraîne des dégâts par la
toxicité de ces éléments chimiques, induisant ensuite une
diminution de la photosynthèse.
Cet abaissement de la photosynthèse résulte soit
d'un effet direct sur le transport des électrons et les enzymes du cycle
de Calvin, soit d'un effet indirect, en raison d'une diminution de la teneur en
chlorophylle.
En plus d'être accumulé sur les surfaces
foliaires, certains composants de ciment s'accumulent dans le sol tels que : le
sable (SiO2), le minerai de fer (Fe2O3) et la bauxite (Al2O3). Ces
éléments entrent dans la composition du sol et peuvent être
absorbés par les plantes. Certains minéraux sont indispensables
pour la croissance et le développement des
Chapitre III Résultats et discussions

39
Chapitre III Résultats et discussions

40
végétaux, tel que le fer. Ce dernier demeure un
élément essentiel participant à de nombreux processus
métaboliques indispensables à la vie de la plante. Cette
importance se traduit par le fait qu'il peut former jusqu'à six liaisons
de coordination en acceptant une paire d'électrons sur chacune de ses
six orbitales atomiques. Cette propriété fondamentale permet au
fer de s'associer à des protéines. Le chloroplaste est un lieu
majeur de l'utilisation du fer chez les végétaux chlorophylliens
puisqu'il contient 80% du fer cellulaire, plus particulièrement,
l'appareil photosynthétique contient 21- 22 atomes de fer, ce qui
représente l'un des processus cellulaires le plus exigeant en fer
(Briat et Vert, 2004).
En outre, l'accumulation des particules métalliques de
ciment peuvent provoquer suite à la formation de radicaux libres, des
dommages des membranes cellulaires, des acides nucléiques et des
pigments chloroplastiques... Ces éléments métalliques
provoquent une dégradation oxydative des lipides et des acides gras
insaturés. Des phases terminales de la dégradation conduiront
à des aldéhydes, parmi lesquels on peut citer le
dialdéhyde malonique (ou malondialdéhyde ou MDA). Nos
résultats (Figure 1), ont montré qu'il y a une forte
péroxydation lipidique, estimée par la forte accumulation de MDA,
chez les plantes exposées à la cimenterie, notamment celles du
site S2.
La gaïacol péroxydase (POD, GPX) est l'enzyme qui
élimine le 112O2 dans les chloroplastes. Elle est produite
par dismutation d'O2.- catalysée par la SOD. Dans les
feuilles du ricin récoltées au niveau des sites S1 et S2, nous
avons noté une augmentation de l'activité de la GPX (Figure 5).
Ces résultats montrent que cette enzyme joue un rôle crucial dans
les mécanismes de défense contre le stress oxydant chez les
plantes stressées du ricin.
La concentration en sucres solubles indique l'activité
physiologique d'une plante et détermine sa sensibilité à
la pollution atmosphérique. En effet, la réduction de la teneur
en sucres solubles dans les stations polluées peut être
attribuée à une respiration accrue et à une moindre
fixation du CO2 en raison de la détérioration de la chlorophylle.
Il a été mentionné que des polluants tels que le SO2, le
NO2 et le 112S dans des conditions de durcissement peuvent provoquer un
épuisement accru des sucres solubles dans les feuilles des plantes
cultivées dans des zones polluées (Tripathi et Gautam,
2007).
La diminution de la teneur en sucres solubles totaux des
feuilles endommagées correspond probablement à l'inhibition
photosynthétique ou à la stimulation du taux de
respiration (Tzvetkova et Kolarov, 1996). Les
résultats de la figure 3 montrent que les teneurs en sucres solubles
augmentent notamment chez les plantes du site 2 fortement exposées
à la cimenterie. Cette accumulation des sucres solubles semblent jouer
le rôle des osmo-protecteurs lors du stress oxydatif et aussi assurent
une protection des compartiments cellulaires suite à une
pénétration des particules constitutives de ciment. En outre,
l'augmentation des sucres solubles a été signalée chez
plusieurs espèces résistantes à la pollution
atmosphérique industrielle telles que Dodonea viscosa et
Prosopis juliflora (Abedi et al., 2009a, b; Koochak
et Seyyed Nejad, 2010).
Il a été rapporté que la proline agit en
tant que piégeur de radicaux libres pour protéger les plantes
contre les dommages causés par le stress oxydatif. La proline est
classée parmi les osmolytes les plus fréquemment accumulés
chez un grand nombre d'espèces. Cependant, son accumulation chez les
plantes peut aussi être le résultat d'autres facteurs
environnementaux qui ne perturbent pas la balance osmotique tels que les
contraintes biotiques. Il est aujourd'hui bien admis que la proline, outre sa
contribution dans l'ajustement osmotique, à d'autres rôles. Elle
peut stabiliser les membranes et les complexes protéiques. Elle peut
agir comme antioxydant, notamment grâce à sa capacité de
piégeage des radicaux libres. Elle peut également intervenir dans
la régulation du pH cytoplasmique ou servir de réserves
carbonées et azotées que la plante utilisera
postérieurement à la période du stress. Selon des
données récentes, l'effet protecteur de la proline en condition
du stress serait la conséquence des changements dans la
régulation de son métabolisme et de ses propriétés
intrinsèques (Ben Rejeb et al., 2012).
Nos résultats révèlent une augmentation
significative des teneurs en proline dans les feuilles du ricin (Figure 4). Ces
résultats sont en accord avec ceux de Seyyednejad et
al., 2009, qui ont montré une
accumulation de la proline dans les feuilles de Callistemon citrinus
planté sur un site pétrochimique.
Nos résultats suggèrent également que
plusieurs stratégies de défenses pourraient être
impliquées dans la réponse antioxydante du ricin. Cependant,
outre le rôle joué par ces enzymes antioxydantes, les
polyphénols accomplissent un rôle important dans la
détoxification des espèces oxygénées
réactives chez les plantes soumises à un stress oxydatif. Les
résultats de la figure 6 ont montré une accumulation des
composés phénoliques (polyphénols totaux et
flavonoïdes), dans les feuilles des plantes exposées directement
à la cimenterie (S2). Ceci suggère que la pollution
exercée par les émissions
Chapitre III Résultats et discussions

41
de la cimenterie a tendance à synthétiser des
métabolites secondaires tels que les polyphénols totaux et les
flavonoïdes, qui semblent jouer un rôle dans la tolérance de
ces plantes au stress exercé. Par contre la réduction de ces
teneurs dans les feuilles des plantes du ricin récoltées au
niveau du site S1 suggère que la synthèse de ces composés
est inférieure à leur catabolisme.
Les effets des polluants sur les plantes comprennent la
destruction des pigments, l'épuisement des lipides cellulaires et la
peroxydation des acides gras polyinsaturés (Tiwari et
al., 2006). Nos résultats (Figure 8, Figure 9 et
Tableau 3), ont montré que le stress réduit
considérablement les rendements en lipides totaux au niveau des feuilles
des plantes du ricin, induit une modification de la composition des acides gras
et ont révélé une tendance vers l'accumulation des AGS et
AGMI dans les feuilles du ricin des deux sites S1 et S2 via une
réduction des AGPI, notamment l'acide á-linolénique et
l'acide linoléique. La réduction des rendements en lipides totaux
au niveau des parties aériennes serait la conséquence d'une
réduction de l'activité photosynthétique, de la
péroxydation lipidique et de l'activation des processus catalytiques via
l'activation des enzymes lipolytiques (Zhu et al.,
2007).
Conclusions générales
et
Perspectives

42
Conclusions générales et perspectives
À l'échelle mondiale, les dernières
décennies ont connu une dégradation importante de la
qualité de l'air. Ce phénomène est lié au
développement des activités industrielles et au trafic routier
qui sont les principales sources de la pollution atmosphérique.
Dans notre projet, on s'est intéressé à
évaluer l'impact de la pollution de l'air provoquée par la
cimenterie, sur la réponse biochimique du ricin, et ce à l'aide
de l'analyse de quelques paramètres (chlorophylles,
caroténoïdes, activité antioxydante, composés
phénoliques, composition en acides gras etc...).
Les résultats obtenus ont révélé
que la pollution atmosphérique induit une réduction de la teneur
en Chl a et des caroténoïdes totaux, accompagnée d'une
augmentation de la teneur en Chl b, ce qui induit une réduction du
rapport Chla/b dans les feuilles des plantes récoltées au niveau
du site 2. Ce qui peut expliquer un abaissement de la photosynthèse qui
résulte soit d'un effet direct sur le transport des électrons et
les enzymes du cycle de Calvin, soit d'un effet indirect, en raison d'une
diminution de la teneur en chlorophylle.
Également, la pollution a induit une peroxydation
lipidique des feuilles des plantes du ricin estimée par une augmentation
de la teneur en MDA pour les deux sites S1 et S2. Ainsi, cette production de
MDA suite à une peroxydation lipidique accrue sera la cause d'une
génération excessive des radicaux libres.
Nos résultats montrent qu'en réponse à
l'accumulation de MDA, les teneurs en SST et en proline augmentent, notamment
dans les feuilles des plantes du site 2. Cette accumulation peut expliquer le
rôle protectif des SST et de la proline contre les dommages induits par
le stress oxydatif.
Il est bien établi que le stress oxydatif peut induire
des dommages des protéines cellulaires et membranaires, une peroxydation
des lipides et une dégradation des acides gras polyinsaturés,
affectant ainsi la fonction cellulaire et l'intégrité
structurelle.
L'analyse détaillée du profile en acides gras a
permis l'identification de 21 acides gras dont 11 sont des AGS et 10 sont des
AGI. L'huile des feuilles du ricin est plus riche en AGI dont l'acide á-
linolénique (C18:3) et linoléique (C18:2) sont les
composés prépondérants dans les feuilles du ricin des
trois sites analysées.
La pollution atmosphérique a engendré une nette
augmentation des pourcentages de certains AGS, notamment l'acide myristique,
margarique, stéarique, béhénique et linocérique.

43
Conclusions générales et perspectives
Dans l'ensemble, les résultats obtenus montrent que le
stress induit par la pollution a tendance à réduire le
degré d'insaturation des acides gras dans les feuilles du ricin via
une réduction des AGI, notamment l'acide
á-linolénique et l'acide linoléique. Cette
réduction des rendements en lipides totaux au niveau des parties
aériennes serait la conséquence d'une réduction de
l'activité photosynthétique, de la péroxydation lipidique
et de l'activation des processus catalytiques via l'activation des enzymes
lipolytiques.
En perspective, il serait intéressant de
continuer ce travail par:
? L'étude des mécanismes impliqués dans
la réponse des plantes du ricin vis-à-vis la pollution
atmosphérique provoquée par la cimenterie
? L'évaluation de l'effet de cette pollution sur la
composition en polyphénols
? L'analyse de la nutrition minérale des feuilles du
ricin affectée par la pollution atmosphérique
? L'étude de la spécificité de la
réponse des plantes issues du site 1 ? La sélection des
espèces indicatrices de la pollution.
Références
bibliographiques

44
Références
bibliographiques
A
Abbas, M.A. Iftikhar, H. Gul, A, 2015.
Effects of industrial pollution on Crop Productivity . Crop
productivity and Global environnemental issues, pp: 123-129.
Abedi, I., M. Ghorbanli and S.M. Seyyednejad,
2009. A study on resistance of Prosopis juliflora (s.w.) D.C.
to industrial air pollution by using assay of soluble sugar and some
antioxidant enzymes. Proceedings of the 1st National Conference Iran Plant
Physiology, Abstract, (NCIPPA`09), Iranian Society of Plant Physiology,
Esfehan, pp: 69-69.
Abedi, I., M. Ghorbanli and S.M. Seyyednejad, M.
Kezemi, 2009. A study on resistance of Dodonea viscose to industrial
air pollution by using assay of soluble sugar and some antioxidant enzymes.
Proceedings of the 1st Local Symposium in Medicinal Plant Role in Economic and
Social Development of Zagros, (LSMPRESDZ`09), Abstract, Agricultural Jahad and
Islamic Azad University, Ilam, pp: 9-9.
Agbaire, P.O. and Esiefarienrhe, E, 2009. Air
Pollution Tolerance Indices (APTI) of some plants around Otorogun gas plant in
Delta State, Nigeria. . Applied Science and Environmental Management, pp:
11-14.
Arora, A. Sairam, R.K. Srivastava, G.C, 2002.
Oxidative stress and antioxidative system in plants. Current science,
pp : 1227- 1238.
Auclair, D, 1976. Effets des
poussières sur la photosynthèse. Annales des sciences
forestières, pp :247-255.
Auclair, D, 1977. Effet des poussières
sur la photosynthèse - influence des polluants particulaires sur la
photosynthèse de pin de Sylvestre et de peuplier. Annales des sciences
forestières, pp : 47-57.
B
Bates, L.S., Waldren, R.P., Teare I.D. 1973.
Rapid determination of free proline for water-stress studies. Plant
Soil . pp: 205-207
Benakmoum, A., Souheila, A., Ali, A., Panagiotis, K.,
Dimitrios, G, 2008. Valorisation of low quality edible oil with tomato
peel waste. Food Chemistry. pp: 684-690.
Bengamra, S.,Oujidi, M.,Bastid , J,. Esteve, V,
2006. Apport de la diffraction des rayons X à la
détermination des traceurs minéralogiques de la pollution
atmosphérique particulaire d'une cimenterie. Pollution
atmosphérique. pp :455-463.
Ben rejeb, K., Abdelly, C., Savouré, A,
2012. La proline, un acide aminé multifonctionnel
impliqué dans l'adaptation des plantes aux contraintes
environnementales. pp: 291-299.
Bradford, M, 1976. A rapid and sensitive method
for quantitation of microgram of protein utilizing the principle of protein-dye
binding.Anal. Biochemistry . pp: 248-254.

45
Références
bibliographiques
Bossavy, J, 1970. Les pollutants
atmosphériques: leurs effets sur la végétation, Revue
forestière française. pp: 533-543
Briat, J.F., Vert, G, 2004. Acquisition et
gestion du fer par les plantes. Cahiers agricultures. pp:183-201.
C
Cakmak, I., Marschner, H, 1992. Magnesium
deficiency and high light intensity enhance activities of superoxide dismutase,
ascorbate peroxidase, and glutathione reductase in bean leaves. Plant
Physiology. pp: 1222-1227.
D
Dahech, S., Beltrando, G., Quenol, H, 2006.
Brise de mer et pollution atmosphérique à Sfax (Tunisie).
Pollution atmosphérique. pp: 211-220.
Dalstein, L., Tagliaferro, F., Vas, N., Ferrara, A-M.,
Spaziani, F, 2005. Effet de l'ozone sur la foret et la
végétation dans les Alpes franco-italiennes, forêt
méditerranéenne. pp :149156.
Déthiollaz, S, 2003. La ricine, une arme
biologique. Protéine à la `'Une». pp : 1-4.
Dewanto, V., Wu, X. Adom, K.K., Liu, R.H,
2002. Thermal processing enhances the nutritional value of tomatoes by
increasing total antioxidant activity. Journal of Agriculture and food
chemistry. pp:3010-3014.
F
Forero, C.L.B., 2004. Biodiesel from castor
oil: apromising fuel for cold weather. UniversityAvenidaGranColombia, Sciences
Francisco de Paula Santander. pp 96-99.
G
Ghnimi, W., Dicko, A., Khouja, M.L., El Ferchichi,
O.H., 2014. Larvicidal activity, phytochemical composition, and
antioxidant properties of different parts of five populations of Ricinus
communis L. Industrial Crops and Products. pp: 43-51
Ghosh, S., Tiwari, S.S., Srivastava, S., Sharma, A.K.,
Kumar, S., Ray, D.D., Rawat, A.K, 2013. Acaricidal properties of
Ricinus communis leaf extracts against organophosphate and pyrethroids
resistant Rhipicephalus (Boophilus) microplus. Veterinary Parasitology. pp:
259267.
Grub, A. Bungener P., Contat F., Nussbaum, S. Etner
V., Fuhrer J, 1997. Pollution atmosphérique et
biodiversité floristique, revue Suisse d'agriculture. pp: 43-48

46
Références
bibliographiques
H
Haleng, J., Pincemail, J., J.O. Defraigne, J.O.,
Charlier, C., ChaPelle, J.P, 2007. Le stress oxydant, Revue
médicale de liege. pp:628-638.
Hall, S.M., Medlow, G.C, 1975. Identification
of IAA in phloem and roots pressure saps of Ricinus communis by mass
spectrometry. Plant physiology. pp:56: 177.
Heath, R.L., Packer, L, 1968.
Photoperoxidation in isolated chloroplasts. I. Kinetics and stoichiometry of
fatty acid peroxidation. Archives of Biochemistry and Biophysics. pp:
189- 198.
I
Impens, R.A, 1999. Life conditions and stress
for urban trees, example of Brussels city. Acta Horticulturae. pp:301-307.
J
Joshi, N., A. Chauhan Joshi, P.C, 2009.
Impact of industrial air pollutants on some biochemical parameters and yield in
wheat and mustard plants. Environmentalist, 29: 398404.
Joshi, P.C. Swami, A, 2009.Air pollution
induced changes in the photosynthetic pigments of selected plant species.
Journal of environmental biology. pp: 295-298.
K
Kang, S.S., Cordell, A., Soejarto, D.D., Fong, H.H.S,
1985. Alkaloids and flavonoids from Ricinus communis. Journal
of natural products. pp: 155-156.
Khafagy, S.M., Mahmoud, Z.F., Salam, N.E.A,
1979. Coumarins and flavonoids of Ricinus communis growing in
Egypt.Planta Med., 37, p 191.
Kirtikar, K.R., Basu, B.A., 1991. Indian
medicinal plants, 3, Periodical Experts Book Agency, New Delhi, pp
:2274-2277.
Khogali, A., Barakat, S., Abou-Zeid, H.,
1992. Isolation and identification of the phenolics from Ricinus
communis L. Delta Journal of science. pp 198-211.
Koochak, H. and S.M. Seyyed Nejad, 2010. Some
morphological changes and physiological responses due to air pollution in
Prosopisjuliflora plant. Proceedings of the 16th National and 4th International
Conference of Biology, November 4-6, 2010, Mashhad, Iran, pp: 1414-1414.
Kota, C.S., Manthri, S., 2011. Antibacterial
activity of Ricinus communis leaf extract. International journal of
pharmaceutical sciences and research. pp: 1259-1261.

47
Références
bibliographiques
L
Lichtenthaler, H.K, 1988. Chlorophylls and
carotenoids: pigments of photosynthetic biomembranes. Methods in Enzymology.
pp: 350-383.
Liu, Y.J. and H. Ding, 2008. Variation in air
pollution tolerance index of plants near a steel factory: Implications for
landscape-plant species selection for industrial areas. WSEAS Transactions on
Environment Development. pp: 24-32.
M
Mau, J.L., Chao, G. R. Wu, K.T, 2001.
Antioxidant properties of methanolic extracts from several ear mushrooms.
Journal of Agricultural and Food Chemistry. pp: 5461-5467.
N
Nath, S., Manabendra, D.C., Shubhadeep, R.C., Das, A.T.,
Sirotkin, A.V., Zuzana, B., Kádasi, A.,Nora, M., Adriana, K,
2011. Restorative aspect of castor plant on mammalian
physiology.Journal of Microbiology, Biotechnology and Food Science. pp:
236-246.
Neff, C, 2008. Les Biocarburants - Analyse du
potentiel de production de biocarburants à l'échelle
internationale et en Tunisie, Orientations pour la production de biocarburants
en Tunisie, pp : 4-5.
O
Olsnes, S., Kozlov, J.V, 2001. Ricin. Toxicon.
pp: 1723-1728.
P
Parekh PP, Khan AR, Davin MT, 1989. X-ray
powder diffractometry of emissions from the cement industry.Atmospheric
Environment. pp: 2085-91.
Parent, C., Capelli, N., Dat, J., 2008.
Formes réactives de l'oxygène, stress et mort cellulaire
chez les plantes, Comptes Rendus Biologie. pp :255-261.
Perret, J.P., 2007. L'huile de Ricin Est Elle
Le Meilleur Lubrifiant Pour Nos Moteurs, Journal de l'environnement. pp 2-5.
Polvèche, V, 1996. La culture du ricin en
Europe, Ingénieries - EAT - Numéro 6, pp :49-58.
Poonam, S., Parchi, A., Krishna, M.Y., Tandon, V.,
2008. Antidiabetic activity of 50% ethanolic extract of Ricinus
communis L. and purified fractions, Food Chemistry and Toxicology. pp:
3458-3466.
Prieto, P., Pineda, M., Aguilar, M, 1999.
Spectrophotometric quantitation of antioxidant capacity through the formation
of a phosphomolybdenum complex: specific application to the determination of
vitamin E. Anal Biochemistry. pp: 337-341.

48
Références
bibliographiques
R
Ribereau-Gayon, P. (1968). Les
composés phénoliques des végétaux. Ed. Dunod,
Paris. pp : 250-254 .
Rousset, P., Marion, C., Coelho, F.C., Silva, O.,
Bélot, J.L., Berthaud, A., Clement, D., Fallot A.,Girard, P., Prades,
A., Silvie, P., Vaitilingom, G., Roscoe, R., Energie, I., Bedrossian, C. A,
2008 .Guide technique pour une utilisation énergétique
des huiles végétale. pp : 79-85.
S
Sharma, S., Vasudevan, P., Madan, M., 1990.
Insecticidal value of castor (Ricinus communis L.) against termites.
International Biodeterioration and biodegradation. pp 249-254.
Shin, J.H., Kim, S.R., An, G. (2009). Rice
aldehyde dehydrogenase7 is needed for seed maturation and viability. Plant
Physiology. pp: 905-915.
Seyyednejad, S.M., M. Niknejad and M. Yusefi,
2009. The effect of air pollution on some morphological and
biochemical factors of Callistemon citrinus in petrochemical zone in South of
Iran. Asian Journal and Plant Sciences. pp: 562-565.
Srinivas, N.D.; Rshami, K.R.; Raghavarao, K.S.M.S,
1999. Extraction and purification of a plant peroxidase by aqueous
two-phase extraction coupled with gel filtration. Process Biochemistry.
pp: 43-48
T
Tadolini, B., Juliano, C., Piu, L., Franconi, F.,
Cabrini, L, 2000. Resveratrol inhibition of lipid peroxidation. Free
Radical Research. pp:105-114
Tiwari, S., M. Agrawal and F.M. Marshall,
2006. Evaluation of ambient air pollution impact on carrot plants at a
sub urban site using open top chambers. Environmental Monitoring and
Assessment. pp: 15-30.
Tripathi, A.K. and M. Gautam, 2007.
Biochemical parameters of plants as indicators of air pollution. Journal of
Environmental Biology. pp: 127-132.
Tzvetkova, N. and D. Kolarov, 1996. Effect of
air pollution on carbohydrate and nutrient concentrations in some deciduous
tree spicies.Bulg. Journal of Plant Physiology. pp: 53-63.
V
Visen, P., Shukla, B., Patnaik, G., Tripathi, S.,
Kulshreshtha, D., Srimal, R., Dhawan, B, 1992. .Hepatoprotective
activity of Ricinus communis leaves. Intnational journal of.
Pharmacognosy. pp :241-250.

49
Références
bibliographiques
W
Wan, H.M, 2006. Biofuels Republic Brazil, la
rapide expansion de l'industrie des biocarburants au Brésil fait peser
de sérieuses menaces pour la survie de certaines populations et pour la
planète. pp : 19-21.
Woo, S.Y., D.K. Lee and Y.K. Lee,
2007. Net
photosynthetic rate, ascorbate peroxidase and glutathione reductase activities
of Erythrinaorientalis in polluted and non-polluted areas. Photosynthetica. pp:
293-295.
Y
Yemm, E., Willis, A, 1954. The estimation of
carbohydrates in plant extracts by anthrone. Biochemistry journal.
pp:508-514.
Yunus, M., Ahmad, K.J., Gale, R, 1979. Air
pollutants and epidermal traits in Ricinus communis, Applied science.
189-198
Z
Zhishen, J., Mengcheng, T., Jianming, W, 1999.
The determination of flavonoid contents in mulberry and their scavenging
effects on superoxide radicals. Food Chemistry. 64:555-559.
Zhu, J., Alvarez, S., Marsh, EL., Lenoble, M.E., Cho,
IJ., Sivuguru, M, 2007. Cell wall proteome in the maize primary root
elongation zone. ii. region-specific changes in water soluble and lightly
ionically bound proteins under water deficit1[W][OA].
-----------------------------------------------------------------------------------------------------------------Résumé
Dans cette étude on s'est intéressé
à évaluer l'impact de la pollution atmosphérique
provoquée par les particules émises de la cimenterie, sur la
réponse biochimique du ricin, et c'est à l'aide de l'analyse de
quelques paramètres (chlorophylles, caroténoïdes,
activité antioxydante, composés phénoliques, composition
en acides gras etc...).
Il s'est révélé que la pollution
atmosphérique a induit une peroxydation lipidique estimée par la
production accrue de MDA et qui sera la cause d'une génération
excessive des radicaux libres.
Nos résultats montrent qu'en réponse à
l'accumulation de MDA, les teneurs en sucres solubles totaux et en proline
augmentent notamment, dans les feuilles des plantes du site 2. Cette
accumulation peut expliquer le rôle protectif des SST et de la proline
contre les dommages induits par le stress oxydatif.
La pollution a augmenté les teneurs en
poyphénols totaux et en flavonoïdes au niveau des feuilles des
plantes du ricin. Nos résultats suggèrent que les composés
phénoliques pourraient jouer un rôle crucial dans les
mécanismes de défense contre le stress oxydant chez les plantes
du ricin.
Les résultats obtenus montrent que le stress induit par
la pollution a tendance à réduire le degré d'insaturation
des acides gras dans les feuilles du ricin via une réduction
des AGI, notamment l'acide á-linolénique et l'acide
linoléique.
Mots clés: Pollution, ricin,
chlorophylles, polyphénols totaux, flavonoïdes, acides
gras.
Abstract
In this study we were interested in evaluating the impact of
air pollution caused by the cement on the biochemical response of castor, using
the analysis of some parameters (chlorophylls, carotenoids, antioxidant
activity, phenolic compounds, fatty acid composition, etc.).
It is revealed that the pollution induced a lipid peroxidation
estimated by the increased production of MDA and which will be the cause of
excessive generation of free radicals.
Our results show that in response to the accumulation of MDA,
the levels of TSS and proline increase especially in the leaves of plants of
site 2. This accumulation can explain the protective role of TSS and proline
against the damage induced by oxidative stress.
Pollution has increased the total phenolics and flavonoid
levels in the leaves of castor plants. Our results suggest that phenolic
compounds may play a crucial role in the defense mechanisms against oxidative
stress in castor plants.
The results obtained show that pollution-induced stress tends
to reduce the degree of unsaturation of fatty acids in castor leaves by
reducing UFA, especially á-linolenic acid and linoleic acid.
Key words: Pollution, castor, chlorophylls, total
phenolics, flavonoids, fatty acids.
| 


