|
REPUBLIQUE TUNISIENNE Ministère de
l'Agriculture
Institution de la Recherche et de
l'Enseignement
Supérieur Agricole

Institut National Agronomique De Tunisie
Rapport de séminaire II
Spécialité : Production
Végétale
Installation d'une unité de
production de biofertilisants
Elaboré par : ALAMRI Rihab
BEN ABDALLAH Mariem
BEN HAMZA Amani
Encadré par : Madame LABIDI Sonia

Année Universitaire : 2014 - 2015
i | I NAT
Sommaire
INTRODUCTION 1
I- LES BIOFERTILISANTS 2
I.1- Définition 2
I.2- Différents types de biofertilisants 2
I.2.1.Les biofertilisants à base des bactéries
fixatrices d'azote 2
I.2.1.1. Les bactéries symbiotiques 2
I.2.1.2. Les bactéries non symbiotiques 3
I.2.2.Les biofertilisants à base des bactéries
solubilisatrices des éléments minéraux 4
I.2.3.Les biofertilisants à base de rhizobactéries
favorisant la croissance des plantes
(PGPR) 4
I.2.4.Les biofertilisants à base des champignons
mycorhiziens arbusculaires 5
II- PRODUCTION DE BIOFERTILISANTS 6
II.1- Production de biofertilisants à base de
Rhizobium 6
II.1.1.Isolement du nodule frais 6
II.1.2.Production de bouillon de culture 6
II.1.3 Procédures de contrôle de la qualité
8
II.2- Production de biofertilisants à base des
champignons mycorhiziens arbusculaires 9
II.2.1.Méthodes de production 9
II.2.2.Processus de production par la méthode
conventionnelle 11
II.2.3.Principales méthodes de contrôle 12
ii | I NAT
II.3- La préparation des supports de biofertilisants 13
III- CONCEPTION D'UNE UNITE DE PRODUCTION DE
BIOFERTILISANTS 15
III.1. Le plan 15
III.2. Le bâtiment 16
III.3. L'administration 16
III.4. Les laboratoires 17
III.4.1. Laboratoire de production des biofertilisants à
base de Rhizobium 17
III.4.2. Laboratoire de production des biofertilisants à
base de mycorhizes 21
IV- ETUDE ECONOMIQUE 25
CONCLUSION 28
BIBLIOGRAPHIE 29
1 | I NAT
Introduction
Les sols sont considérés comme des
systèmes dynamiques qui contiennent une variété de
micro-organismes tels que les bactéries, les actinomycètes et les
champignons. Le maintien de cette microflore tellurique favorable est
très important pour la durabilité des sols.
Cependant, les techniques agricoles utilisées ces
dernières décennies (utilisation de grandes quantités
d'intrants chimiques, tassement des sols...) ont provoqué une
raréfaction, voire une élimination de certaines micro-organismes
bénéfiques de la plupart des sols cultivés ce qui a
contribué à la perte de productivité de ces sols.
Vu le rôle fondamental joué par les
micro-organismes telluriques dans la fertilité des sols, une alternative
de maintien d'augmentation de leur biomasse devient une nécessité
de nos jours. Cette stratégie doit viser essentiellement à
réduire considérablement l'apport d'engrais chimiques de
synthèse et de pesticides. De ce fait, le recours à une
agriculture raisonnée paraît être la meilleure solution.
L'exploitation des nouveaux outils biologiques ouvre des perspectives
d'innovation et d'amélioration des systèmes de culture conduisant
à minimiser les risques de pollution de l'environnement (sol, eau et
air) et de contamination des aliments.
Parmi ces outils biologiques, les biofertilisants
représentent une tentative dont la demande ne cesse d'augmenter.
L'intérêt de ces biofertilisants réside dans la large gamme
d'actions dont ils offrent à l'agronomie d'aujourd'hui. Cette
diversité d'actions possède comme origine la différence de
la composition des préparations biologiques. En effet, ces
préparations contiennent des souches de cellules vivantes ou latentes
dont certaines possèdent une action directe sur la croissance des
végétaux tel est le cas des bactéries solubilatrices des
éléments minéraux et d'autres ayant une action indirecte
par le biais des phytohormones.
Dans ce cadre, l'installation d'une unité de production
de biofertilisants en Tunisie paraît être une solution pour
l'amélioration de la fertilité des sols cultivés à
travers la réintroduction de micro-organismes autochtones
bénéfiques.
2 | I NAT
I. Les biofertilisants
I.1. Définition
Les biofertilisants sont définis comme des
préparations contenant des cellules vivantes ou des cellules latentes de
souches de micro-organismes efficaces qui aident à l'absorption des
éléments minéraux par les plantes cultivées suite
à leurs interactions dans la rhizosphère lorsqu'ils sont
appliqués sur les semences ou dans le sol. Ils accélèrent
certains processus microbiens dans le sol impliqués dans l'augmentation
de la disponibilité des nutriments dans une forme facilement assimilable
par les plantes (Vessey, 2003).
L'utilisation des engrais biologiques est proposée
pour améliorer les rendements des cultures tout en assurant une
meilleure durabilité des systèmes de culture (Ohyama, 2006).
I.2. Les différents types de biofertilisants
I.2.1. Les biofertilisants à base de bactéries fixatrices
d'azote
Les bactéries fixatrices d'azote ont été
isolées de la rhizosphère de la majorité des plantes
cultivées présentant le plus souvent un taux d'azote fixé
inférieure à 20 kg par hectare et par cycle cultural (Roger et
Ladha, 1992).
Ces bactéries peuvent exister soit sous forme libre
(seules ou en symbiose avec d'autres bactéries du sol) soit en symbiose
avec des plantes tout en assurant la fixation de l'azote atmosphérique
(N2). En fonction de leur régime respiratoire, ces micro-organismes
peuvent être soit aérobies soit anaérobies.
I.2.1.1. Les bactéries symbiotiques
a. Le rhizobium
Les rhizobiums sont des bactéries du sol qui se
caractérisent par leur faculté unique d'infecter les poils
absorbants des légumineuses et de produire sur les racines des nodules,
siège de la fixation d'azote atmosphérique (Franche et al.,
2009).
Ils sont des micro-organismes en forme de bâtonnet qui
existent uniquement à l'état végétatif. Ce sont des
bactéries Gram négatif. A la différence de nombreux autres
microorganismes du sol, les rhizobiums ne produisent pas de spores. Ils sont
aérobies et mobiles (Jordan, 1984). Le rhizobium est classé parmi
les espèces économiquement importantes. Cet intérêt
provient du fait de l'importance de la quantité d'azote dont il peut
fixer. Cette fixation se déroule au sein des nodosités sur les
racines des légumineuses (Gage, 2004).
3 | I NAT
Ces micro-organismes présentent sept genres qui sont
hautement spécifiques pour former des nodules dans les
légumineuses tout en indiquant que le premier inoculum rhizobial a
été produit aux Etats-Unis et commercialisé par une
entreprise privée dans les années 1930.
b. Azospirillum
Les bactéries du genre Azospirillum sont des
habitants primaires du sol. On les retrouve aussi ; en symbiose à
l'intérieur des espaces intercellulaires du cortex racinaire de
certaines graminées (Agritech, 2014).
En dehors de la fixation de l'azote, la production de
substances de croissance, la résistance aux maladies et la
tolérance à la sécheresse sont quelques avantages
supplémentaires favorisés par l'inoculation des plants avec
Azospirillum (Agritech, 2014).
Cinq espèces d'Azospirillum ont
été décrites à nos jours: A. brasilense,
A.lipoferum, A.amazonense, A.halopraeferens et A.irakense
(Agritech, 2014).
c. Cyanobactéries
Les cyanobactéries (algues bleues et vertes) ont
été mises au profit de la culture du riz. Elles sont capables de
fixer entre 20 et 30 kg d'N / ha dans des conditions idéales, mais leur
utilisation n'est pas actuellement répandu vu que la préparation
du biofertilisant représente elle-même une limitation et les
mesures de contrôle de la qualité ne sont pas
généralement respectées (Amutha et al., 2014).
d. Azolla
C'est une fougère flottante qui fixe l'azote
atmosphérique en association avec l'algue bleue verte Anabaena
azollae fixatrice d'azote. Les frondes d'Azolla se composent de
sporophytes avec un rhizome flottant, de petites feuilles et des racines
bilobées qui se chevauchent entre elles. Elle est utilisée comme
engrais biologique pour le riz dans les zones humides en fournissant environ
40-60 kg d'N / ha par récolte de riz (Roger, 1993).
I.2.1.2. Les bactéries non symbiotiques a.
Azotobacter
Il en existe plusieurs espèces d'Azotobacter.
Parmi ces espèces, A. chroococcum présente
l'espèce dominante dans les sols arables capable de fixer l'N2 pour une
dose qui varie entre 2-15 mg N2 / g de sol à partir d'une source de
carbone dans les milieux de culture (Amutha
4 | I NAT
et al., 2014).
I.2.2. Les biofertilisants à base des
bactéries solubilisatrices des éléments minéraux a.
Bactéries solubilisant le silicate (SSB)
Ces micro-organismes sont capables de dégrader les
silicates qui sont des minéraux formés à partir d'un motif
élémentaire tétraédrique (SiO4). Ils fournissent
:
-Des ions H + dans le milieu favorisant ainsi l'hydrolyse.
-Les acides organiques comme l'acide citrique, l'acide
oxalique, les acides aminés et les acides hydro-carboxyliques dont le
complexe avec des cations permet de promouvoir leur enlèvement et leur
rétention dans le milieu à l'état dissous (Agritech,
2014).
De manière générale, les isolats
bactériens fabriqués à partir de différents
endroits ont un potentiel variable de solubilisation des silicates. Des
études d'inoculation avec des isolats sélectionnés avec de
la terre rouge, sol argileux, sable et la terre vallonnée ont
montré que les organismes se multiplient dans tous les types de sol et
libèrent plus de silice augmentant ainsi la disponibilité de la
silice dans le sol et l'eau (Amutha et al., 2014).
I.2.3. Les biofertilisants à base de
rhizobactéries favorisant la croissance des plantes (PGPR)
Les rhizobactéries sont définies comme des
bactéries qui colonisent les racines ou la rhizosphère du sol et
qui sont bénéfiques aux cultures (PGPR) (Beauchamp, 1993).
Ces bactéries sont actuellement commercialisées
sous forme d'inoculum. Elles semblent promouvoir la croissance des cultures par
plusieurs mécanismes qui sont comme suit : suppression des maladies des
plantes (par des bio-protecteurs), l'amélioration de l'acquisition des
éléments nutritifs (biofertilisants), ou la production de
phytohormones (appelées biostimulants) (Agritech, 2014).
Des espèces comme le Pseudomonas et
Bacillus élaborent des substances qui ne sont pas encore bien
définies soit comme des phytohormones soit comme des régulateurs
de croissance permettant aux cultures d'avoir plus de racines fines augmentant
ainsi la surface d'absorption chez les plantes. Ces PGPR sont
désignés comme des bio-stimulants et les
5 | I NAT
phytohormones qu'ils produisent comprennent :
indole-acétique, les cytokinines, les gibbérellines et les
inhibiteurs de la production d'éthylène (Agritech, 2014).
I.2.4. Les biofertilisants à base des champignons
mycorhiziens arbusculaires
La mycorhize représente une association symbiotique
entre des champignons telluriques et les racines des plantes. Ces associations
mycorhiziennes concernent plus de 95% des plantes terrestres dont la plupart
sont des plantes agricoles et horticoles (Barea et al., 1980).
Le type de symbiose est connu par sa capacité de
fournir un meilleur accès aux éléments nutritifs du sol
aidant ainsi les plantes à mieux résister aux stress
environnementaux (sécheresse, salinité, attaque par des agents
pathogènes...) de façon naturelle (Smith et Read, 2008).
En effet, les mycorhizes arbusculaires (MA) jouent un
rôle considérable dans l'amélioration de la nutrition du
végétal, notamment en phosphore. Bien que l'avantage principal
apporté par les mycorhizes soit nutritionnel, des effets non
nutritionnels sont également observés. En effet, les MA se
comportent comme des bioprotecteurs en renforçant les défenses
naturelles de la plante contre les bactéries et champignons
phytopathogènes, et en augmentant la tolérance des
végétaux à différents stress abiotiques (Van Vuuren
et al., 2010).
Au-delà de ces effets bénéfiques sur le
développement et la santé des plantes, le réseau
mycélien extra-radiculaire qui se développe dans le sol favorise
la rétention de ses agrégats, en stabilisant ainsi sa structure
et sa qualité. De ce fait, les mycorhizes MA peuvent aussi être
considérées comme des biostabilisants (Jeffries et al., 2003;
Gianinazzi et al., 2010).
Sachant que les ressources en phosphates minéraux se
raréfient, la maîtrise de la fertilisation devient une
priorité dans une stratégie de gestion durable (Van Vuuren et
al.,
2010). Puisque la symbiose mycorhizienne permet une meilleure
nutrition phosphatée,
elle peut jouer un rôle important dans la
durabilité de nos systèmes agricoles (Plenchette et al. 2005;
Hijri et al. 2006).
En conclusion, cette première partie renseigne sur le
large spectre d'activité des biofertilisants qui varie en fonction des
micro-organismes les composant. Ceci rend le choix du produit dépendant
des données agronomiques du pays et du lieu où il sera
appliqué. Pour ce faire, une analyse des conditions environnementales
dans les différentes régions de la Tunisie est nécessaire.
En effet, la Tunisie est un pays qui se caractérise par un climat aride
qui cause un déficit d'eau affectant d'une mauvaise manière
l'agronomie tunisienne. En plus,
6 | I NAT
les sols tunisiens souffrent d'un appauvrissement en
matière organique. Ce qui rend le stress hydrique et la pauvreté
des sols tunisiens en MO les critères de base pour le choix de
biofertilisants.
II. La production des biofertilisants
II.1. Production des biofertilisants à base de
Rhizobium II.1.1. Isolement du nodule frais
La première étape est l'isolement des nodules
sur des racines fraîches des légumineuses sont cultivées
sous serre puis nettoyées avec de l'eau du robinet pour enlever toutes
les saletés et les particules organiques. Ensuite, les racines sont
coupées à 2-3 mm de chaque côté des nodules et afin
de ne pas les endommager, l'utilisation des pinces est conseillée
(Burton, 1985 ; Beck et al., 1993). Ainsi, les nodules intacts sont
immergés pendant 10 secondes dans de l'éthanol à 95% ou
dans l'isopropanol afin de briser la tension de surface et d'éliminer
les bulles d'air. Ce traitement est suivi par un trempage dans une solution
d'hypochlorite de sodium à 2.5 % pendant 4-5 minutes (Burton, 1985).
Ces nodules peuvent être aussi stérilisés
superficiellement par immersion dans de chlorure mercurique (HgC12) à 0,
l % pendant 3 mn ou dans une solution de peroxyde d'hydrogène (3%)
(Burton, 1985). Après stérilisation, i1s sont
écrasés dans une goutte d'eau stérile. Ainsi, la
suspension obtenue est étalée sur le milieu Yeast Extract Manitol
(YEM) composé à base de mannitol et d'extrait de levure contenu
dans des boites de Pétri (Yokoyama et al., 2006).
Enfin, l'ensemble est incubé à 25-28 ° C
pendant 3 à 10 jours en fonction de l'espèce jusqu'à ce
que des colonies apparaissent (Burton, 1985). L'isolat d'une seule colonie de
rhizobium est ensuite purifié et confirmé comme Rhizobium
en démontrant sa capacité à former des nodules sur
une légumineuse hôte d'essai dans des conditions
contrôlées (authentification des isolats) (Burton, 1985).
II.1.2. Production de bouillon de culture
Le but de cette étape réside dans l'obtention
d'une forte densité de rhizobiums dans le bouillon de culture. Cette
opération est favorisée par le faite que ces micro-organismes
sont connus par leur capacité à être cultivés
facilement dans un milieu liquide. En revanche, ce processus est
influencé par plusieurs facteurs qui sont : le milieu de culture, la
souche de rhizobium, la température et l'aération (Yokoyama et
al., 2006).
7 | I NAT
Il est très important d'indiquer que la
stérilisation de l'ensemble de l'enceinte de croissance et du milieu
ainsi que d'assurer l'inoculation du fermenteur avec la culture de
Rhizobium dans un environnement stérile sont des
précautions à ne pas négliger (Yokoyama et al., 2006).
Étant donné que les rhizobiums sont des
bactéries aérobies, des longues expériences ont
montré que ces derniers ont besoin de 5-10 litre d'air pour 1 litre de
milieu de culture en une heure (Roughley ,1970). De plus, la température
optimale de croissance rhizobienne est de 28 à 30°C (Patil et
Alagawadi, 2010).
Le bouillon de culture doit contenir une source
d'énergie qui peut être des sucres, des alcools ou certains
acides. Ce milieu doit contenir aussi bien des facteurs de croissance que des
vitamines. Cependant, certaines espèces peuvent produire leurs propres
facteurs de croissance (Patil et Alagawadi, 2010).
Ainsi, la composition du bouillon en gramme par litre d'eau
distillée est la suivante :
Tableau1 : La composition du milieu de
culture YEM (Yokoyama et al., 2006)
|
Ingrédients
|
g l-1
|
|
K2HPO4
|
0.5
|
|
MgSO4.7H2O
|
0.1
|
|
NaCl
|
0.2
|
|
Mannitol
|
10.0
|
|
Extrait de levure
|
0.5
|
Toutefois, certains laboratoires utilisent le saccharose ou
l'infusion de maïs, au lieu d'ajouter le mannitol. L'ensemble du
mélange doit être maintenu à un pH de 6,4 (Hémissi
Zaghdoudi, 2013).
Enfin, la culture est incubée à 30 #177; 2
° C en culture submergée avec une agitation orbitale de 150 ppm
(partie par million). Cette incubation demeure jusqu'à ce que la
population de cellules soit maximale de 1010 à
1011 ufc (unité formant une colonie) / ml. La culture obtenue
est appelée culture démarreur (Yokoyama et al.,
2006).
8 | I NAT
Il reste à noter que le temps de reproduction varie en
fonction des bactéries. Il est de 2 à 4 heures pour les
bactéries dites « à croissance rapide » qui produisent
généralement des colonies relativement grandes de 2 à 4 mm
de diamètre en 3 à 5 jours et de 6 à 8 heures pour celles
« à croissance lente » qui forment des colonies de 1mm de
diamètre en 7 à 10 jours (Hémissi Zaghdoudi, 2013).
II.1.3. Procédures de contrôle de la
qualité du biofertilisant rhizobial
Le contrôle de la qualité des biofertilisants
rhizobiaux est basé sur trois types de test : - Test de culture
Mère
- Test de Bouillon
- Test de la tourbe (support)
a. Test de culture Mère
Au niveau de ce test, les aspects suivants doivent être
vérifiés : La croissance, la pureté et la coloration Gram
négatif des bactéries (Patiyuth et al., 2006).
b. Test de Bouillon
Les qualités suivantes des échantillons de
bouillon doivent être vérifiées:
I pH : Si le pH du bouillon diminue, cela signifie la
présence de contaminants.
I Coloration Gram négatif
I Densité optique : Suite à la
croissance des rhizobiums le bouillon de culture deviendra trouble au bout de
3-4 jours. Cette turbidité, ou la densité optique (DO) est
mesurée en utilisant un spectrophotomètre (à 540 nm). La
valeur de DO corrèle avec le nombre de cellules.
I Nombre total : en utilisant Petroff-Hausser une
chambre de comptage pour déterminer le nombre total des cellules viables
et mortes.
I Nombre viable : Le nombre de cellules vivantes est
pris en compte par des procédés de propagation sur plaque de
diffusion en faisant des dilutions en série 10 - 1, 10 - 6 ou 10 - 7
(dépendent de la concentration). Ensuite, trois échantillons
répétés de 0,1 millilitre du bouillon 10 - 6 et 10 - 5
sont répartis sur les plaques contenant : Extrait de levure + mannitol +
gélose rouge (congo). Les plaques sont incubées à (28 - 30
° C) ou à une température ambiante pendant 7 jours. Les
colonies de cellules de rhizobium sont rondes et à bord lisse. Elles
sont de couleur blanche et n'absorbent pas la couleur rouge.
9 | I NAT
Calcul du nombre de rhizobiums par ml :
nombre de colonies x facteur de dilution
Nombre de cellules /ml =
Volume de l`inoculum
c. La tourbe
Pour la tourbe, on vérifie :
? Le pH : Maintenir le pH neutre pour l'inoculant.
Étant donné que la tourbe est acide, le pH doit être
augmenté avec du CaCO3.
? L'humidité : La teneur optimale en
humidité de la tourbe-inoculant est comprise entre 40 - 50%. A basse
humidité les rhizobiums vont mourir rapidement. Si l'humidité est
élevée, l'inoculant peut coller au sac en plastique et, par
conséquent, détériore la croissance des rhizobiums.
? Nombre Viable : Le nombre de rhizobiums viables est
déterminé par la
méthode de diffusion-plaque comme dans l'essai de
bouillon.
La révélation des infections chez les plantes
peut se faire par une méthode indirecte connue par la méthode du
nombre le plus probable (NPP) suite à la formation des nodules. Elle est
largement utilisée lorsque la tourbe n'est pas stérile.
L'inconvénient de cette technique réside dans la longue
durée de l'obtention de résultat. La lecture des résultats
se fait par le biais des signes où le signe + indique la présence
des nodules et le signe - indique leur absence (Patiyuth et al.,
2006).
II.2. Production des biofertilisants à base des
champignons mycorhiziens arbusculaires
II.2.1. Méthodes de production
Le mode de production d'inoculums diffère selon la
famille des champignons (Haimet, 2013). Les champignons mycorhiziens
arbusculaires sont des symbiotes obligatoires strictes c'est à dire
dépendants de la présence d'une plante hôte pour se
développer et se multiplier. Le producteur d'inoculum est alors tenu de
cocultiver le complexe « champignon-plante hôte ». Sans
l'utilisation de plantes hôtes il serait impossible de mener à
terme le cycle de vie du mycorhize jusqu'à la production de nouvelles
propagules / spores (Haimet, 2013).
A ce jour, les deux technologies de production les plus
utilisées sont : la méthode conventionnelle et la méthode
in vitro.
a. 10 | I N A T
La méthode conventionnelle
Elle consiste à multiplier les champignons
mycorhiziens sur les racines d'une plante-hôte entière,
cultivée dans des containers en conditions contrôlées, en
serre ou en chambre de culture (Gianinazzi, 2012).
La production d'inocula doit se faire sur des supports
vivants, et non inertes comme habituellement pratiqué pour d'autres
microbes utilisés en production végétale. Ce mode
particulier de production conditionne le choix des souches à multiplier,
mais surtout la formulation des produits mycorhiziens et leur mode
d'inoculation (Gianinazzi et Vosatka, 2004).
b. La méthode « in vitro
»
Cette méthode consiste à multiplier le
champignon mycorhizien sur des racines cultivées sur milieu
synthétique en conditions stériles.
De ce fait, l'inoculum sous forme solide ou en suspension
liquide pourra se composer de différents types de propagules : spores,
mycélium fongique, fragments de racines mycorhizées. Un ou
plusieurs types de propagules peuvent être formulés dans un
même inoculum mycorhizien. De plus, les inoculums de champignons
mycorhiziens peuvent contenir une ou plusieurs espèces fongiques
mélangées. Les produits multi-espèces sont plus proches
des conditions naturelles car dans les écosystèmes il est rare de
ne rencontrer qu'une seule espèce de champignon mycorhizien. La
présence de plusieurs espèces fongiques permet à
l'inoculum de répondre à une plus grande diversité de
conditions de culture (Italpollina, 2015).
La multiplication in vitro est souvent à moindre
coût, et nécessite des systèmes plus réduits, ainsi
que des milieux de culture artificiels pour des temps de production plus
courts. L'utilisation de cette technologie reste utile pour les tests de
laboratoire in vitro, mais l'inoculum mycorhizien ainsi obtenu
(environnement artificiel sur des racines génétiquement
modifiés) est mal adapté à des applications dans le
domaine agricole, fournissant des résultats peu satisfaisant dans
l'ensemble (Italpollina, 2015).
D'autres modes d'inoculation peuvent être
pratiqués, comme le pralinage des racines et l'injection au pied des
arbres (Gianinazzi, 2012). De nouvelles technologies sont aussi en
développement, comme l'enrobage de graines avec des spores de
champignons MA, ou leur distribution via les circuits d'arrosage. Leur
réussite devrait fortement favoriser l'essor de l'utilisation des
champignons MA en production végétal (Gianinazzi, 2012).
11 | I NAT
II.2.2. Processus de production par la méthode
conventionnelle
Selon la publication INVAM, pour la production d'inoculum
à partir des cultures monospécifiques (à base d'une seule
espèce mycorhizienne), le piégeage des spores des mycorhizes
arbusculaires est souvent une nécessité (Saito et al., 2006).
En effet, ces cultures pièges peuvent également
aider à l'identification des champignons MA. Les spores
échantillonnées directement d'une parcelle de terrain peuvent
paraître en bonne santé, mais ne sont pas viables. Les spores
peuvent apparaître différemment, en raison de l'altération
du sol et les effets de l'environnement (Saito et al., 2006). Les cultures
pièges sont importantes dans les cas suivants :
· Lorsque la colonisation des MA est élevé
au niveau des racines d'une communauté végétale, mais avec
peu ou pas de spores produits, en particulier dans des conditions de sol arides
et hydriques.
· Lorsque le sol a une activité microbienne
élevée, en particulier au niveau des environnements tropicaux,
avec une température et une humidité relativement
élevées.
· Pour recueillir des spores saines d'espèces
différentes et établir des cultures monospécifiques.
Les étapes de la production de l'inoculum
mycorhizien sont les suivantes :
· Recueillir du sol, avec des pousses des plantes
pièges coupées à la couronne. Les racines sont finement
hachées et mélangées avec le sol en utilisant un hachoir
fort.
· Les racines hachées et le sol sont
mélangés avec du sable grossier, ou bien massé dans un sac
en plastique durable.
· Le mélange de terre est ensuite
transféré dans un pot en plastique de 15 cm de hauteur.
· Plantez des graines de la plante piège
appropriée dans le pot.
· Les cultures en pots sont maintenues dans une serre
pendant au moins 3 mois tout en vérifiant la sporulation de temps en
temps. Après quatre mois, la sporulation des mycorhizes peut être
à la pointe. Des tests sanitaires peuvent également être
effectués pour s'assurer qu'aucune contamination par des champignons
parasites ne s'est produite.
· Garder l'application des engrais à des faibles
quantités, afin d'encourager la prolifération des mycorhizes
à arbuscules.
12 | I NAT
? Les pots de la culture piège sont ensuite
laissés à sécher à l'ombre pour un maximum de deux
semaines.
? Récolter les spores en utilisant les techniques de
tamisage et de décantation.
? Les spores monospécifiques sont prêtes pour
l'inoculation sur les plantules des cultures désirées (Saito et
al., 2006).
II.2.3. Principales méthodes de
contrôle
Plusieurs méthodes analytiques sont utilisées
afin de détecter, quantifier et identifier la flore mycorhizienne
(Haimet, 2013). Parmi ces méthodes on peut citer :
a. L'évaluation du niveau de colonisation des
racines
Cette analyse porte sur l'observation d'un échantillon
représentatif de racines qui sera préalablement lavé
(Garbaye, 1990), éclairci, coloré puis observé sous loupe
binoculaire ou microscope (Phillips et Haymann, 1970).
b. Le taux de mycorhization estime le
pourcentage de longueurs de racines endomycorhizées. La colonisation des
racines par le champignon peut être évaluée par la
méthode des intersections de lignes. Ce diagnostic s'applique à
des échantillons de racines issues des cultures de pleins champs ou des
cultures hors sol sur substrat inoculé avec des champignons
mycorhiziens. Cette analyse met en évidence la présence de
propagules infectieuses de champignons mycorhiziens dans le support de culture.
Elle permet aussi d'évaluer si les conditions de culture (composition du
support, pratiques culturales...) sont favorables au bon développement
de la symbiose (Haimet, 2013).
c. Dénombrement de spores
Pour les champignons mycorhiziens arbusculaires, un
dénombrement de spores peut être réalisé sur des
échantillons de sols, de supports de culture inoculés,
d'inoculums microbiens ou tous autres produits enrichis en spores (engrais,
amendement) (Haimet, 2013).
Une extraction par voie humide suivie d'un tamisage est
réalisée. Les refus de tamis entre 40 et 250 microns sont
observés sous loupe binoculaire et les spores comptabilisées. Une
identification des genres fongiques, basée sur des critères
morphologiques, peut compléter le dénombrement (Haimet, 2013).
d. Test MPN (Most Probable Number ou Nombre le plus
probable)
Ce test est couramment utilisé pour quantifier les
populations microbiennes (bactéries, champignons saprophytiques) et le
nombre de propagules infectieuses dans un échantillon
13 | I NAT
(Gianinazzi-Pearson et al., 1985). Il s'appuie sur des
dilutions successives de l'échantillon à dénombrer puis
sur la culture, en conditions contrôlées, de plantes hôtes
inoculées avec chaque dilution réalisée. Ce test peut
être réalisé sur un échantillon de sol, un support
de culture inoculé ou un inoculum mycorhizien (Gianinazzi-Pearson et
al., 1985).
Le test MPN et le taux ou la fréquence
de mycorhization sont des analyses complémentaires permettant d'orienter
l'agriculteur sur les pratiques culturales à adopter pour favoriser
l'augmentation du potentiel mycorhizien de sa parcelle et le
développement d'une symbiose mycorhizienne bien établie (Haimet,
2013).
II.3. La préparation des supports de
biofertilisants
Les biofertilisants sont généralement
préparés comme inoculants à base de support contenant des
micro-organismes. L'incorporation des microorganismes dans un matériau
de support permet : Une manipulation facile, un stockage à long terme et
de haute efficacité des biofertilisants. Fondamentalement, l'inoculant
transporteur basé de ces bactéries peut être
préparé par une procédure commune (Senoo et Narumi,
2006).
La façon la plus courante de l'inoculation est
"l'inoculation des semences", dans lequel l'inoculant (Mélange
bactéries-support) est mélangé avec de l'eau bouillie, et
ensuite mélangé avec des graines. Dans ce cas, le transporteur
doit être sous forme de poudre fine. Pour réaliser le
revêtement étanche d'inoculant sur la surface des semences,
l'utilisation d'adhésif, tel que la gomme arabique, la
méthyléthylcellulose, solutions de saccharose, et les huiles
végétales, est recommandée (Senoo et Narumi, 2006).Tout
matériau collant disponible localement, qui est non toxique pour les
bactéries et les graines, peut être utilisé comme
adhésif.
L'inoculation de graines n'est pas toujours couronnée
de succès. Cela peut être dû à la faible
densité de population et / ou faible taux de survie de la souche
bactérienne ou de la spore inoculée sur la surface des graines et
dans le sol. Dans un tel cas, «l'inoculation du sol" sera adoptée
(Senoo et Narumi, 2006). Pour l'inoculation du sol en général,
l'inoculant granulaire est placé dans le sillon sous ou à
côté de la semence. Cela améliore la chance pour la souche
inoculée d'être en contact avec les racines des plantes (Van Veen
et al., 1997).
a. Matériel de support
Une grande variété de matériaux
utilisés comme transporteurs a été mis au point pour
améliorer la survie et l'efficacité biologique des inoculants en
protégeant les microorganismes de stress biotiques et abiotiques (Van
Veen et al., 1997).
14 | I N A T
Un support approprié devrait être peu
coûteux, facile à utiliser, miscible, emballable, et disponible.
En outre, le transporteur doit permettre l'échange de gaz, notamment de
l'oxygène, et sa teneur en matière organique et sa
capacité de rétention d'eau doivent être
élevées (Bashan, 1998 ; Ben Rebah et al., 2002). Selon
Somasegaran and Hoben (1994) un bon matériau de support doit être
non toxique, soit aux inoculants ou à la plante elle-même. En
outre, Stephens et Rask (2000) et Ferreira et Castro (2005) ont
déclaré que les transporteurs devraient avoir un pH neutre ou
facilement réglable, être localement abondante à un
coût raisonnable et capable d'être stériliser.
Parmi les transporteurs qui peuvent soutenir des niveaux
élevés de la charge microbienne, la tourbe est
considérée comme le support le plus utilisé (Burton, 1967
; Peterson et Loynachan, 1981) , mais n'est pas universellement disponible
(Tilak et Subba Rao, 1978).
Alternativement, différents matériaux tels que
les sous-produits industriels, les déchets organiques, les sols
minéraux, les sous-produits végétaux, le charbon, la
perlite et les déchets agro-industriels ont été
testés comme milieu de culture pour la croissance microbienne (Brockwell
et Bottomley, 1995 ; Stephens et Rask, 2000).
Un support peut être un matériau, tels que la
tourbe, la vermiculite, la poudre de lignite, l'argile, le talc, le son de riz,
le phosphate de roche granulé, le charbon de bois, le sol, le compost de
paille de riz ou de blé ou un mélange de ces matériaux
(Brar et al., 2012).
Dans la pratique courante, pour une meilleure durée de
vie de la formulation de biofertilisant, un transporteur ou un mélange
de tels matériaux de support sont choisis sur la base de la
viabilité des micro-organismes mélangés avec eux. De
même, la pré-stérilisation de la matière de support
et son enrichissement en éléments nutritifs est l'autre
stratégie pour améliorer la durée de conservation, en
permettant de maintenir le micro-organisme dans un micro-environnement non
compétitif (Stephens et Rask, 2000). Le saccharose, le maltose, le
tréhalose, la mélasse, le glucose et le glycérol sont des
nutriments supplémentaires et des agents protecteurs de cellules
couramment utilisées avec un matériau de support pour assurer la
viabilité cellulaire maximale et la durée de conservation
prolongée.
b. La stérilisation
La stérilisation des matériaux support est
essentielle pour garder un nombre élevé de micro-organismes
inoculés sur le support pendant une longue période de stockage
(Senoo et Narumi, 2006).
III. Conception de l'unité de production de
biofertilisants
L'installation d'une unité de biofertilisants doit
obéir à certains critères comme : la production
appropriée, l'emplacement, l'espace de construction, les
équipements, les machines, autre matériel de laboratoire et fonds
de roulement (Biomate india, 2008).
III.1. Le plan
Ce plan a été élaboré par un logiciel
d'architecture disponible sur Internet nommé Kozikaza
(figure 1).
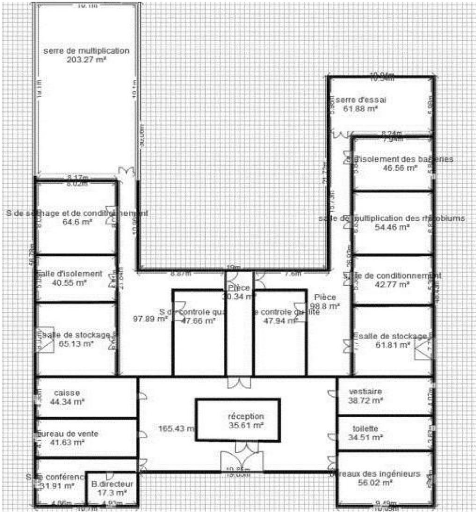
Figure1 : Plan représentatif de
l'unité de production de biofertilisants
15 | I NAT
16 | I NAT
L'unité s'étend sur une superficie totale de
1429.12 m2 dont deux tiers sont réservés aux
laboratoires de production.
III.2. Le bâtiment
Le bâtiment doit être fondé dans une zone
homogène sur la base de l'interaction des caractéristiques de
sols, de la géomorphologie et du climat. Cet endroit doit être
qualifié de tampon pour réduire les risques de contamination au
cours du processus de contrôle de la production et de la
qualité.
Le bâtiment reste l'infrastructure la plus importante.
L'architecture globale présente l'élément clé pour
la réussite de la production de biofertilisants. Pour ce faire, elle
doit être organisée dans une architecture en H. Le choix de cette
architecture repose sur le fait de son aspect économe en surface et sa
capacité de s'adapter au processus de stérilisation avec marche
en avant, autrement dit partir du « souillé », pour aller vers
le « propre » et ensuite vers le « stérile », sans
possibilité de retour en arrière et sans croisement de flux de
« souillé » et de « propre » (Biomate india,
2008).
La notion de stérilisation est consolidée par le
biais d'un couloir de circulation placé entre les deux espaces de
multiplication. Il dispose d'un système de traitement d'air pour
autoriser la circulation des personnels en tenues professionnelles. La
stérilisation est accentuée par la présence des portes qui
sont munies de panneaux transparents, ayant une résistance au feu
convenable et comportant de préférence un système de
fermeture automatique (OMS, 2005).
L'unité est répartie en 4 compartiments principaux
qui sont comme suit :
? Administration
? 2 laboratoires : une destinée à la production
des biofertilisants à base de bactéries et l'autre
réservée à la production des biofertilisants à base
des mycorhizes arbusculaires.
? Un espace réservé à l'emballage et au
stockage.
III.3. L'administration
|
Le rôle de l'équipe administrative consiste
à
|
permettre aux équipes scientifiques
|
et techniques de réaliser leurs missions dans les
meilleures conditions tout en respectant les directives et règles
administratives. Pour atteindre ces objectifs, différentes tâches
doivent être mise en oeuvre dont les principales sont :
préparation, mise en oeuvre du budget et contrôle de
son exécution, achats et procédures d'appel
d'offre, contrats et convention, gestion du
17 | I NAT
personnel de l'unité, élaboration et suivi du plan
de formation, accueil physique
et téléphonique, courrier et mise en oeuvre et
suivi des règles d'hygiène et de sécurité
(Atilf,
2015).
III.4. Les laboratoires
Un laboratoire doit être construit par des murs, des
plafonds et des sols lisses, faciles à nettoyer, imperméables aux
liquides et résistants aux désinfectants utilisés dans le
laboratoire. Les revêtements de sol doivent être
antidérapants. Ensuite, pour garantir le bon déroulement du
travail, l'étendu du laboratoire doit être suffisamment spacieux
(OMS, 2005).
Dans le plan de toute nouvelle installation (OMS, 2005), il
faudra prévoir :
? Un système de ventilation mécanique assurant
un flux d'air dirigé vers l'intérieur sans recyclage.
? Une alimentation électrique doit être fiable et
de puissance suffisante; il faut prévoir un éclairage de secours
permettant de sortir en cas de nécessité.
? Une alimentation en gaz de ville doit être fiable et
suffisante. Il est impératif d'assurer le bon entretien de cette
installation
? Une installation des lavabos, si possible avec l'eau
courante, dans chaque salle du laboratoire, de préférence
près de la porte.
? Une installation de systèmes de protection physique
et de sécurité anti-incendie doit être envisagée.
Enfin, il faut prévoir la place et les moyens
matériels permettant de manipuler et d'entreposer sans danger les
solvants, les substances radioactives ainsi que les gaz comprimés et
liquéfiés.
III.4.1. Laboratoire de production des biofertilisants
à base de Rhizobium
Cette unité de production est formée par une
serre et plusieurs salles : une salle d'isolement des souches
bactériennes, une salle de multiplication de l'inoculum
bactérien, une salle de conditionnement, une salle de contrôle de
qualité et une salle de stockage des inoculums bactériens.
L'ensemble s'étend sur une superficie totale de 414.22 m2.
a. 18 | I N A T
Serre d'essai
La serre vise à maximiser la productivité des
cultures en améliorant la relation entre la croissance des plantes
hôtes et la biomasse des nodules rhizobiales. Les cultures sont
cultivées dans des pots pour éviter tout risque de contamination
(figure 2). Outre le développement des cultures, la serre assure la
vérification du potentiel du Rhizobium purifié dans la
formation des nodules sur une légumineuse hôte d'essai dans des
conditions contrôlées (Burton, 1985). Ces taches se
déroulent dans un espace de 61.88 m2.

Figure2 : Serre d'essai
b. Salle d'isolement des souches
bactériennes
Cette salle de superficie 46.56 m2 est
consacrée à l'isolement des nodules, qui sont extraits à
partir des racines fraîches des légumineuses cultivées sous
serre. Les racines sont nettoyées et coupées en 2-3 mm de chaque
côté des nodules. Ces derniers sont stérilisés
superficiellement pour être écrasés par la suite dans une
goutte d'eau stérile (Burton, 1985 ; Beck et al, 1993).
La production du milieu doit tenir compte des exigences des
rhizobiums en énergie, en azote, en certains sels minéraux et en
facteurs de croissance (Yokoyama et al., 2006). Ce cursus est pratiqué
dans des récipients de différentes tailles qui sont ensuite
passés à l'autoclave pour être stérilisés.
Cette stérilisation est également nécessaire pour tous les
équipements de cette chambre. La notion de stérilisation
s'étend pour atteindre l'air d'admission qui sera véhiculé
par un compresseur accompagné par des filtres stériles (Yokoyama
et al., 2006).
c. 19 | I N A T
Salle de multiplication de l'inoculum
bactérien
La salle de multiplication occupe une superficie de 54.46
m2. Pour que la croissance du rhizobium soit possible, une culture
démarreur doit être également préparée. Cette
culture est réalisée à partir de la suspension obtenue
lors de l'isolement. En effet, un ensemencement est pratiqué sur un
milieu composé à base de mannitol et d'extrait de levure (YEM).
Puis, l'ensemble est incubé à 28°C jusqu'à que la
croissance de rhizobium sera observée dans des incubateurs
appropriés. Pour la production à grande échelle,
l'inoculum de la culture démarreur est transféré à
un grand fermenteur et produit jusqu'à le niveau des cellules requises
soit atteint (Yokoyama et al., 2006).
Toutefois, la culture démarreur doit maintenir
certains critères :
- Pureté : absence de contaminations
- Densité des colonies - Stade de croissance
Un réfrigérateur est utilisé pour
préserver toutes les cultures mères utilisées pour la
production des biofertilisants. La culture mère est
régulièrement sous- cultivée et conservée au
réfrigérateur pour une utilisation à long terme (Agritech,
2014).
d. Salle de conditionnement
Au niveau de cette salle de superficie de 42.77 m2,
un mélange entre le support stérile avec la culture
bactérienne sera effectué dans un sac stérile de
polypropylène et thermoscellé (Yokoyama et al.,
2006).
Chaque sachet du support doit être
pré-stérilisé de façon aseptique puis
injecté avec la culture au moyen d'une seringue munie d'une aiguille
stérile. A ceci s'ajoute, une machine automatique de distribution
(seringue automatique) est utilisée afin d'augmenter le taux de
production. Une fois le mélange est préparé, le trou de
perforation sera immédiatement scellé avec une étiquette
autocollante pré imprimé. Les sacs sont ensuite malaxés
à la main ou par un agitateur jusqu'à ce que l'inoculum liquide
sera absorbé uniformément dans le transporteur (Yokoyama et
al., 2006).
Il reste à indiquer que si le matériau de
support contient des nutriments disponibles pour le développement des
bactéries (par exemple le sol minéral), l'injection de culture de
départ des cellules bactériennes avec de l'eau stérile
pour le réglage de l'humidité est suffisante.
e. 20 | I NAT
Salle de stockage
Après l'emballage, le produit obtenu doit être
placé dans une température de 4°C pour assurer son stockage
pour une longue durée. Pour la réussite de cette conservation,
l'humidité finale de l'inoculant doit être de 45 à 50%. Le
milieu de stockage occupe un espace de 61.88 m2.
f. Salle de contrôle de la
qualité
Cette chambre occupant une superficie de 47.94 m2
est dédiée à réaliser trois types de tests de
contrôle de qualité du produit : le test de culture Mère,
le test de Bouillon et le test de la tourbe (support)
Ces tests sont assurés par un certain nombre de
matériels tels que le microscope, le pH-mètre et le
spectrophotomètre (figure 3).
Les résultats ainsi obtenues sont introduites dans une
base de données. Par défaut, tous les documents concernant la
production de biofertilisants sont stockés de manière
centralisée sur le serveur web de l'unité, sauvegardés sur
un disque dur séparé sur le même ordinateur, et
mémoriser sur un autre ordinateur dans le laboratoire.

Figure3 : Salle de contrôle de la
qualité
21 | I NAT
III.4.2. Laboratoire de production des biofertilisants
à base de mycorhizes
L'usine de production du biofertilisant est formée par
plusieurs salles occupant une superficie totale de 519.09 m2 et dont
la disposition est comme suit : en amont de la serre de multiplication de
l'inoculum mycorhizien, une salle de séchage et de conditionnement de
l'inoculum est installée suivie successivement par une salle d'isolement
des souches mycorhiziennes. En outre, l'usine renferme une salle de
contrôle de qualité et une salle de stockage des inoculums
mycorhiziens.
a. La serre de multiplication de l'inoculum
mycorhizien
La serre garantie la maximisation de la productivité
des cultures en optimisant la relation entre la croissance des plantes
hôtes et la biomasse des mycorhizes. Elle présente l'espace le
plus étendu avec une superficie de 203.27 m2 (figure4). Pour
que les plantes soient indemnes de maladies, la culture doit se faire dans des
pots ou dans des contenaires (INVAM, 2012).
Dans ce cadre, la plupart des cultures sont cultivées
pendant 3 à 4 mois pour minimiser l'accumulation de saprophytes dans le
milieu de croissance excessive et de la sénescence des racines.
Toutefois, une culture maintenue plus que 5 mois et un arrosage
réglementé est recommandé (INVAM, 2012).

Figure4 : Serre de multiplication de l'inoculum
mycorhizien
b. 22 | I NAT
Salle de séchage et de conditionnement de
l'inoculum
Cette salle est située juste avant la serre avec une
superficie de 64.6 m2 (figure 5). L'instauration de cette salle vise
à sécher le contenu des pots afin d'être
ultérieurement conditionné (INVAM, 2012).
Une fois les cultures sont prêtes à être
récoltées, elles sont déplacées vers des
étagères dans cette salle afin qu'elles ne sont pas
exposées à la lumière tout en permettant un séchage
lent du contenu des pots durant 2 à 3 semaines (INVAM, 2012).
Après cette période, les racines des cultures sont
découpées et mélangées avec un support
approprié.
La procédure du conditionnement débute par la
mise des cultures dans des sacs scellés. Ces sacs sont munis par des
codes écrits à la fois en surface et sur des étiquettes
apposées sur le coin supérieur gauche des cultures afin qu'ils
soient facilement identifiés au moment d'empilement. A ceci s'ajoute,
une organisation par ordre alphabétique des cultures est
également conseillée.

Figure 5 : Salle de séchage et de
conditionnement de l'inoculum
c. Salle d'isolement des souches
mycorhiziennes
Cette chambre est complètement isolée de toutes
les zones de culture de plantes ainsi que l'usage du sol non
stérilisé est strictement interdit (INVAM, 2012). Elle occupe un
espace de 40.55 m2.
23 | I NAT
L'isolement est pratiqué comme suit :
- Le contenu des pots séchés est installé
sur des planchers.
- L'isolement des spores à partir de l'échantillon
se fait par un tamisage
- Les spores sont obtenues suite à une décantation
de l'échantillon tamisé (INVAM, 2012).
L'usage du contenu isolé possède double fins :
- Production de biofertilisants à base des spores.
- Elaboration des recherches.
Une série de précautions doit également
être respectée (INVAM, 2012):
? Les planchers sont lavés au moins chaque semaine
? Pas de balayage afin d'éviter le soulèvement de
la poussière
? Les tables et les étagères sont nettoyées
avec une éponge humide ou une serviette. d. Salle de
contrôle de qualité
Cette salle occupant 47.66 m2 de superficie est
consacrée pour effectuer des tests de contrôle (figure 6). Ces
tests englobent le dénombrement des spores, l'évaluation du
niveau de colonisation des racines, le test MPN et l'examen microscopique des
spores isolées dont le nombre varie entre 10 à 15 pots par jour.
Une fois extraites, les spores sont transportées dans des boîtes
de Pétri en verre et conservés dans le
réfrigérateur du laboratoire. En effet, l'examen est
réalisé par un stéréo microscope le jour de
l'extraction.
Les informations ainsi récupérées sont
stockées dans une base de données et toutes les notes
écrites sont archivées comme une sauvegarde physique. De
façon systématique, tous les dossiers ayant traité la
collecte de la culture sont stockés de manière centralisée
sur le serveur web de l'unité, sauvegardés sur un disque dur
séparé sur le même ordinateur, et mémoriser sur un
autre ordinateur dans le laboratoire (INVAM, 2012).

24 | I NAT
Figure 6 : Salle de contrôle de
qualité
e. Salle de stockage
Le stockage se fait dans un espace de 65.13 m2
à une atmosphère de 4°C au niveau des étagères
de racks métalliques (figure 7). Ces dernières sont
caractérisées par des surfaces maillées pour optimiser la
circulation d'air autour de toutes les cultures tout en facilitant leur
nettoyage. Les racks sont placés au centre de la pièce et
équipés par des roues pour faciliter leur déplacement. La
durée de stockage peut atteindre 3 ans au maximum (INVAM, 2012).

Figure 7 : Racks métalliques de
stockage
25 | I NAT
Ce processus exige certaines recommandations:
I La surface des sacs et celle des étiquettes de sacs doit
être nettoyée de toute poussière avant qu'ils ne soient
placés dans cette salle.
I Les planchers et les étagères sont
régulièrement nettoyés avec un chiffon ou une
éponge humide.
I Les cultures doivent être stockées dans un coin du
laboratoire où la température de l'air ne soit pas
préjudiciable à la viabilité champignon.
IV-Etude économique
Notre projet consiste à mettre en place une
unité de production de biofertilisants. Ce projet est installé
pour couvrir le déficit biologique des sols tunisiens qui ne cesse
d'augmenter année après année.
En effet, notre projet a un double intérêt :
? Un intérêt écologique et
environnemental : maintenance de la diversité biologique
? Un intérêt agronomique :
effets bénéfiques aussi bien sur le rendement que la
qualité des produits agricoles.
De plus, le marché tunisien est dépourvu d'un
tel projet d'après une enquête établie auparavant du
ministère de l'agriculture. Ceci garantie plus de chance de
réussite à notre projet. En effet, l'absence des concurrents nous
rend un leader dans ce type de production en Tunisie.
Pour satisfaire tous les dépenses de notre
unité, nous allons adopter une stratégie de financement qui se
fait à raison de 30% sur fonds propres du responsable de l'exploitation
et 70% sous forme d'emprunts au taux d'intérêt annuel de 12%
remboursable en 4 ans.
Dans le même contexte, notre projet sera installé
dans une zone de l'intérieur du pays afin de profiter des remboursements
que l'état offre pour les projets installés dans ces zones. En
outre, l'innovation de notre projet ainsi que sa vision écologique nous
offre des subventions établies dans ce cadre.
Basé sur les différents paramètres
technico-économiques, une description des éléments de
revenus et ceux de dépenses peut être établie. En effet,
les éléments de revenus comprennent la vente des biofertilisants
alors que ceux de dépenses comprennent le coût des
matières
26 | I NAT
premières, du transport et de la commission, d'emballage,
des salaires, les réparations et l'entretien, l'assurance, la
publicité et autres frais généraux.
Les frais d'investissement sont traités comme suit
(tableau 2) :
Tableau 2 : Le bilan comptable
|
Actif
|
Passif
|
|
Actif immobilisé
Immobilisations corporelles
|
60 000DT
80 000DT
50 000DT
20 000DT
|
Financement permanent Capitaux
propres
|
70 000DT 105 000DT 80 000DT
|
|
Terrain
Constructions
Installations techniques, matériels et
outillage
Matériel de transport
|
Capital social
Capitaux propres et assimilés
|
|
Subvention d'investissement Dettes de
financement
|
|
Emprunts obligatoires
|
|
Total 1
|
210 000DT
|
Total 1
|
255 000DT
|
|
Actif circulant
Matières premières
Approvisionnements : emballages,... Production en cours
Créances
|
15 000DT 10 000DT 10 000DT 20 000DT
|
Passif circulant
Dettes fournisseurs Dettes fiscales et sociales
|
45 000DT 50 000DT
|
|
Total 2
|
55 000DT
|
Total 2
|
95 000DT
|
|
Trésorerie active
Caisse, chèques bancaires et postaux
|
120 000DT
|
Trésorerie passive
Concours bancaires et Soldes bancaires créditeurs
|
35000DT
|
|
Total3
|
120 000DT
|
Total3
|
35 000DT
|
|
Total général (1) + (2) + (3)
|
385 000DT
|
Total général (1) + (2) + (3)
|
385 000DT
|
Etant donné que l'idée de notre projet est
considérablement nouvelle par rapport à l'esprit de l'agriculteur
tunisien, le recours à l'exportation est une stratégie fortement
conseillée.
En effet, au départ le fait de se limiter uniquement
à la production locale parait être un risque vu les
caractéristiques particulières que porte notre agriculture. De ce
fait, un taux de 30 % d'export peut être suffisant au début.
Une fois la production est mise en oeuvre, une
stratégie de marketing doit être réalisée. Pour ce
faire, nous utiliserons simultanément plusieurs circuits (vente directe,
vente à des grossistes, grandes surfaces, vente à des
collectivités). Ce travail est assuré par un représentant
commercial. Pour les intermédiaires, nous décidons de leur donner
des
27 | I NAT
promotions et de leur offrir une facilité de paiement
afin de pousser la vente. De plus, nous organiserons des sessions de formations
à nos personnels (représentants commerciaux) et faire
contrôler la force de vente pour prendre les décisions
adéquates au moment opportun.
Cette politique de commercialisation peut être
également élargie par des publicités publiées
à la télé ou à la radio. A ceci s'ajoute, des
affiches publicitaires et des prospectus peuvent être utilisés. De
plus, on peut adopter une stratégie de porte à porte afin de
garantir la bonne connaissance de notre produit auprès des
agriculteurs.
En conclusion, nous allons installer des points de vente au
niveau des grands rassemblements agronomiques afin de faciliter l'accès
à nos produits et de fournir des services rapide et précis.
28 | I NAT
Conclusion
Les biofertilisants à base de mycorhizes arbusculaires
et de rhizobiums d'origine tunisienne peuvent être un remède face
à l'appauvrissement de nos sols et la chute de leur fertilité.
L'importance de ces micro-organismes prend naissance de leurs capacités
à augmenter la teneur des éléments minéraux
présents dans le sol et d'améliorer la résistance des
végétaux aux stress environnementaux. Pour cela, l'installation
d'une unité de production de biofertilisants locaux devient une
nécessité en Tunisie.
Etant donné que les principaux biofertilisants à
base des micro-organismes qui n'appartiennent pas à la même
famille, la production de chaque type de biofertilisant va adopter des
étapes différentes. Pour cette raison, l'architecture de notre
unité est basée sur la séparation des deux laboratoires
afin d'éviter les contaminations entre les micro-organismes formant les
fertilisants. Cette séparation est favorisée par la mise en place
d'un couloir de circulation dont les caractéristiques sont en faveur de
notre objectif.
En plus, l'emplacement des salles au niveau de chaque
compartiment est réalisé de sorte que le traitement des produits
sera réalisé en une atmosphère indemne de toute
contamination afin de garantir une meilleure qualité à nos
produits tel est le cas de la salle de séchage des mycorhizes. Le
stockage des produits occupe à son tour un rôle important dans la
réussite de notre unité. En effet, un stockage
réalisé avec les précautions nécessaires assure
d'une part la survie des micro-organismes donc l'efficacité biologique
des inoculums est également procurée et d'autre part le stockage
à long terme devient une perspective possible. Ceci est garanti par le
biais de l'usage des supports appropriés peu coûteux, facile
à manipuler, emballables et disponibles.
En conclusion, notre projet d'installation d'une unité
de production de biofertilisants à base de micro-organismes autochtones
est le premier de son genre en Tunisie. C'est un projet qui peut participer
dans l'amélioration de la fertilité des sols cultivés et
d'assurer la durabilité de la production agricole Tunisienne.
29 | I NAT
Références bibliographiques
Amutha.R, Karunakaran.S, Dhanasekaran.S, Hemalatha.K,
Monika.R, Shanmugapriya.P, Sornalatha.T, 2014. Isolation and mass
production of biofertilizer (azotobacter and phosphobacter). International
Journal of Latest Research in Science and Technology, 3, Issue1, 79-80.
Bashan Y, 1998. Inoculants for plant
growth-promoting bacteria in agriculture. Biotechnology
Advances.16.4:729-770.
Barea JM, Escudero JL, Azc6n-Aguilar C, 1980.
Effects of introduced and indigenous VA mycorrhizal fungi on
nodulation, growth and nutrition of Medicago sativa in phosphate-fixing soils
as affected by P fertilizers. Plant Soil.54 :283-296
Beauchamp C.J, 1993. Mode d'action des
Rhizobactéries favorisant la croissance des plantes et potentiel de leur
utilisation comme agent de lutte biologique. Phytoprotection, 74, numéro
1, 1993, p.19-27.
Beck, D.P., Materon L.A., Afandi F., 1993.
Practical Rhizobium - legme technology manual - technical manual vol
19. ICARDA, Syria.
Ben Rebah F.B., Tyagi R.D., Prevost D.,
2002.Wastewater sludge as a substrate for growth and carrier for
rhizobia: the effect of storage conditions on survival of Sinorhizobium
meliloti .Bioresource Technology.83:145-151.
Brar S.K, Sarma S.J, Chaabouni E.,
2012.Shelf-life of Biofertilizers: An Accord between Formulations and
Genetics. J Biofertil Biopestici, 3:e109.
Brockwell, J. and P. J. Bottomley, 1995.
Recent advances in inoculant technology and prospects for the future.
Soil Biology and Biochemistry .27:683-697.
Burton, J.C., 1967. Rhizobium culture and
use.p.1-33 In: Peppler, H.J.,Microbial Technology. Reinhold Publishing Corp.,
New York.
Burton, J.C,1985 .Legume inoculant production
manual. NifTAL Project, Hawaii.
Franche C., Lindstro·m K. et Elmerich C., 2009.
Nitrogen-fixing bacteria associated with leguminous and non-leguminous
plants. Plant Soil.321:35-59.
Ferreira E.M., Castro I.V., 2005.Residues of
the cork industry as carriers for the production of legumes inoculants .Silva
Lusitana.13. 2:159-167.
30 | I NAT
Gage D.J., 2004. Infection and invasion of
roots by symbiotic, nitrogen-fixing rhizobia during nodulation of temperate
legumes. Microbiol Mol Biol.Rev..68. 2:280-300.
Garbaye J., 1990. Pourquoi et comment
observer l'état mycorhizien des plants forestiers. Revue
forestière française.17.1:35-47.
Gianinazzi S., et Vosatka M., 2004. Inoculum
of arbuscular mycorrhizal fungi for production systems: science meets business.
Canadian Journal of Botany.82: 1264- 1271.
Gianinazzi S., Gollotte A., Binet MN., van Tuinen D.,
Redecker D. et Wipf D., 2010. Agroecology: the key role of arbuscular
mycorrhizas in ecosystem services. Mycorrhiza. 20 :519-530.
Gianinazzi S, 2012. La biotechnologie des
mycorhizes à arbuscules en horticulture. In : Alliances au pays des
racines -14. Colloque Scientifique de la Société d'Horticulture
de France(25.05.2012). 14-16.
Gianinazzi-Pearson V., Gianinazzi S., Trouvelot A.,
1985. Evaluation of the infectivity and effectiveness of indigenous
vesicular-arbuscular fungal populations in some agricultural soils in burgundy.
Canadian Journal of Botany .63 :1521-1524.
Hémissi Zaghdoudi I, 2013.
Optimisation de la symbiose rhizobium -pois chiche pour la
fertilisation et la lutte biologique. Thèse de doctorat, Sciences
Agronomiques, Institut National Agronomique de Tunisie, Tunis, 166p.
Hijri, I., Z. Sykorova, F. Oehl, K. Ineichen, P.
Mader, A. Wiemken and D. Redecker, 2006. Communities of arbuscular
mycorrhizal fungi in arable soils are not necessarily low in diversity.
Molecular Ecology . 15: 2277-2289
Jeffries P., Gianinazzi S., Perotto S., Turnau K. et
Barea JM., 2003. The contribution of arbuscular mycorrhizal fungi in
sustainable maintenance of plant health and soil fertility. Biology and
Fertility of Soils. 37:1-16.
Jordan D.C., 1984. Rhizobiaceae. In:
Kreig, N R (ed) Bergey's manual of systemic Bacteriology.1: 234-256.
Ohyama T, 2006.Introduction. p.1-2. In:
Biofertilizer Manual. Japan Atomic Industrial Forum (JAIF), Japan.
31 | I NAT
OMS-Organistaion Mondiale des la Santé,
2005. Manuel de sécurité biologique en laboratoire,
3éme édition, Genève, p.219.
Patil C. R. et Alagawadi A. R., 2010. Microbial
Inoculants for Sustainable Legume Production. M.S.Khan et al. (eds.). Microbes
for Legume Improvement. Springer-Verlag Wien. Germany.
Patiyuth S, Mercedes U, Juliet A, Bin Abdul Rahim k ,
Sun Suh J, 2006. Quality Control of Biofertilizers. p. 112-123. in :
BiofertilizerManual. Japan Atomic Industrial Forum (JAIF), Japan.
Peterson, H., and T. E. Loynachan, 1981. The
significance and application of Rhizobium in agriculture. pp. 311-331. In: The
Biology of the Rhizobiaceae. Academic Press, New York.
Phillips, J. M. and D. S. Hayman, 1970.
Improved procedures for clearing roots and staining parasitic and
vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection.
Transactions of the British Mycological Society, 55: 157-160.
Plenchette, C., C. Clermont-Dauphin, J.M. Maynard and
J.A. Fortin, 2005. Managing arbuscular nycorrhizal fungi in cropping
systems. Canadian Journal of Plant Sciences 85:3140.
Roger P A et Ladha J K, 1992. Biological N,
fixation in wetland rice fields: Estimation and contribution to nitrogen
balance. Plant and Soil .141 : 41-55.
Roger P.A, 1993. Les biofertilisants
fixateurs d'azote en riziculture: potentialites, facteurs limitants et
perspectives d'utilisation.p. 327-348.In: M. Raunet (ed.) Bas-fond et
riziculture. Montpellier cedex, France.
Roughley, R.J. 1970. The preparation and use
of legume seed inoculants. Plant and Soil 32:675-701.
Saito M, Nopamornbodi O,Thamsurakul S, Bin Abdul Rahim
K, 2006. Inoculant For Biofertilizer, Mycorrhiza. p. 90-101. In:
BiofertilizerManual. Japan Atomic Industrial Forum (JAIF), Japan.
Senoo K, Narumi I, 2006. Carrier materials.
p. 41-49. in : BiofertilizerManual. Japan Atomic Industrial Forum (JAIF),
Japan.
Smith SE, Read DJ, 2008. Mycorrhizal symbiosis.
3rd edn. Academic Press. London.
32 | I NAT
Somasegaran, P. and Hoben, H. J. 1994.
Handbook for Rhizobia. Methods in Legume-Rhizobium technology.
Springer-Verlag, NewYork. p. 332-341.
Stephens, J.H.G. and Rask, H.M., 2000.
Inoculant production and formulation. Field Crops Research, 65: 249-258.
Tilak, K.V.B.R., and N.S. Subba Rao., 1978.
Carriers for legume (Rhizobium) inoculants. Fert. News, 23:25-28.
Van Veen, B.D., van Drongelen, W., Yuchtman, M.,
Suzuki, A., 1997. Localization of brain electrical activity via
linearly constrained minimum variance spatial filtering. IEEE Trans. Biomed.
Eng. 44.9: 867 - 880.
Van Vuuren DP., Bouwman AF. et Beusen AHW., 2010.
Phosphorus demand for the 19702100 period: a scenario analysis of
resource depletion. Global Environmental Change, 20:428-439.
Vessey, J. K., 2003.Plant growth promoting
rhizobacteria as biofertilizers, Plant Soil 255:571-586.
Yokoyama T, Nuntagij A , Toan P.V , Senoo k ,
Tittabutr P , 2006. Inoculant For Biofertilizer, Rhizobium . p. 54-68.
in : BiofertilizerManual. Japan Atomic Industrial Forum (JAIF), Japan.
33 | I NAT
Références
électroniques
- AGRITECH - Organic Farming, 2014. Organic
Inputs and Techniques : Biofertilizers [en
ligne]. Disponible sur Internet : <
http://agritech.tnau.ac.in/org
farm/orgfarm biofertilizertechnology.html > [consulté le
02.12.2014].
- Atilf-Analyse et traitement informatique de la langue
française. Administration, gestion et secrétariat [en
ligne]. Disponible sur Internet : <
http://www.atilf.fr/spip.php?rubrique71
> [consulté le 18.03.2015].
- BIOMATE INDIA, 2008.BIOFERTILIZER LABORATORY AND PRODUCTION
UNIT fermentor-bio-fertilizer-project-reports.pdf.India [en ligne].
Disponible sur Internet : <
http://trade.indiamart.com/details.mp?offer=4241437591
> [consulté le 24.03.2015].
- Haimet M.L, 2013. MYCORHIZES, AUXILIAIRES DISCRÈTES DU
JARDINIER : Mycorhizes: Diagnostic et inoculation. Jardins de France
[en ligne]. Disponible sur Internet : <
http://www.jardinsdefrance.org/la-collection/622-mycorhizes-auxiliaires-discretes-du-jardinier/mycorhizes-diagnostic-et-inoculation
> [consulté le 20.01.2015].
- INVAM-West Virginal University. International Culture
Collection of (Vesicular) Arbuscular Mycorrhizal Fungi, 2012. Methods: Quality
control [en ligne]. Disponible sur Internet : <
http://invam.wvu.edu/methods/quality-control
> [consulté le 26.03.2015].
- ITALPOLLINA- France. Technologies :
PRODUCTION IN VIVO DE MICROORGANISMES UTILES A L'AGRICULTURE [en
ligne]. Disponible sur Internet : <
http://www.italpollina.fr/fr/Reproduction
in vivo.asp > [consulté le 11.02.2015].
- LAM-Laboratoire d'Astrophysique de Marseille. Administration
[en ligne]. Disponible sur Internet : <
http://www.lam.fr/le-laboratoire/administration/
> [consulté le 18.03.2015].
| 


