CHAPITRE III :
RESULTATS ET DISCUSSION
INSAT Chapitre III : Résultats et
discussion
I. Caractérisation de produits finis
L'étude des produits finis est élaborée
en se basant sur la comparaison de l'état cristallin et du comportement
thermique des médicaments (génériques ou princeps)
renfermant le même principe actif.
I.1. Analyse par diffraction des rayons X
L'examen des diffractogrammes permet d'une part d'évaluer
la cristallinité des principes actifs dans les comprimés et
d'autre part d'identifier quelques excipients cristallins et même
amorphes.
I.1.1. Produits finis à base d'acébutolol
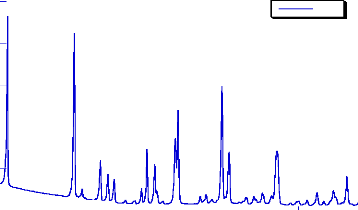
Le diffractogramme des rayons X de l'acébutolol
présente les pics caractéréstiques du polymorphe
(á) (figure 6)[29].
Intensité
1 ,6 1 0 5
1 ,4 1 0 5
1 ,2 1 0 5
4 1 0 4
2 1 0 4
8 1 0 4
6 1 0 4
1 1 0 5
0

A c e b
1 0 1 5 2 0 2 5 3 0 3 5
2 ? ( ° )
Fig- 6 : Diffractogramme des rayons X de
l'acébutolol
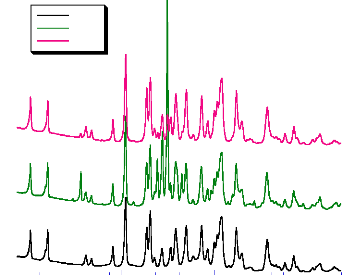
La figure (7) illustre les diffractogrammes des différents
produits finis à base d'acébutolol.
2012-2013 39
INSAT Chapitre III : Résultats et
discussion
Intensité
Aceb1
Aceb2
Aceb3
8 12 16 20 24 28 32
2? (°)
2012-2013 40
Fig- 7 : Diffractogrammes des rayons X des
produits finis à base d'acébutolol
On remarque que ce dernier reste sous la même forme
cristalline dans tous les produits finis puisque les positions des pics sont
conservées. Cependant, la variation de l'ordre d'intensité
révèle une modification de l'orientation des plans
préférentiels ; ceci est dùe probablement dû aux
opérations mécaniques effectuées lors de la mise en forme
galénique comme la granulation ou la compression.
On note aussi la présence d'autres pics qui sont relatifs
aux excipients cristallisés.
INSAT Chapitre III : Résultats et
discussion
2012-2013 41
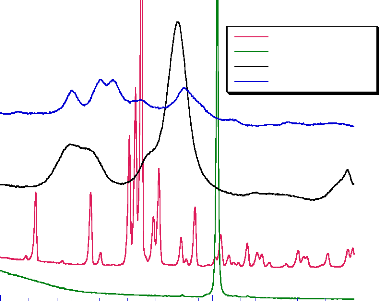
L'analyse de quelques excipients est effectuée afin
d'assigner les différents pics. On distingue un pic correspondant au
dioxyde de titane à 25,31° (Aceb (1)) et à 25,22°
(Aceb(2)).
Le lactose monohydrate possède quelques pics intenses
à la même position que ceux du principe actif : l'ordre
d'intensité des pics a donc changé à cause de la
superposition des deux réponses. En fait, cet excipient joue le
rôle d'un diluant pour la formulation et il est employé en grande
quantité. Il est présent dans les produits Aceb (2) et Aceb
(3).Ce dernier est substitué par un autre excipient amorphe pour le
produit Aceb (1). En effet, on remarque un écartement de son
diffractogramme de la ligne de base à un intervalle entre 13° et
23°. On peut trancher que ce signal est relatif à la cellulose
microcristalline plus tôt qu'à l'amidon de blé (figure
8).
Intensité
Lactose mono Dioxyde de titane Cellulose microcristalline Amidon
de blé
10 15 20 25 30 35
2? ???
Fig- 8 : Diffractogrammes des excipients
employés dans la formulation des produits
finis
INSAT Chapitre III : Résultats et
discussion
I.1.2. Produits finis à base de bétaxolol
Le diffractogramme des rayons X du bétaxolol est
présenté par la figure (9).
1 1 0 5
8 1 0 4
6 1 0 4
4 1 0 4
2 1 0 4
0
B eta
Intensité Intensité
e L
5 1 0 1 5 2 0 2 5 3 0 3 5
2 0 (° )
Fig- 9 : Le diffractogramme des rayons X du
bétaxolol
La comparaison des différents diffractogrammes des
produits finis à base de bétaxolol est illustré dans la
figure (10).
B e ta1
B e ta2
B e ta3
5 1 0 1 5 2 0 2 5 3 0 3 5
2 0 (°)
Fig- 10 : Diffractogramme des rayons X des
produits finis à base de bétaxolol
2012-2013 42
INSAT Chapitre III : Résultats et
discussion
I.1.3. Produits finis à base de
carvédilol
Le diffracogramme de carvédilol montre qu'il se trouve
sous la forme polymorphique II (figure 11) [30].
car
2 1 0 5
1 ,5 1 0 5

Intensité
5 1 0 4
1 1 0 5
0
1 0 1 5 2 0 2 5 3 0 3 5
2 0 (°)
Fig- 11 : Diffractogramme des rayons X du
carvédilol
La comparaison des différents diffractogrammes des
produits finis à base de bétaxolol est illustré dans la
figure (12).
Intensité
3,6 105
3,2 105
2,8 105
2,4 105
1,6 105
1,2 105
4 105
2 105
8 104

car1
car2
car3
10 15 20 25 30 35
20 (°)
Fig- 12 : Diffractogrammes des rayons X des
produits finis à base du carvédilol
2012-2013 43
INSAT Chapitre III : Résultats et
discussion
2012-2013 44
L'examen des diffractogrammes des produits à base de
bétaxolol et de carvédilol a permis de vérifier que les
produits finis sont toujours sous leurs formes cristallines initiales
(conservation des positions des pics par rapport au principe actif seul).
Néanmoins, la texture des principes actifs n'a pas pu être
déterminée étant donné que les pics sont
d'intensité très basse à cause des faibles dosages
(successivement 20 mg et 25 mg dans des comprimés de 320 à 350
mg).
Les réponses intenses des différents produits
finis sont relatifs essentiellement au lactose monohydrate, présent dans
la formulation à des proportions plus au moins importantes.
On remarque que les produits Beta (2) et Car (2)
présentent une zone de 13° à 23° relative à une
substance amorphe. En Effet, dans la formulation de ces deux comprimés
la cellulose microcristalline est employée à des proportions plus
importantes que celle du lactose monohydrate. Il est intéressant de
noter que les diffrctogrammes des produits Beta (3) et Beta (1) sont
parfaitement superposables : les deux produits finis donnent la même
réponse car ils ont une composition en excipients très semblable
de point de vue qualitatif et quantitatif.
Cette analyse structurale a permis de vérifier que les
molécules thérapeutiques ne présentent pas de
phénomène de polymorphisme : elles ne sont pas affectées
par les étapes de la mise en forme galénique à savoir la
granulation humide et/ou la compression ; leurs structures cristallines sont
assez stables dans les mélanges solides complexes des comprimés.
De plus, la présence de faibles quantités de certains excipients
cristallins et même amorphes a été mise en évidence
tel que le dioxyde de titane.
I.2. Analyse par calorimétrie
différentielle à balayage (DSC)
La calorimétrie différentielle à balayage
est une technique d'analyse qui fournit une courbe présentant le flux de
chaleur en fonction de la température. Elle permet d'étudier le
comportement thermique des substances analysées. On peut extraire des
thermogrammes la température de début de fusion (Ton set) et
l'enthalpie (ÄfH) mises en jeu au cours des phénomènes
observés.
INSAT Chapitre III : Résultats et
discussion
Il est nécessaire de souligner le fait que le principe
actif est dilué dans les comprimés à cause de la
présence d'autres composés ; la prise d'essais par
coséquent contient impérativement une quantité
inférieure de la substance thérapeutique que lorsqu'elle est
seule.
I.2.1. Produits finis à base d'acébutolol
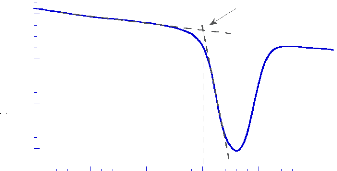
L'acébutolol présente un seul pic endothermique
dans l'intervalle 100- 150°C attribué à sa la fusion. La
température de début de fusion (Ton set) est de 140,1 °C, et
l'énergie mise en jeux au cours de ce phénomène est de
104,3 kJ/kg (figure 13).

-8
A ceb
Flux de chaleur (mW)
-10
-12
-14
-16
.
T
o n set
2012-2013 45
110 1 20 1 30 140 150 1 60
Température (°C )
Fig- 13 : Courbes DSC de
l'acébutolol
Les thermogrammes des produits finis à base de
l'acébutolol montre un seul pic endothermique au meme intervalle relatif
à la fusion du principe actif (figure 14) .
INSAT Chapitre III : Résultats et
discussion
Flux de chaleur (mW)
-10,4
-11,2
-12,8
-13,6
-14,4
-15,2
-12
-16

Aceb Aceb1 Aceb2 Aceb3
2012-2013 46
125 130 135 140 145 150 155 160
Température (°C)
Fig- 14 : Comparaison des courbes DSC de
l'acébutolol et ses produits
finis
Tableau 7 : Données issues des courbes
DSC de l'acébutolol et ses produits finis
|
Produit
|
ÄfH (kJ/kg)
|
Ton set (°C)
|
|
Aceb (principe actif)
|
112,7
|
140,1
|
|
Aceb 1 (générique)
|
67
|
138,3
|
|
Aceb 2 (générique)
|
85,5
|
134
|
|
Aceb 3 (princeps)
|
83,7
|
137,2
|
On constate que le produit Aceb (2) possède la
température de fusion la plus faible malgré qu'il possède
qualitativement la même composition que le produit Aceb (3).
Le générique (1) présente une enthalpie
moins importante que celle d'Aceb (2) et Aceb (3) quoiqu'il renferme la
même concentration en principe actif (tableau (7)).
INSAT Chapitre III : Résultats et
discussion
2012-2013 47
Théoriquement, l'enthalpie est une grandeur extensive,
elle doit donc être proportionnelle aux quantités de principe
actif dans les prises d'essais analysée .en effet, la teneur massique de
ce dernier n'est pas la même pour tous les produit finis (la masse des
comprimé diffère pour chaque produit fini).
I.2.2. Produits finis à base de bétaxolol
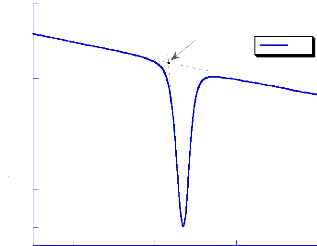
Le termogramme du bétanol présente dans
l'intervalle 100-150°C, un phénomène endothermiques
correspondant à sa fusion. La température de début de
fusion est de 113,3°C et l'énergie mise en jeux de ce
phénomène est de l'ordre de 104,3 kJ/kg (figure 15).
-50
Beta
-52
T
on set
-54
-56
-58
-60
-62
Flux de chaleur (mW)
80 90 100 110 120 130 140 150
Température (°C)
Fig- 15 : Courbes DSC du bétaxolol
La comparaison des différents thermogrammes des
produits finis présentés dans la figure (figure 16) montre un
décalage au niveau de la température du début de
fusion.
INSAT Chapitre III : Résultats et
discussion

Beta Beta1 Beta2 Beta3
Flux de chaleur (UA)
x 5
96 104 112 120 128 136 144 152
x 5
x 5
2012-2013 48
Température (°C)
Fig- 16 : Comparaison des courbes DSC du
bétaxolol et ses produits finis
Le produit Beta(3) possède la Ton set la plus faible.
On constate aussi que l'énergie de fusion du principe actif est
très faible pour les comprimés par apport à celle de la
substance thérapeutique seule. Ceci est dû au faible dosage du
bétaxolol dans les comprimés (20 mg environ). En outre, les
quantités de chaleur mise en jeu sont comparables (tableau(8)).
Tableau 8 : Données issues des courbes
DSC de bétaxolol et ses produits finis
|
Produit
|
ÄfH (kJ/kg)
|
Ton set (°C)
|
|
Beta (principe actif)
|
104,3
|
113,3
|
|
Beta1 (générique)
|
4,1
|
109,3
|
|
Beta 2 (générique)
|
5,1
|
109,3
|
|
Beta 3 (princeps)
|
4,4
|
108,3
|
On note aussi que les produits Beta (1) et Beta (3)
présentent un deuxième pic de fusion, aux alentours de
115-140°C, qui peut être relatif aux d'excipients :
carboxyméthyl cellulose sodique, Macrogol 400 et l'hypromellose. En
effet, ces excipients ne sont présents que dans la formulation des
produits Beta (1) et Beta (3).
INSAT Chapitre III : Résultats et
discussion
2012-2013 49
I.2.3. Produits finis à base de
carvédilol
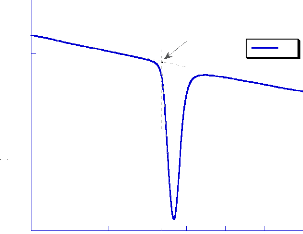
La courbe DSC du carvédiol illustre un seul
phénomène endothermique dans l'intervalle 100-150°C,
correspondant à sa fusion (figure17). La température de
début de fusion est de 113,7°C et une énergie mise en jeux
de 123,5 kJ/kg.
Car
T
on set
-65
-70
-75
Flux de chaleur (UA)
80 90 100 110 120 130 140 150
Température (°C)
Fig- 17 : Courbe DSC du carvédilol
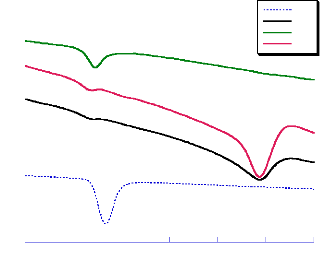
Les thermogrammes des produits finis à base du
cavédilol présentent deux phénomènes
endothermiques. Le premier est attribué à la fusion du principe
actif.
Le deuxième phénomène observé aux
alentours de 150 °C pour les produits Car (1) et Car (3). Il peut
correspondre à la fusion du PVP étant donné qu'il n'existe
que dans la formulation de ces deux médicaments (figure 18).
On constate que le produit Car (3) présente la
température de début de fusion la plus faible, alors que Car (2)
possède une enthalpie de fusion six fois plus importante que celles des
autres produits finis (Tableau (9)).
INSAT Chapitre III : Résultats et
discussion
Car
Car1
Car2
Car3
Flux de chaleur (UA)
x5
100 110 120 130 140 150 160
x5
x5
2012-2013 50
Température (°C)
Fig- 18 : Comparaison des courbes DSC du
carvédilol et ses produits finis
Tableau 9 : Données issues des courbes
DSC de carvédilol et ses produits finis
|
Produit
|
ÄfH (kJ/kg)
|
Ton set (°C)
|
|
Car (principe actif)
|
123,5
|
113,7
|
|
Car 1 (générique)
|
1,1
|
111,2
|
|
Car 2 (générique)
|
7,7
|
111,7
|
|
Car 3 (princeps)
|
1,3
|
110,9
|
D'une manière générale, on note pour les
différentes courbes DSC :
? un seul phénomène endothermique relatif au
principe actif et correspondant à sa fusion est observé dans
l'intervalle 100-150°C;
? les températures de début de fusion des
produits finis sont moins importantes que celle du principe actif seul ;
? une variation importante de l'enthalpie de fusion. Celle-ci
pourrait être due l'existence d'une interaction entre le principe actif
et les excipients dans chaque formulation.
INSAT Chapitre III : Résultats et
discussion
2012-2013 51
II. Etude du comportement thermique et cristallin des
principes actifs au sein des mélanges binaires
Pour la suite des analyses, notre intérêt s'est
uniquement porté sur l'étude de comportement de
l'acébutolol et du bétaxolol puisque la compatibilité
carvédilol-excipients a été le sujet de plusieurs travaux
de recherches [13, 15, 23, 25].
Des mélanges binaires principe actif- excipient ont
été alors préparés. Tout d'abord, les excipients
choisis sont ceux déjà existant dans la formulation des
médicaments étudiés : le lactose monohydrate (diluant), le
magnésium stéarate (lubrifiant) et le povidone (PVP) (liant).
Nous avons ensuite étudié l'interaction principe
actif-excipient des antioxydants qui se sont avérés incompatibles
avec l'aténolol (un bétabloquant) : l'acide ascorbique, l'acide
citrique et le butylhydroxyanisole (BHA).
II.1. Etude des DSC de mélanges binaires avec
des excipients existants dans la formulation des produits finis
Les mélanges binaires préparés sont
divisés en deux séries : la première est analysée
juste après leur préparation et l'autre est soumise à des
conditions de stress dans la chambre de vieillissement
accéléré.
Les conditions de stress choisies (40°C ,75%
d'humidité, mélanges 50:50 , à un séjour d'un mois)
ont comme but de favoriser et d'accélérer toute interaction
probable entre les principes actifs et les excipients
II.1.1. Etude thermique des mélanges binaires avec
l'acébutolol
La figure 19 présente les courbes DSC des
mélanges binaires préparés avec l'acébutolol avant
et après leurs mises sous conditions de stress.
INSAT Chapitre III : Résultats et
discussion

Aceb
Aceb lactose monohydrate
Aceb Mg stéarate
Aceb PVP
Aceb CS
Aceb lactose monohydrate CS
Aceb Mg stéarate CS
Aceb PVP CS
10
5
-10
-15
0
-5
Flux de chaleur (mW)
60 80 100 120 140 160
Température (°C)
Fig- 19 : Courbes DSC de l'acébutolol et
ses mélanges binaires avec le lactose monohydrate, le Mg stéarate
et le PVP avant et après conditions de stress (CS)
On remarque que la température de début de fusion
diminue pour les mélanges sans applications de conditions de stress de
1,2 à 1,8 °C (Tableau 10).
On observe aussi un changement au niveau de la forme des pics
révélant une modification de la cinétique de ce
phénomène pour le cas des mélanges avec le Mg
stéarate et le PVP.
On remarque aussi un phénomène endothermique
relatif à la fusion du Mg stéarate qui a lieu aux alentours de
110°C [20].
Pour le cas du mélange avec le PVP, le principe actif
présente la température de fusion la plus faible. Etant un
polymère, cet excipient à l'état pur fond dans un
intervalle de 100 à 150 °C (masse molaire moléculaire de
40.000 à 60.000 g.mol-1)
2012-2013 52
INSAT Chapitre III : Résultats et
discussion
2012-2013 53
Tableau 10 : Données issues des courbes
DSC de l'acébutol et ses mélanges binaires
sans l'application
de conditions de stress
|
Echantillon
|
ÄfH (kJ/kg)
|
Ton set (°C)
|
|
Aceb (principe actif)
|
112,7
|
140,1
|
|
Aceb + lactose monohydrate
|
96,9
|
138,4
|
|
Aceb + Mg stéarate
|
59,5
|
139,00
|
|
Aceb + Povidone
|
44,2
|
138,3
|
Il est intéressant de mentionner que l'énergie
de fusion des mélanges binaires est moins importante que celle de
l'acébutolol seul. Cette grandeur est normalement proportionnelle
à la quantité des principes actifs dans les prises d'essais
analysées. Puisque les mélanges sont préparés 50:50
on s'attend théoriquement à une énergie de fusion
égale à la moitié de celle du principe actif à
l'état pur (tableau (11)). Toute variation pourrait signifier la
présence d'interaction principe actif-excipient.
Tableau 11 : Comparaison des enthalpies de
fusion théoriques et expérimentales des
mélanges
binaires préparés avec l'acébutlol
|
Mélange binaire
|
Prise d'essais (%)
|
ÄfH théor (kJ/kg)
|
ÄfH exp (kJ/kg)
|
|
Aceb + lactose monohydrate
|
51,8
|
58 ,4
|
96,9
|
|
Aceb + Mg stéarate
|
51
|
57 ,5
|
59,5
|
|
Aceb + Povidone
|
49,9
|
56,2
|
44,2
|
Pour le mélange avec le lactose monohydrate, il est
à noter que la déshydratation de ce dernier se produit à
140°C [31]. Un chevauchement avec la fusion de l'acébutolol ait
lieu. En conséquence, l'enthalpie mesurée est relativement
importante.
Après la fusion du Mg stéarate et le PVP au sein
des mélanges à une température de fusion inférieure
à celle du principe actif, les granules de ce dernier se trouvent
entourées par des films d'excipient à l'état liquide ; le
processus relatif au transfert de
INSAT Chapitre III : Résultats et
discussion
2012-2013 54
chaleur n'est plus le même ce qui peut expliquer
l'allure du pic ainsi que la valeur de l'énergie mise en jeu.
Pour cette série de mélanges binaires, la fusion
du principe actif est soit précédée par celle d'un
excipient, soit chevauché à un phénomène
endothermique relatif à ce dernier (fusion ou déshydratation).
Ainsi, la variation de la température de début de fusion et de
l'énergie mise en jeu ne peut pas être considérée
significative d'interaction.
Les thermogrammes en trait discontinu (figure 19) montrent le
comportement des mélanges binaires et du principe actif seul
après leur séjour dans la chambre de vieillissement
accéléré.
Les résultats obtenus suite aux analyses des
échantillons sont résumés dans le tableau (12).
Tableau 12 : Données issues des courbes
DSC de l'acébutol et ses mélanges binaires
sous conditions de
stress
|
Echantillon
|
ÄfH (kJ/kg)
|
Ton set (°C)
|
|
Aceb (principe actif) CS
|
114
|
141,0
|
|
Aceb + Lactose monohydrate CS
|
105,8
|
138,7
|
|
Aceb + Mg stéarate CS
|
67,9
|
140,4
|
|
Aceb + Povidone CS
|
8,5
|
123,3
|
On constate que les énergies de fusion augmentent sauf
pour le povidone où le pic devient très large. En effet, ce
principe actif est très hygroscopique ; l'aspect de ce mélange
binaire s'est transformé d'une poudre jaunâtre à un
agglomérat brun.
On remarque aussi que le pic relatif au départ d'eau
devient plus prononcé pour le lactose monohydrate.
L'augmentation de l'enthalpie et de la température du
début de fusion du principe actif seul mène à la remise en
question de la stabilité du principe actif seul sous ces conditions.
INSAT Chapitre III : Résultats et
discussion
II.1.2. Etude thermique des mélanges binaires avec le
bétaxolol
La figure (figure 20) présente les courbes DSC du
bétaxolol et les mélanges binaires avant et après leurs
mises sous conditions de stress. Les résultats obtenus sont
présentés dans le tableau (13).
La température du début de fusion diminue
légèrement sauf pour le cas du mélange avec le Mg
stéarate, la fusion de ce dernier n'apparait pas comme prévue
à 110°C.
En effet, on peut expliquer ce décalage par le fait que la
fusion de cet excipient a eu lieu à une température
supérieure ; ce phénomène se trouve donc superposé
à la fusion du principe actif qui se fait à des
températures inférieures dans les mélanges.
On note aussi que la déshydratation du lactose est
observée à 127°C au lieu de 140°C.
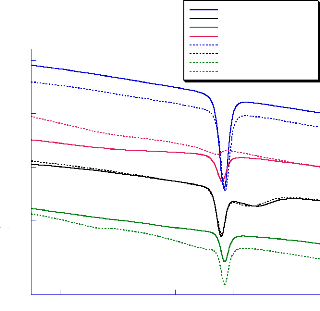
Beta
Beta lactose monohydrate
Beta Mg stéarate
Beta PVP
Beta CS
Beta lactose monohydrate CS
Beta Mg stéarate CS
Beta PVP CS
0
-5
-20
60 80 100 120 140
Flux de chaleur (mW)
-10
-15
Température (°C)
Fig- 20 : Courbes DSC de l'acébutol et
ses mélanges binaires avec le lactose monohydrate, le Mg stéarate
et le PVP avant et après conditions de stress
2012-2013 55
INSAT Chapitre III : Résultats et
discussion
2012-2013 56
Les résultats relatifs aux événements
thermiques sont présentés dans le tableau (13).
Tableau 13 : Donnés issues des courbes
DSC du bétaxolol et ses mélanges binaires
sans conditions de
stress
|
Echantillon
|
AfH (J/g)
|
Ton set (°C)
|
|
Beta (principe actif)
|
104,3
|
113,7
|
|
Beta + lactose monohydrate
|
47,1
|
112,8
|
|
Beta + Mg stéarate
|
37,2
|
114,2
|
|
Beta + Povidone
|
31,9
|
112,2
|
Comme le cas des mélanges avec l'acébutolol, une
estimation de l'enthalpie de fusion théorique est réalisée
pour les échantillons à base de bétaxolol (tableau
(14)).
Tableau 14 : Comparaison des enthalpies de
fusion théoriques et expérimentales des
mélanges
binaires préparés avec le bétaxolol
|
Mélange binaire
|
Prise d'essais (%)
|
AfH théor (J/g)
|
AfH exp (J/g)
|
|
Béta + lactose monohydrate
|
50,2
|
52,4
|
47,1
|
|
Béta + Mg stéarate
|
50,2
|
52,4
|
26,2
|
|
Béta + Povidone
|
49,5
|
51,6
|
31,9
|
Une diminution importante des enthalpies de fusion est
notée pour les différents mélanges.
Pour le mélange préparé avec le Mg
stéarate et le PVP, l'hypothèse de superposition de la fusion de
l'excipient et le bétaxolol n'est plus valable. En effet, un tel
phénomène provoque théoriquement l'augmentation de
l'enthalpie. Or, pour ces deux échantillons cette dernière est
réduite à moitié pour le Mg stéarate et à
environ 40% pour le PVP.
Concernant le lactose monohydrate, l'énergie est
comparable à la valeur théorique.
En examinant les thermogrammes des mélanges binaires
mis sous conditions de stress, on remarque que l'enthalpie et la
température de début de fusion ontlégèrement
varié à l'exception de l'échantillon préparé
avec le povidone (Tableau (15)).
INSAT Chapitre III : Résultats et
discussion
2012-2013 57
Tableau 15 : Données issues des courbes
DSC du bétaxolol et ses mélanges binaires
sous conditions de
stress
|
Echantillon
|
ÄfH (J/g)
|
Ton set (°C)
|
|
Beta (principe actif) SC
|
95,6
|
114,1
|
|
Beta + lactose monohydrate SC
|
44,3
|
112,9
|
|
Beta + Mg stéarate SC
|
40,9
|
114,3
|
|
Beta + Povidone SC
|
12,4
|
109,0
|
Le PVP a subi le même changement d'aspect que celui avec
l'acebutolol. De plus son enthalpie de fusion a diminué
considérablement par rapport à celle de l'échantillon
analysé juste après sa préparation.
Pour résumer, à partir de ces expériences on
constate que :
? les mélanges avec le PVP présentent plus de
décalage de point de vue énergie et température ;
? la température de début de fusion augmente
ainsi que l'énergie relative à la déshydratation
d'excipient pour la majorité des échantillons mis sous conditions
de stress.
Il est probable qu'une fois exposés à
l'humidité, une quantité importante d'eau se trouve à la
surface de ses particules pouvant former des liaisons hydrogènes avec
les fonctions alcools des principes actifs. Ainsi la fusion demanderait plus
d'énergie pour avoir lieu.
Les écarts de température sont inférieurs
à 10°C pour tous les mélanges étudiés. La
variation des températures de fusions peut être expliquée
par la thermochimie. Par contre les mécanismes mis en jeu restent
ambiguë pour plusieurs cas.
En revanche les variations des énergies de fusions
peuvent être considérées comme étant des
éléments de réponse révélant une interaction
entre les principes actifs et les excipients.
Concernant le PVP, il est intéressant de mentionner que
sa synthèse nécessite l'utilisation du peroxyde
d'hydrogène comme initiateur de polymérisation radicalaire.
L'excipient commercialisé renferme toujours des traces de l'initiateur
pouvant provoquer l'oxydation des principes actifs.
INSAT Chapitre III : Résultats et
discussion
2012-2013 58
Il s'avère alors nécessaire de vérifier la
possibilité d'incompatibilité chimique avec le PVP dans le cas
où il est ajouté à des quantités plus au moins
importantes dans la formulation pharmaceutique [20].
II.2. Etude des mélanges binaires avec les
excipients antioxydants
Le bétaxolol mélangé avec le BHA se
transforme de l'état solide à l'état liquide, par
conséquent on n'a pas pu suivre ni le comportement thermique du principe
actif ni sa structure cristalline.
II.2.1. Etude des DSC des mélanges binaires
La figure présente le comportement thermique de
l'acébutolol et du bétaxolol en présence des trois
excipients : l'acide ascorbique, l'acide citrique et le BH (figure 21).
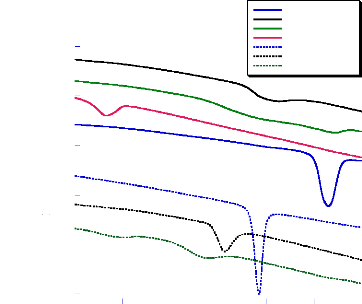
Aceb
Aceb acide ascorbique Aceb acide citrique Aceb BHA
Beta
Beta acide ascorbique Beta acide citrique
.
Flux de chaleur (mW)
-10
-15
0
-5
-20
-25
40 60 80 100 120 140 160
Température (°C)
Fig- 21 : Courbes DSC de l'acébutolol,
du bétaxolol et leurs mélanges binaires
avec l'acide
ascorbique, l'acide citrique et le BHA
INSAT Chapitre III : Résultats et
discussion
2012-2013 59
INSAT Chapitre III : Résultats et
discussion
Tableau 16 : Données issues des courbes
DSC de l'acébutolol et ses mélanges
binaires avec l'acide
ascorbique, l'acide citrique et le BHA
|
Echantillon
|
ÄfH (J/g)
|
Ton set (°C)
|
|
Aceb (principe actif)
|
114
|
141
|
|
Aceb + acide ascorbique
|
41,1
|
112
|
|
Aceb + acide citrique
|
13,4
|
135
|
Les données issues des thermogrammes sont
présentées dans le tableau (16).
On constate que les décalages de température du
début de fusion est très importants avec des pics endothermiques
larges pour les deux acides.
Le pic relatif à la fusion de l'acide citrique
(théoriquement à 153°C) n'a pas apparu entre 60-160 °C
; il est probable qu'elle soit chevauchée à celle du principe
actif.
Pour le cas du mélange avec l'acide ascorbique, seule
la fusion du principe actif figure au niveau de la courbe DSC puisque
l'excipient seul fond à 190°C.
Par contre, le thermogramme du mélange avec le BHA ne
présente qu'un seul phénomène endothermique
attribué à la fusion de l'excipient aux alentours de
45°C.
Pareil au mélange acébutolol-Mg stéarate,
le BHA, se trouvant à l'état liquide, peut solubiliser totalement
ou partiellement le principe actif ce qui provoque la disparition de son pic de
fusion.
Concernant les mélanges avec le bétaxolol, on
note l'apparition d'un pic endothermique large au niveau de la courbe DSC de
l'échantillon renfermant l'acide citrique : il s'agit d'une
évaporation de molécules d'eau au voisinage de 55°C, et le
pic correspondant à sa fusion ne figure pas entre 100-160°C
(tableau (17)).
La transition solide-liquide du principe actif se fait aux
alentours de 95°C. Ainsi le phénomène observé peut
être attribué soit à la fusion simultanée des deux
composants, soit il est relatif à la formation d'un autre
composé.
L'acide ascorbique semble avoir plus d'interaction avec
l'acébutolol qu'avec le bétaxolol.
2012-2013 60
En effet, un tel décalage de température de
fusion (largement supérieur à 10°C) et de l'énergie
relative à ce phénomène (très inférieures
à celle des principes actifs seuls) est souvent interprété
comme une incompatibilité chimique [32].
Tableau 17 : Données issues des courbes
DSC du bétaxolol et ses mélanges binaires
avec l'acide
ascorbique et l'acide citrique
|
Echantillon
|
ÄfH (J/g)
|
Ton set (°C)
|
|
Beta (principe actif)
|
104,261
|
113,652
|
|
Beta + acide ascorbique
|
62,3
|
97,4
|
|
Beta + acide citrique
|
51,2
|
83,2
|
Pour récapituler, il est évident que la DSC est
une technique rapide et fiable pour étudier la compatibilité au
sein des formulations pharmaceutiques solides.
Généralement, la modification de la forme d'un
pic (aspect cinétique ou/et énergétique) ou de son
emplacement impliquent automatiquement la présence d'une interaction
physique et/ou chimique.
Par ailleurs, il est indispensable de vérifier qu'aucun
mélange binaire principe actif-excipient étudié ne
coïncide avec la composition d'eutectique (changement de la nature
physique du mélange).
C'est un cas particulier de mélange solide où
les deux constituants se comportent comme un corps pur de point de vue
température de fusion (fusion et solidification à
température et composition constantes). Cette dernière a lieu
dans ce cas à des températures inférieures que celles des
deux constituant à l'état pur.
Les excipients subissant une transition solide-liquide avant
celle du principe actif - c'est le cas de Mg stéarate et le BHA-
provoquent une disparition par effet de la solubilisation de ce dernier et non
pas sa dégradation [32].
Tandis que ce phénomène peut parfois provoquer
une interaction chimique comme le cas de l'acide acétylsalicylique et le
Mg stéarate. En effet la formation de film d'excipient autour des
particules du principe actif favorise sa réaction de
décomposition [20].
INSAT Chapitre III : Résultats et
discussion
2012-2013 61
Pour le PVP, le processus est différent ; celui-ci peut
augmenter la réactivité de la substance thérapeutique
à cause de son caractère hygroscopique.
En effet, les molécules d'eau libres peuvent contribuer
à sa dégradation en modifiant le pH du microenvironnement.
Pour mieux comprendre la nature des interactions principe
actif-excipient, des mélanges binaires ont été
examinés par d'autres techniques (DRX, et dosage par HPLC). Les
mélanges dont les thermmogrammes ont présenté le plus de
décalage par rapport au principe actif pur ont été choisis
pour la suite de l'étude.
II.2.2. Analyse DRX des mélanges binaires
Afin de mieux comprendre les types d'interaction au niveau des
thermogrammes qui ont présenté une enthalpie très basse
par rapport à celle du principe actif, on a décidé d'avoir
recours à d'autres techniques comme la DRX et l'infrarouge.
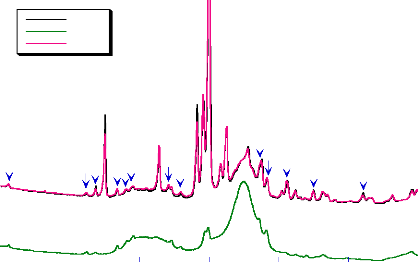
Les diffractogrammes des mélanges binaires avec l'acide
ascorbique, l'acide citrique et le BHA sont présentés dans les
figures (figure 22 et figure 23).
La structure des principes actifs dans ces mélanges n'a
pas été modifiée. Les diffractogrammes montrent que leurs
cristallinités sont conservées avec l'apparition d'autres pics
correspondant aux excipients (Annexe 2).
Il est important de souligner que l'abaissement
systématique des pics
caractéristiques des principes actifs est simplement
dû à la diminution de leurs proportions dans les mélanges
(50% au lieu de 100% pour le produit pur).
L'évaluation de la cristallinité des
mélanges binaires préparés par rapport à celle du
principe actif seul est déterminée par la comparaison de la
largeur à mi-hauteur des différents pics.
On remarque que la cristallinité des deux principes
actifs diminue légèrement, surtout pour les mélanges avec
l'acébutolol.
INSAT Chapitre III : Résultats et
discussion

Aceb
Aceb acide citrique Aceb acide ascorbique Aceb BHA
*: Pic relatif à l'excipient
*
*
*
1,6 105
1,4 105
1,2 105
Intensité
1 105
8 104
6 104
4 104
2 104
0
2012-2013 62
6 7 8 9 10
20 (°)
Fig- 22 : Diffractogrammes des rayons X de
l'acébutolol et ses mélanges binaires
avec l'acide ascorbique,
l'acide citrique et le BHA

B eta
B eta acide citrique
B eta acide ascorbique
1,6 10 5
: Pic re latif à l'excipient
*
1,2 10 5
*
8 10 4
4 10 4
0
Intensité
9,5 10 10,5 11 11,5 12 12,5 13
20 (°)
Fig- 23 : Diffractogrammes des rayons X du
bétaxolol et ses mélanges binaires avec
l'acide ascorbique,
l'acide citrique et le BHA
L'étude par spectroscopie IR s'avère
indispensable dans le but d'évaluer la possibilité d'interaction
chimique.
INSAT Chapitre III : Résultats et
discussion
2012-2013 63
II.2.3. Analyse IR des mélanges binaires
L'analyse du spectre infrarouge a permis de déterminer les
bandes caractérisantes la structure chimique des substances
thérapeutiques.
Les tableaux ci-dessous présentent l'attribution des
bandes de vibration observées aux groupements fonctionnels des deux
molécules.
Tableau 18 : Les bandes de vibrations
caractéristiques de l'acébutolol chlorhydrate
|
Principe actif
|
Nombre d'onde (cm-1)
|
Nature de la vibration
|
|
Acébutolol
|
3273
|
N-H (amine secondaire)
|
|
2963-2840
|
C-H (alcane)
|
|
1661
|
C=O (cétone)
|
|
1596
|
C=O (amide)
|
|
1524
|
C-C (aromatique)
|
|
1097
|
C-O (éther)
|
|
1275-1228
|
O-H (alcool secondaire)
|
|
1242
|
C-N
|
Tableau 19 : Les bandes de vibrations
caractéristiques du bétaxolol chlorydrate
|
Principe actif
|
Nombre d'onde (cm-1)
|
Nature de la vibration
|
|
Bétaxolol
|
3234
|
N-H (amine secondaire)
|
|
2963-2840
|
C-H (alcane)
|
|
1606-1469
|
C-C (aromatique)
|
|
1244
|
C-O (éther)
|
|
1300
|
O-H (alcool secondaire)
|
|
1090
|
C-N
|
INSAT Chapitre III : Résultats et
discussion
2012-2013 64
En examinant les spectres JR (figure 24), on constate qu'une
nouvelle bande est apparue à 3400 cm-1 pour les trois
mélanges probablement relative à l'élongation des O-H
associés par des liaisons hydrogène ; elle est plus
prononcée pour le cas du mélange avec le BHA.
De plus, la bande correspondante à la liaison C=O de
l'amide devient plus large que celle du principe actif seul et se décale
vers des longueurs d'onde plus faibles pour les mélanges avec les deux
acides (figure 25).
On peut confirmer qu'il s'agit dans ce cas d'un
décalage et non pas d'une disparition totale du signal grâce
à la présence de la bande caractéristique de la liaison
C-N de l'amide dans le spectre de ces deux excipients.
On note les mêmes observations pour les oscillateurs
carbonyles (C=O) de l'acétone et de l'ester.
Un élargissement des bandes caractéristiques de
l'amine secondaire (N-H) et de l'alcool (O-H) est aussi remarqué.

N-H amine
Transmission (%)
*
*
*
*
*
*
*
*
*
* *
3800 3600 3400 3200 3000 2800 2600 2400 2200
Aceb
Aceb acide citrique Aceb acide ascorbique Aceb BHA
Nombre d'onde (cm-1)
Fig- 24 : Spedtre JR de l'acébutolol et
ses mélanges binaires avec l'acide
ascorbique, l'acide citrique et le
BHA (3800-2000 cm-1)
INSAT Chapitre III : Résultats et
discussion
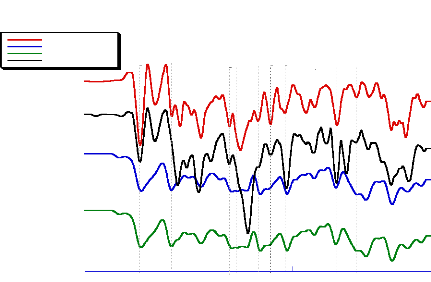
1500
1000
500
déformation N-H (amine)
O-H (alcool secondaire)
déformation N-H (amide)
C=O (amide)
C=O (cétone)
C-N (amide)
C=O (ether)
C-N
Transmission (%)
*
*
*
*
*
*
*
*
*
*
*
*
*
*
*
*
*
A ceb
A ceb acide citrique
A ceb acide ascorbique A ceb BH A
Nombre d'onde (cm-1)
Fig- 25 : Spectres JR de l'acébutolol
et ses mélanges binaires avec l'acide ascorbique,
l'acide citrique et
le BHA (2000-400 cm-1)
Comme l'acébutolol, la bande N-H du bétaxolol s'est
élargie surtout pour le cas du mélange avec l'acide citrique
(figure 26).
Cependant, la même bande est chevauchée avec celle
des groupements O-H associées avec des liaisons hydrogène pour le
mélange avec le BHA (figure 26).
Les spectres montrent que les bandes O-H obtenues par l'alcool
subissent aussi un élargissement (figure 27).
2012-2013 65
INSAT Chapitre III : Résultats et
discussion
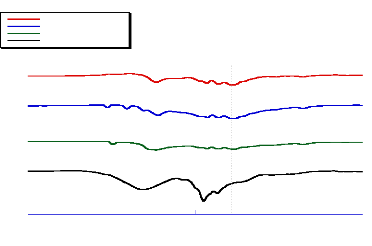
*
*
B eta
B eta acide ascorbique Beta acide citrique Beta BHA
4 0 0 0
3 5 0 0
3 0 0 0
2 5 0 0
2 0 0 0
*
* *
N ombre d 'o n d e (c m-1)
Transmission (%)
N-H amine (secondaire)
Fig- 26 : Spectres JR de bétaxolol et ses
mélanges binaires avec l'acide ascorbique, l'acide citrique et le BHA
(4000-2000 cm-1)
B eta
Beta acide ascorbique B eta acide citrique Beta B H A
|
C-C (aromatique)
|
O-H (alcool secondaire)
|
C-O (ether)
|
C-N
|
déformation N-H (amine)
|
1 8 0 0 1 6 0 0 1 4 0 0 1 2 0 0 1 0 0 0 8 0 0 6 0 0
N ombre d'onde ( c m- 1 )
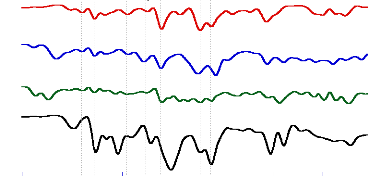
Transmission (%)
*
*
*
*
*
*
*
*
*
*
*
*
*
*
*
*
*
Fig- 27 : Spectres JR de bétaxolol et ses
mélanges binaires avec l'acide ascorbique, l'acide citrique et le BHA
(1500-600 cm-1)
2012-2013 66
INSAT Chapitre III : Résultats et
discussion
2012-2013 67
Après avoir attribué les bandes des oscillateurs
caractéristiques des différents échantillons, on n'a pu
constater des changements au niveau des spectres des mélanges par
rapport à ceux des principes actifs seuls.
En effet, les interactions non covalentes, comme les liaisons
hydrogènes, provoquent généralement un décalage des
signaux caractéristiques et un élargissement de bande des
groupements fonctionnels [33].
Il est probable que les groupements carboxyles de
l'acébutolol peuvent former des liaisons hydrogène avec les
fonctions alcools des trois excipients des mélanges examinés.
L'analyse qualitative des mélanges par IR ne suffit pas
pour s'assurer qu'aucune interaction covalente n'a eu lieu entre les principes
actifs et les excipients (impliquant la disparition ou l'apparition d'une ou
plusieurs bandes).
En effet, la réaction peut se produire avec un taux
d'avancement faible (systèmes solide-solide). Une comparaison des aires
des bandes observées d'un tel système à deux constituants
organiques semble être compliquée.
On peut avoir recours à une autre technique plus simple
: HPLC qui assure la séparation puis la quantification des
différentes substances existantes dans un mélange. Ainsi
l'apparition de tout nouveau produit sera détectée.
INSAT Conclusion et perspectives
2012-2013 68
| 


