Année Universitaire : 2012/2013
|
Ministère de l'Enseignement Supérieur
et de la
Recherche Scientifique
*** * ***
Université de Carthage
*** *
***
Institut National des Sciences
Appliquées et de
Technologie
|
|
Projet de Fin d'Etudes
Pour l'obtention
du
Diplôme National d'Ingénieur
en
Sciences Appliquées et en Technologie
Filière : Chimie Industrielle
Sujet :
Etude des interactions physicochimiques des
bétabloquants avec les excipients
Réalisé par : Wiem
DAHMEN
Etablissements d'accueil :
Laboratoire National de Contrôle des Médicaments
(LNCM)
Institut National de Recherche et d'Analyses physicochimiques
(INRAP)
Soutenu le 18/06/2013
|
Président de Jury : Examinateur :
Encadrant Universitaire : Encadrants Etablissement d'accueil :
|
Mr. Taieb SAIED
Mme Salma MOALLA
Mme Latifa BERGAOUI
Mr. Radhouen LOUHICHI (LNCM)
Mr. Haykel GALAI (INRAP)
|
Dédicaces
**************************
A ma chère
mère,
Tu représentes pour moi le symbole de la
bonté par excellence, la source de tendresse et l'exemple du
dévouement qui n'a pas cessé de m'encourager. Ta prière et
ta bénédiction m'ont été d'un grand secours pour
mener à bien mes études.
A mon cher père,
L'épaule solide, l'oeil attentif
compréhensif et la personne la plus digne de mon estime et de mon
respect. Tout ce que je peux t'offrir ne pourra exprimer l'amour et la
reconnaissance que je te porte. Que Dieu te préserve et te procure
santé et longue vie.
A ma chère tante,
Aucune dédicace ne saurait être assez
éloquente pour exprimer ce que tu mérites pour tous les
sacrifices que tu n'as cessé de me donner depuis ma naissance. Je te
dédie ce travail en témoignage de mon profond amour.
A la mémoire de ma chère
grand-mère maternelle Ferha,
Pour ton amour et ta sollicitude à mon égard
qui me marqueront à jamais. Tu as été toujours dans mon
esprit et dans mon coeur, je te dédie aujourd'hui ma réussite.
Ton souvenir reste à jamais gravé dans ma mémoire.
Que Dieu, le miséricordieux, vous accueille dans son
éternel paradis. A mes chers oncles,
Vous avez toujours été présents pour
les bons conseils. Votre affection et votre soutien m'ont été
toujours d'un grand secours.
Veuillez trouver dans ce modeste travail ma reconnaissance
pour tous vos efforts. A mon cher frère Oussema et mes deux
adorables petites soeurs Wijden et Alaa, A mes chers cousins
et cousines,
Meilleurs voeux de succès dans vos
études.
A tous mes amis et mes collègues
pour leurs encouragements et leur soutien.
Remerciements
En préambule à ce travail, je souhaiterais
adresser tous mes remerciements aux personnes qui ont contribué à
l'élaboration de ce rapport de projet de fin d'études.
Je voudrais remercier, tout d'abord, Monsieur Mohamed
Hédi LOUESLETI, le directeur général du
Laboratoire National de Contrôle des Médicaments (LNCM) et
Madame Najwa KAMMOUN, la directrice de l'Institut National de
Recherche et d'Analyses Physicochimiques (INRAP) qui ont bien voulu m'accepter
au sein de leurs établissements et pour m'avoir offert
l'opportunité de passer ce stage de fin d'études dans des
meilleures conditions.
Mes vifs remerciements s'adressent à mes encadreurs
:
- A mon Professeur Madame Latifa BERGAOUI
pour sa disponibilité, la justesse de ses critiques qui a
été très constructive et utile et surtout pour ses
encouragements continus. Son amabilité et sa gentillesse méritent
toute admiration.
- A Monsieur Radhouen LOUHICHI, le directeur
du département d'analyse physicochimique de LNCM, pour m'avoir fait
confiance et accepter de m'encadrer durant ce stage. Il m'a toujours
réservé le meilleur accueil, malgré ses obligations
professionnelles. Je tiens à lui exprimer ma profonde gratitude pour ses
précieux conseils.
- A Monsieur Haykel GALAI, Maitre-assistant
à l'INRAP. Ses conseils et remarques, toujours pertinents, m'ont permis
de confronter et ajuster mon étude à des problématiques
pratiques et réelles. Sincèrement, grâce à lui j'ai
pu valoriser mon travail en me mettant en relation avec plusieurs
spécialistes.
Je tiens à exprimer mes remerciements aux membres du
jury : Monsieur Taib SAIED et Madame Salma
MOALLA, qui m'ont fait l'honneur d'avoir accepté
d'évaluer ce travail.
Je saisis cette occasion pour exprimer ma profonde gratitude
à Monsieur Rafik KALFAT, le responsable du Laboratoire
de la Maîtrise des Techniques d'Analyses à l'INRAP, pour m'avoir
accueilli dans son laboratoire et surtout pour l'intérêt qu'il a
toujours porté à mon travail.
Ma gratitude va également à Monsieur
Imed HASSEN, Maitre-assistant à l'INRAP, pour ses
précieux conseils et les nombreux services qu'il m'a rendus.
Je remercie aussi Madame Mouna GHALI,
ingénieur à l'INRAP, pour sa disponibilité et son aide.
Je tiens à remercier tout le personnel de LNCM et
l'INRAP qui m'a facilité la tâche en me permettant de travailler
dans un cadre particulièrement agréable et en m'assurant la
disponibilité des équipements nécessaires pour la
réalisation de ce travail.
INSAT Sommaire
2012-2013
INSAT Sommaire
Sommaire
Introduction 11
Chapitre I : Etude bibliographique 12
I. Notions sur les médicaments 12
I.1. Généralités 13
I.1.1. Définitions et compositions 13
I.1.2. Notions des génériques 13
I.1.3. Formes galéniques des médicaments 14
I.2. Formes orales solides : Les comprimés 15
I.2.1. Définition 15
I.2.2. Types de comprimés 15
I.2.3. Avantages 16
I.2.4 Processus de fabrication 16
I.3 Excipients 18
I.3.1 Rôles d'excipients dans les formes solides 18
I.3.2 Classification 19
II Interactions physico-chimiques principe actif-excipients 21
II.1 Définition de la notion d'interaction 21
II.2 Méthodes d'étude d'interactions principe
actif-excipients 21
II.3 Types d'interactions principe actif-excipients 22
II.4 Incompatibilités physicochimiques principe actif-
excipients 22
II.4.1 Incompatibilités chimiques 22
II.4.2 Incompatibilités physiques 25
II.5 Cas d'incompatibilités présentées par
les bétabloquants 25
III Phénomènes de polymorphisme dans les
médicaments 26
III.1 Principe actif : état cristallin et polymorphisme
26
2012-2013
III.2 Facteurs provoquant le polymorphisme 26
III.3 Conséquences du polymorphisme 27
III.3.1 Répercussion sur la biodisponibilité et sur
le profil de dissolution 27
III.3.2 Effets sur les propriétés physicochimiques
27
IV Principes actifs étudiés 28
IV.1 Choix des principes actifs 28
IV.2 Classe thérapeutique 28
IV.3 Propriétés physicochimiques et
pharmacologiques 29
Chapitre II : Matériels et méthodes 31
I Produits finis et mélanges binaires
préparés 31
II.1 Produits finis 32
II.2 Mélanges binaires principes actifs-excipients 33
II.3 Préparations des échantillons à
analyser 34
II. Techniques de caractérisation physicochimique 35
II.1. Spectroscopie d'absorption infra-rouge à
transformée de Fourier et à réflexion
totale atténuée (FT-IR ATR) 35
II.2. La calorimétrie différentielle à
balayage 35
III.3. La diffraction des rayons X (DRX) 37
Chapitre III : Résultats et discussion 38
I Caractérisation de produits finis 38
I.1 Analyse par diffraction des rayons X 39
I.1.1. Produits finis à base d'acébutolol 39
I.1.2. Produits finis à base de bétaxolol 42
I.1.3. Produits finis à base de carvédilol 43
I.2 Calorimétrie différentielle à balayage
(DSC) 44
II Etude du comportement thermique et cristallin des principes
actifs au sein des
mélanges binaires 51
INSAT Sommaire
II.1 Etude des DSC de mélanges binaires avec des
excipients existants dans la
formulation des produits finis 51
II.1.1 Etude thermique des mélanges binaires avec
l'acébutolol 51
II.1.2 Etude thermique des mélanges binaires avec le
bétaxolol 55
II.2 Etude des mélanges binaires avec les excipients
antioxydants 58
II.2.1 Etude des DSC des mélanges binaires 58
II.2.2 Analyse DRX des mélanges binaires 61
II.2.3 Analyse IR des mélanges binaires 63
Conclusion et perspectives 68
Références bibliographiques 70
Netographie 72
2012-2013
INSAT Liste des tableaux
2012-2013
Liste des tableaux
Tableau 1 : Propriétés physicochimiques des
principes actifs étudiés 30
Tableau 2 : Dosage des produits finis analysés 32
Tableau 3 : Composition des produits finis à base
d'acébutolol 32
Tableau 4 : Composition des produits finis à base de
bétaxolol 33
Tableau 5 : Composition des produits finis à base de
carvédilol 33
Tableau 6 : Origines et propriétés physicochimiques
des excipients utilisés pour la
préparation des mélanges binaires 34
Tableau 7 :
Données issues des courbes DSC de l'acébutolol et ses produits
finis 46
Tableau 8 : Données issues des courbes DSC de
bétaxolol et ses produits finis 48
Tableau 9 : Données issues des courbes DSC de
carvédilol et ses produits finis 50
Tableau 10 : Données issues des courbes DSC de
l'acébutol et ses mélanges binaires
sans l'application de conditions de stress 53
Tableau 11 :
Comparaison des enthalpies de fusion théoriques et expérimentales
des
mélanges binaires préparés avec
l'acébutlol 53
Tableau 12 : Données issues des courbes DSC de
l'acébutol et ses mélanges binaires
sous conditions de stress 54
Tableau 13 : Donnés issues
des courbes DSC du bétaxolol et ses mélanges binaires
sans conditions de stress 56
Tableau 14 : Comparaison des
enthalpies de fusion théoriques et expérimentales des
mélanges binaires préparés avec le
bétaxolol 56
Tableau 15 : Données issues des courbes DSC du
bétaxolol et ses mélanges binaires
sous conditions de stress 57
Tableau 16 : Données
issues des courbes DSC de l'acébutolol et ses mélanges
binaires avec l'acide ascorbique, l'acide citrique et le BHA
59
Tableau 17 : Données issues des courbes DSC du bétaxolol et
ses mélanges binaires
avec l'acide ascorbique et l'acide citrique 60
Tableau 18 :
Les bandes de vibrations caractéristiques de l'acébutolol
chlorhydrate 63
Tableau 19 : Les bandes de vibrations caractéristiques du
bétaxolol chlorydrate 63
INSAT Liste des figures
2012-2013
Listes des figures
Fig- 1 : Les formes galéniques et leurs
voies d'administration 14
Fig- 2 :Processus de fabrication des
comprimés 17
Fig- 3 : Réaction de Maillard entre
l'amine primaire d'un principe actif et le lactose 24
Fig- 4 : Les différentes classes des
antagonistes des récepteurs adrénergiques 28
Fig- 5 : Détermination des données
issues des thermogrammes par le logiciel 36
Fig- 6 : Diffractogramme des rayons X de
l'acébutolol 39
Fig- 7 : Diffractogrammes des produits finis
à base d'acébutolol 40
Fig- 8 : Diffractogrammes des excipients
employés dans la formulation des produits
finis 41
Fig- 9 : Le diffractogramme des rayons X du
bétaxolol 42
Fig- 10 : Diffractogramme des rayons X des
produits finis à base de bétaxolol 42
Fig- 11 : Diffractogramme des rayons X du
carvédilol 43
Fig- 12 : Diffractogrammes des rayons X des
produits finis à base du carvédilol 43
Fig- 13 : Courbes DSC de l'acébutolol
45
Fig- 14 :Comparaison des courbes DSC de
l'acébutolol et ses produits finis 46
Fig- 15 : Courbes DSC du bétaxolol 47
Fig- 16 : Comparaison des courbes DSC du
bétaxolol et ses produits finis 48
Fig- 17 : Courbe DSC du carvédilol 49
Fig- 18 : Comparaison des courbes DSC du
carvédilol et ses produits finis 50
Fig- 19 : Courbes DSC de l'acébutolol et
ses mélanges binaires avec le lactose monohydrate, le Mg stéarate
et le PVP avant et après conditions de stress (CS) 52 Fig- 20
: Courbes DSC de l'acébutol et ses mélanges binaires
avec le lactose
monohydrate, le Mg stéarate et le PVP avant et
après conditions de stress 55
Fig- 21 : Courbes DSC
de l'acébutolol, du bétaxolol et leurs mélanges binaires
avec
l'acide ascorbique, l'acide citrique et le BHA 58
Fig-
22 : Diffractogrammes des rayons X de l'acébutolol et ses
mélanges binaires
avec l'acide ascorbique, l'acide citrique et le BHA
62
Fig- 23 : Diffractogrammes des rayons X du
bétaxolol et ses mélanges binaires avec
l'acide ascorbique, l'acide citrique et le BHA 62
Fig-
24 : Diffractogrammes des rayons X du bétaxolol et ses
mélanges binaires avec
l'acide ascorbique, l'acide citrique et le BHA(3800-2000
cm-1) 64
INSAT Liste des figures
2012-2013
Fig- 25 : Spectres JR de l'acébutolol et
ses mélanges binaires avec l'acide ascorbique,
l'acide citrique et le BHA (2000-400 cm-1)
65
Fig- 26 : Spectres JR de bétaxolol et ses
mélanges binaires avec l'acide ascorbique,
l'acide citrique et le BHA (4000-2000 cm-1)
66
Fig- 27 : Spectres JR de bétaxolol et ses
mélanges binaires avec l'acide ascorbique,
l'acide citrique et le BHA (1500-600 cm-1) 66
INSAT Introduction
2012-2013 11
Introduction
L'industrie des médicaments est l'une des branches
économiques dont l'effort de recherche est le plus important. Par
ailleurs, le principal volet de la stratégie tunisienne est de continuer
à accroître la production locale pour réduire la facture
d'importation, surtout par la promotion des médicaments
génériques. Toute nouvelle formulation est
généralement soumise à des études pour garantir une
stabilité et une biodisponibilité identique à celle du
princeps.
Des interactions physico-chimiques, entre les
différents ingrédients d'une formulation thérapeutique,
peuvent affecter significativement les caractéristiques principales des
médicaments à savoir leur efficacité et leur
stabilité. L'étude de la stabilité ne se limite pas
seulement à l'étape de la préformulation mais elle doit
être assurée tout au long du stockage du médicament, au
moyen de différentes techniques d'analyses.
L'objectif de ce travail consiste à étudier la
stabilité de quelques bétabloquants commercialisés en
Tunisie (l'acébutolol, le bétaxolol et le carvédilol),
tout en vérifiant la compatibilité entre les principes actifs et
quelques excipients utilisés pour les formulations des comprimés.
En premier lieu, l'examen de l'état cristallins et du comportement
thermiques des produits finis a été réalisé en
comparaison avec le principe actif pur. Des mélanges binaires principe
actif et certains excipients usuels ont été étudiés
pour mieux cerner des éventuelles interactions.
Le présent rapport est subdivisé en trois
parties. La première concerne un aperçu bibliographique sur les
substances thérapeutiques faisant l'objet de ce travail ainsi que les
différentes interactions physicochimiques pouvant avoir lieu entre les
principes actifs et les excipients dans les médicaments solides. La
deuxième partie est dédiée à la présentation
des différentes méthodes d'analyse et l'utilité de chaque
technique. Les résultats obtenus par les différentes techniques
(DRX, DSC, IR) ainsi que leurs interprétations constituent la
troisième partie de ce document.
CHAPITRE I :
ETUDE BIBLIOGRAPHIQUE
INSAT Chapitre I : Etude
bibliographique
2012-2013 13
I. Notions sur les médicaments I.1.
Généralités
I.1.1. Définitions et compositions
Le code de la santé publique définit le
médicament comme étant toute substance ou composition
possédant des propriétés curatives ou préventives
à l'égard des maladies humaines ou animales, permettant de
restaurer, corriger ou modifier les fonctions physiologiques en exerçant
une action pharmacologique, immunologique ou métabolique.
Les médicaments sont généralement
constitués de principe(s) actif(s) et d'excipients. Le principe actif
est une substance présentant une action thérapeutique. Les
substances actives peuvent être des éléments ou des
composés chimiques ainsi que des mélanges et solutions naturels
qui sont issus d'origine microbiennes (les vaccins), végétales ou
animales. Les substances actives peuvent aussi être obtenues par
synthèse chimique ou par des techniques de biotechnologie [1].
Les excipients sont des composants sans action
pharmacologique, nécessaires à la fabrication, à la
conservation et à l'administration des médicaments. Ils servent
de support à la matière active dont les quantités seraient
souvent trop faibles pour être facilement administrées. L'un des
rôles majeurs des excipients est notamment de donner une forme au
médicament, lui conférer un goût particulier et de garantir
sa stabilité [1].
I.1.2. Notions des génériques
Lorsqu'un laboratoire découvre un médicament, il
le protège par un brevet qui lui assure l'exclusivité
commerciale, et ce pendant 20 à 25 ans. Au-delà de cette
période, la licence de fabrication de ce médicament de
référence (ou princeps) tombe dans le domaine public. Un autre
laboratoire peut alors commercialiser un médicament
générique comparable à celui-ci.
Sa formulation présente la même composition
qualitative et quantitative en principe(s) actif(s) et la même forme
pharmaceutique qu'une spécialité de référence
déjà
INSAT Chapitre I : Etude
bibliographique
2012-2013 14
existante. Seuls les excipients peuvent varier, ce qui peut
entraîner de nouveaux effets secondaires ou certaines contre-indications,
comme les allergies.
La firme productrice n'a aucun frais de recherche et de
développement de ce fait le frais de remboursement des
génériques est inférieur à celui du princeps, ce
qui en fait son intérêt [1].
I.1.3. Formes galéniques des médicaments
Le terme de «galénique » provient du nom de
Claudius Galenus (Galien), médecin ayant vécu au
IIème siècle av. J-C à Rome. Il s'est
intéressé tout particulièrement à la formulation et
à la préparation des médicaments.
Avant la mise sur le marché, chaque médicament
doit faire l'objet d'une étude de composition, de forme et de
présentation qui convienne le mieux à son administration,
permettant ainsi de garantir la précision du dosage et une
stabilité satisfaisante pendant une durée
déterminée [2].
La forme galénique la mieux adéquate sera le
compromis entre :
? la meilleure efficacité thérapeutique ;
? la meilleure tolérance clinique ;
? la meilleure observance ;
? le plus faible coût de traitement.
On distingue plusieurs formes galéniques dont chacune est
adaptée à une voie
d'administration [3] :

Voie orale
· comprimés
· capsules
· suspensions...
Voie cutannée
· lotions
· mousses
· pommades...
Voie parentérale
· préparartions injectables
· implants
Voies
d'adminisrattion
&
formes
galéniques
appropriées
Voie transmuqueuse
· collutoires
· pommades
· suppositoires...
Fig- 1 : Les formes galéniques et leurs
voies d'administration
INSAT Chapitre I : Etude
bibliographique
2012-2013 15
I.2. Formes orales solides : Les comprimés
I.2.1. Définition
Selon la Pharmacopée française, les
comprimés sont des préparations solides contenant une
unité de prise d'une ou plusieurs substances actives. Ils sont obtenus
en agglomérant par compression un volume constant de particules. C'est
la forme galénique la plus répandue sur le marché.
I.2.2. Types de comprimés
Il existe plusieurs types de comprimés dont on distingue
:
· Les comprimés non enrobés
Ils comprennent des comprimés à couche unique
et des comprimés à couche multiples disposées
parallèlement ou concentriquement. Très peu de substances sont
directement compressibles, il est donc nécessaire de leur adjoindre des
adjuvants agglutinants ou de réaliser une opération de
granulation. Ces deux méthodes permettent de garantir une
cohésion suffisante entre les grains et un délitement plus
facile.
? Les comprimés enrobés
Ce sont des comprimés dont la surface est recouverte
d'une ou plusieurs couches de mélanges de substances diverses comme les
résines, les gommes, la gélatine, les sucres, les cires, les
polyols et les colorants.
? Les comprimés effervescents
Leur délitement est assuré par un
dégagement d'anhydride carbonique résultant de l'action d'un
acide organique sur un carbonate. Ils sont destinés à être
dissous ou dispersés dans l'eau avant administration.
? Les comprimés orodispersibles
Ils sont constitués de nombreuses microparticules
enrobées qui sont comprimés entre elles. Elles se
désagrègent dans la bouche au contact de la salive et le principe
actif est résorbé dans le tractus digestif.
· INSAT Chapitre I : Etude
bibliographique
2012-2013 16
Les comprimés gastro-résistants
Ce sont des comprimés à libération
modifiée, destinés à résister aux sucs gastriques
et à libérer le ou les principes actifs dans les sucs
intestinaux. Ils sont obtenus soit en recouvrant les comprimés d'un
enrobage gastro-résistant, soit en les préparant à partir
de granulés déjà recouverts par une couche protectrice.
Ils sont utilisés pour les principes actifs irritants pour l'estomac ou
ceux qui peuvent s'altérer en milieu acide [3].
I.2.3. Avantages
Les formes pharmaceutiques destinées à
l'administration par voie orale et plus particulièrement les formes
sèches représentent plus de 80 % des médicaments produits
à l'échelle mondiale. Elles sont économiquement
intéressantes et hautement reproductibles grâce à la
maitrise des procédés industriels de leur fabrication. Les
comprimés et les capsules présentent la catégorie la plus
fréquemment produites et consommée parmi les autres formes
solides. Les principaux avantages de ces formes sont :
· l'auto-administration ;
· l'existence de différentes méthodes de
fabrication ;
· la commodité lors de l'emballage et du stockage
;
· la production en masse à faible coût ;
· la qualité constante et la précision du
dosage ;
· la stabilité plus satisfaisante comparativement
à la forme liquide ;
· la possibilité d'adaptation du profil de
dissolution par un système de libération prolongée [4].
I.2.4. Processus de fabrication
La fabrication des comprimés peut se faire selon deux
procédés différents. La figure (2) résume les
différentes étapes de chaque mode de production [5].
Les divers constituants, sous forme de poudres, sont
mélangés à l'aide de malaxeurs. Ils sont ensuite
préparés soit par une compression directe soit par une
granulation.
INSAT Chapitre I : Etude
bibliographique

a) Compactage
b) Concassage
c) Tamisage
Mélange des poudres de principe(s)
actif(s) et
d'excipients

Granulation humide
Granulation sèche
Mélange
Compression
a) Mouillage
b) Granulation
d) Séchage
c) Tamisage
2012-2013 17
Fig- 2 : Processus de fabrication des
comprimés
? La compression directe
Cette technique réduit le nombre d'opérations de
fabrication et diminue donc les coûts d'obtention ; mais requiert des
excipients onéreux et une technicité de mise au point
supérieure. Elle ne peut être mise à profit qu'avec des
comprimés à très faibles teneurs en principe(s)
actif(s).
? La granulation
Elle sert à augmenter la densité, à avoir
un meilleur écoulement, à obtenir une porosité
supérieure facilitant la dissolution ainsi qu'une meilleure
compressibilité.
Elle est réalisée soit pour voie humide, soit par
voie sèche : - La granulation par voie humide
Le liquide de mouillage est souvent de l'eau seule ou
additionnée de l'alcool dilué. Le mouillage est assuré
dans les malaxeurs des mélangeurs planétaires, à vis ou
autre types d'appareils.
INSAT Chapitre I : Etude
bibliographique
2012-2013 18
La granulation qui suit est réalisée dans les
granulateurs rotatifs ou oscillants et suivie d'une opération de
séchage en étuve ou dans des séchoirs à lit
fluidisé. Les granulés sont ensuite tamisés,
mélangés aux adjuvants avant de faire l'objet de la compression
définitive.
- La granulation par voie sèche
Plus rarement employée, elle est destinée
à la formulation de principes actifs ne supportant ni l'humidité
ni la chaleur du séchage. On réalise une compression
préliminaire, avec obtention de briquettes qui sont ensuite
concassées dans les broyeurs.
? L'enrobage
L'opération d'enrobage consiste à recouvrir la
surface des comprimés par une substance filmogène. Elle est
réalisée soit par dragéification ou pelliculage ; afin
d'obtenir un effet particulier comme la gastro-résistance ou la
libération prolongée, de masquer un goût
désagréable ou encore de fournir une coloration distinguée
pour des raisons commerciales. La pelliculage est la méthode est la plus
utilisée grâce à sa rapidité, son automatisme et
surtout son faible coût.
? Le contrôle
Lors de la fabrication, on contrôle le grain
(homogénéité, humidité résiduelle,
fluidité) et quelques propriétés des comprimés
obtenus telles que la dureté, l'aspect macroscopique, les dimensions
(épaisseur, diamètre) ainsi que la masse [5].
I.3. Excipients
I.3.1. Rôles d'excipients dans les formes solides
Le concept traditionnel de l'excipient a connu une
évolution importante d'une simple charge à un constituant
essentiel de la formulation. La qualité des médicaments est
déterminée non seulement par la substance active mais aussi par
la performance des autres constituants.
Leurs propriétés physicochimiques agissent
principalement sur trois axes [6]: - in vivo : ils définissent le temps
de la transition gastro-intestinale ;
INSAT Chapitre I : Etude
bibliographique
2012-2013 19
- au niveau du processus de fabrication : ils sont
indispensables pour la mise en forme galénique ;
- pendant le stockage : ils assurent la conservation.
Le développement rapide des facteurs scientifiques,
réglementaires et économiques a introduit un nouvel
intérêt pour le rôle et la fonctionnalité des
excipients. Plus d'un millier de matières premières, disponibles
à partir d'une multitude de sources, sont utilisés aujourd'hui
dans l'industrie pharmaceutique. Leurs structures chimiques varient de petites
molécules complexes naturelles à des molécules
synthétiques qui sont généralement des
polymères.
La sélection des excipients se base sur deux
critères déterminants de la qualité d'un médicament
: la stabilité et la biodisponibilité de la substance active. Ils
remplissent d'importantes fonctions en particulier dans le cas des formes
posologiques solides [7].
I.3.2. Classification
Les excipients jouent plusieurs rôles en
galénique. Ils sont utilisés à des teneurs massiques
différentes qui dépendent à la fois de la famille
d'excipients à laquelle ils appartiennent et de leur nature chimique
[8,9].
Ils sont classés suivant leurs fonctions au sein de la
préparation solide :
? Les diluants (20% - 90%) :
Ce sont des poudres généralement inertes, ils
jouent un rôle de remplissage lorsque la quantité de principe
actif est insuffisante pour la préparation de comprimés.
A titre d'exemple, on cite :
- les sucres : lactose, mannitol, saccharose ;
- les sels : phosphate dicalcique, tricalcique, sulfate de
calcium, carbonate
de calcium, chlorure de sodium ;
- l'amidon natif ;
- la cellulose microcristalline.
? Les liants ou agglutinants (5% - 10%) :
Certains jouent un rôle au niveau de la compression
directe tel que la cellulose microcristalline, et d'autres sont utilisés
pour la granulation humide tel que les dérivés
INSAT Chapitre I : Etude
bibliographique
2012-2013 20
vinyliques comme le polyvidone ou povidone (PVP). On trouve
entre autre les dérivés cellulosiques, les amidons, les
polyethylene-glycols (PEG), les dérivés glycéridiques
(D-glucose, maltose, sorbitol), les protéines (gélatine) et les
gommes.
? Les désagrégeants ou délitants (0,5% -
10%) :
Ils accélèrent la désintégration
du comprimé en fragments, dispersant ainsi une certaine quantité
du principe actif dans le milieu physiologique. Ils agissent selon divers
procédés : par gonflement, par dissolution ou par réaction
chimique. On cite comme exemple : la crospovidone, la croscarmellose
carboxyméthylamidon sodique.
? Les lubrifiants (0,5% - 15%) :
Ils donnent un aspect brillant et non poussiéreux aux
comprimés. Ils influencent les propriétés
rhéologiques des granulés et les opérations de compression
:
- ils améliorent la fluidité du grain en
favorisant l'alimentation régulière de la chambre de compression
et promouvant les propriétés rhéologiques du
mélange : c'est le cas de la silice;
- ils diminuent les problèmes de collage au niveau des
poinçons de la matrice de compression en réduisant
l'électricité statique de certaines poudres. C'est le pouvoir
anti-adhérent ou antistatique : exemple du talc;
- ils réduisent la friction entre les particules durant
la compression et diminuent les frottements : exemple du stéarate de
magnésium.
Les lubrifiants les plus couramment utilisés sont: le
stéarate de magnésium, l'acide stéarique, les
dérivés glycériques, la paraffine solide, le
polytetrafluoroethylène, le talc, l'huile de ricin et de coton
hydrogénée, le laurylsulfate de sodium et la silice pure
colloïdale.
? Les adjuvants divers :
Ils sont classés selon plusieurs familles :
- les mouillants : compensent les propriétés
hydrofuges de certains constituants ;
- les substances tampons: ont pour rôle de
protéger les principes actifs contre les variations du pH au cours de la
conservation. Exemple, le citrate ou phosphate de calcium ;
- les colorants : améliorent l'aspect du comprimé
;
INSAT Chapitre I : Etude
bibliographique
2012-2013 21
- les aromatisants et les édulcorants: atténuent
les saveurs désagréables ;
- les conservateurs : permettent la conservation du
comprimé et donc d'augmenter sa durée de vie en retardant
l'oxydation ou la photolyse du principe actif et des excipients ainsi que la
prolifération microbienne. Ce sont essentiellement des antioxydants et
antimicrobiens : acide citrique et acide ascorbique. On distingue aussi des
agents opacifiants qui protègent les principes actifs photosensibles des
rayonnements lumineux comme le dioxyde de titane.
II. Interactions physico-chimiques principe
actif-excipients
II.1. Définition de la notion
d'interaction
Une interaction est une influence réciproque entre
deux entités ou deux phénomènes. Dans le domaine
pharmaceutique, une interaction peut avoir lieu entre un principe actif et les
excipients ou entre les excipients eux-mêmes dans une même
formulation.
Les approches rationnelles de choix des excipients ont
été basées sur la probabilité potentielle de leurs
interactions avec les principes actifs. Plusieurs études ont
souligné l'existence des interactions comme la complexassion, la liaison
hydrogène, les interactions ion-dipôle, dipôle-dipôle
et de van der Waal. Ces dernières peuvent modifier le comportement
physicochimique, pharmacologique ou pharmacocinétique des
médicaments.
Par conséquent, les excipients sont des composantes
importantes pouvant soit améliorer les caractéristiques des
formulations soit réduire l'efficacité de certaines
préparations [10].
II.2. Méthodes d'étude d'interactions
principe actif-excipients
Un élément clé de la qualité du
médicament est le profil de stabilité qui constitue une rubrique
particulière du dossier d'Autorisation de Mise sur le Marché
(AMM).
La stabilité découle de l'ensemble des
données physiques et chimiques acquises tout au long du
développement du médicament et au cours de son stockage. Elle se
base sur la capacité du produit à demeurer conforme aux
critères d'acceptation en assurant sa qualité
thérapeutique et sa pureté durant une période de
conservation spécifiée.
INSAT Chapitre I : Etude
bibliographique
2012-2013 22
Cette dernière dépend essentiellement de
l'environnement chimique du principe actif, renfermant les excipients. Les
études de compatibilité principe actif-excipient sont
indispensables pour la maîtrise de la stabilité des produits
finis. Elles se font généralement sous des conditions de stress
à savoir la température, l'humidité et les mélanges
binaires ou ternaires, afin de prévoir tous types d'interactions
potentielles dans un laps de temps restreint (par rapport à la
durée de la validité du médicament avant sa
péremption).
L'étude de la stabilité se fait par plusieurs
méthodes : spectroscopiques, microscopiques, thermiques et
chromatographiques [6].
II.3. Types d'interactions principe
actif-excipients
Le choix des excipients et leurs interactions avec le
principe actif sont les bases de la formulation des médicaments :
l'ampleur de leurs effets sur le dosage libéré de la substance
active dépend de ces caractéristiques ainsi que de la
quantité et les propriétés des excipients [11].
Il peut s'agir d'une synergie entre les différents
constituants : l'interaction dans ce cas est considérée comme
étant bénéfique [12] ; on observe par exemple une
augmentation de la stabilité [13] et de la solubilité [14-16].
Les cas d'incompatibilité causent l'altération
de l'activité thérapeutique qui peut se traduire par
l'augmentation des effets indésirables ou la diminution significative de
la biodisponibilité [10, 17].
II.4. Incompatibilités physicochimiques principe
actif- excipients II.4.1. Incompatibilités chimiques
Les principes actifs sont généralement des
molécules fragiles, assez influençables par leur environnement
chimique. Deux catégories d'incompatibilité chimique sont
distinguées :
? les réactions de dégradation intrinsèque
de la substance active ; ? les réactions covalentes entre le principe
actif et les excipients.
INSAT Chapitre I : Etude
bibliographique
2012-2013 23
Les réactions de la première catégorie
sont favorisées par les excipients. En effet, ces derniers sont
déterminants de deux facteurs importants à savoir : la
présence d'une quantité d'eau plus ou moins importante et le
micro-pH local.
L'existence d'excipients hygroscopiques peut favoriser
l'augmentation de la concentration en impuretés. En effet,
l'humidité résiduelle dans un système à
l'état solide peut avoir un impact significatif sur la stabilité
du principe actif.
D'une part, elle augmente la plasticité et la
mobilité de ce système par conséquent sa
réactivité. Dans ce cas, l'incorporation d'excipients à
caractère hygroscopique (isolant l'humidité) empêche
l'hydrolyse de la substance active; comme la silice colloïdale par
exemple.
D'autre part, la quantité d'eau emmagasinée par
l'excipient, étant faiblement adsorbée à sa surface, reste
mobile et cause ainsi l'altération du médicament ; on cite le cas
de la cellulose microcristalline qui a favorisé la dégradation du
nitrozepam [18].
Les excipients peuvent posséder aussi un comportement
acido-basique selon leurs structures chimiques. Leurs critères de choix
doivent dépendre de la compatibilité de leur profil de pH avec la
fragilité des principes actifs. En outre, l'humidité libre
favorise la réactivité acido-basique à l'interface
principe actif-excipient. En effet, la majorité des médicaments
sont commercialisés sous la forme de sels car ils sont plus stables que
les bases ou les acides organiques correspondants. La modification du pH du
microenvironnement de principe actif régénère des formes
acides ou basiques libres et par la suite augmente la probabilité de sa
dégradation [18].
On cite à titre d'exemple la réaction
d'hydrolyse du principe actif, telle que celle d'un nitrile en amide, d'un
ester en acide et alcool, ou la réaction d'oxydation telle que celle
d'un thiol en disulfure, d'un alcool en cétone ou d'un aldéhyde
en acide [19].
En ce qui concerne les réactions covalentes entre le
principe actif et les excipients, ces dernières font intervenir des
groupements fonctionnels des excipients ou des impuretés pouvant
interagir avec la molécule thérapeutique.
INSAT Chapitre I : Etude
bibliographique
2012-2013 24
L'exemple type est la réaction de Maillard entre des
amines primaires ou secondaires et les sucres réducteurs. Le
schéma suivant présente le mécanisme de la réaction
entre le lactose et un principe actif portant une amine primaire [20] :

Fig- 3 : Réaction de Maillard entre
l'amine primaire d'un
principe actif et le lactose
Les réactions d'oxydoréduction ou de photolyse
sont initiées par le dioxygène en présence de la
lumière, d'un catalyseur ou de la chaleur, induisant la formation de
radicaux libres.
La polymérisation est une autre réaction qui
peut avoir lieu à cause des groupements fonctionnels portés par
les molécules. Elle mène à des entités chimiques
à poids moléculaires plus importants. Dans le cas de
l'ampicilline, l'amino-pénicilline en solution concentrée, subit
une polymérisation qui peut détruire le pouvoir
thérapeutique de ce principe actif.
L'isomérisation peut survenir avec certains types
d'excipients générant des impuretés ; c'est le cas de la
vitamine A.
Les excipients ionisables peuvent interagir avec des principes
actifs ionisables provoquant la formation de composés insolubles
résultant des interactions de charges entre les différents
composés (échange de contre-ion).
INSAT Chapitre I : Etude
bibliographique
2012-2013 25
Les bentonites et les attapulgites qui sont des
minéraux dont la surface est chargée peuvent interagir avec des
molécules thérapeutiques de charges opposées [19].
II.4.2. Incompatibilités physiques
Certains composés peuvent s'adsorber à la
surface du principe actif favorisant sa dissolution. Par contre, si les forces
d'attraction sont fortes, la libération du principe actif devient plus
difficile. C'est le cas des excipients lipophiles comme les lubrifiants tel que
le stéarate de magnésium qui peut former des
agglomérations autours des molécules actives [19].
II.5. Cas d'incompatibilités
présentées par les bétabloquants
Les bétabloquants, comme tous les principes actifs,
portent plusieurs groupements fonctionnels lui permettant d'accomplir leurs
rôles thérapeutiques. Cette fonctionnalité est à
l'origine, dans certains cas, d'incompatibilités avec différents
excipients.
Plusieurs études publiées portent sur l'analyse
du comportement de l'aténolol avec différents excipients. Cette
substance active a montré qu'elle est susceptible d'établir des
liaisons hydrogène avec le mannitol (entre l'hydroxyde du sucre et
l'hydrogène de l'amine secondaire de l'aténolol) ; cette
incompatibilité a été mise en évidence par une
température et une énergie de fusion plus importante que celle du
principe actif seul [21].
D'autres excipients ont engendré sa
décomposition, comme le lactose, via la réaction de Maillard avec
un taux de dégradation de 2%. De plus, l'acide ascorbique, l'acide
citrique et le butyl hydroxyanisole provoquent l'oxydation de
l'aténolol.
En effet, ces réactions augmentent parfois la
concentration en impuretés connues dans la monographie de la substance
active ou fait apparaitre des nouveaux produits de dégradations.
L'impureté (G) de l'aténolol, par exemple, est produite par
l'hydrolyse de sa fonction amide en présence des deux acides
cités précédemment [22].
Le carvédilol s'est avéré aussi
incompatible avec l'acide citrique : l'interaction entre les deux substances
produit l'ester de l'acide citrique et l'amide du principe actif [23].
INSAT Chapitre I : Etude
bibliographique
2012-2013 26
III. Phénomènes de polymorphisme dans les
médicaments III.1. Principe actif : état cristallin et
polymorphisme
Le polymorphisme est défini comme étant la
faculté que possède une substance de cristalliser selon des
structures différentes.
Ce phénomène concerne les médicaments de
formes solides. Les différentes opérations mécaniques,
chimiques et/ou galéniques prenant place après la cristallisation
auront, en général, des répercussions négatives sur
ce qu'il est convenu d'appeler la cristallinité initiale du principe
actif. En effet, la forme cristalline initialement obtenue peut évoluer
en subissant des transitions solide-solide incluant des transformations
polymorphiques, pseudopolymorphiques (formation d'hydrates ou de solvates) ou
devenir amorphe [24].
III.2. Facteurs provoquant le polymorphisme
Au cours du processus de fabrication, plusieurs
paramètres peuvent contribuer à la survenance du
polymorphisme.
Un principe actif, en vue de préparer des
gélules ou des comprimés, peut subir l'effet de
différentes opérations mécaniques incluant : le broyage,
le compactage et la compression.
Toute ces opérations mécaniques peuvent apporter
de l'énergie au système concerné par :
- un échauffement pouvant conduire à la fusion
de certaines entités du mélange ;
- un changement de la structure cristalline en favorisant soit
l'apparition d'une nouvelle forme cristalline soit l'amorphisation plus au
moins totale du principe actif et/ou des excipients. Il est important de noter
que même si le taux global de phases amorphes est faible et parfois
indétectable. Ces phases sont souvent présentes à la
surface des particules ;
- par la création de défauts cristallins qui
sont des zones localisées de hautes énergies pouvant favoriser
les processus de recristallisation en des phases plus stables [25].
D'une part, au niveau d'une formulation galénique
incluant un procédé de granulation humide ou avec un solvant, une
hydratation ou solvatation peut se produire : c'est le
INSAT Chapitre I : Etude
bibliographique
2012-2013 27
pseudopolymorphisme. D'autre part, ce phénomène
dans la majorité des cas est réversible. En effet, par un simple
chauffage, les pseudopolymorphes obtenus peuvent évoluer en fonction des
conditions de température de séchage et récupérer
leurs formes initiales.
La présence en quantité notable de
différents excipients s'est avérée favorisante de
l'accélération de certaines transformations polymorphiques. On
cite l'exemple du carvédilol et l'aténolol qui sont des
bétabloquants : une fois mélangé au povidone, le
carvédilol passe de la forme II à la forme III [26] alors que
l'aténolol perd sa cristallinité complètement à
cause des fortes interactions entre le principe actif et l'excipient.
En outre, pour d'autres familles de molécules
thérapeutiques, le broyage du chloramphenicol en présence de la
silice colloïdale provoque aussi l'amorphisation de ce dernier [20].
III.3. Conséquences du polymorphisme
III.3.1. Répercussion sur la biodisponibilité et
sur le profil de dissolution
Il est important, pour des considérations de
contrôle de qualité, d'illustrer les différents profils de
dissolution pour une molécule donnée dans le cas de l'existence
d'un polymorphisme. La cinétique de dissolution dépend de la
forme cristalline considérée mais également de
l'état d'agglomération, de la distribution granulométrique
de la surface spécifique et de la réactivité surfacique
[25].
III.3.2. Effets sur les propriétés
physicochimiques
Les molécules à l'état solide
présentent toujours une certaine réactivité
physico-chimique plus faible qu'à l'état liquide ou gazeux.
Néanmoins, dans certains cas, les phases amorphes peuvent
présenter des réactivités très importantes par
rapport à la forme cristallisée caractérisée
généralement par une meilleure stabilité [26].
La cristallisation de composés à
intérêt pharmaceutique est très compliquée car elle
résulte de la compétition de nombreux mécanismes comme la
croissance des différentes formes cristallines et la transformation des
formes métastables vers les formes stables. Pour contrôler le
polymorphisme, il est donc nécessaire de connaître et
INSAT Chapitre I : Etude
bibliographique
â 1 sélectifs

ex : acébutolol, aténolol bétaxolo,
métoprolol...
de comprendre non seulement l'influence des différentes
conditions opératoires mais aussi les divers mécanismes
élémentaires mis en jeux lors de la cristallisation [27].
IV. Principes actifs étudiés
IV.1. Choix des principes actifs
Cette étude est faite sur l'acébutolol, le
bétaxol et le carvédivol qui des principes actifs dont, au moins
trois produits finis, sont commercialisés en Tunisie. Les
médicaments sont sous forme de comprimés (non enrobés et
enrobés, sécables et non sécables). Leurs compositions
diffèrent de point de vue dosage de la substance active et excipients
utilisés pour leurs formulations. Ils sont aussi fabriqués par
des méthodes différentes (compression directe,
granulation...).
IV.2. Classe thérapeutique
Les bétabloquants appartiennent à la classe des
antihypertenseurs qui sont des médicaments très utilisés
en cardiologie ainsi que pour le traitement de pathologies diverses. Ce sont
des antagonistes de récepteurs adrénergiques du système
nerveux autonome sympathique (Figure 4) [28].
Non selectifs
ex : carvédilol, nadolol propranolol, timolol...
Béta-antagonites
|
Antagonistes des récepteurs adrénergiques
|
Non séléctifs
2012-2013 28
|
Alpha-antagonistes
|
á 1sélectifs
|
|
á 2 sélectifs
|
Fig- 4 : Les différentes classes des
antagonistes des récepteurs adrénergiques
INSAT Chapitre I : Etude
bibliographique
2012-2013 29
IV.3. Propriétés
physicochimiques
Les noms IUPAC et les structures des principes actifs
étudiés sont les suivants :
|
Acébutolol (chlorhydrate)
|
|
Nom IUPAC
|
Chlorhydrate de
N-[3-acétyl-4-[(2RS)-2-hydroxy-3-[(1-méthyl)
amino] propoxy)
phényl] butanamide.
|
|
Structure
|
|
|
|
Bétaxolol (chlorhydrate)
|
|
Nom IUPAC
|
Chlorhydrate de (2RS)-1-[4-[2-(cyclopropylmethoxy)
éthyl]phenoxy]-3-[(1-méthyléthyl) amino] propan-2-ol.
|
|
Structure
|
|
|
|
|
|
Carvédilol
|
|
Nom IUPAC
|
[3 - (9H-carbazol-4-yloxy)-2-hydroxypropyl] [2 -
(2-méthoxy phénoxy) éthyl] amine.
|
|
Structure
|
|
|
INSAT Chapitre I : Etude
bibliographique
2012-2013 30
Le tableau (1) résument les propriétés
physicochimiques [@1].
Tableau 1 : Propriétés
physicochimiques des principes actifs étudiés
|
Principe actif
|
|
Propriété
|
Acébutolol
|
Bétaxolol
|
Carvédilol
|
|
Formule chimique
|
C18H28N2O4, HCl
|
C18H29NO3, HCl
|
C24 H26 N2 O4
|
|
Masse molaire (g.mol-1)
|
372,88
|
343,88
|
406,47
|
|
Température de fusion
|
141-143°C
|
113-117 °C
|
114-115 °C
|
|
pKa
|
9,4
|
9,4
|
15
|
|
Réfractivité
|
88,64
|
88.64
|
115.64
|
|
Lipophilie
|
Log P = 0,2
|
Log P = 0,59
|
Log P >1
|
|
Solubilité (eau) (mg.L-1)
|
220
|
451
|
0,583
|
|
Aspect
|
Poudre cristalline
blanche
|
Poudre cristalline
blanche
|
Poudre cristalline
blanche
|
Plusieurs substances actives peuvent se présenter sous
différentes formes polymorphiques.
L'acébutolol existe seulement sous la forme de deux
polymorphes á et â. La forme utilisée pour les formulations
médicamenteuse est celle de á [29].
Pour le cas de carvédilol, plusieurs études ont
fait l'objet de la préparation d'une variété importante de
polymorphes et de pseudopolymorphes afin d'améliorer son comportement
lors de la dissolution : les formes (I), (II) et (IV) sont des anhydres, la
forme (V) est un solvate et la forme (III) est un hydrate [30].
Cependant, jusqu'au aujourd'hui, le bétaxolol n'est
connu que sous une seule forme cristallisée utilisée dans
l'industrie pharmaceutique.
CHAPITRE II :
MATERIELS ET METHODES
INSAT Chapitre II : Matériels et
méthodes
I. Produits finis et mélanges binaires
préparés
II.1. Produits finis
Les produits finis sont commercialisés sous formes de
comprimés (tableau (2)). Tableau 2 : Dosage des
produits finis analysés
|
Principe actif
|
Acébutolol
|
Bétaxolol
|
Carvédilol
|
|
Produits finis
|
Symbole
|
type
|
Symbole
|
type
|
Symbole
|
type
|
|
Aceb1
Aceb2
Aceb3
|
générique générique princeps
|
Beta1
Beta2
Beta3
|
générique générique princeps
|
Car1
Car2
Car3
|
générique
générique
générique
|
|
Dosage
|
400 mg
|
20 mg
|
25 mg
|
Les compositions de chaque médicament figurant dans la
notice sont reprises dans les tableaux (3,4 et 5).
Tableau 3 : Composition des produits finis
à base d'acébutolol
|
Famille
d'excipients
|
Aceb1
|
Aceb2
|
Aceb3
|
|
Diluant
|
amidon de blé
cellulose
microcristalline
|
lactose
amidon de blé
|
lactose
amidon de blé
|
|
Liant
|
talc,
povidone
hypromellose
polyéthylèneglycol
|
povidone
talc
|
povidone
talc
|
|
Lubrifiant
|
silice colloïdale
anhydre
magnésium stéarate
|
silice colloïdale
anhydre
magnésium stéarate
|
magnésium stéarate
|
|
Agent de
pelliculage
|
TiO2
|
TiO2
hypromellose
Magrocol 6000
|
hypromellose
Magrocol 20000
|
2012-2013 32
INSAT Chapitre II : Matériels et
méthodes
Tableau 4 : Composition des produits finis
à base de bétaxolol
|
Famille
d'excipients
|
Béta1
|
Béta2
|
Béta3
|
|
Diluant
|
lactose monohydrate
cellulose
microcristalline
|
lactose monohydrate
cellulose
microcristalline
|
lactose monohydrate
cellulose
microcristalline
|
|
Liant
|
Macrogol 400
hypromellose
CMC sodique
|
-
|
Macrogol 400
hypromellose
CMC sodique
|
|
Désagrégeant
|
-
|
croscarmellose Na
|
-
|
|
Lubrifiant
|
silice colloïdale
anhydre
magnésium stéarate
|
silice colloïdale
anhydre
magnésium stéarate
|
silice colloïdale
anhydre
magnésium stéarate
|
|
Agent de
pelliculage
|
TiO2
|
hypromellose, TiO2
Macrogol 2000
|
TiO2
|
Tableau 5 : Composition des produits finis
à base de carvédilol
|
Famille
d'excipients
|
Car1
|
Car2
|
Car3
|
|
Diluant
|
lactose monohydrate
saccharose
|
lactose monohydrate
cellulose
microcristalline
|
lactose monohydrate
|
|
Liant
|
povidone
crospovidone
|
-
|
povidone
glycolate d'amidon
sodique
|
|
Lubrifiant
|
silice colloïdale
anhydre
magnésium stéarate
|
silice colloïdale
anhydre
magnésium stéarate
|
silice colloïdale
anhydre
magnésium stéarate
|
II.2. Mélanges binaires principes
actifs-excipients
Les mélanges binaires préparés aucours du
présent travail sont constitués d'un principe actif et d'un
excipient.
Les principes actifs sont : l'acébutolol, le
bétaxolol et le carvédilol ;
2012-2013 33
INSAT Chapitre II : Matériels et
méthodes
Les excipients sont : le lactose monohydrate, le magnésium
stéarate, le povidone (PVP), l'acide citrique, l'acide ascorbique et le
butylhydroxyanizole (BHA).
L'origine et les propriétés physicochimiques des
excipients sont résumées dans le tableau (6)[9].
Tableau 6 : Origines et
propriétés physicochimiques des excipients utilisés pour
la
préparation des mélanges binaires
|
Excipients
|
Formule chimique
|
pH (w/veau)
|
T fusion (°C)
|
Origines
|
|
Lactose
monohydrate
|
C12H22O11, H2O
|
-
|
200-202
|
Animale (lait)
|
|
Mg stéarate
|
[CH3(CH2)16COO] 2 Mg
|
-
|
110 - 150
|
- Animale - Végétale
|
|
Acide
ascorbique
|
C6H8O6
|
2,4 (5%)
|
190
|
-Végétale -Synthétique
|
|
Acide citrique
|
C6H8O7, H2O
|
2,2 (1%)
|
153
|
-Végétale (jus de citron) -Synthétique
(fermentation)
|
|
BHA
|
C11H16O2
|
-
|
47
|
Synthétique
(réaction du methoxyphenol
avec
l'isobutène)
|
|
PVP
|
(C6H9NO)n
|
5,5 (5%)
|
100-150
|
Synthétique
(polymèrisation de la N-
vinylpyrrolidone)
|
II.3. Préparations des échantillons
à analyser
? Produits finis
Les comprimés sont broyés finement à
l'aide d'un mortier en agate pour tous les essais.
? Mélanges binaires
Il existe plusieurs méthodes pour la préparation
d'échantillons en vue de la réalisation d'une étude de
compatibilité. Ces méthodes diffèrent selon la proportion
des composés dans le mélange, sa manière
d'homogénéisation, les conditions du vieillissement
accéléré et la période d'incubation.
2012-2013 34
INSAT Chapitre II : Matériels et
méthodes
2012-2013 35
Au cours de ce projet, les mélanges sont
préparés selon la proportion massique 50% principe actif et 50%
excipient. Une partie est analysée directement après la
préparation et l'autre est soumise sous des conditions de stress dans
une chambre de vieillissement accéléré à 40°C
et 75% humidité pendant trois semaines.
II. Techniques de caractérisation
physicochimique
II.1. Spectroscopie d'absorption infra-rouge à
transformée de Fourier et à réflexion totale
atténuée (FT-IR ATR)
La spectroscopie FT-IR est une méthode physique
rapide, économique, non destructive et couramment utilisée en
analyse structurale.
Elle se base sur l'interaction rayonnement-matière.
Etant spécifiques, les longueurs d'ondes vibrationnelles permettent de
déterminer la présence de groupements fonctionnels, ainsi que les
structures de certaines molécules simples.
Les analyses ont été effectuées à
l'aide d'un spectrophotomètre FT-IR ATR VERTEX 70-BURKER ATR avec une
interface gérée par le logiciel OPUS.
II.2. La calorimétrie différentielle
à balayage
La calorimétrie différentielle à balayage
ou Differential Scanning Calorimetry (DSC) est couramment utilisée dans
de nombreux domaines pour la caractérisation de plusieurs types de
matériaux. Cette technique consiste à mesurer le flux de chaleur
émis ou absorbé par l'échantillon analysé
comparativement à la cellule de référence en fonction de
la température.
Elle est très utilisée dans le domaine de la
recherche et du développement des produits pharmaceutiques vue la
multitude des informations extraites des thermogrammes fournis : la
température, l'énergie (l'enthalpie ÄH) ainsi que la
cinétique des phénomènes exothermiques ou endothermiques
observés :
· les transitions solide-liquide : détermination
de la pureté des échantillons analysés ou d'une
interaction potentielle entre un principe actif et un excipient ;
· les transitions solide-solide : identification du
polymorphisme des composés analysés ;
·
INSAT Chapitre II : Matériels et
méthodes
2012-2013 36
les transitions de phase dans les cristaux liquides :
détermination de la température de la transition vitreuse ou de
la cristallisation des amorphes.
Les échantillons sont pesés à l'aide
d'une balance de précision (la masse des prises d'essais est de 1,7 mg
#177; 0,4) puis mis dans des creusets sellés en aluminium de volume 30
ìL. L'analyse est réalisée de 20°C à
170°C sous air avec une montée de température de 10°C
par minute.
L'appareil DSC utilisé durant ce présent travail
est de type SETARAM 131 EVO piloté par le logiciel CALISTO. L'extraction
des données issues des thermogrammes est réalisée
automatiquement par ce logiciel (figure 5).

Fig- 5 : Détermination des
données issues des thermogrammes par le logiciel
INSAT Chapitre II : Matériels et
méthodes
2012-2013 37
III.3. La diffraction des rayons X (DRX)
L'acquisition des données est assurée par un
diffractomètre de type (?-2?) de marque Panalytical opérant avec
une raie Ká du cuivre (ë=1,540598 Å). Le
système est géré par le logiciel X'Pert High Score.
Le dispositif de l'appareil comprend :
- un générateur à haute tension
stabilisée qui alimente le tube à rayons X ; - un tube à
rayon X scellé où la source d'électrons est maintenue
à des valeurs
de 20 à 50 kV au moyen d'un potentiel négatif
élevé et une anode en métal
épais, refroidie par un circuit d'eau ;
- un goniomètre qui permet de faire tourner
l'échantillon et le détecteur dans les conditions fixées
par l'équation de Bragg ;
- un système de détection qui mesure
l'intensité des rayons X diffracté.
L'analyse des diffractogrammes permet d'identifier le
composé étudié, de déterminer les paramètres
de sa maille ainsi que l'orientation préférentielle de ces plans
de diffraction.
CHAPITRE III :
RESULTATS ET DISCUSSION
INSAT Chapitre III : Résultats et
discussion
I. Caractérisation de produits finis
L'étude des produits finis est élaborée
en se basant sur la comparaison de l'état cristallin et du comportement
thermique des médicaments (génériques ou princeps)
renfermant le même principe actif.
I.1. Analyse par diffraction des rayons X
L'examen des diffractogrammes permet d'une part d'évaluer
la cristallinité des principes actifs dans les comprimés et
d'autre part d'identifier quelques excipients cristallins et même
amorphes.
I.1.1. Produits finis à base d'acébutolol
Le diffractogramme des rayons X de l'acébutolol
présente les pics caractéréstiques du polymorphe
(á) (figure 6)[29].
Intensité
1 ,6 1 0 5
1 ,4 1 0 5
1 ,2 1 0 5
4 1 0 4
2 1 0 4
8 1 0 4
6 1 0 4
1 1 0 5
0

A c e b
1 0 1 5 2 0 2 5 3 0 3 5
2 ? ( ° )
Fig- 6 : Diffractogramme des rayons X de
l'acébutolol
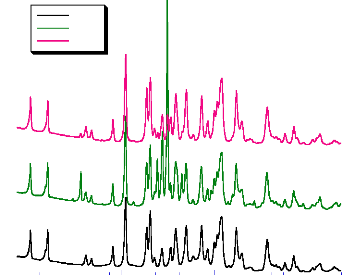
La figure (7) illustre les diffractogrammes des différents
produits finis à base d'acébutolol.
2012-2013 39
INSAT Chapitre III : Résultats et
discussion
Intensité
Aceb1
Aceb2
Aceb3
8 12 16 20 24 28 32
2? (°)
2012-2013 40
Fig- 7 : Diffractogrammes des rayons X des
produits finis à base d'acébutolol
On remarque que ce dernier reste sous la même forme
cristalline dans tous les produits finis puisque les positions des pics sont
conservées. Cependant, la variation de l'ordre d'intensité
révèle une modification de l'orientation des plans
préférentiels ; ceci est dùe probablement dû aux
opérations mécaniques effectuées lors de la mise en forme
galénique comme la granulation ou la compression.
On note aussi la présence d'autres pics qui sont relatifs
aux excipients cristallisés.
INSAT Chapitre III : Résultats et
discussion
2012-2013 41
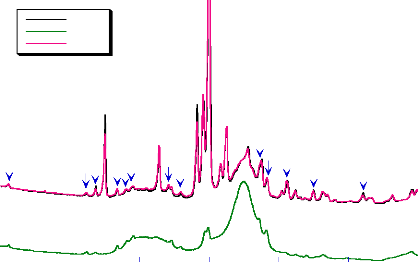
L'analyse de quelques excipients est effectuée afin
d'assigner les différents pics. On distingue un pic correspondant au
dioxyde de titane à 25,31° (Aceb (1)) et à 25,22°
(Aceb(2)).
Le lactose monohydrate possède quelques pics intenses
à la même position que ceux du principe actif : l'ordre
d'intensité des pics a donc changé à cause de la
superposition des deux réponses. En fait, cet excipient joue le
rôle d'un diluant pour la formulation et il est employé en grande
quantité. Il est présent dans les produits Aceb (2) et Aceb
(3).Ce dernier est substitué par un autre excipient amorphe pour le
produit Aceb (1). En effet, on remarque un écartement de son
diffractogramme de la ligne de base à un intervalle entre 13° et
23°. On peut trancher que ce signal est relatif à la cellulose
microcristalline plus tôt qu'à l'amidon de blé (figure
8).
Intensité
Lactose mono Dioxyde de titane Cellulose microcristalline Amidon
de blé
10 15 20 25 30 35
2? ???
Fig- 8 : Diffractogrammes des excipients
employés dans la formulation des produits
finis
INSAT Chapitre III : Résultats et
discussion
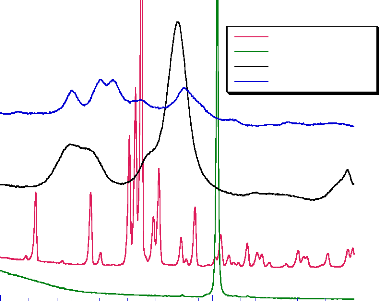
I.1.2. Produits finis à base de bétaxolol
Le diffractogramme des rayons X du bétaxolol est
présenté par la figure (9).
1 1 0 5
8 1 0 4
6 1 0 4
4 1 0 4
2 1 0 4
0
B eta
Intensité Intensité
e L
5 1 0 1 5 2 0 2 5 3 0 3 5
2 0 (° )
Fig- 9 : Le diffractogramme des rayons X du
bétaxolol
La comparaison des différents diffractogrammes des
produits finis à base de bétaxolol est illustré dans la
figure (10).
B e ta1
B e ta2
B e ta3
5 1 0 1 5 2 0 2 5 3 0 3 5
2 0 (°)
Fig- 10 : Diffractogramme des rayons X des
produits finis à base de bétaxolol
2012-2013 42
INSAT Chapitre III : Résultats et
discussion
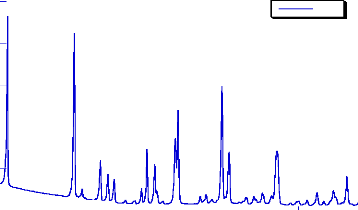
I.1.3. Produits finis à base de
carvédilol
Le diffracogramme de carvédilol montre qu'il se trouve
sous la forme polymorphique II (figure 11) [30].
car
2 1 0 5
1 ,5 1 0 5

Intensité
5 1 0 4
1 1 0 5
0
1 0 1 5 2 0 2 5 3 0 3 5
2 0 (°)
Fig- 11 : Diffractogramme des rayons X du
carvédilol
La comparaison des différents diffractogrammes des
produits finis à base de bétaxolol est illustré dans la
figure (12).
Intensité
3,6 105
3,2 105
2,8 105
2,4 105
1,6 105
1,2 105
4 105
2 105
8 104

car1
car2
car3
10 15 20 25 30 35
20 (°)
Fig- 12 : Diffractogrammes des rayons X des
produits finis à base du carvédilol
2012-2013 43
INSAT Chapitre III : Résultats et
discussion
2012-2013 44
L'examen des diffractogrammes des produits à base de
bétaxolol et de carvédilol a permis de vérifier que les
produits finis sont toujours sous leurs formes cristallines initiales
(conservation des positions des pics par rapport au principe actif seul).
Néanmoins, la texture des principes actifs n'a pas pu être
déterminée étant donné que les pics sont
d'intensité très basse à cause des faibles dosages
(successivement 20 mg et 25 mg dans des comprimés de 320 à 350
mg).
Les réponses intenses des différents produits
finis sont relatifs essentiellement au lactose monohydrate, présent dans
la formulation à des proportions plus au moins importantes.
On remarque que les produits Beta (2) et Car (2)
présentent une zone de 13° à 23° relative à une
substance amorphe. En Effet, dans la formulation de ces deux comprimés
la cellulose microcristalline est employée à des proportions plus
importantes que celle du lactose monohydrate. Il est intéressant de
noter que les diffrctogrammes des produits Beta (3) et Beta (1) sont
parfaitement superposables : les deux produits finis donnent la même
réponse car ils ont une composition en excipients très semblable
de point de vue qualitatif et quantitatif.
Cette analyse structurale a permis de vérifier que les
molécules thérapeutiques ne présentent pas de
phénomène de polymorphisme : elles ne sont pas affectées
par les étapes de la mise en forme galénique à savoir la
granulation humide et/ou la compression ; leurs structures cristallines sont
assez stables dans les mélanges solides complexes des comprimés.
De plus, la présence de faibles quantités de certains excipients
cristallins et même amorphes a été mise en évidence
tel que le dioxyde de titane.
I.2. Analyse par calorimétrie
différentielle à balayage (DSC)
La calorimétrie différentielle à balayage
est une technique d'analyse qui fournit une courbe présentant le flux de
chaleur en fonction de la température. Elle permet d'étudier le
comportement thermique des substances analysées. On peut extraire des
thermogrammes la température de début de fusion (Ton set) et
l'enthalpie (ÄfH) mises en jeu au cours des phénomènes
observés.
INSAT Chapitre III : Résultats et
discussion
Il est nécessaire de souligner le fait que le principe
actif est dilué dans les comprimés à cause de la
présence d'autres composés ; la prise d'essais par
coséquent contient impérativement une quantité
inférieure de la substance thérapeutique que lorsqu'elle est
seule.
I.2.1. Produits finis à base d'acébutolol
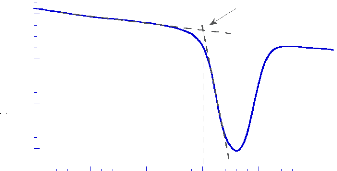
L'acébutolol présente un seul pic endothermique
dans l'intervalle 100- 150°C attribué à sa la fusion. La
température de début de fusion (Ton set) est de 140,1 °C, et
l'énergie mise en jeux au cours de ce phénomène est de
104,3 kJ/kg (figure 13).

-8
A ceb
Flux de chaleur (mW)
-10
-12
-14
-16
.
T
o n set
2012-2013 45
110 1 20 1 30 140 150 1 60
Température (°C )
Fig- 13 : Courbes DSC de
l'acébutolol
Les thermogrammes des produits finis à base de
l'acébutolol montre un seul pic endothermique au meme intervalle relatif
à la fusion du principe actif (figure 14) .
INSAT Chapitre III : Résultats et
discussion
Flux de chaleur (mW)
-10,4
-11,2
-12,8
-13,6
-14,4
-15,2
-12
-16

Aceb Aceb1 Aceb2 Aceb3
2012-2013 46
125 130 135 140 145 150 155 160
Température (°C)
Fig- 14 : Comparaison des courbes DSC de
l'acébutolol et ses produits
finis
Tableau 7 : Données issues des courbes
DSC de l'acébutolol et ses produits finis
|
Produit
|
ÄfH (kJ/kg)
|
Ton set (°C)
|
|
Aceb (principe actif)
|
112,7
|
140,1
|
|
Aceb 1 (générique)
|
67
|
138,3
|
|
Aceb 2 (générique)
|
85,5
|
134
|
|
Aceb 3 (princeps)
|
83,7
|
137,2
|
On constate que le produit Aceb (2) possède la
température de fusion la plus faible malgré qu'il possède
qualitativement la même composition que le produit Aceb (3).
Le générique (1) présente une enthalpie
moins importante que celle d'Aceb (2) et Aceb (3) quoiqu'il renferme la
même concentration en principe actif (tableau (7)).
INSAT Chapitre III : Résultats et
discussion
2012-2013 47
Théoriquement, l'enthalpie est une grandeur extensive,
elle doit donc être proportionnelle aux quantités de principe
actif dans les prises d'essais analysée .en effet, la teneur massique de
ce dernier n'est pas la même pour tous les produit finis (la masse des
comprimé diffère pour chaque produit fini).
I.2.2. Produits finis à base de bétaxolol
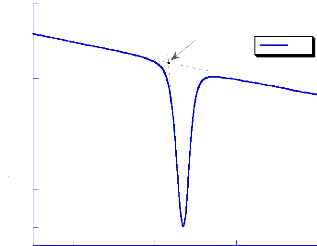
Le termogramme du bétanol présente dans
l'intervalle 100-150°C, un phénomène endothermiques
correspondant à sa fusion. La température de début de
fusion est de 113,3°C et l'énergie mise en jeux de ce
phénomène est de l'ordre de 104,3 kJ/kg (figure 15).
-50
Beta
-52
T
on set
-54
-56
-58
-60
-62
Flux de chaleur (mW)
80 90 100 110 120 130 140 150
Température (°C)
Fig- 15 : Courbes DSC du bétaxolol
La comparaison des différents thermogrammes des
produits finis présentés dans la figure (figure 16) montre un
décalage au niveau de la température du début de
fusion.
INSAT Chapitre III : Résultats et
discussion

Beta Beta1 Beta2 Beta3
Flux de chaleur (UA)
x 5
96 104 112 120 128 136 144 152
x 5
x 5
2012-2013 48
Température (°C)
Fig- 16 : Comparaison des courbes DSC du
bétaxolol et ses produits finis
Le produit Beta(3) possède la Ton set la plus faible.
On constate aussi que l'énergie de fusion du principe actif est
très faible pour les comprimés par apport à celle de la
substance thérapeutique seule. Ceci est dû au faible dosage du
bétaxolol dans les comprimés (20 mg environ). En outre, les
quantités de chaleur mise en jeu sont comparables (tableau(8)).
Tableau 8 : Données issues des courbes
DSC de bétaxolol et ses produits finis
|
Produit
|
ÄfH (kJ/kg)
|
Ton set (°C)
|
|
Beta (principe actif)
|
104,3
|
113,3
|
|
Beta1 (générique)
|
4,1
|
109,3
|
|
Beta 2 (générique)
|
5,1
|
109,3
|
|
Beta 3 (princeps)
|
4,4
|
108,3
|
On note aussi que les produits Beta (1) et Beta (3)
présentent un deuxième pic de fusion, aux alentours de
115-140°C, qui peut être relatif aux d'excipients :
carboxyméthyl cellulose sodique, Macrogol 400 et l'hypromellose. En
effet, ces excipients ne sont présents que dans la formulation des
produits Beta (1) et Beta (3).
INSAT Chapitre III : Résultats et
discussion
2012-2013 49
I.2.3. Produits finis à base de
carvédilol
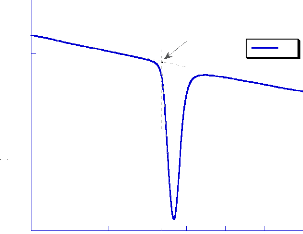
La courbe DSC du carvédiol illustre un seul
phénomène endothermique dans l'intervalle 100-150°C,
correspondant à sa fusion (figure17). La température de
début de fusion est de 113,7°C et une énergie mise en jeux
de 123,5 kJ/kg.
Car
T
on set
-65
-70
-75
Flux de chaleur (UA)
80 90 100 110 120 130 140 150
Température (°C)
Fig- 17 : Courbe DSC du carvédilol
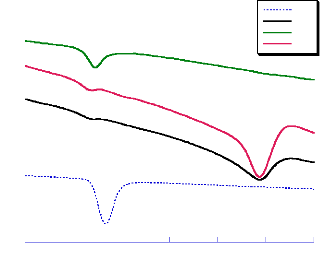
Les thermogrammes des produits finis à base du
cavédilol présentent deux phénomènes
endothermiques. Le premier est attribué à la fusion du principe
actif.
Le deuxième phénomène observé aux
alentours de 150 °C pour les produits Car (1) et Car (3). Il peut
correspondre à la fusion du PVP étant donné qu'il n'existe
que dans la formulation de ces deux médicaments (figure 18).
On constate que le produit Car (3) présente la
température de début de fusion la plus faible, alors que Car (2)
possède une enthalpie de fusion six fois plus importante que celles des
autres produits finis (Tableau (9)).
INSAT Chapitre III : Résultats et
discussion
Car
Car1
Car2
Car3
Flux de chaleur (UA)
x5
100 110 120 130 140 150 160
x5
x5
2012-2013 50
Température (°C)
Fig- 18 : Comparaison des courbes DSC du
carvédilol et ses produits finis
Tableau 9 : Données issues des courbes
DSC de carvédilol et ses produits finis
|
Produit
|
ÄfH (kJ/kg)
|
Ton set (°C)
|
|
Car (principe actif)
|
123,5
|
113,7
|
|
Car 1 (générique)
|
1,1
|
111,2
|
|
Car 2 (générique)
|
7,7
|
111,7
|
|
Car 3 (princeps)
|
1,3
|
110,9
|
D'une manière générale, on note pour les
différentes courbes DSC :
? un seul phénomène endothermique relatif au
principe actif et correspondant à sa fusion est observé dans
l'intervalle 100-150°C;
? les températures de début de fusion des
produits finis sont moins importantes que celle du principe actif seul ;
? une variation importante de l'enthalpie de fusion. Celle-ci
pourrait être due l'existence d'une interaction entre le principe actif
et les excipients dans chaque formulation.
INSAT Chapitre III : Résultats et
discussion
2012-2013 51
II. Etude du comportement thermique et cristallin des
principes actifs au sein des mélanges binaires
Pour la suite des analyses, notre intérêt s'est
uniquement porté sur l'étude de comportement de
l'acébutolol et du bétaxolol puisque la compatibilité
carvédilol-excipients a été le sujet de plusieurs travaux
de recherches [13, 15, 23, 25].
Des mélanges binaires principe actif- excipient ont
été alors préparés. Tout d'abord, les excipients
choisis sont ceux déjà existant dans la formulation des
médicaments étudiés : le lactose monohydrate (diluant), le
magnésium stéarate (lubrifiant) et le povidone (PVP) (liant).
Nous avons ensuite étudié l'interaction principe
actif-excipient des antioxydants qui se sont avérés incompatibles
avec l'aténolol (un bétabloquant) : l'acide ascorbique, l'acide
citrique et le butylhydroxyanisole (BHA).
II.1. Etude des DSC de mélanges binaires avec
des excipients existants dans la formulation des produits finis
Les mélanges binaires préparés sont
divisés en deux séries : la première est analysée
juste après leur préparation et l'autre est soumise à des
conditions de stress dans la chambre de vieillissement
accéléré.
Les conditions de stress choisies (40°C ,75%
d'humidité, mélanges 50:50 , à un séjour d'un mois)
ont comme but de favoriser et d'accélérer toute interaction
probable entre les principes actifs et les excipients
II.1.1. Etude thermique des mélanges binaires avec
l'acébutolol
La figure 19 présente les courbes DSC des
mélanges binaires préparés avec l'acébutolol avant
et après leurs mises sous conditions de stress.
INSAT Chapitre III : Résultats et
discussion

Aceb
Aceb lactose monohydrate
Aceb Mg stéarate
Aceb PVP
Aceb CS
Aceb lactose monohydrate CS
Aceb Mg stéarate CS
Aceb PVP CS
10
5
-10
-15
0
-5
Flux de chaleur (mW)
60 80 100 120 140 160
Température (°C)
Fig- 19 : Courbes DSC de l'acébutolol et
ses mélanges binaires avec le lactose monohydrate, le Mg stéarate
et le PVP avant et après conditions de stress (CS)
On remarque que la température de début de fusion
diminue pour les mélanges sans applications de conditions de stress de
1,2 à 1,8 °C (Tableau 10).
On observe aussi un changement au niveau de la forme des pics
révélant une modification de la cinétique de ce
phénomène pour le cas des mélanges avec le Mg
stéarate et le PVP.
On remarque aussi un phénomène endothermique
relatif à la fusion du Mg stéarate qui a lieu aux alentours de
110°C [20].
Pour le cas du mélange avec le PVP, le principe actif
présente la température de fusion la plus faible. Etant un
polymère, cet excipient à l'état pur fond dans un
intervalle de 100 à 150 °C (masse molaire moléculaire de
40.000 à 60.000 g.mol-1)
2012-2013 52
INSAT Chapitre III : Résultats et
discussion
2012-2013 53
Tableau 10 : Données issues des courbes
DSC de l'acébutol et ses mélanges binaires
sans l'application
de conditions de stress
|
Echantillon
|
ÄfH (kJ/kg)
|
Ton set (°C)
|
|
Aceb (principe actif)
|
112,7
|
140,1
|
|
Aceb + lactose monohydrate
|
96,9
|
138,4
|
|
Aceb + Mg stéarate
|
59,5
|
139,00
|
|
Aceb + Povidone
|
44,2
|
138,3
|
Il est intéressant de mentionner que l'énergie
de fusion des mélanges binaires est moins importante que celle de
l'acébutolol seul. Cette grandeur est normalement proportionnelle
à la quantité des principes actifs dans les prises d'essais
analysées. Puisque les mélanges sont préparés 50:50
on s'attend théoriquement à une énergie de fusion
égale à la moitié de celle du principe actif à
l'état pur (tableau (11)). Toute variation pourrait signifier la
présence d'interaction principe actif-excipient.
Tableau 11 : Comparaison des enthalpies de
fusion théoriques et expérimentales des
mélanges
binaires préparés avec l'acébutlol
|
Mélange binaire
|
Prise d'essais (%)
|
ÄfH théor (kJ/kg)
|
ÄfH exp (kJ/kg)
|
|
Aceb + lactose monohydrate
|
51,8
|
58 ,4
|
96,9
|
|
Aceb + Mg stéarate
|
51
|
57 ,5
|
59,5
|
|
Aceb + Povidone
|
49,9
|
56,2
|
44,2
|
Pour le mélange avec le lactose monohydrate, il est
à noter que la déshydratation de ce dernier se produit à
140°C [31]. Un chevauchement avec la fusion de l'acébutolol ait
lieu. En conséquence, l'enthalpie mesurée est relativement
importante.
Après la fusion du Mg stéarate et le PVP au sein
des mélanges à une température de fusion inférieure
à celle du principe actif, les granules de ce dernier se trouvent
entourées par des films d'excipient à l'état liquide ; le
processus relatif au transfert de
INSAT Chapitre III : Résultats et
discussion
2012-2013 54
chaleur n'est plus le même ce qui peut expliquer
l'allure du pic ainsi que la valeur de l'énergie mise en jeu.
Pour cette série de mélanges binaires, la fusion
du principe actif est soit précédée par celle d'un
excipient, soit chevauché à un phénomène
endothermique relatif à ce dernier (fusion ou déshydratation).
Ainsi, la variation de la température de début de fusion et de
l'énergie mise en jeu ne peut pas être considérée
significative d'interaction.
Les thermogrammes en trait discontinu (figure 19) montrent le
comportement des mélanges binaires et du principe actif seul
après leur séjour dans la chambre de vieillissement
accéléré.
Les résultats obtenus suite aux analyses des
échantillons sont résumés dans le tableau (12).
Tableau 12 : Données issues des courbes
DSC de l'acébutol et ses mélanges binaires
sous conditions de
stress
|
Echantillon
|
ÄfH (kJ/kg)
|
Ton set (°C)
|
|
Aceb (principe actif) CS
|
114
|
141,0
|
|
Aceb + Lactose monohydrate CS
|
105,8
|
138,7
|
|
Aceb + Mg stéarate CS
|
67,9
|
140,4
|
|
Aceb + Povidone CS
|
8,5
|
123,3
|
On constate que les énergies de fusion augmentent sauf
pour le povidone où le pic devient très large. En effet, ce
principe actif est très hygroscopique ; l'aspect de ce mélange
binaire s'est transformé d'une poudre jaunâtre à un
agglomérat brun.
On remarque aussi que le pic relatif au départ d'eau
devient plus prononcé pour le lactose monohydrate.
L'augmentation de l'enthalpie et de la température du
début de fusion du principe actif seul mène à la remise en
question de la stabilité du principe actif seul sous ces conditions.
INSAT Chapitre III : Résultats et
discussion
II.1.2. Etude thermique des mélanges binaires avec le
bétaxolol
La figure (figure 20) présente les courbes DSC du
bétaxolol et les mélanges binaires avant et après leurs
mises sous conditions de stress. Les résultats obtenus sont
présentés dans le tableau (13).
La température du début de fusion diminue
légèrement sauf pour le cas du mélange avec le Mg
stéarate, la fusion de ce dernier n'apparait pas comme prévue
à 110°C.
En effet, on peut expliquer ce décalage par le fait que la
fusion de cet excipient a eu lieu à une température
supérieure ; ce phénomène se trouve donc superposé
à la fusion du principe actif qui se fait à des
températures inférieures dans les mélanges.
On note aussi que la déshydratation du lactose est
observée à 127°C au lieu de 140°C.
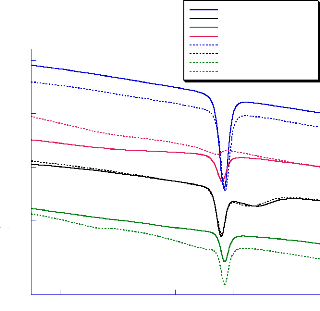
Beta
Beta lactose monohydrate
Beta Mg stéarate
Beta PVP
Beta CS
Beta lactose monohydrate CS
Beta Mg stéarate CS
Beta PVP CS
0
-5
-20
60 80 100 120 140
Flux de chaleur (mW)
-10
-15
Température (°C)
Fig- 20 : Courbes DSC de l'acébutol et
ses mélanges binaires avec le lactose monohydrate, le Mg stéarate
et le PVP avant et après conditions de stress
2012-2013 55
INSAT Chapitre III : Résultats et
discussion
2012-2013 56
Les résultats relatifs aux événements
thermiques sont présentés dans le tableau (13).
Tableau 13 : Donnés issues des courbes
DSC du bétaxolol et ses mélanges binaires
sans conditions de
stress
|
Echantillon
|
AfH (J/g)
|
Ton set (°C)
|
|
Beta (principe actif)
|
104,3
|
113,7
|
|
Beta + lactose monohydrate
|
47,1
|
112,8
|
|
Beta + Mg stéarate
|
37,2
|
114,2
|
|
Beta + Povidone
|
31,9
|
112,2
|
Comme le cas des mélanges avec l'acébutolol, une
estimation de l'enthalpie de fusion théorique est réalisée
pour les échantillons à base de bétaxolol (tableau
(14)).
Tableau 14 : Comparaison des enthalpies de
fusion théoriques et expérimentales des
mélanges
binaires préparés avec le bétaxolol
|
Mélange binaire
|
Prise d'essais (%)
|
AfH théor (J/g)
|
AfH exp (J/g)
|
|
Béta + lactose monohydrate
|
50,2
|
52,4
|
47,1
|
|
Béta + Mg stéarate
|
50,2
|
52,4
|
26,2
|
|
Béta + Povidone
|
49,5
|
51,6
|
31,9
|
Une diminution importante des enthalpies de fusion est
notée pour les différents mélanges.
Pour le mélange préparé avec le Mg
stéarate et le PVP, l'hypothèse de superposition de la fusion de
l'excipient et le bétaxolol n'est plus valable. En effet, un tel
phénomène provoque théoriquement l'augmentation de
l'enthalpie. Or, pour ces deux échantillons cette dernière est
réduite à moitié pour le Mg stéarate et à
environ 40% pour le PVP.
Concernant le lactose monohydrate, l'énergie est
comparable à la valeur théorique.
En examinant les thermogrammes des mélanges binaires
mis sous conditions de stress, on remarque que l'enthalpie et la
température de début de fusion ontlégèrement
varié à l'exception de l'échantillon préparé
avec le povidone (Tableau (15)).
INSAT Chapitre III : Résultats et
discussion
2012-2013 57
Tableau 15 : Données issues des courbes
DSC du bétaxolol et ses mélanges binaires
sous conditions de
stress
|
Echantillon
|
ÄfH (J/g)
|
Ton set (°C)
|
|
Beta (principe actif) SC
|
95,6
|
114,1
|
|
Beta + lactose monohydrate SC
|
44,3
|
112,9
|
|
Beta + Mg stéarate SC
|
40,9
|
114,3
|
|
Beta + Povidone SC
|
12,4
|
109,0
|
Le PVP a subi le même changement d'aspect que celui avec
l'acebutolol. De plus son enthalpie de fusion a diminué
considérablement par rapport à celle de l'échantillon
analysé juste après sa préparation.
Pour résumer, à partir de ces expériences on
constate que :
? les mélanges avec le PVP présentent plus de
décalage de point de vue énergie et température ;
? la température de début de fusion augmente
ainsi que l'énergie relative à la déshydratation
d'excipient pour la majorité des échantillons mis sous conditions
de stress.
Il est probable qu'une fois exposés à
l'humidité, une quantité importante d'eau se trouve à la
surface de ses particules pouvant former des liaisons hydrogènes avec
les fonctions alcools des principes actifs. Ainsi la fusion demanderait plus
d'énergie pour avoir lieu.
Les écarts de température sont inférieurs
à 10°C pour tous les mélanges étudiés. La
variation des températures de fusions peut être expliquée
par la thermochimie. Par contre les mécanismes mis en jeu restent
ambiguë pour plusieurs cas.
En revanche les variations des énergies de fusions
peuvent être considérées comme étant des
éléments de réponse révélant une interaction
entre les principes actifs et les excipients.
Concernant le PVP, il est intéressant de mentionner que
sa synthèse nécessite l'utilisation du peroxyde
d'hydrogène comme initiateur de polymérisation radicalaire.
L'excipient commercialisé renferme toujours des traces de l'initiateur
pouvant provoquer l'oxydation des principes actifs.
INSAT Chapitre III : Résultats et
discussion
2012-2013 58
Il s'avère alors nécessaire de vérifier la
possibilité d'incompatibilité chimique avec le PVP dans le cas
où il est ajouté à des quantités plus au moins
importantes dans la formulation pharmaceutique [20].
II.2. Etude des mélanges binaires avec les
excipients antioxydants
Le bétaxolol mélangé avec le BHA se
transforme de l'état solide à l'état liquide, par
conséquent on n'a pas pu suivre ni le comportement thermique du principe
actif ni sa structure cristalline.
II.2.1. Etude des DSC des mélanges binaires
La figure présente le comportement thermique de
l'acébutolol et du bétaxolol en présence des trois
excipients : l'acide ascorbique, l'acide citrique et le BH (figure 21).
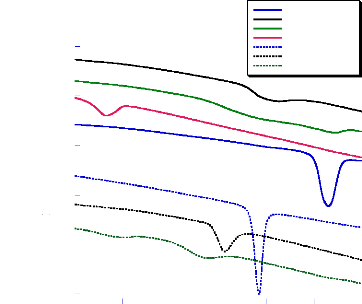
Aceb
Aceb acide ascorbique Aceb acide citrique Aceb BHA
Beta
Beta acide ascorbique Beta acide citrique
.
Flux de chaleur (mW)
-10
-15
0
-5
-20
-25
40 60 80 100 120 140 160
Température (°C)
Fig- 21 : Courbes DSC de l'acébutolol,
du bétaxolol et leurs mélanges binaires
avec l'acide
ascorbique, l'acide citrique et le BHA
INSAT Chapitre III : Résultats et
discussion
2012-2013 59
INSAT Chapitre III : Résultats et
discussion
Tableau 16 : Données issues des courbes
DSC de l'acébutolol et ses mélanges
binaires avec l'acide
ascorbique, l'acide citrique et le BHA
|
Echantillon
|
ÄfH (J/g)
|
Ton set (°C)
|
|
Aceb (principe actif)
|
114
|
141
|
|
Aceb + acide ascorbique
|
41,1
|
112
|
|
Aceb + acide citrique
|
13,4
|
135
|
Les données issues des thermogrammes sont
présentées dans le tableau (16).
On constate que les décalages de température du
début de fusion est très importants avec des pics endothermiques
larges pour les deux acides.
Le pic relatif à la fusion de l'acide citrique
(théoriquement à 153°C) n'a pas apparu entre 60-160 °C
; il est probable qu'elle soit chevauchée à celle du principe
actif.
Pour le cas du mélange avec l'acide ascorbique, seule
la fusion du principe actif figure au niveau de la courbe DSC puisque
l'excipient seul fond à 190°C.
Par contre, le thermogramme du mélange avec le BHA ne
présente qu'un seul phénomène endothermique
attribué à la fusion de l'excipient aux alentours de
45°C.
Pareil au mélange acébutolol-Mg stéarate,
le BHA, se trouvant à l'état liquide, peut solubiliser totalement
ou partiellement le principe actif ce qui provoque la disparition de son pic de
fusion.
Concernant les mélanges avec le bétaxolol, on
note l'apparition d'un pic endothermique large au niveau de la courbe DSC de
l'échantillon renfermant l'acide citrique : il s'agit d'une
évaporation de molécules d'eau au voisinage de 55°C, et le
pic correspondant à sa fusion ne figure pas entre 100-160°C
(tableau (17)).
La transition solide-liquide du principe actif se fait aux
alentours de 95°C. Ainsi le phénomène observé peut
être attribué soit à la fusion simultanée des deux
composants, soit il est relatif à la formation d'un autre
composé.
L'acide ascorbique semble avoir plus d'interaction avec
l'acébutolol qu'avec le bétaxolol.
2012-2013 60
En effet, un tel décalage de température de
fusion (largement supérieur à 10°C) et de l'énergie
relative à ce phénomène (très inférieures
à celle des principes actifs seuls) est souvent interprété
comme une incompatibilité chimique [32].
Tableau 17 : Données issues des courbes
DSC du bétaxolol et ses mélanges binaires
avec l'acide
ascorbique et l'acide citrique
|
Echantillon
|
ÄfH (J/g)
|
Ton set (°C)
|
|
Beta (principe actif)
|
104,261
|
113,652
|
|
Beta + acide ascorbique
|
62,3
|
97,4
|
|
Beta + acide citrique
|
51,2
|
83,2
|
Pour récapituler, il est évident que la DSC est
une technique rapide et fiable pour étudier la compatibilité au
sein des formulations pharmaceutiques solides.
Généralement, la modification de la forme d'un
pic (aspect cinétique ou/et énergétique) ou de son
emplacement impliquent automatiquement la présence d'une interaction
physique et/ou chimique.
Par ailleurs, il est indispensable de vérifier qu'aucun
mélange binaire principe actif-excipient étudié ne
coïncide avec la composition d'eutectique (changement de la nature
physique du mélange).
C'est un cas particulier de mélange solide où
les deux constituants se comportent comme un corps pur de point de vue
température de fusion (fusion et solidification à
température et composition constantes). Cette dernière a lieu
dans ce cas à des températures inférieures que celles des
deux constituant à l'état pur.
Les excipients subissant une transition solide-liquide avant
celle du principe actif - c'est le cas de Mg stéarate et le BHA-
provoquent une disparition par effet de la solubilisation de ce dernier et non
pas sa dégradation [32].
Tandis que ce phénomène peut parfois provoquer
une interaction chimique comme le cas de l'acide acétylsalicylique et le
Mg stéarate. En effet la formation de film d'excipient autour des
particules du principe actif favorise sa réaction de
décomposition [20].
INSAT Chapitre III : Résultats et
discussion
2012-2013 61
Pour le PVP, le processus est différent ; celui-ci peut
augmenter la réactivité de la substance thérapeutique
à cause de son caractère hygroscopique.
En effet, les molécules d'eau libres peuvent contribuer
à sa dégradation en modifiant le pH du microenvironnement.
Pour mieux comprendre la nature des interactions principe
actif-excipient, des mélanges binaires ont été
examinés par d'autres techniques (DRX, et dosage par HPLC). Les
mélanges dont les thermmogrammes ont présenté le plus de
décalage par rapport au principe actif pur ont été choisis
pour la suite de l'étude.
II.2.2. Analyse DRX des mélanges binaires
Afin de mieux comprendre les types d'interaction au niveau des
thermogrammes qui ont présenté une enthalpie très basse
par rapport à celle du principe actif, on a décidé d'avoir
recours à d'autres techniques comme la DRX et l'infrarouge.
Les diffractogrammes des mélanges binaires avec l'acide
ascorbique, l'acide citrique et le BHA sont présentés dans les
figures (figure 22 et figure 23).
La structure des principes actifs dans ces mélanges n'a
pas été modifiée. Les diffractogrammes montrent que leurs
cristallinités sont conservées avec l'apparition d'autres pics
correspondant aux excipients (Annexe 2).
Il est important de souligner que l'abaissement
systématique des pics
caractéristiques des principes actifs est simplement
dû à la diminution de leurs proportions dans les mélanges
(50% au lieu de 100% pour le produit pur).
L'évaluation de la cristallinité des
mélanges binaires préparés par rapport à celle du
principe actif seul est déterminée par la comparaison de la
largeur à mi-hauteur des différents pics.
On remarque que la cristallinité des deux principes
actifs diminue légèrement, surtout pour les mélanges avec
l'acébutolol.
INSAT Chapitre III : Résultats et
discussion

Aceb
Aceb acide citrique Aceb acide ascorbique Aceb BHA
*: Pic relatif à l'excipient
*
*
*
1,6 105
1,4 105
1,2 105
Intensité
1 105
8 104
6 104
4 104
2 104
0
2012-2013 62
6 7 8 9 10
20 (°)
Fig- 22 : Diffractogrammes des rayons X de
l'acébutolol et ses mélanges binaires
avec l'acide ascorbique,
l'acide citrique et le BHA

B eta
B eta acide citrique
B eta acide ascorbique
1,6 10 5
: Pic re latif à l'excipient
*
1,2 10 5
*
8 10 4
4 10 4
0
Intensité
9,5 10 10,5 11 11,5 12 12,5 13
20 (°)
Fig- 23 : Diffractogrammes des rayons X du
bétaxolol et ses mélanges binaires avec
l'acide ascorbique,
l'acide citrique et le BHA
L'étude par spectroscopie IR s'avère
indispensable dans le but d'évaluer la possibilité d'interaction
chimique.
INSAT Chapitre III : Résultats et
discussion
2012-2013 63
II.2.3. Analyse IR des mélanges binaires
L'analyse du spectre infrarouge a permis de déterminer les
bandes caractérisantes la structure chimique des substances
thérapeutiques.
Les tableaux ci-dessous présentent l'attribution des
bandes de vibration observées aux groupements fonctionnels des deux
molécules.
Tableau 18 : Les bandes de vibrations
caractéristiques de l'acébutolol chlorhydrate
|
Principe actif
|
Nombre d'onde (cm-1)
|
Nature de la vibration
|
|
Acébutolol
|
3273
|
N-H (amine secondaire)
|
|
2963-2840
|
C-H (alcane)
|
|
1661
|
C=O (cétone)
|
|
1596
|
C=O (amide)
|
|
1524
|
C-C (aromatique)
|
|
1097
|
C-O (éther)
|
|
1275-1228
|
O-H (alcool secondaire)
|
|
1242
|
C-N
|
Tableau 19 : Les bandes de vibrations
caractéristiques du bétaxolol chlorydrate
|
Principe actif
|
Nombre d'onde (cm-1)
|
Nature de la vibration
|
|
Bétaxolol
|
3234
|
N-H (amine secondaire)
|
|
2963-2840
|
C-H (alcane)
|
|
1606-1469
|
C-C (aromatique)
|
|
1244
|
C-O (éther)
|
|
1300
|
O-H (alcool secondaire)
|
|
1090
|
C-N
|
INSAT Chapitre III : Résultats et
discussion
2012-2013 64
En examinant les spectres JR (figure 24), on constate qu'une
nouvelle bande est apparue à 3400 cm-1 pour les trois
mélanges probablement relative à l'élongation des O-H
associés par des liaisons hydrogène ; elle est plus
prononcée pour le cas du mélange avec le BHA.
De plus, la bande correspondante à la liaison C=O de
l'amide devient plus large que celle du principe actif seul et se décale
vers des longueurs d'onde plus faibles pour les mélanges avec les deux
acides (figure 25).
On peut confirmer qu'il s'agit dans ce cas d'un
décalage et non pas d'une disparition totale du signal grâce
à la présence de la bande caractéristique de la liaison
C-N de l'amide dans le spectre de ces deux excipients.
On note les mêmes observations pour les oscillateurs
carbonyles (C=O) de l'acétone et de l'ester.
Un élargissement des bandes caractéristiques de
l'amine secondaire (N-H) et de l'alcool (O-H) est aussi remarqué.

N-H amine
Transmission (%)
*
*
*
*
*
*
*
*
*
* *
3800 3600 3400 3200 3000 2800 2600 2400 2200
Aceb
Aceb acide citrique Aceb acide ascorbique Aceb BHA
Nombre d'onde (cm-1)
Fig- 24 : Spedtre JR de l'acébutolol et
ses mélanges binaires avec l'acide
ascorbique, l'acide citrique et le
BHA (3800-2000 cm-1)
INSAT Chapitre III : Résultats et
discussion
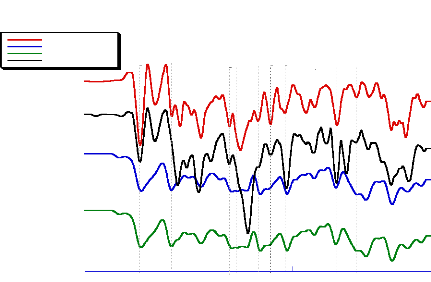
1500
1000
500
déformation N-H (amine)
O-H (alcool secondaire)
déformation N-H (amide)
C=O (amide)
C=O (cétone)
C-N (amide)
C=O (ether)
C-N
Transmission (%)
*
*
*
*
*
*
*
*
*
*
*
*
*
*
*
*
*
A ceb
A ceb acide citrique
A ceb acide ascorbique A ceb BH A
Nombre d'onde (cm-1)
Fig- 25 : Spectres JR de l'acébutolol
et ses mélanges binaires avec l'acide ascorbique,
l'acide citrique et
le BHA (2000-400 cm-1)
Comme l'acébutolol, la bande N-H du bétaxolol s'est
élargie surtout pour le cas du mélange avec l'acide citrique
(figure 26).
Cependant, la même bande est chevauchée avec celle
des groupements O-H associées avec des liaisons hydrogène pour le
mélange avec le BHA (figure 26).
Les spectres montrent que les bandes O-H obtenues par l'alcool
subissent aussi un élargissement (figure 27).
2012-2013 65
INSAT Chapitre III : Résultats et
discussion
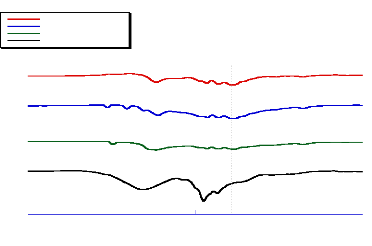
*
*
B eta
B eta acide ascorbique Beta acide citrique Beta BHA
4 0 0 0
3 5 0 0
3 0 0 0
2 5 0 0
2 0 0 0
*
* *
N ombre d 'o n d e (c m-1)
Transmission (%)
N-H amine (secondaire)
Fig- 26 : Spectres JR de bétaxolol et ses
mélanges binaires avec l'acide ascorbique, l'acide citrique et le BHA
(4000-2000 cm-1)
B eta
Beta acide ascorbique B eta acide citrique Beta B H A
|
C-C (aromatique)
|
O-H (alcool secondaire)
|
C-O (ether)
|
C-N
|
déformation N-H (amine)
|
1 8 0 0 1 6 0 0 1 4 0 0 1 2 0 0 1 0 0 0 8 0 0 6 0 0
N ombre d'onde ( c m- 1 )
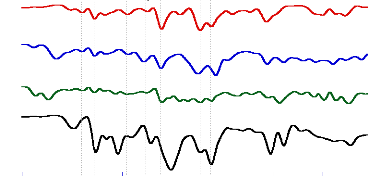
Transmission (%)
*
*
*
*
*
*
*
*
*
*
*
*
*
*
*
*
*
Fig- 27 : Spectres JR de bétaxolol et ses
mélanges binaires avec l'acide ascorbique, l'acide citrique et le BHA
(1500-600 cm-1)
2012-2013 66
INSAT Chapitre III : Résultats et
discussion
2012-2013 67
Après avoir attribué les bandes des oscillateurs
caractéristiques des différents échantillons, on n'a pu
constater des changements au niveau des spectres des mélanges par
rapport à ceux des principes actifs seuls.
En effet, les interactions non covalentes, comme les liaisons
hydrogènes, provoquent généralement un décalage des
signaux caractéristiques et un élargissement de bande des
groupements fonctionnels [33].
Il est probable que les groupements carboxyles de
l'acébutolol peuvent former des liaisons hydrogène avec les
fonctions alcools des trois excipients des mélanges examinés.
L'analyse qualitative des mélanges par IR ne suffit pas
pour s'assurer qu'aucune interaction covalente n'a eu lieu entre les principes
actifs et les excipients (impliquant la disparition ou l'apparition d'une ou
plusieurs bandes).
En effet, la réaction peut se produire avec un taux
d'avancement faible (systèmes solide-solide). Une comparaison des aires
des bandes observées d'un tel système à deux constituants
organiques semble être compliquée.
On peut avoir recours à une autre technique plus simple
: HPLC qui assure la séparation puis la quantification des
différentes substances existantes dans un mélange. Ainsi
l'apparition de tout nouveau produit sera détectée.
INSAT Conclusion et perspectives
2012-2013 68
Conclusion et perspectives
La maîtrise des facteurs pouvant assurés la
stabilité des médicaments, particulièrement de forme
galénique solide, constitue un enjeu essentiel pour l'industrie
pharmaceutique. L'étude des interactions éventuelles principe
actif-excipient permet de vérifier leur compatibilité au sein de
la formulation thérapeutique.
Ce travail a permis d'étudier la stabilité
physicochimique des produits finis formulés à base de trois
bétabloquants (acébutolol, bétaxolol, carvédilol)
commercialisés sous forme de comprimés. Tout d'abord, l'examen de
la cristallinité des principes actifs au sein des formulations par DRX
met en évidence leur stabilité de point de vue structural.
Ensuite, afin de mieux comprendre le comportement thermique des produits finis
par DSC, des mélanges binaires des excipients les plus usuels (lactose
monohydrate, Mg stéarate, PVP) ont été
préparés. Les échantillons ont été
analysés juste après leur préparation et après
avoir être mis à des conditions de stress (40°C, 75%
humidité, séjour de trois semaine) afin d'augmenter la
probabilité de toute interaction possible. Dans un deuxième lieu,
une évaluation de la compatibilité de l'acébutolol et du
bétaxolol avec trois excipients antioxydants est élaborée
par différentes techniques (DSC, DRX, IR).
Cette étude met en valeur l'utilité de la DRX
comme étant une technique indispensable à l'étude de
stabilité structurale par la détermination de la
variété polymorphique du principe actif. En outre, la DSC a
permis la caractérisation du comportement thermique de ce dernier. En
effet, les résultats obtenus par cette technique montrent une
éventuelle existence d'interaction principe actif-excipient. Cependant,
elle s'est avérée insuffisante pour cerner la nature de
l'interaction mise en jeu (physique ou chimique) et la technique infrarouge a
été complémentaire.
Les perspectives de ce travail peuvent être
abordées à deux niveaux. D'une part, il serait intéressant
d'élargir l'étude à d'autres systèmes binaires ou
ternaires dans le but d'investiguer l'effet de synergie de plusieurs excipients
au sein de la formulation médicamenteuse et même de
vérifier l'effet de la soumission à d'autres conditions de stress
plus sévère (température 70°C, séjours de
trois mois).
INSAT Conclusion et perspectives
2012-2013 69
Par ailleurs, l'emploi de la chromatographie liquide
couplée à la spectroscopie de masse permettra de mieux comprendre
la nature des interactions chimiques mises enjeu et confirmera les observations
réalisées par les techniques de caractérisation du
solide.
INSAT Références
bibliographiques
2012-2013 70
INSAT Références
bibliographiques
Références bibliographiques
[1] Stora D., Pharmacologie BP, Prophyre,
Wolters Kluwer, France, 2010.
[2] Talbert M., Gervais R., Guide pharmaco
clinique, Wolters Kluwer, France, 2011.
[3] Mathieu M., Jean F., Le manuel porphyre
du préparateur en pharmacie: préparation du BP, Wolters Kluwer,
France, 2008.
[4] Gad S., Pharmaceutical Manufacturing
Handbook: Production and Processes, John Wiley & Sons, 2008.
[5] Michel V., Médicaments, Le
Moniteur, Wolters Kluwer, France, 2007.
[6] Thomas J., Drug product development : a
technical review of chemistry, manufacturing and control information for the
support of pharmaceuticals compound licencing activities, Drug development and
industrial pharmacy, vol.2, pp. 939-958, 2003.
[7] Pifferi G, Santoro P., Pedrani M.,
Quality and functionality of excipients, Farmaco, vol. 55, pp. 1-14,
1999.
[8] ABBAS D., Thèse de doctorat,
Synthèse, étude physicochimique et préformulation d'un
dérivé pyrido [3,2g] quinoleine triméthyle, Faculté
de pharmacie de Marseille, 2010.
[9] Rowe C., Paul J., Marian E., Handbook of
Pharmaceutical Excipients, Pharmaceutical Press, 2009.
[10] Kalinkova G., Studies of beneficial
interactions between active medicaments and excipients in pharmaceutical
formulations, International Journal of Pharmaceutics, vol.1, N°187, pp.
1-15, 1999.
[11] Jackson K., Young D., Pant D.,
Drug-excipient interactions and their effect on the absorption, Pharm
Sci Technolo, vol.3, N°10, pp.336-345, 2005.
[12] Crowley P.J., Excipients as
stabilizers, PSTT, vol.2, N° 6, pp. 237-243, 1999.
[13] Odon P.,Borout K, Franc V.,
Carvédilol dissolution improvement by preparation of solid
disperssions with porous silica, International journal of pharmaceutics,
N°406, pp. 41-48, 2011.
[14] Vialpando M., Martens J., Van den Mooter G.,
Potential of ordered mesoporous silica for oral delivery of poorly
soluble drugs, Ther Deliv, vol.2, N°8, pp. 1079-91, 2011.
[15]
2012-2013 71
Shammaa R. N., Bashab M., A novel polymeric
solubilizer for optimisation of carvedilol solid dispersion : formulation
design and method of preparation, Powder technology, vol. 237, pp.406-414,
2013.
[16] Giorgio P., Patrizia R., The safety of
pharmaceuticals, Il Farmaco, N°58, pp.541-550, 2003.
[17] Daming G., Development of solid dosage
form compatibility studies on the active substance-excipients, vol. 14,
N°3, pp. 303-310, 2004.
[18] Narang A. S., Desai D., Badawy S.,
Impact of excipient interactions on solid dosage form stability, Drug
product science and technology, N°29, pp.2660-83, 2012.
[19] Crowley P.J., Luigi G. M.,
Drug-excipient interactions, Pharmaceutical technologie Europe,
N°582, pp.1-6, 2001.
[20] Bharate S.S., Bharateb S.B., Bajajc A.N.,
Interactions and incompatibilities of pharmaceutical excipients with
active pharmaceutical ingredients: a comprehensive Review, Journal of
excipients and food chemistry,vol.3, N°1, pp. 3-26, 2010.
[21] Wesolowski M., Rojek B.,
Thermogravimetric detection of incompatibilities between atenolol and
excipients using multivariate techniques, Journal of thermal analysis and
calorimetry, pp. 1-9, 2013.
[22] Vijay K., Ravi P.S., Satish M., Saranjit S.,
Compatibility of atenolol with excipients: LC-MS/TOF characterization
of degradation/interaction products, and mechanisms of their formation, Journal
of pharmaceutical and biomedical analysis, vol. 49, pp. 880-888, 2009.
[23] Larsen J., Cornett C., Jaroszewski J.W., Hansen
S.H., Reaction between drug substances and pharmaceutical excipients:
formation of citric acid esters and amides of carvedilol, Journal of
pharmaceutical and biomedical analysis, vol. 49, pp. 11-17, 2009.
[24] Lu J., Rohani S., Polymorphism and
crystallization of active pharmaceutical ingredients, vol.7, N°16, pp.
884-905, 2009.
[25] Bauer M., Polymorphisme
conséquence en pharmacie, Technique de l'ingénieur, P1098,
2005.
[26] Tapas A., Kawtikwar P., SakarkarD., An
improvement in physicochemical properties of carvedilol through spherically
agglomerated solid dispersions with PVP K30, Acta Poloniae Pharmaceutica,
vol.69, N°2, pp. 299-308, 2012 .
[27]
INSAT Références
bibliographiques
2012-2013 72
Teychené S., Thèse de doctorat,
Maîtrise du polymorphisme dans les procédés de
cristallisation de produits d'intérêts pharmaceutiques :
application à la cristallisation de l'eflucimibe, INSA, 2004.
[28] Les Bétabloquants, Module de Pharmacologie
Générale, Faculté de Médecine de Strasbourg,
2006.
[29] Drug Master File (acebutolol chloridride), Documentation
interne, Industie pharmaceutique Adwya.
[30] Hildesheim J., Finogueev S., Aronhime J. et al,
Brevet, US 7.485.663 B2, 2009.
[31] Dilip. M. R., Ravikiran Allada, K.V., Girish D. et
al, Dehydration of Lactose Monohydrate : Analytical and Physical
Characterization, Scholars Research Library Der Pharmacia Lettre, vol.3,
N°5, pp. 202-12, Inde, 2011.
[32] Tamiris A.J., Igor F.Z., Jerusa S.G., Marcello
G.T., Compatibility of sildenafil citrate and pharmaceutical
excipients by thermal analysis and LC-UV, Journal of thermal analysis, pp. 1-8,
Brésil, 2012.
[33] Frizon F., Josimar de Oliveira E., Donaduzzi C. M.,
Mitsui M. L. et al., Dissolution rate enhancement of loratadine in
polyvinylpyrrolidone K-30 solid dispersions by solvent methods, Powder
Technology, N° 235, pp.532-9, Brésil, 2013.
Netographie
[@1]
http://www.pubchem.ncbi.nlm.nih.gov
INSAT Annexes
2012-2013 73
Annexe (1)
Les différentes impuretés des excipients
utilisés pour la préparation des mélanges binaires et ses
incompatibilités connues [9,11]
|
Excipients
|
Impuretés
|
Incompatibilités
|
|
Lactose monohydrate
|
glucose, aldéhyde, acide formique
et acide
acétique
|
- Condensation de ses impuretés,
- Pouvoir catalytique des réactions d'hydrolyse sa
- Réactivité avec les molécules portant des
fonctions
amines primaires ou secondaire via le mécanisme de
Maillard.
|
|
Povidone
|
formaldéhyde peroxyde
et acide formique
|
- Réaction avec les aminoacides et les peptides
- Participation à l'hydrolyse du principe actif
- Sensibilite à la lumière.
|
|
Mg stéarate
|
MgO
|
- Formation d'hydrate,
- Catalyse de la dégradation hydrolytique
- Complexassion de certaines molécules par le Mg
|
INSAT Annexes
|
Acide ascorbique
|
acide erythorbique et ascorbate de sodium
|
Incompatible avec :
- methenamine, phenylephrine hydrochloride,
- maleate de pyrilamine, salicylamide, nitrite de sodium
et salicylate sodium.
Interfère avec certain dosage colorimétrique en
réduisant l'intensité de la coloration produite.
|
|
Acide citrique
|
acide fumarique, acide malique,
citrate de sodium et acide
tartarique
|
Incompatible avec : tartrate de potassium, carbonates
bicarbonates, acétates, sulfides, nitrates, sucrose ...
|
|
Butyl hydroxyanisole
|
Butyl hydroxytoluène
|
Agents oxydants
|
2012-2013 74
INSAT Annexes
Annexe (2)
Analyses des différents excipients
utilisés pour la préparation des
mélanges
binaires
Flux de chaleur (mW)
-10
-15
-20
-25
-30
-5
0

Lactose monohydraye Acide citrique Mg stéarate BHA
40 60 80 100 120 140 160
Température (°C)
Fig-1 : Caractérisation par
calorimétrie différentielle des excipients
2012-2013 75
INSAT Annexes
Intensité
2,5 105
3,5 105
1,5 105
2 105
3 105
5 104
1 105
0
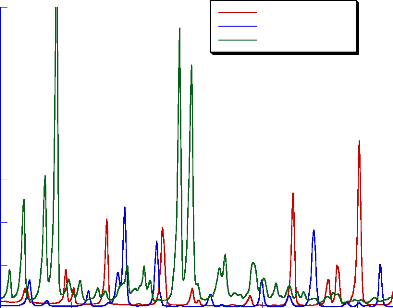
Acide ascorbique Acide citrique BHA
14 16 18 20 22 24 26 28
2? ???
Fig- 2 : Caractérisation par
Diffraction des rayons X des excipients
2012-2013 76
INSAT Annexes
|
BHA
Acide ascorbique A c eb acide citrique
|

Transmission (%)
2012-2013 77
|
3 5 0 0
|
3 0 0 0
|
2 5 0 0
|
2 0 0 0
|
1 5 0 0
|
1 0 0 0
|
5 0 0
|
Nombre d'onde (c m - 1)
Fig-3 : Caractérisation par IR des
excipients



