|
REPUBLIQUE DU CAMEROUN
***********
Paix - Travail - Patrie
|
REPUBLIC OF CAMEROON
***********
Peace - Work - Fatherland
|

UNIVERSITE DE DOUALA
***********
THE UNIVERSITY OF
DOUALA
***********
INSTITUT DES SCIENCES HALIEUTIQUES A YABASSI
***********
INSTITUTE OF FISHERIES AND
AQUATIC SCIENCES AT
YABASSI
***********

EFFET DU TYPE D'ALIMENT SUR LA CROISSANCE DE
OREOCHROMIS NILOTICUS
Rapport rédigé et soutenu en vue de
l'obtention du Diplôme d'Ingénieur de Travaux Halieute
Spécialité: AQUACULTURE
Octobre 2012
Par :
FANDA NGANDEU Jackson Privat
Matricule: 11B06537
1ère Promotion
|
REPUBLIQUE DU CAMEROUN
***********
Paix - Travail - Patrie
|
REPUBLIC OF CAMEROON
***********
Peace - Work - Fatherland
|

UNIVERSITE DE DOUALA
***********
THE UNIVERSITY OF DOUALA
***********
INSTITUT DES SCIENCES HALIEUTIQUES A YABASSI
***********
INSTITUTE OF FISHERIES AND
AQUATIC SCIENCES AT
YABASSI
***********

EFFET DU TYPE D'ALIMENT SUR LA CROISSANCE DE
OREOCHROMIS NILOTICUS
Rapport rédigé et soutenu en vue de
l'obtention du Diplôme d'Ingénieur de Travaux Halieute
Spécialité: AQUACULTURE
Octobre 2012
Par :
FANDA NGANDEU Jackson Privat
Matricule:
11B06537
SUPERVISEUR ENCADREURS
|
Pr. TOMEDI EYANGO Minette épse TABI
Maître de Conférences
|
Dr. POUOMOGNE Victor Chef de station IRAD de
Foumban
Dr MEKE SOUNG Pierre Nolasque Directeur
adjoint de l'ISH
|
DEDICACE
Aux familles
NGANDEU
Et
TCHOUTCHE
REMERCIEMENTS
Mes remerciements s'adressent à toutes les personnes
qui ont d'une manière ou d'une autre contribué à sa
réalisation :
Je voudrai ici exprimer ma profonde gratitude au Professeur
TOMEDI EYANGO Minette épouse TABI ABODO, Directrice de l'Institut des
Sciences Halieutiques (ISH), pour m'avoir fait découvrir le domaine
halieutique et pour sa supervision tout au long de ce travail.
Je remercie le Docteur POUOMOGNE Victor, Chef de la Station
Spécialisée de l'IRAD à Foumban pour m'avoir
accepté comme stagiaire au sein de la dite station. Ses conseils et son
soutien ont contribué à la réalisation de cette
étude.
Je remercie également le Docteur MEKE SOUNG Nolasque,
Directeur adjoint de l'ISH, mon encadreur académique pour m'avoir
guidé dans ce travail et le savoir qu'il a su me transmettre.
Je remercie tout le personnel de l'IRAD-Foumban, plus
précisément les encadreurs M. NJOUOKOU Salifou, M. SANDJOH
Rostand et les techniciens M. YIAGNIGNI Ousmanou et M. DIFFO Jean pour leur
disponibilité et les précieux apports tout au long du stage. Que
toute l'équipe trouve ici l'expression de ma profonde reconnaissance.
Je ne saurais oublier le Professeur Bruno BEKOLO EBE pour ses
multiples contributions pour notre bonne formation.
Je remercie très sincèrement le corps enseignant
de l'ISH, en particulier les enseignants du département d'aquaculture,
de qui je dois cette formation.
Mes remerciements à tous les camarades de promotion et
tous les étudiants de l'ISH pour les bons moments passés
ensemble.
Je remercie mes parents, mes oncles et tantes, mes
frères et soeurs, qui chacun à leur manière m'ont toujours
soutenu dans cette aventure.
A mes amis d'enfance et de la promotion 2007 à l'ISTDI,
plus particulièrement KENDI NOUMEU François, SIAKEN NGAKAM Jorez,
MINKO ELCANA Delors, pour leur encouragement tout au long de cette
formation.
SOMMAIRE Pages
DEDICACE iii
REMERCIEMENTS iv
SOMMAIRE v
LISTE DES TABLEAUX vii
LISTE DES FIGURES viii
LISTE DES ANNEXES viii
LISTE DES ABBREVIATIONS ix
RESUME x
ABSTRACT xi
INTRODUCTION 12
CHAPITRE I : DEFINITION DES CONCEPTS ET REVUE DE LA LITTERATURE
15
I.1. Définition des concepts 16
I.2. Revue de la littérature 17
2.1. Biologie et écologie de Oreochromis niloticus
17
2.1.1. Taxonomie, morphologie et exigences écologiques
17
2.1.2. Anatomie et physiologie du tube digestif 18
2.1.3. Régime alimentaire 18
2.1.4. Croissance et reproduction 18
2.2. Besoins nutritionnels de O. niloticus en
élevage intensif 19
2.2.1. Protéines 19
2.2.2. Lipides 20
2.2.3. Vitamines et minéraux 21
2.2.4. Energie 23
2.3. Quelques sous-produits agricoles et de l'industrie
agroalimentaire utilisables pour l'alimentation de
O. niloticus au Cameroun 24
2.3.1. Sous-produits de céréales : Son de
blé, son de riz, farine de maïs 24
2.3.2. Tourteaux d'oléagineux : Tourteau de soja, tourteau
de coton 24
2.3.3. Farines d'origine animale et les micro-ingrédients
25
2.3.4. Produits divers 25
CHAPITRE II : MATERIELS ET METHODES 27
II.1. Zone d'étude 28
1.1. Coordonnées géographiques 28
1.2. Relief 29
1.3. Sol 29
1.4. Hydrographie 29
1.5. Climat 29
1.6. Végétation 29
1.7. Faune 29
1.8. Population humaine 30
II.2. Données secondaires 30
3.1. Infrastructures d'élevage 30
3.2. Matériel biologique 30
3.3. Intrants alimentaires 31
3.4. Données collectées 33
II.4. Conduite de l'étude 33
II.5. Paramètres étudiés 34
II.6. Analyses statistiques 35
CHAPITRE III : RESULTATS ET DISCUSSION 36
3.1. RESULTATS 37
1.1. Effet de l'incorporation des tourteaux de soja et de coton
sur la Survie 37
1.2. Effet du type d'aliment sur les caractéristiques de
la croissance 37
1.3. Coûts alimentaires d'élevage 39
3.2. DISCUSSION 39
CONCLUSION ET RECOMMANDATIONS 41
REFERENCES BIBLIOGRAPHIQUES 43
ANNEXES 47
Tableau 1 : Quelques critères de qualité d'eau
exigée par les Tilapias 17
Tableau 2 : Besoins quantitatifs en acides aminés
essentiels de O. niloticus (g/16g N) 20
Tableau 3 : Besoins en vitamines des Tilapias 22
Tableau 4 : Exemple de prémix minéral pour les
Tilapias 23
Tableau 5 : Résumé des teneurs en divers nutriments
relativement aux besoins et contraintes 24
de fabrication de l'aliment chez les tilapias 24
Tableau 6 : Synthèse sur les ingrédients potentiels
26
Tableau 7 : Valeurs des analyses bromatologiques des intrants
alimentaires 31
Tableau 8 : Formulation et composition biochimique des
régimes alimentaires 32
Tableau 9 : Valeurs des paramètres physico-chimiques de
l'eau enregistrés 34
Tableau 10 : Variation du taux de survie (%) en fonction de la
période d'élevage 37
Tableau 11 : Evolution du poids moyen individuel (g) des poissons
par régime alimentaire. 37
Tableau 12 : Valeurs (moyenne #177; écart-type) des
caractéristiques de la croissance des poissons 38
par différents traitements 38
Tableau 13 : Coût alimentaire de production d'un kg de
poisson 39
Figure 1 : Carte de la zone d'étude 28
Figure 2 : Evolution du poids moyen à différents
régimes en fonction du temps 38
Annexe 1 : Vue d'ensemble de l'infrastructure 47
Annexe 2 : Vue d'un hachoir à granuler 47
Annexe 3 : Récapitulatif des pêches de
contrôle 48
Annexe 4 : Quantité cumulée d'aliments
distribués (g) 48
Annexe 6 : Kit de mesure des paramètres
physicochimiques de l'eau 49
Annexe 7 : Vidange d'un bac à la fin de
l'expérimentation 50
Annexe 8 : Aspect morphologique du tilapia O. n 51
Annexe 9 : Résultats des analyses statistiques 51
LISTE DES ABBREVIATIONS
AAE: Acides amines essentiels
AAFCO : Association of American Feed Control
Officials
CEP: Coefficient d'efficacité
protéique
CIJ : Croissance individuelle
journalière
CMV: Complexe minéro-vitaminique
IC: Indice de consommation
IRAD: Institut de la recherche pour
l'agriculture et le développement
ISH: Institut des sciences halieutiques
ISTDI: Intitut supérieure des
technologies et du design industriel
O.n: Oreochromis niloticus
TCS: Taux de croissance spécifique
TS: Taux de survie
RESUME
Afin de réduire la pression par la pêche sur les
ressources halieutiques destinées à la production de la farine de
poisson utilisée en aquaculture et la compétition
vis-à-vis de l'Homme, cette étude réalisée à
la station de Koupa Matapit IRAD Foumban durant la période d'Avril
à Juillet, a pour but de tester l'effet du type d'aliment sur la
croissance de O. niloticus. A cet effet, les poissons ont
été soumis à trois régimes isoprotéiques (35
% de protéines brutes) R0 (farine de poisson, tourteau de coton, farine
de maïs, son de blé et de riz, CMV), R1 (tourteau de soja et de
coton, farine de maïs, son de blé, farine d'os et huile
végétale) et R2 (tourteau de soja et de coton, farine de
maïs, son de riz, farine d'os et huile végétale).
Les juvéniles de tilapias (2,8 #177; 0,67) g, repartis
en triplicatas dans 9 bacs en bétons de 0,77 m3 de capacité,
étaient nourris avec des aliments expérimentaux pendant 50 jours.
Les aliments étaient distribués manuellement 3 fois par jour,
tous les jours de la semaine. Une pêche de contrôle de
différents paramètres zootechniques a été
réalisée à mi-élevage et les rations alimentaires
réajustées.
Les principaux résultats bien que préliminaires
montrent un taux de survie supérieur à 98 % dans tous les
traitements. Les poids moyens finaux observés sont de 14,9 #177; 3,53 g
(R0) ; 15,5 #177; 3,40 g (R1) et 13,5 #177; 2,63 g (R2) et un taux de
croissance spécifique variant de 3,08 #177; 0,40 à 3,35 #177;
0,44 %/j. Les taux de conversion respectifs correspondants sont de 1,6 #177;
0,47 ; 1,6 #177; 0,46 et 1,7 #177; 0,48.
L'analyse économique des résultats
zootechniques, obtenus à l'issue des expérimentations, montre que
les coûts de production du kilogramme de poisson des aliments tests R1 et
R2 sont de 480,11 et 537,26 FCFA contre 629,6 FCFA pour l'aliment témoin
R0.
Le régime R1 présente de meilleurs
résultats. Mais des études sur l'analyse bromatologique des
ingrédients et l'analyse de la qualité nutritionnelle et
organoleptique des poissons devront compléter ce travail.
Mots-clés : Nutrition, alimentation, tilapia O.
niloticus, performances de croissance.
ABSTRACT
To reduce the pressure by peach on the halieutic resources
intended for the production of the fish meal used in fish farming and the
competition towards the Man, this study conducted in Koupa Matapit IRAD
Foumban's station aims at testing the effect of the substitution of the flour
by two oilseed cakes (cotton and soya) in the production of O.
Niloticus. For that purpose, fishes were submitted to three isoproteic
regimes (35 % of crude proteins) R0 (fish meal, cotton cake, cornstarch, sound
of wheat and rice, CMV), R1 (cake of soya and cotton, meal of maize, bran of
wheat, meal of bone and vegetable oil) and R2 (cake of soya and cotton, meal of
maize, bran of rice, meal of bone and vegetable oil).
The juvenile tilapias (2,8 #177; 0,67) g, distributed in
triplicatas, in 9 tubs in concretes of 0,77 m3 of the capacity there, were fed
with experimental food during 50 days. Food was manually distributed 3 times a
day, every day of the week. A peach of control of various zootechnic parameters
was built at the middle-breeding and the straightened daily food rations.
The preliminary results of the study show rates of survival
greater than 98 % in all the treatments. The observed final middleweight is
14,9 #177; 3,53 g (R0 ), 15,5 #177; 3,4 g R1 ) and 13,5 #177; 2,63 g ( R2) and
a specific growth rate varying 3,08 #177; 0,4 to 3,35 #177; 0,44 % / j. The
corresponding respective rates of conversion are 1,6 #177; 0,47; 1,6 #177; 0,46
and 1,79 #177; 0,48.
The economic analysis of the zootechnic results, obtained at the
end of the experiments, shows that the production costs of the kilogram of fish
of food test R1 and R2 is 480,11 and 537,26 FCFA against 629,6 FCFA for the
food witness R0.
The R1 diet presents better results. But studies on the
bromatologic analysis of the ingredients and the analysis of the nutritional
and organoleptic quality of fishes will must to complete this work.
Keywords: Nutrition, food, tilapia O. niloticus,
performances of growth.
INTRODUCTION
Contexte :
L'aquaculture reste un secteur en expansion, dynamique et
important pour la production d'aliments à forte teneur en
protéines. La production mondiale de poissons de consommation issus de
l'aquaculture, y compris les poissons eux-mêmes, les crustacés,
les mollusques et d'autres animaux aquatiques propres à la consommation
humaine, aurait atteint 59,9 millions de tonnes en 2010. Au cours de la
période 1980-2010, la production de poissons de consommation issus de
l'aquaculture a augmenté en moyenne de 8,8 pour cent par an (FAO, 2012).
Malgré l'essor important que connait la production mondiale issue de
l'aquaculture, ce secteur n'a pas encore atteint une dimension
économique viable en Afrique, que ce soit en termes de volume ou en
termes de place de cette activité dans les autres systèmes de
production (Lazard et al., 1991)
Etant donné que le poste alimentation représente
une part importante du coût de production des poissons en aquaculture
intensive, l'intérêt économique de ce type d'élevage
est donc très dépendant de la disponibilité et du
coût des aliments (Tacon, 1996; Hoffman et al, 1997). Ainsi, la
réduction des charges liées à l'alimentation, et par
conséquent la maitrise du coût de production des poissons de
table, est l'une des priorités en pisciculture (Jauncey et Ross, 1982).
La farine de poisson est en général la composante majeure des
aliments en aquaculture. En effet, elle est riche en acides aminés
essentiels (AAE) dont le profil correspond remarquablement aux besoins des
poissons. Cette source conventionnelle de protéines représente 40
à 60% des protéines totales dans les aliments standards pour les
Tilapias (NRC, 1990). Son prix d'achat élevé et
l'irrégularité de sa qualité ont orienté les
recherches vers des sources alternatives de protéines, en particulier
végétales, qui ne sont pas directement utilisables pour la
consommation humaine. Les sous-produits agricoles en l'occurrence le tourteau
de soja, tourteau de coton, farine de maïs, son de blé et son de
riz sont localement disponibles et assez bon prix. D'après Liebert et
Portz (2005), ces sous-produits agricoles sont des composantes
énergétiques et protéiques.
Problématique :
La farine de poisson est le composant majeur des aliments du
poisson en aquaculture, ce qui créée une compétition
vis-à-vis de l'homme ; tout comme la demande en aliments d'aquaculture
augmente la pression par pêche sur les ressources halieutiques sauvages.
La nutrition du poisson représente 50 - 60% des coûts de
production. Remplacer l'aliment à base de la farine de poisson par celui
à base des tourteaux de soja et coton pourrait réduire les
coûts de production et améliorer la rentabilité des
exploitations.
Objectif général :
Contribuer à l'effet des aliments locaux sur la croissance
des alevins de Oreochromis niloticus.
Objectifs spécifiques :
? Evaluer l'effet de l'incorporation des tourteaux de soja et de
coton sur la survie. ? Comparer les caractéristiques de la
croissance enregistrées.
? Evaluer les coûts alimentaires d'élevage.
Organisation du travail :
Le présent rapport débute par une revue de
littérature (chapitre 1) faisant la synthèse des connaissances
sur la biologie, l'écologie, les besoins nutritionnels de
Oreochromis niloticus et un recensement de quelques sous-produits
agricoles utilisables pour son alimentation au Cameroun.
Le deuxième chapitre de ce travail porte sur
l'étude expérimentale de la valeur nutritionnelle des aliments
formulés sur la croissance de Oreochromis niloticus en bacs
bétonnés (chapitre 2). Elle présente d'abord la zone
d'étude, ensuite les données collectées, avant de
décrire la conduite de l'étude et les paramètres
étudiés.
Et le troisième chapitre traite des résultats
obtenus et de leur discussion.
CHAPITRE I : DEFINITION DES CONCEPTS ET REVUE DE LA
LITTERATURE
I.1. Définition des concepts
Alimentation : action de donner à
manger
Aliment : substance minérale ou
organique susceptible d'être ingérée par l'animal et
pouvant contribuer à sa croissance. (POUOMOGNE, 2012. Support de
cours)
Digestibilité : elle exprime la
quantité de nutriments supposée absorbée par l'animal par
différence entre la quantité ingérée et la
quantité excrétée dans les fèces.
(wikipédia)
Formulation : c'est la technique de
l'élaboration des aliments composés.
Ingrédient : substance alimentaire
entrant dans la composition d'une ration. (Larousse, 2010)
Nutriment : substance alimentaire pouvant
être assimilée directement et entièrement sans avoir besoin
de subir des transformations digestives. (Hachette)
Nutrition : science qui étudie la
transformation ou l'utilisation des aliments pour la croissance et
l'activité d'un être vivant. (Larousse, 2010)
Ration : quantité totale d'aliments
fournie à un animal au cours d'une période de 24 heures. (AAFCO,
2000)
Régime alimentaire :
ingrédients alimentaires ou mélange d'ingrédients, y
compris l'eau, qui sont consommés par les animaux. (AAFCO, 2000)
Sons : résidus obtenus après
séparation de la farine par tamisage. (wikipédia)
Tourteaux : résidus solides obtenus
après extraction de l'huile des graines ou des fruits de plantes
oléagineuses. (wikipédia)
Loin d'être exhaustif, ce glossaire est
complété par d'autres termes techniques comme : taux de
croissance spécifique, gain de poids, etc. (indices pour
estimer la croissance des poissons) ; indice de consommation,
coefficient d'efficacité protéique (indices pour
caractériser l'efficacité d'utilisation des aliments mis en
essai), et bien d'autres qui sont clairement définis dans le rapport.
I.2. Revue de la littérature
2.1. Biologie et écologie de Oreochromis
niloticus
2.1.1. Taxonomie, morphologie et exigences
écologiques
L'espèce Oreochromis niloticus fait partie du
genre Oreochromis, famille des Cichlidés, ordre des
Perciformes, classe des Actinopterygii, super classe des Ostéichtyens,
sous embranchement des Vertébré, embranchement des Chordés
du règne Animal.
Oreochromis niloticus est un incubateur buccal. La
femelle élève toujours ses petits dans la bouche.
On le reconnaît à ses rayures verticales sur la
nageoire caudale. D XVII - XVIII rayons durs ; 12 - 14 rayons mous. La ligne
latérale supérieure couvre 21 à 24 écailles, la
ligne latérale inférieure couvre 14 à 18 écailles.
Il possède 21 à 26 branchiospines sur le bas du premier arc
branchial et 5 à 7 branchiospines en haut du premier arc branchial. La
papille génitale des mâles est allongée alors que chez les
femelles, elle est courte et présente une fente transversale en son
milieu : c'est l'oviducte situé entre l'anus et l'orifice
urétral.
O. niloticus est un poisson thermophile (qui aime les
températures élevées) qui préfère les
températures de l'eau de 14 à 35°C et en conditions
extrêmes, il peut supporter des températures de 7 à
41°C pendant plusieurs heures (Balarin et Hatton, 1979). Il supporte une
salinité de 0,015 à 30 %o et un pH de 8 à 11. Il peut
supporter de vivre plusieurs heures à des teneurs en oxygène
dissous de l'ordre de 0,1 ppm (Mélard, 1986). Tout ceci explique la
grande variabilité de son habitat naturel ou d'introduction. (Tableau
1)
|
Tableau 1 : Quelques critères de qualité
d'eau exigée par les Tilapias
|
|
Paramètres physico-chimiques de l'eau
|
Valeurs
|
|
Gamme de température (°C)
|
8 - 40
|
|
Limite létale en oxygène (mg/l)
|
2 - 3
|
|
pH : gamme de tolérance
|
5 - 11
|
|
Concentration létale en CO2 (mg/l)
|
>72.6
|
|
Concentration létale en NH3 - NH4+ (mg/l)
|
>4 à pH 7.3 - 7.5
|
|
Turbidité (ppm)
|
13 000
|
|
Salinité %o
|
<20 - 35
|
|
Source : Balarin et Hatton, 1979
|
|
2.1.2. Anatomie et physiologie du tube digestif
L'appareil digestif de O. niloticus est simple et peu
spécialisé. On distingue schématiquement et dans l'ordre
antéro-postérieur : les dents (maxillaires et pharyngiennes),
l'oesophage, un estomac en forme de sac, et un long et sinueux intestin
caractéristique des animaux à chaîne alimentaire courte.
Une étude histologique de l'estomac de O. niloticus
révèle une structure autorisant une grande
possibilité de distension, d'où une accommodation facile en cas
de larges variations dans la quantité des particules
ingérées. L'intestin est différencié en un
duodénum antérieur court à parois minces, et une section
postérieure très longue, avec un plus petit diamètre. La
longueur totale de l'intestin entier varie de 5 à 8 fois la longueur du
corps (Moriarty, 1973).
La prise alimentaire en milieu contrôlé a lieu
essentiellement en période éclairée, et
l'ingéré met 9 à 11 heures pour traverser le tube digestif
chez l'adulte et moins de 2 heures chez le juvénile (Bowen, 1982).
2.1.3. Régime alimentaire
Plusieurs travaux relatifs aux contenus stomacaux de O.
niloticus révèlent qu'en milieu naturel l'espèce est
essentiellement phytoplanctonophage, mais peut aussi ingérer des algues
bleues, du zooplancton ainsi que des sédiments riches en
bactéries et diatomées (Moriarty, 1973).
Il convient de relever que l'acidité gastrique
particulièrement forte chez O. niloticus lui permet
d'être parmi les rares espèces à pouvoir digérer les
cyanophycées (abondante source de protéines) sans concurrence
notable avec d'autres espèces piscicoles dans l'écosystème
aquatique (Lauzanne, 1988). Cette capacité phénoménale
d'adaptation à divers aliments et déchets est à la base de
sa haute potentialité pour la pisciculture.
En milieu artificiel, cette espèce est pratiquement
omnivore, valorisant divers déchets agricoles (tourteaux
d'oléagineux, sons, etc.), tirant parti des excréments de porcs
ou de volailles, de déchets ménagers, acceptant facilement des
aliments composés sous forme de granulés ou
pulvérulent.
2.1.4. Croissance et reproduction
En général, O. niloticus est connue
pour sa croissance rapide, elle présente un indice
de croissance plus performant que les autres espèces de
tilapia (Pauly et al. , 1988). Sa durée de vie est relativement
courte (4 à 7 ans), sa vitesse de croissance est extrêmement
variable selon les milieux. Dès que les individus atteignent l'âge
de maturité, les sujets mâles présentent une croissance
plus rapide que les femelles et atteignent une taille nettement
supérieure, dans de petites surfaces (Lowe-Mc Connell, 1982).
Pour ce qui est de la reproduction, dans les milieux naturels,
la taille de première
maturation de O. niloticus varie
généralement entre 14 et 20 cm (Ruwet et al., 1975) soit
environ deux mois d'élevage et 35g. Toutefois, cette taille de
maturité peut varier au sein d'une même
population en fonction des conditions fluctuantes du milieu
(déficit alimentaire qualitatif et quantitatif, dimensions
réduites du milieu, etc.). La période de reproduction de cette
espèce est exponentiellement continue pendant toute l'année (07
à 08 pontes par an), si la température de l'eau est de 25
à 28°C, il peut se reproduire tous les 30 à 40 jours (Ruwet
et al., 1975). Ainsi, quand mâles et femelles sont
élevés ensemble, la population s'accroît rapidement et l'on
peut obtenir en fin de cycle beaucoup d'individus « nains »
difficilement commercialisables. Parmi les méthodes
préconisées pour pallier ce défaut, l'association à
un prédateur Hemichromis fasciatus apparaît dans
l'état actuel des connaissances comme la solution la plus
adaptée.
2.2. Besoins nutritionnels de O. niloticus en
élevage intensif
2.2.1. Protéines
Il existe une abondante littérature sur les besoins ou
les teneurs optimales en protéines des rations destinées aux
tilapias. Selon la taille des poissons et la teneur énergétique
des rations, les taux de protéines brutes recommandés peuvent
varier de 25 à plus de 35 % (De Silva et al., 1985). Jauncey et
Ross (1982) suggèrent un optimum de 40 % avec un rapport
protéines/énergie (P/E) de 27,75 mg/kJ. Wang et al.
(1985), qui utilisent des régimes purifiés contenant de la
caséine et de la cellulose en teneurs variables, rapportent que la
meilleure croissance d'alevins de O. niloticus (3 - 10 g) est
réalisée avec un régime à 40 % de protéines
et contenant un niveau d'énergie digestible suffisant pour le poisson.
Les niveaux d'ingestion pour une croissance maximale avec un tel régime
sont estimés à 502 - 543 kJ d'énergie digestible et 1,6 -
1,7 g d'azote/kg de poids vif/jour (soit un rapport PD/ED de 20 mg/kJ). Kaushik
et al. (1993) trouvent des valeurs proches de ces dernières :
le maximum de croissance est obtenu avec un régime à 32 % de
protéines brutes et un rapport PD/ED de 18mg/kJ, le besoin optimum en
protéines étant estimé à 10-12g/kg de poids
vif/jour.
Les travaux relatifs aux besoins en acides aminés des
tilapias sont peu nombreux.
Mazid et al. (1979) effectuant des tests avec
Tilapia zillii rapportent que les tilapias ont besoin des mêmes
10 acides aminés essentiels que les autres poissons. Jauncey et al.
(1983) quantifient ces besoins avec le tilapia O. mossambicus, en
estimant la rétention relative d'acides aminés dans la carcasse
du poisson. D'autres données obtenues en évaluant l'incidence sur
la croissance d'une supplémentation graduelle de chaque acide
aminé chez O. niloticus nous sont rapportées par
Santiago et Lovell (1988). Kaushik et al. (1993) trouvent des valeurs
proches de ces dernières. (Tableau 2).
Tableau 2 : Besoins quantitatifs en acides
aminés essentiels de O. niloticus (g/16g N)
Acides aminés Besoins quantitatifs (g/16g N)
|
Arginine
|
4.20
|
|
Histidine
|
1.72
|
|
Isoleucine
|
3.11
|
|
Leucine
|
3.39
|
|
Lysine
|
5.12
|
|
Méthionine
|
2.68
|
|
Méthionine + cystine
|
3.21
|
|
Phénylalanine
|
3.75
|
|
Phénylalanine + tyrosine
|
5.54
|
|
Thréonine
|
3.75
|
|
Tryptophane
|
1.00
|
|
Valine
|
2.80
|
|
Source : Santiago et Lovell, 1988
|
|
2.2.2. Lipides
|
|
L'apport de lipides dans l'alimentation des poissons est
d'abord indispensable pour satisfaire les besoins en acides gras essentiels,
acides gras non synthétisés par l'organisme et nécessaires
au métabolisme cellulaire (pour la synthèse des prostaglandines
et composés similaires) ainsi qu'au maintien de
l'intégrité des structures membranaires. Les lipides servent
aussi de vecteur lors de l'absorption intestinale des vitamines liposolubles
(vitamines A, D, E, K) et des pigments caroténoïdes.
Enfin, les lipides, généralement bien
digérés, jouent également un rôle majeur pour la
fourniture d'énergie, rôle d'autant plus important chez les
poissons que la majorité de ces
derniers digèrent mal les glucides complexes (Guillaume
et al., 1999). La quantité de lipides à apporter pour un
régime dépend de la source de matières grasses et de
l'équilibre protéines énergie du régime. En
utilisant des régimes isocaloriques à teneurs en lipides
variables, De Silva et al. (1985) mettent en évidence une
épargne des protéines chez l'alevin du tilapia rouge, qui
augmentait avec l'incorporation croissante des lipides dans le régime,
jusqu'à un maximum de 18 %.
Takeushi et al. (1983) ont montré que chez les
tilapias, le besoin en acides gras de la série oméga 6 (acide
linoléique 18 : 2??6) est plus important. Ils montrent que l'apport
d'acides gras
autres que le 18 : 2??6 ne stimule pas la croissance chez
O. niloticus. Ils évaluent ce besoin à 0,5 % du
régime.
2.2.3. Vitamines et minéraux
Des études ont été
réalisées sur les besoins en plusieurs vitamines chez les
tilapias (Tableau 3). Un fait qu'il convient de relever toutefois réside
dans la possibilité de synthèse de certaines vitamines par les
bactéries du tube digestif des tilapias ; chez O. niloticus,
les densités de populations bactériennes (109 à
1010/g de tube digestif) sont ainsi capables de couvrir en
totalité les besoins en vitamine B12 de ce poisson (Lovell et
Limsuwan, 1982), Sugita et al. , 1990, 1991). En attendant que des
travaux ultérieurs permettent de compléter les données sur
les besoins effectifs de toutes les vitamines chez les tilapias, Tacon et
al. (1982) ont proposé un prémix vitaminique pour
tilapia sur la base des besoins connus chez les salmonidés (Halver,
1979) (Tableau 3).
Si les besoins chez les salmonidés ont retenu
l'attention de plusieurs auteurs, aucun travail hormis sur le phosphore
(Watanabe et al., 1980 ; Viola et al., 1986 ; Viola et al., 1988) n'a
été réalisé chez les tilapias. Viola et
al. (1986) puis Viola et Arieli (1988) suggèrent d'apporter 0,7% de
phosphore dans les régimes destinés à l'adulte et 1% pour
les plus jeunes. En se référant aux besoins chez les
salmonidés, Tacon et al. (1983) ont proposé un prémix
minéral pour l'élevage des tilapias en structure hors-sol
(Tableau 4).
Tableau 3 : Besoins en vitamines des
Tilapias
|
Vitamines
|
Prémix (1) (g/kg prémix)
|
Besoins (g/kg aliment)
|
|
Thiamine (Vit B1)
|
2.5
|
-
|
|
Riboflavine (Vit B2)
|
2.5
|
6(2)
|
|
Pyridoxine (Vit B6)
|
2.0
|
-
|
|
Acide pantothénique
|
-
|
10(3)
|
|
(Pantothénate)
|
5.0
|
-
|
|
Inositol
|
100
|
-
|
|
Biotine (Vit H)
|
0.3
|
-
|
|
Acide folique
|
0.75
|
-
|
|
Acide para-N-benzoïque
|
2.5
|
-
|
|
Choline
|
200
|
26 - 125(4)
|
|
Niacine (acide nicotinique ou Vit P.P.)
|
10
|
-
|
|
Cyanocobalamine (Vit B12)
|
0.005
|
-
|
|
Rétinol (Vit A)
|
-
|
-
|
|
(Palmitate de ...)
|
-
|
-
|
|
á-Tocophérol
|
-
|
50 - 100(5)
|
|
(Acétate de ...)
|
20.1
|
-
|
|
Vit K
|
2.0
|
-
|
|
Acide ascorbique (Vit C)
|
50
|
50(6)
|
|
|
25(7)
|
|
Cholécalciférol (Vit D3)
|
-
|
-
|
Sources : (1) Tacon et al., 1983 (incorporer au taux de
2% dans l'aliment sec).
(2) Soliman et Wilson, 1992a ; (3) Roem et al., 1991 ;
(4) Shiau et Suen, 1992 ; (5) Satoh et al., 1987 (5% de lipide dans
l'aliment) ; (6) Stickney et al., 1984 ; (7) Roem et al.,
1990
Tableau 4 : Exemple de prémix minéral
pour les Tilapias
Minéraux Besoin pour tilapia (en eau douce, g/kg)
Orthophosphate de Ca (CaHPO4, 2H2O) 727,7775
Phosphore 0.51
Sulfate de Mg : MgSO4, 7H2O 127,5000
Chlorure de Na : NaCl 60,0000
Chlorure de K : KCl 50,0000
Sulfate de Fe : FeSO4, 7H2O 25,0000
Sulfate de Zn : ZnSO4, 7H2O 5,5000
Sulfate de Mn : MnSO4, 4H2O 2,5375
Sulfate de Cu : CuSO4, 5H2O 0,7850
Sulfate de Co : CoSO4, 7H2O 0,4775
Iodure de Ca: CaIO3, 6H2O 0,2950
Chlorure de Cr : CrCl3, 6H2O 0,1275
Source : Pouomogne, 1994
2.2.4. Energie
L'efficacité dans l'utilisation des nutriments d'un
régime chez le poisson est généralement
appréciée en terme de pourcentage de rétention des
protéines ou d'énergie. Kaushik et al. (1993) estiment
les besoins énergétiques d'entretien de O. niloticus
à 70 kJ/kg de poids vif/j (température 28-30°C). Par
rapport aux autres espèces, O. niloticus fixe de manière
générale avec une meilleure efficacité les
protéines ingérées. Luquet (1993) rapporte ainsi que le
taux de fixation des protéines et d'énergie est supérieure
à 55% chez cette espèce, contre 30-50 % chez la truite
arc-en-ciel, le poisson-chat américain ou la carpe. La rétention
de l'énergie sous forme non protéique serait par contre beaucoup
plus faible chez le tilapia (30-41 %).
Le tableau 5 résume les données sur les teneurs
recommandées en divers nutriments par rapport aux besoins des poissons
et les contraintes de fabrication de l'aliment chez les tilapias.
Tableau 5 : Résumé des teneurs en divers
nutriments relativement aux besoins et contraintes de fabrication de l'aliment
chez les tilapias
|
Nutriments
|
Classe des tailles
|
|
Aliments de
démarrage jusqu'à
0,5g (%)
|
0,5g à 10g
(%)
|
10 à 35g
(%)
|
35g à la taille
marchande
(%)
|
Géniteurs
(%)
|
|
Protéines brutes
|
50
|
35-40
|
30-35
|
25-30
|
30
|
|
Lipides bruts
|
10
|
10
|
6-10
|
6
|
8
|
|
Glucides digestibles
|
25
|
25
|
25
|
25
|
25
|
|
Fibres
|
8
|
8
|
8-10
|
8-10
|
8-10
|
|
Rapports P/E (Mg/Kj)
|
-
|
20
|
18
|
-
|
-
|
Incorporer 2% de prémix vitaminique et 4% de prémix
minéral. Source : Pouomogne, 1994
2.3. Quelques sous-produits agricoles et de l'industrie
agroalimentaire utilisables pour l'alimentation de O. niloticus au Cameroun
2.3.1. Sous-produits de céréales : Son de
blé, son de riz, farine de maïs
Le son de blé est un coproduit de la fabrication de farine
à partir de grains de blé tendre (Triticum aestivum L.), fraction
fine constituée principalement de fragments d'enveloppes et de
particules de grains dont la plus grande partie de l'albumen a
été enlevée. C'est une des sources les plus riches en
fibres insolubles.
Le son de riz constitué des différentes couches
cellulaires entre les enveloppes et l'albumen amylacé. Il est obtenu par
tamisage ou vannage, c'est dire qu'il est obtenu après le retrait des
balles.
Coproduit de la transformation du maïs (Zea mays L.).
L'appellation "son de maïs" recouvre une vaste gamme de coproduits de
semoulerie ou d'amidonnerie, allant de la farine basse aux sons proprement
dits. La teneur en protéines est inférieure à 20% et la
teneur en matières grasses est inférieure à 15%.
2.3.2. Tourteaux d'oléagineux : Tourteau de
soja, tourteau de coton
Après extraction de l'huile, il est obtenu le tourteau de
coton qui est la base d'une alimentation animale équilibrée et
riche. Constitué par les amandes déshuilées et contenant
en moyenne 42% de protéines, le taux de cellulose brute varie de 8
à 23% et le taux de matières grasses de 0.5 à 15%. Il est
beaucoup plus riche en fibres et en lignine. La teneur en protéines
assez élevée du tourteau de coton en fait un produit
intéressant malgré que son utilisation en alimentation animale
soit limitée par leur teneur en gossypol. D'après les
statistiques de 2005, plus de 70 000 tonnes seraient produits au Cameroun. Les
tourteaux de coton sont vendus à 300 FCFA.
Coproduit d'huilerie obtenu par pression, extraction au solvant
et traitement thermique de graines de soja (Glycine max (L.) Merr.). Le
tourteau de soja présente une très forte variabilité. Le
taux de protéines varie de 30 à 50%. Pauvre en matière
grasse et en cellulose, il est riche en lysine. En 2005, seulement 150 tonnes
produites au Cameroun contre environ 15 000 tonnes importées. Le
tourteau de soja est vendu au prix de 375 FCFA.
2.3.3. Farines d'origine animale et les
micro-ingrédients
Ce sont des farines de poisson, de viande, d'os calcinés
et de coquillages divers, de même que les premix minéraux et
vitaminiques, importés. Leur utilisation en nutrition animale en tant
que pourvoyeurs de protéines de haute valeur ou de micronutriments
déficients est bien connue. Cependant, il sera plus avantageux de
chercher à tirer le meilleur profit de la productivité naturelle
de l'étang que d'utiliser ces produits relativement coûteux.
La farine de poisson est un produit obtenu par traitement de
poissons ou de parties de poisson, contenant ou ne contenant pas l'huile et les
fractions solubles.
La farine d'os est un produit obtenu par chauffage,
séchage et mouture très fine d'os largement
dégraissés par extraction ou séparation physique, non
dégélatinisés, provenant d'animaux terrestres à
sang chaud. Ce produit contient plus de 35% de protéines.
2.3.4. Produits divers
D'autres ingrédients comme le manioc, les feuilles de
patate, la mélasse de canne à sucre, les pulpes et les parches de
café, les cabosses de cacao, plusieurs autres légumineuses, sont
autant d'ingrédients potentiels pour l'alimentation des tilapias.
Tableau 6 : Synthèse sur les
ingrédients potentiels
Ingrédients Prix moyen/kg (FCFA)
Son de blé 150
Son de riz 125
Farine de maïs 280
Tourteau de soja 375
Tourteau de coton 300
Farine de poisson 700
Farine d'os 250
CMV 1200
CHAPITRE II : MATERIEL ET METHODES
II.1. Zone d'étude
1.1. Coordonnées géographiques
La station qui a servi de cadre d'étude est celle de
Koupa Matapit, située à 13 km de la ville de Foumban,
arrondissement de Foumban, dans le département du Noun, région de
l'Ouest Cameroun. Ses 5 ha de superficie se centrent ainsi entre le 5° 43'
44 et 5° 46' latitude Nord et le 10° 45' et 10° 54 longitude
Est.

Figure 1 : Carte de la zone d'étude
Source :
http://www.carnets-voyage.com/cameroun-carte-foumban.html
(consulté le 11/06/2012 à 8h)
1.2. Relief
Le relief est constitué de plateaux
représentatifs des montagnes et des bas fonds qui sont utilisés
en saison sèche pour les cultures de contre saison, c'est
également la zone des cultures maraîchères. En ce qui
concerne les montagnes, l'altitude moyenne est de 1000 m et la plus
élevée est le Koukandie.
1.3. Sol
Le sol est latéritique, avec des faciès riche en
argile propice à la construction d'étangs dans les
vallées. L'analyse chimique (Bachelier, 1958 ; Pouomogne, 1983)
révèle un sol lessivé et très pauvre (phosphore
assimilable et azote à l'état de trace, pH < 5, entre autres),
à vocation typiquement forestière.
1.4. Hydrographie
L'ensemble de la région est bien arrosée. Au
niveau du site des travaux, deux ruisseaux alimentent la retenue (lac
André) qui approvisionne l'ensemble de la station en eau : le «
Me-vêt » et le « Tchap-liet ».
1.5. Climat
Aubreville (1949) englobe le plateau de Foumban dans le
sous-climat dit camerounien. A cela correspond un régime de pluie de
type tropical de transition, avec une saison sèche de novembre à
fin février et une saison des pluies irrégulières de mars
à fin octobre. La température est relativement faible (moyenne
22°C), la moyenne annuelle des précipitations est de 1500 mm. Les
variations de température jour-nuit sont faibles en saison des pluies et
élevées en saison sèche, la durée totale
d'ensoleillement dans l'année est de 2400 heures. Deux régimes de
vent dominent sur Koupa Matapit : la mousson, vent humide du sud-ouest qui
provoque les pluies, et à l'opposé, l'harmattan du nord-est qui
engendre la sècheresse.
1.6. Végétation
La végétation dominante est la savane arbustive
à espèces pyrophyles (dont Annona senegalensis, Lophira
lancoelata, Harungana madagascariensis) avec dans les micro-zones
habitées une poussée plus ou moins marquée
d'espèces forestières dont divers fruitiers, eucalyptus, pins et
cyprès, bambou de chine. Il convient de relever parmi les
graminées de la strate herbacée des espèces telles que
Hyparrhenia rufa, Imperata cylindrica, Pannicum maximum ou
Pennisetum purpureum.
1.7. Faune
Pour ce qui est de la faune aquatique, les ruisseaux
alimentant la retenue abritent quatre espèces de poissons : Clarias
camerunensis, Oreochromis niloticus, Cyprinus carpio, Hemichromis
.
fasciatus. Les grenouilles et crapauds
présents en grand nombre constituent un danger pour les alevins en
étang.
La faune terrestre comprend des serpents dont le plus courant
est le cobra aquatique (Naja nigricollis) et des mammifères,
dont la loutre à cou tacheté (Lutra maculicallis
Lichtenstein), les souris et rats.
La faune aérienne quant `à elle est
constituée des oiseaux ichtyophages et insectes ; l'aigrette gazette
(Aigretta garzetta) très semblable au héron garde-boeuf,
le corbeau, le martin pêcheur (Alcedo atthis) et les
libellules.
1.8. Population humaine
La population de la localité est composée de 90%
de Bamouns, musulmans en majorité. La zone s'étend sur une
superficie de 126 km2 pour une population d'environ 1200 habitants
(moins de 30 habitants/km2). Les interdits religieux limitent la
consommation de la viande de porc, de singe et d'oiseaux (poulets inclus),
entrainant ainsi la demande en produits piscicoles élevée. Des
éleveurs de bétails, les Bororos, ainsi que les éleveurs
de poulets de chair et pondeuses sont installés dans la zone.
II.2. Données secondaires
Les documents utilisés provenaient de la
bibliothèque de l'IRAD et de l'internet. Le mois d'Avril a
été consacré à la revue de la
littérature.
II.3. Données primaires
3.1. Infrastructures d'élevage
Les tests de performances des aliments expérimentaux
sur la croissance de O. niloticus ont été
réalisés sur une structure de bacs bétonnés
comprenant neuf bacs d'une capacité de 0.77 m3 (2 m x 0.7 m x
0.55 m) chacun. Ces bacs sont alimentés en eau par gravité
à partir du barrage de retenue de 5 hectares. Ils sont dotés d'un
système de canalisation en PVC enterré, dont les tuyaux
d'arrivée d'eau ont été munis d'une toile moustiquaire
(maille : 1 mm) (annexe 1).
3.2. Matériel biologique
Les alevins de O. niloticus utilisés dans
cette étude ont été produits in situ avec comme
souche des géniteurs venant de la Mapé. L'échantillonnage
par pesée a permis de sélectionner des individus dans une plage
de poids de 2 - 4 g, pour un poids moyen individuel de 2.8 #177; 0.67 g. Les
poissons (360) ont été repartis en 9 lots expérimentaux,
soit trois triplicatas de 40 poissons chacun.
3.3. Intrants alimentaires
Les ingrédients retenus pour l'étude sont les
suivants : Le tourteau de soja, le tourteau de coton, la farine de poisson, le
son de blé, le son de riz, la farine de maïs, la farine d'os,
l'huile végétale, le CMV. Les résultats des analyses des
différents ingrédients sont présentés dans le
tableau 7:
Tableau 7 : Valeurs des analyses bromatologiques des
intrants alimentaires
|
Ingrédients
|
Matières
sèches
|
Protéines
brutes
|
Matières
grasses
|
Cellulose
brute
|
Cendres
|
|
Tourteau de soja
|
87.1
|
49.2
|
5.1
|
4.5
|
7.2
|
|
Tourteau de coton
|
87.8
|
45.1
|
5.0
|
9.8
|
7.7
|
|
Farine de poisson
|
90.0
|
60.0
|
9.0
|
0.7
|
14.2
|
|
Son de blé
|
89.5
|
15.7
|
4.04
|
10
|
5.5
|
|
Son de riz
|
89.5
|
8.5
|
3.5
|
29.5
|
15.3
|
|
Farine de maïs
|
88.0
|
9.0
|
3.8
|
9.0
|
2.4
|
|
Farine d'os
|
/
|
/
|
/
|
/
|
99.0
|
|
Huile végétale
|
/
|
/
|
96.0
|
/
|
/
|
|
CMV
|
/
|
40.0
|
3.0
|
4.6
|
/
|
Source : Pouomogne, 1994
Les trois régimes tests formulés à 35% de
protéines par la méthode du « carré de Pearson »
à partir de ces ingrédients sont consignés dans le tableau
8.
Tableau 8 : Formulation et composition biochimique des
régimes alimentaires
|
Ingrédients
|
|
Régimes
|
|
|
R0
|
R1
|
R2
|
|
Tourteau de soja
|
0.00
|
30.6
|
32.15
|
|
Tourteau de coton
|
25.15
|
30.6
|
32.15
|
|
Farine de poisson
|
25.15
|
0.00
|
0.00
|
|
Farine de maïs
|
14.90
|
16.40
|
14.85
|
|
Son de blé
|
14.90
|
16.40
|
0.00
|
|
Son de riz
|
14.9
|
0.00
|
14.85
|
|
Farine d'os
|
0.00
|
4.00
|
4.00
|
|
Huile végétale
|
0.00
|
2.00
|
2.00
|
|
CMV
|
5.00
|
0.00
|
0.00
|
|
Valeur nutritive
|
|
|
|
|
Matières sèches (%)
|
84.5
|
82.6
|
82.5
|
|
Protéines brutes (% MS)
|
35.0
|
35.0
|
35.0
|
|
Matières grasses (% MS)
|
5.3
|
6.2
|
6.2
|
|
Cellulose brute (% MS)
|
10.0
|
7.4
|
10.3
|
|
Cendres (% MS)
|
8.9
|
9.8
|
11.3
|
Le prix de revient du kilogramme de chaque aliment a
été calculé en multipliant le prix du kilogramme de chaque
ingrédient avec la proportion de chacun d'eux dans chaque aliment.
(annexe 5)
? Fabrication :
Les ingrédients tamisés ont été
pesés et mélangés jusqu'à l'obtention d'une poudre
homogène à laquelle on a ajouté de l'huile
végétale pour les régimes R1 et R2. La farine de manioc
est ajoutée dans les trois régimes pour servir de liant au taux
de 2%. De l'eau a été ensuite ajoutée à raison de
60 % de matière sèche d'aliment, de manière à
obtenir une pâte malléable qui, passée à travers la
filière d'un hachoir à viande (n°12) donne des filaments de
4 mm de diamètre (spaghettis) (voir annexe 2). Ces filaments sont par la
suite séchés au soleil (deux jours de soleil intense),
fragmentés à la taille, ensachés et stockés
jusqu'à la distribution.
· Nourrissage
Selon des études réalisées, entre autres,
par Jauncey et Ross (1982), New (1987), (Arrignon, 1993) et les valeurs
adaptées par Lazard (2007), la ration alimentaire optimale quotidienne
pour les poissons de 2-10 g est d'environ 11 % de la biomasse. Plus faible pour
ceux de 10 - 25 g (proche de 5.5% de la biomasse).
3.4. Données collectées
Les paramètres de la qualité de l'eau ont
été contrôlés régulièrement.
- Le pH à l'aide d'un kit JBL était mesuré
une fois par semaine en prélevant 5 ml de l'eau de chaque bac que l'on
versait dans un flacon, ensuite ajouter 3 gouttes de la solution de test du pH.
Quelques minutes plus tard lire la valeur du pH en fonction de la coloration
obtenue.
- La température avec un thermomètre à
mercure JBL, deux fois par jour avant 7h et après 17h en plongeant le
thermomètre à au moins 5 cm dans l'eau puis patienter 2 minutes
avant de lire les valeurs.
- La transparence à l'aide d'un disque de Secchi
gradué en cm en enfonçant le disque dans l'eau jusqu'à la
non visibilité du disque puis lire la profondeur.
- Le poids des poissons à chaque pêche de
contrôle en pesant les sujets sur une balance sensible de marque METLAB
TOLEDO ; poids max : 3,1 kg erreur : 0,1g.
- La quantité d'aliment à distribuer chaque jour
était pesée avec cette même balance en fonction de la
biomasse des poissons.
II.4. Conduite de l'étude
La méthode mise en oeuvre a consisté à :
- La préparation des bacs en ajoutant une couche de 5
cm de terre, suivi d'un chaulage au taux de 200g/m2 soit 280 g par
bac. La mise en eau a suivi le lendemain à une profondeur de 30 cm. 10
jours plus tard, les bacs ont été fertilisés avec de la
fiente de poule sous forme séchée et diluée dans de l'eau
(200g/m2), du superphosphate (5g/m2) et de l'urée
(5g/m2). Une fertilisation d'entretien avec de la fiente de poule
était appliquée une à deux fois par semaine pour maintenir
la transparence de l'eau.
- L'alevinage de 9 bacs avec les alevins de O. niloticus
d'un poids moyen de 2.8 #177; 0.67 g, à la densité de la
densité de 40 alevins/bac.
- Les poissons répartis en trois triplicatas,
étaient nourris avec les trois aliments expérimentaux, chaque
triplicata recevant un régime.
Les aliments étaient distribués manuellement
trois fois par jour (8h, 12h, et 16h), tous les jours de la semaine dans des
mangeoires flottantes pendant 50 jours.
Une pêche de contrôle des différents
paramètres zootechniques était programmée tous les 25
jours, entre 10h et 12h, deux pêches de contrôle ont
été effectuées (annexe 3) ;
Pendant les pêches de contrôle (les poissons
ayant subit au moins 16 h de jeun avant la pêche), la population
était entièrement dénombrée pour déterminer
le taux de survie. Puis, dans un échantillon de 20 individus par bac (50
% de la population) pris au hasard, les poissons étaient pesés
;
Après chaque pêche de contrôle, les
rations alimentaires journalières étaient
réajustées en fonction de la biomasse en élevage.
Les valeurs des paramètres physico-chimiques de l'eau
obtenus tout au long de l'élevage sont consignées dans le tableau
9.
Tableau 9 : Valeurs des paramètres
physico-chimiques de l'eau enregistrés
Valeurs
Paramètres contrôlés
Température 21 - 25°C
Transparence 15 - 25 cm
pH 7,4 - 9
II.5. Paramètres étudiés
Pour estimer la croissance des poissons au cours de
l'expérimentation et caractériser l'efficacité
d'utilisation des aliments mis en essai, les différents
paramètres zootechniques et indices suivants ont été
calculés :
· Taux de survie
Le taux de survie est calculé à partir du nombre
total de poissons à la fin de l'expérience et de l'effectif en
début d'élevage, selon la relation ci-dessous :
Nombre de poissons final
Survie (%) = x 100
Nombre de poissons initial
· Gain de poids
Il permet d'évaluer la croissance pondérale des
poissons pendant un temps donné. Il est calculé à partir
de la formule ci-dessous :
Gain de poids (g) = Poids final (g) - Poids initial
(g)
· Gain de poids journalier
Encore appelé croissance individuelle journalière,
il permet d'apprécier le gain de poids journalier des poissons en
élevage. Il est déterminé à partir de la relation
ci-dessous :
~. _ Gain de poids (g)
CIJ
(g J) Durée
d'élevage (j)
· Taux de croissance spécifique
Ce coefficient permet d'évaluer le poids gagné
par le poisson chaque jour, en pourcentage de son poids vif.
TCS (%/j) = [ln (poids final) - ln
(poids initial)]
x100
Durée de
l'expérience en jours
· Indice de consommation
Ce coefficient couramment utilisé pour
caractériser l'efficacité d'utilisation de l'aliment est un
rapport entre l'aliment ingéré et le gain de masse corporelle.
Quantité d'aliment sec
distribuée
IC =
gain de poids
· Coefficient d'efficacité protéique
Il est calculé pour apprécier l'efficacité
d'utilisation des protéines contenues dans l'aliment.
CEP = Gain de poids
qté de protéines
ingérées (Qté
d'aliment sec distribuée x
%protéines dans l'aliment)
· Biomasse nette
Biomasse nette = biomasse finale - biomasse
initiale
II.6. Analyses statistiques
Les caractéristiques de la croissance (poids final, gain
de poids, gain de poids journalier, taux
de croissance spécifique, indice de consommation et
coefficient d'efficacité protéique) ont été
soumises à des analyses de variance à un facteur (ANOVA1). Ces
analyses ont été effectuées à l'aide du logiciel
EXCEL. (Annexe 9)
CHAPITRE III : RESULTATS ET DISCUSSION
3.1. RESULTATS
1.1. Effet de l'incorporation des tourteaux de soja et de
coton sur la Survie
L'effet de l'incorporation des tourteaux de soja et de coton
sur la survie des poissons comme l'illustre le tableau 10 montre que le taux de
survie n'a pas été affecté les deux premières
périodes quelque soit le régime alimentaire. Il a
été affecté pour la période d'élevage J50
avec un taux de survie équivalent entre les trois régimes. Aucune
différence significative n'a été enregistrée
(p>0,05).
Tableau 10 : Effet combiné du type d'aliment sur
le taux de survie (%) en fonction de la
période d'essai
|
Régimes
|
|
Périodes d'élevage (en jours)
|
|
|
J0
|
J25
|
J50
|
|
R0
|
100,00a
|
100,00b
|
98,75c
|
|
R1
|
100,00a
|
100,00b
|
98,75c
|
|
R2
|
100,00a
|
100,00b
|
98,75c
|
1.2. Effet du type d'aliment sur les
caractéristiques de la croissance
L'effet du type d'aliment sur les caractéristiques de
la croissance comme l'illustre les tableaux 11 et 12 montrent que :
? Le poids moyen individuel des poissons entre les trois
régimes ne différencie pas
significativement à la
période d'élevage J25. A la période J50, la valeur la plus
forte est obtenue avec le régime R1 et la plus faible significativement
différente aux deux autres régimes a été
observée avec le régime R2.
Tableau 11 : Poids moyen individuel (g) des poissons
par régime en fonction de la période
d'élevage.
|
RégimeJ0
|
|
Périodes d'élevage (en jours)
|
|
|
J25
|
J50
|
|
R0
|
2,8 #177; 0,67a
|
8,2 #177; 2,44b
|
14,9 #177; 3,53c
|
|
R1
|
2,8 #177; 0,67a
|
8,9 #177; 1,94b
|
15,5 #177; 3,4c
|
|
R2
|
2,8 #177; 0,67a
|
8,3 #177; 2,01b
|
13,5 #177; 2,63d
|
R0 : farine de poisson, tourteau de coton, farine de maïs,
son de blé, son de riz, cmv
R1 : tourteau de soja, tourteau de coton, farine de maïs,
son de blé, farine d'os, huile végétale
R2 : tourteau de soja, tourteau de coton, farine de maïs,
son de riz, farine d'os, huile végétale
Dans chaque colonne, les valeurs (moyennes ? ESM, n =
3) affectées par des lettres différentes, sont significativement
différentes (P < 0,05). Celles portant la même lettre
alphabétique dans chaque colonne ne sont pas significativement
différents.
La représentation graphique de l'évolution du
poids moyen individuel des poissons par régime alimentaire, au cours de
l'expérience comme l'illustre la figure 2 montre que les poissons soumis
aux trois régimes ont une allure régulière et une tendance
ascendante.
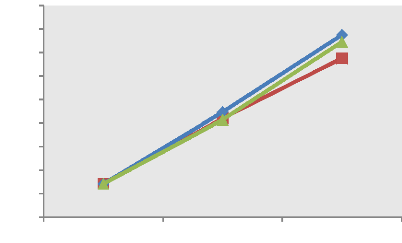
0 25 50
Poids moyen (g)
18
16
14
12
10
4
8
0
6
2
R2
R1
R0
Temps (jours)
Figure 2 : Evolution du poids moyen à
différents régimes en fonction du temps
? Quelque soit la caractéristique
considérée, pour ce qui est du gain de poids moyen, gain de
poids journalier, TCS, CEP et IC, les valeurs les plus faibles
significativement différentes ont été observées
avec le régime R2 comparé aux deux autres régimes. Les
valeurs les plus fortes obtenues avec R1 ne présentent pas de
différences significatives avec le régime témoin R0.
Tableau 12 : Valeurs (moyenne #177; écart-type)
des caractéristiques de la croissance des poissons
par différents régimes
|
Paramètres de la croissance
|
|
|
Régimes
|
|
|
|
|
R0
|
|
R1
|
|
R2
|
|
Gain de poids moyen (g)
|
12,09
|
#177; 3,53a
|
12,60
|
#177; 3,40a
|
10,60
|
#177; 2,63b
|
|
Gain de poids journalier (g/j)
|
0,24
|
#177; 0,07a
|
0,25
|
#177; 0,06a
|
0,21
|
#177; 0,04b
|
|
TCS (%/j)
|
3,27
|
#177; 0,46a
|
3,35
|
#177; 0,44a
|
3,08
|
#177; 0,40b
|
|
CEP
|
1,93
|
#177; 0,56a
|
1,92
|
#177; 0,50a
|
1,70
|
#177; 0,42b
|
|
IC
|
1,60
|
#177; 0,47a
|
1,60
|
#177; 0,46a
|
1,79
|
#177; 0,48b
|
Sur chaque ligne, les valeurs (moyennes ? ESM, n = 3)
affectées par des lettres différentes, sont significativement
différentes (P < 0,05). Celles portant la même lettre
alphabétique sur chaque ligne ne sont pas significativement
différents.
1.3. Coûts alimentaires d'élevage
Le coût alimentaire de production du kilogramme de
poisson comme l'illustre le tableau 13 a été obtenu en
multipliant le coût du kilogramme d'aliment par régime et l'IC de
chaque régime. Il en ressort que produire 1 kg de poisson avec le
régime R0 coûte 1,3 fois plus cher qu'avec le régime R1
pourtant les deux régimes en termes de caractéristiques de la
croissance ne sont pas significativement différents.
Tableau 13 : Coût alimentaire de production du
kg de poisson
Régimes Coût de production d'un kg de poisson
(FCFA)
R0 629,6
R1 480,11
R2 537,26
3.2. DISCUSSION
? Survie
Les valeurs obtenues sont proches de celles de Yacouba Bamba
et al. (2003) ce qui confirmerait la bonne qualité des aliments
testés. Le taux de survie de 90 % étant
généralement admis en élevage, et ceux obtenus se situant
au-dessus, on peut considérer que ces résultats se situent dans
la norme admise.
? Caractéristiques de la croissance
Les TCS enregistrés ici sont satisfaisant puisqu'ils
appartiennent à la plage des données rapportées par
Jauncey (1982) (taux de croissance spécifique supérieur à
3 %/j).
Les croissances enregistrées pour le régime R1
(tourteau de soja, tourteau de coton, farine de maïs, son de blé,
farine d'os, huile végétale) et le témoin R0 (farine de
poisson, tourteau de coton, farine de maïs, sonde blé, son de riz,
cmv) sont similaires. La différence de performances constatée
entre les régimes (R1 et R0) et le régime R2 (tourteau de soja,
tourteau de coton, farine de maïs, son de riz, farine d'os, huile
végétale) résulterait du meilleur degré de
convertibilité des ingrédients incorporés dans ces
aliments. En d'autres termes, les aliments R1 et R0 seraient plus digestes et
facilement assimilables par les poissons. Köprücü &
Özdemir (2005) indiquent que la digestibilité d'un aliment
dépend de la nature des ingrédients utilisés. Ils
mentionnent que des ingrédients peuvent paraître d'excellentes
sources de nutriments, mais de faibles valeurs nutritives, à cause de la
variabilité de leurs coefficients de digestibilité, d'absorption
et de la disponibilité des nutriments (acides aminés,
minéraux). Melard (1999) rapporte que les coefficients de
digestibilité protéique de soja et du maïs sont
respectivement de 96% et 85%, contre 87% pour la farine de poisson. En
outre,
selon Ouattara (2004), le son de blé procure une
meilleure croissance aux poissons que ceux de riz. Ce qui indiquerait que,
l'écart de croissance observé pourrait être lié
à la nature des ingrédients utilisés comme l'ont
souligné Burel et al. (2000) et Köprücü &
Özdemir (2005).
Ces résultats corroborent aux démonstrations de
Deyab et Elsaidy (2002) selon lesquelles chez les juveniles d'O. niloticus
d'un poids moyen initial de 1,93 g, le tourteau de soja enrichi par la
L-lysine à un taux de 0,5 %, peut remplacer totalement la farine de
poisson dans un régime de 30 % de protéines, sans affecter les
performances de croissance ; Furuya et al. (2004) ont montré que la
substitution totale de la farine de poisson par le tourteau de soja est
possible dans un régime alimentaire destiné pour les alevins
d'O. niloticus enrichi par la méthionine, la lysine, la
thréonine et le phosphate de calcium.
Les croissances moyennes journalières
enregistrées dans cette étude sont moins élevées
que celles obtenues par Yacouba Bamba et al. (2003) avec un aliment
tirant 25% de protéines brutes, formulé à base des
mêmes ingrédients. Cet écart de croissance serait la
résultante de plusieurs facteurs :
? La température du milieu d'élevage ;
? Les infrastructures d'élevage qui dans ce cas
étaient des bacs bétonnés tandis que celles de Yacouba
Bamba et al. (2003) était des étangs.
? La durée d'élevage ; 120 contre 50 jours.
? La qualité bromatologique des ingrédients ;
? La densité de mise en charge dans le cas actuel
était de 28 alevins/m2 contre 10 alevins/m2 pour
Yacouba Bamba et al. (2003)
Concernant l'IC, il se rapproche des résultats obtenus
par Yacouba Bamba et al. (2003).
La différence significative observée entre le
coefficient d'efficacité protéique des régimes R1 et R0
par rapport au régime R2 fait penser que les protéines brutes du
régime R2 sont moins valorisées que celles des régimes R1
et R0, qui renferment tous 35%. Le faible taux du CEP de R2 pourrait être
attribué à la faible digestibilité de certains de ses
nutriments due à la teneur élevée en cellulose à
l'instar du son de riz comme l'on signalé Rivière (1978) et Arzel
et al. (1999), pourtant présent dans le régime R0.
CONCLUSION ET RECOMMANDATIONS
L'objectif majeur poursuivi par cette étude
était d'identifier parmi les aliments formulés à partir
d'intrants locaux, celui qui soit zootechniquement et économiquement
intéressant. Ceci pour tenter de résoudre le problème
posé par le coût élevé et
l'irrégularité de la farine de poisson. Au vu des
caractéristiques de la croissance et du coût de production d'un
kilogramme de poisson, nous pouvons dans l'état actuel des
connaissances, considérer le régime R1 constitué de
(tourteau de soja, tourteau de coton, farine de maïs, son de blé,
farine d'os, huile végétale) comme étant le plus
intéressant.
Néanmoins, cette étude présente des
limites telles que la saison (pluvieuse) qui freine la croissance des sujets ;
la courte durée des expérimentations (3 mois) qui n'est pas
suffisante pour que les juvéniles puissent déjà s'habituer
aux aliments.
Recommandations techniques
Ce travail réalisé dans une structure hors-sol
mériterait donc d'être repris en étang, où la
productivité naturelle pourrait contribuer à améliorer les
résultats. Connaissant le potentiel du tilapia à tirer profit de
sources alimentaires diverses dans le milieu naturel, les organismes du
plancton ou du benthos pourraient ainsi résoudre, dans une certaine
mesure, le problème des nutriments déficients.
Recommandations scientifiques
? Une analyse bromatologique des différents
ingrédients serait indispensable.
? Une analyse de la qualité nutritionnelle et
organoleptique des poissons viendront compléter ce travail. Car un bon
aliment est formulé à base de matières premières
disponibles de bonne qualité, couvre les besoins nutritionnels et
énergétiques des poissons, permet une croissance optimale, donne
un produit ayant de bonnes qualités (nutritionnelles, technologiques et
sensorielles).
? Mener une étude sur l'âge de maturité du
tilapia et les facteurs y intervenant car on a obtenu des larves dans un bac
où le poids maximal n'atteignait pas 21g.
REFERENCES BIBLIOGRAPHIQUES
Arzel J., Guillaume J.,
& Kaushik S., 1999. Composition et valeur
nutritive des matières premières utilisées. In :
Guillaume J., Kaushik S., Bergot P. & R. Metailler Eds. Nutrition et
alimentation des poissons et crustacés. Paris, France : INRA, : pp. 429-
455.
BALARIN J.D. et HATTON J.D.,
1979. Tilapia: A guide to their biology and culture in Africa. Unit of
Aquatic Pathobiology, Stirling University, 174 p.
BOWEN S.H., 1982. Feeding digestion and growth -
qualitative consideration. In: Pullin R.S.V., Lowe-McConnell R.h.
(éds.), The biology and culture of tilapias, 141-156, ICLARM conf.
proceedings, 7, Manila, Philippines.
Burel C., Boujard T.,
Tulli F., & Kaushik S.
J., 2000. Digestibility of extruded peas,
extruded lupin and rapesseed meal in rainbow trout (Oncorhynchus
mykiss) and turbot (Psetta maxima). Aquaculture,
188, 285 - 298.
CAMPBELL D., 1978. Formulation
des aliments destinés à l'élevage de Tilapia nilotica
(L.) en cages dans le Lac de Kossou. Côte d'Ivoire. Rapport
technique n° 46, Département des pêches FAO, 26 p.
CHO C.Y. and KAUSHIK S.J.,
1985. Effect of protein intake on metabolizable and net energy
value of fish diet. In : Cowey C.B., Mackie A.M. and Bell J.B.
(éds.), Nutrition and feeding in fish. Academic press, London, pp.
95-117.
DA COSTA K.S., DEMBELE I. et
LAMO S., 1994. Elevage monosexe mâle de
Oreochromis niloticus en Côte d'Ivoire : Comparaison de deux
formes d'apport de l'aliment ternaire 3A. In : Proceedings du
troisième Symp. Intern. Aqua. du tilapia (ISTA III), 11-16 nov. 1991,
Côte d'Ivoire.
DE SILVA S.S. et PERERA M.K.,
1985. Effects of dietary protein level on growth, food
conversion, and protein use in young Tilapia nilotica at four
salinities. Trans. Am. Fish. Soc., 583-589.
Deyab M. and El-Saidy D.,
2002. - Complete replacement of fish meal by soybean meal with dietary
L-Lysine supplementation for Nile Tilapia Oreochromis niloticus (L.)
fingerlings. Journal of the World Aquaculture Society, 33 (3), 297 -
306.
EL-SAYED A. M. and TESHIMA S.,
1972. Protein and energy requirements of Nile tilapia Oreochromis
niloticus. Aquacutlture, 103 : 55-63.
FAO (Food and Agriculture Organisation),
2012. In:
www.fao.org, consulté le
01/07/12 à 15 h.
Furuya M.W., Pezzato E.L., Barros M.M., Pezzato A.C.,
Furuya R.B. and Miranda C.E., 2004. - Use of ideal
protein concept for precision formulation of amino acid levels in
fish-meal-free diets for juvenile Nile Tilapia (Oreochromis niloticus
L.). Aquaculture Research, 35, (12) 1110 - 1116.
GUILLAUME J., KAUSHIK S., BERGOT P., METAILLER R.,
1999. Nutrition et alimentation des poissons et crustacés. INRA
Éditions., 489 p.
http://www.carnets-voyage.com/cameroun-carte-foumban.html
consulté le 11/06/2012 à 8h
IGA IGA Robert, 2008. Contribution à la
mise au point d'aliments pour tilapia Oreochromis niloticus à
base d'intrants locaux : cas du Gabon. Mémoire de master. 47 p
JAUNCEY K. et ROSS B., 1982. A
guide to tilapia feeds and feeding. Institute of Aquaculture, University of
Stirling, Scotland. 111 p.
KAUSHIK S. J., 1992. Digestibilité de
matières premières d'origine africaine. In : Lazard J.
(éds.), (1993). Compte-rendu final de l'A.T.P CIRAD n° 71/90,
CIRAD-EMVT/GAMET, Montpellier, 40 p., pp18-22.
KAUSHIK S. J., DOUDET T., MEDALE F., AGUIRRE P.
and BLANC D., 1993. Estimation of protein and energy needs for
maintenance and growth of nile tilapia (Oreochromis niloticus) using
different criteria. In : Proceedings Abstracts EIFAC Workshop on
Methodology for Determination of Nutrient Requirements in fish, 29 June-1 July
1993, Eichenau, Germany, p. 19.
Köprücü K., &
Özdemir Y., 2005. Apparent digestibility of selected feed
ingredients for Nile tilapia (Oreochromis niloticus).
Aquaculture 250 : 308 - 316.
LAUZANNE L., 1988. Les habitudes alimentaires
des poissons d'eau douce africains, pp. 221-242. In :
Lévêque C., Bruton M. N. et Ssentongo G. W. (éds.),
Biologie et écologie des poissons d'eau douce africains. ORSTOM Paris,
508 p.
LAZARD J., MORISSENS P., PARREL P., AGLINGLO C., ALI
I., et ROCHE P., 1990. Méthodes artisanales
d'aquaculture du tilapia en Afrique. Nogent-Sur-Marne, CIRAD/C.T.F.T., 82 p.
LAZARD J., LECOMTE Y., STOMAL B. et
WEIGEL J.Y., 1992. Pisciculture en Afrique subsaharienne.
Situations et projets dans les pays francophones. Propositions d'action. Paris,
Ministère de la coopération et du développement, CID/DOC,
155 p.
LOVELL R. T., 1980. Feeding tilapia.
Aquaculture Magazine, 7(1): 42-43.
LOWE-McCONNELL, R.H., 1982. Tilapia in fish
communities. In: Pullin R.S.V. and Lowe-McConnell R.H. (éds.):
The biology and culture of tilapias. ICLARM Conference Proceedings, 7, Manila,
Philippines, 83-114.
LUQUET P., 1989. Practical considerations on the
protein nutrition and feeding of tilapia. Aquaf. Liv. ßesour.,
2: 99-104.
MELARD C., 1999. Bases biologiques de
l'aquaculture : Notes de cours. Université de Liège, Belgique :
Centre de Formation et de Recherche en Aquaculture. 238 pp.
MELARD, Ch., 1986. Les bases biologiques de
l'élevage intensif du tilapia du Nil. Cahiers d'Ethologie
appliquée, Fasc. 3, Vol. 6, 224p.
MORIARTY C.D., 1973. The physiology of digestion
of blue-green algae in the cichlid fish Tilapia nilotica. J.
Zool. 171: 25-40.
Ouattara N. I., 2004. Etude du potentiel
aquacole d'une population du tilapia estuarien Sarotherodon melanotheron
Rüppell (1852) isolée dans le lac de barrage d'Ayamé
(Côte d'Ivoire). Thèse de Doctorat. Université de
Liège, Belgique. 275 pp.
PAULY D., MOREAU J. et PREIN M.,
1988. A comparaison of overall growth performance of Tilapia in open
waters and aquaculture. 469-479. In: R.S.V. Pullin et al: The Second
International Symposium on tilapia in Aquaculture. ICLARM Conference
Proceedings 15, 623p.
POUOMOGNE V., 1985. Influence du taux
d'alimentation sur la croissance de Oreochromis niloticus et
Cyprino carpio élevés en bacs métalliques. pp.
33-32. In : Rapport de recherches sur la nutrition et la croissance du
tilapia, clarias et heterotis. Station de recherches
halieutiques de Limbe (Cameroun), 60 p.
POUOMOGNE V., 1994. L'alimentation du tilapia
(Oreochromis niloticus) en étang.
Evaluation du potentiel de quelques sous-produits de l'industrie
agro-alimentaire et modalités d'apport des aliments. Thèse
doctorale ENSAR. 101 p.
Rivière R., 1978. Manuel
d'alimentation des ruminants domestiques en milieu tropical. Paris, France :
Institut d'Elevage et de Médecine Vétérinaire des Pays
Tropicaux. 527 pp.
RUWET J. C., VOSS J., HANON L. et MICHA
J. C., 1975. Biologie et élevage des tilapias. FAO/CIFA Tech.
Pap., 4 : 332-364.
SANTIAGO C.S. et LOVELL R.T.,
1988. Effects of varying dietary crude protein levels on growth and
spawning frequency of T. nilotica breeders. AOD. SEAFDEC. Ann. Rep.,
30 p.
TACON A.G.J. et COWEY C. B. (1985).
Protein and amino acid requirements. In: Fish energetics, P.
Tytler, P. Calow Eds., Croom, London, Sydney, 155-183.
TACON A.G.J. and JACKSON A.J.,
1982. Utilization of conventional and unconventional protein sources
in practical fish feeds. In : Nutrition and Feeding in Fish, Cowey,
C.B., Mackie, A.M. and Bell, J.G., (éds.). Academic Press, London, pp.
11 9-1 45.
TAKECHI, T., SATOH, S. et WATANABE, W.,
1983. Dietary lipids suitable for practical feed of Tilapia nilotica.
Bull. Jap. Soc. Sci. Fish. 49, 9, 1361-1365.
TREWAVAS, E., 1983. Tilapiine Fishes of the
Genera Sarotherodon, Oreochromis and Danakilia.
British Museum Nat. Hist., 583p.
VIOLA S. et ARIELI Y., 1983.
Nutrition studies with tilapia (Sarotherodon). 1. Replacement
offishmeal by soybean-meal in feeds for intensive tilapia culture. Bamidgeh,
35, 9-17, 1983. Nutrition studies with tilapia hybrids. 2. The effects of oil
supplements to practical diets for intensive aquaculture. Bamidgeh, 35,
45-52.
VIOLA S., MOKADY S., BEHAR D. and U.
COGAN., 1988. Effects of polyunsaturated
fatty acids in feeds of tilapia and carp. 1. Body composition and
fatty acid profiles at different environmental temperatures.
Aquaculture, 75 (1988):127-137.
WAN K., T. TAKECHI et W. WATANABE,
1985. Effect of dietary protein levels on growth of Tilapia
nilotica. Bull. Jap. Soc. Sci. Fish., 51, 133-140. Optimum
protein and digestible energy levels in diets for Tilapia nilotica.
Bull. Jap. Soc. Sci. Fish., 51, 141-146.
YACOUBA BAMBA, ALLASSANE OUATTARA, KOUASSI S. Da COSTA
et GERMAIN GOURENE, 2008. Production de
Oreochromis niloticus avec des aliments à base de sous produits
agricoles. 90-99.
ANNEXES
Annexe 1 : Vue d'ensemble de l'infrastructure

Annexe 2 : Vue d'un hachoir à granuler

Annexe 3 : Récapitulatif des pêches
de contrôle
|
Paramètres
|
R0
|
R1
|
R2
|
|
1ère pêche
|
2ème pêche
|
1ère pêche
|
2ème pêche
|
1ère pêche
|
2ème pêche
|
|
Poids moyen initial (g)
|
2,8
|
8,2
|
2,8
|
8,9
|
2,8
|
8,3
|
|
Poids moyen final (g)
|
8,2
|
14,9
|
8,9
|
15,5
|
8,3
|
13,5
|
|
Gain de poids moyen (g)
|
5,37
|
6,7
|
6,07
|
6,6
|
5,47
|
5,2
|
|
Durée d'élevage (j)
|
25
|
25
|
25
|
25
|
25
|
25
|
|
Croissance journalière (g/j)
|
0,21
|
0,26
|
0,24
|
0,26
|
0,21
|
0,20
|
|
Nombre de poissons initial
|
40
|
40
|
40
|
39
|
40
|
40
|
|
Nombre de poissons final
|
40
|
39
|
39
|
39
|
40
|
39
|
|
Taux de survie (%)
|
100
|
98,75
|
100
|
98,75
|
100
|
98,75
|
Annexe 4 : Quantité cumulée
d'aliments distribués (g)
|
Période 1
|
Période 2
|
Total
|
|
J0 - J25
|
J25 - J50
|
J0 - J50
|
|
R0
|
900
|
1 353
|
2 253
|
|
R1
|
900
|
1 431
|
2 331
|
|
R2
|
900
|
1 369,5
|
2 269,5
|
Annexe 5 : Estimation du prix de revient d'un kg
d'aliment
|
Prix des Ingrédients
(FCFA)
|
Prix d'un kg de R0
|
Prix d'un kg de R1
|
Prix d'un kg de R2
|
|
Tourteau de soja : 375 fcfa/kg
|
/
|
(30,6 x 375)/100 = 114,75
|
(32,15 x 375)/100 = 120,56
|
|
Tourteau de coton : 300 fcfa/kg
|
(25,1 x 300)/100 = 75,3
|
(30,6 x 300)/100 = 91,8
|
(32,15 x 300)/100 = 96,45
|
|
Farine de poisson : 700 fcfa/kg
|
(25,1 x 700)/100 = 175,5
|
/
|
/
|
|
Farine de maïs : 280 fcfa/kg
|
(14,9 x 280)/100 = 41,72
|
(16,4 x 280)/100 = 45,92
|
(14,85 x 280)/100 = 41,58
|
|
Son de blé : 150 fcfa/kg
|
(14,9 x 150)/100 = 22,35
|
(16,4 x 150)/100 = 24,6
|
/
|
|
Son de riz : 125 fcfa/kg
|
(14,9 x 125)/100 = 18,625
|
/
|
(14,85 x 125)/100 = 18,5625
|
|
Farine d'os : 250 fcfa/kg
|
/
|
(4 x 250)/100 = 10
|
(4 x 250)/100 = 10
|
|
Huile végétale : 650 fcfa/litre
|
/
|
(2 x 650)/100 = 13
|
(2 x 650)/100 = 13
|
|
CMV : 1200 fcfa/kg
|
(5 x 1200)/100 = 60
|
/
|
/
|
|
Total
|
393,5 FCFA
|
300,07 FCFA
|
300,15 FCFA
|
Annexe 6 : Kit de mesure des paramètres
physicochimiques de l'eau


Annexe 7 : Vidange d'un bac à la fin de
l'expérimentation

Annexe 8 : Aspect morphologique du tilapia
O. n
A la fin de l'expérimentation (21 g)

Annexe 9 : Résultats des analyses
statistiques
Analyse de variance: un facteur RAPPORT
DÉTAILLÉ
Nombre
Groupes d'échantillons Somme Moyenne
Variance
R1 40 357,4 8,935 3,79412821
R2 40 333,6 8,34 4,07015385
ANALYSE DE VARIANCE
|
Source des
variations
|
Somme des
carrés
|
Degré de
liberté
|
Moyenne
des carrés F
Probabilité
|
Valeur critique pour F
|
Entre Groupes 7,0805 1 7,0805 1,80067295 0,18352451
3,963471921
A l'intérieur
des groupes 306,707 78 3,93214103
Total 313,7875 79
? Poids à la 1ère pêche de
contrôle (J25)

Degré de liberté
Source des variations
Somme des carrés
Valeur critique pour F
Moyenne
des carrés F
Probabilité
Degré de liberté
Source des variations
Somme des carrés
Valeur critique pour F
Moyenne
des carrés F
Probabilité
Analyse de variance: un facteur
RAPPORT DÉTAILLÉ
Nombre
Groupes d'échantillons Somme Moyenne
Variance
R1 40 357,4 8,935 3,79412821
R0 40 331 8,275 5,97115385
ANALYSE DE VARIANCE
Entre Groupes 8,712 1 8,712 1,78428026 0,18550917 3,963471921
A l'intérieur
des groupes 380,846 78 4,88264103
Total 389,558 79
R2 40 333,6 8,34 4,07015385
R0 40 331 8,275 5,97115385
ANALYSE DE VARIANCE
Entre Groupes 0,0845 1 0,0845 0,01683048 0,89711218
3,963471921
A l'intérieur des
groupes 391,611 78 5,02065385
Total 391,6955 79
Nombre
d'échantillons Somme Moyenne
Variance
Analyse de variance: un facteur RAPPORT
DÉTAILLÉ
Groupes
? Poids final

Degré de liberté
Source des variations
Somme des carrés
Valeur critique pour F
Moyenne
des carrés F
Probabilité
Analyse de variance: un facteur
RAPPORT DÉTAILLÉ
|
Nombre
Groupes d'échantillons
|
Somme
|
Moyenne
|
Variance
|
|
R1
|
119
|
1821,9
|
15,5050633
|
11,6233074
|
|
R2
|
119
|
1662,3
|
13,4848101
|
6,94079195
|
|
ANALYSE DE VARIANCE
|
|
|
|
|
|
Source des
variations
Entre
|
Somme des
carrés
|
Degré de
liberté
|
Moyenne
des carrés
|
F
|
Probabilité
|
Valeur critique pour F
|
|
Groupes
|
161,2162025
|
1
|
161,216203
|
17,3685994
|
5,0861E-05
|
3,9017606
|
|
A l'intérieur des groupes
|
1447,999747
|
156
|
9,28204966
|
|
|
|
|
Total
|
1609,215949
|
157
|
|
|
|
|
Analyse de variance: un facteur
RAPPORT DÉTAILLÉ
Nombre
Groupes d'échantillons Somme Moyenne
Variance
R1 119 1821,9 15,5050633 11,6233074
R0 119 1776 14,9240506 12,5236449
ANALYSE DE VARIANCE
Entre Groupes 13,33424051 1 13,3342405 1,10442431 0,29492243
3,9017606
A l'intérieur
des groupes 1883,462278 156 12,0734761
Total 1896,796519 157
Analyse de variance: un facteur RAPPORT
DÉTAILLÉ
Nombre
Groupes d'échantillons Somme Moyenne
Variance
R2 119 1662,3 13,4848101 6,94079195
R0 119 1776 14,9240506 12,5236449
ANALYSE DE VARIANCE
|
Source des
variations
|
Somme des
carrés
|
Degré de
liberté
|
Moyenne
des carrés F
Probabilité
|
Valeur
critique pour F
|
Entre Groupes 81,82082278 1 81,8208228 8,40721191 0,00427676
3,9017606
A l'intérieur des
groupes 1518,226076 156 9,73221844
Total 1600,046899 157
? Gain de poids moyen
Analyse de variance: un facteur RAPPORT
DÉTAILLÉ
Nombre
Groupes d'échantillons Somme Moyenne
Variance
R1 119 1484,33 12,6750633 11,6233074
R2 119 1324,73 10,6548101 6,94079195
ANALYSE DE VARIANCE
|
Source des
variations
|
Somme des
carrés
|
Degré de
liberté
|
Moyenne
des carrés F
Probabilité
|
Valeur critique
pour F
|
Entre Groupes 161,2162025 1 161,216203 17,3685994 5,0861E-05
3,9017606
A l'intérieur des
groupes 1447,999747 156 9,28204966
Total 1609,215949 157

Degré de liberté
Source des variations
Somme des carrés
Valeur critique pour F
Moyenne
des carrés F
Probabilité
Degré de liberté
Source des variations
Somme des carrés
Valeur critique pour F
Moyenne
des carrés F
Probabilité
Analyse de variance: un facteur
RAPPORT DÉTAILLÉ
Nombre
Groupes d'échantillons Somme Moyenne
Variance
R2 119 1324,73 10,6548101 6,94079195
R0 119 1438,43 12,0940506 12,5236449
ANALYSE DE VARIANCE
Entre Groupes 81,82082278 1 81,8208228 8,40721191 0,00427676
3,9017606
A l'intérieur des
groupes 1518,226076 156 9,73221844
Total 1600,046899 157
R1 119 1484,33 12,6750633 11,6233074
R0 119 1438,43 12,0940506 12,5236449
ANALYSE DE VARIANCE
Entre Groupes 13,33424051 1 13,3342405 1,10442431 0,29492243
3,9017606
A l'intérieur des
groupes 1883,462278 156 12,0734761
Total 1896,796519 157
Nombre
d'échantillons Somme Moyenne
Variance
Analyse de variance: un facteur RAPPORT
DÉTAILLÉ
Groupes
? Gain de poids journalier

Degré de liberté
Source des variations
Somme des carrés
Valeur critique pour F
Moyenne
des carrés F
Probabilité
Nombre
d'échantillons Somme Moyenne
Variance
Groupes
Degré de liberté
Source des variations
Somme des carrés
Valeur critique pour F
Moyenne
des carrés F
Probabilité
R1 119 29,6266 0,25350127 0,00464932
R2 119 26,1346 0,2130962 0,00277632
ANALYSE DE VARIANCE
Entre Groupes 0,064486481 1 0,06448648 17,3685994 5,0861E-05
3,9017606
A l'intérieur des
groupes 0,579199899 156 0,00371282
Total 0,64368638 157
Nombre
d'échantillons Somme Moyenne
Variance
Analyse de variance: un facteur RAPPORT
DÉTAILLÉ
Groupes
Analyse de variance: un facteur
RAPPORT DÉTAILLÉ
R2 119 26,1346 0,2130962 0,00277632
R0 119 28,7086 0,24188101 0,00500946
ANALYSE DE VARIANCE
Entre Groupes 0,032728329 1 0,03272833 8,40721191 0,00427676
3,9017606
A l'intérieur des
groupes 0,60729043 156 0,00389289
Total 0,640018759 157
Analyse de variance: un facteur RAPPORT
DÉTAILLÉ
|
Nombre
Groupes d'échantillons
|
Somme
|
Moyenne
|
Variance
|
|
R1
|
119
|
29,6266
|
0,25350127
|
0,00464932
|
|
R0
|
119
|
28,7086
|
0,24188101
|
0,00500946
|
|
ANALYSE DE VARIANCE
|
|
|
|
|
|
Source des
variations
|
Somme des
carrés
|
Degré de
liberté
|
Moyenne
des carrés
|
F
|
Probabilité
|
Valeur critique
pour F
|
|
Entre Groupes
|
0,005333696
|
1
|
0,0053337
|
1,10442431
|
0,29492243
|
3,9017606
|
|
A l'intérieur des groupes
|
0,753384911
|
156
|
0,00482939
|
|
|
|
|
Total
|
0,758718608
|
157
|
|
|
|
|
? TCS
Analyse de variance: un facteur RAPPORT
DÉTAILLÉ
Nombre
Groupes d'échantillons Somme Moyenne
Variance
R1 119 394,949483 3,35379093 0,19710945
R2 119 373,636042 3,08400054 0,15949917
ANALYSE DE VARIANCE
|
Source des
variations
|
Somme des
carrés
|
Degré de
liberté
|
Moyenne
des carrés F
Probabilité
|
Valeur critique pour F
|
Entre Groupes 2,875080769 1 2,87508077 16,1245725 9,1918E-05
3,9017606
A l'intérieur
des groupes 27,81547225 156 0,17830431
Total 30,69055302 157

Nombre
d'échantillons Somme Moyenne
Variance
Groupes
Degré de liberté
Source des variations
Somme des carrés
Valeur critique pour F
Moyenne
des carrés F
Probabilité
Degré de liberté
Source des variations
Somme des carrés
Valeur critique pour F
Moyenne
des carrés F
Probabilité
Analyse de variance: un facteur
RAPPORT DÉTAILLÉ
R2 119 373,636042 3,08400054 0,15949917
R0 119 388,382566 3,2706654 0,22208333
ANALYSE DE VARIANCE
Entre Groupes 1,376328923 1 1,37632892 7,21379474 0,00801781
3,9017606
A l'intérieur
des groupes 29,76343516 156 0,19079125
Total 31,13976408 157
Analyse de variance: un facteur RAPPORT
DÉTAILLÉ
Nombre
Groupes d'échantillons Somme Moyenne
Variance
R1 119 394,949483 3,35379093 0,19710945
R0 119 388,382566 3,2706654 0,22208333
ANALYSE DE VARIANCE
Entre Groupes 0,272939223 1 0,27293922 1,30221337 0,25555806
3,9017606
A l'intérieur
des groupes 32,69703704 156 0,20959639
Total 32,96997626 157
? IC

Degré de liberté
Source des variations
Somme des carrés
Valeur critique pour F
Moyenne
des carrés F
Probabilité
Analyse de variance: un facteur
RAPPORT DÉTAILLÉ
|
Nombre
Groupes d'échantillons
|
Somme
|
Moyenne
|
Variance
|
|
R1
|
119
|
190,535645
|
1,60171702
|
0,22215577
|
|
R2
|
119
|
205,580123
|
1,79215346
|
0,24804536
|
|
ANALYSE DE VARIANCE
|
|
|
|
|
|
Source des
variations
|
Somme des
carrés
|
Degré de
liberté
|
Moyenne
des carrés
|
F
|
Probabilité
|
Valeur critique pour F
|
|
Entre Groupes
|
1,432508484
|
1
|
1,43250848
|
6,09317333
|
0,01464963
|
3,9017606
|
|
A l'intérieur des groupes
|
36,67568796
|
156
|
0,23510056
|
|
|
|
|
Total
|
38,10819644
|
157
|
|
|
|
|
Analyse de variance: un facteur
RAPPORT DÉTAILLÉ
Nombre
Groupes d'échantillons Somme Moyenne
Variance
R2 79 205,580123 1,79215346 0,24804536
R0 79 191,151548 1,60951327 0,23364303
ANALYSE DE VARIANCE
Entre Groupes 1,317618876 1 1,31761888 5,47083516 0,02060455
3,9017606
A l'intérieur
des groupes 37,57169402 156 0,24084419
Total 38,8893129 157
Analyse de variance: un facteur RAPPORT
DÉTAILLÉ
Nombre
Groupes d'échantillons Somme Moyenne
Variance
R1 119 190,535645 1,60171702 0,22215577
R0 119 191,151548 1,60951327 0,23364303
ANALYSE DE VARIANCE
|
Source des variations
|
Somme des
carrés
|
Degré de
liberté
|
Moyenne
des carrés F
Probabilité
|
Valeur critique pour F
|
Entre Groupes 0,002400868 1 0,00240087 0,01053477 0,91838128
3,9017606
A l'intérieur
des groupes 35,55230658 156 0,2278994
Total 35,55470745 157
? CEP
Analyse de variance: un facteur RAPPORT
DÉTAILLÉ
Nombre
Groupes d'échantillons Somme Moyenne
Variance
R1 119 227,991864 1,92394765 0,26780332
R2 119 210,542258 1,70306655 0,17732944
ANALYSE DE VARIANCE
|
Source des
variations
|
Somme des
carrés
|
Degré de
liberté
|
Moyenne
des carrés F
Probabilité
|
Valeur critique pour F
|
Entre Groupes 1,927144054 1 1,92714405 8,6587385 0,00375194
3,9017606
A l'intérieur
des groupes 34,72035475 156 0,22256638
Total 36,6474988 157

Nombre
d'échantillons Somme Moyenne
Variance
Groupes
Degré de liberté
Source des variations
Somme des carrés
Valeur critique pour F
Moyenne
des carrés F
Probabilité
Nombre
d'échantillons Somme Moyenne
Variance
Groupes
Degré de liberté
Source des variations
Somme des carrés
Valeur critique pour F
Moyenne
des carrés F
Probabilité
Analyse de variance: un facteur
RAPPORT DÉTAILLÉ
R2 119 210,542258 1,70306655 0,17732944
R0 119 228,758814 1,93365587 0,32014414
ANALYSE DE VARIANCE
Entre Groupes 2,100271578 1 2,10027158 8,44375133 0,00419606
3,9017606
A l'intérieur
des groupes 38,80293879 156 0,24873679
Total 40,90321036 157
Analyse de variance: un facteur
RAPPORT DÉTAILLÉ
R1 119 227,991864 1,92394765 0,26780332
R0 119 228,758814 1,93365587 0,32014414
ANALYSE DE VARIANCE
Entre Groupes 0,003722859 1 0,00372286 0,01266392 0,91054464
3,9017606
A l'intérieur
des groupes 45,85990125 156 0,29397373
Total 45,8636241 157
| 


