
Instituut voor Tropische Geneeskunde Antwerpen

Institut de Médecine Tropicale Anvers
Institute of Tropical Medicine Antwerp
Stichting van Openbaar Nut | 0410.057.701
Nationalestraat 155 - 2000 Antwerpen - België
Efficacité après 5 ans d'un projet
d'accès à la thérapie antirétrovirale en
République Démocratique du
Congo
Mémoire présenté en vue de l'obtention du
diplôme de
Master en Santé Publique, orientation Contrôle des
Maladies
par
LOANDO MBOYO Aimé
Antwerpen 2009
I. DEDICACE
Je dédie ce mémoire à mes parents,
ma femme et mes enfants.
A mon défunt Père Pierre MBOYO LOANDO et
à ma Mère BOMPONGO Marie pout tous les aspects positifs de ma
vie.
A ma très Chère Epouse bien aimée
Adèle YULA pour les encouragements et tous les sacrifices consentis au
cours de cette année de formation.
A mes Enfants bien aimés Clarice BOTULI, Liliane
BOMBUSA, Dorcas ELIKI, Pierre MBOYO et Laurianne BOMPONGO pour toutes les
privations.
Sentez et voyez combien l'Eternel est bon, heureux
l'homme qui cherche en lui son refuge. Craignez l'Eternel vous ses saints, car
rien ne manque à ceux qui le craignent (Psaume 34,9-10)
II. REMERCIEMENTS
Au Docteur Lut LYNEN et à sa collaboratrice Anja
WEGGHELEIRE pour l'encadrement, les conseils et orientations techniques qui
nous ont permis de réaliser ce travail de fin de Maitrise en
Santé publique. Merci aussi à Joris MENTEN pour la guidance
statistique.
A toute l'équipe Enseignante de l'Institut de
Médecine Tropicale (IMT) d'Anvers. Merci pour les enseignements de haute
qualité et les échanges qui nous ont permis d'acquérir des
compétences spécifiques en contrôle des maladies. Nos
remerciements particuliers au Professeur Docteur Marleen BOELAERT, à
notre coordinatrice Marjan PIRARD, à Marianne HILGERT et Nadine
NUYTS.
A la Direction Générale pour Coopération
au Développement (DGCD) pour la bourse d'études qui nous a permis
de suivre cette formation au Royaume de Belgique.
A l'organisation humanitaire Médecins Sans
Frontières Belgique (MSF-B) qui a mis à notre disposition toutes
les données nécessaires pour la réalisation de ce travail.
Nos remerciements particuliers au Docteurs Mit PHILIPS, Freya RASSCHAERT et
Marcel MANZI.
A tous ceux qui nous aidé d'une manière ou d'une
autre au cours de cette année de formation, nous disons un GRAND
MERCI.
III. LISTE DES
ABREVIATIONS
|
3TC :
|
Lamivudine
|
|
APD :
|
Aide publique au développement
|
|
ARV :
|
Antirétroviraux
|
|
AZT :
|
Zidovudine
|
|
CHK :
|
Centre hospitalier de Kabinda
|
|
CTA :
|
Centre de Traitement Ambulatoire
|
|
D4T :
|
Stavudine
|
|
DGCD :
|
Direction Générale pour la Coopération au
développement
|
|
EFV :
|
Efavirenz
|
|
GSS :
|
Générale des Services de Santé
|
|
HR :
|
Hazard Ratio
|
|
IC :
|
Intervalle de Confiance
|
|
IMC :
|
Indice de Masse Corporelle
|
|
IMT :
|
Institut de Médecine Tropicale
|
|
INRT :
|
Inhibiteur Nucléotidique de la Reverse Transcriptase
|
|
IO :
|
Infections Opportunistes
|
|
IP :
|
Inhibiteur de la Protéase
|
|
IQR :
|
Intervalle interquartiles
|
|
MAP :
|
Multi country Aids Program
|
|
MSF :
|
Médecins Sans Frontières
|
|
NVP :
|
Nevirapine
|
|
OMS :
|
Organisation Mondiale de la Santé
|
|
ONG :
|
Organisation Non Gouvernementale
|
|
ONUSIDA :
|
Programme commun des nations unies contre le VIH/SIDA
|
|
OPALS :
|
Organisation Panafricaine de Lutte contre le SIDA
|
|
PAM :
|
Programme Alimentaire Mondial
|
|
PCR :
|
Polymerase Chain Reaction
|
|
PIB
|
Produit intérieur brut
|
|
PNLS :
|
Programme National de lutte contre le SIDA
|
|
PNMLS :
|
Programme national multisectoriel de lutte contre le SIDA
|
|
PNUD :
|
Programme des nations unies pour le développement
|
|
RDC :
|
République Démocratique du Congo
|
|
SIDA :
|
Syndrome de l'immunodéficience humaine
|
|
TAR :
|
Traitement Anti Rétroviral
|
|
VIH :
|
Virus de l'immunodéficience humaine
|
IV. RESUME DU MEMOIRE
INTRODUCTION : La survie des patients
sous traitement antirétroviral en Afrique subsaharienne a
été suffisamment évaluée à court terme. La
probabilité de survie à moyen et long terme constitue une
préoccupation de santé publique mais reste encore sous
étudiée. Aussi la rétention des patients admis dans les
projets et n'ayant pas encore commencé la thérapie
antirétrovirale n'est pas suffisamment explorée.
METHODE : Nous avons mené de
manière rétrospective une analyse de cohorte de tous les patients
admis dans un projet pilote d'accès à la thérapie
antirétrovirale en République Démocratique du Congo. Pour
le groupe qui avait commencé cette thérapie la période
d'étude considérée allait du 22 octobre 2003 au 31
décembre 2008. La période d'étude pour le groupe sans
thérapie antirétrovirale allait du 15 février 2002 au 31
décembre 2008. La survie sous thérapie antirétrovirale a
été mesurée avec la méthode de Kaplan Meier et la
recherche des facteurs de risque par la régression à effet
proportionnel de Cox. Une analyse de cohorte a été
réalisée pour l'ensemble des patients admis au projet dans le but
d'évaluer la capacité globale de rétention.
RESULTATS : La probabilité de
survie à 4 ans pour les enfants sous thérapie
antirétrovirale était estimée à 88,9%
(scénario de base) et à 61% (scénario du pire). Pour les
patients adultes cette probabilité à 5 ans était à
78,6%(scénario de base) et à 66% (scénario du pire). La
malnutrition (indice de masse corporelle <18,5Kg/m²), la
dégradation sévère du système immunitaire
(CD4<50 cellules par mm) et le stade avancé de la maladie (Stade OMS
III ou IV) ont été identifiés comme les prédicteurs
indépendants de la survie chez les adultes. Aucun prédicteur fort
n'a été identifié pour la cohorte pédiatrique. En
ce qui concerne le groupe sans ARV (enfants et adultes) du projet, 6,2%
seulement étaient en suivi régulier à la fin de cette
étude.
CONCLUSION : Cette étude montre
les résultats satisfaisants de la survie à moyen terme sous
traitement antirétroviral dans un contexte à ressources
limitées. Par ailleurs les efforts doivent être mise en oeuvre
pour suivre efficacement le groupe sans ARV afin d'améliorer le taux de
rétention qui est assez médiocre dans cette étude.
LA TABLE DE MATIERES
I. DEDICACE
i
II. REMERCIEMENTS
ii
III. LISTE DES ABREVIATIONS
iii
IV. RESUME DU MEMOIRE
v
V. INTRODUCTION
1
VI. OBJECTIFS DE LA THESE
3
VII. CONTEXTE
4
VIII. METHODES
6
IX. RESULTATS
13
X. DISCUSSION
20
XI. RECOMMANDATIONS
24
XII. ATTRIBUTION DU MEMOIRE
A
XIII. REFERENCES BIBLIOGRAPHIQUES
B
INTRODUCTION
L'infection par le virus de l'immunodéficience humaine
(VIH) demeure un problème majeur de santé publique
internationale. En 2007, le nombre total des personnes infectées
à l'échelle mondiale était estimé à 33
millions (30-36 millions). Les nouvelles infections au cours de cette
même année étaient estimées à 2,7 millions
(2,2-3,2 millions) et les cas de décès à 2 millions
(1,8-2,3 millions). L'Afrique subsaharienne reste la région la plus
touchée avec 67% de toutes les infections et 75% de décès
(1).
Pour lutter efficacement contre cette mortalité, une
intervention médicale basée sur l'évidence scientifique
existe depuis 1996. Il s'agit de la thérapie antirétrovirale avec
la combinaison d'au moins 3 médicaments ayant la capacité
d'empêcher la réplication du VIH et de restaurer les
compétences immunitaires. Ce traitement se prend tous les jours, dure
toute la vie et nécessite un suivi médical régulier (2).
Environ 3 millions de personnes (2,7-3,2 millions) infectées par le VIH
suivaient ce traitement dans les pays à revenus faibles ou
intermédiaires en 2007. Dans ces régions, les personnes ayant
besoin de ce traitement étaient 9,7 millions (8,7-11 millions) et la
couverture en traitement ARV était donc estimée à 31%
(27-34%) (3).
L'efficacité opérationnelle de cette
thérapie sur la survie à long terme a été
démontrée dans les pays à revenus élevés.
L'espérance de vie pour un jeune VIH positif de 25 ans qui commence
actuellement la thérapie antirétrovirale est de 39 ans (IC95%
35-40 ans) au Danemark. Ce paramètre est de 51 ans pour un jeune VIH
négatif du même âge (4;5).
Depuis 1998, cette thérapie antirétrovirale est
utilisée en Afrique subsaharienne pour lutter contre la mortalité
liée au syndrome de l'immunodéficience acquise (SIDA) (6). En
2007, on estimait à 2,1 millions (1,9-2,3 millions) le nombre de
patients sous traitement ARV dans cette partie du monde (3). Plusieurs
études sur l'efficacité de la thérapie
antirétrovirale en Afrique ont relevé des taux satisfaisants de
survie à court terme, en dépit d'une mortalité
précoce importante favorisée par le recours tardif aux services
de prise en charge. Les principaux facteurs de risque étant le stade
avancé de la maladie, l'immunodéficience sévère,
l'anémie, la malnutrition et la faible adhérence des patients aux
programmes thérapeutiques (6-25). Ces premières études
à court terme ont confirmé la faisabilité des programmes
ARV dans le contexte africain et favorisé une grande mobilisation des
ressources. L'un des défis majeurs à présent est la
démonstration de cette faisabilité à moyen et long terme
car la thérapie rétrovirale contre l'infection VIH/SIDA est un
traitement à long terme. Une revue systématique de la
littérature réalisée par Rosen et collaborateurs sur 33
études de cohorte dans 13 pays de l'Afrique subsaharienne a
montré une faible rétention des patients africains sous
traitement ARV à cause de la mortalité et perdus de vue. La
prédiction de la rétention dans ces cohortes à deux ans a
été estimée à 50% dans le scénario
plausible (26). Les problèmes de mortalité et perdus de vue
se posent également dans le groupe des patients éligibles mais
n'ayant pas encore commencé le traitement antirétroviral (liste
d'attente). Ce phénomène est encore sous étudiée
dans plusieurs programmes en Afrique qui focalisent leurs système de
monitoring sur le groupe des patients sous ARV (27). La rétention des
patients apparait désormais comme une priorité pour les
programmes de prise en charge de l'infection VIH/SIDA en Afrique subsaharienne.
Toute recherche qui essaie de contribuer à mieux comprendre ce
phénomène de faible rétention est plus que
nécessaire. Ce travail s'inscrit donc dans cette démarche de
santé publique.
Notre question de recherche consistait à mesurer
l'efficacité d'un projet d'accès à la thérapie
antirétrovirale en République Démocratique du Congo. Le
volet principal était la mesure de la rétention pour l'ensemble
des patients et la survie à 5 ans après initiation de la
thérapie antirétrovirale. Le second volet consistait à
identifier les principaux prédicteurs de cette survie.
I. OBJECTIFS DE LA THESE
Objectif général
Evaluer l'efficacité d'un projet d'accès au
traitement antirétroviral en République Démocratique du
Congo sur les aspects de rétention et survie à moyen terme,
identifier les principaux prédicteurs de cette survie afin de proposer
les mesures correctrices nécessaires.
Objectifs spécifiques
1. Déterminer la rétention après 5 ans
pour l'ensemble des patients admis dans le projet
2. Déterminer la survie après 5 ans pour les
enfants et adultes mis sous ARV dans le projet
3. Identifier les prédicteurs de la survie sous
thérapie antirétrovirale
4. Elaborer un plan d'amélioration basé sur
l'évidence
II. CONTEXTE
La République Démocratique du Congo (RDC) est un
pays d'Afrique Centrale. Sa population est actuellement estimée à
estimée 60 millions d'habitants. Dotée d'immenses ressources
naturelles variées, la RDC figure parmi les trois derniers pays du
classement mondial sur la base du produit intérieur brut (PIB) par
tête d'habitant (28). L'espérance de vie à la naissance en
bonne santé est actuellement estimée à 44 ans pour les
hommes, 46 ans pour les femmes et 45 ans pour les deux sexes (29). Les
performances du système sanitaire sont faibles et une réforme est
en cours pour tenter d'améliorer la situation (30). L'aide publique au
développement(APD) et les interventions humanitaires constituent les
principales réponses aux problèmes sanitaires de la population.
La prévalence de l'infection VIH est actuellement estimée
à 1,3% (IC95% : 1,2-1,5) pour la population âgée de 15
à 49 ans. Le ratio d'infection entre les femmes et les hommes est de
1,78. Il s'agit d'un pays avec épidémie VIH
généralisée (31). Les premiers cas de SIDA en RDC ont
été décrits par Piot et collaborateurs en 1983 à
l'hôpital Mama Yemo de Kinshasa (32). Pendant près de vingt ans
après les premières notifications, la stratégie nationale
de riposte contre l'épidémie était basée
essentiellement sur la prévention de nouvelles infections. Les
premières recommandations nationales sur la prise en charge de
l'infection VIH/SIDA ont été élaborées en 2002
(33). Au cours de la même année, Médecins Sans
Frontières lança en collaboration avec le ministère de la
santé le premier projet pilote dans la ville de Kinshasa, capitale du
pays. C'est ce projet qui a été évalué dans le
cadre de ce travail. A cause de son importance, ce projet fait partie des 52
programmes spécialisés du ministère congolais de la
santé. Le projet était mise en oeuvre à travers un centre
spécialisé pour la prise en charge globale et gratuite de
l'infection VIH/SIDA. Le choix du modèle vertical était
justifié par les difficultés d'intégration dans les
structures sanitaires de Kinshasa. Le modèle choisi était celui
d'un centre de traitement ambulatoire (CTA) selon la formule
développé par l'Organisation Panafricaine de Lutte contre le SIDA
(OPALS) avec la création du premier CTA à Brazzaville en
République du Congo en 1994 (34). Ce projet est totalement
financé avec des fonds propres MSF et ceux des coopérations
belges et japonaises. Toutes les procédures de gestion et de supervision
étaient assurées par Médecins sans Frontières
Belgique. Le projet a fonctionné avec un support global de
Médecins Sans Frontières Belgique avec l'approvisionnement
régulier en médicaments, paiement des primes du personnel,
réhabilitation des infrastructures, équipements, paiement des
frais hospitalisation, formation du staff, gestion des ressources et
supervision des activités. Depuis sa mis en place en 2002 jusqu' au
premier semestre 2008, le CTA a fonctionné comme un hôpital de
jour spécialisé pour la prise en charge globale des personnes
vivant avec le VIH. Le modèle inclut un service de dépistage, les
consultations médicales de première et deuxième ligne, le
laboratoire, les consultations d'observance, la prise en charge nutritionnelle,
le suivi psychosocial, l'hospitalisation du jour et la référence
pour les soins hospitaliers. A partir du second semestre 2008, le volet
hospitalisation de nuit a démarré transformant le CTA en Centre
Hospitalier de Kabinda (CHK). De 2002 à 2005, le projet avait
fonctionné avec une cohorte ouverte à toute la ville de Kinshasa.
Tous les sites de dépistage VIH de la ville de Kinshasa avaient la
possibilité de référer les patients vers le projet. A
partir de 2006 le projet s'est réorienté vers la prise en charge
du noyau familial des anciens patients avec un accès particulier sur la
prise en charge pédiatrique. La fermeture de la cohorte était
justifiée par la saturation et la disponibilité des offres
alternatives des soins dans la ville avec les autres initiatives d'accès
à la thérapie antirétrovirale. En effet en 2003 une
seconde initiative ARV a démarré dans la ville de Kinshasa
grâce à un partenariat entre le ministère de la
santé et la firme indienne CIPLA. Les objectifs de ce partenariat
étaient de fournir les médicaments antirétroviraux dans le
système de santé congolais, former les médecins
prescripteurs et fournir les équipements nécessaires pour le
suivi biologique. Le coût mensuel des médicaments était de
29 dollars américains et tous les autres services étaient
payants. Une troisième initiative va démarrer effectivement en
2005 avec deux financements importants qui vont être accordés
à la RDC pour améliorer la couverture ARV par la Banque Mondiale
et le Fonds Mondial.(35) Depuis 2007 le volet pédiatrique est
appuyé par la Fondation Clinton. La couverture nationale en
thérapie antirétrovirale était estimée à 4,2
% en 2007 (36)
III. METHODES
Type d'étude
Cette analyse de cohorte était conduite suivant un plan
longitudinal et rétrospectif. La période d'étude allait du
15 février 2002 au 31 décembre 2008 pour la première
partie de l'analyse sur le profil évolutif de tous les patients
après admission. Pour la survie après initiation de la
thérapie antirétrovirale, la période
considérée allait du 22 octobre 2003 au 31 décembre
2008.
Méthodes de sélection
La sélection des sujets pour cette étude
rétrospective était réalisée sur base d'une liste
des critères. Le sujet éligible devait d'abord disposer d'un
dossier médical électronique au projet CTA Kabinda avec un
numéro d'identification justifiant son statut de
séropositivité VIH. La date d'admission dans le projet devait se
situer entre le 15 février 2002 et 31 décembre 2008 inclus. Au
moins une visite de consultation était nécessaire après
l'ouverture du dossier. Toutes les catégories d'âges
étaient prises en considération. Pour les patients ARV, la date
d'initiation du traitement devait se situer entre le 22 octobre 2003 et 31
décembre 2008. Les patients adultes sous thérapie
antirétrovirale devaient être ARV naïfs et disposer d'au
moins 90% des informations à l'initiation sur les 10 variables
indépendantes utilisées comme prédicteurs potentiels. Il
s'agissait du sexe, l'âge, le niveau d'éducation, le statut
matrimonial, l'origine géographique, l'indice de masse corporelle (IMC),
le stade clinique OMS, le taux de CD4, le régime de traitement ARV,
l'année du début de la thérapie antirétrovirale.
Les enfants de moins de 15 ans sous traitement ARV étaient aussi pris en
considération dans les analyses. Le statut VIH+ était
défini par deux tests rapides positifs. Un patient était
considéré comme ARV naïf s'il n'avait jamais commencé
la thérapie antirétrovirale avant l'admission dans le projet. Les
patients avec antécédents de traitement ARV pendant moins d'un
mois étaient également considérés comme ARV
naïfs.
Méthodes d'intervention
Conseils et dépistage volontaire
Les activités de dépistage étaient
organisées selon l'approche « initiation par le
client ». La majorité des clients étaient
référés par les sites partenaires après une
première procédure de dépistage VIH. A cause des
problèmes de fiabilité, un contrôle systématique des
résultats était réalisé au niveau du projet avant
l'admission. Un consentement éclairé et écrit était
requis avant de procéder aux analyses de dépistage. Le
dépistage VIH était réalisé à l'aide des
tests rapides validés par le laboratoire national de
référence VIH/SIDA de Kinshasa. L'algorithme prévoyait de
commencer, à partir de 12 mois d'âge, avec le test Determine®
(Abbott, USA). Au cas où ce premier test était négatif on
notifiait au client un résultat négatif. Un premier test positif
nécessitait la confirmation par le test Uni-Gold® (Trinity Biotech,
Ireland). Le client était notifié comme positif en cas de
conformité entre ces deux tests. Sinon on notifiait le client comme
indéterminé avec possibilité de refaire le test
après six semaines. Les échantillons des cas persistants comme
indéterminés étaient envoyés au laboratoire
national. Le dépistage VIH des enfants de moins de 12 mois était
réalisé par test PCR à ARN au niveau des projets
partenaires (projet SARA de l'université Nord Caroline et la Fondation
Clinton).
Dépistage et prise en charge des Infections
Opportunistes
Après un conseil post test positif, le patient
était orienté sur le même site à l'unité des
consultations médicales pour son premier bilan. Un dossier
médical était ouvert avec un code numérique
spécifique. Le bilan clinique était orienté vers la
recherche des infections opportunistes et la catégorisation du patient
selon les stades cliniques OMS. La prophylaxie primaire au Cotrimoxazole
était administrée à tous les patients à partir du
stade clinique II OMS. La recherche active de la tuberculose était
fortement recommandée au cours de cette première visite. Un
protocole de prise en charge syndromique des infections opportunistes
était en place pour pallier aux difficultés de la prise en charge
étiologique. Tous les consultants étaient formés et
régulièrement recyclés sur cette stratégie. Les
médicaments génériques prescrits par les médecins
du centre étaient offerts gratuitement à tous les patients. Le
traitement du sarcome de Kaposi par chimiothérapie était
également disponible au niveau du projet. Les suspects et cas
confirmés de tuberculose étaient orientés vers un centre
spécialisé de dépistage et prise en charge de la
tuberculose situé à proximité sur le même site.
Traitement antirétroviral
Au cours des deux premières années du projet,
l'initiation de la thérapie était conditionnée par un taux
de CD4<200 cellules/mm quelque soit le stade clinique OMS. Les
critères d'initiation de la thérapie antirétrovirale ont
été revus en 2005 au niveau national. Tous les patients adultes
et aux stades IV OMS étaient désormais éligibles pour
commencer le traitement. Les patients aux stades III avec CD4 <350
cellules/mm étaient également éligibles, ainsi que ceux
aux stades I et II avec CD4< 200 cellules/mm. Les critères
d'initiation ARV pour les enfants étaient également conformes au
protocole national (33).
La première ligne était une trithérapie
constituée de deux inhibiteurs nucléosidiques de la reverse
transcriptase(INRT) et d'un inhibiteur non nucléosidiques de la
même enzyme(INNRT). Quatre schémas de première ligne
étaient disponibles avec les médicaments
génériques. Il s'agissait des associations Stavudine (D4T) +
Lamivudine (3TC) + Nevirapine (NVP) ; Zidovudine (AZT) + 3TC + NVP, D4T +
3TC +Efavirenz (EFV) et AZT + 3TC + EFV. L'association AZT+d4T+NVP était
recommandée pour les enfants de moins de 3 ans.
Les critères non médicaux étaient
très rigides au cours des deux premières années. Le
patient devait prouver une bonne adhérence à la prophylaxie
Cotrimoxazole, subir une évaluation sociale à domicile et
attendre la décision d'un comité de validation qui se
réunissait une fois par mois. Les visites de suivi médical
étaient mensuelles au cours de la première année et
trimestrielles à partir de la deuxième année. Les patients
avaient également la possibilité de consulter à tout
moment en cas de problème.
Laboratoire et suivi biologique
Un laboratoire était opérationnel sur place dans
le centre avec du personnel qualifié et un équipement de base. La
numération CD4 était réalisé à l'aide d'un
appareil de type Partec CyFlow® Counter (PARTEC,
Germany). Le contrôle CD4 était réalisé
tous les six mois. La charge virale n'était pas réalisée
au niveau du projet. Les prélèvements sanguins des patients
suspects d'échec thérapeutique étaient envoyés au
laboratoire national de référence.
Prise en charge psychosociale
Un service social était accessible aux patients tous
les jours ouvrables. Deux assistants sociaux travaillaient à plein temps
et offraient un service personnalisé d'écoute sociale. Le service
fonctionnait principalement en réseau avec les organisations non
gouvernementales locales partenaires du projet pour la référence
psychosociale.
Le paquet social offert par les partenaires était
constitué principalement les cellules d'écoute, l'appui
nutritionnel, la scolarisation des enfants, les activités
génératrices des revenus et les visites à domicile. Plus
de 250 volontaires partenaires étaient formés par le projet pour
couvrir les 24 communes de la ville de Kinshasa. Les réunions de
concertation et échanges étaient organisées chaque mois
avec les responsables des organisations partenaires.
Education thérapeutique
Avant de commencer le traitement ARV, les patients suivaient
une session préparatoire sur le traitement et l'importance de
l'adhérence. L'initiation du traitement était conditionnée
par une évaluation positive des connaissances acquises par le patient.
Au cours du traitement les consultations d'observance étaient
dispensées par une équipe des conseillers. Les patients avec
difficultés d'adhérence étaient
référés par les médecins vers les conseillers pour
une session plus approfondie. L'observance était mesurée par la
régularité aux rendez-vous et le compte des médicaments
restants à la dernière consultation par la pharmacie.
Tous les jours ouvrables, une équipe des
éducateurs thérapeutiques animaient des sessions dans la salle
d'attente. Plusieurs sujets étaient abordés dont l'importance de
l'observance au traitement. Les projections vidéo étaient aussi
organisées dans la salle d'attente avec des moments d'échanges et
de discussion. Le projet avait développé un modèle de
support à l'adhérence basé sur le renforcement des
capacités des patients stabilisés. Une fois par semaine les
patients habitant la même zone géographique se rencontraient pour
partager leurs expériences dans les groupes de support.
Références et décentralisation vers
les structures partenaires
Le centre offrait principalement une prise en charge
ambulatoire et disposait d'un hôpital de jour pour les soins d'urgence.
Une ambulance était disponible pour le transport des malades vers les
hôpitaux partenaires. Les frais liés à ces hospitalisations
étaient totalement payés par le projet. Les formations et stages
de perfectionnement étaient organisés pour les prestataires des
structures partenaires. Les visites de suivi étaient organisées
par une équipe du projet (médecin et assistant social). Les
consultations et soins spécialisés (ophtalmologie, cardiologie et
autres) recommandées par les médecins généralistes
du CTA étaient totalement payés par le projet. Le volet
décentralisation des patients ARV stables vers les centres de
santé a démarré à la fin de l'année 2004.
Prise en charge nutritionnelle
Un service nutritionnel était disponible pour la
réhabilitation des patients gravement malnutris (Indice de masse
corporelle inférieur à 17). L'approvisionnement des vivres
était assuré grâce à un partenariat avec le
Programme Alimentaire Mondial (PAM) et le paquet des vivres était
composé de farine de maïs, biscuits énergétiques,
haricots, huile végétale, sucre et sel.
Recherche active des perdus de vue
Un système de recherche active était mis en
place pour les patients perdus vue sous traitement antirétroviral. Un
patient sous ARV était considéré comme perdus de vue
à partir de 3 mois au-delà de la date prévue de sa visite
au centre. Le système était basé principalement sur la
collaboration des volontaires partenaires du projet à partir des listes
générées par le logiciel FUCHIA (Epicentre) et
croisées avec le registre du service social.
Méthodes d'évaluation
Collecte des données
Chaque patient disposait d'une fiche médicale papier
pour la collecte des informations. Cette collecte était assurée
par les médecins et infirmiers pendant les consultations
médicales. Les fiches étaient ensuite transférées
vers une unité de saisie sur le logiciel FUCHIA (Epicentre).Deux
personnes formées s'occupaient spécialement de cette base de
données électroniques. La saisie des données par simple
entrée sur le logiciel se faisait de manière anonyme et
l'accès était protégé par un code secret. Chaque
patient était identifié par un code numérique. Un
système de contrôle de qualité (interne et externe)
était en place pour détecter et corriger les erreurs. Un
système interne au programme informatique (logiciel R) permettait de
générer la liste automatique des erreurs. Le contrôle
externe était assuré par les responsables du projet.
Analyses statistiques
Analyses descriptives
La première analyse descriptive avait porté sur
le profil évolutif de tous les patients du projet après
admission. Les patients étaient catégorisés en 4 groupes
incluant les décédés, perdus de vue, les
transférés et les suivis réguliers. Le groupe de
décès englobait l'ensemble des patients admis dans le projet
pendant la période de l'étude et décédés
quelque soit la cause. Les perdus de vue étaient des admis du projet
dont on avait plus d'information 3 mois au-delà de la date prévue
de leur prochain rendez-vous pour les patients sous ARV. Ce délai
était de 6 mois pour les patients qui n'étaient pas encore sous
thérapie antirétrovirale. Les transférés
étaient des patients référés vers une autre
structure pour continuer la prise en charge. Les suivis réguliers
étaient des patients qui étaient en vie et continuaient à
suivre le traitement dans le projet. Le résumé statistique de
chaque groupe était assuré par les proportions.
La seconde analyse avait permis de décrire les
caractéristiques cliniques, socioéconomiques et biologiques des
patients à l'admission pour le groupe sans ARV et au début du
traitement antirétroviral. Les 10 variables indépendantes pour
les adultes étaient l'âge (=35 ans et > 35 ans), le sexe,
l'état-civil en 3 catégories (célibataire, mariés
et autres), le niveau d'éducation en 4 catégories
(analphabète, primaire, secondaire et supérieure), l'origine
géographique (<5km et >5 km), l'indice de masse corporelle
(<18,5 kg/m² et = 18,5 kg/m²), le stade clinique OMS(I&II et
III&IV), le taux de CD4 en 3 catégories (=50 cellules/mm, >50
cellules/mm et données non renseignées), le type de traitement
ARV à l'initiation en 3 catégories (INRT+NVP, INRT+EFV et REGIME
IP) et l'année du début de la thérapie
antirétrovirale(2003-2006 et 2007-2008). Les 6 variables
indépendantes pour la cohorte pédiatriques étaient
l'âge (<5 ans et = 5ans), le sexe, l'origine géographique, le
stade clinique OMS, le type de traitement et l'année du début.
Les médianes avec leurs intervalles interquartiles (IQR) ont
été utilisées pour résumer les variables
quantitatives. Les variables qualitatives étaient résumées
avec les proportions.
Analyse de survie des patients sous thérapie
antirétrovirale
Le début de l'observation de la survie pour les
adultes était fixé au 22 octobre 2003 et la fin au 31
décembre 2008. Pour la cohorte pédiatrique la période
d'observation avait débuté le 22 septembre 2004. La variable
d'intérêt primaire était le délai jusqu'à la
survenue du décès (toutes causes). Le temps d'observation des
patients décédés était clôturé
à la date de la mort. Les perdus de vue étaient censurés
à droite et à la date de leurs dernières visites au
projet. Les suivi réguliers et les transférés
étaient également censurés à droite et à la
date de leurs dernières visites. Il s'agissait de l'hypothèse la
plus plausible pour ce projet (scénario de base). Par ailleurs une
analyse de sensibilité a été réalisée avec
l'hypothèse selon laquelle les perdus de vue seraient
décédés juste après leurs dernières visites
(scénario du pire). L'analyse de survie a été
réalisée à l'aide des courbes de Kaplan Meier. Le test
statistique de Log-Rank a été utilisé pour comparer les
sous groupes et le test était considéré comme significatif
au dessous du seuil de 0,05.
Analyses multi variées avec la régression
de COX
La recherche des facteurs de prédiction de la survie
sous ARV a été assurée à l'aide de la
régression de COX. L'objectif de l'analyse était la
prédiction de la survenue du décès en fonction des
variables indépendantes signalées plus haut. Les critères
utilisés étaient la précision et la parcimonie. Toutes les
variables avaient la même valeur dans le processus de
modélisation. Une première sélection des variables a
été réalisée à l'aide de la valeur p du test
du rapport de vraisemblance. Les variables avec une valeur p inférieur
à 0,10 étaient retenues pour la modélisation. Une seconde
sélection basée sur le gain de précision par le même
test a permis de construire un modèle final. Le seuil de signification
pour l'intégration dans le modèle final était de 0,05. La
force d'association entre une variable indépendante et
l'événement était mesurée par le test de Wald et le
hazard ratio. Un hazard ratio égal à 1 signifiait une absence
d'association dans les limites de cette étude. L'analyse des
données était réalisée à l'aide du logiciel
STATA 10 (STATA Corp., Collège Station, Texas, USA).
IV. RESULTATS
Du 15 février 2002 au 31 décembre 2008, 6453
personnes vivant avec le VIH étaient admises pour prise en charge au
CTA Kabinda. Parmi elles, 3041 avaient commencé la thérapie
antirétrovirale entre le 22 octobre 2003 et le 31 décembre 2008.
Nous avions exclut dans ce groupe 12 patients pour données manquantes
sur l'IMC. L'étude a donc porté sur 3029 patients pour le groupe
ARV et 3412 patients pour le groupe sans ARV.
Caractéristiques et évolution de tous les
patients du projet
Le groupe sans ARV était constitué de 3412
patients dont 149 enfants de moins de 15 ans. Ce groupe regroupait les patients
qui n'avaient jamais commencé la thérapie antirétrovirale
pendant la durée de l'étude. Le ratio femme sur homme
était de 1,9. A l'admission 2649(78%) étaient aux stades III ou
IV de l'OMS. Au niveau nutritionnel 1818 (53,2%) avaient un indice de masse
corporelle inférieure à 18,5 kg/m². Sur 1910 patients qui
disposaient des données sur le taux CD4 à l'admission, 1048
avaient un taux inférieur à 200 cellules /mm.
Le groupe ARV était constitué de 3029 patients
dont 128 enfants de moins de 15 ans. A l'initiation de la thérapie
antirétrovirale, la médiane d'âge pour la cohorte
pédiatrique était de 7 ans (IQR : 4-10 ans) et 79,7%
étaient aux stades cliniques III ou IV de l'OMS. Pour la cohorte adulte
2226(76,7%) étaient aux stades III ou IV à l'admission au niveau
du projet. Les caractéristiques des patients adultes à
l'initiation ARV sont résumées au Tableau 1. L'âge
médian était de 39 ans (IQR : 33-46). La médiane CD4
était estimée à 123 cellules/mm (IQR : 48-193) pour
48% des patients qui disposaient de cette information. Les inclusions dans le
projet ont diminué à partir de 2006 suite à la fermeture
de la cohorte pour les nouveaux patients n'appartenant pas aux noyaux familiaux
des anciens patients du projet.
L'évolution des patients de chaque groupe est
décrite en détails sur la figure I. Pour l'ensemble des 6441
patients inclus dans cette étude, nous avions noté 805
décès (12,5%), 425 transferts (6,6%), 3126 perdus de vue (48,5%)
et 2085 en suivi régulier (32,4%). Le taux global de rétention du
projet a été estimé à 39% (suivis réguliers
et transférés).
Figure I. Profil de la cohorte d'étude CTA
Kabinda
6453 patients
(2002 - 2008)
Groupe sans ARV 3412 patients
Groupe ARV 3041
Suivis réguliers : 210
(6,2%)
92 transferts (2,7%)
295 décès (8,6%)
2815 perdus de vue (82,5%)
Enfants <15 ans : 128 patients
Adultes :
2913 patients
Suivis réguliers :
89 (69,5%)
Suivis réguliers : 1786
(62%)
2901
311 transferts (10,7%)
7 décès (5,5%)
22 transferts (17,2%)
10 perdus de vue (7,8%)
301 perdus de vue (10,3%)
503 décès (17%)
12 exclus
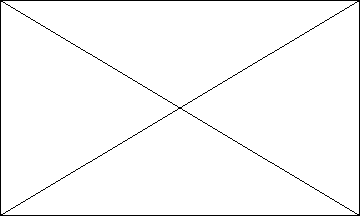
Fin de l'observation : 31/12/2008
La survie sous thérapie
antirétrovirale
Nous avons analysé d'abord la survie pour la cohorte
adule. La probabilité de survie pour les adultes était
estimée à 89% (IC95% : 87-90) à 6 mois, 85%
(IC95% : 84-87) à un an, 82% (IC 95% : 81-84) à deux
ans, 80% (IC95% : 79-82) à trois ans, 79% (IC95% : 77-80)
à quatre ans et 78% (IC95% : 76-80) à cinq ans avec le
scénario de base (Figure II). Avec le scénario du pire, la
probabilité de survie pour les adultes était de 80%
(IC95% : 78-81) à un an, 73%(IC95% : 72-75) à deux
ans et 66% (IC95% : 64-69) après cinq ans de suivi (voir figure
III).
La même analyse a été faite pour la
cohorte pédiatrique. Dans ce groupe cette probabilité
était estimée à 96% (IC95% : 91-98) à 6 mois,
95% (IC95% : 90-98) à un an, 94% (IC95% : 88-97) à
deux ans et à 88% (95%IC : 69-96) à quatre ans. La survie
des enfants était considérée comme significativement
différente de celle des adultes dans le scénario qui ne
considérait comme évènement que les décès
(Figure II). Avec le scénario du pire (perdus de vue
considérés comme décédés après la
dernière visite), la probabilité de survie était de 94%
(IC95% 88-97) à six mois, 91% (IC 85-95) à une
année, 89% (IC95% 82-93) à deux ans et 61%(IC95% 27-83)
après 4 ans de suivi dans le projet. La différence entre les
adultes et les adultes n'a pas été observée dans ce
scenario (Figure III).
Prédicteurs de la survie sous thérapie
antirétrovirale
La recherche des prédicteurs de la survie sous ARV a
été réalisée par la régression de Cox. Au
niveau de la cohorte adulte, la première sélection des variables
basée sur le test de rapport de vraisemblance avait permis de retenir 6
variables ayant une valeur p inférieur à 0,10. Il s'agissait par
ordre de puissance de l'indice de masse corporelle (IMC), le taux des CD4, le
stade clinique OMS, l'année de début du traitement, l'état
civil et le régime de traitement. La deuxième sélection a
été faite avec le même test en se basant sur le gain de
précision avec un seuil de signification de 0,05. Ce qui avait aboutit
à la construction d'un modèle final composé de 3
variables, IMC, CD4 et stade OMS (Tableau 2), en fonction des critères
de précision et de parcimonie. Avec le scénario pire, la
régression de COX a permis de construire un modèle final avec
l'indice de masse corporelle, le taux de CD4 et le sexe. Les patients malnutris
avec un IMC inférieur à 18,5 deux fois plus de risque (HR 2,3
IC95% : 1,9-2,6) de mourir par rapport à ceux qui avait un bon
statut nutritionnel. Les hommes avaient un risque de décès 1,3
fois plus élevé par rapport aux femmes. Les patients avec CD4
inférieur à 50 cellules/mm avaient un risque double de mourir par
rapport aux autres.
Une procédure identique a été
utilisée pour la cohorte pédiatrique avec les variables âge
(<5 ans et = 5ans), le sexe, l'origine géographique, le stade
clinique OMS, le type de traitement et l'année du début. Aucun
prédicteur n'a été identifié dans les deux
scénarios.
Figure II. Courbes de Kaplan- Meier pour l'estimation
de la survie par rapport à l'âge des patients enfants et adultes
(événement=décès)
0.00
0.25
0.50
0.75
1.00
2901
2116
1656
878
206
14
Adultes
128
103
75
19
2
0
Enfants
Nombre à risque
0
1
2
3
4
5
Temps en année
Enfants <15ans
Adultes
Valeur p <0,01 (log-rank)

Figure III. Courbes de Kaplan- Meier pour l'estimation
de la survie par rapport à l'âge des patients
(événement : décès et perdus de
vue).
0.00
0.25
0.50
0.75
1.00
2901
2116
1656
878
206
14
Adultes
128
103
75
19
2
0
Nombre à risque
Enfants < 15 ans
0
1
2
3
4
5
Temps en année
Enfants <15ans
Adultes
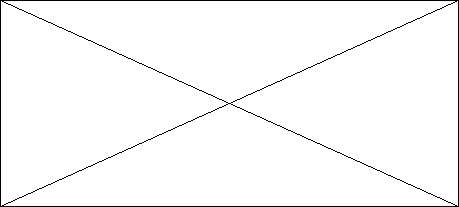
Tableau 1. Caractéristiques des patients
adultes à l'initiation de la thérapie antirétrovirale
(n=2901)
|
Variable
|
Catégorie
|
N
|
%
|
|
Sexe
|
Féminin
|
2115
|
73
|
|
Masculin
|
786
|
27
|
|
Age
|
= 35 ans
|
1030
|
36
|
|
> 35 ans
|
1871
|
64
|
|
Etat civil
|
Célibataire
|
685
|
24
|
|
Marié(e)
|
974
|
33
|
|
Autres
|
1240
|
42,7
|
|
Non renseigné
|
2
|
<0,1
|
|
Origine
|
< 5 km
|
631
|
22
|
|
= 5km
|
2270
|
78
|
|
Education
|
Aucune
|
109
|
4
|
|
Primaire
|
435
|
15
|
|
Secondaire
|
1994
|
68,7
|
|
Supérieur
|
347
|
12
|
|
Non renseigné
|
16
|
<1
|
|
IMC
|
< 18,5 kg/m²
|
1101
|
38
|
|
= 18,5 kg/m²
|
1800
|
62
|
|
Stade OMS
|
Stades I ou II
|
216
|
7
|
|
Stade III ou IV
|
2685
|
93
|
|
CD4
|
= 50 cellules/mm
|
370
|
13
|
|
> 50 cellules/mm
|
1020
|
35
|
|
Non renseigné
|
1511
|
52
|
|
Traitement
|
INRT + NVP
|
2743
|
94,5
|
|
INRT + EFV
|
155
|
5,3
|
|
Régime IP
|
3
|
<1
|
|
Année
|
2003- 2006
|
2630
|
91
|
|
2007-2008
|
271
|
9
|
Tableau 2. Prédicteurs de la survie
après initiation de la thérapie antirétrovirale pour les
patients adultes (événement = décès)
|
Variable
|
Catégorie
|
HR (95%IC)
|
p-value
|
HR ajusté (95%IC)
|
p- value
|
|
Sexe
|
Féminin
|
1
|
|
_____
|
|
|
Masculin
|
1,11(0,92-1,35)
|
0,253
|
_____
|
|
|
Age
|
= 35 ans
|
1
|
|
_____
|
|
|
> 35 ans
|
0,97(0,81-1,16)
|
0,762
|
_____
|
|
|
Etat civil
|
Célibataire
|
1
|
|
_____
|
|
|
Marié(e)
|
0,75(0,59-0,95)
|
0,020
|
_____
|
|
|
Autres
|
0,91(0,73-1,13)
|
0,413
|
_____
|
|
|
Origine
|
< 5 km
|
1
|
|
_____
|
|
|
= 5km
|
1,08(0,87-1,34)
|
0,444
|
_____
|
|
|
Education
|
Aucun
|
1
|
|
_____
|
|
|
Primaire
|
0,86(0,53-1,40)
|
0,561
|
_____
|
|
|
Secondaire
|
0,93(0,59-1,44)
|
0,749
|
_____
|
|
|
Supérieur
|
0,71(0,42-1,19)
|
0,198
|
_____
|
|
|
IMC :
|
< 18,5 kg/m²
|
3,13(2,61-3,74)
|
<0,001
|
2,72(2,26-3,27)
|
<0,001
|
|
= 18,5 kg/m²
|
1
|
|
1
|
|
|
Stade OMS
|
Stades I ou II
|
1
|
|
1
|
|
|
Stade III ou IV
|
3,11(1,79-5,40)
|
<0,001
|
2,32(1,33-4,04)
|
0,003
|
|
CD4:
|
= 50 cellules/mm
|
3,18(2,47-4,09)
|
<0,001
|
2,35(1,80-3,03)
|
<0,001
|
|
> 50 cellules/mm
|
1
|
|
1
|
|
|
Non renseigné
|
1,39(1,12-1,72)
|
|
1,34(1,08-1,66)
|
0,007
|
|
Traitement
|
INRT + NVP
|
1
|
|
_____
|
|
|
INRT + EFV
|
1,27(0,80-1,83)
|
0,180
|
_____
|
|
|
Année
|
2003- 2006
|
2,24(1,40-3,59)
|
0,001
|
_____
|
|
|
2007-2008
|
1
|
|
_____
|
|
V. DISCUSSION
Caractéristiques et évolution de tous les
patients du projet
Les résultats de cette étude montrent d'abord
que le recours aux soins a été tardif pour la majorité des
patients admis dans ce projet. Selon nous quatre facteurs importants expliquent
cette situation dans le contexte de Kinshasa. En effet ce projet a
démarré 20 ans après la notification du premier cas SIDA
dans cette ville en 1983. La masse des patients au stade SIDA était
déjà importante et le premier projet ARV de la ville ne pouvait
que faire face à cette triste réalité. Ensuite le
modèle de dépistage préconisé par la politique
nationale VIH repose principalement sur l'initiative du client. Dans un
contexte de forte stigmatisation et faible sensibilisation au dépistage
VIH, les personnes hésitent longtemps avant de prendre cette initiative.
Enfin les patients admis dans le projet étaient en grande partie
pré sélectionnés après un dépistage VIH+ au
niveau de 130 sites partenaires avant la référence vers le
projet.
Il apparait aussi dans cette étude une faible
rétention (6,2%) chez les patients qui n'ont pas encore commencé
le traitement antirétroviral avant. Le modèle d'organisation des
soins mis en place au début du projet pour gérer cette
problématique du recours tardif n'a pas fonctionné comme il
fallait, principalement à cause du manque d'expérience des
acteurs pendant la phase de démarrage des activités. En effet les
patients en situation critique étaient référés en
dehors du projet, vers certains hôpitaux de ville avec un personnel
insuffisamment préparé à la gestion des infections
opportunistes sévères. Le plateau technique de ces structures
était très limité pour le diagnostic et traitement des
infections des stades III et IV de l'OMS. Aussi les références
n'étaient pas toujours acceptées dans les hôpitaux à
cause des capacités limitées en termes de nombre de lits
disponibles et de la surmortalité précoce des patients
référés. L'inefficacité du dispositif a
été préjudiciable pour beaucoup de patients qui sont
décédés avant de commencer le traitement
antirétroviral. Le projet a principalement fonctionné avec un
modèle ambulatoire pour la prise en charge des patients en situation
critique. Un autre facteur était la longue procédure de
préparation avant de commencer la thérapie antirétrovirale
pendant les deux premières années du projet. Le patient
éligible au TAR devait d'abord prouver une bonne adhérence
à la prophylaxie primaire au Cotrimoxazole, subir une évaluation
socio-économique à domicile et attendre l'avis d'un comité
de validation qui se réunissait une fois par mois. Toute la
procédure de préparation durait en moyenne 4 à 6 mois.
Enfin le système de monitoring était basé essentiellement
sur les patients sous ARV avec le logiciel FUCHIA.
La rétention des patients dans le groupe sous
thérapie antirétrovirale est satisfaisante mais pas meilleure. La
tendance décrite par Rosen en Afrique subsaharienne pour ce groupe est
de 50% (scénario plausible) après deux ans (26). Notre
étude a trouvé une rétention de 69,5% après 4 ans
pour la cohorte pédiatrique et 62% après 5 ans pour la cohorte
adulte (suivi réguliers uniquement). Ces résultats pourraient
s'expliquer par la gratuité totale des soins, l'octroi des frais de
transport et un système efficace de recherche active des patients sous
ARV à travers un réseau des agents communautaires.
Survie après la thérapie
antirétrovirale
La probabilité de survie pour les enfants était
estimée à 96% à 6 mois, 95% à un an, 94% à
deux ans et à 88% à quatre ans. Avec le scénario pire la
probabilité de survie était de 94% à six mois, 91%
à une année, 89% à deux ans et 61% après 4 ans
de suivi. Pour la discussion des résultats de survie, les études
comparables étaient celles réalisées par Médecins
sans Frontières dans les contextes similaires. Aucune étude
publiée par MSF ne donne les résultats sur un suivi
au-delà de 3 ans. Une étude multicentrique réalisée
par MSF dans 16 projets (20) sur les enfants sous ARV (âge <13 ans) a
mesuré la probabilité de survie à un an de 95% avec
décès comme évènement et 87% pour le
scénario du pire. Une autre étude pédiatrique
réalisée par MSF au Cambodge par Janssens et collaborateurs a
trouvé une probabilité de survie de 91% après deux ans
dans le scénario pire (37). Au Rwanda, Griensven a trouvé une
probabilité de survie de 92,7% à trois ans en scénario
pire(23). Comparé à d'autres cohortes pédiatriques nous
avons jugé que les résultats initiaux sont comparables et que la
prise en charge est satisfaisante dans ce projet. Ce résultat s'explique
par la collaboration du projet avec une structure spécialisée en
prise en charge du SIDA pédiatrique à Kinshasa et appuyée
par la Croix rouge Belgique. Par ailleurs nous sommes concernés par la
chute de probabilité de survie après la deuxième
année. Bien qu'il s'agisse d'un petit nombre d'enfants et les IC95% sont
larges, une analyse approfondie s'avère indispensable.
La probabilité de survie pour les adultes était
estimée à 85% à un an, 82% à deux ans, 80% à
trois ans et 78% à cinq ans. Avec le scénario pire, la
probabilité de survie pour les adultes était de 73% à 2
ans et 66% à 5 ans. En effet en Afrique du sud, Coetzee et
collaborateurs (13) ont mesuré la survie sous ARV chez les adultes
à 86,3% à deux ans dans le scénario pire. Au Malawi,
Zachariah et collaborateurs (25) ont trouvé une survie de 85%
après deux ans. Une autre étude MSF réalisée au
Cambodge par Ferradini et autres (15) a trouvé cette probabilité
de survie à 85%. Nous avons jugé acceptables les performances de
ce projet sur base de la survie après initiation de la thérapie
antirétrovirale. De nouveau très peu des données sont
publiées au-delà de deux ans.
Par ailleurs une récente étude multicentrique
réalisée par la firme HEINEKEN a trouvé une
probabilité de survie de 89% après 4 ans de thérapie
antirétrovirale pour les patients adultes (scénario pire). La
cohorte était constituée des employés de la firme et leurs
membres de famille (12). La probabilité de survie à 5 ans a
été estimée au Botswana à 79% (11) et au Cameroun
à 40% (21), au Sénégal à 75,4% (6).
Ces résultats satisfaisants dans une grande cohorte ARV
ont été obtenus par Médecins sans Frontières
à Kinshasa grâce à une politique de gratuité totale
des soins, approvisionnement régulier en médicaments et
matériels de qualité, un programme efficace de formation du
personnel, un système de motivation du personnel et un monitoring
individualisé grâce au logiciel FUCHIA.
Le modèle final sur les prédicateurs de la
survie dans notre étude était constitué de l'indice de
masse corporelle, le taux de CD4 et le stade clinique OMS. Ce qui
reflète le recours tardif aux soins. Les résultats similaires ont
été observés dans d'autres études africaines
(21;21;25;25;38). Un problème rencontré dans la
modélisation était le nombre important des données
manquantes sur le taux de CD4. Nous avions crée une catégorie
spécifique pour tester une éventuelle association avec le
décès. Cette catégorie est apparue comme significative
dans le modèle final. Nous pensons que cela s'explique par le fait que
cette catégorie regroupe en majorité les patients stades III ou
IV qui auraient commencé les ARV sans bilan CD4. Nous sommes
également conscients de l'effet des oublis de saisie et des
périodes où l'appareil PARTEC était en panne.
Les limites de l'étude
Les données utilisées pour cette étude
ont été collectées en routine sans toute la rigueur
scientifique requise. Par ailleurs la collecte était assurée par
des médecins et infirmiers formés, et saisies sur support
informatique par un personnel spécialisé. Nous n'avons pas inclut
certains prédicteurs possibles dans l'étude par manque des
données. Il s'agit par exemple du taux d'hémoglobine et du niveau
d'adhérence au traitement antirétroviral.
En conclusion
Cette étude montre qu'il est possible de garantir aux
patients sous ARV une survie à moyen terme dans un contexte à
ressources limitées. La rétention dans le groupe sans ARV est
médiocre et nécessite d'autres études plus approfondies
pour vérifier les hypothèses explicatives évoquées
dans cette étude.
RECOMMANDATIONS
Pour le Ministère de la santé:
1. Réviser la politique nationale sur le
dépistage de l'infection VIH par la promotion du modèle de
conseils et dépistage à l'initiative du prestataire des soins. Le
dépistage VIH devrait être proposé à toute personne
fréquentant les services de santé pour n'importe quelle raison
(39;40).
2. Mettre en place un système de dépistage VIH
sur sang capillaire, réalisable en dehors d'un laboratoire par un
personnel polyvalent. Le laboratoire devra garder le rôle de supervision,
formation, contrôle de qualité et gestion des résultats
indéterminés.
Pour MSF et Epicentre :
3. Améliorer le logiciel FUCHIA en intégrant le
suivi des patients non ARV dans le rapport mensuel de la cohorte avec des
informations sur les décès, perdus de vue,
transférés et suivi réguliers. Ce qui permettra au projet
d'assurer un monitoring efficace pour l'ensemble des patients.
Pour le projet CTA Kabinda :
4. Le projet vient de commencer avec une unité
d'hospitalisation permanente. Cette initiative n'est pas justifiée si la
cohorte reste fermée pour les nouveaux patients en dehors des membres de
famille anciens patients. Nous proposons la réouverture de la cohorte
aux nouveaux patients et le renforcement de la décentralisation des
anciens patients stables pour permettre au projet de jouer efficacement un
rôle de structure de référence VIH.
5. Mettre en place un système d'audit des
décès hospitaliers et autopsie verbale pour les
décès communautaires afin de mieux comprendre les causes directes
des décès.
ATTRIBUTION DU MEMOIRE
Ce travail est le résultat d'une étude que nous
avons planifié et réalisé au cours de cette année
de formation à l'Institut de Médecine tropicale, en utilisant
les données collectées et stockées en routine dans un
projet VIH/SIDA en République Démocratique du Congo.
REFERENCES
BIBLIOGRAPHIQUES
(1) ONUSIDA. Rapport sur l'épidémie mondiale de
sida 2008. Disponible sur
http://www.unaids.org/fr/KnowledgeCentre/HIVData/GlobalReport/2008/2008_Global_report.asp
[Consulté le 28 juin 2009].
(2) OMS. Traitement antirétroviral de l'infection
à VIH chez l'adulte et l'adolescent en situation de ressources
limitées. Disponible sur
http://www.who.int/hiv/pub/arv/adult/fr/index.html
[Consulté le 28 juin 2009].
(3) OMS, ONUSIDA, UNICEF. Vers un accès universel.
Etendre les interventions les interventions prioritaires liées au
VIH/SIDA dans le domaine de la santé. Rapport de situation 2008.
Disponible sur
http://whqlibdoc.who.int/publications/2008/9789242596885_fre.pdf
[Consulté le 28 juin 2009].
(4) Lohse N, Hansen AB, Gerstoft J, Obel N. Improved survival
in HIV-infected persons: consequences and perspectives. J Antimicrob Chemother.
2007;60:461-3.
(5) Lohse N, Hansen AB, Pedersen G, Kronborg G, Gerstoft J,
Sorensen HT, et al. Survival of persons with and without HIV infection in
Denmark, 1995-2005. Ann Intern Med. 2007;146:87-95.
(6) Etard JF, Ndiaye I, Thierry-Mieg M, Gueye NF, Gueye PM,
Laniece I, et al. Mortality and causes of death in adults receiving highly
active antiretroviral therapy in Senegal: a 7-year cohort study. AIDS.
2006;20:1181-9.
(7) Bong CN, Yu JK, Chiang HC, Huang WL, Hsieh TC, Schouten EJ,
et al. Risk factors for early mortality in children on adult fixed-dose
combination antiretroviral treatment in a central hospital in Malawi. AIDS.
2007;21:1805-10.
(8) Brinkhof MW, Dabis F, Myer L, Bangsberg DR, Boulle A,
Nash D, et al. Early loss of HIV-infected patients on potent antiretroviral
therapy programmes in lower-income countries. Bull World Health Organ.
2008;86:559-67.
(9) Brinkhof MW, Boulle A, Weigel R, Messou E, Mathers C,
Orrell C, et al. Mortality of HIV-infected patients starting antiretroviral
therapy in sub-Saharan Africa: comparison with HIV-unrelated mortality. PLoS
Med. 2009;6:e1000066
(10) Brinkhof MW, Pujades-Rodriguez M, Egger M. Mortality of
patients lost to follow-up in antiretroviral treatment programmes in
resource-limited settings: systematic review and meta-analysis. PLoS ONE
2009;4:e5790.
(11) Bussmann H, Wester CW, Ndwapi N, Grundmann N, Gaolathe
T, Puvimanasinghe J, et al. Five-year outcomes of initial patients treated in
Botswana's National Antiretroviral Treatment Program. AIDS. 2008;22:2303-11.
(12) Van der Borght SF, Clevenbergh P, Rijckborst H, Nsalou
P, Onyia N, Lange JM.et al. Mortality and morbidity among HIV type-1-infected
patients during the first 5 years of multicountry HIV workplace programme in
Africa. Antiviral therapy.2009.14:63-74.
(13) Coetzee D, Hildebrand K, Boulle A, Maartens G, Louis F,
Labatala V, et al. Outcomes after two years of providing antiretroviral
treatment in Khayelitsha, South Africa. AIDS. 2004;18:887-95.
(14) Culbert H, Tu D, O'Brien DP, Ellman T, Mills C, Ford N,
et al. HIV treatment in a conflict setting: outcomes and experiences from
Bukavu, Democratic Republic of the Congo. PLoS Med. 2007;4:e129.
(15) Ferradini L, Jeannin A, Pinoges L, Izopet J, Odhiambo
D, Mankhambo L, et al. Scaling up of highly active antiretroviral therapy in a
rural district of Malawi: an effectiveness assessment. Lancet.
2006;367:1335-42.
(16) Jerene D, Endale A, Hailu Y, Lindtjorn B. Predictors of
early death in a cohort of Ethiopian patients treated with HAART. BMC Infect
Dis. 2006;6:136.
(17) Johannessen A, Naman E, Ngowi BJ, Sandvik L, Matee MI,
Aglen HE, et al. Predictors of mortality in HIV-infected patients starting
antiretroviral therapy in a rural hospital in Tanzania. BMC Infect Dis.
2008;8:52.
(18) Karcher H, Omondi A, Odera J, Kunz A, Harms G. Risk
factors for treatment denial and loss to follow-up in an antiretroviral
treatment cohort in Kenya. Trop Med Int Health. 2007;12:687-94.
(19) Lawn SD, Harries AD, Anglaret X, Myer L, Wood R. Early
mortality among adults accessing antiretroviral treatment programmes in
sub-Saharan Africa. AIDS. 2008;22:1897-908.
(20) O'Brien DP, Sauvageot D, Zachariah R, Humblet P. In
resource-limited settings good early outcomes can be achieved in children using
adult fixed-dose combination antiretroviral therapy. AIDS. 2006;20:1955-60.
(21) Sieleunou I, Souleymanou M, Schonenberger AM, Menten J,
Boelaert M. Determinants of survival in AIDS patients on antiretroviral therapy
in a rural centre in the Far-North Province, Cameroon. Trop Med Int Health.
2008;14:1-8.
(22) Stringer JS, Zulu I, Levy J, Stringer EM, Mwango A, Chi
BH, et al. Rapid scale-up of antiretroviral therapy at primary care sites in
Zambia: feasibility and early outcomes. JAMA .2006;296:782-93.
(23) van Griensven J, De Naeyer L, Uwera J, Asiimwe A,
Gazille C, Reid T. Success with antiretroviral treatment for children in
Kigali, Rwanda: experience with health center/nurse-based care. BMC Pediatr.
2008;8:39.
(24) Wamalwa DC, Farquhar C, Obimbo EM, Selig S,
Mbori-Ngacha DA, Richardson BA, et al. Early response to highly active
antiretroviral therapy in HIV-1-infected Kenyan children. J Acquir Immune Defic
Syndr. 2007;45:311-7.
(25) Zachariah R, Fitzgerald M, Massaquoi M, Pasulani O,
Arnould L, Makombe S, et al. Risk factors for high early mortality in patients
on antiretroviral treatment in a rural district of Malawi. AIDS.
2006;20:2355-60.
(26) Rosen S, Fox MP, Gill CJ. Patient retention in
antiretroviral therapy programs in sub-Saharan Africa: a systematic review.
PLoS Med. 2007;4:e298.
(27) Bassett IV, Wang B, Chetty S, Mazibuko M, Bearnot B,
Giddy J, et al. Loss to care and death before antiretroviral therapy in Durban,
South Africa. J Acquir Immune Defic Syndr 2009 Jun 1;51(2):135-9.
(28) PNUD. Rapport national sur le développement
humain 2008 en RDC. Disponible sur
http://www.undp.org.cd/downloads/PNUD%20Rapport%20National%20sur%20le%20d%C3%A9veloppement%20Humain.pdf
[Consulté le 28 juin 2009].
(29) OMS. Statistiques sanitaires mondiales 2009. Disponible
sur
http://www.who.int/whosis/whostat/FR_WHS09_Full.pdf
[Consulté le 28 juin 2009].
(30) MINISANTE RDC. Stratégie de renforcement du
système de santé. Juin 2006.
(31) République Démocratique du Congo.
Enquête Démographique et de 2007. Disponible sur
http://www.measuredhs.com/pubs/pdf/FR208/FR208.pdf
[Consulté le 28 juin 2009].
(32) Piot P, Quinn TC, Taelman H, Feinsod FM, Minlangu KB,
Wobin O, et al. Acquired immunodeficiency syndrome in a heterosexual population
in Zaire. Lancet.1984;2:65-9.
(33) MINISANTE RDC, OMS. Guide national de traitement de
l'infection à VIH par les antirétroviraux. Janvier 2005.
(34) TranMinh T, Astel L, Chieze F, Mantion S, Adam G,
Gentilini M. Dix ans de prise en charge du VIH/SIDA dans les centres de
traitement ambulatoire de l'OPALS et de la croix rouge française. Med
Trop. 2004. 64 :109-14.
(35) PNUD-FONDS MONDIAL. Evaluation de la prise en charge
globale des personnes vivant avec le VIH sous ARV en République
Démocratique du Congo. 2006.
(36) PNMLS/RDC. Rapport national de suivi UNGASS 2007.
Disponible sur
http://data.unaids.org/pub/Report/2008/democratic_republic_of_congo_2008_country_progress_report_fr.pdf
[Consulté le 28 juin 2009].
(37) Janssens B, Raleigh B, Soeung S, Akao K, Te V, Gupta J,
et al. Effectiveness of highly active antiretroviral therapy in HIV-positive
children: evaluation at 12 months in a routine program in Cambodia. Pediatrics.
2007;120:1134-40.
(38) Van Overloop C. Treatment outcomes of antiretroviral
therapy in urban Kinshasa.
Thèse de maitrise. London School of
Hygiene and Tropical Medecine. Année académique 2005-2006.
(39) OMS. ONUSIDA. Guide du conseil et du dépistage du
VIH à l'initiative du soignant dans les établissements de
santé. Disponible sur
http://www.who.int/publications/list/9789241595568/fr/index.html
[Consulté le 28 juin 2009].
(40) Weiser SD, Heisler M, Leiter K, Percy-de KF, Tlou S,
DeMonner S, et al. Routine HIV testing in Botswana: a population-based study on
attitudes, practices, and human rights concerns. PLoS Med. 2006;3:e261.



