|

Institut National de la Santé et de la Recherche
Médicale
Unité 556
Rapport INSERM Mars/Septembre 2005
Découplage des signaux IRM et des ultrasons
thérapeutiques
Présenté par
Ababacar NDIAYE
Pour obtenir le grade de
Master2 Recherche en Electronique et Instrumentation
de
l'université Joseph Fourier de Grenoble ²
Responsable INSERM : Responsable CNRS :
Rares SALOMIR Pierre Etienne WOLF
Chargé de recherche Directeur de recherche
INSERM de Lyon Unité 556 CRTBT/CNRS de Grenoble
Equipe « Application des ultrasons à la
thérapie » 25 avenue des Martyrs
151 cours Albert Thomas 38042 Grenoble cedex 09
69424 Lyon cedex 03
REMERCIEMENTS
Je remercie monsieur Jean Yves CHAPELON, directeur de
l'unité 556 de L'INSERM de Lyon pour m'y avoir accueilli.
Je remercie également monsieur Dominique CATHIGNOL,
directeur de l'équipe 2 « ultrasons appliqués à la
thérapie » pour m'avoir facilité mon intégration au
sein de l'équipe.
Je remercie plus particulièrement mon responsable de
stage, monsieur Rares SALOMIR pour son soutien et sa disponibilité qui
m'ont été très précieux.
Je remercie également monsieur Pierre Etienne WOLF,
responsable du Master2 Recherche PpI pour ses conseils.
Je remercie aussi madame Chantal BLANC-GONNET,
secrétaire du Master2 PpI pour sa disponibilité.
Enfin, je remercie tous ceux qui, de loin ou de près,
m'ont aidé à accomplir ce travail.
SOMMAIRE
A. Introduction ..4
B. Etat de l'art 5
C. L'Imagerie par résonance magnétique
(IRM) ..6
C.1. Obtention du signal IRM 6
C.2. Principe de l'IRM ..6
C.3. Les paramètres de contraste en IRM ..6
C.3.1. La densité de protons ..7
C.3.2. Le temps de relaxation longitudinale T1 8
C.3.3. Le temps de relaxation transversale T2 ..9
C.3.4. Le paramètre TR 10
C.3.5. Le paramètre TE 10
C.4. L'IRM de température .10
D. Les ondes ultrasonores 11
D.1. Atténuation 11
D.2. Les ultrasons focalisés de haute intensité
(HIFU) 12
D.3. L'applicateur ultrasonore mono-élément 13
D.4. L'applicateur ultrasonore 64 voies compatible IRM 14
D.4.1. Description de l'applicateur ultrasonore endorectal 14
D.4.2. Génération d'ondes planes ..15
D.5. Plateforme de tirs des ultrasons 16
E. Découplage IRM/ultrasons 18
E.1. Mise en évidence des interférences
IRM/ultrasons 18
E.1.1. Discussion 19
E.2. Méthode de découplage 20
F. Conception et test des modules de découplage
20
F.1. L'antenne 20
F.1.1. Discussion 21
F.2. Le circuit électronique de découplage 21
F.2.1. Le filtre passe haut ..22
F.2.2. Le redresseur 23
F.2.3. Le générateur d'impulsions 23
F.2.4. Le Témoin 25
F.2.5. La sortie multivoie 25
F.2.6. La sortie monovoie ..26
G. Tests sous IRM .27
G.1. Tirs d'ultrasons avec la sonde multivoie dans les deux
modes 27
G.1.1. Discussion 27
G.2. Tirs d'ultrasons avec la sonde monovoie dans les deux modes
28
G.2.1. Discussion 29
H. Conclusion et perspectives 30
I. Bibliographie 31
A. Introduction
Au début des années 1900, Lippmann
établit l'effet piézoélectrique selon lequel: un cristal
de quartz soumis à un champ électrique se comprime ou se dilate.
L'utilisation de ce principe a permis la génération des ultrasons
grâce aux travaux de Chilowski et Langevin. Aujourd'hui, l'imagerie
ultrasonore est devenue un moyen de diagnostic incontournable. La chirurgie
ultrasonore qui est une des techniques utilisant les effets thermiques des
ultrasons pour la thérapie, est aujourd'hui utilisée pour le
traitement de certains cancers. Elle consiste à provoquer une
élévation de température très intense (au
delà de 60°) sur des périodes très courtes (quelques
secondes). Ce principe a été utilisé pour la
première fois en focalisant un champ ultrasonore de haute
intensité. Cette technique, appelée HIFU pour High Intensity
Focused Ultrasound est aujourd'hui appliquée au traitement des cancers
du sein, de la vessie, de l'oesophage et de la prostate. La miniaturisation des
applicateurs ultrasonores a permis le traitement de certains organes
inaccessibles par voie extracorporelle. Différents moyens d'imagerie
sont utilisés pour guider les traitements ultrasonores, il s'agit
notamment de l'échographie, de l'élastographie, de la
vibro-acoustographie et de l'imagerie à résonance
magnétique (IRM). L'IRM est la technique qui s'impose actuellement comme
étant la plus appropriée pour obtenir, de façon
complète et non invasive, un contrôle en temps réel de
l'évolution de la température des tissus et des nécroses
de coagulation induites par les ultrasons de haute intensité.
Cependant, pour le suivi en temps réel par IRM en
présence des ultrasons, nous sommes confrontés à deux
contraintes majeures. La première est la compatibilité de
l'applicateur ultrasonore avec un environnement IRM du point de vue de la
susceptibilité magnétique des matériaux utilisés.
Ensuite l'effet perturbateur que le système électronique de
commande de l'applicateur ultrasonore peut avoir sur le signal IRM via un
couplage électromagnétique avec l'antenne de réception
IRM.
L'objectif global de notre étude est le
développement d'un environnement permettant le guidage du geste
thérapeutique et le suivi par IRM en temps réel du traitement in
vivo par HIFU.
Dans cette étude, on s'intéressera aux
contraintes relatives aux interférences des signaux de puissance du
générateur pour les HIFU avec le signal IRM. En effet, il s'agira
plus particulièrement de développer l'instrumentation permettant
le découplage des HIFU avec le signal IRM. On commencera par
présenter l'imagerie par résonance magnétique, l'obtention
du signal IRM et la mesure de la température par IRM. Ensuite nous
présenterons les ultrasons, on présentera aussi deux applicateurs
ultrasonores utilisés pendant les manipulations et la plateforme
utilisée pour la génération des HIFU. Par la suite, on
s'intéressera à la partie instrumentale qui constitue l'objectif
principal de ce sujet et on finira par les tests.
B. Etat de l'art
Depuis quelques années la recherche médicale
commence à beaucoup s'intéresser sur l'utilisation des HIFU sous
contrôle IRM et en temps réel. En effet, L'IRM s'impose
actuellement comme étant plus appropriée pour un contrôle
en temps réel de l'évolution de la température des tissus
et des nécroses induites par les ultrasons focalisés de haute
intensité. L'intérêt reste énorme par rapport aux
autres techniques telle que l'échographie qui permet d'imager les tissus
biologiques en temps réel avec une résolution de l'ordre du
dixième de millimètre. Par contre l'échographie ne permet
pas une mesure de la température des tissus ni une visualisation
précise des nécroses. Cependant il subsiste quelques contraintes
avec l'IRM. Le problème lié à la compatibilité de
l'applicateur ultrasonore avec l'environnement IRM reste d'ordre uniquement
technologique. En effet, il doit être conçu avec des
matériaux amagnétiques et non ferromagnétiques pour
éviter d'induire une perturbation ou un masquage de l'image IRM.
Actuellement, la contrainte majeure qui préoccupe la communauté
scientifique et qui fait l'objet de notre étude concerne les
interférences entre les HIFU et l'IRM. Ainsi, différentes
méthodes dédiées à ces interférences entre
les HIFU et l'IRM ont été développées mais
celles-ci restent encore limitées pour aboutir sur des applications
entièrement fiables. Une première idée consiste à
utiliser un filtre réjecteur réglé à la
fréquence de fonctionnement de l'antenne IRM ( par exemple, 64MHz pour
un imageur clinique 1.5 T ). Ce filtre réjecteur s'avèrerait
efficace pour supprimer tous les signaux à la fréquence de
l'antenne. Cependant la complexité de cette méthode réside
dans la conception de 64 filtres réjecteurs identiques (pour une sonde
à 64 transducteurs). Egalement, même si le filtre est parfaitement
efficace à la fréquence de l' IRM, l'harmonique fondamentale de
travail pour les ultrasons (de 1 à 10 MHz) peut saturer le
préamplificateur de la chaîne de réception IRM, avant
d'être rejetée par la détection synchrone. Une autre
façon déjà utilisée consiste à interposer
sur chaque voie un câble coaxial dont la longueur est ajustée
à ë/4 de manière à ce que tous les signaux à
la fréquence de fonctionnement de l'antenne IRM soient supprimer. Cette
méthode qui revient à un filtrage coupe bande présente une
limite liée à l'atténuation induite de 30 dB en moyenne
[4], avec les avantages de la simplicité et de ne pas
être limité en puissance maximale autorisée. Une autre
méthode utilisée consiste à couvrir les câbles
coaxiaux de cuivre. Ceci revient à mettre une cage de Faraday autour de
chaque voie. Cette méthode permet uniquement de diminuer les
artéfacts mais pas encore suffisamment à ce jour pour donner lieu
à une application.
Au constat des limites de toutes ces méthodes nous nous
orientons vers une méthode basée sur un découplage au sens
propre des HIFU et de l'IRM.
C. L'imagerie par résonance magnétique
(IRM)
L'imagerie par résonance magnétique est une
technique d'imagerie basée sur l'analyse du comportement des protons
contenus dans un système physique magnétique résonant et
soumis d'une part à un champ magnétique et d'autre part à
une impulsion de radiofréquence.
Dans le cadre de ce travail, l'étude se limite à
l'atome d'hydrogène qui constitue l'élément le plus
important en imagerie par résonance magnétique clinique compte
tenu de la quantité d'eau présente dans les tissus
biologiques.
C.1. Obtention du signal IRM
L'imagerie par résonance magnétique est une
technique d'imagerie utilisant principalement la résonance des noyaux
d'hydrogène lorsque, placés dans un champ magnétique, ils
sont excités par une onde radiofréquence. Les atomes
d'hydrogène peuvent être considérés comme des petits
dipôles magnétiques dont l'orientation spatiale est
aléatoire en dehors d'un champ magnétique significatif.
Placés dans un aimant, ces dipôles s'orientent tous dans le
même sens en fonction de la direction du champ magnétique
créé. Deux orientations sont possibles : un état stable de
faible énergie, que va adopter une faible majorité des
dipôles et un état instable d'énergie supérieure,
correspondant à la direction opposée, que va adopter, au hasard,
une minorité des dipôles. L'adjonction d'un rayonnement
électromagnétique, de fréquence bien précise va
faire entrer en résonance les atomes d'hydrogène qui vont passer
de l'état stable à un état instable. L'arrêt du
rayonnement entraîne une relaxation qui se caractérise par un
retour progressif à l'état stable en même temps que
l'émission d'une onde radiofréquence qui constitue le signal RMN.
Le signal RMN résulte de l'excitation par une onde radio
fréquence (RF) de protons préalablement polarisés dans un
champ magnétique intense et dépendant de la structure
moléculaire dans laquelle est impliqué l'atome d'hydrogène
en question. [1]
C.2. Principe de l'IRM

La formation d'une image RMN est basée sur le principe de
la discrimination spatiale par l'application d'un champ magnétique
variable selon une direction donnée Bi= B0 + Gi.
~
Il est composé de gradients de champ magnétique Gi
= g × i (i = x, y, z et Gi g i
= · ) et d'un champ magnétique statique B0. Nous
avons un champ homogène qui porte tous les protons d'un
échantillon à la même fréquence de résonance
ù0 = ãB0 ( ã est le rapport gyromagnétique,
constante caractéristique du noyau ).
Äù
Ensuite une impulsion radiofréquence sélective
(largeur de bande Af = ) en présence d'un
2 Ð
premier gradient dit « gradient de sélection de
coupe Gz » dans la direction z par exemple, excite
sélectivement
tous les points d'une coupe (ou plan) centrée à la cote z et dont
la largeur de bande de
l'impulsion RF définit l'épaisseur ?z =
Äù de la coupe. Après arrêt de l'impulsion RF et un
temps
ãGz
particulier appelé temps d'écho TE, la bobine
réceptrice recueille un signal caractérisant le retour à
zéro de la composante transversale de l'aimantation.
C'est durant ce retour que le codage des points de l'espace
(dans les deux directions de ce plan) se fait par l'application des deux autres
gradients : un gradient dit « gradient de phase » réalise le
codage de phase dans la direction y par exemple et un second gradient dit
« gradient de lecture » réalise le codage en fréquence
dans la direction x. [1]
C.3. Les paramètres de contraste en
IRM
C.3.1. La densité de protons
Le proton, très abondant dans l'organisme, est à
la base de l'IRM. Le signal en IRM provient de la seule excitation des protons,
l'image est donc assimilable à une cartographie des noyaux
d'hydrogène de l'organisme. Cette cartographie représente alors
directement, sous forme de niveau de gris, la localisation des noyaux
d'hydrogène des différentes structures examinées. Il est
donc aisé de comprendre que le contraste de l'image dépend
étroitement de la concentration des tissus en noyaux d'hydrogène.
Il existe ainsi des tissus très riches (Liquide Céphalo-
Rachidien) et très pauvres (os) en protons qui sont susceptibles de
produire respectivement un signal intense et faible. Pour réaliser une
telle cartographie, il faut que les protons puissent émettre un signal.
Une condition nécessaire est de préparer ou de rendre ces protons
aptes à recevoir une excitation qu'ils restitueront sous forme d'un
signal. C'est le rôle du champ magnétique principal B0,
très intense, qui réalise une aimantation préalable des
protons. La valeur totale de l'aimantation M d'un tissu est alors directement
proportionnelle à sa concentration en noyaux d'hydrogène N,
c'est-à-dire à sa densité protonique ñ.
Après excitation par l'onde radio fréquence RF le signal
émis S est directement proportionnel à l'aimantation des tissus
et donc à leur densité. [2]

M(r, t) : aimantation du système étudié au
point r à t
B(r) : champ magnétique reçu au point r : (B0 +G r)
T : température de l'échantillon en Kelvin
ã: rapport gyromagnétique du proton (43 MHz/T)
M0 : aimantation totale d'un échantillon contenant N spins
1/2 k : constante de Boltzmann
h : constante de Planck
C.3.2. Le temps de relaxation longitudinale T1
L'excitation par l'impulsion RF de 90° a pour
conséquence de faire disparaître la composante longitudinale du
vecteur d'aimantation tissulaire M par égalisation des spins sur les
deux niveaux d'énergie. Cet état est instable et, dès
arrêt de l'impulsion RF, il va y avoir retour à l'état
d'équilibre stable au cours duquel les phénomènes inverses
vont avoir lieu : il y a progressivement transitions inverses du niveau
antiparallèle au niveau parallèle. L'aimantation longitudinale
repousse ainsi progressivement : c'est la relaxation longitudinale. On
l'appelle également relaxation spin - réseau car ce
phénomène s'accompagne, lors du retour des protons du niveau de
haute énergie sur le niveau de basse énergie , d'une
émission d'énergie par interaction avec le milieu
moléculaire environnant ou réseau. On l'appelle également
relaxation T1 car la repousse de l'aimantation longitudinale se fait selon une
exponentielle croissante où la constante de temps T1 est
caractéristique d'un tissu donné : elle correspond à 63%
de repousse.

Figure 1 : Courbe exponentielle de repousse de
l'aimantation longitudinale en fonction de T1 Par définition, le temps
nécessaire pour que l'aimantation globale d'un tissu atteigne environ
2/3 (63%) de sa valeur définitive M0 est appelé T1 : temps de
relaxation longitudinale [1]. Le T1 varie avec la structure
moléculaire ainsi que l'état solide ou liquide de la
matière. Le T1 est plus long dans les liquides par rapport aux solides ;
il est court dans les tissus graisseux. Les tissus pour lesquelles
l'aimantation longitudinale repousse rapidement auront très vite une
plus grande densité de protons disponibles pour réaliser une
image : signal intense.
Les tissus qui s'aimantent lentement auront peu de proton
aimantés disponible rapidement pour réaliser une image : signal
faible. Ces différences en T1 vont être mises à profit en
imagerie pour obtenir des contrastes. Le contraste de l'image ne
dépendra plus de la seule quantité totale de protons mais surtout
de la capacité de l'aimantation à repousser plus ou moins vite :
l'image sera alors pondérée T1.
C.3.3. Le temps de relaxation transversale T2
L'excitation par l'impulsion RF de 90° a pour
conséquence de faire apparaître une composante transversale. La
composante transversale a un mouvement de rotation qui est
détecté par un capteur et enregistré : c'est le signal RMN
de précession libre ou encore FID (free induction decay). L'aimantation
transversale décroît rapidement : c'est la relaxation
transversale. On l'appelle également relaxation spin - spin car ce
phénomène est la conséquence d'une interaction des protons
entre eux.
La relaxation transversale est également
dénommée relaxation T2 car la disparition de l'aimantation
transversale se fait selon une exponentielle décroissante où la
constante de temps T2, exprimée en millisecondes est
caractéristique d'un tissu donné. Elle correspond à 63% de
décroissance. Le T2 caractérise la relaxation transversale d'un
tissu.

Figure 2 : Courbe exponentielle de disparition
de l'aimantation transversale en fonction du T2
Par définition, le temps pendant lequel
l'intensité du signal décroît d'environ 2/3 de sa valeur
initial est appelé T2 : temps de relaxation transversale. Cependant T2
est généralement plus court que T1. Le paramètre T2 est
donc bien adapté pour comparer les différents tissus de
l'organisme. Qualitativement, dans un liquide, les spins restent plus longtemps
en phase que dans une solide. Ils créent donc un signal plus intense car
le T2 est « long ».
En revanche, dans un solide, le T2 est court par
conséquence le signal est faible. Comme pour T1, c'est cette
différence de temps de relaxation qui est mis à profit pour
obtenir des contrastes. Ainsi, le contraste de l'image ne dépendra plus
de la seule quantité totale de protons mais surtout de leur
capacité à donner un signal plus ou moins persistant avec le
temps : l'image sera dite pondérée T2. De façon
général T2 des tissus biologiques est environ 10 fois plus court
que T1.
C.3.4. Le paramètre TR
Dans une séquence classique d'IRM il faut
répéter le cycle élémentaire d'impulsion RF de
90° et /ou 180° pour créer un signal dans le plan transversal
et le mesurer. Le temps de répétition TR correspond à
l'intervalle séparant deux impulsions de 90°. Durant chaque
intervalle TR, l'aimantation longitudinale de chacun des tissus repousse en
fonction de leurs T1 respectifs. Le temps de répétition
correspond donc également au « temps de repousse » ou de
récupération de l'aimantation longitudinale. Le TR conditionne
également le contraste en T1, c'est-à-dire la «
pondération en T1 » d'une séquence.
C.3.5. Le paramètre TE
Le paramètre TE détermine le moment
précis où le signal est mesuré, c'est-à-dire le
temps pendant lequel on laisse évoluer le signal avant de le mesurer et
il conditionne principalement la pondération en T2 d'une
séquence.
C.4. IRM de température
La thermométrie par IRM peut être basée
sur le temps de relaxation T1, le coefficient de diffusion moléculaire
de l'eau ou la fréquence de résonance du proton (PRF). Le
décalage de la fréquence de résonance des protons de l'eau
est la technique la plus couramment employée, elle permet de
cartographier la température en utilisant l'information de phase des
images d'écho de gradient («RF-spoiled») selon
l'équation suivante :
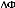
AT=
â ãB 0TE
où AT est la différence de température
(°C) par rapport à l'acquisition précédente, A(I) est
la différence
de phase entre deux acquisitions successives, y est le
rapport gyromagnétique, B 0 est le champ
magnétique de l'aimant (Tesla), TE est le temps
d'écho (secondes) et â est le coefficient de décalage de la
fréquence de résonance des protons (typiquement de l'ordre de0,01
ppm/°C).
Une image de référence est utilisée pour
compenser les autres facteurs qui contribuent à la phase dans l'image,
comme l'homogénéité du champ magnétique. La mesure
de la température est donc relative, une mesure absolue peut être
réalisée mais nécessite l'emploi d'agents de contraste
thermosensibles. Les fréquences de résonance des lipides ne
dépendent pas de la température et ont un décalage moyen
de 3,5 ppm par rapport à la résonance de l'eau. Les signaux des
lipides affectent la phase de l'image et causent donc des erreurs sur les
cartes de température. Ces erreurs sont difficilement
prédictibles car elles dépendent de la quantité de
graisse, du temps d'écho, de la fréquence de résonance du
spectromètre et de la température. Pour ces raisons, les signaux
des lipides sont supprimés pour assurer une imagerie de
température fiable. Les applications que connaît la
thermométrie par IRM sont nombreuses, il s'agit notamment des lasers,
des radiofréquences, des micro-ondes et des ultrasons. Au cours du
processus de thérapie par échauffement des tissus biologiques, la
température des tissus est mesurée à une cadence comprise
entre une et cinq secondes par image. Il est alors possible de
déterminer l'importance des effets de diffusion thermique de
façon à ajuster la puissance des ondes émises durant
l'exposition des tissus pour obtenir une température uniforme dans la
zone ciblée, ce qui évite d'endommager les tissus adjacents.
L'IRM est aujourd'hui utilisée pour des traitements cliniques avec de
récents appareillages ultrasonores interstitiels ou de type HIFU.
[3]
D. Les ondes ultrasonores
Les ondes ultrasonores sont des ondes mécaniques
générées par un objet vibrant dont la fréquence est
au-delà de 20 kHz, seuil de la perception de l'oreille humaine. Les
ondes ultrasonores sont émises par des transducteurs puis transmises au
milieu dans lequel elles se propagent.
Un transducteur acoustique est un matériau qui est
capable de produire une vibration mécanique. Cette vibration est
transmise au milieu qui est en contact avec le transducteur. Une fois que les
particules en contact avec le transducteur entrent en mouvement, elles
transmettent à leurs voisines ce mouvement. La transmission du mouvement
entre particules crée une onde de pression caractérisée
par la vitesse des particules.
D.1. Atténuation
Une onde ultrasonore qui se propage dans les tissus biologiques
est en partie absorbée.
Les mouvements de particules produits par le passage de l'onde
ultrasonore induit des forces de friction qui s'opposent à ces
mouvements. L'énergie perdue par l'onde acoustique à cause de ces
frottements est restituée localement sous forme de chaleur.
L'élévation de température résultante est fonction
de la conductivité thermique du milieu et du taux de perfusion.
[6]
En plus de l'absorption, plusieurs facteurs contribuent
à l'atténuation d'une onde ultrasonore dans un milieu biologique
: la divergence du faisceau ultrasonore, la diffusion due aux petits
réflecteurs et la propagation de l'onde suivant d'autres modes. Cette
énergie est tout de même absorbée par le tissu et contribue
donc à l'élévation de température du milieu. Pour
ces raisons, les coefficients d'atténuation et d'absorption sont
classiquement assimilés dans les milieux biologiques. L'apport de
chaleur local par unité de volume, exprimé en W.m-3,
est donné par la relation suivante : Q = 2uI.
Avec u est le coefficient d'atténuation des tissus en
m-1 et I l'intensité de l'onde ultrasonore en
Wm-2. Dans la littérature, le coefficient
d'atténuation est plus généralement exprimé en
dB.cm-1.
D.2. Les Ultrasons Focalisés de Haute
Intensité ( HIFU )
Le principal inconvénient lié à
l'utilisation des ultrasons pour l'hyperthermie est de maintenir une
température thérapeutique assez uniforme pendant un temps
important. Il en résulte des zones de surchauffe où les tissus
sont détruits sans distinction et des points froids où les tissus
ne sont pas traités. Pour s'affranchir de ce problème,
l'idée d'utiliser des temps d'exposition plus courts est apparue. Dans
ce cas, l'énergie doit être augmentée pour produire des
effets dans les tissus. De cette idée naît la chirurgie
ultrasonore comme une option pour la destruction des tissus par l'application
d'un faisceau ultrasonore focalisé très intense (HIFU en anglais)
pendant des très courtes durées. L'énergie
appliquée est alors suffisante pour provoquer la nécrose des
cellules qui se trouvent dans la zone de focalisation. Le terme de haute
intensité fait référence à la puissance surfacique
qui peut atteindre des milliers de watts par centimètre carré au
centre de la zone traitée. L'utilisation de transducteurs à haute
fréquence et fortement focalisés permet d'obtenir des
nécroses bien délimitées par la tache focale du
transducteur, de l'ordre de quelques millimètres de diamètre par
un ou deux centimètres de long, assurant une localisation très
précise du traitement ce qui donne aux HIFU le nom de chirurgie
ultrasonore. C'est pour ces raisons que les applications des HIFU sont
principalement orientées vers le traitement des tumeurs
localisées qu'elles soient bénignes ou malignes. Le traitement de
tout un volume tumoral est effectué en déplaçant le
faisceau ultrasonore séquentiellement de point en point sur tout le
volume soit par un moyen mécanique soit par un moyen
électronique. La focalisation fait généralement appel
à des transducteurs concaves. Les lésions créées
par HIFU sont principalement produites par deux phénomènes : les
effets purement thermiques liés à l'absorption des tissus et les
effets de cavitation. Ces deux effets combinés sont à l'origine
de la forme légèrement conique des lésions individuelles
crées par les HIFU. [4]


Le temps et la précision du traitement sont donc
fortement dépendants des possibilités de mouvement du
système sur lequel est monté l' applicateur ultrasonore.
L'utilisation d'un applicateur dont la partie émettrice se
décompose en plusieurs éléments permet de contrôler
dynamiquement via l'électronique de commande la forme et
l'intensité du champ de pression créé. Il est ainsi
possible de changer la localisation du dépôt de chaleur sans que
l'applicateur n'effectue de mouvement.
D.4. L'applicateur ultrasonore 64 voies compatible
IRM
Des traitements antérieurs ont montré que la
rotation mécanique de l'applicateur est délicate à
transmettre de façon précise in vivo. Pour surmonter cette
contrainte des applicateurs ultrasonores multiéléments ont
été développés. La partie active est
composée de 64 transducteurs répartis sur toute la
périphérie d'un cylindre. Le but est de réaliser une
rotation électronique du faisceau ultrasonore dans les tissus afin de
s'affranchir des contraintes de déplacement mécanique. Une onde
plane est produite en utilisant huit transducteurs adjacents excités
avec la loi de phase appropriée. La rotation électronique est
obtenue en excitant de la même façon huit autres transducteurs
adjacents. Les matériaux de l'applicateur sont choisis pour qu'ils
soient compatibles avec une utilisation en environnement IRM.
D.4.1. Description de l'applicateur ultrasonore
endorectal
La partie distale de l'applicateur est une pièce en PVC
cylindrique de 14 mm de diamètre sur laquelle sont disposés 64
transducteurs piézocomposites de 0,60×20 mm2, distants
les uns des autres de 92 um. L'onde émise par la face arrière des
transducteurs est réfléchie sur un backing cylindrique creux qui
assure la rigidité mécanique de l'ensemble. Le réseau
d'adaptation est déporté à trois mètres du centre
de l'aimant pour éviter les interférences avec le champ
magnétique. Un boîtier blindé en aluminium connecté
à l'applicateur contient les 64 réseaux d'adaptation
électriques (un pour chaque transducteur). Ce boîtier est pourvu
d'une connexion pour relier les masses à la cage de Faraday. Pendant les
manipulations, la tête de la sonde contenant les transducteurs, est
entourée par une enveloppe en latex pour contenir l'eau de couplage
acoustique.
Le refroidissement des transducteurs est assuré par un
flux continu d'eau dégazée qui circule en circuit fermé le
long de la face avant des transducteurs puis pénètre à
l'intérieur du backing. L'eau du circuit de refroidissement, maintenue
à 25°C, est entraînée par une pompe
péristaltique Masterflex (Cole Parmer Instrument Co., Chicago, Etats
Unis) avec un débit de 0,2 L/min pour maintenir la température de
l'eau de couplage aux alentours de 45°C durant les insonifications.

1 : Zone active ( transducteurs)
2 et 4 : Epaulements pour la fixation
4 3 1 2 des joints maintenant le ballonnet en
latex
3 : Trou pour la circulation de l'eau
Tête de l'applicateur de refroidissement
Figure 5 : Applicateur ultrasonore
multiéléments endorectal
D.4.2. Génération d'ondes planes
Pour éviter une dispersion de la chaleur en dehors des
tissus à traiter, on génère des ondes planes. Les ondes
planes assurent une focalisation du faisceau ce qui permet d'éviter les
phénomènes de dispersion et donc d'avoir une lésion bien
profonde. L'ouverture angulaire couverte par 8 transducteurs adjacents est de
45°. La directivité de chaque transducteur est donc telle qu'au
maximum 8 éléments peuvent être utilisés de
façon à ce que le transducteur le plus éloigné
dépose de l'énergie le long de l'axe acoustique. Ainsi pour
réaliser une rotation électronique de la sonde, les transducteurs
sont excités par lot de 8 transducteurs adjacents avec la même loi
de phase. Pour générer une onde plane à partir de 8
transducteurs, il faut effectuer un retard d'excitation approprié
à chaque transducteur en prenant en compte la résolution du
générateur TTL qui est de 10 ns. Ainsi, pour créer une
onde plane à 1 mm en avant de la barrette les retards d'excitation
appliqués aux éléments 1 à 8 sont respectivement de
0, 100, 170, 200, 200, 170, 100 et 0 nanosecondes (figure 6).

Figure 6 : Principe de la création d'une
onde plane à partir d'une barrette cylindrique
D.5. Plateforme de tir des ultrasons ( figure 8)
Une plateforme de commande spécifique a
été conçue et mise au point de façon à
ajuster la phase et l'amplitude appliquées à chaque transducteur.
L'énergie électrique est fournie par 64 amplificateurs de
puissance AHF 855 (Adece, Artannes, France) qui mettent en forme
sinusoïdale les signaux TTL ( figures 7a et 7b ) délivrés
par un générateur de "patterns" (PG1050 Acute, Hsin Chuang City,
Taiwan) contenant 50 voies.
Le décalage entre chaque voie est ajustable avec une
résolution de 10 nanosecondes. Des cartes de sortie 64 voies
numériques/analogiques 0-10V permettent de régler le gain de
chaque amplificateur. Des cartes d'entrée 128 voies recueillent les
tensions analogiques directement proportionnelles aux puissances
électriques directes et réfléchies. Un ordinateur PC
pilote les cartes d'entrée et de sortie ainsi que le
générateur. Un programme de pilotage des cartes
développé sous Dynamic C et embarqué dans un
microprocesseur Rabbit 2000 permet de définir les valeurs des gains
à appliquer sur chacune des voies d'amplification, de recueillir et
d'analyser les valeurs des puissances électriques fournies durant chaque
exposition ultrasonore. Une augmentation significative de la puissance
électrique réfléchie est synonyme d'une anomalie pouvant
conduire à la détérioration des transducteurs. La
fréquence d'utilisation retenue est de 3.57 MHz, il s'agit du meilleur
compromis pour l'ensemble des transducteurs.
A l'origine ces amplificateurs fournissaient une puissance
incidente maximale de 5 Watts. Pour anticiper les pertes et pouvoir obtenir de
hautes intensités, on a effectué des modifications au niveau de
l'étage final des amplificateurs. On a rajouté 6 spires sur la
bobine secondaire. Ces modifications ont permis de porter la puissance
incidente de 5 Watts à 9 Watts pour une fréquence de 3.57 MHz.
Amplitude (Volts)
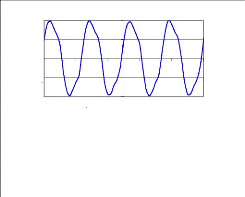
Figure 7b : Signal quasi-sinusoïdal
à 3.57 MHz
en sortie des amplificateurs de puissance
Amplitude (Volts)
-5,00E-
0
|
|
10
|
|
|
|
|
|
5
|
|
|
|
|
|
|
|
|
|
|
|
0
|
|
|
|
|
|
|
|
|
|
|
-3,00E-
|
-1,00E-
5
|
1,00E-
|
3,00E-
|
5,0
|
|
7
|
07
|
07
|
07
|
07
|
0
|
|
|
10
|
|
|
|
Temps (Secondes)
0E-
7

-1
-2
3
2
0
1
-5,00E-
|
-4,00E-
|
-3,00E-
|
-2,00E-
|
-1,00E-
|
0,00E+
|
|
07
|
07
|
07
|
07
|
07
|
00
|
Temps (Secondes)
Figure 7a : Signal TTL à 3.57 MHz
à l'entrée
des amplificateurs de puissance

1 à 5 : Amplificateurs de puissance ( 8 voies x 5 )
6 : Unité centrale ( 1 Master, 2 slaves, convertisseurs
)
7 : Générateur de TTL ( PG acute )
8 : Câbles de connexion avec la sonde via un guide
d'onde
Figure 8 : Plateforme de tir des ultrasons
E. Découplage IRM/ultrasons
Notre objectif est de découpler le signal IRM avec les
signaux électromagnétiques qui permettent d'exciter les
transducteurs générateurs des ultrasons.
Le but est d'établir une carte de température
par IRM en temps réel des tissus biologiques soumis au traitement par
ultrasons. En théorie, l'acquisition du signal IRM devra coïncider
avec le tir des ultrasons.
E.1. Mise en évidence des interférences
IRM/ultrasons
La fréquence de tir des ultrasons doit être un
compromis entre le matériel de tir ( amplificateurs de puissance,
générateur de TTL, convertisseurs de tension ) et la sonde
ultrasonore. Dans notre cas, avec la sonde et la plateforme de tir
déjà présentées , on a choisi une fréquence
de tir de 3.57 MHz.. En effet, l'onde électromagnétique fournie
par les amplificateurs de puissance est quasi sinusoïdale avec une
fréquence de 3.57 MHz ( figure 7b ). L'antenne IRM fonctionne à
la fréquence de 63,9 MHz. Par conséquent, en théorie, le
signal IRM et les ondes électromagnétiques qui sont à des
fréquences très différentes ne devraient pas
interférer. Cependant, en réalité l'onde
électromagnétique présente des harmoniques à des
fréquences proches de celle du signal IRM. Ces harmoniques peuvent
provoquer des interférences entre le signal IRM et les ondes
ultrasonores.
Le module de la transformée de Fourier du signal
sinusoïdal ( 3.57 MHz ) fourni par les amplificateurs de puissance pour
exciter les transducteurs est représentée sur la figure 9. Les
données ont été obtenues après un moyennage sur
plusieurs acquisitions pour améliorer le RSB ( Rapport Signal sur Bruit
) afin de rendre les harmoniques plus visibles.

Figure 9 : Module de la Transformée de
Fourier du signal électromagnétique ( 3,57MHz)
On remarque bien la présence d'harmoniques à des
fréquences bien plus élevées que celle du fondamental. Le
RSB ( rapport signa sur bruit) du spectre ne permet pas de ressortir les lignes
spectrales au-delà de 40 MHz.
Toujours dans le cadre de la mise en évidence des
interférences entre IRM et ultrasons, on a effectué des tirs dans
un échantillon de muscle. On a effectué l'IRM de
l'échantillon simultanément avec l'application des ultrasons
pendant un certain temps avant d'arrêter le tir d'ultrasons. Les images
IRM pendant et après le tir d'ultrasons et le tracé temporel du
bruit dans un pixel situé en dehors de l'échantillon sont
respectivement sur les figures 10a et 10b.
Pendant le tir Tir
arrêté
Figure 10b : Tracé temporel du bruit
d'intensité
recueilli dans un pixel en dehors de
l'échantillon
Figure 10a : Image Pendant et après le
tir
E.1.1. Discussion
La première image de la figure 10a a été
acquise en même temps que les tirs d'ultrasons. On a effectué une
IRM de l'échantillon pendant que celui-ci était soumis aux
ultrasons. Le constat qu'on peut faire de cette image est la présence
d'artéfacts d'interférences électromagnétiques.
Ceux-ci sont matérialisés par une augmentation significative du
bruit de fond dans l'image par rapport à la deuxième image de la
figure 10a acquise après l'arrêt du tir d'ultrasons. On peut aussi
remarquer l'augmentation du bruit d'intensité pendant les tirs
d'ultrasons ( figure 10b).
Ces erreurs se répercutent directement sur la mesure de
phase, donc sur la mesure de température.
Il faudra donc trouver une méthode qui puisse permettre
d'utiliser l'IRM pour contrôler en temps réel l'évolution
de la température des tissus soumis aux ultrasons en s'affranchissant de
ces interférences électromagnétiques.
E.2. Méthode de découplage
L'idée sera de bloquer le tir des ultrasons pendant
l'acquisition de l'écho IRM. Notre plateforme de tir ( figure 8 ) nous
permet d'effectuer le tir en continu avec un balayage de la tension de commande
sur une plage de 0 à 10 Volts.
Pour bloquer le tir, on va inhiber le signal TTL qui est
fourni par le générateur ( PG acute ) à l'entrée
des amplificateurs de puissance. En l'absence de signal TTL, les transducteurs
ne sont pas excités et donc il n'y aura pas de génération
d'ultrasons. On commencera par une détection du signal
radiofréquence émis par la bobine RF excitatrice de l'imageur. On
utilisera ce signal RF pour générer un signal inhibiteur du
signal TTL. La figure 11 montre la configuration des différents modules
de la chaîne.

Figure 11 : Configuration de la chaîne de
tir
F. Conception et test des modules de
découplage
Les modules de la chaîne qu'on a eu à concevoir sont
l'antenne et la carte électronique de traitement. Cette partie sera
dédiée à leur présentation.
F.1. L'antenne
Pour la détection du signal radiofréquence, on
utilise une antenne dite « antenne de surface ». Il s'agit d'une
antenne constituée par une seule spire en cuivre de 42
centimètres de diamètre. Elle est placée à
l'intérieur de la cage de Faraday mais en dehors de l'aimant. Le but de
cette antenne est uniquement de capter le signal RF d'excitation des protons.
Un des tests effectués pour vérifier le niveau de signal RF
qu'elle sera capable de capter donne le résultat en figure 12.
Cette séquence qui a permis d'obtenir ce
résultat a été effectuée avec un TR (temps de
répétition) de 100 millisecondes. Le signal capté a une
amplitude crête à crête de 5 Volts. Une autre
possibilité était de récupérer le signal de
synchronisation disponible sur certaines consoles IRM. Cette approche rendrait
moins « portable » le dispositif car dépendant de la mise en
forme de signaux par le constructeur de l'imageur.

Amplitude (Volt)
-0,002
- ,
0 001
Figure 12 : Signal RF capté par
l'antenne
-1,5
2,5
0,5
0,5
2,5
1,5
Temps (Seconde)
0,001
0,002
0,003
0,004
F.1.1 Discussion
Etant donné la résolution temporelle sur
l'oscilloscope, le signal est sous échantillonné et ne permet pas
de visualiser le sinus cardinal. La séquence utilisée est de type
binomiale [5]. Elle permet d'éliminer le signal RMN des
protons de la graisse. En effet, on excite deux fois les protons avec la
même phase pour l'eau et en opposition de phase pour la graisse. Cette
méthode permet de supprimer le signal correspondant à la graisse.
L'utilisation d'une séquence binomiale explique la présence des
deux impulsions RF séparées par un intervalle de temps de 2.35 ms
environ à 1.5 Teslas. Le décalage de phase de 180° entre les
deux impulsions ne peut être détecté à partir de
cette acquisition sur l'oscilloscope.
F.2. Le circuit électronique de
découplage
L'idée est de générer, à partir du
signal RF capté par l'antenne, un signal qui permettra d'inhiber la
génération du signal TTL par le PG acute. Le circuit conçu
pour réaliser pour cette fonction est celui de la figure 13
ci-dessous.

Figure 13 : Les différents modules du
circuit électronique de traitement du signal RF

Amplitude (Volt)
-0,002
Signal_RF_Antenne 1,5 Signal_RF_filtré
-0,001 -0,5 0
Figure 14 : Signal RF avant (bleu) et
après filtrage (rouge)
-1,5
-2,5
2,5
0,5
Temps (Seconde)
0,001 0,00
0,003 0,004
F.2.1. Le filtre passe haut
Sur le signal RF capté par l'antenne ( figure 12 ), on
a un bruit basse fréquence qui provient du réseau
électrique. Ce filtre passe haut de type RC d'ordre ² a pour but
d'éliminer ce bruit basse fréquence. Il a été
réglé avec une fréquence de coupure de 45 KHz. Le signal
à 50 Hz est atténué d'un facteur 1000 environ alors que le
signal RF à 64 MHz n'est pas affecté. En comparant, les signaux
RF avant et après le filtrage passe haut, on remarque une nette
réduction du bruit basse fréquence ( Figure 14 ).
F.2.2. Le redresseur
Le rôle du redresseur est de transformer le signal RF (
alternatif ) en signal continu. La diode permet de laisser passer uniquement
les tensions positives et de bloquer les tensions négatives. Il s'agit
d'un redresseur à une seule alternance. Le test effectué sous
IRM, avec la même séquence qui a permis d'obtenir le signal RF de
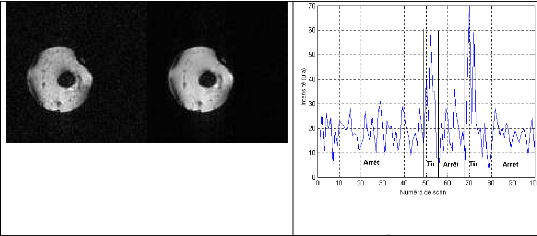
l'antenne de la figure 12, donne le résultat en figure 15.
Cette tension est prise après la diode. Elle varie
constamment comme le signal d'entrée par contre elle reste toujours
positive puisque la diode ne laisse passer le courant que dans un seul sens. Ce
module redresseur comporte un filtre RC. Le rôle de ce filtre RC est de
transformer ce signal redressé à la sortie de la diode en un
signal continu et stable. Les valeurs de R et de C doivent être choisies
de sorte que la constante de temps RC de décharge du condensateur soit
très supérieure à la période du signal
1
RF (soit T RF = 6 = 15,65 ns). A cette condition, la
décharge de C se fera plus lentement et les
63,9.10
oscillations ne seront pas détectées et le
signal RF sera vu comme une seule enveloppe. Par contre, la constante de temps
RC sera limitée par la période de l'impulsion
générée par le Timer ( paragraphe F.2.3) soit 30 ms pour
éviter de saturer le Timer avec l'impulsion RF suivante. Donc, on
veillera à la condition : 15,65ns << RC < 30ms.
Amplitude (Volt)
-0,002 -0,001 0 0,001 0,002 0,003 0,004
0 ,5
Figure 15 : Le signal RF redressé et
filtré
0,5
1,5
2
0
1
Temps (Seconde)
F.2.3. Le générateur d'impulsions
Il est constitué d'un Timer de type 555. Il a un
rôle de temporisateur en générant une impulsion dont la
durée est égale celle de la temporisation. Dans ce cas il est
configuré en mode monostable ( figure 15 ).
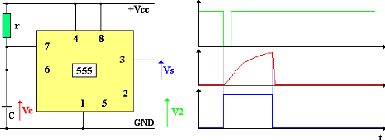
Figure 16 : Configuration et fonctionnement du
Timer 555
Amplitude (Volt)
0,5
-0,002 -0,001 0
Figure 16 : Impulsions négatives pour
activer le Timer
-1,5
-2,5
-3,5
-4,5
0,5
5,5
Temps (Seconde)
0,001 0,002
0,003 0,004
Le Timer 555 ne réagit qu'à une impulsion
négative ( en vert ). A chaque fois qu'il reçoit une impulsion
négative sur son entrée trigger, le condensateur ( C ) se met
à se charger à travers la résistance ( r ). Durant la
charge, il génère une impulsion de durée égale au
temps de charge complète du condensateur. Cette durée est de
l'ordre de 1,1×r×C. C'est la partie la plus importante du circuit. Il
est utilisé pour générer une impulsion à partir du
signal RF capté par l'antenne. Le Timer va réagir au signal RF
redressé et filtré . Le transistor bipolaire sur l'entrée
trigger du 555 permet de générer l'impulsion négative
nécessaire pour activer le Timer. En l'absence de signal RF ou lorsque
le signal RF capté par l'antenne est insuffisant ( inférieure
à VCEsat = 0.6 Volts au niveau de la base du transistor ), le transistor
est à l'état bloqué. Dans ce cas, le courant qui traverse
le transistor est très faible. Lorsque le signal RF capté est
suffisant, le transistor devient saturé et la tension au niveau de
l'entrée du 555 chute et devient quasiment nulle : ce qui correspond
à une impulsion négative. Dans ce cas le courant qui traverse le
collecteur et disponible à l'entrée du 555 est de l'ordre de 4
microAmpères, cette valeur est bien conforme aux spécifications
du constructeur. Avec la même séquence d'IRM qui a donné le
signal RF en figure 12, on obtient le résultat de la figure 16. Il
correspond à l'impulsion négative générée
à partir du signal RF capté par l'antenne.
Avec cette impulsion, le Timer va générer une
impulsion d'amplitude égale à Vcc et de durée égale
à la Constante de temps RC. La résistance de 1 Mégohms et
la batterie de condensateurs permettent de fixer la durée de l'impulsion
générée. Il est intéressant de pouvoir faire varier
cette durée de l'impulsion qui doit correspondre à la
fenêtre d'acquisition de l'écho IRM. Les trois condensateurs de
20, 33 et 47 nanofarads sont connectés en parallèle entre eux et
en série avec la résistance de 1 Mégohms par
l'intermédiaire d'un interrupteur triple voies. L'interrupteur permet de
choisir le(s) condensateur(s) à connecter à la résistance
selon la valeur de la constante de temps recherchée.
La constante de temps fixe la durée de l'impulsion
générée, cette durée doit correspondre au minimum
à la fenêtre d'acquisition de l'écho IRM à savoir
deux fois le paramètre TE qui est de l'ordre de 50 millisecondes. Avec
la même séquence qui a donné les résultats
précédents, on obtient les impulsions en figure 17. Pendant une
impulsion l'acquisition du signal IRM s'effectue et les tirs d'ultrasons sont
bloqués.
Temps (Seconde)
Amplitude (Volt)
1
-2 -1,95 -1,9 -1,85 -1,8 -1,75 -1,7 -1,65 -1,6 -1,55 -1,5
Figure 17 : Impulsions
générées par le Timer
On utilise une excitation binomiale mais les deux pulses RF
génèrent une seule impulsion du timer. L'intervalle de temps
entre les deux impulsions est égal au paramètre TR de la
séquence IRM 300 ms.
F.2.4. Le témoin
Il permet de vérifier visuellement si la carte
électronique fonctionne correctement. Il est constitué d'un
switch basse fréquence et d'une diode électroluminescente. La
diode s'allume avec l'impulsion RF pendant une durée égale
à celle de l'impulsion générée par le Timer. La
résistance de 220 ohms permet de réduire le courant qui arrive
sur la diode. C'est la sécurité du circuit.
F.2.5. La sortie multivoie
Il s'agit de la sortie du Timer. Elle est dite multivoie
puisqu'elle sera connectée à l'entrée du
générateur de signaux TTL ( PG acute ) qui possède 50
sorties. Sur cette sortie, on a une impulsion à chaque fois qu'un signal
RF est détecté par l'antenne.
A chaque fois que le PG acute détecte à son
entrée cette impulsion, il arrête la génération de
signaux TTL pendant toute la durée de l'impulsion. Dans ce cas le tir
est coupé pendant toute cette durée qui correspond à
l'acquisition du signal IRM.
F.2.6. La sortie monovoie
Elle est dédiée à une sonde monovoie qui
va être directement excitée par le signal sinusoïdal transmis
via un commutateur. On utilise un switch ( DG612 [7] ) haute
fréquence et un générateur de fréquence. Avec ce
générateur, on fixe la fréquence du signal sinusoïdal
selon la fréquence de fonctionnement de la sonde ultrasonore monovoie
(10,4 MHz). Le signal de commande du switch sera le signal émis par le
Timer 555. Le transistor bipolaire permet d'inverser cette impulsion en sortie
du 555. En effet, le switch doit laisser passer le signal sinusoïdal quand
la sortie du 555 est à zéro donc en l'absence d'impulsion RF. Le
switch permet de couper le signal sinusoïdal d'excitation de la sonde et
donc d'arrêter le tir d'ultrasons pendant l'acquisition du signal IRM.
Cette acquisition correspond à l'impulsion en sortie du 555 et donc
pendant cette période le switch est ouvert et le signal est
coupé. En l'absence d'impulsion en sortie du 555, le switch se ferme et
laisse passer le signal sinusoïdal d'excitation. Ainsi, rentre-t-on dans
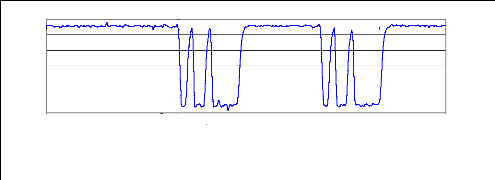
une phase de tirs. Les tests effectués sous IRM avec la même
séquence que précédemment donnent les résultats en
figure 18. On applique un signal sinusoïdal de 10.4 MHz à
l'entrée du switch haute fréquence. On observe le signal de
sortie de la monovoie. Dans le cas où on utilise la carte de
découplage, le signal de sortie est coupé par le switch à
chaque impulsion RF et pendant toute la durée de celle-ci c'est à
dire la durée de l'acquisition du signal IRM. Ainsi, le tir d'ultrasons
est coupé pendant toute cette durée. Pendant la coupure du tir,
le faible signal que l'on observe est du bruit basse fréquence.

Figure 18 : Sorties avec et sans le
découplage avec de la monovoie
G. Tests sous IRM
G.1. Tirs d'ultrasons avec la sonde multivoie dans les
deux modes
Pour effectuer des tirs avec découplage, la carte
électronique qui a été réalisée et
testée vient s'intégrer dans la chaîne de tir comme le
montre la figure 11. La sortie multivoie de la carte électronique est
connectée à l'entrée du PG acute. Pendant l'acquisition du
signal IRM, on a une impulsion au niveau de la sortie multivoie de la carte.
Cette impulsion est détectée comme un événement
inhibiteur par le PG acute (spécifié dans le programme de
pilotage). Ainsi, pendant toute la durée de l'impulsion, le PG acute
s'arrête de générer des signaux TTL et donc les tirs
d'ultrasons sont bloqués. Durant cette période le signal IRM est
découplé des signaux électromagnétiques.
Les tirs d'ultrasons ont été effectués sous
IRM sur un échantillon de muscle. On effectue un tir continu de 4 Watts
par voie à la fréquence de 3.57 MHz avec 100 scans IRM
successifs.
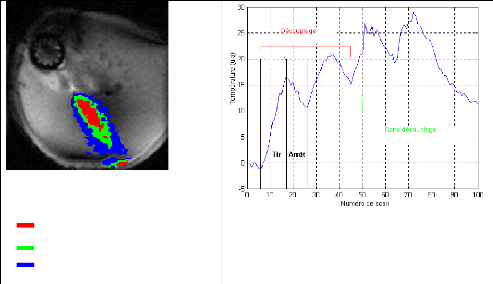
+10°
+5°
Valeurs relatives.
Figure 19a : Image avec découplage Carte
de température superposée à l'image d'intensité.
+15°
Figure 19b : Courbe de température
G.1.1. Discussion
Dans la première phase, le circuit de découplage
est utilisé. L'image correspondant à cette phase est en figure
19a. Au bout de 50 scans, le circuit de découplage est
déconnecté pendant que le tir se poursuit. La courbe de
température pendant toute la durée du tir est en figure 19b avec
les différentes phases. On y distingue bien les phases de tir
correspondant à la croissance de la température jusqu'à un
certain pic. La séquence de tir consiste en 4 cycles de 20 secondes dont
10 secondes de tir et 10 secondes d'arrêt. Chaque tir engendre une
augmentation de température suivi d'une décroissance (par
diffusion thermique) pendant la phase d'arrêt.
A la fin de l'acquisition du signal IRM, le tir continue et la
température se remet à augmenter. Pour évaluer le bruit
dans les deux modes, on prend la courbe de température ( figure 20 ) en
considérant un pixel de l'échantillon à la
périphérie de la zone chauffée où le signal sera
essentiellement constitué de bruit.
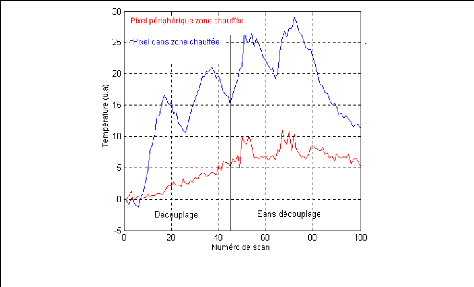
Figure 20 : Courbes de température dans
(bleue) et à la périphérie (rouge) de la zone
chauffée
La courbe correspondant au pixel situé à la
périphérie de la zone chauffée permet d'apprécier
le niveau de bruit selon qu'on se trouve en mode découplage ou non. On
remarque l'augmentation du niveau de bruit lorsque les tirs d'ultrasons sont
effectués sans le découplage. Le calcul de l'écart type du
bruit dans la mesure de température donne : 0.9065 en mode
découplage et 1.4185 dans le mode sans découplage. Ces valeurs
sont en conformité avec les remarques qualitatives.
G.2. Tirs d'ultrasons avec la sonde monovoie dans les
deux modes
Les tirs d'ultrasons ont été effectués
sous IRM sur un échantillon de muscle comme pour la sonde multivoie. On
effectue un tir continu de 24 Watts à la fréquence de 9.13 MHz
avec 100 scans. Dans la première phase, le circuit de découplage
est utilisé. L'image correspondant à cette phase est en figure
21a. Au bout de 60 scans, le circuit de découplage est
déconnecté pendant que le tir se poursuit jusqu'au scan 80. On
peut observer l'image IRM correspond à cette phase sur la figure 21b. La
courbe de température pendant toute la durée du tir est sur la
figure 21c avec les différentes phases.

Figure 21a : Image avec découplage
Figure 21b : Image sans découplage
Figure 21c : Courbe de température avec
et sans découplage
G.2.1. Discussion
Sur l'image IRM de la figure 21b, on note la présence
de nombreux artéfacts qui rendent l'image sombre (normalisation du
signal en présence de « spikes » d'interférence RF).
Ceux-ci proviennent des interférences entre les ultrasons et le signal
IRM. En effet, on a excité la sonde avec une fréquence de 9.13
MHz qui est une sous harmonique entière du signal IRM qui est à
63.9 MHz.
Sur la carte de température ainsi obtenue, on note deux
parties. La première partie correspond au tir avec découplage et
on note une évolution de la température bien lisible. Cette
courbe est bien exploitable pour faire un contrôle de la
température des tissus chauffés. Par contre, la deuxième
phase qui correspond au tir sans le découplage est beaucoup plus
bruitée.
Le calcul de l'écart type donne : 0.3343 avec le
découplage et 0.7684 sans le découplage. Le niveau de bruit
augmente d'un facteur 2.5 quand on passe du mode avec découplage au mode
sans découplage. On peut remarquer que l'amélioration
apportée par le découplage est loin d'être
négligeable.
H. Conclusion et Perspectives
L'objectif du stage était dans un premier temps de
proposer une méthode de découplage des signaux ultrasonores et
d'IRM thérapeutiques dans le domaine temporel. Ensuite la
réalisation du circuit électronique dédié au
découplage et sa validation par des tests dans des conditions
expérimentales identiques aux futurs essais in vivo. La première
partie a été consacrée à la revue de la
théorie sur les ultrasons et l'IRM de température. Par la suite,
l'existence des interférences entre les ultrasons et l'IRM a
été démontrée. Après la réalisation
du circuit électronique de découplage, plusieurs tests sous IRM
sur des échantillons de muscle ex-vivo ont été
effectués dont quelques résultats sont présentés
dans ce rapport. A ce stade, on peut avancer que ces résultats sont
satisfaisants en attendant les expériences prévues sur le cochon
dans quelques mois.
En perspectives, il y a d'abord la conception d'une sonde qui
intègrera l'antenne qui est encore indépendante à ce
stade. Ensuite, la mise en oeuvre de la boucle d'asservissement automatique de
l'outil de tirs d'ultrasons. En effet, celle-ci permettra la correction
automatique des éventuelles erreurs de tirs d'ultrasons par rapport
à la dose thermique limite fixée par le corps médical.
Ce stage est intéressant à plus d'un titre.
D'abord pour l'intérêt qu'il porte dans le traitement des tumeurs
cancéreuses. Mais aussi le challenge qu'il représente en
matière de recherche est une motivation supplémentaire.
I. Bibliographie
1. B. Kastler ; Comprendre l'IRM - Manuel d'auto
apprentissage ; 4e édition ; 2001
2. Introductory and advanced MRI : Techniques with clinical
applications ; Joseph C
3. R. Salomir. MRI-guided focused ultrasound : fast MR
thermometry and in vivo tumor ablation, 2001; thèse
Université de Bordeaux 1
4. D. Melo de Lima. Applicateur intraluminal à
balayage électronique pour le traitement des cancers de l'oesophage
guidé par IRM ; thèse Université de Lyon 1 2004
5. M. PACHOT-CLOUARD . Cours d'imagerie RMN de DEA ;
2005
6. L. Curiel. Application de la focalisation dynamique
à la chirurgie ultrasonore ; thèse INSA Lyon 2001
7. High-Speed, Low-Glitch D/CMOS Analog Switches ;
Vishay Siliconix
| 


