Conclusion
Conclusion
CONCLUSION
Notre étude est une initiation aux calculs par ordinateur
des paramètres d'un phénomène physico-chimique très
complexe qui est la combustion.
Dans le temps qui nous a été alloué, on n'a
pas pu tenir compte de tous les phénomènes influents sur le
déroulement de la combustion, d'ou l'utilisation de certaines
hypothèses simplificatrices pour nous faciliter la tâche.
Les résultats obtenus restent des valeurs
approchées.la première
méthode donne des résultats quantitatifs conformes à la
réalité quelque soit la richesse du mélange.
Pour la seconde méthode si les valeurs obtenues pour les
mélanges pauvres sont valables dans l'ensemble, celles des
mélanges riches sont en contradiction avec la réalité.
Nous pensons qu'il y a une erreur qu'on n'a pas pu déceler à
temps pour palier à cet inconvénient.
Notre programme peut calculer à la demande en plus de la
température de flamme et de la composition, d'autres paramètres
tel que: les chaleurs spécifiques, l'enthalpie, l'entropie et
l'enthalpie libre.
En fin dans cette étude nous avons amélioré
nos connaissances dans le domaine de la combustion et appris à manipuler
le logiciel de la
programmation avancé qui est le «DELPHI».
Annexes
Annexe A-1: [3]
|
CO2
|
H2O
|
N2
|
O2
|
|
Hf(298)
So(298)
|
-94.054
+51.070
|
-57.798
+45.106
|
+0.000
+45.770
|
+0.000
+49.000
|
|
a1
|
+4.460041E+00
|
+2.7167633E+00
|
+2.8963194E+00
|
+3.6219535E+00
|
|
a 2
|
+3.0981719E-03
|
+2.9451374E-03
|
+1.5154866E-03
|
+7.3618264E-04
|
|
a 3
|
-1.239257 1E-06
|
-8.0224374E-07
|
-5.7235277E-07
|
-1 .965222E-07
|
|
a 4
|
+2.2741325E-10
|
+1.022666E-10
|
+9.907393E-11
|
+3.620155E-11
|
|
a5
|
-1.5525954E-14
|
-4.8472146E-15
|
-6.5223555E-15
|
-2.8945627E+15
|
|
a6
|
-4.8961442E+04
|
-2.9905826E+04
|
-9.0586184E+02
|
1.2019825E+03
|
|
a7
|
-9.8635982E-01
|
+6.6305671E+00
|
+6.1615148E+00
|
+3.6150960E+00
|
Annexe A-2:
|
CO
|
H2
|
OH
|
NO
|
|
Hf(298)
So(298)
|
-26.420
+47.210
|
+0.000
+31.210
|
+9.432
+43.880
|
+21.580
+50.347
|
|
a 1
|
+2.9840696E+00
|
+3.1001901E+00
|
+2.9106427E+00
|
+3.1890000E+00
|
|
a 2
|
+1.4891390E-03
|
+5.1119464E-04
|
+9.5931650E-04
|
+1.3382280E-03
|
|
a 3
|
-5.7899684E-07
|
+5.2644210E-08
|
-1.9441702E-07
|
-5.2899318E-07
|
|
a 4
|
+1.0364577E-10
|
-3.4909973E-11
|
+1.3756646E-11
|
+9.5919332E-11
|
|
a5
|
-6.9353550E+15
|
+3.6945345E-15
|
+1.4114542E-16
|
-6.4847932E-15
|
|
a 6
|
-1.4245228E+04
|
-8.7738042E+02
|
+3.935315E+03
|
+9.8283290E+03
|
|
a 7
|
+6.34791 56E+00
|
-1.962942 1E+00
|
+5 .4423445E+00
|
+6.74581 26E+00
|
Annexe A-2:
|
H
|
O
|
NO2
|
N
|
|
Hf(298)
So(298)
|
+52.100
+27.392
|
+59.559
+3.470
|
+7.910
-57.340
|
+113.000
+36.610
|
|
a 1
|
+2.5000000E+00
|
+2.5420596E+00
|
+4.6240771E+00
|
+2.4502682E+00
|
|
a2
|
+0.0000000E+00
|
-2.7550619E-05
|
+2.5260332E-03
|
+1.0661458E-04
|
|
a 3
|
+0.0000000E+00
|
-3.1028033E-09
|
-1.0609498E-06
|
-7.4653373E-08
|
|
a4
|
+0.0000000E+00
|
+4.5510674E-12
|
+1.9879239E-10
|
+1.8796524E-11
|
|
a5
|
+0.0000000E+00
|
-4.3680515E-16
|
-1.3799384E-14
|
-1.0259839E-15
|
|
a6
|
+2.5471627E+04
|
+2.9230803E+04
|
+2.2899900E+03
|
+5.6116040E+04
|
|
a7
|
-4.6011763E-01
|
+4.9203080E+00
|
+1.332413E+00
|
+4.448758E+00
|
Remarque : Hf et SO en (cal/mole).
Annexe B: [7]
Les enthalpies de formation de diverse substance dans
l'état standard de référence, [Hf] 298 0
K
|
Substance
|
[Hf]298 0 K
(Kcal/mole)
|
|
Substance
|
0
[Hf] 298 K
(Kcal/mole)
|
|
O(g)
|
59.148
|
|
CH1(g) .
|
-17.889
|
|
O2(g) .....
|
0
|
|
C2H6(g) ...
|
-20.236
|
|
H(g)
.
|
52.082
|
|
C3H8(g) .
|
-24.820
|
|
H2(g)
|
0
|
|
C4H12(g)... .
|
-29.812
|
|
OH(g)
|
9.402
|
|
C5H14(g)
|
-35.00
|
|
N(g) ...
|
112.482
|
|
C6H14((g) .
|
-39.96
|
|
N2(g)
|
0
|
|
C7H16(g)
|
-44.89
|
|
NO(g) .
|
21.595
|
|
C8H18(g) ..
|
-49.82
|
|
NO2(g) ...
|
8.090
|
|
C6H6(g) .
|
19.820
|
|
CO(g)
|
-26.412
|
|
C2H2(g)
|
54.194
|
|
CO2(g) .
|
-94.040
|
|
C2H4(g)...
|
12.496
|
|
H2O(g)
|
-57.790
|
|
|
|
|
H2O(l) .
|
-68.309
|
|
|
|
Légende: (g): gaz.
(l): liquide.
Annexe C: [7]
C-1-Chaleur Spécifique à Pression Constante
Cp Des Gaz
|
Température
|
|
t
|
T
|
|
C°
|
K°
|
|
0
|
273
|
|
100
|
373
|
|
200
|
473
|
|
300
|
573
|
|
400
|
673
|
|
500
|
773
|
|
600
|
873
|
|
700
|
973
|
|
800
|
073
|
|
900
|
1173
|
|
1000
|
1273
|
|
1100
|
1373
|
|
1200
|
1473
|
|
CH4
|
C2H6
|
C3H8
|
|
CP
|
CP
|
CP
|
|
Kcal/Kg°K
|
Kcal/Kg°K
|
Kcal/Kg°K
|
Kcal/Kg°K
|
Kcal/Kg°K
|
Kcal/Kg°K
|
|
0.5172
|
2.1654
|
0.3934
|
1.6471
|
0.3701
|
1.5495
|
|
0.5848
|
2.4484
|
0.493
|
2.0674
|
0.4817
|
2.0168
|
|
0.6704
|
2.8068
|
0.5947
|
2.4899
|
0.5871
|
2.4581
|
|
0.7584
|
3.1753
|
0.6814
|
2.8696
|
0.6770
|
2.8345
|
|
0.8430
|
3.5295
|
0.7676
|
3.2138
|
0.7550
|
3.1610
|
|
0.9210
|
3.8560
|
0.8405
|
3.5190
|
0.8237
|
3.4487
|
|
0.9919
|
4.1529
|
0.9045
|
3.770
|
0.8831
|
3.6974
|
|
1.0560
|
4.4213
|
0.3607
|
4.0223
|
0.9357
|
3.9159
|
|
1.1129
|
4.6595
|
1.0069
|
2.2157
|
0.9175
|
4.0926
|
|
1.1638
|
4.8726
|
1.0483
|
4.3890
|
1.0151
|
4.2500
|
|
1.2089
|
5.0614
|
1.0863
|
4.5481
|
1.0495
|
4.3945
|
|
1.2483
|
5.2264
|
1.1209
|
4.6930
|
1.0811
|
4.5263
|
|
1.2820
|
5.3675
|
1.1521
|
4.8236
|
1.1094
|
4.6448
|
C-2-
|
Température
|
|
t
|
T
|
|
C°
|
K°
|
|
0
|
273
|
|
100
|
373
|
|
200
|
473
|
|
300
|
573
|
|
400
|
673
|
|
500
|
773
|
|
600
|
873
|
|
700
|
973
|
|
800
|
073
|
|
900
|
1173
|
|
1000
|
1273
|
|
1100
|
1373
|
|
1200
|
1473
|
|
CH4
|
C2H6
|
C3H8
|
|
CP
|
CP
|
CP
|
|
Kcal/Kg°K
|
Kcal/Kg°K
|
Kcal/Kg°K
|
Kcal/Kg°K
|
Kcal/Kg°K
|
Kcal/Kg°K
|
|
0.3486
|
1.4395
|
0.38447
|
1.6007
|
0.2253
|
0.9433
|
|
0.4363
|
1.267
|
0.44669
|
1.8702
|
0.3189
|
1.3352
|
|
0.5197
|
2.1759
|
0.48817
|
2.0439
|
0.4003
|
1.6760
|
|
0.5918
|
2.4777
|
0.51928
|
2.1714
|
0.4673
|
1.9565
|
|
0.6334
|
2.7357
|
0.54501
|
2.2818
|
0.5213
|
2.1826
|
|
0.7065
|
2.9580
|
0.56756
|
2.3763
|
0.5659
|
2.3693
|
|
0.7532
|
3.1535
|
0.58784
|
2.4612
|
0.6029
|
2.5242
|
|
0.7942
|
3.3252
|
0.60643
|
2.5390
|
0.6342
|
2.6553
|
|
0.8295
|
3.4730
|
0.62337
|
2.6099
|
0.6609
|
2.7671
|
|
0.8609
|
3.6044
|
0.63881
|
2.6746
|
0.6834
|
2.8613
|
|
0.8887
|
3.7208
|
0.65279
|
2.7331
|
0.7029
|
2.9429
|
|
0.9126
|
3.8209
|
0.66542
|
2.7860
|
0.7196
|
3.0128
|
|
0.9336
|
3.9088
|
0.67672
|
2.8333
|
0.7340
|
3.0731
|
|
Température
|
|
T
|
T
|
|
C°
|
K°
|
|
0
|
273
|
|
100
|
373
|
|
200
|
473
|
|
300
|
573
|
|
400
|
673
|
|
500
|
773
|
|
600
|
873
|
|
700
|
9731
|
|
800
|
073
|
|
900
|
1173
|
|
1000
|
1273
|
|
1100
|
1373
|
|
1200
|
1473
|
|
1300
|
1573
|
|
1400
|
1673
|
|
1500
|
1773
|
|
1600
|
1873
|
|
1700
|
1973
|
|
1800
|
2073
|
|
1900
|
2173
|
|
2000
|
2273
|
|
2100
|
2373
|
|
2200
|
2473
|
|
2300
|
2573
|
|
2400
|
2673
|
|
2500
|
2773
|
|
2600
|
2873
|
|
2700
|
2973
|
|
2800
|
3073
|
|
2900
|
3173
|
|
3000
|
3273
|
|
O2
|
N2
|
|
CP
|
CP
|
|
Kcal/Kg°K
|
Kcal/Kg°K
|
Kcal/Kg°K
|
Kcal/Kg°K
|
|
0.2185
|
0.9148
|
0.2482
|
1.0392
|
|
0.2230
|
0.9337
|
0.2489
|
1.0421
|
|
0.2300
|
0.9630
|
0.2512
|
1.0517
|
|
0.2376
|
0.9948
|
0.2554
|
1.0693
|
|
0.2445
|
1.0237
|
0.2607
|
1.0915
|
|
0.2504
|
1.0484
|
0.2664
|
1.1354
|
|
0.2533
|
1.0869
|
0.2721
|
1.1392
|
|
0.2593
|
1.0856
|
0.2774
|
1.1614
|
|
0.2627
|
1.0999
|
0.2822
|
1.1815
|
|
0.2656
|
1.1120
|
0.2864
|
1.1991
|
|
0.2682
|
1.1229
|
0.2902
|
1.2150
|
|
0.2703
|
1.1317
|
0.2935
|
1.2280
|
|
0.2723
|
1.1401
|
0.2964
|
1.2410
|
|
0.2743
|
1.1484
|
0.2989
|
1.2514
|
|
0.2762
|
1.1564
|
0.3011
|
1.2606
|
|
0.2780
|
1.1639
|
0.3030
|
1.2686
|
|
0.2797
|
1.1710
|
0.3048
|
1.2761
|
|
0.2815
|
1.1786
|
0.3063
|
1.2824
|
|
0.2832
|
1.1857
|
0.3077
|
1.281
|
|
0.2849
|
1.1928
|
0.3089
|
1.2933
|
|
0.2867
|
1.2004
|
0.3100
|
1.2979
|
|
0.2884
|
1.2075
|
0.3110
|
1.3021
|
|
0.2900
|
1.2142
|
0.3120
|
1.3063
|
|
0.2917
|
1.2213
|
0.3128
|
1.3096
|
|
0.2933
|
1.2280
|
0.3136
|
1.3130
|
|
0.2948
|
1.2343
|
0.3143
|
1.3150
|
|
0.2964
|
1.2410
|
0.3155
|
1.3209
|
|
0.2979
|
1.2472
|
0.3162
|
1.3239
|
|
0.2984
|
1.2493
|
0.3170
|
1.3272
|
|
0.2997
|
1.2548
|
0.3173
|
1.3285
|
|
0.3010
|
1.2602
|
0.3180
|
1.3314
|
C-3-
Annexe D: [1] Constantes d'équilibres.
|
T(°K) K[i]
|
H2 = 2H
|
O2=2O
|
O2= 2N
|
N2+ O2 = 2NO
|
2CO2= 2CO +O2
|
2H2O= 2H2+O2
|
2H2O=2OH+H2
|
|
1000
|
5.121 10-18
|
3.63 10-20
|
8.2 10-32
|
7.3 10 -9
|
4.00 10-21
|
7.5 10-21
|
1.310-23
|
|
1100
|
6.682 10-18
|
8.8 10-18
|
2.26 10-28
|
5.3 10 -8
|
1.92 10-18
|
1.71 10-18
|
710-21
|
|
1200
|
3.889 10-14
|
8.6 10-16
|
1.67 10-26
|
2.77 10 -7
|
3.28 10-16
|
1.59 10-16
|
1.410-18
|
|
1300
|
1.221 10-12
|
4.19 10-14
|
4.50 10-24
|
1.11 10-6
|
2.52 10-14
|
7.46 10-15
|
1.210-16
|
|
1400
|
2.361 10-11
|
1.17 10-12
|
5.5 10-21
|
3.68 10-6
|
1.00 10-12
|
2.02 10-13
|
610-15
|
|
1500
|
3.090 10-10
|
2.11 10-11
|
5.610-19
|
1.04 10-5
|
2.58 10-11
|
3.54 10 -11
|
1.610-13
|
|
1600
|
2.956 10-9
|
2.66 10-10
|
1.3 10-17
|
2.58 10 -5
|
4.26 10-10
|
4.35 10 -11
|
3.010-12
|
|
1700
|
2.166 10-8
|
2.48 10 -9
|
3.40 10-16
|
5.76 10-5
|
5.05 10 -9
|
3.98 10-10
|
410-11
|
|
1800
|
1.279 10 -7
|
1.82 10-8
|
6.0 10-15
|
1.17 10 -4
|
4.5 10 -8
|
2.8 10 -9
|
410-10
|
|
1900
|
6.287 10 -7
|
1.08 10 -7
|
7.8 10-14
|
2.22 10 -4
|
3.2 10 -7
|
1.7 10-8
|
3.010-9
|
|
2000
|
2.634 10-6
|
5.38 10 -7
|
7.8 10-13
|
3.93 10 -4
|
1.9 10-6
|
8.2 10-8
|
1.910-8
|
|
2100
|
9.684 10-6
|
2.31 10-6
|
6.4 1012
|
6.6 10 -4
|
9 10 -6
|
3.4 10 -7
|
110-7
|
|
2200
|
3.163 10 -5
|
8.7 10-6
|
4.26 10-10
|
1.06 10 -3
|
3.8 10 -5
|
1.3 10-6
|
4.510-7
|
|
2300
|
8.367 10 -5
|
2.90 10 -5
|
2.45 10-11
|
1.63 10 -3
|
1.4 10 -4
|
4.2 10-6
|
1.810-6
|
|
2400
|
2.512 10-4
|
8.8 10-5
|
1.20 10-9
|
2.42 10-3
|
4.8 10-4
|
1.3 10-5
|
610-6
|
|
2500
|
6.295 10-4
|
2.43 10-4
|
5.20 10-8
|
3.48 10-3
|
1.4 10-3
|
3.5 10-5
|
2.110-5
|
|
2600
|
1.468 10-3
|
6.24 10-4
|
7.11 10-7
|
4.86 10-3
|
3.9 10-3
|
8.9 10-5
|
610-5
|
|
2700
|
3.216 10 -3
|
1.48 10 -3
|
2.28 10 -7
|
6.62 10 -3
|
1 10-2
|
2.1 10 -4
|
1.610-4
|
|
2800
|
6.668 10-3
|
3.36 10-3
|
6.80 10-7
|
8.8 10-3
|
2.2 10-2
|
4.7 10-4
|
4.210-4
|
|
2900
|
1.256 10-2
|
7.14 10-3
|
1.88 10-6
|
1.15 10-2
|
4.8 10-2
|
1.0 10-2
|
110-3
|
|
3000
|
2.483 10-2
|
1.44 10-2
|
2.44 10-6
|
1.48 10-2
|
0.11
|
2.0 10 -3
|
2210-3
|
Annexe E: [7]
Calcul de l'enthalpie du mélange
frais:
L'enthalpie HT fdu mélange frais à la
température T est donnée par:
à
T
fi
H f H H
T = ? 0 fi +?
i i
Hf0i , est l'enthalpie de formation du constituant i
aux conditions de référence. à
?fi H T
? ? n T fi
Cp(T T 0 )
T --
fi
i i
Compte tenu des relations (II-3 0) - (II-31) - (II-32) on
à: à
?fi H T
? ? n 0 fi
Cp(T T 0 )
0 --
fi
i i
Si on considère le mélange suivant:
Ri CncHnh +Zst (O2 + ù N2) avec Zst = nc+(
nh/4) Sachant que: H (O ) H (N 2 ) 0
0 f = =
0
2 f
On aura:
H H (C H ) (R 4.762 Z ) Cp (T T )
T 0 0
f ? + + --
f nc nh i st 0
f
l'enthalpie massique du mélange frais devient:
H T
h T f
f (R 4. 762 Z ) .M --
i st
f
+
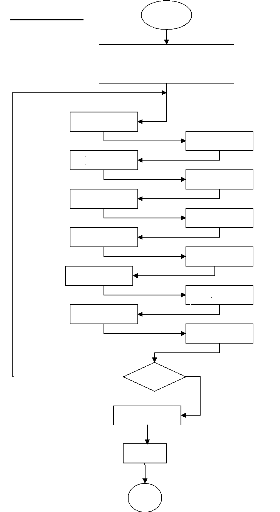
Organigramme

H1
Méthode 1 Méthode2
T1
H2
Méthode 1
Méthode2
T2
Initialisation T1 et T2
Calcul de la température de flamme par la
méthode de la
sécante

Procédure graphe ( Tb , Xb , Hx )
Début
Tf =T1
Température de flamme
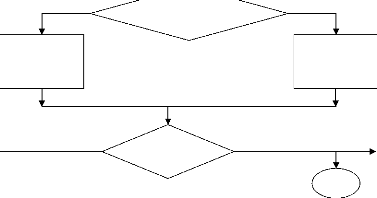
T1=T2 T2 = Tb
Non
Non
| T1 -T2 | < 1
|H2-Hf | > |H1-Hf|
Oui
Oui
T2 = T1 T1=Tb
Fin
|
T (H H ) T (H H )
2 1 f 1 2 2
-- -- --
Tb =
H H
1 2
--
|


METHODE (1)
Procédure matrice Xb (T , Xb
, Hb)

I=0
Début
X1(I)=0.0 1
I=I+1
Oui Non
I<7
A0

Inverse

Transpose
|
At n
, At ,
i Xt
0
|
|
A t ,
0
|
D
|

Produit M.V
Rs= * D
A t
0

T
GrTT

GrT0=G0+ln GrT1= G1+ln
p

p 0
p
p 0



Produit M-V



DC

D

C
Rs -Rsi

DIFFRENCE
|
GrT0 , GrT1
|
X0= R s - Rs1
|
|
|
|
|
|
|
Calcul G
|
|
|
|
|
|
( ) ( )
X 0 i
G 0 ~ G r T 0 i + ln Xb
( ) ( )
X 1 i
G 1 ~ G r T 1 i + ln Xl
|
|
|
|
|
|
|
|
|
|
G0 , G1
|
|
Aff
|
|
|
Test 2

bool
Faux
bool
Vrai

Prod HK


Fin
Hb

Fin
CALCUL DE L'AFFINITE CHIMIQUE
Procédure Aff (Go , G1 , Aff )
Xn, G0


Début
Prod M-V

G1,Xn G
XnG= X n *G0
DiffAff

Aff= G1-XnG
TEST DE CONVERGENCE
Procédure test 2(Aff,bool )

Bool=Faux


i=0
Non
Er<0.01
Non
Er=Er+Aff(i)
I<7
Oui
Oui
Bool = vrai
i=i+1

X1(i) = x1 (i)* exp (-Aff (i) /2)
Non
Oui
i=i+1
I<7
Fin
Er = 0
I=0
? Méthode (2)
Début
Initialisation X2
E(X2) ,
F(X2) , K(T)
prod HK
Prod M-V
Calcul E
Faux
Const K
Calcul f
Inverse
Test 3
bool
X2
K,X2
E-1,f(i)
T
test
Vrai
E(X2)
bool
K(T)
f(i)
E-1
dx i
Hm
Fin
Enthalpie du mélange

Procédure (nor ,V1,V2,V3, bool)
P=1
Bool = false
SV=0
V(i)=V1(i)
V2(i)=V1 (i)-V(i)
V3(i)=V1(i)
non
V(i)=V1(i) +PV2(i)
X1(i)~ 0
non
P=P-0, 1
V1(i)=
Norm (f,norm2)
calcul f(V3 ,K,f)
oui
norm2 <nor
oui
V1(i
)
V2(i)
SV=SV+
oui non
SV<0,1
bool = true
FIN
TEST 3
Bibliographie
Bibliographie
[1] : Thermodynamique générale et
applications Par:R.KLING (1980);
[2] : Cours de sciences physiques
thermodynamiques Par: R. Annequin et Boutigny (1979);
[3] : Simulation de la combustion dans un
moteur alternatif à combustion interne Par: P. BANER et O. HEUZE
(1986);
[4] : La combustion industrielle Par: E.
PERTHUIS (1983);
[5] : Thermodynamique (6ème
édition) Par : A. KASTLER (2000);
[6] : Méthodes Numériques
Appliquées Par : A. GOURDIN et M. BOUMAHRAT (1988);
[7] : Simulation de la Combustion Interne :
Modélisation et Expérémentation Par : ASNOUN AHMED,
Thèse de doctorat (1997);
[8] : Thermodynamique et Equilibre Chimique Par
: ALAIN GRUGE (1997);
[9] : Thermodynamique, Physique et Chimique
Par: PAUL Roux et JEAN Robert (1998).
| 


